抽象的
背景
郑单958(郑58 ×长7-2)是利用Reid × Tang-SPT杂种优势模式,在我国大面积生产的商品杂交种。拔节期是玉米营养生长向生殖生长的关键时期,在一定程度上决定了玉米后期的发育和杂种优势。microrna (mirna)在植物发育调控中发挥着重要作用,但其在6叶(V6)期第6叶片中的作用如何影响拔节期杂种优势尚不清楚。
结果
本研究以Reid × Tang-SPT杂交组合郑单958、豫5(叶478 ×长7-2)、叶478 ×黄早司、郑58 ×黄早司及其亲本自交系为材料,研究其mirna与杂种优势的相关机制。在V6期第6叶共鉴定出234个mirna,其中85个mirna在杂交组合和亲本自交系间差异表达。差异表达的mirna多为非加性表达,说明mirna可能参与了拔节期的杂种优势。miR164、miR1432和miR528家族在四种杂交组合中均受到抑制,部分mirna如miR156、miR399和miR395家族在不同杂交组合中表现出不同的表达趋势,这可能导致对杂种优势调控机制的影响不同。
结论
所鉴定的mirna的潜在靶点与光合作用、对植物激素的响应和营养利用有关。不同的杂交组合使用相同miRNA家族的不同成熟miRNA,表现出不同的表达趋势,可能导致基因表达增强或抑制,从而调控杂种优势。综上所述,我们的研究结果揭示了一个mirna介导的网络,通过转录后调控在节节期杂种优势中发挥了关键作用。
背景
杂种优势是指一个杂种的活力优于其纯合子亲本的两个系;杂种优势可以用来描述杂种的性能[1],并在过去一个世纪中在高产优质农产品方面发挥了重要作用[2].虽然它在植物和动物育种中都有不可缺少的影响,但是杂种优势的分子基础仍然不清楚。提出了两个主要的等位杂合度假说来解释杂种优势的遗传基础:显性[3.那4.]和过度融资[5.].随着基因组工具的快速发展,探索了非平行基因相互作用,也被认为是杂种优势的原因;因此,Epistasis [6.]和基因表达调控网络假说已经提出。近年来,全球不同的表达趋势[7.那8.]特异性蛋白质功能,差异累积以及后术后修改[9.那10.那11.已被鉴定为与不同器官的杂种优势和分子水平不同的发育阶段有关。
玉米生产代表了杂种优势的成功商业化使用。同时,异性组的分类提高了杂种优势利用效率;例如,Reid×Tang-SPT是中国的主要单独模式。此外,在过去的20年中,随着郑丹958,在中国广泛种植的郑丹958开发的领先混合动力车已达到约4300万公顷的估计种植面积。此外,玉米也是一种适当的模型作物物种,用于探索杂种优势的遗传机制,因为该物种包括许多表型,等位基因12.],转录[13.那14.]翻译变化[15.],因为它的基因组信息已经获得[12.那16.那17.].玉米拔节期是玉米由营养阶段向生殖阶段过渡的关键时期,可能影响后期的发育;因此,拔节期杂种优势在一定程度上可以反映出籽粒产量杂种优势。植物的叶子是重要的生物功能发生的地方,例如,光合作用、呼吸作用、蒸腾作用和排液作用[18.];此外,与小叶子相比,大叶子会提高光合作用产量、水分和养分利用效率,以及生物量生产率[19.].发现转录和生理代谢过程在超杂化水稻及其父母之间不同,并且在光合作用和碳固定中显着富集了差异表达的基因[20.那21.].B73 × Mo17与亲本自交系比较,至少两个组织中高亲本模式一致或高于高亲本模式的基因在光合作用中显著富集[22.].这些研究表明,光合作用在杂种优势中起着关键作用。
miRNA大约是21-nt长的非编码RNA,其在转录后水平下对基因表达产生负面调节[23.].与平移抑制成分相比,miRNA介导的目标信使RNA(mRNA)的切割似乎是颅面调节的主要机制[24.].由于高通量测序技术的出现,许多MIRNA已经在不同植物物种上发现了基因组范围,显示了组织特异性和/或显影依赖表达模式[25.那26.那27.].在玉米中,多种发育过程由miRNA介导的基因调节控制;例如,据报道MIR166调节叶极性[28.[MiR156的过表达导致少年发展控制中miR172的表达水平降低[29.] MIR172通过靶向Apetala2花卉归属转录因子(TFS)来调节性别测定[30.].此外,许多研究都集中在mirna与杂种优势的关系上。研究表明,一些mirna在杂交水稻中的表达与其亲本的表达进行了比较,发现存在显著差异[31.].在番茄中,已经获得了培养和野生物种幼苗的miRNA转录组及其杂种[32.].玉米的研究表明,在杂交体中,miR167在授粉后10天后的粒子中表达比其父母更高的水平,这表明MiRNA可以参与杂种的调节[33.].此外,大多数保守mirna在亲本自交系中比杂种中更丰富,这表明杂种中的mirna普遍受到抑制,可能与玉米萌发胚胎的杂种优势有关[34].来自八个近晶父母和12个杂种基因型的多种组织或发育阶段的研究显示了SRNA中的变异和遗传模式[35].综上所述,所有研究表明,mirna在杂种优势中发挥关键作用;然而,mirna和潜在靶基因在玉米拔节期杂种优势中的作用机制尚不清楚。在我们的研究中,我们试图阐明microrna的角色和他们的互动与他们的目标基因在拔节期玉米杂交的杂种优势利用新一代测序技术的执行一个microrna的转录组分析六叶四个杂交组合亲本自交系在V6阶段。
结果
六叶六叶阶段的光合作用指数及杂交组合的粮食产量及自交系
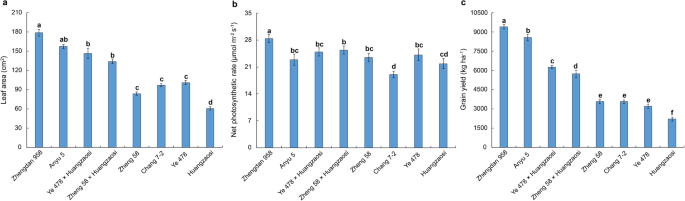
这4个杂种组合是按照我国相同的杂种优势模式培育出来的。为了评估这些杂交组合及其亲本的光合作用,我们测量了叶面积(图。1a)和净光合速率(图。1b) V6阶段的第6片叶片,此时第6片叶片刚刚在田间完全展开。此外,麦田(图。1c)在收获后测量。结果表明,所有杂交组合比其父母自交系所做的更好,并且每个材料呈现出明显不同的光合速率。我们对潜在的miRNA监管网络在分子水平下的潜在的miRNA调节网络感兴趣,因此在本研究中测序了用Reid×Tang-Spt模式和父母自交系产生的四种杂种组合的miRNA。
玉米杂交种和自交系中检测到的mirna
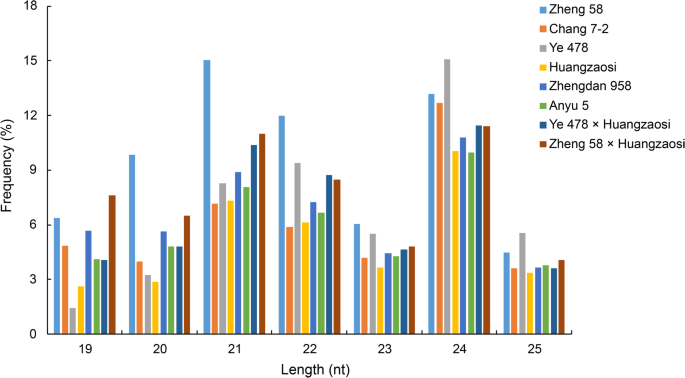
利用Illumina测序技术对4个杂交组合和自交系V6期第6叶片的sRNA库进行测序。将低质量的读取数据从原始数据中删除后,对干净的数据进行进一步分析。sRNA长度分布分析(图。2)的峰值大小分别为21 nt和24 nt,并对不同类别的srna进行了注释(表)1).
除了具有未经发布的序列的SRNA外,SRNA主要作为“RRNA”和“外显子感”注释。总共有182名已知的miRBase已知的miRNA(图。3.;附加文件1:表S1)和识别了52个新型miRNA(附加文件2:表S2)。计算每个miRNA的读计数,并将其归一化为每百万转录本数(TPM)。杂种组合的表达模式与亲本有显著差异。
在杂交组合与自交系之间V6阶段差异表达miRNA的表达模式分类
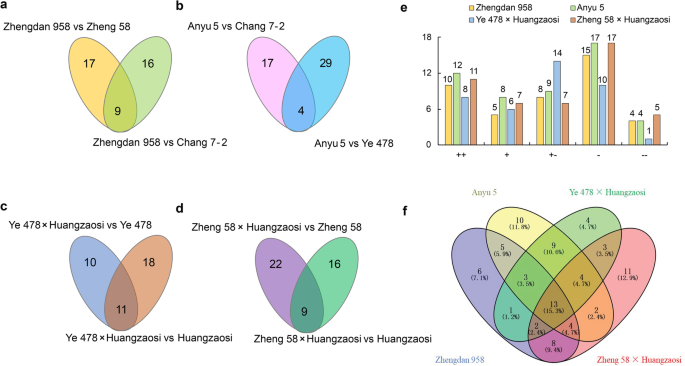
为了对mirna进行分类,首先根据阈值对杂交组合和亲本表达差异显著的mirna进行鉴定P< 0.01, log2(折叠变化)> 1或< - 1.226和25(共同的)MIRNA分别在郑丹958和郑58以及郑丹958和常数7-2之间显着差异地表达了(图。4.一种;附加文件3.:表S3-1)。比较于Anyu 5、Ye 478和Chang 7-2,分别有33个和21个(共有4个)mirna显著差异表达(图2)。4.B;附加文件4.(见表S4-1), 21和29(共11个)mirna在叶478 ×黄早司和叶478 ×黄早司之间分别显著表达(图4 - 1)。4.c;附加文件5.:Tables5-1).类似地,25和31(9种共同的)miRNA分别在郑58×黄泽索和黄泽索斯和郑58之间显着表达(图。4.D;附加文件6.:表S6-1)。
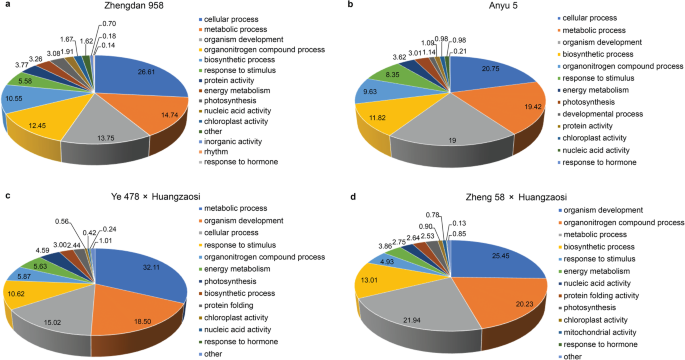
进一步分析了杂交组合与母本自交系和杂交组合与父本自交系中差异表达mirna的结合情况。将郑单958、豫5、叶478 ×黄早寺和郑58 ×黄早寺中差异表达的42、50、39和47个mirna按上述分类标准分为5种不同的表达模式;因此,这些mirna以后被称为缩放mirna。表达模式可以用加性、显性和超显性假说来解释;大多数缩放的mirna是非加性(显性和过度显性)表达。根据D/A值,郑单958、豫5、叶478 ×黄早寺和郑58 ×黄早寺分别诱导了17、23、18和21个mirna (D/A >),抑制了25、27、21和26个mirna (D/A < 0)。一般而言,郑单958、豫5和郑58 ×黄早寺中亲本低表达(−)的miRNA构成了最丰富的miRNA组;相反,叶478 ×黄早寺中加性表达(+ -)的miRNA构成了最丰富的miRNA群(图4)。4.e)。根据统计数据,60,54,54和55%的差异表达的miRNA在郑丹958,Anyu 5,Ye 478×Huangzaosi和郑58×黄泽索中被压抑。在生物过程类别中,郑丹958中这些缩放MiRNA的目标基因的主要GO术语(图。5.a)、宇5(图5)。5.b),Ye 478×Huangzaosi(图。5.c)、郑58 ×黄早斯(图5)。5.D)在光合作用、能量代谢、叶绿体活性和对激素的响应方面富集,表明这些生物过程可能有助于杂种优势的形成。
4个杂交组合中V6期第6叶片mirna的分布特征
在四种混合组合中有13个缩放的miRNA(图。4.f;表格2)和其中一些缩放的miRNA,包括MiR160B-3P,MIR162-3P,MIR162-5P,MIR169C-3P和MIR171G-5P,在四种杂交组合中表现出相同的表达模式。
6个、10个、4个和11个鳞片大小的mirna分别在郑单958、豫5、叶478 ×黄早司和郑58 ×黄早司中存在。4.f).一些mirna表现出有趣的表达趋势。许多miR156成员在杂交组合中存在差异表达,不同的miR156成员在不同的杂交组合中表达。郑单958、羽5和郑58 ×黄早寺中miR156成员主要为低亲本表达或极低亲本表达,而miR156成员c Ye 478 ×黄早寺中除miR156j-3p外,大部分miR156j-3p亲本表达极低(表2)3.).MiR395成员还在不同的混合组合中显示了不同的表达式偏差。缩放的mir395b-3p仅在郑丹958,anyu 5和ye 478×黄泽索中呈现;缩放的miR395b-3p在前两个混合组合中展示了“ - ”表达式模式,但在最后一个组合中显示了“+”表达模式(表4.).MiR395E-5P在郑丹958中唯一存在,展示了“+ - ”表达模式,Zma-MiR395O-5P在郑58×黄泽索斯和YE 478×Huangzaosi中表现出“+ - ”表达趋势,ZMA-MiR395A-5P展出所有四种混合组合中的不同表达式模式。
miR408a在郑单958中唯一表现为“+”的表达模式,而miR408b-5p在郑单958和玉5中唯一表现为“—”的表达模式。miRNA528a-5p在玉5号和叶478 ×黄早寺中被抑制,而miR528a-3p在郑单958和郑58 ×黄早寺中表现为“-”表达模式(表2)5.).miR399家族成员主要在四种杂交组合中诱导产生(表1)6.).因此,基于这些发现,来自同一miRNA家族的成员的不同表达偏差也可能是杂种优势的原因。
通过降解组分析验证选定的mirna及其靶基因
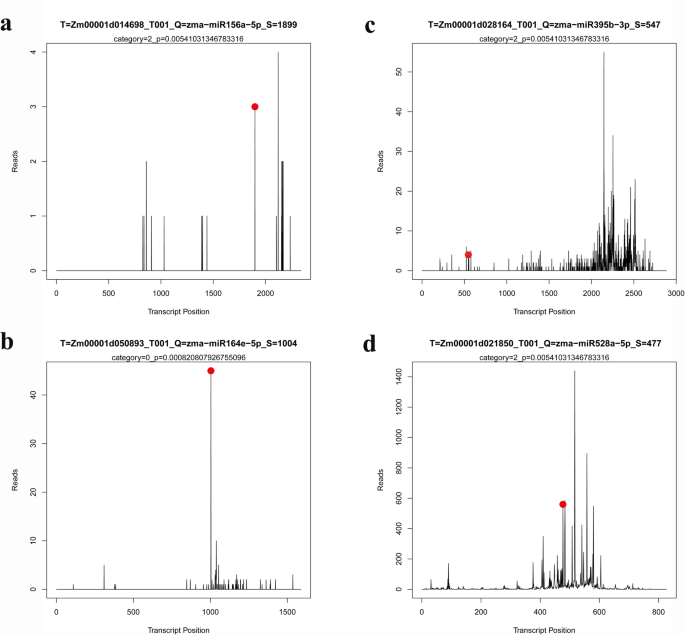
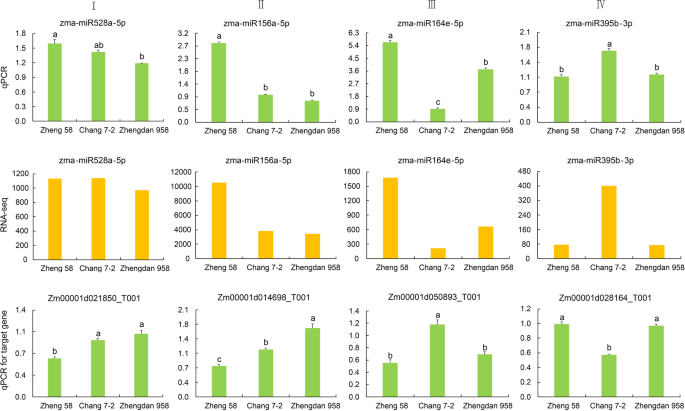
验证靶基因对于理解mirna的生物学功能非常重要。在我们的研究中,我们构建了V6阶段第6叶的降解库。经鉴定的靶基因与郑单958中的mirna匹配(附加文件)3.:表S3-2)4.:表S4-2),YE 478×Huangzaosi(附加文件5.:表S5-2),郑58×黄泽索(附加文件6.:表S6-2)。正如预期的那样,大多数被保守mirna靶向的转录本与保守靶基因相关。例如,miR156a-5p靶向SPL11, miR164e-5p靶向NAC79, miR395b-3p靶向硫酸盐转运蛋白2.2,和miR528a-5p靶向铜二氧化素超家族蛋白质(图。6.).确定由降解组的这些保守的miRNA和靶基因的表达谱进行测定四种杂交组合及其亲本。我们对总RNA进行了逆转录反应,然后进行定量实时聚合酶链反应(QRT-PCR)。内部对照Zmactin用于QRT-PCR和2——ΔΔCt施用方法以表达级计算。所选miRNA的表达谱在很大程度上与来自测序数据的相一致。与相应的miRNA相比,靶基因显示出相反的表达趋势(图。7.;附加文件7.那8.那9.:图。S1,S2,S3)。
讨论
杂种优势,光合作用和miRNA之间的关系
杂种优势是指F1s相对于亲本的优异表现,在玉米的许多性状和杂交组合中普遍存在[36].玉米在生物量、株高、根系生长、光合作用、淀粉代谢、籽粒产量和生物/非生物胁迫抗性等诸多性状上表现出显著的杂种优势;因此,玉米已成为杂种优势研究的模式植物。郑单958是我国种植面积较大的商品杂交种,代表了Reid × Tang-SPT杂种优势模式的成功利用。最近,分子和生理证据表明,光合作用与杂种优势有关[37那38那39].在拟南芥,无论是在杂种组合还是父母中,如果每单位叶片恒定的光合作用率恒定,则由于每种细胞,细胞大小和叶区域的叶绿体数量增加,杂种率增加了光合作用能力的增加19.].在玉米中,关于mirna在杂种优势中的作用的研究较多,如种子萌发、节间膨大、胚乳发育等方面的研究[33.那40那41].mirna在郑单958、Anyu 5和其他2个Reid × Tang-SPT杂种优势模式组合中调控节期杂种优势的作用机制。了解这一机制有助于我们更好地理解杂种优势。
引用的miRNA-mRNA调节机制参与连接阶段杂种优势
在本研究中,从8份材料中鉴定出了182个已知的mirna,并根据其D/A值对杂交种与至少一个亲本中表达差异的mirna进行了量化。郑单958、豫5、叶478 ×黄早寺和郑58 ×黄早寺分别抑制了25、27、21和26个mirna的表达,诱导了17、23、18和21个mirna的表达。这些尺度缩小的mirna与靶基因之间的相互作用可能与杂种优势有关。例如,miR156是一类据报道通过与GTAC顺式元件特异性结合参与植物发育和生长的星状mirna,靶向TFs的SQUAMOSA启动子结合样(SPL)家族[42那43].鉴于关于MIR156的知识增加,已建议MiR156 / SPL模块是一种多方面工具,可以增强农艺性状[44].在米饭中,OS-MIR156和OSSPL14模块控制理想的工厂结构[45]也发现SPL TFS调节粒度,粒度,穗分支以及植物高度[46那47].在玉米中,miR156在杂交组合中被抑制,这可能导致SPL的表达增加节间膨大[41].在我们的研究中,miR156a-5p的抑制可能导致的过表达Squamosa启动子结合样蛋白11加速相转变,这表明杂交种具有比父母自交系更强的生长潜力。
在玉米自交系B73中,MiR408B-5P在第11个基本位置的单核苷酸多态性(SNP)(A / g),其5'dend与Mo17的不同,在另一个研究中已经证实,表明这一点B73×MO17和MO17×B73互易跨越的父母表达可能导致功能变化[40].由降解剂,早期光诱导的蛋白质(ElIPS)鉴定的miR408b-5p的靶基因是结合叶绿素的光收获络合物,并在绿色植物中占用太阳能拟南芥.在强光胁迫下抑制ELIPs的快速积累导致叶片脱色,并导致延长的光氧化损伤[48].在我们的研究中,郑单958和渝5中只有mo17等位基因miR408b-5p下调。有趣的是,miRNA miR408a已经被证明可以通过过表达来提高生物量和种子产量拟南芥[49,是郑单958唯一诱导的。MIR408-overexpressing拟南芥植物呈现出显着改善的叶面积,叶柄长度,植物高度,花尺寸和硅质长度以及显着提高的光合速率,这导致了更多的生物质和种子产量。表达中下调的基因mir408-ox转基因植物在核糖体、光合作用、碳固定和色素生物合成等过程中富集。在另一项研究中,miR408过表达导致幼苗期鲜重增加,根长增加,成虫期叶片全部变大[50].在玉米中,miR408a在应对低温胁迫时上调以维持叶片生长[51].根据我们的研究,miR408a仅在郑单958中表现出的高亲本表达也可能导致光合作用的增加,从而可能对玉米杂交组合的杂种优势产生影响。
硫是植物生长,涉及光合作用,呼吸,氮气和碳水化合物代谢的矿物质元素,从而调节植物发展[52].硫酸盐是植物可用无机硫的主要形式;它被植物根吸收,然后易于转移到不同的组织以进行同化。在拟南芥,存在两种形式的成熟miR395(miR395a,d,e和mir395b,c,f),其靶向两个基因,ATP硫脲酶和硫酸酯转运蛋白2;1,两者都涉及硫酸盐代谢途径,并且它们的转录物在MiR395-过表达转基因中强烈压抑拟南芥与野生型植物相比,它们的体型相对较小,且略多一些褪绿。miR395在植物中维持硫酸盐稳态的机制已经被阐明[53].因此,我们可以推断MiR395B-3P在杂种中下调,以更有效地利用硫酸盐。
磷酸盐在植物生长和开发中发挥关键作用作为必要的常规营养素,它是核酸,磷脂和能量分子ATP的关键结构组分[54那55].miR399家族成员作为一个磷酸盐缺乏反应因子参与了体内磷酸盐平衡拟南芥.显示MIR399在PI剥夺下诱导诱导靶mRNA pHO2的剪接,并通过PHO2抑制下游PHT1和PHO1泛素化降解,促进PI吸收和转运[56那57那58那59那60.].在玉米中,miR399在缺磷时表达上调,过表达miR399b导致地上部磷积累[61.].MiR399还上调在伸长区中,这可能在叶片开发期间从细胞分裂切换到细胞伸长中可能的作用[62.].在我们的研究中,miR399在杂交种中被诱导,这可能会提高磷的利用效率,加速生长发育,最终可能是杂种优势的一个原因。
mir528是一类米兰斯,限于单像[63.].在水稻中,miR528被证明可以靶向至少四个基因的mRNA转录本,这些基因编码两个质体色素样蛋白,一个l -抗坏血酸氧化酶和一个ein3结合的F-box蛋白[64.].铜是蛋白质合成的重要元素[65.].存在主要类别的含Cu的蛋白质,其主要是电子转移蛋白,而不是作为氧化酶,其通常被命名为蓝铜蛋白或铜氧化锡,例如塑性蛋白样蛋白,在光合作用期间起着重要作用[66.].在我们的研究中,MiR528A-5P在混合组合中被压抑,这可能会增加电子转移以调节光合作用。
miR164的靶标是tf编码基因NAC1,该基因特异性地与顺式元件IDE2结合。在许多植物物种中,NAC转录因子通过调节生长素信号通路增加对生物和非生物胁迫的抗性[67.那68.那69.].生长素还可促进TIR1下游NAC1的表达和功能[70];毒素诱导的miR164和泛素化可以降低NaC1转录以减少养蛋白信号传导[71.].在我们的研究中,miR164e-5p在杂交组合中下调;因此,NAC1的转录可能被上调,导致生长素信号通路的增加。
PS1-F(光系统1-F亚基)是本研究通过降解体鉴定的miR1432靶标,在水稻中调控籽粒产量和分蘖数。Ds纯合插入OsPS1-F突变体的叶绿素浓度和电子传递速率显著降低,导致株高、分蘖数和籽粒产量降低,叶片颜色呈现淡黄色。如果突变体由proUBI::OsPS1-F补充,由于突变的表型不那么明显[72.].在我们的研究中,MiR1432-5P在杂交种中被压抑,诱导PS1-F,因此光合作用增加。
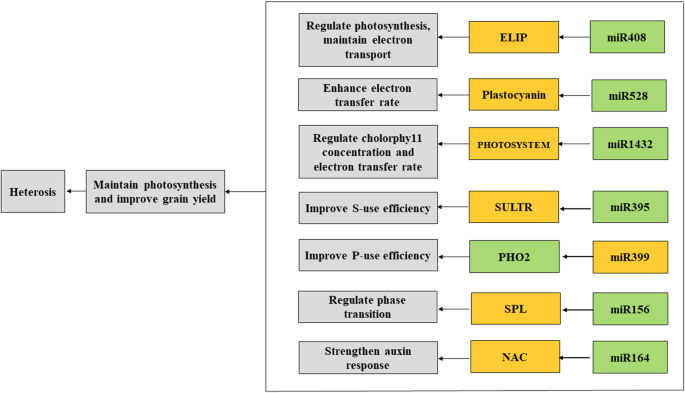
miRNA-mRNA模块可能调节拔节期杂种优势(图。8.).在这些mirna中,miR1432、miR164和miR528家族在四种杂交组合中均受到抑制;然而,有趣的是,miR408、miR395、miR399和miR156家族在不同杂交组合中以不同的成熟miRNA形式表达,并可能表现出不同的表达趋势,我们认为这可能具有不同的调控作用。尽管从基因表达、存在/缺失变异、DNA甲基化变化、蛋白质变化以及代谢产物变化等不同水平对杂种优势进行了研究,但我们的研究重点是mirna在杂种和亲本中的行为,这为mirna介导的杂种优势调控机制提供了新的认识。然而,杂种优势是一个复杂的、综合性的科学问题,还需要进一步的研究。
结论
在本研究中,我们发现4个杂交组合与亲本在V6阶段有85个mirna的差异表达,并根据其D/A值对差异表达的mirna的结合进行分类。在这些mirna中,25、27、21和26个mirna被抑制,而郑单958、豫5、叶478 ×黄早寺和郑58 ×黄早寺分别被诱导表达17、23、18和21个mirna。大多数比例的mirna是非加性表达。不同成熟mirna表达的同一家族的mirna在不同的杂交组合中表现出不同的模式,这可能导致转录后调控机制的作用不同,进而产生不同的杂种优势表型。我们还通过qRT-PCR验证了一些代表性mirna的表达。通过降解组测序确定了可能的miRNA靶基因。我们的研究结果表明,mirna介导的转录后调控网络(miR408, miR528, miR1432, miR395, miR399, miR156, miR164)可能通过光合作用调控拔节期的杂种优势。我们的工作为进一步探索mirna的杂种优势机制提供了有益的信息。
方法
植物材料
郑丹958(郑58×张7-2),Anyu 5(ye 478×chang 7-2),叶478×黄泽索,而郑58×黄泽索斯是根据普遍的异性图案Reid×Tang-Spt在中国开发的那和their parental lines (Zheng 58 and Ye 478 are famous inbred lines from the domestic Reid group, and Chang 7–2 and Huangzaosi were famous inbred lines from the Tang-SPT group) were used as materials. We crossed the Zheng 58 and Ye 478 (maternal lines) with Chang 7–2, Huangzaosi (paternal lines) to gain four hybrid combinations, and the four hybrid combinations as well as the four inbred lines were then planted in the summer of 2018 on a farm at Henan Agricultural University (Zhengzhou, 113°42′E, 34°48′N) in northern China. In each replication, forty-five seeds of each material were planted in pots arranged in three lines in the field with 0.25-m line spacing and 0.60-m row spacing, such that the plant density was 67,500 ha- 1,有三次重复。
光合作用指数和谷物产量测量
当植物达到v6阶段时,第六叶刚刚完全扩展,10种随机选择的幼苗的第六叶的光合作用在每次复制中通过Li-6400光合体系(Li-Cor Biosciences,Lincoln,Ne那USA) in the field between 8:00 a.m. and 11:00 a.m. Then, for the above-mentioned 10 selected seedlings, the length and greatest width of the sixth-fully-expanded leaf were used to measure leaf area according to the method of Montgomery [73.].在每个重复中,采收各材料中间行,测量每穗粒重,按以下公式计算粮食产量- 1) =每穗粒重(kg) ×株密度(67500公顷)- 1).进行了三次重复。
玉米RNA提取,SRNA测序和miRNA鉴定
在每种生物复制中,一旦植物达到V6阶段,就收获了来自每种材料的全膨胀幼苗的完全展开的幼苗中部分的等量组织。它们储存在-80°C,获得了三种重复。使用Trizol试剂提取来自每种材料的总RNA,并在北京基因组学研究所构建24例SRNA文库。
处理来自Illumina测序的原始数据以过滤并移除低质量,重复和低复杂性读取。为了鉴定保守的miRNA,将具有18至25nt的长度的独特的SRNA序列映射到MiRBase 21.0中报告的miRNA(http://www.mirbase.org/).保守miRNA被注释后,使用预测软件MIREAP的剩余部分读取的小RNA读数识别新颖的miRNA(http://sourceforge.net/projects/mireap/).如果符合文献中报道的严格标准,可以定位玉米基因组的srna被认为是潜在的miRNA候选[74.].
识别差异表达的miRNA和表达模式分类
表达水平被标准化为TPM值。评估统计学意义,at- 最低应用。用以下标准确定杂种组合和父母线之间的差异表达的miRNA:P-Value是<0.01和日志2(折叠变化)> 1或< - 1.对于每个差异表达的miRNA,基于TPM计算缩放差异作为主导/添加性(D / a值);优势程度计算为杂交 - 中父母;添加程度是以高级亲父母计算的。通过公式计算D / A值:(F1-MP)/(HP-MP)[22.].D/A大于零被认为是诱导的,而D/A小于零被认为是抑制的。将miRNA表达模式分为5组:(1)“+ +”,亲代表达极高,D/ a大于2;(2)“+”,亲本表达量高,D/ a大于0.5且小于2;(3)“+ -”,加性表达式,D/ a大于- 0.5且小于0.5;(4)“-”,亲本低表达,D/ a大于−2且小于−0.5;(5)“—”,亲代表达极低,D/ a小于−2 [34].
降级图书馆建设和目标识别
我们同样地混合了用于MiRNA测序的24个总RNA,以根据文献中报告的方法构建单个降低组文库[75.].在Illumina Hiseq 2000(Illumina,San Diego,CA USA)上进行单端测序(50bp)。我们使用Cleaveland 3.0分析生成的测序数据。相应的差异表达的miRNA的鉴定的靶基因与GO术语注释(http://www.geneontology.org/),它们被认为是显著丰富的P- 值<0.05。
使用qRT-PCR对选定的mirna及其靶基因进行定量分析
我们使用One Step PrimeScript miRNA cDNA Synthesis Kit (TaKaRa Co., Tokyo, Japan)按照生产商的说明书进行逆转录反应。采用SYBR PrimeScript miRNA RT-PCR试剂盒,结合荧光检测系统(Roche LightCycler 480 II)进行qRT-PCR-ΔΔct方法(使用的引物序列在附加文件中给出10.:表S10)。杂种与自交系的表达量差异采用Fisher最小显著差异检验;P< 0.05被认为有统计学意义。
可用性数据和材料
在当前研究期间生成和分析的数据集可在Bioproject Prjna649665下的NCBI序列读取存档(SRA)数据库中获得(https://www.ncbi.nlm.nih.gov/bioproject/prjna649665.).本研究所使用的资料(郑58,叶478,常7-2,黄早寺,郑单958,余5,叶478 ×黄早寺,郑58 ×黄早寺)均应通讯作者合理要求提供。
缩写
- miRNA:
-
microRNA.
- SRNA:
-
小核糖核酸
- V6阶段:
-
六叶阶段
- 走:
-
基因本体论
- 存在:
-
定量逆转录 - 聚合酶链反应
- SPL:
-
Squamosa启动子结合蛋白质
- 南京:
-
NAC含域的蛋白质
- elips:
-
早期的光致蛋白质
- psii:
-
光系统II复杂
- PS1-F:
-
Photosystem-1 F子单元
- PHO2:
-
磷酸2
- PHO1:
-
磷酸盐1
- PHT1:
-
磷酸盐转运蛋白protein1
- EIN3绑定F-BOX:
-
乙烯 - 不敏感3转录因子绑定F箱
参考
- 1。
Shull GH。杂种优势概念的开端。In: Gowen JW,编辑。杂种优势。爱荷华州立大学出版社;1952.14-48页。
- 2。
duvick dn。20世纪30年代生物技术:杂交玉米的发展。NAT Rev Genet。2001; 2(1):69-74。
- 3.
布鲁斯ab。孟德尔遗传学理论与增强活力。科学。1910; 32(827):627-8。
- 4.
琼斯df。关联因子的主导地位作为杂种优势的核算手段。P Natl Acad Sci USA。1917; 3(4):310-2。
- 5.
东EM,杂种优势。遗传学。1936;21(4):375 - 97。
- 6。
番茄自交系和F1杂种的相对产量。机器人Gaz。1945;106(3):247 - 68。
- 7。
Hoocker N,Keller B,Muthreich N,Chollet D,Descombes P,Piepho HP,Hochsheger F.玉米的比较(玉米L.)F1-杂交和父母近交线原代根转录om表明非增生基因表达的器官特异性模式和保守表达趋势。遗传学。2008; 179(3):1275-83。
- 8.
Hochshedinger F,Hoocker N.朝着杂种优势的分子基础。趋势植物SCI。2007; 12(9):427-32。
- 9.
Guo M,Rupe Ma,Zinselmeier C,Habben J,Bowen Ba,Smith OS。玉米杂交种基因表达的等位基因变异。植物细胞。2004; 16(7):1707-16。
- 10.
Liu Y, von Behrens I, Muthreich N, Schütz W, Nordheim A, Hochholdinger F.玉米中柱鞘蛋白质组的调控(玉米L.)主要根源Rum1.侧根启动需要。EUR JBelt Biol。2010; 89(2-3):236-41。
- 11.
Paschold A,Marcon C,Hoecker N,Hochsheger F.早期玉米根系发育期间杂种优势表现的分子解剖。Al Appl Genet。2010; 120(2):383-8。
- 12.
Schnable PS,Ware D,Fulton Rs,Stein Jc,Wei F,Pasternak S,Liang C,Zhang C,Zhang J,Fulton L,Graves Ta,等。B73玉米基因组:复杂性,多样性和动态。科学。2009; 326(5956):1112-5。
- 13。
MA J,Morrow DJ,Fernandes J,Walbot V.玉米线路感觉和反义转录组的比较分析。基因组Biol。2006; 7(3):R22。
- 14.
stharar rm,springer nm。CIS.玉米自交系B73和Mo17的转录变化导致F1杂种的加性表达模式。遗传学。2006;173(4):2199 - 210。
- 15.
Hoecker N, Lamkemeyer T, Sarholz B, Paschold A, Fladerer C, Madlung J, Wurster K, Stahl M, Piepho HP, Nordheim A, et al.;玉米幼根非加性蛋白积累分析(玉米l .)F(1)杂种与亲本自交系比较。蛋白质组学,2008;8(18):3882 - 94。
- 16.
李超,宋伟,罗勇,高胜,张锐,史志,王旭,王锐,王飞,王军,等。黄早司玉米基因组的研究为了解玉米基因组变异和改良历史提供了依据。摩尔。2019;12(3):402 - 9。
- 17。
孙胜,周勇,陈建军,史军,赵华,赵辉,宋伟,张敏,崔颖,董欣,等。Mo17与其他玉米基因组存在广泛的种内基因顺序和基因结构差异。Nat麝猫。2018;50(9):1289 - 95。
- 18.
Jacotot A,Marchand C,Gensous S,Allenbach M.升高的大气CO的影响2并增加两种常见红树林的叶片气体交换参数的潮汐洪水:矮小和根卓菲奥萨.Photosynth杂志2018;138(2):249 - 60。
- 19.
Fujimoto R,Taylor JM,Shirasawa S,孔雀WJ,Dennis Es。杂种优势拟南芥C24和COL之间的杂交种与相比的光合容量增加相关。P Natl Acad Sci USA。2012; 109(18):7109-14。
- 20.
Wei G,Tao Y,Liu G,Chen C,Luo R,夏H,GaN Q,Zeng H,Lu Z,Han Y等。超杂米的转录组分析LYP9.和它的父母。P Natl Acad Sci USA。2009; 106(19):7695-701。
- 21.
宋GS,翟HL,彭·yg,张l,魏g,陈xy,小yg,王l,陈yj,wu b等。超杂交水稻杂交水稻杂交机理的比较转录分析及初步研究。莫尔植物。2010; 3(6):1012-25。
- 22.
周鹏,Hirsch CN, Briggs SP,施普林格NM。玉米发育过程中基因表达、加性和调控变异的动态模式摩尔。2019;12(3):410 - 25所示。
- 23.
Jones-Rhoades MW,Bartel DP,Bartel B. Micrornas及其在植物中的监管角色。Annu Rev植物Biol。2006; 57:19-53。
- 24。
Brodersen P, Sakvarelidze-Achard L, Bruun-Rasmussen M, Dunoyer P, Yamamoto YY, Sieburth L, Voinnet O.植物mirna和sirna的广泛翻译抑制。科学。2008;320(5880):1185 - 90。
- 25。
薛立军,张建军,薛宏伟。水稻种子中mirna的特性和表达谱。核酸学报2009;37(3):916-30。
- 26.
焦勇,宋伟,张敏,赖军。基于前体加工精度的新型玉米mirna鉴定。BMC Plant Biol. 2011;11:141。
- 27.
太阳F,Guo G,Du J,Guo W,Peng H,Ni Z,Sun Q,Yao Y.麦克纳斯的全基因组发现及其在小麦的目标(Triticum aestivum.L.)。BMC植物BIOL。2014; 14:142。
- 28.
Juarez Mt,Kui Js,Thomas J,Heller Ba,Timmermans MC。microRNA介导的镇压滚动Leaf1.指定玉米叶片极性。大自然。2004;428(6978):84 - 8。
- 29。
Nag A, Jack T.雕刻花朵;microrna在花发育中的作用。Curr Top Dev Biol. 2010; 91:349-78。
- 30.
Chuck G,Meeley R,Irish E,Sakai H,Hake S.玉米tasselseed4microRNA通过靶向控制性别决定和分生组织细胞命运Tasselseed6 /不定spikelet1.Nat麝猫。2007;39(12):1517 - 21所示。
- 31.
他陈F, G, H,陈W,朱X,梁M,陈L,邓小平XW。两个水稻亚种及其互交杂交种mirna和高表达小rna的表达分析。acta botanica yunnanica(云南植物研究). 2010;52(11):971-80。
- 32.
ShivaPrasad PV,Dunn RM,Santos Ba,Bassett A,BaulCombe DC。杂交番茄的非凡侵袭表型受到表观生物学和小沉默RNA的影响。Embo J. 2012; 31(2):257-66。
- 33.
Mica E, Gianfranceschi L. Pe ' ME。玉米中五个microRNA家族的特性研究。中国农业科学。2006;57(11):2601-12。
- 34.
丁D,王Y,韩米,富Z,李W,刘Z,胡y,唐j. microRna玉米种子萌发过程中杂种的转录组分分析。Plos一个。2012; 7(6):E39578。
- 35.
wang P, wang P, wang P, wang P, wang P, wang P, wang P, wang P ., wang P ., wang P ., wang P ., wang P ., wang P ., wang P ., wang P ., wang P ., wang P .。玉米自交系和F1杂种小rna的变异和遗传。植物杂志。2020;182(1):318 - 31所示。
- 36。
引用本文:Flint-Garcia SA, Buckler ES, Tiffin P, Ersoz E,施普林格NM。在不同的玉米种质中,多性状杂种优势普遍存在。《公共科学图书馆•综合》。2009;4 (10):e7433。
- 37。
我们能从杂种优势和表观遗传学中学习改善光合作用吗?植物学报。2014;19:105-10。
- 38.
宋y,张z,棕褐色x,江y,高j,林l,王z,ren j,wang x,qin l等。玉米生殖阶段耳叶衰老/应力反应和光合作用/代谢的分子调控的关联。SCI代表2016; 6:29843。
- 39.
利用无标记蛋白质组学研究向日葵叶片的杂种优势。J蛋白质组。2014;99:101-10。
- 40.
杨国强,王旭东,倪志伟,杨国强,杨国强。玉米胚乳发育过程中miRNA表达的变化。植物科学学报2015;6:744。
- 41.
赵鹏,丁冬,张飞,赵旭,薛勇,李伟,付志,李华,唐军。利用microRNA转录组深度测序研究玉米节间膨大杂种优势的分子遗传基础。功能整合基因组学。2015;15(3):261-70。
- 42.
王杰,公园我的,王lj,koo y,chen xy,weigel d,poithig卢比。树木植物相变的miRNA控制。Plos Genet。2011; 7(2):E1002012。
- 43.
王L,顾X,徐D,王W,王H,Zeng M,Chang Z,Huang H,Cui X.Mir396靶向AtgrF转录因子是细胞分裂和叶片发育过程中的分化的协调所必需的拟南芥.中国农业科学。2011;62(2):761-73。
- 44.
王H,王H. MIR156 / SPL模块,一个监管中心和多功能工具箱,齿轮造成农作物,以增强农艺性状。莫尔植物。2015; 8(5):677-88。
- 45.
焦y,王y,薛d,王继,燕m,刘g,东g,zeng d,lu z,zhu x等。规范OsSPL14由osmir156定义米饭中的理想植物建筑。NAT Genet。2010; 42(6):541-4。
- 46.
三浦K,池田M,松原A,宋晓杰,伊藤M,浅野K,松冈M,北野H, Ashikari M。OsSPL14促进水稻中穗分枝和较高的谷物生产力。NAT Genet。2010; 42(6):545-9。
- 47.
司林,陈建军,黄旭,罗军,侯强,周涛,陆涛,朱军,上官勇,等。OsSPL13控制栽培水稻的晶粒尺寸。NAT Genet。2016; 48(4):447-56。
- 48。
Hutin C,Nussaume L,Moise N,Moya I,Kloppstech K,Havaux M.早期光诱导的蛋白质保护拟南芥从光氧化胁迫。P Natl Acad Sci USA。2003; 100(8):4921-6。
- 49。
宋Z,张我,王,李,李某,李某,赵h,张h。MiR408的本构表达改善生物质和种子产量拟南芥.前植物SCI。2017; 8:2114。
- 50。
张H,Li L.Squamosa启动子结合蛋白样7营养开发所需的监管MicroRNA408拟南芥.工厂J. 2013; 74(1):98-109。
- 51。
Aydinoglu F.阐明MicroRNA在玉米中的调节作用(玉米L.)叶生长反应对寒冷的压力。Planta。2020; 251(2):38。
- 52.
史密斯IK,Lang Al。大豆硫酸盐易位(大豆L. MERR)。植物理性。1988; 86(3):798-802。
- 53.
梁G,杨F,Yu D. MicroRNA395介导硫酸盐积聚和分配的调节拟南芥.植物j . 2010; 62(6): 1046 - 57。
- 54.
Péretb,克里马特M,Nussaume L,Desnos T.根系发育适应磷酸盐饥饿:更安全,而不是抱歉。趋势植物SCI。2011; 16(8):442-50。
- 55.
López-Arredondo DL,Leyva-GonzálezMa,González-Morales Si,López-BucioJ,Herrera-Estrella L.磷酸盐营养:提高农作物的低磷耐耐受性。Annu Rev植物Biol。2014; 65:95-123。
- 56.
赵廷俊,林思,翁凯,朱家杰。一个参与磷饥饿反应的miRNA拟南芥.Curr Biol。2005; 15(22):2038-43。
- 57.
邱天俊,昂柯,林思,吴聪,蒋顺生,苏春林。细胞内MicroRNA对磷酸盐稳态的调控拟南芥.植物细胞。2006; 18(2):412-21。
- 58.
林思,蒋雪汁,林维,陈杰,曾迪,吴电脑,chou tj。MicroRNA399的监管网络和PHO2通过系统信令。植物理性。2008; 147(2):732-46。
- 59.
刘玉婷,黄大仙,曾育英,赖永英,林思,林文耀,陈吉文,邱天俊。PHO2端依赖退化PHO1调节体内磷酸盐稳态拟南芥.植物细胞。2012; 24(5):2168-83。
- 60。
黄tk,韩春林,林思,陈永杰,蔡永昌,陈玉玲,陈吉文,林文英,陈pm,刘天宇,等。用定量膜蛋白组学鉴定泛素结合酶PHOSPHATE2下游成分拟南芥的根源。植物细胞。2013;25(10):4044 - 60。
- 61。
杜强,王凯,邹超,徐超,李文祥。的pilncr1.-mir399监管模块对于玉米磷耐耐受性很重要。植物理性。2018; 177(4):1743-53。
- 62。
Aydinoglu F,Lucas SJ。玉米推定叶生长相关微大稻草的鉴定和表达谱(玉米L.)Hybrid ADA313。基因。2019年; 690:57-67。
- 63。
刘b,李p,李x,刘c,cao s,chu c,cao x.损失功能OSDCL1.影响MicroRNA积累并导致水稻中的发育缺陷。植物理性。2005; 139(1):296-305。
- 64。
杨R,李鹏,梅清,王D,Sun J,Yang C,Hao L,Cao S,Chu C,Hu S等人。MiR528积累的微调调节水稻中的开花时间。莫尔植物。2019; 12(8):1103-13。
- 65.
黄志强,王志强,王志强,等。铜辅助因子在植物细胞中的传递。植物学报。2006;9(3):256-63。
- 66.
C3植物的循环电子流。Acta botanica yunnanica(云南植物研究)2006;
- 67.
Tran LS, Nakashima K, Sakuma Y, Simpson SD, Fujita Y, Maruyama K, Fujita M, Seki M, Shinozaki K, Yamaguchi-Shinozaki K.分离和功能分析拟南芥胁迫诱导的NAC转录因子与干旱响应结合CIS.- 在这方面早期响应脱水应力1启动子。植物细胞。2004;16(9):2481 - 98。
- 68.
Christianson Ja,Wilson Iw,Llewellyn Dj,Dennis Es。低氧诱导的NAC结构域转录因子ANAC102影响可行性拟南芥低氧治疗后种子。植物理性。2009; 149(4):1724-38。
- 69.
Balazadeh S,Siddiqui H,Allu Ad,Matallana-Ramirez LP,Caldana C,Mehrnia M,Zanor Mi,KöhlerB,Mueller-roeber B.由NAC转录因子ANAC092 / ATNAC2 / ORE1控制的基因调节网络在盐促进期间衰老。工厂J.2010; 62(2):250-64。
- 70.
谢Q,Frugis G,Colgan D,Chua NH。拟南芥NAC1在下游转换TIR1下游以促进横向根部发育。基因开发。2000; 14(23):3024-36。
- 71.
郭海生,谢强,费建峰,蔡宁华。MicroRNA指导转录因子的mRNA切割母下调植物素信号拟南芥侧根的发展。植物细胞。2005;17(5):1376 - 86。
- 72。
Ramamoorthy R,Vishal B,Ramachandran S,Kumar PP。的OsPS1-F基因通过调节光合电子运输速率来调节水稻的生长和发育。植物细胞批准。2018; 37(2):377-85。
- 73。
E.蒙哥马利,MB蒙哥马利。玉米的相关研究。内布拉斯加州农业实验站,1911年;页108 - 159。
- 74。
Meyers BC, Axtell MJ, Bartel B, Bartel DP, Baulcombe D, Bowman JL等。植物microrna注释标准。植物细胞。2008;20(12):3186 - 90。
- 75。
add-quaye c,eshoo tw,bartel dp,axtell mj。通过测序确定的内源siRNA和miRNA靶标拟南芥degradome。咕咕叫医学杂志。2008;18(10):758 - 62。
确认
我们要感谢Lei Tian,Moubiao Zhang和Jingyang Gao帮助他们的生物信息学分析。我们还感谢American Journal Experts(Durham,北卡罗来纳州,美国)进行验证我们的稿件。
资金
该工作得到了中国国家重点研究和发展方案资助的,授予2016YFD0101205。这项融资机构在研究的设计中没有作用;数据收集,分析和解释;并在写作稿件。
作者信息
从属关系
贡献
LCW,LXK帮助设计了实验;YHC设计了实验;GGH进行了实验并写了草案;XLM修改了稿件;YHD和GGH进行了QRT-PCR并制作了一些数字;FFZ,QNZ,Tyl和DDD进行了现场特征分析和取样。所有作者都为稿件的更正并批准了提交。
相应的作者
伦理宣言
伦理批准和同意参与
本研究中的植物材料集合符合机构,国家或国际指南。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
本研究中发现的已知mirna。
附加文件2:表S2。
本研究中发现的新型mirna。
附加文件3:表S3。
郑丹958中差异表达miRNA的表达模式及降低组鉴定的目标函数。
附加文件4:表S4。
差异表达MIRNA在AFU5中的表达模式及降低组识别的目标函数。
附加文件5:表S5。
通过降解组鉴定叶478 ×黄早寺差异表达mirna的表达模式和靶功能。
附加文件6:表S6。
通过降解组鉴定郑58 ×黄早寺差异表达mirna的表达模式及靶功能。
附加文件7:图S1。
验证Anyu 5中所选miRNA的表达模式及其靶基因5.列上方的不同小写字母表示显着的差异
附加文件8:图S2。
筛选的mirna及其靶基因在叶478 ×黄早寺的表达模式验证列上方不同的小写字母表示显著差异(P< 0.05)。
附加文件9:图S3。
验证郑58×黄泽的选定miRNA的表达模式及其靶基因。列上方不同的小写字母表示显著差异(P< 0.05)。
附加文件10:表S10。
本研究使用寡核苷酸引物进行qRT-PCR检测。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
侯,G.,Dong,Y.,朱,F.等等。玉米第6叶片的MicroRNA转录组分析(玉米揭示了拔节期杂种优势的调控机制。BMC植物杂志20.541(2020)。https://doi.org/10.1186/s12870-020-02751-3
收到了:
公认:
发表:
关键词
- 玉米
- microrna的
- v6舞台
- 第六叶
- 光合作用
- 拔节期杂种优势