摘要
背景
器官形状和大小共变异(异速生长)因子是研究进化和发育的基本概念。虽然对器官形状和大小的研究很多,但很少有研究考虑这两个性状的相关变异,并在一个共同的框架内定量测量变异。单个器官或不同器官间异速生长变异的遗传基础也相对未知。
结果
对器官地标和轮廓的一个主要成分分析(PCA)进行了处理,并用于定量捕获多种先进发电机(魔法)群的叶子和花瓣的形状和大小变化拟南芥. 主成分分析表明,大小变异是异速生长变异的主要组成部分,叶片和花瓣大小的变化呈负相关。通过数量性状位点(QTL)定位,共鉴定出4叶5个QTL,7叶11个QTL,花瓣大小和形状12个QTL。除了ER基因座外,这些qtl与先前鉴定的qtl不完全相同。利用异速生长模型测量叶片和花瓣的异速生长协变量,研究同源器官间的进化和遗传协调。共鉴定出12个与第四叶和花瓣异速生长相关的qtl,8个与第七叶和花瓣异速生长相关的qtl。在这些QTL置信区中,存在着与细胞增殖和扩增相关的重要基因,这些基因具有最大效应。此外,还对与抽薹天数、茎长、莲座叶数等生活史性状相关的QTL进行了定位,这些QTL与气候变化和局部适应性高度协调,并与叶片和花瓣异速生长表现出重叠,从而解释了它们相关性的遗传基础。
结论
本研究探讨了叶瓣异速生长及其相互作用的遗传基础,为研究叶瓣器官形状和大小的相关变异和进化提供了重要信息拟南芥.
背景
器官的形态是由器官的形状和大小决定的,而形状和大小的协调变化是自然多样性的重要组成部分。异速生长是指形态性状中与大小有关的变化,可以用来描述一种器官内或不同器官的相对比例所发生的形状和大小的相关变化[1那2那3.].同源器官、叶子和花瓣可能共享一个基本的发育控制机制[4.那5.那6.],其器官大小与形状之间的相关性可能受某些异速生长因子的调控。即使是亲缘关系很近的物种也可能表现出非常不同的异速生长,这可能是由于选择产生的相关性[7.那8.]和发展限制[9.].异速生长变异的遗传和进化基础对我们理解植物发育是不可或缺的。然而,人们对此知之甚少。
为了解决这个问题,已经建立了一些定量遗传框架来量化器官的形状和大小[1那3.那10.那11.那12.]. 利用这些框架测量和比较了不同器官的大小和形状差异,以解决不同器官间的异速生长差异。一个点和轮廓的方法首先被放大以量化金鱼草叶片内的异速生长变异(Antirrhinum.)的物种3.].该方法直接捕捉异速生长变异而不导致形状和大小分离,实现了不同类型器官在同一框架内的合并。它已被用于量化叶片和花瓣的异速生长变化Antirrhinum.和拟南芥,研究器官大小和形状发育机制的遗传基础[1那10.那11.].
拟南芥是研究叶子和花瓣形状和大小的自然变化的理想生物体,因为在全球范围内具有广泛的变化,这些特征和许多人寿历史特征都是广泛的变化[13.那14.那15.].叶子和花瓣有一个优势,因为它们的形状和大小都可以通过二维(2D)轮廓很容易地捕捉到。以往的研究主要是对叶和花瓣的形状和大小进行QTL分析拟南芥.重组自交系(RILs)勒-0×第4栏交叉鉴定了16个和13个携带qtl的自然发生等位基因,它们分别导致了幼叶和成叶结构的自然变化[16.].在里面l×CVI.RIL群体,鉴定了八个花瓣特征的七QTL和三QTL用于叶状性状的QTLS [17.].亚伯拉罕等。[18.]在2个RIL群体中发现了涉及花瓣长度、宽度、面积和形状变异的23个qtl (列-0×Est-1和勒-0×第4栏).此外,许多控制叶和花瓣形状和大小的因素已经被鉴定出来,并被证明在叶和花瓣发育过程中受到激素信号、转录因子和mirna的调控,最近的研究结果强调了机械信号对叶和花瓣生长的贡献[19.那20.那21.].然而,这些qtl和所鉴定的因子都不能完全捕捉叶片和花瓣的异速生长变化,这是由于一般方法在充分捕捉叶片形状变化和整合形状和大小分析方面的局限性[22.].
本研究利用一组水稻叶片和花瓣自然异速生长变异的遗传基础拟南芥源自MAGIC系列,由19位创始人创建[14.].由于等位基因和重组事件的数量较多,多亲本系能够更好地处理遗传相关性,这允许在更小的间隔内进行映射[14.].此外,更多的等位基因数量提高了确定等位基因效应的分布是否与多效性兼容的能力。此外,我们使用了一种基于地标位置PCA的定量方法来定义捕捉形状和大小变化的异速生长空间[1那3.那10.那11.,它被集体处理,以允许异速生长关系的定义。
结果
异速生长模型的叶子和花瓣在魔术线
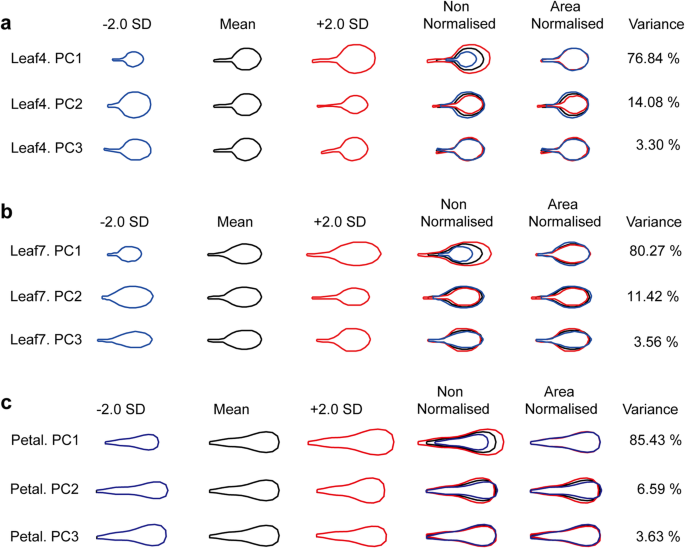
检测内部叶片和花瓣的形状和大小变化拟南芥,采用一种基于器官标志和轮廓PCA的异速生长方法来量化这一性状。对来自MAGIC线条的Leaf4、Leaf7和花瓣进行建模并生成单独的数据集。采用主成分分析(PCA),并根据每个主成分所描述的总方差的比例对所得到的主成分(PCs)进行排序(图5)。1,补充图1).
在叶4中,主成分分析显示90.92%的器官形状和大小的变异归因于两个PC(图。1一种)。Leaf4.PC1占总方差的76.84%,影响了叶子尺寸。更高的PC1值对应于较大的叶子,而较低的值产生较小的叶片。PC2占变异的14.08%,反映了叶形和叶柄长度的变化。具有较高PC2值的植物具有更长的叶柄更长的叶片,而叶片较低,叶片较低,叶柄较短。PC3解释了3.30%的方差,并在叶片扁平时显示了叶柄扭曲的程度,但其值在基因型之间没有显着差异。
在Leaf7中,PCA显示出器形状和尺寸的差异的95.25%可归因于三个PC(图。1b).本模型为Leaf7。P.C1 caused 80.27% of the total variance, which mostly influenced leaf size, but also had a minor effect on shape. Higher PC1 values corresponded to larger, more elongated leaves, whereas lower values yielded smaller and more rounded leaves. PC2 was responsible for 11.42% of the variance and mostly arranged the steepness of the transition from petiole to blade. Higher PC2 values yielded longer petioles with a steep transition, and lower values yielded shorter petioles with a very gradual transition. PC3 accounted for 3.56% of the variance and affected mainly the shape. Lower values of PC3 yielded more elongated and narrower leaves, whereas higher values of PC3 yielded more rounded and wider leaves.
在花瓣中,PCA显示92.02%的器官形状和大小的变异可归因于两个pc(图。1c) 是的。PC1占总方差的85.43%,影响花瓣大小。较高的PC1值对应较大的花瓣,而较低的值产生较小的花瓣。PC2占方差的6.59%,主要影响形状。低浓度的PC2使花瓣变长,形状变窄;高浓度的PC2使花瓣变圆,形状变宽。PC3占变异量的3.63%,表现为花瓣压扁时的花瓣扭曲。由于我们无法检测到不同基因型之间的显著差异,因此被排除在进一步分析之外。
叶片和花瓣的数量变化被异速生长模型捕获为MAGIC线(表1,补充图2).观察到魔法线之间测量的所有特征的广泛表型变异,并且通过广义遗传性估算了相对遗传贡献(H2).的范围H2是0.62至0.87,这表明不同线之间的表型变化更归因于遗传组分。
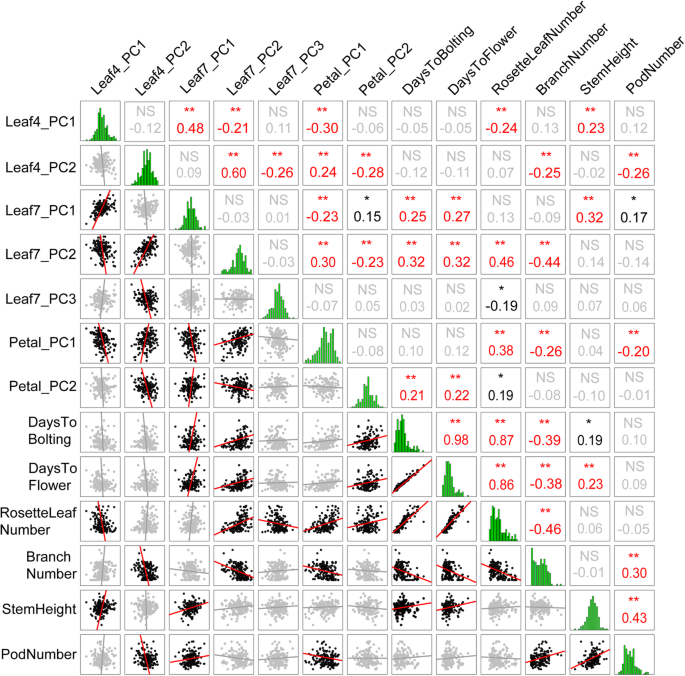
形状和大小之间的相关分析也进行了,并观察到一些显著的两两相关(图。2).Leaf4.pc1与Leaf7.PC1显着相关,其中表示叶片尺寸。Leaf4.pc2与Leaf7.pc2和Leaf7.pc3显着相关,其代表叶形。此外,叶片形状和尺寸显示出与花瓣的显着相关性。Petal.pc1与Leaf4.pc1和Leaf7.pc1显着相关,其显示叶子和花瓣之间的负尺寸相关性。此外,Leaf4.pc2和Leaf7.pc2都与petal.pc1显着呈正相关,并与petal.pc2负相关。叶子和花瓣谐振模型之间的相关性表明了遗传依赖性和进化相关控制叶和瓣腔体。此外,在寿命历史特征和叶子和花瓣谐振模型之间进行成对相关性分析(图。2).Leaf4。P.C1 was correlated with rosette leaf number and stem height; additionally, Leaf4.PC2 was highly correlated with branch number and pod number; Leaf7.PC1 was correlated with days to bolting, days to flower and stem height; Leaf7.PC2 was highly positively correlated with days to bolting, days to flower, rosette leaf number, and branch number; Petal.PC1 was correlated with rosette leaf number and branch number; and Petal.PC2 was correlated with days to bolting and days to flower.
qtl解释了叶片和花瓣异速生长
为了研究MAGIC线中叶片和花瓣形状和大小变异的遗传基础,我们将每个叶片和花瓣作为一个数量性状,其变异频率呈正态分布(图1)。2,补充图3.)对于QTL映射。在魔法线的QTL映射中,使用了叶片和花瓣谐振模型的PC和19个创始人生态型中的1260个SNP标记。然后,我们计算了一系列与叶片和花瓣形状和尺寸的方差相关的QTL(图。5.,补充表2补充数据4.那5.和6.).在叶片模型中,对Leaf4进行QTL分析。P.C1 identified four QTLs located on chromosomes 1 and 3 and one QTL located on chromosome 2 for Leaf4.PC2. For Leaf7.PC1, five QTLs were observed on chromosome 3, one QTL was located on chromosome 2 for Leaf7.PC2, and four QTLs were located on chromosomes 1 and 2 for Leaf7.PC3. In the petal model, three QTLs were identified on chromosomes 1 and 4 in Petal.PC1, and nine QTLs were identified on chromosomes 1, 2, 3, and 5 in Petal.PC2.
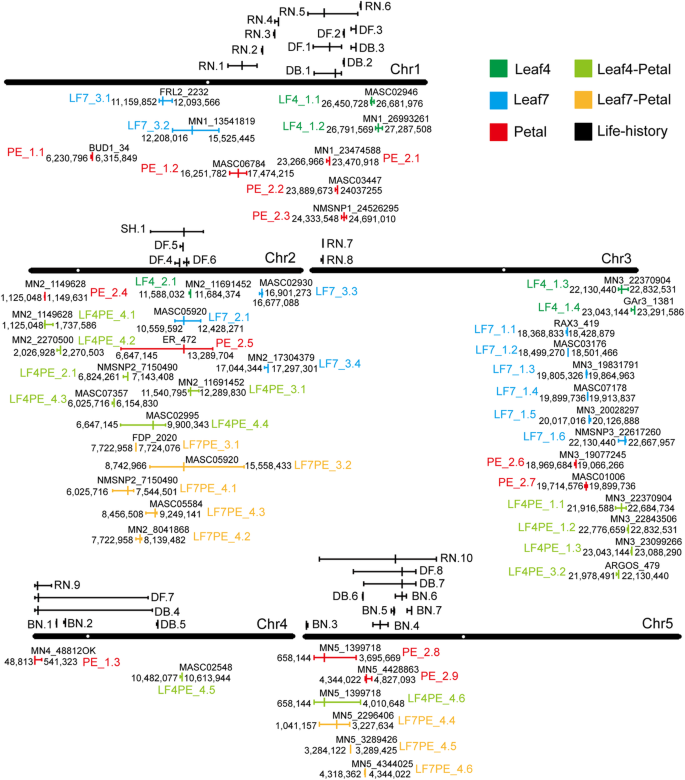
结果表明,叶片和花瓣异速生长模型中存在一定的QTL重叠。叶片PC2的qtl为Leaf4。PC2: LF4_2.1 Leaf7。P.C2: LF7_2.1) and petal (Petal.PC2: PE_2.5) on chromosome 2 (~ 11 Mb) overlapped, and the alleles from thel-0加入形成了最宽的形状最圆形的叶子和花瓣(补充表3.).该QTL可能来自于erecta.,这是已知的影响果实长度,是由于来自勒-0加入[18.].除叶片和花瓣形状的ER位点外,其余qtl为LF7_1.1、LF7_1.2、LF7_1.3、LF7_1.4和LF7_1.5。3号染色体上的PC1与petals . pc2的QTL PE_2.6重叠。此外,花瓣QTL LF7_1.3、LF7_1.4和LF7_1.5也与PE_2.7重叠。而这些qtl均表现出不相关的等位效应分布(补充表)3.).对于第4和第7个叶片,除了重叠的ER位点(Leaf4。PC2: LF4_2.1 Leaf7。P.C2: LF7_2.1) for PC2 described above, the QTLs LF4_1.3 and LF4_1.4 for Leaf4.PC1 overlapped with QTL LF7_1.6 for Leaf7.PC1 on chromosome 3 and showed the same allelic effects distribution with a maximum value in theMt-0加入和最低值可加入(补充表3.).这些重叠qtl可能解释了叶片和花瓣异速生长的表型相关,并表明了叶片和花瓣异速生长在进化过程中的相关遗传模块。
叶子和瓣叶片候选基因
解释叶片和花瓣异速生长的自然变异的基因在很大程度上仍然是未知的。为了鉴定可能的候选基因,我们根据这些加入等位基因间的PC分布,寻找含有独特的非同义snp的基因(补充表3.).基于19个父母的重构和成果加入[23.[我们发现候选基因具有独特的等位基因,提及95%置信区中的最大效应加入(补充表4.).在Leaf4异速生长模型中,生长素受体TIR1,油菜素内酯信号调节器BSL3,TIR1,有助于抑制开花时间,在编码序列上具有独特的等位基因变异。在Leaf7异速生长模型中,激素相关基因如Sua.(抑制abi3-5)那阿戈斯,丝氨酸/ threonine-protein激酶PID2.那BRI1抑制器1(BSU1) - 纯3,ABI4型基因,在编码序列中有等位变异。此外,还有花时间调节器ELF3和ELF4,受体激酶erecta.细胞壁修饰相关基因和一些转录因子赋予了独特的等位变异以获得最大的增益。
在花瓣异速生长模型中,发现了23个基因的变异。在这些基因中,PTL在花瓣。P.C2 encodes a trihelix transcription factor whose expression is limited to the margins of floral and vegetative organs. It is involved in limiting lateral growth of organs, and recessive mutations have been found to be defective in organ initiation and orientation in the second whorl [24.].的OFP13在花瓣。P.C2 encodes a member of the plant-specific OVATE family of proteins. Members of this family have been shown to bind to KNOX and BELL-like TALE class homeodomain proteins and function as transcriptional repressors that suppress cell elongation [25.].的SEU在Petal.pc1编码转录核心调节器,其与Leunig坐标,通过控制花瓣内的刀片细胞数和血管系统开发来调节花瓣形状[26.].其他基因,包括细胞周细胞相关蛋白质细胞周期蛋白A1; 1,蛋白激酶,CYP家族蛋白质,光周期相关的ELF6和与非同义SNP的转录相关基因也有助于花瓣PC。所识别的QTL和候选基因为我们提供了有价值的参考,用于深入了解叶子和瓣腔体。
异速生长模型叶片和花瓣共变异的遗传基础
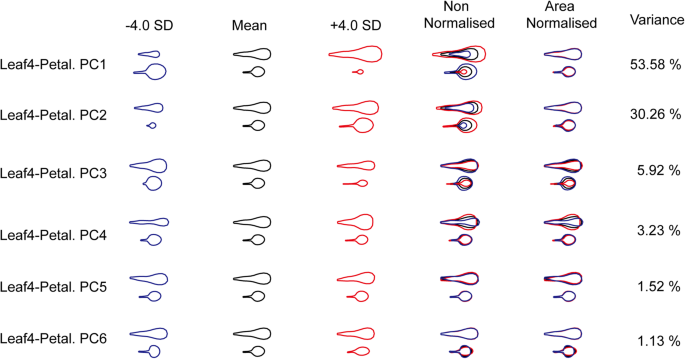
为了检查叶子和花瓣之间的形状和尺寸协变的遗传基础,将上述叶片和花瓣建模数据组组合以创建Leaf4-Petal和Leaf7-Petal数据集,允许识别整体趋势。为了确保来自不同器官的数据等加权,常数因子乘以所有植物的器官尺寸,以便以前的研究[1].通过PCA分析与Leaf4-Petap和Leaf7-Petap数据集进行了主要相关变化。
在leaf -花瓣模型中,PC1占总方差的53.58%,代表了leaf - 4和花瓣之间的负尺寸协方差。PC1值越高,花瓣大小越大,第四叶大小越小。PC2占总方差的30.26%,说明第4叶与花瓣之间存在正的大小协变。PC2值越高,花瓣和叶片的大小越大。PC3占总方差的5.92%,表现出第四叶与花瓣的形状(主要是宽度)正协变。PC3值越高,叶片和花瓣越圆,叶柄越短。PC4占总方差的3.23%,表现出第四叶与花瓣的形状(主要是宽度)负协变。值越高,叶片越窄,叶柄越长,花瓣越圆。其他的pc只代表一个器官形状或大小的差异,所以不考虑进一步分析(图。3.).
在QTL映射到Leaf4-Path Model的魔法线之后,对于PC1的三个重要QTL,对于PC2,一个重要的QTL,对于PC3的两个重要QTL和用于PC4的六个重要QTL(图。5.,补充表5.,补充图7.).在每个QTL中,鉴定出了在95%置信度区域内具有最大效应加入的非同义snp的候选基因(Supplementary Tables)6.和7.). 在PC1中,有5个基因具有独特的最大效应等位基因,包括细胞增殖相关基因,如阿戈斯那LOM2,EXPB5型.在代表形状(主要是宽度)共变异的PC3中,鉴定出4个基因:阿戈斯那FRS3.那BSL3,伸展蛋白proline-rich1.在PC4中,代表负形状(主要宽度)协变量,还有四种基因含有独特的入学等位基因。在这些基因中,CYCD2; 1基因作用于细胞周期的G1期,控制芽和根分生组织中的细胞分裂率,具有一种独特的等位基因Hi-0加入,PRX53影响细胞伸长的基因有一个独特的等位基因PO-0.加入。
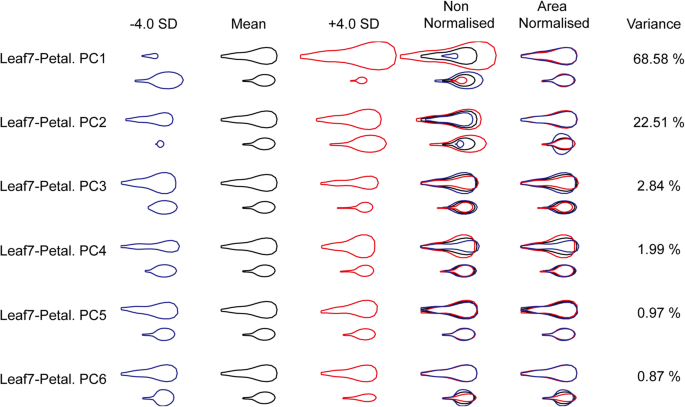
与leaf 4-花瓣模型相似,在leaf 7-花瓣模型中,PC1对总方差的贡献率为68.58%,代表第7片叶子和花瓣之间的尺寸负协方差,而PC2对总方差的贡献率为22.51%。代表了第7片叶子和花瓣的大小正协方差和第7片叶子形状的方差。PC3占总方差的2.84%,代表正形状(主要是宽度)共变异,PC4占总方差的1.99%,代表负形状(主要是宽度)共变异。其他的pc只代表一个器官形状或大小的差异,所以不考虑进一步分析(图。4.).
在叶片7-花瓣模型的MAGIC株系中鉴定出2个对PC3有显著影响的QTL和6个对PC4有显著影响的QTL,而在PC1和PC2中未鉴定出显著影响的QTL。5.,补充表5.,补充图8.).此外,还鉴定了候选基因(补充表格6.和7.).PC3中QTL LF7PE_3.2的叶片和花瓣的形状(主要是宽度)呈正协变,叶片和花瓣最圆勒-0最窄的叶子和花瓣没有0加入。在95%的置信区中,有34个基因赋予了独特的等位基因勒-0或没有0加入。在这些基因中,GRF基因AT2G22840, pentatricoptide repeat protein SLOW GROWTH1 (SLO1), ORGAN BOUNDARY1 (OBO1)和卵形蛋白OFP16家族已被报道影响器官的形状或大小[25.那27.那28.那29.].此外,周期素依赖的激酶抑制剂KRP4 [30.]和丝氨酸/苏氨酸蛋白激酶PINOID (PID)参与了生长素信号转导的调节[31].生长调节因子3(GRF3),调节叶片和子叶组织中的细胞膨胀[28.],以及其他与细胞分化、细胞扩张、细胞壁修饰和花时间控制相关的基因,也被鉴定出来。PC4的QTL LF7PE_4.4叶片最窄,叶柄最长,花瓣最圆,主要表现为负形(宽度)协变PO-0.加入。有三个基因具有独特的等位基因PO-0.加入,包括二甲醚,一种参与基因印迹的转录激活因子;过氧化物酶2,影响细胞伸长率[32];和CYP712A2,CYP712A的成员。
MAGIC株系中叶4、叶7、花瓣、叶4-花瓣、叶7-花瓣和生活史性状变异qtl的染色体定位鉴定出的qtl的染色体位置显示在5个位点上拟南芥染色体。每个QTL用一条线段表示,线段的长度表示95%置信区域,SNP峰值在QTL区域以一条长长的垂直线表示。不同性状的qtl呈现不同颜色:Leaf4异速生长qtl呈现深绿色,命名为LF4 (LF4_1, Leaf4. pc1;LF4_2 Leaf4.PC2);Leaf7异速生长的qtl为蓝色,命名为LF7 (LF7_1, Leaf7. pc1;LF7_2 Leaf7.PC2;LF7_3 Leaf7.PC3);花瓣异速生长的qtl为红色,命名为PE (PE_1, petals . pc1;PE_2 Petal.PC2);叶片-花瓣形状和大小共变异的qtl以浅绿色表示,命名为L4PE (L4PE_1, leaf4 -花瓣. pc1; L4PE_2, Leaf4-Petal.PC2; L4PE_3, Leaf4-Petal.PC3; L4PE_4, Leaf4-Petal.PC4); the QTLs for Leaf7-Petal shape and size covariation are shown in orange and named L7PE (L7PE_3, Leaf7-Petal.PC3; L7PE_4, Leaf7-Petal.PC4); the QTLs for life-history traits are all shown in the dark (BN, branch number; DB, days to bolting; DF, days to flower; RN, rosette leaf number; SH, stem height)
讨论
在这项研究中,我们定义了遗传控制的同种空间,该空间捕获了诸如魔法线之间的叶子和花瓣形状和大小的大部分变化。在识别的基因座中,除了ER轨迹之外,其他QTL与先前识别的形状和大小相关的基因座不相同。另外,在这些QTL置信区中,许多细胞增殖和细胞扩张相关基因根据加入分布分离出独特的等位基因。此外,我们检查了候选基因表达数据,并在19个创始人的魔法中进行了促进剂序列,并发现了两个候选基因,erecta.(AT2G26330),前4.(AT2G27040)在2号染色体上的ER基因座中,启动子序列有特异性变异,这是继代的最大效应所特有的。此外,特异性启动子序列变异也显著改变了表达水平(补充图11.).然而,需要更多的工作来测试这些位点,如通过构建一个NIL群体。
叶子和花瓣形状和尺寸变化的相互作用
有趣的是,当我们增强叶子和花瓣数据以研究叶子和花瓣的调节时,结果表明,叶子和花瓣大小的变化负相关性,提供了魔法线的各种变化的最大组分。3型QTL上的QTL用于Leaf4-Petal.pc1与Leaf4.pc1的QtLs重叠,叶片尺寸最小,最大的花瓣尺寸可入世等位基因。这表明该基因座对第四叶大小的正调控作用同时对花瓣大小的负调控作用。叶4-花瓣2号染色体上的QTLPC3与Leaf4重叠。PC2和花瓣。P.C2 with the widest leaf and petal in the勒-0变异等位基因,表明该基因座对叶宽和花瓣宽均有正向调控作用。叶4-花瓣2号染色体上的QTLPC4与花瓣的QTL一致。P.C2 with the same accession allelic effects distribution. Moreover, the QTL on chromosome 5 was identical to the QTL for Petal.PC2 with uncorrelated allelic effects distribution. In Leaf7-Petal.PC4, the QTL on chromosome 2 was identical to the QTL for Leaf7.PC2 and overlapped with the ER locus for Petal.PC2 with the maximum allelic effects in the勒-0加入。在5号染色体上,Leaf7-Petal.PC4的两个QTL与Petal.PC2的QTL重叠,重叠的QTL LF7PE×u4.6和PE×u2.9均达到最小值Ws-2加入。这些qtl除与叶片或花瓣异速生长存在重叠外,其他qtl不存在重叠,可能是叶片和花瓣共变异的独立位点。
叶瓣异速生长与局部适应相协调
此外,还测定了抽薹天数、开花天数、莲座叶数、分枝数和茎高等生活史性状。由于发现了许多显著的表型相关(图。2),存在可用于解释遗传相关性的重叠qtl。对这些生活史性状进行QTL定位。5.补充表8.和9.,补充图9.),比较了生活史性状和叶瓣异速生长模型的qtl(补充图)10.).在LEAF4.PC1中,QTL LF4_1.1与一个连接的QTL,RN.6重叠,用于玫瑰花叶号,并显示出与最大值的相同的等位基因效应分布PO-0.加入。在Leaf7。P.C2, QTL LF7_2.1 on chromosome 2 (~ 11.2 Mb) overlapped with three linked QTLs (DF.4, DF.5, and DF.6) for days to flower, with the highest value found in theBur-0入世等位基因。在花瓣。P.C1, two QTLs, PE_1.2 on chromosome 1 (~ 16.9 Mb) and PE_1.3 on chromosome 4 (~ 0.05 Mb), overlapped with the QTLs RN.1 and RN.9 separately for rosette leaf number with uncorrelated allelic effects distribution. In Petal.PC2, there were four QTLs overlapping with the QTLs for days to bolting. Among these QTLs, the QTLs PE_2.2 and PE_2.3 on chromosome 1 overlapped with QTL DB.1, with the maximum value in thePO-0.入世等位基因。此外,第5染色体上的PE_2.9与DB.6重叠,在第5染色体上达到最大值可入世等位基因。其他人表现出不相关的等位基因效应分布。还有四个用于花瓣的QTLS .PC2与QTLS与花的数日重叠,并且所有都显示出不相关的等位基因效应分布。具有寿命历史特征的叶子和花瓣的重叠QTL提供了相关分析的遗传基础。这种分层化可能是由肺炎或紧密联系的因果基因导致的,这表明所有特征之间的遗传整合。
结论
这是首次利用MAGIC线研究叶片和花瓣异速生长变异及其互作的遗传基础。MAGIC株系的主成分分析表明,叶片大小是异速生长变异的主要成分,叶片和花瓣大小的变化呈负相关。本研究共鉴定了4片叶的5个qtl, 7片叶的11个qtl,花瓣大小和形状的12个qtl。除了内质网位点外,这些qtl与之前发现的qtl不完全相同。这说明异速生长变异不是简单的器官宽度、长度和大小的组合。通过对叶片花瓣整合模型的QTL分析,鉴定出12个与第4个叶片和花瓣异速生长共变异相关的QTL, 8个与第7个叶片和花瓣异速生长共变异相关的QTL。QTL重叠解释了不同叶片和同源器官叶片和花瓣之间的异速生长相关。然而,Leaf4和Leaf7之间的一些特异qtl可能解释了叶片异速生长的差异,可能与叶片发育限制有关。此外,生活史性状与叶片和花瓣异速生长的相关性和QTL重叠暗示了器官异速生长与局部适应的遗传整合和互作。
方法
植物材料及生长条件
527名RILs的庞大人群[14.]毕业于英国牛津大学,后在中国山东师范大学传播。种子在75%乙醇中消毒10分钟,在95%乙醇中洗涤4 ~ 6次,然后在0.1%琼脂中悬浮。所有品系分别在1/2 Murashige和Skoog培养基中生长。随后,种子在植物培养箱(Percival Scientific, Inc)中生长:22°C/18°C(昼/夜)和16 h/8 h(昼/夜),在4°C的黑暗中处理4天后进行分层。在培养基中生长7天后,当可以看到真正的叶子时,把幼苗移植到土壤中。对于每一行,我们种植了8棵幼苗,每个花盆中有4棵幼苗,它们被随机分配到一个托盘中。这些托盘每周都在培养箱中旋转。
叶子和瓣收集
当植物的第一朵花开放后,将每棵植物的第4片和第7片叶子摘下来,压平,然后粘在纸上扫描记录叶子的形状。共从232个株系中获得第4片叶,从215个株系中获得第7片叶(补充表)1).由于叶片在生长过程中更容易受到环境的影响,我们计算了同一直线上所有获得的叶片和保留的叶片的平均面积,其差异范围为+/−20%,以便进一步分析。为了测量花瓣的形状和大小,我们在花瓣完全反折的第13阶段(花蕾完全开放,花瓣可见,开花期),用立体显微镜摘取并解剖了花蕾。将所有四个花瓣、四个萼片、六个雄蕊和一个雌蕊取出,放在1%琼脂上,用徕卡相机拍照。只使用主茎上芽位4和芽位10之间的芽。每株植物解剖2朵花,我们收集到的每一株至少有4株。由于在目前的种植条件下,部分品系开花效果不佳,我们最终从345品系中获得了花瓣,用于模型构建(补充表)1).
叶子和花瓣的造型
在制作完第四片和第七片叶子以及花瓣的所有线条的图像后,使用Photoshop CS5软件(Adobe Inc.)将数字图像正确定位(顶端始终指向右边,水平度良好)。在那之后,我们使用MATLAB R2007b软件(MathWorks Inc.)和AAM工具箱(version 6.5) [10.]来分别构建每一片叶子和花瓣的模型[1].每个叶子和花瓣的轮廓由其25分的笛卡尔坐标表示,其使用叶(Le)和花瓣(PE)模板围绕叶子和花瓣轮廓。绘制了这些点以显示数据集中的各种点,并且在整个数据集上使用PCA以确定变化的趋势。
统计分析
广义遗传(H2)对每个性状进行了估计,如Gnan等[33],表示各株系间的方差(每株系约有8株)与总方差的比值。用PASW Statistics 18软件(SPSS Inc.)测量的性状之间的线平均值计算成对Pearson相关性。然后使用R软件包HAPPY进行QTL分析[14.为Leaf4 PCs, Leaf7 PCs,花瓣pc, Leaf4-花瓣pc的论点,Leaf7-花瓣pc的论点,和生活史特征。2个距离小于1mb的qtl被认为是反映遗传多效性的重叠qtl [33].
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文及其附加文件中。本研究所用的原始数据和补充资料见Figshare (https://figshare.com/s/90c637df9f8965f346c8).用于PCA的数据集1包含魔法线的每个工厂的所有裁剪图像和点模型。每个PC和魔法线中每个工厂的生命历史特征的值都列在DataSet 2.数据集3中是种植ID和魔法线ID之间的对应记录。文件1包含魔法线中QTL映射的R源代码文件。
缩写
- 魔法:
-
多亲本先进代杂交
- 主成分分析:
-
主要成分分析
- 电脑:
-
主成分
- QTL:
-
数量性状位点
参考
- 1。
关键词:异速生长,异速生长,进化Antirrhinum..植物细胞。2009;21(10):2999 - 3007。
- 2。
尺寸、形状和形式:几何形态测量中的异速测量概念。基因进化研究。2016;226(3):113-37。
- 3.
Langlade NB,Feng X,Dransfield T,Copsey L,Hanna Ai,ThébaudC,Bangham A,Hudson A,Coen E.通过转基地控制的谐波空间进化。Proc Natl Acad SCI U S A. 2005; 102(29):10221-6。
- 4.
Anastasiou E,Lenhard M.成长为一个人的标准。CurrOp植物BIOL。2007; 10(1):63-9。
- 5.
植物器官大小的控制。咕咕叫医学杂志。2012;22(9):360 - 7。
- 6.
植物侧器官生长与细胞数量的关系。植物生物学杂志。2014;17:36-42。
- 7.
Galen C.太阳能熔炉或沼泽冷却器:通过高山雪毛茛的太阳能跟踪花卉的成本和益处,毛茛属ardoneus..oecologia。2006; 148(2):195-201。
- 8.
McDonald PG、Fonseca CR、Overton JM、Westoby M。叶片大小沿降雨和土壤养分梯度的差异:大小减少的方法在枝类中是常见的吗?功能经济学。2003;17(1):50–7.
- 9.
Smith J、Burian R、Kauffman S、Alberch P、Campbell J、Goodwin B、Lande R、Raup D、Wolpert L。发展制约与演化:一个山湖的视角。生物评论。2014;60(3):265–87.
- 10.
Bensmihen S、Hanna AI、Langlade NB、Micol JL、Bangham A、Coen ES。叶片形状和大小的变异空间。HFSP J。2008;2(2):110–20.
- 11.
Costa MM、Yang S、Critchley J、Feng X、Wilson Y、Langlade N、Copsey L、Hudson A。水稻异胚性自然变异的遗传基础Antirrhinum..新植物。2012; 196(4):1251-9。
- 12.
形态计量学、数学建模、发育和进化生物学的整合。基因进化研究。2016;226(3):109-12。
- 13。
Alonso-Blanco C, Koornneef M.在拟南芥:植物遗传学的欠缺资源。趋势植物SCI。2000; 5(1):22-9。
- 14.
关键词:多亲本,多亲本,数量性状,精细定位拟南芥.公共科学图书馆麝猫。2009;5 (7):e1000551。
- 15.
自然变异拟南芥:从分子遗传学到生态基因组学。植物杂志。2012;158(1):2-22。
- 16.
Pérez-Pérez JM, Serrano-Cartagena J, Micol JL。建筑中自然变异的遗传分析拟南芥植物叶。遗传学。2002; 162(2):893-915。
- 17.
Juenger T,Perez-Perez JM,Bernal S,MICOL JL。花卉和叶片形态特征的定量特质基因座映射拟南芥:模块化基因结构的证据。另一个星球Dev。2005;7(3):259 - 71。
- 18.
Abraham MC, Metheetrairut C,爱尔兰VF。自然变异识别控制花瓣形状和大小的多个位点拟南芥.《公共科学图书馆•综合》。2013;8 (2):e56743。
- 19.
切斯尼克H,伦哈德M.植物的大小控制——来自叶子和花的经验。冷泉Harb展望生物杂志。2015;7(8):a019190。
- 20.
Maugarny-CalèsA,Laufs P.叶片成形:分子,细胞,环境和进化视图。发展。2018; 145(13):DEV161646。
- 21.
Moyroud E, Glover BJ。不同植物形态的进化。咕咕叫医学杂志。2017;27 (17):R941-51。
- 22.
Klingenberg CP。几何形状的定量遗传学:遗传学与单变量方法的缺陷。进化。2003; 57(1):191-5。
- 23。
Gan X, Stegle O,贝洱J,史蒂芬詹,Drewe P,希尔德布兰德KL, Lyngsoe R, Schultheiss SJ,奥斯本EJ, Sreedharan VT,卡尔,Bohnert R,琼G,德文特河P,凯西P Belfield EJ, Harberd NP,刻满E, Toomajian C, Kover PX,克拉克RM, Ratsch G,莫特R .多个参考基因组和转录组拟南芥. 自然。2011;477(7365):419–23.
- 24。
Kaplan-Levy RN,Quon T,O'Brien M,Sappl PG,Smyth博士。花瓣损失蛋白的功能域,一种抑制细胞区域生长的三螺旋转录因子拟南芥.植物j . 2014; 79(3): 477 - 91。
- 25。
王某,张y,guo j,zeng q,ellis是,陈杰。拟南芥卵巢家族蛋白质,一种新型转录压缩机家族,控制植物生长和发育的多个方面。Plos一个。2011; 6(8):E23896。
- 26.
刘卓,刘志明。SEUSS和LEUNIG调控细胞增殖、血管发育和器官极性拟南芥花瓣。足底。2006;224(4):801 - 11所示。
- 27.
Cho E, Zambryski PC。器官边界1定义了一个表达于茎尖分生组织和侧部器官交界处的基因。美国国家科学研究院学报2011;108(5):2154-9。
- 28.
转录因子AtGRF家族参与了植物叶和子叶的生长拟南芥.工厂J. 2003; 36(1):94-104。
- 29.
PPR的sl1蛋白需要在多个位点进行RNA编辑,且上游序列相似拟南芥线粒体。植物j . 2010; 63(3): 499 - 511。
- 30.
schessl K, Muiño JM, Sablowski R。拟南芥JAGGED通过抑制kipi相关的细胞周期抑制剂连接花器官模式到组织生长。国家自然科学基金资助项目:国家自然科学基金资助项目;
- 31.
通过过度表达PINOID激酶来改变植物生长素稳态和信号转导,导致叶片生长缺陷拟南芥.植物科学与技术,2017;
- 32.
金俊,胡伟子T,鲍文杰。拟南芥过氧化物酶ATPRX53影响细胞伸长和易感性对Heterodera Schachtii。植物信号表现。2011; 6(11):1778-86。
- 33.
gan S, Priest A, Kover PX。种子大小和数量自然变异的遗传基础及其权衡利用拟南芥神奇的线。遗传学。2014;198(4):1751 - 8。
确认
非常感谢John Innes中心的Enrico Coen教授为527 MAGIC系列提供种子。
资金
这项工作得到中国国家自然科学基金(31470286和31801387号)的资助。资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写方面没有发挥任何作用。
作者信息
从属关系
贡献
SXY和XZF构建了该项目并设计了这项工作。XL,CXW和QS执行了实验,并且YHZ和XL分析了数据。SXY和XZF写了稿件。所有作者阅读并认可的终稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
PCA应用于Leaf4,Leaf7和Petal数据集,以确定魔法线之间的形状和大小变化的趋势。叶子的轮廓由其25分的笛卡尔坐标表示,同样,花瓣以同样的方式表示25分。GIF显示了以标准偏差表达的每个PC的数据集,从叶子和花瓣集合中的点的平均位置表示。图S2。为叶子和花瓣同种异体模型获得的PC值范围。每个魔法线的平均值由蓝色钻石表示,并且杆显示该线路观察到的所有值的范围。PC单位是标准偏差。图S3。在魔法线内,叶子4,叶子7和花瓣的变异沿着每个PC。每个直方图都代表了从叶子和花瓣异速生长模型中沿着其中一个pc的MAGIC线的分布。图S4。MAGIC株系第4叶异速生长性状的QTL扫描。图S5。魔系间第七叶异速生长PCAs的QTL扫描。图S6。MAGIC株系花瓣异速生长性状的QTL扫描。图S7。MAGIC株系四叶和花瓣异速生长共变异的QTL扫描。图S8。QTL扫描PCA的第七片叶和瓣膜各自变焦的魔法线。图S9。QTL扫描魔法线之间的生命历史特征。图S10。生活史性状与异速生长模型的遗传相关性。垂直线表示qtl与1mb内的SNP峰重叠。具有相同变异等位基因的不同qtl具有最大效应,如图红色所示。图S11。启动子序列比对及候选基因表达分析。候选基因erecta.(AT2G26330),得到最小的Leaf7。PC2的值Bur-0增加,有特定的变化Bur-0在启动子序列中表达量最低Bur-0.第二个候选基因前4.(AT2G27040)的lf7_1 .1、PE_2.5和LF7PE_3.2基因座在启动子上有特异的变异勒-0加入,最大叶7。PC2,花瓣。P.C2 value and minimum Leaf7-Petal.PC3 value and obtained the highest expression level in勒-0.
附加文件2:表S1。
所有性状的表型数据用于QTL分析。
附加文件3:表S2。
叶片和花瓣异速生长模型检测到显著的QTL。
附加文件4:表S3。
在叶片和花瓣异速生长模型中,19个亲本等位基因的估计值均检测到了QTL。
附加文件5:表S4。
候选基因占叶子和瓣腔体的变异。
附加文件6:表S5。
叶片和花瓣异速生长共变异的QTL检测结果显著。
附加文件7:表S6。
每个亲本19个等位基因的估计值均检测到叶片和花瓣异速生长共变异的QTL。
附加文件8:表S7。
候选基因解释了叶片和花瓣异速生长共变异。
附加文件9:表S8。
MAGIC株系生活史性状的QTL达到显著水平。
附加文件10:表S9。
每个亲本的19个等位基因的估计值检测到生活史性状的QTL。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
李,X.,张,Y.,杨,S。et al。叶片和瓣叶片等因素的遗传控制拟南芥.BMC植物杂志20.547(2020)。https://doi.org/10.1186/s12870-020-02758-w
收到了:
公认:
发表:
关键字
- 拟南芥
- 叶子和花瓣
- 各种变化
- QTL定位
- 多亲本先进代交错系