摘要
背景
长期的机械应力(MS)导致抗硫胺,一种与抗病抗性增加相关的应激适应响应。难以清楚的是1)预见到短时间内的植物在短时间内的重复性MS可以在随后与虚张症病原体攻击后的防御反应,2)MS通过Jasmonic酸(JA)信号传导的植物免疫,3)短时间的重复性MS可以引起长期的-Term改变类似于应激诱导的记忆的基因表达。要解决这些要点,10天大的少年拟南芥使用软刷机械压力7天,随后用坏养殖病原体攻击,链格孢属brassicicola,和灰葡萄孢.在这里,我们评估了MS如何受到影响的结构细胞壁环容,疾病症状和改变的基因表达响应于感染。
结果
与未受质谱胁迫的植株相比,质谱处理的植株表现出更强的细胞壁贴壁和茉莉酸(JA)积累,这与疾病进展的减少有关。侵染后4天,ms处理的植株中涉及JA信号转导、胼胝质沉积、过氧化物酶、植物抗毒素生物合成和活性氧解毒的基因表达被过度诱导。JA不敏感介导的JA信号功能丧失冠状腺素不敏感1(coi1)突变体损害防御基因表达的超诱导和促进MS处理的植物中的病原体增殖受感染。基础表达水平病因相关基因1和植物防御素1.2MS结束后5天,莲藕叶中防御标记基因呈构成性上调,MS结束后naïve茎生叶与花序分生组织分化良好。
结论
本研究揭示了青少年的暴露拟南芥短时间的MS可改变植物的基因表达和通过ja介导的坏死病原菌攻击后的主要抗性COI1信号通路。MS可能促进应激诱导记忆,以调节植物对未来应激遭遇的反应。这些数据推进了我们对MS如何启动植物对坏死性病原体的免疫以及如何在可持续农业实践中利用的理解。
背景
中国和日本的农民在作物幼苗上施加的机械应力已经被利用了几个世纪mugifumi使作物硬化以抵御生物和非生物胁迫[1].由风或触觉引起的MS延长可以通过增强弹性和抗弯刚度来改变植物的细胞壁,最终导致植株体型变矮,叶片变小,抗拉强度增加;这种适应反应被称为触觉形态发生[2,3.].ms诱导的木质素、纤维素、苯丙氨酸解氨酶、过氧化物酶的延长,以及细胞内空间的减少,使病原体更难侵入植物细胞[4,5,6,7,8].从外源喷水到的单一事件拟南芥据报道,在人工介质中生长的幼苗或来自土壤生长植物的叶片弯曲,分别引起大规模的差异基因表达10%和2.5%拟南芥组织(9,10].MS-响应基因的大部分涉及细胞壁修饰,激素调节,细胞器和钙信号传导,其共同介导植物中的应力适应响应[9,10,11,12].在没有多发性硬化症的情况下,大多数多发性硬化症应答转录本的表达回到了他们的基础表达水平。然而,一些基因如触摸转录物(TCH3.和TCH4.)参与钙信号和细胞壁修饰的细胞仍然对MS敏感,而其他细胞对随后的刺激变得不敏感[11,12].响应于单一刺激MS的基因表达的快速变化可以提供对长时间MS的敏感性降低,并保护植物免受风或触摸引起的重复响应的响应。植物对重复的MS的脱敏可能代表“一个记忆”,使他们能够应对MS的持续事件[13,14,15].
植物免疫涉及植物激素的生物合成和信号转导,特别是茉莉酸与植物抵抗坏死性感染广泛相关。天真的拟南芥在没有明显的组织损伤的情况下,受温和叶摩擦的瞬态40s的植物显示出增强的抗性葡萄孢属cinereal,尽管这与JA的生物合成或信号传导无关[8].相比之长,MS(14天的触摸)可以增强JA积累以诱导抗硫胺发生,并促进抗抗性B灰霉菌在拟南芥[16].外源性喷水也会暂时性引起持续数小时的茉莉酸反应[9),拟南芥JA生物合成和信号转导受损的突变体(氧化丙二烯合酶, 和myc2 myc3 myc4型显示三重突变体,以防止抗硫胺和/或表达一些MS诱导基因,因此,在MS诱导的响应中暗示JA [9,16].茉莉酸(jasmonate - zimi - domain, JAZ)抑制因子与F-box蛋白COI1 (CORONATINE INSENSITIVE1)相互作用,这是SCF (Skp-Cullin-F-box) E3泛素连接酶复合体的一部分,参与茉莉酸- l-异氨酸(JA- ile)/ CORONATINE (COR)的直接相互作用[17]. 在应激反应中,COI1-JAZ共受体复合物导致JAZ抑制物的蛋白酶体依赖性降解和影响JA依赖性过程的MYC转录因子的释放。基因突变导致的功能丧失COI1消除了伤口和己酸酯诱导的植物防御的转录调节所需的蛋白质复合物和JA反应[18].涉及其他激素(如赤霉素)的其他信号通路也有助于ms诱导的植物的触觉形态建成和逆境适应[19,20.].目前尚不清楚的是,MS的短重复周期是否会导致JA反应[9通过JA依赖或JA-Industy的过程,可以引发防止病症病原体感染的防御。
植物长期的胁迫,包括盐胁迫、极端温度和病原菌侵染等,可以诱导一种由表观遗传过程介导的记忆,从而增强植物对未来胁迫的适应反应[21].报告表明ms诱导的反应拟南芥涉及表观遗传修饰,例如组蛋白甲基化[22,23].然而,作为植物遇到的第一个胁迫的MS应用是否能诱导应激记忆或启动植物对后续胁迫(病原体或非生物胁迫)的反应尚不清楚。启动被定义为植物对胁迫的敏感性和反应性的增强,这是由于先前的经验导致的,从而增加了对生物和/或非生物胁迫的抗性或耐受性[24].启动为植物提供了一个有利的优势,使其能够更快地做出反应,并减轻随后的压力。启动阶段发生在生理、转录、蛋白质组学、代谢和表观遗传水平上,作为一个预警信号,可以引发更强烈的反应,这种反应可以持续整个植物生命周期,在某些情况下还可以遗传给后代[24,25,26].
MS对植物防御的影响大多是利用MS来评价的B灰霉菌作为模型病原体,通过组织化学或表型研究。然而,MS诱导的植物免疫的分子机制,以及MS可以粉碎防御反应,仍然不清楚。在这里,我们调查了10天大的少年拟南芥经MS处理7天的幼苗可获得较好的防御能力A.芸薹属感染。属链格孢属引起黑斑病的重要真菌病原体在哪里芸苔属植物导致全球产量损失超过15%[27].感染alternaria brassicicola.其特征是深褐色病变和叶片坏死病变周围的淡黄色晕[28].A.芸薹属是一种坏死性病原体,主要需要茉莉酸介导的防御,并以死亡的植物组织为食以增殖[29,30.].
我们假设短时间的重复MS可以通过改变植物激素的积累、增强防御基因的表达和促进植物防御的细胞壁次生代谢产物来增强植物对刺激后数天的耐受性或抗性。在这里,我们表明,植物受到短时间的重复MS启动了防御反应A.芸薹属在WT中,而在ja不敏感突变体中没有coi1-16表明茉莉酸与ms诱导的免疫有关我们的研究表明,非化学策略如MS可以提高植物幼苗的防御能力,促进对坏死性病原体的抗性。
结果
短时间的MS诱导防御相关代谢产物
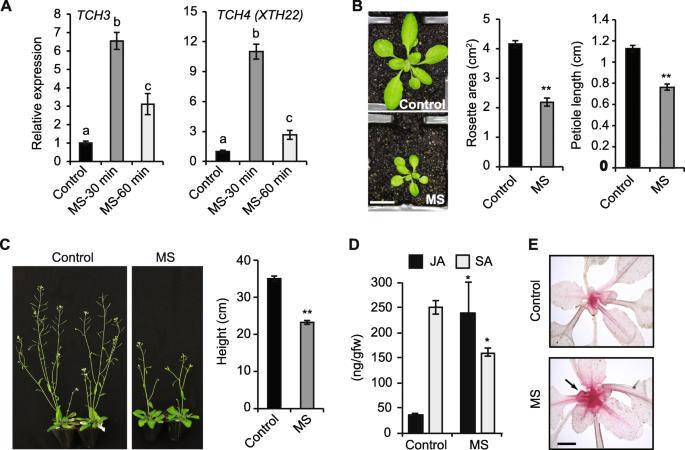
在这里,我们研究了如果7天的重复MS到野生型(WT)拟南芥幼苗可改变防御代谢物,诱导表皮形态建成。一次使用软刷(10秒,每天两次,间隔8小时)至10日龄幼龙的MS治疗拟南芥植物诱导高表达TCH3.和TCH4.(xth22.),它们分别参与钙信号传递和细胞壁修饰[31,32]. 基因表达持续了60分钟 最小值(高出3倍)或更长时间在30时达到最大峰值 MS后的最小值(6到10倍)(图。1一种)。与未经秘密(对照)植物相比,MS的7天MS导致整个植物生长显着降低,叶柄长度和玫瑰花杆菌区域的减少,相比(图。1B) 是的。有趣的是,尽管MS在花序茎出现之前就停止了,但MS使植株高度降低了35%(图。1C).因此,在没有持续刺激的情况下,7天的重复MS(这里称为短MS)对幼苗诱导了皮肤形态建成。
短时间MS对青少年的影响拟南芥幼苗.一个TCH.10 s后30 min和60 min内,相对mRNA表达量归一化β肌动蛋白作为管家基因(n = 3).B10日龄植株的叶柄长度和莲座叶面积经7天的重复MS处理(每天两次,10 s)。展示了一株17天生植株的代表性图像,并对打分的单个植株(n= 15植物)。Cms处理和对照植株的花茎高度和生殖结构。对10日龄的植株进行7天的MS处理,不作任何进一步的刺激,允许其开花。在主花螺栓的35天龄植株上进行表型测定。显示了一个代表性的图像,花茎高度定义了多个独立植物的平均值(n= 15)。D茉莉酸(JA)和水杨酸(SA)的含量在一个完整的莲座丛中进行了定量分析,这些莲座丛来自于幼龄植物,经过7天的MS处理。30天的收获叶片 最小后MS(n = 10 plants).E对照和7天MS植株的叶片用间苯三酚染色,以突出木质素的积累,呈红色(箭头所示)。误差线表示生物变异的标准误差。用字母表示的统计显著性(一个)用Bonferroni检验的方差分析(ANOVA)确定,并用星号表示(B.,C,D)与学生的T-Test确定(p< 0.05)。比例尺= B, 1厘米;C, 5厘米;E, 1厘米
利用超高效液相色谱-串联质谱(UHPLC-MS/MS)研究了质谱对茉莉酸(JA)和水杨酸(SA)在质谱和对照植物体内积累的影响。样品收集后,7天的质谱30分钟时,皮形态发生明显作为一个表型。与对照相比,MS显著上调了JA水平(约5倍),降低了SA水平(40%),揭示了JA和SA信号通路的拮抗作用(图1)。1D).质谱处理的植物和对照植物用间苯三酚染色,发现质谱处理的植物茎分生组织和中脉中木质素含量高(红色沉淀),这可能表明质谱处理的植物具有更高的抗拉强度(图。1这些数据表明,短时间的MS可以促进代谢产物的积累,而这些代谢产物介导了针形形态发生和病原体防御。
机械应力增强了抗alternaria brassicicola.
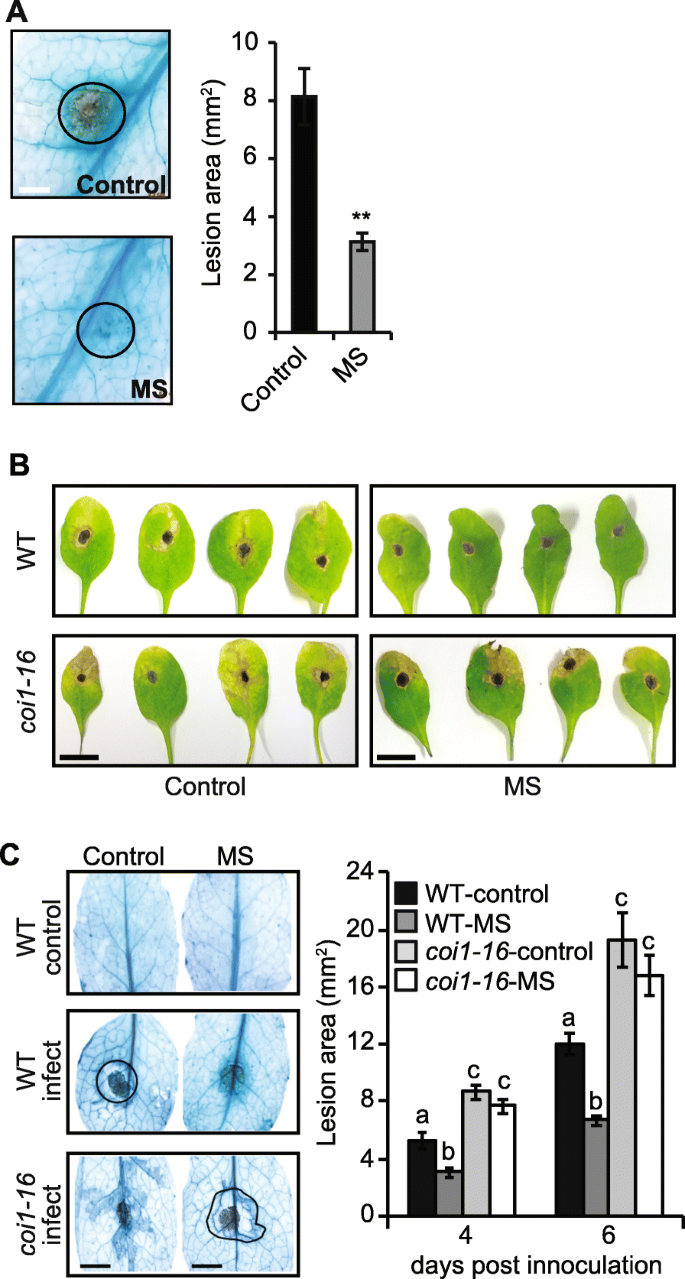
我们质疑如果7天的MS可以在随后的挑战时提升植物防御B灰霉菌或者alternaria brassicicola..ms处理植株(第5、6、7真叶)的叶片接种5 μlB灰霉菌孢子30 最后一次刺激后分钟。MS处理的植株叶片坏死面积减少(3 毫米2)与对照植株(8 mm . 6mm . 6mm . 6mm . 6mm . 6mm . 6mm . 6mm . 6mm . 6mm . 6mm . 6mm . 6mm . 6mm . 6mm . 6mm2)(图。2一种)。与上一份报告一致[16],我们表明,短短的7天的MS可以诱导抗性(病变面积减少62.5%;在接种后48小时)拟南芥对B灰霉菌感染。
MS植物的防御反应B灰霉菌和A.芸薹属感染。用3.5 × 10的5 μL接种17日龄植株第5 ~第7片真叶4孢子/ ml.−1病原体(n= 15植物).一个用乳酚-锥虫蓝染色对照和MS株48 hpi叶片的真菌菌丝,并用圆圈表示坏死病变。显示有代表性的染色图像及平均病灶面积(n= 15叶)。BMS野生型植物(WT)和JA突变体叶片的代表性图像coi1感染了A.芸薹属(5 dpi)。C坏死病灶用乳酚台潘蓝染色,病变面积(mm2),用圆形箭头表示,以提供病原菌增殖的定量测量(n= 15)。所有数据都代表了至少两个独立的实验。误差条表示生物变异的标准误差。用ANOVA和Bonferroni检验确定统计学意义(以字母表示)(P< 0.05)。比例尺= A, 0.2 cm B, 1 cm;C, 0.3厘米
接种五天后alternaria brassicicola.,对照植物显示出增强的叶片氯化(由于叶绿体降解导致的细胞变黄)和围绕初始接种位点的坏死病变的晕,揭示了不相容的相互作用[33].ms处理植株的莲丛叶没有明显的褪绿迹象,也没有明显的坏死晕。2B).用乳酚类锥虫蓝染色的叶片显示,在ms处理的叶片中,病原体被限制在最初的孢子接种部位(图。2C).在对照植株中,病原菌似乎降解了接种部位周围的组织(图。2B).接种4 d和6 d后,对照植株的病损面积显著增大(5.2 mm2和11.9毫米2),而ms处理植株(3.0 mm2和6.7毫米2)(图。2C)。因此,短期的MS可以增强防御alternaria brassicicola..
机械应力增强细胞壁化合物并启动植物防御
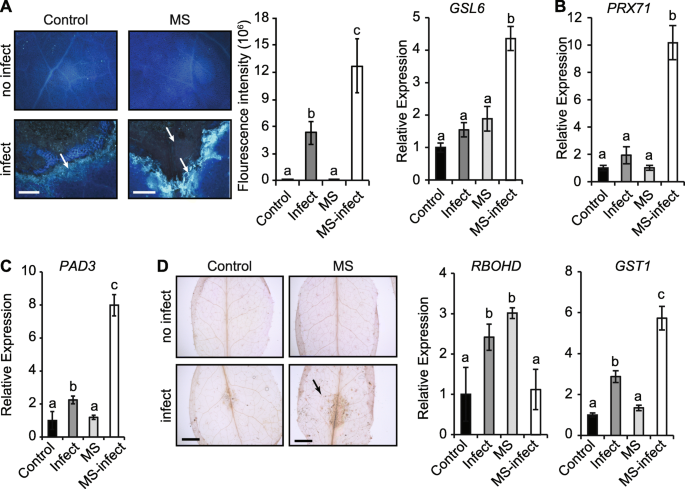
接下来,我们探讨了MS是否增强了细胞壁防御(胼ins,木质素,卡拉宾和ROS)来限制A.芸薹属增殖。与对照感染的叶片相比,在MS感染的叶片(> 2倍沉积)中,增强了一种形成乳头基的细胞壁加厚的(1,3)-β-葡聚糖聚合物的调节。胼舌沉积被限制在MS感染的叶片中的接种位点的边缘,而在对照感染的叶片中,在病原体迁移区域的接种位点外延伸(图。3.一种)。接种后五天,核糖相关标记基因的转录水平葡聚糖SYNTHASE-LIKE 6(GSL6公司)与对照感染的叶片相比,在MS感染中显着上调(3.5倍)(图。3.一种)。这过氧化物酶71.基因(PRX71),其编码的细胞壁结合过氧化物酶促进木质素化,与对照相比,在ms感染的叶片中显著上调(图。3.b)。与对照植物相比,这种与MS植物中的增强木质素相关(图。1e)。此外,转录水平植物抗毒素不足3(PAD3.)参与植物碱(Camalexin)生物合成,并防御A.芸薹属[34]与对照植株(2.2倍)相比,ms侵染植株显著增加(8倍)。3.C).木质素和胼胝质沉积的增加,以及与camalexin,木质素和胼胝质生物合成相关转录本的过度诱导表明,MS可以增强细胞壁防御,促进抗性A.芸薹属.
细胞壁位置的变化和生物合成基因表达的响应A.芸薹属感染。一个用苯胺蓝(3-DPI)染色来自对照,感染,MS处理和MS感染植物的叶子。呼出沉积荧光亮蓝色强度较高(由箭头表示)。在接种叶片中定量地确定的平均调用荧光强度。图像是几片叶子的表示(n= 15)。的相对基因表达GSL6公司量化了5 dpi。公元前相对表达PRX71和PAD3.参与合成木质素和植物抗毒素camalexin,分别为5 dpi。D对照和MS感染植株的叶片用3,3’-二氨基联苯胺染色(36 hpi),形成棕色沉淀,表明活性氧(ROS)积累。ROS标记基因的相对表达(GST1和rbohd.),测定为5 dpi。所有基因的表达量均归一化为β肌动蛋白管家基因(n = 4个生物代表),并代表至少两个独立实验。误差线显示标准误差。字母是统计差异使用方差分析和邦费罗尼检验(p< 0.05)。比例尺= A, 50 μm;C, 1厘米
MS增加ROS的产生作为应激的早期反应A.芸薹属叶片感染 - 接种后36小时; HPI)(图。3.D).接种5天后,ROS标记基因的表达呼吸爆发氧化酶同源物d(rbohd.;微调反应性氧中间体的空间控制和对细胞的过敏反应)[35[对照感染植物(2.5倍)显着上调。然而,rbohd.表达没有改变在ms感染的叶片类似对照水平的反应(1倍),尽管显著增加的基础表达水平rbohd.在ms植物中(3.0倍)(图。3.d)。转录水平谷胱甘肽S-TRANSFERASE 1(GST1;与对照(3倍)相比,MS感染的叶片明显超诱导(6倍),但对照或MS植株不受影响(图。3.D).因此,植物事先暴露于重复MS和随后感染病原体可能会增强ROS的清除和解毒能力,从而促进坏死营养性病原体的毒力[36,37].
JA介导MS诱导的抗肿瘤作用A.芸薹属
MS增强了JA的积累(图。1D),它可以介导对昆虫攻击和坏死病原体感染的抗性[16,34,38]. 因此,我们检测了MS是否诱导了抗肿瘤细胞的耐药性A.芸薹属需要JA信令。JA-不敏感的信号突变体,coi1-16,已被证明对外源施用MeJA不敏感,并损害茉莉酸诱导的植物防御信号传导和转录调控[18,39,40].因此我们调查了如果不敏感coi1-16对JA积累可能会影响ms诱导的抗性A.芸薹属的确,对接种后5天疾病进展的分析A.芸薹属透露了这一点coi1-16与野生型相比,突变体对MS和MS的感染高度敏感(图1)。2B)。coi1-16植物显示增强的叶片氯化和较大的坏死病变区域(通过与WT相比初始孢子接种位点染色的较大的坏死病变区(通过染色乳糖蛋白醇蓝色)(图。2C).因此,MS的周期很短拟南芥幼苗可以加强防御A.芸薹属通过JA介导的信号通路感染。
MS启动防御基因表达A.芸薹属感染
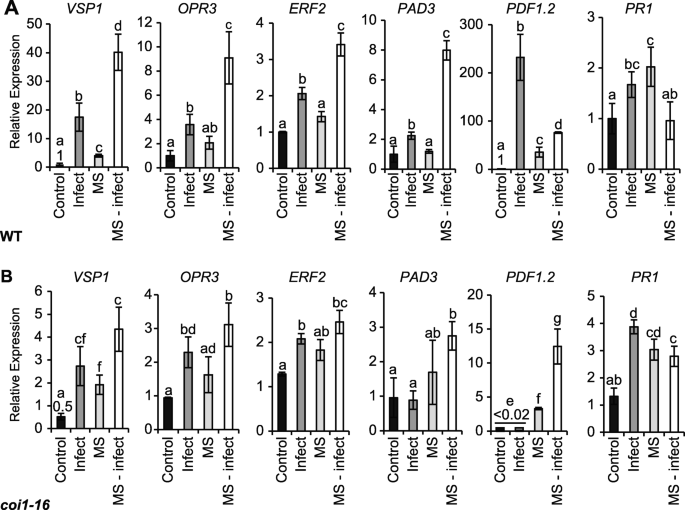
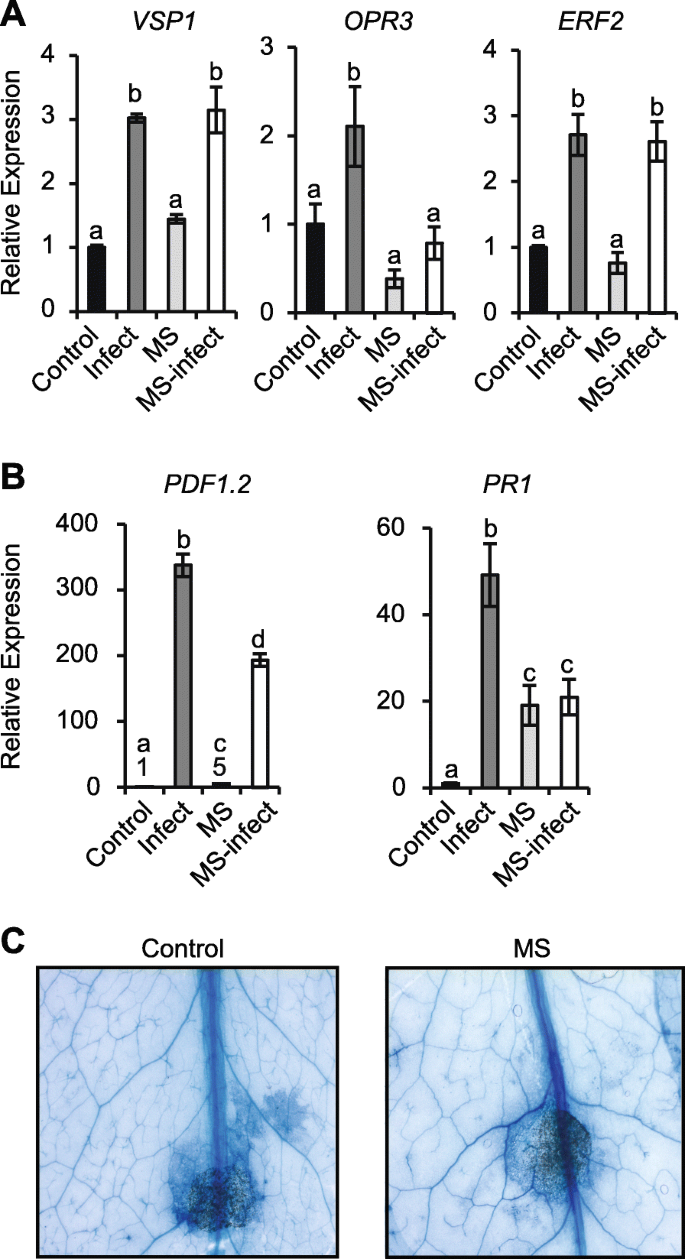
我们测试了MS植物随后是否受到挑战A.芸薹属表明短时间的MS触发了基因表达的改变(图。4).基因分析包括;营养贮藏蛋白(VSP1; 创伤和创伤诱导表达,OXOPHYTODIENOATE-REDUCTASE 3(OPR3;编码茉莉酸盐生物合成所需的蛋白质),乙烯反应因子2(ERF2; 由JA和乙烯诱导),植物防御素1.2(PDF1.2;编码一个乙烯和茉莉酸反应植物防御蛋白),以及植物抗毒素不足3(PAD3.),病因相关基因1(PR1;由SA诱导的标记基因,指示系统获得性反应)。接种5 d后,对照染病植株叶片表达增强VSP1(17.5倍),OPR3(3.8倍),ERF2(2.1倍),PAD3.(2.1倍),PDF1.2(232.2倍)和PR1(1.8倍)相对于来自对照 - 未感染的植物的植物的那些(图。4A).在ms处理的植株中,基性表达水平OPR3,ERF2和PAD3.保持不变。有趣的是,基础水平的表达VSP1,PDF1.2,和PR1在MS后5天,仍然成分增长(4.1,35.6-,2.1倍)。MS感染的植物显示出显着的超诱导VSP1(40倍),OPR3(9.1倍),ERF2(3.4倍)和PAD3.(8倍)比较对照感染植株(图。4A) 是的。相反,PDF1.2和PR1在相对于对照感染组织的MS感染中,表达呈负调节。那是;PDF1.2表达量从对照组的232.2倍减少到ms感染的76.1倍PR1表达量与对照植株无显著差异。4A).在MS感染的野生型植物中,基因表达的超诱导或负调控证明MS可以启动一个不同的基因表达来响应随后的病原体感染。
MS和/或对莲座丛叶防御基因表达的调控A.芸薹属感染。用5 μL 3.5 × 10接种对照、侵染、ms处理和ms侵染17日龄植株的第5 ~ 7片真叶4孢子/ ml.−1的A.芸薹属. 基因表达定量为5dpi。一个基因表达VSP1, OPR3,ERF3,PAD3.,PDF1.2,和PR1在WT。B相对表达VSP1, OPR3,ERF3,PAD3.,PDF1.2,和PR1在coi1-16与wt相比突变体。相对基因表达水平被标准化为β肌动蛋白管家基因。误差条显示平均值的标准错误(n= 4个生物复制)。字母是使用Bonferroni检验的2-way ANOVA处理之间的统计差异,(P < 0.05). 统计分析coi1-16突变体(B)相对于WT (一个).实验重复两次,获得相似的表达模式
我们推断JA介导的信号通路可以促进基因表达的MS诱导的灌注。转录水平VSP1,OPR3,ERF2、PAD3 PDF1.2,和PR1从coi1-16当我们观察到病原体感染的更显显着差异时,植物与5 dpi后的wt相比(图。2B和C)VSP1(0.5倍)PDF1.2(0.01倍)coi1-16(无花果。4B) 与野生植物相比(图。4答案:AVSP1(2.7倍),OPR3(2.2倍),ERF2(2.5倍)和PR1(3.9倍)上调coi1-16受感染的组织。对比WT和WT的基因表达模式coi1-16感染的组织显示出来PDF1.2和PAD3.表达已不再诱导coi1-16来华的组织。归纳VSP1表达量减少(17.5- 2.7倍),而诱导PR1表达量略高(1.8- 3.9倍)coi1-16与小波变换相比(比较图。4a到b)。有趣的是,停止女士5天,coi1-16MS植物显示出基础的表达水平增加VSP1(2倍)和PDF1.2(3.3倍)虽然与WT相比明显少PR1(3倍)显示与MS处理的WT植物类似的表达(比较图。4B和A)。一些基因表达的超诱导(例如。VSP1,OPR3, 和ERF2)在ms感染的WT组织中观察到(图。4A)在ms感染的组织中不明显coi1-16(无花果。4B)。在duction ofPAD3.(2.7倍)PDF1.2(13.5倍)明显coi1-16与MS感染的WT植物相比,MS感染的植物尽可能低(> 2.5倍)(比较图。4MS实际上引起了PDF1.2表达coi1-16感染植株(15倍),这与在ms感染的WT植株中观察到的减少是相反的(比较图。4A和B),同样的,归纳PR1表达MS-infectedcoi1-1在MS感染的WT植物(0.9倍)中降低了6种植物(2.8倍)(比较图。4因此,JA信号转导是通过COI1在ms处理的植物中,似乎启动了基因表达的超诱导和/或反调控A.芸薹属.
MS改变幼稚茎叶中的防御基因表达
在ms处理后的植株中观察到花茎高度的降低(图1)。1B),促使我们测试,如果幼稚的茎生叶,区别于花序茎,也会显示出改变的防御反应A.芸薹属感染。基因表达分析显示2 dpi显著上调VSP1(三倍),OPR3(2.3倍),ERF2(2.7倍),PDF1.2(337.1折)和PR1(49.2倍)在对照感染的茎生叶中的表达(图。5A-B),一种类似于在对照感染的莲座叶中观察到的趋势(图。4A) 是的。表达VSP1,OPR3和ERF2与对照植物茎生叶相似(图。5一种)。有趣的是,基础水平的表达PDF1.2(5.0倍)PR1(19.1倍)在来自MS植物的甲磺酸叶中组成脑部上调(图。5A),在莲座叶中也观察到这种趋势(图1)。4答案:AVSP1和ERF2在对照和MS植株感染的茎生叶中类似(图。5A),揭示了在ms感染的莲座叶中观察到的超诱导(图。4A)没有保留在naïve茎生叶。相比之下,PDF1.2和PR1与对照相比,MS处理的受感染茎叶中的表达受到负调控(图。5B),在受感染的莲座叶中也观察到这种趋势(图1)。4A).用乳酚台虫蓝染色对细胞死亡进行分析,没有发现质谱和对照植物茎叶的疾病易感性有任何显著差异(图)。5C)。虽然幼苗对MS的预先暴露于MS的抗性在尾叶中不足以A.芸薹属短时间的MS可改变茎生组织中防御基因的表达。
naïve茎叶防御基因表达及疾病症状分析A.芸薹属.10日龄的WT植株MS 7天,在不受进一步刺激的情况下生长,直到主花茎长出2-3个茎生叶。用5 μL 3.5 × 10接种ms处理植株和对照植株的第1和/或第2茎叶4孢子/ ml.−1的A.芸薹属.一个,B病原菌相关防御基因在对照茎叶和MS植株茎叶中的相对表达。C接种3天后,茎叶用乳酚台盼蓝染色,显示坏死的病变区域。有代表性的茎叶显示从两个实验显示类似的结果。基因表达水平归一化为β肌动蛋白管家基因。误差条表示均值的标准误差(n = 4). Letters are statistical differences between treatments with Bonferroni test using ANOVA,P< 0.05。实验进行了两次,结果相似
讨论
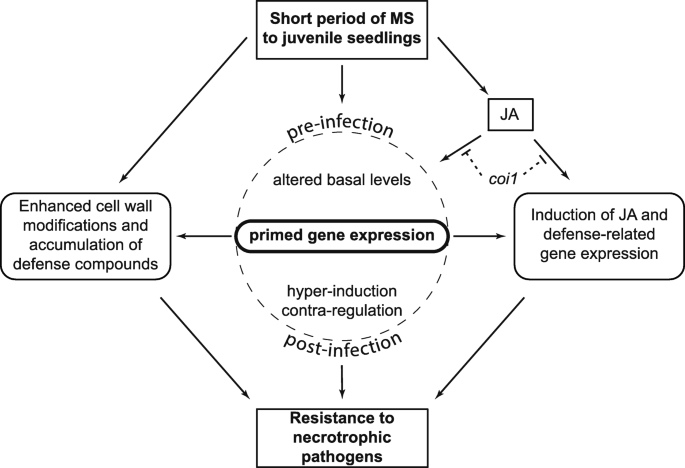
每日两次MS应用于幼鱼拟南芥植株7 d可增加JA积累,促进表皮形态建成。MS为植物提供了对后续挑战反应更强或更快的优势B灰霉菌和A.芸薹属通过启动与抗病性相关的基因表达的高诱导和/或反调节而感染。在这里,我们讨论了MS如何诱导防御屏障和增强的JA信号反应,从而触发对多种坏死性病原体感染的抵抗,以及表明维持表观遗传记忆的基因表达的持久变化(图。6).
MS触发防御性障碍,以限制虚身份病原体感染
MS引起的细胞壁部件的改变可以补偿结构完整性挑战,并有助于植物对病原体的第一道防御[41,42,43].例如,MS增强了胼胝质、a(1,3)-的积累β-葡聚糖聚合物,增强细胞壁A.芸薹属渗透部位限制感染(图。3.) [44].这是一致的,报告显示MS-草莓叶组织中的愈伤组织累积B灰霉菌[6].调用沉积与超诱导相关的相关性GSL6公司基因在ms感染叶片中的表达。报告显示过度表达拟南芥GSL5在白粉病侵染早期提高了抗病性拟南芥[45,46],并沉默大麦HvGSL6型基因表达增加了疾病易感性Blumeria Graminis.f.sp。hordei在勉强[47]. 因此,过度诱导GSL6公司在ms感染的组织中表达和增强胼胝质的沉积可以限制病原体的穿透。
木质素和camalexin是其他细胞壁结构化合物与促进植物防御病原体。这PRX71基因编码一种细胞壁结合过氧化物酶蛋白,其功能是减少细胞膨胀和细胞壁损伤,从而限制病原体进入细胞内的空间[48]. 过表达PRX71触发了木质化拟南芥并增加抵抗力B灰霉菌[48,49,50].实际上,MS治疗的叶子增强了木质素沉积,并且感染导致超诱导PRX71表达(图。1和3.).这PAD3.基因编码细胞色素P450酶,其催化二氢氨基酸转化为Camalexin,一种促进对抗病原体的抗性的化合物[51,52].功能缺失突变PAD3.增强对A.芸薹属在拟南芥[34],揭示超级诱导PAD3.对MS诱导的抗虫性有一定的影响A.芸薹属(无花果。3.).因此,提高JA积累(图。1d)和PAD3.如以前报道的那样,表达可协同促进抗病[34,53]. 氧化应激相关基因谷胱甘肽S-TRANSFERASE 1(GST1),其编码可催化谷胱甘肽 - 吲哚-3-乙腈合成的蛋白质,Camalexin生物合成的前体[54)在ms感染的组织中也是超诱导的(图。3.).先前的植物暴露于MS和随后的感染在超诱导达到顶峰PRX71,PAD3.和GST1表达,其蛋白编码产物有助于促进抗性化合物的生物合成A.芸薹属感染。
活性氧在ms处理的叶组织中积累A.芸薹属感染(MS植物36 hpi)(图。3.),与先前在ms处理草莓和拟南芥叶片受到B灰霉菌感染(6,8].ROS可能促进MS反应的早期信号转导,但可能不直接参与MS诱导的抗性。的功能丧失rbohd.和RBOHF这些基因会影响ROS的产生[55]但没有参与女士诱导的防御B灰霉菌感染MS-treated以来rbohd公司和rbohf公司突变体对感染表现出wt样的抗性[8]. 这表明MS诱导的抗性可能与ROS信号无关。植物对MS的暴露呈组成性上调rbohd.刺激后5天表达。然而,在感染rbohd.MS处理的植株中的表达被负性调节回到基本表达水平,与对照相似(减少2.6倍)(图。3.).减少rbohd.在ms感染的植物中表达可能是由于过度诱导GST1和PRX71表达,其产物参与ROS清除和过氧化氢分解代谢过程[56].因此,MS之前暴露于重复的MS可能会在随后的挑战中发出ROS限制过程的信号A.芸薹属减少细胞死亡,否则会促进坏死病原菌的毒性[36,37].
JA信号传导介导MS诱导的抗病性病原体感染
通过摩擦单一的软ms事件拟南芥表明MS可能不需要茉莉酸来介导抗虫性B灰霉菌感染(8].这与之前的一份报告相反,该报告认为4周ms诱导的JA积累与B灰霉菌耐药性拟南芥[16].单个MS与长时间MS引发的适应反应可能存在差异。例如,单个MS事件[16可能瞬间诱导JA反应[9不足以诱导触状形态发生[9并引发长期的ja介导的反应。然而,这里显示的重复MS可以提高JA水平,最终导致植物的生长变化和持久的防御反应[9,16]. 在这里,我们证明了短7天的MS(在每个光周期内每天两次,持续10天) 他有8分 h间隔)用软刷子可触发thigmoporphigenesis,增加JA水平,促进抗肿瘤能力A.芸薹属感染(图。1).
茉莉酸是抵抗坏死病原体感染的信号[57].例如,长期的MS显示诱导抗性拟南芥来B灰霉菌感染受到损害opr3突变体,并通过构成性过表达增强OPR3[16].我们的结果证实,COI1中的功能丧失,一种茉莉酸反应和转录调控所必需的F-box蛋白[18]损害了MS引起的抗性A.芸薹属感染(图。2).这coi1-16突变体受影响的细胞壁重塑拟南芥[58]并具有二次突变渗透2(PEN2;涉及对病原真菌的抗性),可以限制病原体在细胞外周的生长[59].因此,损害coi1-16不仅影响MS诱导的JA抗性,还可以影响损害细胞内空间内真菌菌丝的侵袭的细胞壁组分的积累[60].我们的结论是JA信号通过COI1介导ms诱导的对坏死病原菌感染的抗性(图。6).
A.芸薹属感染激活JA防御基因表达,与以往报道一致[29,34].一个拟南芥GeneChip阵列显示接种后12-36小时,在疾病症状开始之前,许多A.芸薹属诱导的基因在WT植株中显著增加coi1-16植物。VSP1和PDF1.2明显减少了coi1突变体,而OPR3茉莉酸的生物合成被发现是独立的coi1在感染后期,与我们的数据保持一致(比较图。4) [34].在5-DPI接种中在5-DPI接种中对MS治疗植物中基因表达的调节疾病易感性差异在WT和THE之间的截然不同coil-16突变体。的hyper-inductionVSP1,OPR3, ERF2和PAD3.的表达和/或反规则PDF1.2和PR1表达要么被废除,要么在coi1-16与WT相比(图。4).与以前的报告相符[34],PR1加强了coi1突变体表明JA的拮抗作用PR1信号通过COI1途径。减少PDF1.2在WT MS感染的莲座丛中与WT对照感染的植物相比,MS揭示了MS负调节PDF1.2通过未知机制在病原体感染上表达。一份报告指出GLUTAREDOXIN 480与TGA因子的相互作用可损害PDF1.2[61),但这种机制是否发生在ms反应中尚不清楚VSP1和PDF1。2coi1-16突变体组成性减少(> 50%)表明JA信号通过COI1需要启用其表达和对MS的响应。我们得出结论,JA信号传递介导COI1在ms感染的植物中促进基因表达的超诱导和/或改变(图。6).
多发性硬化症在随后的病原体感染上启动防御反应
以前接触过的青少年拟南芥幼苗对短时间的MS增强了成年植物对随后感染的分子反应A.芸薹属揭示了多发性硬化症可以启动对病原体的防御。ms感染的植物积累了细胞壁化合物,为抵御病原菌入侵提供了更强的防御屏障。随后的挑战与MS植物A.芸薹属最终导致防御基因的高诱导表达(VSP1,OPR3,ERF2, PAD3,PRX71,GSL6公司和GST1)大约2倍,揭示了少年植物对MS的预先暴露可以安装更强的防御响应并因此抵抗A.芸薹属感染。这种反应持续在成体莲座叶上,在MS停止后持续4-5天,通过防御基因表达的超诱导明显。然而,启动的防御反应并没有在植物的整个生命周期中持续,因为ms处理植物的茎生叶对感染表现出wt样的易感性(图)。5).的hyper-inductionVSP1,OPR3和ERF2在茎生叶中未观察到基因表达,但在茎生叶中发现了反调控PDF1.2和PR1莲座叶的基因表达在茎生叶中仍然很明显,这可能反映了胁迫诱导的记忆。因此,在没有持续重复ms的情况下,幼稚茎生叶会消除ms诱导的莲藕叶中的短期抗性。ms诱导记忆的重置会限制维持长期免疫的能量消耗,否则可能会对生长和繁殖产生负面影响[24,62].
灌注发生在生理(激素变化),分子(基因调节)和/或表观遗传水平(DNA或组蛋白修饰)中,基本上提供适应策略,以提高植物防止未来攻击的国防能力[24].据报道,长期干旱、寒冷、盐碱化、光照和病原体感染会导致启动基因的表达,并增强植物对未来逆境的反应[21,63,64,65].我们将MS植物中基因表达的超诱导或反调控归因于较高的内源JA水平,因为coi1-16JA信号突变体破坏了这种增强的反应(图。6) [62].
多发性硬化症导致基因表达的长期变化
MS是植物发育过程中普遍存在的胁迫刺激。未受胁迫的植物和naïve植物被建议保持重复MS的“记忆”,以防止不必要的触觉形态发生[14,15,66].我们的数据表明,植物暴露于短时间的MS可以构成性地上调基础水平RBOHD, VSP1,PDF1.2和PR1刺激后5天的表达(图。4).的upregulationPDF1.2和PR1在任何花茎从成体莲座丛中出现的迹象前10天MS停止>时尚未发育的幼稚茎生叶中仍然明显。幼苗茎尖分生组织内的细胞一直处于未分化状态,直到植物从营养阶段过渡到生殖阶段,此时花序分生组织在萌发后约14天左右发育[67]. 因此,茎生叶中基因表达水平的改变表明,短时间的MS可能在幼嫩植物的茎分生组织中产生了一种应激记忆,这种应激记忆是通过细胞分裂遗传到花序分生组织的[24,25,26]. 在生殖发育过程中,茎组织会从花序分生组织内的特殊细胞类型分化出来,并保留了一些记忆,这是由某些基因的组成性较高的基础表达水平所显示的。今后研究MS诱导的叶片抗性是否能系统地转移到根系,这是一个在土壤中航行时暴露于病原体、共生体和机械应力的关键器官,将有助于我们进一步了解MS对植物免疫的整体影响。
幼苗具有对生长环境应激反应的可塑性;例如,当长时间的寒冷暴露(如春化)会导致成虫提早开花拟南芥由组蛋白修饰介导的植物[68]. 应激诱导的记忆可以通过表观遗传过程(组蛋白修饰或DNA甲基化)在植物中持续存在,从而改变植物对未来遭遇的反应,在某些情况下还可以遗传[21,65]. 例如,染色质修饰酶SET结构域组8(SDG8)促进组蛋白赖氨酸甲基化触摸,病原菌和花期响应基因,并在促进春化和igmomorphogenesis中起关键作用[22,69,70].短时间的MS - 10天的幼苗可以改变莲座丛和naïve茎生叶的基础水平和/或调控基因表达的机制有待进一步的研究。
结论
机械压力已被用于农业长期以硬化作物,促进压力适应[1,16].MS促进应激耐受性和防御反应的机制尚不清楚。全基因组转录组分析表明,短时间的MS可以增强与应激反应有关的几个基因的表达[9,10,12,71].本研究表明,短时间的MS重复对幼苗的抗性增强,并通过JA信号传导促进了随后病原菌攻击时的防御基因表达。植物先前暴露于MS改变了细胞壁和防御相关代谢物,这可以归因于抗性的增强A.芸薹属.在没有进一步的MS的情况下,甲磺酸中的改变的基因表达在没有进一步的MS中,以前的报告暗示促进Thigmomorphogyesis [21,24,65].了解植物MS适应反应的因素(持续时间、强度、植株年龄、信号通路和全基因组调控)有助于种植者利用MS在温室繁殖的幼苗移入田间前诱导其防御机制。
方法
植物材料和生长条件
JA-insensitive突变体的coi1-16(CS68788)是从TAIR获得的coi1-21(SALK_035548)获得自Jose Ramon Botella教授(澳大利亚昆士兰大学)[72].这两个coi1等位基因具有col0野生型背景,并作为具有相同基因位点(AT2G39940)的纯合子母系提供。coi1突变等位基因具有典型的雄性不育表型,在正常生长温度下生长时不会结子[73].但是,当coi1突变等位基因在16°C下生长,男性生育能力恢复,种子如前所述正常结集[74].我们评估了coi1-16相比coi1-21,证实来自两个种质的所有兄弟姐妹都表现出雄性不育表型,并且在生长和形态上没有显著差异。然而,当这些等位基因在寒冷的环境中生长时,我们从中获得了更多的种子coi1-16因此选择该种质进行本文后续研究。两者在表型上没有其他明显的差异coi1在寒冷中生长时的等位基因(数据未显示)。
种子生长在无菌种子混合土壤(DEBCO Pty,澳大利亚)和缓释肥料(Osmocote, Garden City Plastics,), 4℃分层2-3天,然后移入22℃的生长箱,在相对湿度为60%、光强为140 ~ 150 μmol m的条件下,使用16 h光周期/8 h暗光周期−2年代−1.植物每周从生长托盘底部浇水。
植物的机械刺激
通过用非常柔软的刷子触摸8-10秒,通过非常柔软的刷子来轻轻刺激少年植物(生长后的增长后的增长,DAG),以构成单毫秒。注意不要打破叶子,因为这可能导致伤口诱导的反应。除非另有说明,否则重复机械应力,触及每天两次(以8小时间隔)进行7天(MS)。在机械刺激7天后,触摸和未触摸植物的图像用于分析ImageJ软件的抗血管生成的性状(玫瑰花莲面积,叶柄长度和花序高度)(https://imagej.nih.gov/ij/download.html.).测量的植物高度对应于主要的花螺栓。
病原体检测
如前所述,进行了病原菌培养和植物侵染[72,75].用于实验的病原体是A.芸薹属(隔离DAR 27028)和灰葡萄孢(DAR 77536)均来自新南威尔士州第一产业部(http://www.dpi.nsw.gov.au).在23℃下在马铃薯右旋糖琼脂(PDA)板上在马铃薯右旋糖琼脂(PDA)板上生长约12-14天。这b . cineria和A.芸薹属成熟孢子在PDA平板上分别呈现明显的黑色和棕色。孢子用蒸馏水从培养皿中洗净,用奇迹布过滤,并用血球细胞计数。如前所述,试验植物在接种前一天用一个透明的塑料圆顶覆盖以增加湿度[34].用5μl3.5×10滴加植物4孢子/毫升B灰霉菌或者A.芸薹属疾病症状中有坏死斑点和褪绿。采用Image J软件(https://imagej.nih.gov/ij/download.html.).
RNA提取,cDNA合成,基因表达分析
在指定的时间点收集叶组织并在液氮中快速冷冻。将样品用Tissuicalser(QIAGEN)在含有两个钢球的2mL EPPendorf管中接地。使用培养型方案方案的谱植物总RNA试剂盒(Sigma)提取用于基因表达分析的RNA。使用转录器第一链CDNA合成试剂盒(ROCHE)制备第一链cDNA。使用Roche光循环仪480进行定量RT-PCR(http://www.roche.com.)和FastStart DNA Master SYBR Green I试剂盒(罗氏),如手册所述。使用在线Primer3Plus程序设计跨外显子连接的引物(http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi.).识别二次结构以消除使用IDT UNAFOLD程序的引物二聚体(https://sg.idtdna.com/UNAFold). 相对于先前验证的参考基因的基因表达水平β-肌动蛋白2(At3g18780)采用Pfaffle法[76]. 仅限ACT2.被使用,因为它在我们的实验设置中没有改变其转录。表中列出了分析的特异性引物序列1.通过对每个引物建立连续稀释和标准曲线来检查引物的质量和效率,以正确确定扩增效率并去除不良引物。引物的效率范围在90 - 100%之间。
组织化学分析
如前所述确定反应性氧物质(ROS)积累[77].简要地,感染和对照叶是用0.1%(w / v)二氨基苯甲酸(dab)(sigma)(pH 3.9)的真空渗透3分钟并重复渗透所有叶子。将叶片放在高湿度下培养皿中的潮湿滤纸,直至观察到棕色沉淀(3-5小时)并以96%(v / v)乙醇清除,然后用3:1:1的溶液固定乙醇/乳酸/甘油和在光学显微镜下观察(Zeiss Stemi 2000c安装有Axiocam)。
对于坏死性病变,叶子染色萘酚蛋白醇蓝溶液[78] (20 苯酚,20毫升 mL乳酸,40 mL甘油,20 mL水和0.05%台盼蓝混合物和200 mL(96%乙醇)2分钟 最小值,在水合氯醛(2.5)中脱色 g英寸1 mL 30%甘油)过夜。在卡尔蔡司Axio显微镜A1下观察叶片,该显微镜配备干涉或相位对比光学系统和数码相机。使用ImageJ软件确定每个样本的病变面积。将图像比例输入软件,并使用徒手工具选择和测量坏死病灶区域(美国国立卫生研究院W.S.Rasband;http://imagej.nih.gov/ij/).
木质素沉积测定如下:MS胁迫和对照叶片在100%乙醇中染色。将叶片转入新鲜制备的2.5% (w/v)间苯三酚(75%乙醇)中,室温,然后在33% HCl中放置5min。
用95 ~ 100%乙醇去除叶片叶绿素,测定叶片胼胝质沉积。24 h后,叶片在0.07 M磷酸盐(pH 9.0)缓冲液中洗涤,然后转入含有0.05%苯胺蓝(Sigma)的新的0.07 M磷酸盐缓冲液(pH 9.0)中在黑暗中浸泡2 h。使用Carl Zeiss Axio Scope A1显微镜观察并拍照,显微镜设置荧光紫外光(激发波长340 ~ 380 nm,发射波长425 nm)。通过ImageJ软件(W.S. Rasband, National Institutes of Health;http://imagej.nih.gov/ij/).“徒手选择工具”用于定义调用存款区域。注意,在捕获过程中,所有图像必须具有相同的相机设置(比例/焦距和亮度)。对于设置测量,在程序中选择了面积集成强度和平均灰度值,分析工具ROI管理器用于选择和测量每张图像的几个调用沉积。选择由没有荧光的面积确定的每个图像选择的背景,以确定校正沉积物的校正总荧光强度。
植物激素量化
为了定量内源性Ja激素,切除整个玫瑰花并迅速置于液氮中并转移到-80°C冰箱中以进一步分析。如前所述,进行激素的提取[79,80使用UPLC/ESI-MS/MS(水,米尔福德,美国)在悉尼西部大学,质谱仪器,坎贝尔敦,澳大利亚。从Sigma-Aldrich获得纯JA标准激素。内标氘化化合物[2H4] -sa(c7H2D4O3.)是从Olchemim Ltd.,Olomouc,捷克共和国和Jasmonic-D获得的5酸(C.12H13D5O3.)从加拿大的CND同位素中获得。为了减少叶龄引起的变异,整个植株被切除进行分析。共10-15个生物重复,每个重复含有2株植物用于提取。
简单地说,将200mg从组织中提取的液氮粉末放入2ml Eppendorf管中。1毫升提取溶剂(甲醇:水:醋酸,69:30:1 (v/v/v),含100ppb终浓度内标(化合物的标记形式)2H4SA2H2JA)补充道。对照(空白)含萃取溶剂,内标不含植物物质。样品在4°C涡旋5分钟。4℃,10000 rpm, 15 min离心后,收集上清,用0.5 mL提取溶剂重新提取球团,重复提取2次。上层有机层在氮气的作用下收集、结合和蒸发到干燥。每个样品在250 μl甲醇:水(70:30,v/v)中超声处理15分钟(4-8°C),然后通过0.22 μm PTFE过滤器(Waters, Milford, MA, USA)过滤。样品(10 μl)采用UPLC/ESI-MS/ ms进行分析。提取物采用HALO™C18 (Advanced Materials Technology, Inc., Wilmington, USA)色谱柱(2.1 × 75 mm, 2.7 μm)进行分析。建立了从1 ppb到200 ppb包含每一个未标记的分析纯化合物(JA)的定量校准曲线。在每个标准溶液中加入等量的内标物。使用MassLynx 4.1™软件(Waters,美国)生成每个分析物的校正曲线。
统计分析
根据Bonferroni Post Hoc Test使用veriance(Anova)分析对照和MS植物之间的显着差异(P < 0.05),使用SigmaPlot 14.0软件。在一些数据上,只有两组被比较,学生的t- 最低使用。错误栏显示标准错误(SE)。
数据和材料的可用性
本研究中使用和/或分析的数据集可在合理要求下从通讯作者处获得。利用遗传多态性和本研究中使用的DNA序列信息的数据集可从TAIR [https://www.arabidopsis.org.].
缩写
- 小姐:
-
机械应力
- JA:
-
茉莉酸
- 山:
-
水杨酸
- TCH:
-
触摸
- 重量:
-
野生型
参考文献
- 1.
这是一种有益的农业工作,通过踩踏小麦和大麦幼苗来增加机械压力。植物科学与技术,2014;
- 2.
接触:植物对机械刺激的反应。新植醇。2005;165(2):373 - 89。
- 3.
Telewski FW, Jaffe MJ。机械扰动诱导6月龄松木幼苗形态和化学成分的变化。中国林业科学。2001;20(2):1 - 7。
- 4.
蒙沙森GB,Haswell es。一种自然力量:植物机械化的分子机制。J Exp Bot。2013; 64(15):4663-80。
- 5.
Tretner C, Huth U, Hause B. mecostimulation, Medicago truncatula, leads to enhance levels of jasmonic acid. Tretner C, Huth U, Hause B.。实验机器人。2008;59(10):2847-56。
- 6.
托马斯·格拉乌·RH、雷克纳·塞拉·FJ、海尔·康拉德V、马丁内斯·萨莫拉MG、格雷罗·莫利纳MF、迪亚斯·里奇JC。软机械刺激诱导草莓对灰霉病的防御反应。植物细胞代表2018;37(2):239–50.
- 7.
Gus-Mayer S, Naton B, Hahlbrock K, Schmelzer E.局部机械刺激诱导了欧芹对病原体的防御反应。自然科学学报,1998;
- 8.
Benikhlef L, L 'Haridon F, abu - mansour E, Serrano M, Binda M, Costa A, Lehmann S, Métraux J-P。拟南芥叶片对软机械胁迫的感知激活了抗病能力。植物生物学学报。2013;13(1):1 - 12。
- 9
Van Moerkercke A、Duncan O、Zander M、Šimura J、Broda M、Vanden Bossche R、Lewsey MG、Lama S、Singh KB、Ljung K等。MYC2/MYC3/MYC4依赖性转录因子网络调节喷水反应基因表达和茉莉酸水平。国家科学院学报。2019;116(46):23345–56.
- 10。
Lee D,Polisensky DH,Braam J. Genome - 范围内识别触摸和黑暗调节的拟南芥基因:侧重于钙调素样和曲线。新植物。2005; 165(2):429-44。
- 11.
徐Y,伯克维茨O,纳尔赛R,德克莱尔奇I,胡伊M,布隆V,范·布鲁塞格姆F,韦兰J,王Y。线粒体功能调节拟南芥的触觉信号。植物J。2019;97(4):623–45.
- 12.
Pomiès L, Decourteix M, Franchel J, Moulia B, Leblanc-Fournier N.杨树茎转录组在单一或重复的机械刺激下被大量重构。BMC基因组学。2017;18(1):300。
- 13.
经验教会植物在重要的环境中学习得更快,遗忘得更慢。环境科学,2014,175(1):63 - 72。
- 14.
Gagliano M,Vyazovskiy VV,Borbely AA,Grimonprez M,Depczynski M.在植物中的关联学习。SCI批准。2016; 6:38427。
- 15.
植物力学敏感性研究:植物力学敏感性的一个重要问题。植物科学与技术,2014;
- 16.
拟南芥触觉诱导的形态建成是茉莉酸介导的,并对害虫有保护作用。咕咕叫医学杂志。2012;22(8):701 - 6。
- 17.
Kazan K, Manners JM。MYC2:运行中的主程序。摩尔。2013;6(3):686 - 703。
- 18.
张璐,张飞,梅洛托,姚娟,何淑英。病原体和昆虫的茉莉酸信号传导和调控。实验机器人。2017;68(6):1371-85。
- 19
Lange MJP, Lange T. touch诱导的拟南芥形态变化依赖于赤霉素击穿。Nat植物。2015;1:14025。
- 20。
李忠,龚敏。机械刺激诱导的植物交叉适应研究综述。植物生物学通报。2011;
- 21。
何艳,李忠。植物表观遗传环境记忆的建立、维持与重编程。34趋势麝猫。2018;(11):856 - 66。
- 22。
Cazonelli CI,Nisar N,Roberts Ac,Murray Kd,Borevitz Jo,Pogson BJ。染色质调节酶,SDG8,涉及形态学,基因表达和对机械刺激的表观遗传反应。前植物SCI。2014; 5:533。
- 23。
Jensen GS, Fal K, Hamant O, Haswell ES。RNA聚合酶相关因子1复合体是植物接触反应所必需的。实验机器人学报。2017;68(3):499-511。
- 24.
Mauch-Mani B, Baccelli I, Luna E, Flors V.防御启动:诱导抗性的适应性部分。植物生物学杂志。2017;68(1):485-512。
- 25.
防御相关的启动和对反复干旱的响应:ABA和JA信号通路介导的植物转录记忆的两种表现植物细胞环境学报。2019;42(3):983-97。
- 26.
希尔克M,施姆林T。植物的应激启动、记忆和信号传递。植物细胞环境。2019;42(3):753–61.
- 27.
Cho Y.虚身亡霉素alertaria Brassicola杀死植物细胞仍然是谜。真核细胞。2015; 14(4):335-44。
- 28.
Nowakowska M、Wrzesińska M、Kamiński P、Szechura W、Lichocka M、Tartanus M、Kozik EU、Nowicki M。芸苔链格孢-芸苔科致病系统:优化人工生物试验下侵染过程和抗性机制的研究。植物病理学杂志。2019;153(1):131–51.
- 29.
Thomma BPHJ, Eggermont K, Penninckx IAMA, Mauch-Mani B, Vogelsang R, Cammue BPA, Broekaert WF。在拟南芥中,茉莉酸依赖和水杨酸依赖的防御反应途径对于抵御不同的微生物病原体至关重要。自然科学学报,1998;95(25):15107-11。
- 30.
Spsu Pd,Panstruga R.编辑:生物养殖植物微生物相互作用。前植物SCI。2017; 8:192。
- 31。
Wright AJ,Knight H,Knight Mr。拟南芥中机械刺激的TCH3基因表达涉及钙的蛋白质磷酸化和钙的ein6。植物理性。2002; 128(4):1402-9。
- 32。
徐W,Purugganan MM,Polisensky DH,ANTOSIEWICZ DM,FRY SC,BRAAM J.AcaMidopsis TCH4,由激素和环境调节,编码Xyloglucan子类甘油糖苷。植物细胞。1995年; 7(10):1555-67。
- 33。
Su'udi M, Kim MG, Park S-R, Hwang D-J, Bae S-C, Ahn I-P。拟南芥与油菜链格孢亲和和不亲和互作的细胞死亡。摩尔细胞。2011;31(6):593 - 601。
- 34。
Van Wees Scm,Chang Hs,Zhu T,Glazebrook J.使用表达分析表征拟南芥早期反应的alterararia Brassicola感染。植物理性。2003; 132(2):606-17。
- 35.
Kadota Y,Shirasu K,Zipfel C.在植物免疫期间NADPH氧化酶RBOHD调节。植物细胞生理。2015; 56(8):1472-80。
- 36.
Rossi FR, Krapp AR, Bisaro F, Maiale SJ, Pieckenstain FL, Carrillo N.在死营养真菌灰葡萄孢(Botrytis cinerea)侵染烟草叶片过程中,叶绿体产生活性氧。工厂j . 2017, 92(5): 761 - 73。
- 37.
关键词:活性氧,果实,病原菌,相互作用,信号转导,清除机制国际分子科学杂志。2019;20(12):2994。
- 38.
Pathak RK、Baunthiyal M、Pandey N、Pandey D、Kumar A。拟南芥茉莉酸信号转导途径与芸薹链格孢枯萎病病理生理的关系。Sci代表2017;7(1):16790.
- 39.
Feys B, Benedetti CE, Penfold CN, Turner JG。拟南芥突变体选择对植物毒素冠状病毒的抗性是雄性不育,对茉莉酸甲酯不敏感,并对一种细菌病原体抗性。植物细胞。1994;6(5):751 - 9。
- 40.
Kim J, Dotson B, Rey C, Lindsey J, Bleecker AB, Binder BM, Patterson SE。茉莉酸受体COI1的新外衣:延迟脱落,分生组织阻滞和顶端优势。《公共科学图书馆•综合》。2013;8 (4):e60505。
- 41.
微管与生物相互作用。植物J。2013;75(2):278–89.
- 42.
关键词:纤维素,合成,逆境,调控植物生物学杂志。2017;40:06 - 13。
- 43.
植物细胞壁介导免疫:细胞壁变化触发抗病反应。植物j . 2018; 93(4): 614 - 36。
- 44。
voigt ca.愈合介导的植物防御相关乳头的致病性入侵者的抗性。前植物SCI。2014; 5:168。
- 45。
研究结果表明,拟南芥早期胼胝质沉积水平的提高可提高拟南芥对白粉病的完全穿透抗性。植物杂志。2013;161(3):1433 - 44。
- 46。
纤维素/胼胝质葡聚糖网络:植物抗白粉病的关键?新植醇。2016;212(2):303 - 5。
- 47。
Chowdhury J,Schober Ms,Shirley NJ,Singh Rr,Jacobs Ak,Douchkov D,Schweizer P,Fincher GB,Burton Ra,小葡萄牙葡聚糖合酶样6基因(HVGSL6)的下调导致愈合减少Blumeria Graminis F的积累和增加的细胞壁渗透。sp。Hordei。新植物。2016; 212(2):434-43。
- 48.
拟南芥III类过氧化物酶AtPRX71在细胞壁损伤的生理条件下负调控生长。植物杂志。2015;169(4):2513 - 25所示。
- 49.
对拟南芥叶片的伤害可以产生一种强大但短暂的抗孢霉感染的保护作用。植物j . 2008; 55(4): 555 - 67。
- 50。
吕丹,王涛,佩尔松,Mueller-Roeber B, Schippers JHM。KUODA1对ROS稳态的转录调控调控了叶片发育过程中细胞的扩张。Nat Commun。2014;5:3767。
- 51。
吉里MK,辛格N,班代ZZ,辛格V,拉姆H,辛格D,查托帕迪亚S,南迪AK。GBF1通过差异调节CAT2和PAD4转录促进拟南芥的病原防御。植物J。2017;91(5):802–15.
- 52。
格拉泽布鲁克J,奥苏贝尔FM。拟南芥植保素缺失突变体的分离及其与病原菌相互作用的研究。国家科学院学报。1994;91(19):8955–9.
- 53。
哈雷·D、崔·H、胡苏、巴辛·B、金·J、马提诺亚·E、孙·KH、派克·K-H、李·Y。拟南芥ABCG34通过介导camalexin的分泌,参与对坏死性病原体的防御。国家科学院学报。2017;114(28):E5712–20。
- 54。
DubReuil-Maurizi C,ViteCek J,Marty L,Branciard L,Frettinger P,Wendehenne D,Meyer AJ,Mauch F,Poinssot B.拟南芥突变体PAD2-1的谷胱甘肽缺乏影响氧化应激相关事件,防御基因表达和过敏反应。植物理性。2011; 157(4):2000-12。
- 55。
植物NADPH氧化酶的爆发。植物生态学报,2012;
- 56。
Tsukagoshi H, Busch W, Benfey PN。ROS的转录调控控制着根从增殖到分化的过程。细胞。2010;143(4):606 - 16。
- 57。
Glazebrook J.防御生物营养和坏死性病原体的对比机制。Annu Rev phytopathol。2005; 43:205-27。
- 58。
Bömer M, O 'Brien JA, Pérez-Salamó I, Krasauskas J, Finch P, Briones A, Daudi A, Souda P, Tsui T-L, Whitelegge JP,等。coi1依赖的茉莉酸信号影响拟南芥的生长、代谢物产生和细胞壁蛋白组成。安机器人。2018;122(7):1117 - 29。
- 59.
Westphal L, Scheel D, Rosahl S. coi1-16突变体具有第二个位点突变,使PEN2无功能。植物细胞。2008;20(4):824 - 6。
- 60.
关键词:白粉病,拟南芥,免疫分泌通路,白粉病植物信号行为研究。2016;11(10):e1226456。
- 61
Ndamukong I, Abdallat AA, Thurow C, Fode B, Zander M, Weigel R, Gatz C. C. sa诱导的拟南芥glutaredoxin与TGA因子相互作用,抑制ja应答的PDF1.2转录。植物j . 2007; 50(1): 128 - 39。
- 62
[15]黄慧,刘波,刘玲,宋绍生。茉莉酸在植物生长发育中的作用。实验机器人。2017;68(6):1349-59。
- 63
李霞,刘峰。干旱胁迫记忆与植物抗旱性:生化和分子基础。入选:Hossain MA, Wani SH, Bhattacharjee S, Burritt DJ, Tran L-SP,编辑。植物对干旱胁迫的耐受性,Vol . 1:生理生化。Cham:施普林格国际出版公司;2016.17-44页。
- 64
冯晓军,李建军,齐双林,林秋芳,金建军,华晓军。光照影响盐胁迫诱导的拟南芥P5CS1转录记忆。自然科学学报。2016;113(51):E8335-43。
- 65.
Lämke J, Bäurle I.植物逆境适应和应激记忆的表观遗传机制。基因组医学杂志。2017;18(1):124。
- 66.
Martin L,Leblanc-Fournier N,Julien J-L,Moulia B,Coutand C.植物生理和分子反应的适应动力学对多种机械载荷。J Exp Bot。2010; 61(9):2403-12。
- 67.
Klepikova AV, Logacheva医学博士,Dmitriev SE, Penin AA。拟南芥顶端分生组织时间序列的RNA-seq分析揭示了拟南芥花起始的一个临界点。BMC基因组学。2015;16:466。
- 68。
丹尼斯,孔雀wj。开花的表观遗传调节。CurrOp植物BIOL。2007; 10(5):520-7。
- 69。
沈卫华,李国强,李国强,李国强。拟南芥组蛋白甲基转移酶SET DOMAIN GROUP8介导植物对坏死营养真菌的防御反应中茉莉酸/乙烯途径基因的诱导。植物杂志。2010;154(3):1403 - 14所示。
- 70.
Soppe WJ, Bentsink L, Koornneef M.拟南芥早花突变体efs参与了拟南芥的自主促进途径。发展。1999;126(21):4763 - 70。
- 71.
刘X,侯X.在新陈代谢和信号通路中ABA和GA的拮抗调节。前植物SCI。2018; 9:251。
- 72.
Trusov Y, Sewelam N, Rookes JE, Kunkel M, Nowak E, Schenk PM, Botella JR. .异三聚体G蛋白介导的对坏死营养性病原体的抗性机制不依赖于水杨酸、茉莉酸/乙烯和脱落酸介导的防御信号。植物j . 2009; 58(1): 69 - 81。
- 73。
闫杰,张超,顾明,白忠,张伟,齐涛,程忠,彭伟,罗华,南飞,等。拟南芥CORONATINE INSENSITIVE1蛋白是茉莉酸受体。植物细胞。2009;21(8):2220 - 36。
- 74。
埃利斯C,特纳JG。一个有条件可育的coi1等位基因表明拟南芥种子和幼苗的植物激素信号通路之间存在交叉。足底。2002;215(4):549 - 56。
- 75。
李庚,张×,万德,张S,夏Y。拟南芥抗病性及防御反应分析方法。在:运行下午,编辑。植物G蛋白偶联受体信号传导:方法和协议。托托瓦:人马出版社;2013年。55–66.
- 76。
Pfaffl兆瓦。实时荧光定量pcr中相对定量的新数学模型。核酸杂志2001;29(9):e45。
- 77。
植物中活性氧(ROS)、脂质过氧化和电解质泄漏的测定和检测。正确人选:Sunkar R,编辑。植物抗逆性:方法与规程。风险:胡玛纳出版社;2010.291 - 7页。
- 78。
Brenya E,Trusov Y,Dietzgen RG,Botella JR.异三聚体G蛋白促进植物对病原病毒的抗性拟南芥蒂利亚纳(l)Heynh。植物信号行为研究。2016;11(8):e1212798。
- 79。
Müller M, Munné-Bosch S.液相色谱-电喷雾串联质谱快速、灵敏的复杂植物样品激素谱分析。工厂方法。2011;7(1):37。
- 80.
Almeida Trapp M, De Souza GD, rodriges - filho E, Boland W, Mithöfer A.有效的植物激素定量方法。植物科学与技术,2014;
致谢
我们感谢来自西悉尼大学西部大学质谱设施的ema mikhael和埃默马·吉卜勒,以获得技术支持。Jimmy Botella教授提供纯合coi1-21突变种子。悉尼大学南方奖学金被授予EB。
资金
EB通过西悉尼大学获得了澳大利亚国际研究生奖学金。西悉尼大学为进行实验提供了研究资金。
作者信息
隶属关系
贡献
CIC和EB构思了一些想法并设计了研究。EB进行实验。EB在初级主管CIC的协助下撰写稿件,分析数据,准备数据。由DT、ZC和AP共同监督,所有作者对稿件进行编辑。作者阅读并批准了最终稿件。
通讯作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用本文
陈志辉,陈志华。,组织,D。等。之前曝光的拟南芥幼苗加剧了茉莉酸介导的病原体的防御。BMC植物杂志20,548(2020)。https://doi.org/10.1186/s12870-020-02759-9
已收到:
接受:
发表:
关键词
- 机械应力
- 病情养殖病原体
- 茉莉酸
- 压力启动
- alternaria brassicicola.
- 灰葡萄孢