摘要
背景
花生是世界上最重要的油料作物之一。非生物胁迫,特别是干旱,会使花生的品质和产量显著下降。因此,这将有助于全面了解花生干旱应答转录调控活性,并有望从中提取关键的耐旱相关分子机制。
结果
在这项研究中,两个花生落花生hypogaeaL.品种,NH5(耐受性)和FH18(敏感),其显示出显着的差异耐水性,从23个主要的商业花生品种中筛选,用于生理表征和转录组分析。NH5叶片显示出更高的水和GSH含量,更快的气孔闭合,更低的相对电导率(REC)比FH18更低。在干旱治疗的时间过程中,0小时(CK),4小时(DT1),8h(DT2)和24小时(DT3),下调差异表达基因(DEGS)的数量随着进展而增加治疗在花生品种中的干旱表明对转录om对转录om的抑制作用。
结论
然而,NH5比FH18保持更稳定的转录组动力学。此外,所识别的DEG的注释暗示信号转导,消除反应性氧物质,以及维持细胞渗透潜力,其是关键的耐旱性途径。最后,从ABA和SA组分检查的证据表明,NH5中的快速气孔闭合可能通过SA而不是ABA信号传导。总而言之,这些结果为我们提供了对花生干旱响应性转录组变化的全面概述,可作为进一步鉴定花生和其他油作作物中的分子干旱耐受机制的坚实基础。
背景
花生(落花生hypogaeaL.)是人类饮食中油和蛋白质的主要来源之一。其丰富的营养价值对人体心血管系统特别有益。花生种植园广泛地分布在发展中国家,从半干旱热带到亚热带地区[1,2].从历史上看,花生在中国农业经济中发挥了重要作用,仍然是目前中国出口作物的目前的佼佼者。年度中国花生产量达到1.3×710.2008年的吨[3.].尽管如此,干旱的花生质量和产量往往严重减少。受干旱引起的花生生产的全球损失约为600万吨[4].今天上升的全球干旱表现出频率较高,持续时间较长和更广泛的范围。还预计全球干旱的频率和严重程度将在接下来的30-90岁期间继续进展到严格的水平[3.].
一旦发生干旱,作物的正常生长将被禁止,导致减产甚至无收。最近的研究表明,干旱胁迫会影响各种生物过程,包括水分生理、养分吸收、酶活性、光合作用和同化物运输[5,6,7].受干旱胁迫下的植物可以通过改变基因表达模式来调整它们的形态,生理和代谢过程[8].一般来说,某些转录因子(TFs)的表达会受到植物激素信号的调控,进而诱导多个应激应答基因[9,10.,11.].更具体地,干旱胁迫通常刺激脱硅酸(ABA),乙烯(Eth)和水杨酸(SA)信号传导途径,其可以指导植物产生卵黄调节物质以维持细胞渗透电位和抗氧化酶以重新建立氧化余量[12.,13.,14.].此外,植物还可以关闭气孔、加厚角质层、硬化细胞壁来提高抗旱性。
直到最近,已经进行了转录组研究,以获得对花生生物学各种观点的分子机制的见解。例如,陈等人。在花生品种yueyo7的年轻豆荚中测序转录om试图研究为什么只有当他们到达土壤时才能发起年轻豆荚的[15.].另外,Wu等人。使用西班牙花生的叶子,茎和根答:hypogaeal通过转录组分析表征花生不同的发育阶段[16.].此外,Cui等人。在盐胁迫的LH14芽和根组织中测序转录组,以研究盐胁迫对花生的影响[17.].相比之下,只有几项转录组研究报告,目的是花生中的干旱相关分子机制。Shen等人。研究了FH1耐旱品种的叶片中的干旱转录om,七天干旱治疗后揭示了转录变化[18.].Brasileiro等人的另一项研究。HAVE分析了来自野生花生组织的转录om,其强调十一天[19.].另一方面,Zhao等人专门研究了另一种耐旱花生品种J1的根组织对较短干旱(2天)的转录组反应[20.].考虑到上述三种干旱转录组研究,证据表明,干旱胁迫可以诱导诸如ABA相关,碳代谢相关,相关的脯氨酸相关和与光合作用相关和光合作用相关的基因套件的差异表达变化。尽管如此,花生耐旱机制的分子研究仍处于初步阶段,特别是由于其巨大的同种异体四倍体基因组大小。
转录组测序技术已成为分析植物耐旱性分子机制的重要工具。目前,rna测序(RNA-Seq)可以提供丰富的DEGs、转录本结构、新转录本和异构体、选择性剪接和等位基因特异性表达等信息[21.].RNA-Seq已成功应用于布谷鸟、马叶草和棉花的耐旱分子机制分析[8,22.,23.]以及其他作物植物,如扁豆,荞麦和小米[24.,25.,26.].这些研究丰富了我们对转录水平的植物耐受的有用信息大量有用的信息。
具有显着不同应力耐受性的品种的转录组比较是分析某种作物中分子应激反应的有效策略[27.].在整个干旱响应机制中,早期干旱响应通常是上游调控事件,而不是后期干旱响应,因此填补早期干旱引起的花生分子动态变化的知识空白具有特别重要的价值。因此,我们选择了2个在筛选中表现出抗旱性差异的商业花生品种(敏感型FH18和耐型NH5)作为研究材料。采用幼苗期PEG-6000处理模拟干旱胁迫条件。通过测定生理指标,监测花生幼苗在连续干旱胁迫下的生理状态。利用RNA-Seq技术分析不同胁迫时间点叶片FH18和NH5的转录组。研究干旱胁迫下花生的转录组谱,以期深入了解花生苗期抗旱的分子机制。
结果
花生抗旱
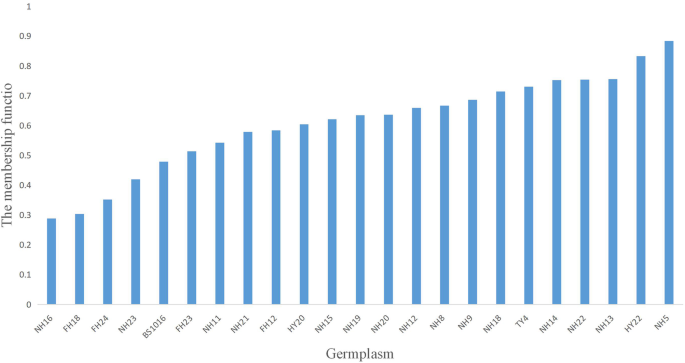
近年来,我国东北地区花生种植面积不断增加。为评价现有花生种质在干旱条件下的表现,为花生干旱生物学研究寻找合适的研究材料,对23个具有代表性的商业花生品种进行了耐旱性试验。模拟干旱胁迫24 h后,3个供试品种的相对鲜重(FW)、枯萎指数(WI)、叶片失水率和电导率均存在差异(表5)S1).抗旱水平用计算的“隶属函数”表示(如“材料和方法”中所述)。在该方法下,最耐旱品种为NH5和HY22,评分分别为0.884和0.833。耐旱性最差的品种是FH18和NH16,等级分别为0.304和0.288,NH5含量约为36%(图1)。1).因此,选择FH18和NH5作为干旱敏感和耐旱花生品种,因为它们的开发彼此同步。
花生干旱反应分析
由于FH18(敏感型)和NH5(耐型)幼苗在第4叶期生长旺盛(图1)。2),在该阶段的幼苗检查由连续模拟干旱应激引起的表型变化。首先,当干旱治疗延长时,来自两种品种的叶片表现出明显的衰弱。然而,FH18叶枯萎在于比NH5的更严重程度(图。2).例如,FH18叶子在DT1(4小时)下开始下垂,而可以在NH5叶同时观察到明显的变化。在DT2(8h),FH18叶片显着枯萎,但仅叶片仅部分枯萎(图。2).这些结果表明,NH5在干旱条件下比FH18能保持较高的叶片水分含量。
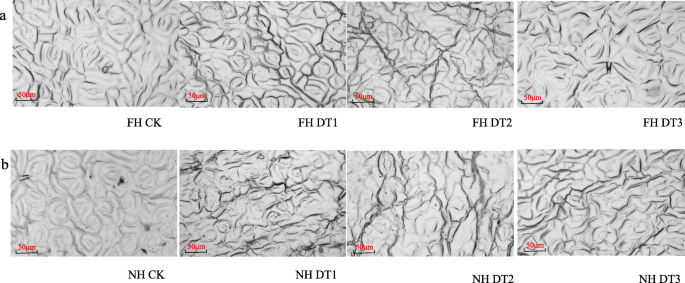
气孔是植物的重要网关,以控制叶片表面和大气之间的碳和水交换。基于上述观察结果,预期在不同干旱治疗时间周期内的FH18和NH5之间将鉴定不同的气孔闭合模式。如所预期的那样,两种花生品种的气孔在干旱胁迫下保持开放(图。3.).NH5,但不是FH18,在DT1上显示气孔闭合(图。3.).在DT2和DT3,两种花生品种的气孔都闭合(图。3.).这些结果表明,干旱条件导致NH5叶片的气孔快速关闭,而不是FH18叶片的气孔关闭,这可能是导致NH5叶片失水速度较慢、叶片含水量高于FH18的原因(图1)。2).
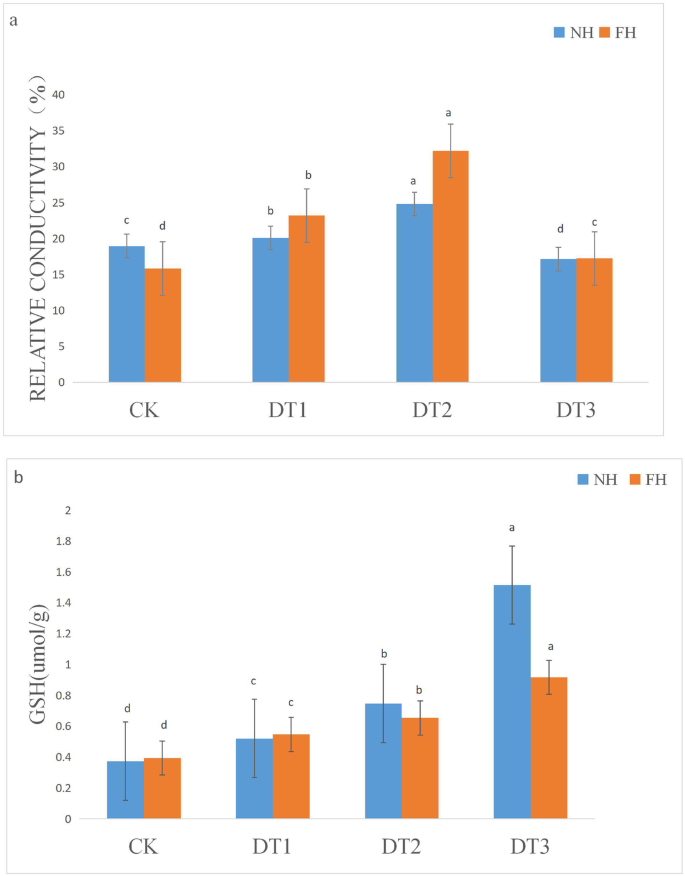
相对电导率(REC)是用于反映质膜中的渗透调节至应力的折射率。在干旱条件下,较低的REC值与调整渗透平衡的能力增加相关。这允许更高的耐旱性。如图1所示。4A,NH 5的REC值低于DT1和DT2的FH18(相对突录增加,与CK的CK:1.81%在DT1的FH18中的NH18,NH1中的5.85%和16.36%在DT2的FH18中的5.85%)(P < 0.01). These data suggested that NH5 preserved better plasma membrane osmotic adjustment ability than FH18.
减少的谷胱甘肽(GSH)是活性氧(ROS)最有效的清除剂之一。测定FH18和NH5样品中的GSH含量(图。4b)。在控制条件下,两种花生品种之间的GSH含量没有显着差异。随着干旱治疗进展,GSH含量在花生品种中增加,但这些增加的幅度不同。与CK组相比,DT1,DT2和DT3在DT1,DT2和DT3中的GSH含量分别增加0.15mol / g,0.37mol / g和1.4mol / g,而DT1,DT2和DT3的FH18增加0.15 mol/g, 0.26 mol/g and 0.52 mol/g, respectively (P < 0.01), about 40% of that of NH5 at DT3. These results showed that drought stresses induced higher GSH contents in NH5 and therefore NH5 contained stronger ROS scavenging capabilities than FH18.
转录组测序和组装
使用Illumina 2000对来自FH18和NH5幼苗进行的转录om,其进行了不同程度的应激水平,并构建了总共24种转录组文库(每次点时每种种类的三个文库重复)。去除低质量读数后,获得177.69 GB的清洁数据。每个样品的清洁数据达到5.90 GB,Q 30碱基的百分比为94.62%以上。每个样品的清洁读数与指定的参考基因组对齐,对准效率范围为94.47至97.49%。基于比较,替代剪接预测分析和基因结构优化分析,发现了6940个新基因(表S2).
表达分析
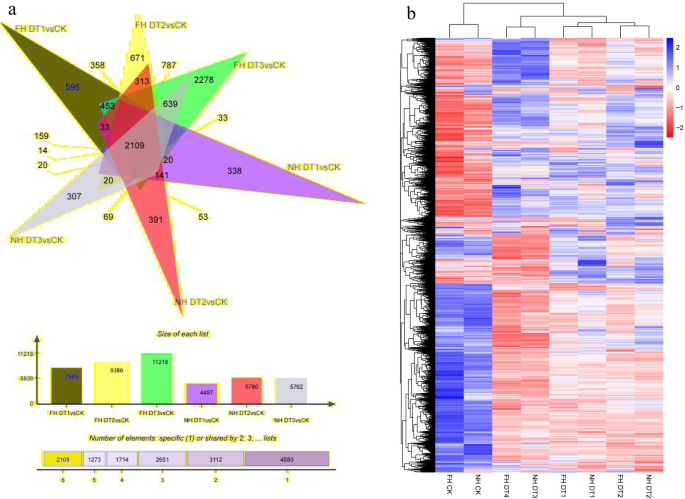
干旱胁迫可以诱导基因表达模式的显着变化。因此,根据其差异表达水平提取逐渐提取我们序列样品中的差异表达基因(DEGS)。然后,用这些鉴定的次数进行功能性注释和富集分析。DT1,DT2和DT3的FH18的DEG分别鉴定为7989(上调3709 /下调4280),9386(上调4052 /下调5334)和11,218(上调4881 / Down-incumput 6337).相反,在DT2和5762的DT1,5780(上调2673 /下调3107)的DT1,5780(上调2673 /下调3107),在DT2和5762(上调2585 /下调3177)时,NH5的含量为4497(上调2673 /下调3107)DT3。显而易见的是,在每次点DH17的每次点都会显着脱离NH5。例如,DT3的FH18次数的数量几乎是11,218几乎是NH5°的两倍。这些次数差异所示,干旱胁迫可以诱导FH18基因组中的更多动态转录组变化而不是NH5基因组。在另一个单词中,NH5似乎能够在干旱条件下保持更稳定的转录组。 Furthermore, the number of down-regulated FH18 DEGs was ~ 30% more than the number of up-regulated DEGs at both DT2 and DT3. As of NH5 DEGs, these ratios were ~ 15% at DT2 and ~ 20% at DT3. These results suggested that drought- stresses within 24 h exerted more down-regulatory impacts on peanut transcriptomes. In addition, this drought-induced down-regulatory impact on transcriptomes appeared to be relatively minor for NH5 than for FH18. Taken together, the differences in DEGs between NH5 and FH18 provided a justified reflection of different molecular basis underlying NH5 drought-tolerant and FH18 drought-sensitive phenotypes. Last, cluster analysis was carried out with identified differential genes (Fig.5b)。
功能注释的DEGS
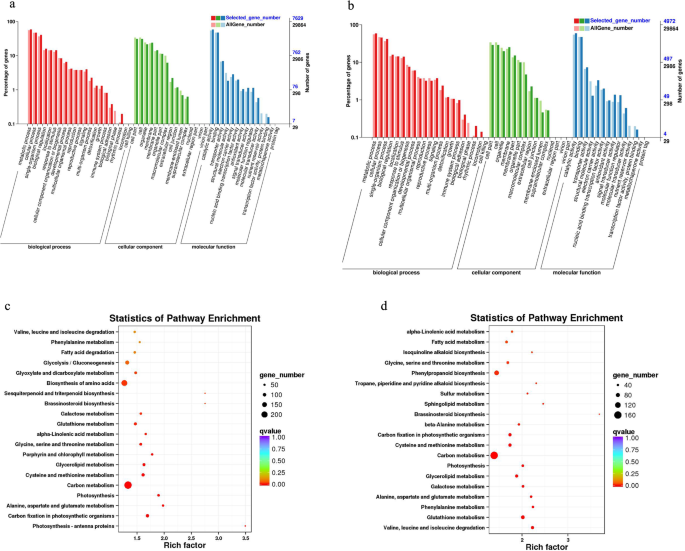
为已识别的DEGS进行功能注释(参见表S3对于每个差异基因集合注释的基因的统计数字)。分别对FH18和NH5中的DEGs进行GO分类。将匹配的DEGs分为三个功能类别:生物过程、分子功能和细胞成分(图1)。6A和B)。在生物过程的类别中,最丰富的基因属于“代谢过程”和“细胞过程”。在细胞组分类别中,“细胞部件和细胞”中的基因数最高。在分子功能类别中,DEG主要属于“结合”和“催化活性”亚组。为了鉴定在两种花生品种中富含DEG的活性生物途径,搜索了KEGG路径数据库(图。S1).KEGG富集分析结果如图所示。6C和D具有最小的重要Q值指示的前20个顶级路径。虽然FH18和NH5共享相似的途径富集模式,但富集基因的数量和富集基因的表达水平相当不同(表S4和S5).富集的途径包括与丙酸相关的GSH相关的谷胱甘肽代谢,糖酵解,乙酰酸和二羧酸酯代谢。角膜和蜡的途径是非原因;脂肪酸降解与地层骨髓有关;碳固定;光合作用 - 天线蛋白;光合作用;缬氨酸,亮氨酸和异氨基氨基酸的降解;并且还富集了卟啉和叶绿素代谢。此外,几种途径仅富含耐旱品种,NH5:丙氨酸代谢; sulfur metabolism; sphingolipid metabolism; phenylpropane biosynthesis; isoquinoline alkaloid biosynthesis; and the biosynthesis of tropane, piperidine, and a pyridine alkaloid.
花生干旱耐受性相关的基因和途径
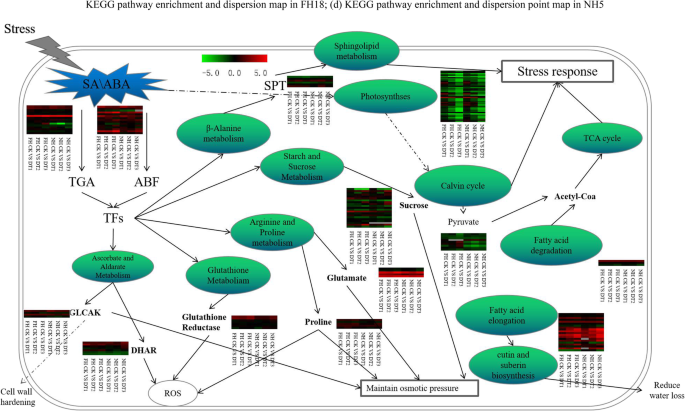
为了探索花生的耐旱机制,我们检查了FH18和NH5中潜在干旱耐受基因的转录变化。我们发现与ABA和SA信号转导相关的基因显着上调,包括16个ABF基因和二十二个TGA(TGACG基序系数)基因(表S6).与FH18转录om相比,一些基因仅在NH5中差异表达。这些NH5特异性可分为各种生物途径。其中,将十四个基因鉴定为ROS-清除基因(表S7)属于谷胱甘肽新陈代谢和脯氨酸代谢。三十三个渗透潜力调节基因(表S7)受到精氨酸,脯氨酸,蔗糖和淀粉的代谢。4个细胞壁硬化相关基因和十四个Cutin和蜡代谢基因也富集来自NH5转录om,可疑影响水损失(表S7).参与花生防御反应的另一组基因在NH5中显示出比FH18更高的表达水平。另一方面,还鉴定了FH18特异性差异基因。然而,它们的表达模式表明这些基因被干旱处理抑制。此外,发现另外的126只可富集在主要的干旱响应性代谢途径中(表S7例如,鞘脂代谢,光合作用,丙酮酸代谢,脂肪酸降解和三羧酸循环。图2中示出了上述富集通路的相互作用图。7.
实时qPCR验证
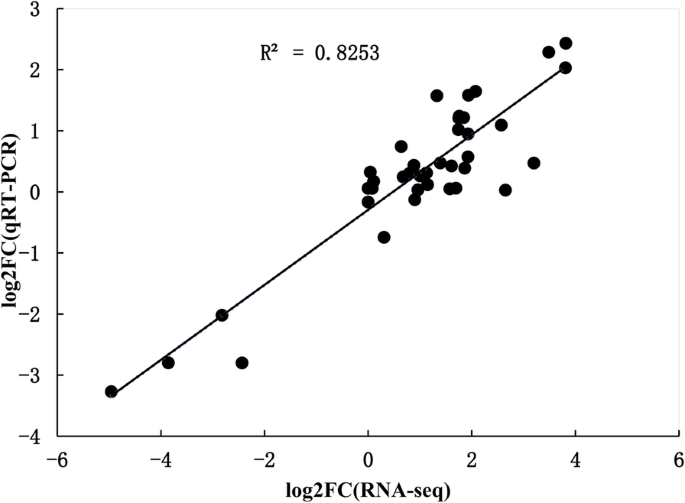
为了验证转录组数据集,应用了实时QPCR技术,以分析来自耐旱性途径随机选择的十个基因的转录水平。测量基因的相对表达水平并使用ARAH1.作为内参基因。这十个基因包括:丙酮酸脱氢酶;谷氨酸合成酶,胍丁胺脱亚胺酶同工酶X2,PXG,海藻糖6-磷酸合酶/磷酸酶,肌醇加氧酶2,谷胱甘肽S-转移酶, Cinnamyl乙醇脱氢酶,甘油激酶和enoyl-CoA水合酶.RT-PCR结果证实,这10个基因的转录变化与在转录组分析中观察到的折叠变化相当(图。8).
讨论
适应花生对干旱的压力
干旱压力是作物生长和生产力的主要限制因素之一。通常,植物干旱耐受性涉及各种生理和生物化学变化的组合,这是基于基因等级的协调表达。这种复杂的机制是植物遗传与外部环境变化之间的相互作用的结果[28.,29.,30.].在这项研究中,我们使用PEG-6000模拟干旱胁迫与转录体测序技术结合,分析了两种花生品种(FH18和NH5)中的耐旱性。与FH18相比,耐旱品种NH5显示出调节血浆膜和清除反应性氧(ROS)中调节渗透压的更强的能力。我们还观察到干旱诱导的气孔闭合,以减少FH18和NH5的水分损失,特别是NH5在4小时干旱处理中的更快气孔闭合。
Stratum Corneum生物合成和细胞壁硬化
Stratum Corneum是一种膜结构,可以保护植物在压力环境中。Stratum Corneum的生物合成测定其透水性等性质,因此是一种有效的节水机制,用于控制水损,通过影响地层基层组合物[31.,32.,33.].Stratum Corneum由蜡,cutin和多糖组成。蜡组成的各种脂族分子,主要是含有超过20个碳原子的长链脂肪酸(VLCFA)及其衍生物,包括伯醇,仲醇,醛,烷烃,酮和蜡酯[34.].与在面包小麦中的发现一致[35.],我们还发现蜡生物合成相关基因能够被干旱诱导。例如,脂肪酸酰基辅酶a还原酶(FAR)在我们的研究中是一个高表达的DEG。FAR的生物学功能被提议为蜡的生物合成提供初级酒精,因为以前的研究表明小麦品系缺乏tafar1叶片和花药蜡中的伯醇含量显著降低[36.].典型的cutin由环氧c16 / c18脂肪酸表示,其通过酯键交联以形成弹性聚酯结构[37.,38.].本研究中,我们发现干旱胁迫显著诱导了C18/C22合成基因的转录丰度。据推测,干旱胁迫下的花生层角质层可能主要由C18脂肪酸角质层和二十二烷酸蜡组成[37.].我们的结果提供了强有力的证据,表明Stratum Corneum的生物合成是一种重要的干旱耐受机制。此外,我们发现,Cutin-and Wax相关基因的促进诱导较强,但NH5比FH18更慢。考虑到NH5的更好的耐旱性,我们有信心提出Stratum Corneum主要在长期干旱条件下发挥其节水功能。
叶片细胞壁硬化是植物另一个已知的主要干旱反应。干旱胁迫下的植物通常水势较低,细胞壁硬化程度较高。植物细胞壁的硬化可以有效地导致叶片生长和水分蒸腾的减少。木质素与半纤维素共价结合可形成相互交织的网络,这是植物细胞壁硬化的分子基础。据报道,大豆和小黑麦在干旱条件下积累木质素使细胞壁变硬[39.,40].通过调节苯丙烷生物合成途径的干旱胁迫可以影响木质素的生物合成。诱导的苯基丙烷生物合成也能够影响花青素的生物合成,这反过来会促进植物角蛋白的形成[41.].在本研究中,我们发现苯丙烷生物合成途径仅在NH5中富集,而在FH18样品中不富集。因此,苯丙烷的生物合成可能是NH5比FH18更耐旱的重要分子机制。葡萄糖醛酸激酶(Glucosyluronic acid kinase, GLCAK)是一种参与果胶和半纤维素前体合成的基因[42.].据肖等人说。拟南芥Glcak突变体(删除突变体)表现出低于WT的耐旱性和可溶性 - 糖含量42.].在这项研究中,观察到Glcak的干旱诱导。该Glcak诱导可能能够导致细胞壁硬化和花生细胞中可溶性糖的积累,这可能会平衡渗透潜力并有助于抵抗干旱胁迫。
稳定的渗透潜力和罗斯清除
植物渗透电位的调节是防止干旱胁迫的防御机制[43.].在干旱条件下,渗透调节物质将积聚在植物中,维持细胞渗透潜力,Turgor压力和细胞体积的平衡[44.].脯氨酸是一种保护性渗透性调节剂。高水平的脯氨酸可以降低水势并增强抗氧化剂的ROS,如豌豆和STIPA Purpurea [45.,46.].蔗糖,一种可溶性糖,也在植物渗透调节中起重要作用。可溶性糖的积累可以增强吸水到细胞中[40,47.].类似于本研究的发现,Chieh-Qua可以通过增强碳水化合物代谢基因表达来增强其耐旱性[48.].谷氨酰胺还可以作为另一种抗干旱胁迫的渗透调节因子[49.].我们研究的结果表明,脯氨酸,蔗糖和谷氨酸的合成基因诱导可能是维持干旱胁迫花生中渗透渗透潜力平衡的分子基础。
植物倾向于在干旱胁迫下积累活性氧物质(ROS)。ROS可以过氧化血浆膜导致细胞死亡的严重病例[50.].相反,抗氧化剂也经常被观察到在干旱胁迫植物中积累,如谷子中的MDA [26.大麦中的黄酮类化合物[51.].谷胱甘肽还原酶(GR)和脱氢抗坏血酸还原酶(DHAR)是能有效清除自由基和保护植物生物的抗氧化酶[52.,53.].GR可以减少氧化 - 谷胱甘肽(GSSH)降低谷胱甘肽(GSH),其是自由基的清除剂和特定有机过氧化物的清除剂[54.,55.].在我们的研究中,发现GR和DHAR基因在干旱条件下令人上调。另外,GSH在耐受性NH5中的转录高于敏感品种FH18中的GSH。所有这些研究结果表明谷胱甘肽和抗坏血酸在花生干旱耐受机制中的重要参与。
ABA和SA信号转导途径
植物通常通过激活传导信号级联来响应外部刺激,所述信号级联来改变下游基因表达模式,最终实现生理和代谢适应[56.].本研究发现干旱显著诱导脱落酸(ABA)和水杨酸(SA)信号通路。ABA和SA是两种众所周知的植物激素,它们在触发干旱反应中起着关键作用[57.,58.,59.].核心ABA信号传导因子包括ABA受体(Pyl / Pyr),蛋白质磷酸酶2C(PP2C),SNF1相关激酶(SNRK2)和ABA反应元件结合因子(ABF)。在干旱条件下,ABA与Pyls / Pyrs结合以抑制PP2C,这导致SNRK2的促进。然后SNRK2激活ABF,以调节下游转录因子并启动ABA响应[34.,60.].干旱通常在植物中诱导升高的ABA水平,这将导致ABI1(Abel SON交助机蛋白1)与Pyl / Pyr受体的结合。一旦ABI1与Pyls / Pyrs结合,将释放ABI1的Slac1激酶的抑制,这又会导致阴离子通道的关闭,并最终气孔闭合[61.,62.].如珍珠谷子在干旱条件下ABA含量增加,调节气孔的开闭,减少失水,保持水分[63.].在本研究中,发现在FH18和NH 5品种中施加的ABA-生物合成相关基因的转录被干旱治疗显着诱导,表明ABA水平升高。另一方面,通过干旱处理在NH5和FH18中抑制了ABA受体帕尔/ Pyr相关基因。此外,我们的结果表明,阴性ABA信号调节剂PP2C也诱导,并通过干旱处理抑制阳性组分SNRK2,表明ABA敏感性降低。然而,在本研究中显着诱导了ABFS的转录水平,ABA下游转录因子。这些似乎对整个ABA信号级联的结果令人困惑地是承认ABA信号传导在花生干旱耐受机制中的复杂性和复杂累及的证据。最后,对Pyl / Pyr相关基因的干旱抑制表明Pyl / Pyr介导的Slac1释放将被抑制。因此,还应抑制Slac1介导的气孔闭合。由于NH5和FH18品种均显示口腔闭合响应,特别是NH5中的快速闭合,因此假设该气孔闭合反应可能不会通过Pyl / Pyr分子模块介导。
研究表明,SA应用于大麦植物,可以增强其旱差[64.].其他一些报告也证明了外源施用或内源积累SA对干旱胁迫的保护作用[65.].通过苯丙氨酸途径通过苯丙氨酸氨酶(PAL)催化,SA通过苯丙氨酸途径生物单曲。以前的研究表明,干旱胁迫可以通过增加PAL活性来增加SA内容物,从而改善植物干旱耐受性[66.].TGA系列转录因子是水杨酸(SA)途径的下游组分,在植物水压力防线中发挥重要作用[67.].也是Miura等人。据指出,SA可以促进气孔闭合并诱导防御基因的表达[58.].在本研究中,高度表达PAL和TGA基因表明SA信号传导参与了花生干旱反应。虽然SA可能占主导地位花生气孔闭合,但一些TGA基因仅在NH5诱导,这可能解释为什么NH5气孔闭合速度超过FH18。所有这些关于干旱诱导的所有这些发现都强烈地暗示了干旱应激的花生中的激素信号传导由ABA和SA激素引发,因此包括一种在花生中的高度复杂的干旱混凝分子机制。
结论
总之,我们首先表现了干旱强调花生的生理反应。然后我们使用RNA-SEQ技术获得了不同遗传物质的花生转录组数据集,以探索关键的干旱相关基因和代谢途径。我们的研究结果表明,在模拟干旱胁迫下,在花生中激活ABA和SA信号。与Stratum Cyneum生物合成,细胞壁硬化,ROS间隙和渗透压有关的基因的表达模式也有利于对干旱胁迫的抗性。所有这些调查结果都扩大了我们对花生干旱耐受机制的了解,可以促进未来的精英花生种质的繁殖。
方法
材料和增长
从沈阳农业大学获得了中国东北地区23个主要商业花生品种。其中16个项目已分别由国家和地方批准委员会正式确定,其他项目正在审查中。更详细的信息在表格中列出S8.花生种子在去离子水中进行预先涂覆,在28℃培养箱中在黑暗中发芽24小时。种植种子在沙子中种植,并在16 h / 8h光周期,60%湿度下生长,每隔一天补充有½会胡玉溶液的28℃。洗涤第4阶段的幼苗,用相似的高度洗涤,干燥,然后在Hoagland溶液中培养3天。通过将20%PEG-6000加入Hoagland溶液作为模拟干旱条件,并将未处理的Hoagland溶液用作对照条件。
干旱耐受筛选
处理24 h后,分别采集胁迫(S)和对照(CK)幼苗进行以下测量。除非另有规定,所有的测量都进行了三个独立的生物学重复。
失水率(RWL)测定:将第2片复叶(1.0 g)从植株上分离,立即称重,用于FW1.然后,将分离的叶子置于纱线网中并空气干燥2小时(远离风和阳光直射)。接下来,称重风干叶片FW2.然后将叶子在80°C的烤箱中烘干至恒定重量(DW)。烘箱干燥时间持续时间为(t1 - t2)。RWL的计算公式如下- 1·Min.- 1)=(FW1弗兰克-威廉姆斯2/ dw(t1-T.2).
测定植株相对鲜重(RFW):首先,随机选取3株幼苗作为每组独立的生物重复,分别测定和计算干旱胁迫组和CK组幼苗的平均鲜重。相对鲜重RFW的计算公式为:RFW =干旱处理植株平均鲜重/ CK植株平均鲜重。电导率:在室温(24°C)下,使用电导率仪(Orion-METTLER-FE30K)测量电导率,并按Xu等人的描述计算[30.].
测定枯萎指数:在目视评估花生枯萎等级。如上所述,花生种子萌发。在15厘米直径的花盆中种植发芽的种子,相同量的砂和16 h / 8h光循环,60%湿度和28℃的温度。每隔一天都补充了½会胡玉溶液。一旦达到第三个真叶阶段,停止浇水,并使土壤自然干燥。当土壤相对水含量达到75%时,每天花生植物的数码照片。即,在0年级:花生叶自然削弱并且是明亮而有光泽的;秆也坚定不移。在1年级:叶子开始失去水,叶子钝,顶部或两片叶子略微下垂。在2年级:植物继续失去更多的水,叶子的下垂增加。 At grade 3: some leaves were dry, hard, and curly. At grade 4: all leaves were drooping and shrinking and had turned yellow. At grade 5: leaves were completely dry and hard, and the plants had died. If the wilting degree was between two levels, it would be treated as a grade and a half.
综合指数计算
花生的相对干旱耐受性通过平均“隶属函数”方法来确定[68.].
“隶属函数”的公式如下:μxj = (Xj-X闵)/(X最大限度-X闵),在那里,对于某种品种,μxj为“J”性状的“隶属函数”;xj是“j”特征的值;和X最大限度和X闵分别是所有所考虑的品种中特征的最大值和最小值。为了避免由品种差异引起的错误,xj, X最大限度和X闵全部计算为“相对值”而不是“测量值”。相对值=在控制下压力/测量值下的测量值。
干旱治疗时间课程
FH18和NH5幼苗按照“材料和生长”部分的描述准备和处理。干旱处理时间由0 h (CK)、4 h (DT1)、8 h (DT2)和24 h (DT3)组成。在每个时间点采集幼苗的第二次复叶,用液氮冷冻后放入−80°C的冰箱中进行分析。
生理指标测量和气孔观测
为研究干旱诱导下FH18和NH5的表型变化,在处理组和对照组中随机选取幼苗第二次复合叶片,测定其生理指标。电导率的测量方法如上所述。还原性谷胱甘肽使用试剂盒(苏州科明生物技术公司)按照制造商的方案进行测定。用蔡司荧光阳性显微镜观察花生气孔[69.].所有测量都使用三个独立的生物学重复。
RNA提取和RNA-SEQ
用24个花生叶片样品(4个处理× 2个基因型× 3个生物重复)制备RNA。总RNA按照制造商的说明使用TRIzol试剂(Invitrogen, Carlsbad, CA, USA)提取。采用Agilent 2100对RNA质量进行评估。测序采用Wang等人的方法[27.].简而言之,使用与寡核苷酸(DT)偶联的磁珠进行分馏并富集MRNA。使用随机六烷烃和Ampure XP珠(Beckman Coulter,Beverly,USA)从mRNA中合成单链和双链CDNA。然后进行PCR富集以获得最终cDNA文库。为了将具有长度为240bp的cDNA片段分离,通过Ampure XP纯化文库。在安捷伦生物分析仪2100系统中评估了库质量。最后,Illumina 2000用于扩增图书馆。
数据分析
使用内置软件“perl脚本(perl脚本由生物标记公司(北京)提供)”来清除原始数据中的劣质读数。在进行下游分析之前,每个样本的clean reads都被映射到花生参考基因组数据库(https://www.peanutbase.org/data/public/arachis_hypogaea/tifrunner.gnm1.kyv3/arahy.tifrunner.gnm1.kyv3.genome_main.fna.gz.)使用Hisat(2.0.4版)软件。使用基因和基因组途径(KEGG)数据库的NCBI非冗余和京都百科全书进行注释所有基因。Deseq(1.10.1版)用于差异表达式分析和群集配置文件P-Value≤0.01和折叠变化≥2被认为是差异表达的基因(DEGS)[70].为了分析DEG的功能关系,我们基于GOGG数据库中的GOSEQ R语言包和途径进行了GO(基因本体)和KEGG浓缩[71.].使用超高度测试来测试全基因组背景的富集 - 意义。
中存在的验证
为了验证RNA-SEQ测序的准确性,可以随机选择10个推定的耐水性相关的次数用于QRT-PCR验证。ARAH1基因被用作参考基因。使用primer5设计基因特异性引物(表S9).在ABI Stepone Plus平台上进行QRT-PCR。在三种生物样品中分析每个基因,对每个生物样品进行三次反应重复。
可用性数据和材料
在SRA RACESSION下,在NCBI数据库中存放原始数据:PRJNA657965(https://www.ncbi.nlm.nih.gov/sra/PRJNA657965).
缩写
- cDNA:
-
互补脱氧核糖核酸
- CK:
-
控制组
- 度:
-
差异表达基因
- FPKM:
-
每千克/百万碎片的碎片
- 去:
-
基因本体论
- KEGG:
-
Kyoto基因和基因组的百科全书
- NCBI:
-
国家生物技术信息中心
- QRT-PCR:
-
定量实时聚合酶链反应
- RNA-seq:
-
RNA序列
- 阿巴:
-
脱落酸
- 山:
-
水杨酸
- 朋友:
-
苯丙氨酸氨裂解酶
- PP2C:
-
蛋白磷酸酶2摄氏度
- SNRK2:
-
SNF1相关激酶
- ABFS:
-
ABA响应元素结合因子
- abi1:
-
abel儿子互动蛋白1
- GSSH:
-
氧化谷胱甘肽
- 谷胱甘肽:
-
减少谷胱甘肽
- GRG:
-
谷胱甘肽还原酶
- 达尔:
-
脱羟基血酸盐还原酶
- GLCAKG:
-
Glucosyluronic酸激酶
- ROS:
-
清除活性氧
参考
- 1。
Sarkar T,Chineshappan R,Kumar A,Mishra GP,Dobaria JR。转基因花生赋予干旱和盐度应力的转基因花生赋予耐受性的异源表达。Plos一个。2014; 9(12):E110507。https://.https://doi.org/10.1371/journal.pone.0110507..
- 2。
Shoba D,Manivannan N,Vindhiyavarman P,Nigam Sn。通过在地生中膨胀的分离分析进行后叶斑病抗性抗叶斑病抗性的SSR标记(落花生hypogaeal.).Euphytica。2012;188:265 - 72。https://doi.org/10.1007/s10681-012-0718-9.
- 3.
戴A.全球变暖下干旱增加的观测和模型。这张2013;3:52-58。https://doi.org/10.1038/nclimate1633.
- 4.
Sarkar T,Chineshappan R,Kumar A,Mishra GP,Dobaria JR。转基因花生中Atdreb1a转录因子的应激诱导表达(落花生hypogaeal.)对土壤水分亏缺具有耐受性。植物科学与技术,2016;https://doi: 10.3389 / fpls.2016.00935。
- 5。
Fahad S, Bajwa AA, Nazir U, Anjum SA, Farooq A, Zohaib A.干旱和高温胁迫下的作物生产:植物响应和管理选择。植物科学进展2017;https://doi: 10.3389 / fpls.2017.01147。
- 6。
Khan FP, Upreti R, Singh P, Shukla K, Shirke PA。两种对比水稻品种在水分胁迫下的生理性能。植物生理学杂志2017;23(1):85-97。https://doi: 10.1007 / s12298 - 016 - 0399 - 2。
- 7。
Yousfi S,Marquez Aj,Betti M,Araus JL,Serret MD。基因表达与生理反应对对比囊肿的盐度和水胁迫。J Integ Plant Biol 2016; 58:48-66。https://doi.org/10.1111/jipb.12359.
- 8.
蔡毅,王jh,张l,宋j,彭立力,张某。生理和转录组分析突出了与旱润耐受的关键代谢途径杜鹃成为.physiolmol biol植物。2019; 25:991-1008。https://.https://doi.org/10.1007/S12298-019-00685.1..
- 9.
关键词:水稻,OsWRKY30, MAP激酶,抗旱性植物学报(英文版);2012;https://doi.org/10.1007/S11103-012-9941-Y..
- 10。
Ullah A,Sun H,Yang x,张XL。棉花干旱应对策略:每滴增加作物。植物Biotechl J 2017; 15:271-284。https://doi.org/10.1111/pbi.12688.
- 11.
熊璐,朱家康。植物反应对渗透压的分子和遗传方面。植物细胞环境;25:131-139。https://doi.org/10.1046/j.1365-3040.2002-00782-X..
- 12.
Miller G,Suzuki N,Ciftci-yilmaz S,Mittller R.反应性氧气物种稳态和干旱和盐度应力的信号传导。植物细胞环境; 33:453-467。https://doi.org/10.1111/j.1365-3040.2009.02041.
- 13。
Ranjan A,Pandey N,Lakhwani D,Dubey NK,Pathre UV,Sawant SV。对比染色草药基因型根系揭示适应旱涝的比较转录组分分析。BMC Genomics 2012; 13:680。https://doi.org/10.1186/1471-2164-13-680.
- 14。
关键词:干旱胁迫,矮牵牛花,游离脯氨酸,积累中国生物医学工程学报2005;https://doi.org/10.1093/jxb/eri195.
- 15.
陈晓,朱伟,Azam S,李辉,朱峰,李辉,等。花生地上和地下幼荚转录组的深度测序分析确定了与早期胚胎流产相关的候选基因。植物生态学报;2013;https://doi.org/10.1111/pbi.12018.
- 16。
wu n,matand k,吴h,李b,李y,张x。de novo nego-modenting,组装和注释落花生hypogaea西班牙植物型全株转录组。Theo App Genet 2013; 126:1145-1149。https://doi.org/10.1007/s00122-013-2042-8.
- 17。
刘崔F,隋N段G, Y,汉族Y,刘年代,Wan年代,李G .代谢物的识别和记录参与盐胁迫花生和恢复。植物科学与技术;2018;https://doi.org/10.3389/fpls.2018.00217.
- 18.
沈勇,志国娥,张旭,刘玉华,陈志东。花生耐缺水种质的筛选与转录组分析(落花生hypogaea).Acta physol sinica 2015; 37:12 - 13。https://doi.org/10.1007/s11738-015-1840-9.
- 19.
Braasileiro ACM,Morgante CV,Araujoacg,Leal-Bertioli Scm,Silva Ak,Silva从有限环境中探讨了野生植物的转录组谱分析,揭开了干旱耐受候选基因植物Mol Biol rep 2015; 33:1876-1892。https://doi.org/10.1007/s11105-015-0882-x.
- 20.
赵Xb,李cj,万sb,张tt,燕cx,山sh。Arachis Hypogaea对干旱胁迫的反应中基因的转录组分析与发现。Mol Bio Rep.2018; 45:119。https://doi.org/10.1007/S11033-018-4145-4.
- 21.
RNA-Seq:转录组学的革命性工具。中国科学(d辑)2009;https://doi.org/10.1038/nrg2484.
- 22.
Acevedo RM,Avico EH,Gonzálezs,萨尔瓦多AR,Rivarola M,Paniego N.转录和代谢调整由干旱引发冬青属植物paraguariensis叶子。足底250:445 2019;462年。https://doi.org/10.1007/s00425-019-03178-3.
- 23.
Hasan Mu,Ma F,Islam F,Sajid M,Prodhan Zh,Li F.三棉中生物过程和关键途径的比较转录组分析(Gossypium spp。)在干旱胁迫下的物种。2019年INT J MOL SCI; 20:2076。https://doi.org/10.3390/ijms20092076.
- 24.
侯z,尹j,鲁y,宋j,王某,魏某的转录组分析揭示了普通荞麦中生理过程和基因表达的时间和空间变化(fagopyrum esculentum moench)在干旱胁迫下长大。农学2019; 9:569。https://doi.org/10.3390/agronomy9100569..
- 25.
Morgil H,Tardu M,Cevahir G,Kavakli Ih。对水干敏感扁豆的比较RNA-SEQ分析(镜片玉米粉)在短期和长期的水赤字下的根和叶子。有趣的Integ基因组学2019; 19:715-727。https://doi.org/10.1007/S10142-019-00675-2..
- 26.
张yy,高XL,李继,龚x w,杨p,gao jf等。Proso Millet的比较分析(Panicum Miliaceum.L.)叶片转录组,洞察耐旱机制。植物生物学(英文版)https://doi.org/10.1186/s12870-019-2001-x.
- 27.
王WS,赵XQ,李米,黄丽,徐JL,张F.比较转录组和代谢组分揭示水稻幼苗耐受性的复杂分子机制。j Exp Bot 2016; 67:405-419。https://doi.org/10.1093/jxb/erv476.
- 28.
黄宝华,黄建平。植物耐盐性的生理生化和分子生物学研究。植物学报,2011,51(3):461 - 468。中国生物医学工程杂志2014;https://doi.org/10.1155/2014/701596.
- 29.
熊璐,朱家康。脱落酸生物合成的调控。植物杂志。2003;133:29-36。https://doi.org/10.1104/pp.103.025395.
- 30.
徐杰,金杰,赵立,李吉。不同血浆的杨树Ussuriensis克隆的干旱胁迫耐受性分析。j 2019林业res; 30:1267-1275。https://doi.org/10.1007/s11676-018-0729-z.
- 31。
AsaPH A,Shital D,Reinhard J,Eveline T,Gert Va,Andy P. AP2结构域转录因子的光泽疏水液激活蜡生物合成,改变角质层的性质,并在过度表达时赋予耐旱耐受性拟南芥.植物细胞2004;16:2463 - 2480。https://doi.org/10.1105/TPC.104.022897.
- 32。
Menard R,Verdier G,Ors M,Erhardt M,Beisson F,Shen Wh。组蛋白H2B单体化涉及Cutin和WAX组合物的调节拟南芥蒂利亚纳.植物细胞基础二2014; 55:455-466。https://doi.org/10.1093/pcp/pct182..
- 33。
王M,何谢,江B,刘瑞,林烨,谢DS等。不同Chieh-Qua品种的转录组分析为干旱应激反应提供了新的见解。工厂Biotech Rep 2019; 13:1-13。https://doi.org/10.1007/S11816-019-00564-019-00564-019-00564-019-00564-019-00564-019-00564-019-.
- 34。
raghavendra,甘肃杜本群vk,Christmann A,格栅E. ABA感知和信令。趋势工厂SCI 2010; 15:395-401。https://doi.org/10.1016/j.tplants.2010.04.006.
- 35。
Ma J,张Y,Wang H.等。在面包小麦的田间条件下干旱敏感时期的差异表达基因和富集的途径。植物MOL BIOL 2019; 37:389-400。https://doi.org/10.1007/s11105-019-01163-4.
- 36。
王W,刘X,GAI X,Ren J,Liu X,Cai Y,Wang Q,Ren H.Cucumis巨大成功l.Wax2在蜡生物合成中起着枢轴作用,影响花粉生育和植物生物和非生物应激反应。植物细胞生理,2015A; 56:1339-1354。https://doi.org/10.1093/pcp/pcv052.
- 37。
Bakan B,Marion D. Cutin聚酯组装:从细胞到细胞外细胞壁。植物。2017; 6:E57。https://doi.org/10.3390/plants6040057.
- 38。
Fich Ea,Segerson Na,Rose JKC。植物聚酯CUTIN:生物合成,结构和生物学作用。ANN Rev Plant Biol 2016; 67:207-233。https://doi.org/10.1146/annurev-arplant-043015-111929..
- 39。
Hura T,Hura K,Dziurka K,Ostrowska A,BąCzek-Kwinta R,Grzesiak M.细胞壁束缚酚类含量的增加与土壤干旱下的小教徒的生产率相关。J Plant Physiol 2012; 169,1728-1736。https://doi.org/10.1016/j.jplph.2012.07.012.
- 40。
acta photonica sinica, 2011, 38(5): 689 - 693 .张建平,张建平。水分胁迫对大豆主根生长响应的影响。植物学报,2011,38(5):689 - 693。I.蛋白质组学分析揭示了苯丙类代谢的区域特异性调控和延伸区游离铁的调控。植物细胞环境2010;33223 - 243。https://doi.org/10.1111/j.1365-3040.2009.02073.x..
- 41。
白Z,王t,吴y,王k,梁qy,pan yz等。差异表达基因的全转录组序列分析新西兰麻tenax在干旱压力下。SCI REP 2017; 7:41700。https://doi.org/10.1038/srep41700.
- 42。
萧wj,胡s,周xx,姚丽,罗杰,袁迪,等。Arabidopsis,Atglcak中的葡萄糖蛋白酶基因通过调节糖代谢而参与干旱耐受性。植物MOL BIOL REP。2017; 35:298-311。
- 43.
Lorenz WW,Alba R,Yu Ys,Bordeaux JM,SimõesM,Dean JFD。微阵列分析和无规模的基因网络识别洛杉矶的干旱源性植物中的候选调节剂(p . taedal.).BMC染色体组。2011;12:264。https://doi.org/10.1186/1471-2164-12-264.
- 44.
ashraf m,诺福德先生。甘氨酸甜菜碱和脯氨酸在提高植物非生物胁迫性中的作用。Environ Exp Bot 2007; 59:206-216。https://doi.org/10.1016/j.envexpbot.2005.12.006.
- 45.
SánchezFJ,Manzanares M,De Andres Ef,Genorio JL,Ayerb,L. Turgor维护,渗透调节和可溶性糖和49豌豆品种的脯氨酸积累,以应对水分胁迫。现场作物res 1998; 59:225-235。https://doi.org/10.1016/s0378 - 4290 (98) 00125 - 7.
- 46.
杨玉克,李X,孔XX,MA L,HU XY,杨YP。转录组分析揭示了沿着藏高原的干旱梯度对Stipa Purpurea的多样化适应。Func Integ基因组学2015; 15(3):295-307。https://doi.org/10.1007/S10142-014-0419-7.
- 47.
潘海燕,周瑞,路易GV, Muhlemann JK, Bomati EK, Bowman ME。肉桂酰辅酶a还原酶和肉桂酰醇脱氢酶的结构研究,这是单酚生物合成的关键酶。植物细胞2014;26:3709 - 3727。https://doi.org/10.1105/TPC.114.127399.
- 48.
王米,他x,江b。等。不同Chieh-Qua品种的转录组分析为干旱应激反应提供了新的见解。植物Biotechnol rep 2019; 13:663-675。https://doi-org-s--bjmu.naihes.cn/10.1007/s11816-019-00564-X。
- 49.
TEGEDER M,Masclaux-DAUBresse C.氮气运输的源和水槽机制。2018年新的Phytol; 217:35-53。https://doi.org/10.1111/nph.14876.
- 50。
Haupt H,Fock HP。在光合作用期间水分应激中碳的碳交换有关的氧气交换。ANN BOT 2002; 89:851-895。https://doi.org/10.1093/aob/mcf023.
- 51。
洪燕,倪世杰,詹广平。转录组和代谢组分析揭示了干旱胁迫下大麦麦芽品质的调控网络和关键基因。植物生理学与生物化学;https://doi.org/10.1016/j.plaphy.2020.04.029.
- 52。
Begaramorales JC,Sánchezcalvob,chaki m,matapérezc,valderrama r,padilla mn。硝化和S-亚硝基化型单羟基血基岩还原酶和谷胱甘肽还原酶的差分分子响应。J Exp Bot 2015; 66(19):5983-5996。https://doi.org/10.1093/jxb/erv306.
- 53。
关键词:超氧化物歧化酶;抗逆性;植物生物学杂志1992;43:83-116。https://doi.org/10.1146/annurev.
- 54。
关键词:植物,非生物胁迫,活性氧,抗氧化机制植物生理学学报2010;48:909-930。https://doi.org/10.1016/j.plaphy.2010.08.016.
- 55。
张飞,万旭,郑勇,孙磊,陈强,朱旭,等。氮素对镉胁迫下杨树叶片抗氧化酶活性及基因表达的影响植物生态学报2013;https://doi.org/10.1080 / 17429145.2013.879676.
- 56。
Osakabe Y,Osakabe K,Shinozaki K,Tran LS。植物对水胁迫的反应。前植物SCI 2014; 5:86。https://doi.org/10.3389/fpls.2014.00086.
- 57。
Fragnière C, Serrano M, Abou-Mansour E, Métraux JPL, Haridon F. Salicylic acid and its location in response to bioand非生物胁迫。1852年2月列托人585:1847 2011;。https://doi.org/10.1007/S10457-012-9563-Z..
- 58。
杨志明,李建平。水杨酸对水、盐和低温胁迫的调节作用。植物营养与肥料学报。植物科学与技术;2014;https://doi.org/10.3389/fpls.2014.00004.
- 59。
PIZZIO GA,RODRIGUEZ L,ANTONI R,GONZALEZ-GUZMAN M,Yunta C. PYL4 A194T突变体揭示了Pyr1-Like4 /蛋白磷酸酶2CA相互作用对脱落酸信号传导和植物抗旱的关键作用。植物理性。2013; 163:441-455。https://doi.org/10.1104/pp.113.224162.
- 60。
藤田y,yoshida t,yamaguchi-shinozaki k。富含血管介导的转录的ASB / ABF-SNRK2途径的关键作用,以响应植物渗透压的渗透胁迫。2013年理物理植物; 147:15-27。https://doi.org/10.1111/j.1399-3054.2012.01635.x.
- 61。
Ma Y,Szostkiewicz I,Korte A,Moes D,Yang Y,Christmann A,Grill E等人。PP2C磷酸酶活性的调节剂作为脱落酸传感器。科学。2009; 324(5930):1064-1068。https://doi.org/10.1126/science.1172408.
- 62。
多种钙依赖激酶调节aba激活的保卫细胞阴离子通道。摩尔种植2012;5(6):1409 - 1412。https://doi.org/10.1093/mp/sss084.
- 63。
太阳M,黄D,张A.等。基于PACBIO全长转录组测序的珍珠米热应激和干旱胁迫转录体分析。BMC植物BIOL 2020; 20:323。https://doi-org-s--bjmu.naihes.cn/https://doi.org/10.1186/s12870-020-02530-0..
- 64。
水杨酸对大麦水分亏缺反应的影响。植物生理学学报2005;27:379-386。https://doi.org/10.1007/S11738-005-0015-5..
- 65。
Abreu Me,Munné-博世S.水杨酸可能参与常年类干旱诱导的叶片衰老的调节:以田间种植的案例研究鼠尾草officinalisL. P含量。Environ Exp Bot 2008; 64:105-112。https://doi.org/10.1016/j.envexpbot.2007.12.016.
- 66。
关键词:大麦,水分亏缺,UV-B辐射,水杨酸环境实验机器人2013;94:9-18。https://doi.org/10.1016/j.envexpbot.2012.03.001.67.
- 67.
冯杰,程玉铮C.八薄草莓TGA基因的表达模式呈对促进盆地蚜虫感染的潜在作用。植物生物科技植物代表2020; 14,55-67。https://doi.org/10.1007/s11816-019-00582-9.
- 68.
Wassie M,张WH,张Q,Ji K,陈L.热应激对苜蓿生长和生理性状的影响(Medicago Sativa.L.)和耐热性的综合评价。农学 - 巴塞尔。2019; 9(10):597。https://doi.org/10.3390/agronomy9100597..
- 69.
孙明霞,彭峰涛,肖永元,于伟,张云飞,高海峰。外源磷脂酰胆碱处理能缓解桃根细胞膜的干旱胁迫,维持根细胞膜的完整性。Sci Hortic 2020; 259年。https://doi.org/10.1016/j.scienta.2019.108821.
- 70。
Cui G,柴H,尹H.杨米,胡庚,郭My,yi rglt,张p.全长转录组测序显示低温耐受机制Medicago Falcata.根。BMC植物BIOL。2019年;19(575)。https://doi.org/10.1186/s12870-019-2192-1..
- 71。
年轻MD,Wakefield MJ,Smyth GK,Oshlack A. RNA-SEQ的基因本体分析:选择偏差。Genome Bio 2010; 11(4):14。https://doi.org/10.1186/gb-2010-11-2-r14.
致谢
我们感谢生物标记公司(北京)在转录组测序方面的帮助。
资金
这项工作得到了中国国家重点研究和发展方案(2018YFD1000906)的资助。
作者信息
从属关系
贡献
J,XL L,JX Z,H J和HQ Y构思了这个想法。XL L,JJ R和JX Z进行了实验室工作。XL L,CY J和H Z执行了数据分析。XL L写了稿件,H j完成了最终修订版。所有作者都已经阅读并赞成最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图S1
.干旱胁迫下FH18和NH5之间的差异基因的差异基因。(a)与CK相比,FH18中的差异基因的KEGG注意;(b)与CK相比,NH5中差异基因的Kegg注意。
附加文件2:表S1
.在PEG处理下所有测试品种的表型研究。表提供了在模拟干旱胁迫后24小时的相对鲜重(FW),枯萎指数(Wi),枯萎指数(Wi),叶片水损失和导电性的数据。
附加文件3:表S2
.测序数据质量摘要。该表概述了干旱条件下花生叶的测序数据质量。
附加文件4:表S3
.DEG的功能评论。该表提供了所识别的DEG功能注释的结果。
附加文件5:表S4
.在FH18中的Kegg Pathway的浓缩结果。该表提供了富集基因的数量和富集基因的表达水平。
附加文件6:表S5
.KEGG途径在NH5中的富集结果。该表提供了富集基因的数量和富集基因的表达水平。
附加文件7:表S6
.干旱对ABA和SA的影响。该表提供了ABA和SA信号转导相关基因的表达水平。
附加文件8:表S7
.花生的耐旱机理。该表提供了花生抗旱相关基因的表达水平。
附加文件9:表S8
.试验中使用的花生品种。该表提供了试验中所使用的花生品种的详细资料。
附加文件10:表S9
.QRT-PCR在本研究中验证的引物序列。该表提供了本研究中的QRT-PCR验证的引物序列。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
江,C.,李,X.,Zou,J.等等。涉及两种花生干旱应激反应的基因的比较转录组分析(落花生hypogaeal .)品种。BMC植物BIOL.21日,64(2021)。https://doi.org/10.1186/s12870-020-02761-1.
已收到:
接受:
发表:
关键词
- RNA-SEQ.
- 植物激素
- 花生落花生hypogaeaL.
- 干旱胁迫