摘要
背景
组织培养是核桃快速育苗和提高生产效率的有效方法,但外植体褐变是核桃组织培养的关键限制因素。具体来说,导致核桃外植体褐变的ppo衍生的醌类聚合还不清楚。研究了“Zanmei”核桃芽尖外植体在琼脂(A)和蛭石(V)培养基中培养的成活率、酚类物质含量、POD和PPO活性的变化JrPPO研究了PPO在核桃外植体中的表达,探讨了PPO在核桃外植体褐变中的作用。
结果
结果表明,V培养基大大降低了外植体的死亡率,V培养基和A培养基培养的外植体存活率分别为89.9和38.7%。与0 h外植体相比,A培养的外植体PPO活性较高,而V培养的外植体PPO活性较低。A培养的外植体在72 h时酚含量显著增加,但随后下降;V培养的外植体在144 h时酚含量上升到较高水平。V培养的外植体中过氧化物酶活性较高,但不引起褐变。基因表达分析显示JrPPO1公司在A和v培养的外植体中JrPPO2型在整个培养物中培养的外植体上调,并在144小时内上调v。JrPPO在不同组织中的表达分析表明JrPPO1公司在茎、幼叶、成熟叶、花絮、雌蕊和果壳中高表达JrPPO2型在成熟叶片和雌蕊中表达量高。褐变分析表明,A和叶片组织的外植体均表现出较高的JrPPO2活性。
结论
酚类物质含量的快速增加导致外植体褐变和死亡。V培养基在短期内延缓了核桃外植体酚类物质的快速积累,显著降低了外植体的死亡率。结果表明JrPPO2型在枝条损伤后外植体的酚类氧化过程中起关键作用。
背景
胡桃木(juglans regia.又名波斯胡桃,属于胡桃科,原产于欧洲东南部、亚洲西部和中国西南部[1,2].由于其坚硬的木材和营养丰富的坚果,这种植物广泛分布在世界各地,除了南极洲[3.].近年来,随着改良品种的发展,优良品种育苗越来越受到农民的欢迎。然而,传统的嫁接育苗方式效率低,极大地限制了优良品种的繁殖和推广[4].在过去几年中,组织培养已成为快速育种幼苗的有效方法,提高生产效率[5].尽管如此,脱南褐变是限制核桃组织培养的关键因素之一[6,7]. 采用多种方法降低核桃外植体组织褐变的发生,但效果不理想[7,8,9].
酶促褐变是植物组织培养中脱蛋白褐变的主要原因[4]. 一般来说,多酚氧化酶(PPOs)和过氧化物酶(POD)是引起褐变的主要酶[10.].当外植体被切开时,细胞会受损,酚被释放出来,并被酶氧化成醌,从而导致酶褐变[11.].此外,酶反应形成的醌可以与蛋白质形成交联,也可以通过脱水、聚合等一系列复杂的生化反应在组织中聚合,生成深色黑色素化合物,破坏组织代谢,抑制生长,最终,引起外植体褐变和死亡[12.,13.,14.].PPOs是导致酚类化合物氧化的主要酶[15.].酚类化合物被PPOs氧化成醌类衍生物,并进一步氧化形成色素黑色素,这种色素存在于生物体中,负责褐变反应[16.]. PPOs是一类含铜的酶,能催化蛋白质的合成o单酚-羟基化反应生成o- 苯酚(酪氨酸酶活性)以及氧化o-二酚类到醌类(儿茶酚酶活性)在氧气存在下[17.]. PPOs在动物中有几个明确的作用,包括皮肤/外骨骼色素沉着和角质层硬化[18.]. 与动物和真菌PPOs不同,许多植物PPOs缺乏单酚氧化酶活性。然而,PPOs在核桃中表现出较高的单酚酶活性[19.]. 在体内,PPO活性通常与衰老、损伤或受损的植物组织有关,在这些组织中细胞的间隔化丢失[18.].然而,PPO在植物中的生理作用仍然尚不清楚,大多数相关的植物研究主要集中在PPO中PPOS在POSTHAROST褐变中的作用,其中植物组织由于PPO产生的Quinones的聚合而转动褐色,产生植物素化合物[20.,21.].
核桃枝叶富含酚类物质[22.,23.],这导致在培养过程中这些组织外植体产生的褐变易感性增加[24.].在过去的几十年里,外植体褐变一直是核桃组织培养的一个难题。PPO转录和活性在外植体褐变和存活中起关键作用。施(25.]报道的核桃接穗成活率与嫁接过程中酚类物质含量和PPO活性密切相关。Araji等人得出结论,PPO在次级代谢中发挥了新的和基本的作用,并作为细胞死亡的间接调节因子j . regia[17.].此前,PPO被描述为一种单基因(JrPPO1公司),编码具有单酚酶和二酚酶活性的蛋白质j . regia[26.];与其他植物中PPO酶的二酚酶活性相比,核桃PPO酶的活性是一个独特的特征。多年来,研究人员一直认为,核桃PPO活性仅受单一的调节JrPPO1公司基因,使其成为研究酶促褐变的理想模型[17.,27.].有趣的是,JrPPO1公司似乎在所有绿色组织中都有高水平的组成性表达,对伤害或茉莉酸甲酯治疗不敏感[26.].以前的研究表明,核桃 - 细菌枯萎的相互作用诱导JrPPO1公司表达及PPO活性[28.].Zekiri等人使用一种新的纯化方法,从j . regia树叶;这些同种型由单个氨基酸不同[19.].的第二个同源物PPO.(JrPPO2型)在基础上发现了j . regia基因组序列,但其作用机制基本上不清楚[29.].Panis报道称,与JRPPO2相比,JRPPO1对单苯酚表现出更大的活性,而JRPPO2则更加活跃o-双酚[30.].
在组织培养过程中,通过优化培养基类型和改善培养条件可以降低褐变率,这一直是组织培养研究的重点[6,7,8,9].有人提出,流体介质,如液体介质和半固体介质,可以有效降低外植体褐变,因为流动性好的介质中的有害物质可以随着时间扩散[31.,32.,33.]. 然而,其他研究表明,增加琼脂浓度和降低流动性可以减少外植体褐变,这可能与所用的特定材料有关[11.].在这项工作中,核桃外植体在两种不同类型的培养基中培养,即低渗透性琼脂和高渗透性蛭石。JrPPO在外植体中测定表达和酚醛含量水平,以阐明外植体褐变和褐变之间的关系JrPPOS以及为核桃组织培养提供新的方法和理论。
结果
外植体在不同培养基中的存活率
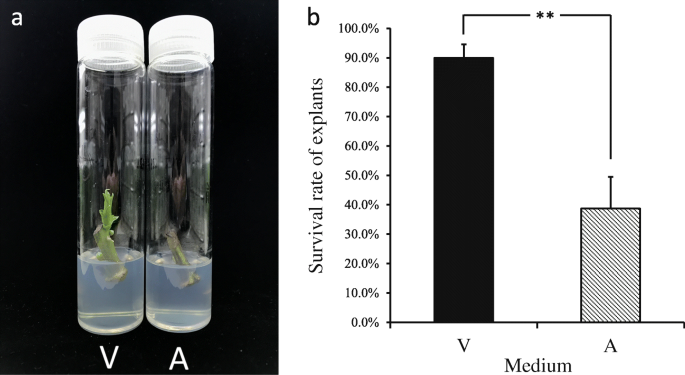
经过72小时后,在展现的严重褐变中培养的外植体,但观察到在V的外植体观察到较少的褐变。在144小时后,在减少的培养层和大多数培养基中培养的新鲜原植物的绿色着色是棕色的;然而,在V中培养的外植体表现出较少的褐变,几个芽旁的叶柄掉下来,这表明芽开始爆裂(图。1).培养7天后,将两个处理外植体转移到新鲜的a培养基中,再培养7天,计算成活率。与V培养基相比,在A培养基中培养的外植体表现出多处褐变,部分外植体芽萌发并发育正常(图5)。2a). a的外植体存活率仅为38.7%,显著低于V(89.9%)。2b)。总之,这些结果表明,Ⅴ中的初始培养显着降低了外植物死亡的百分比并改善了生存率。
外植体中酚类含量的变化
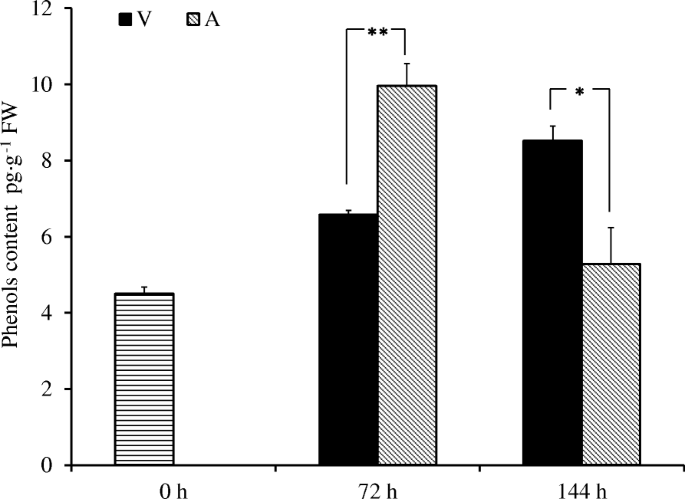
A和V的外植体在培养过程中酚类化合物的变化如图所示。3..酚含量为4.5 pg·g- 1采后72天鲜重增加121.3% 然后下降到5.29 微克- 1A培养的外植体中FW含量先升高后降低。在V培养基中培养的外植体酚含量与在琼脂培养基中培养的不同,增加缓慢,达到6.57 pg·g- 172后FW h和8.52 微克- 1144 h后的FW(图。3.).在培养初期,A培养的外植体酚含量显著高于V,但外植体培养中的酚含量迅速下降随着时间的推移,成为低于诉前灭菌处理和切口损伤引起的高水平的酚醛树脂生产在V和外植体,但V媒体推迟酚醛含量的快速积累。A中酚类含量的下降可能是由于外植体褐变相关死亡和代谢活性的降低。
外植体中PPO和POD活性的变化
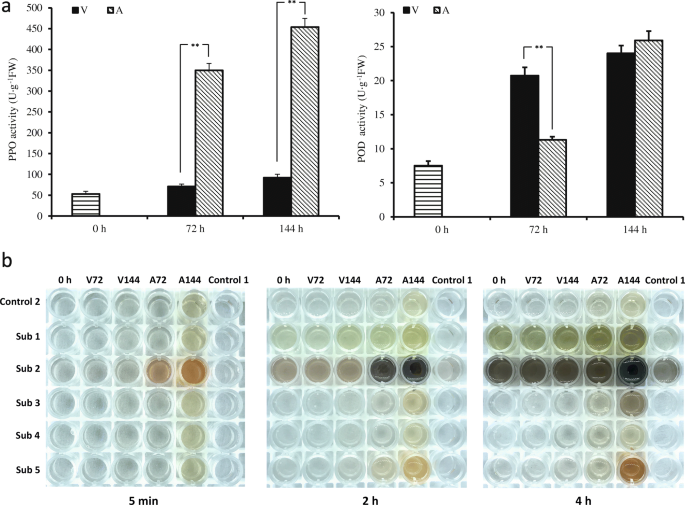
V培养的外植体PPO活性始终保持在较低水平,a培养的外植体PPO活性始终保持较高水平。PPO活性为53.0 U·g- 1收藏当天的FW。在培养期间,V培养的外植体PPO活性略有升高,达到71.0% 单位:克- 1FW在72 h和92.3 单位:克- 1144小时时脱粒。A培养的外植体PPO活性显著提高,达到349.7 U·g- 1FW在72 h和453.4 单位:克- 1前进144 h、 两者都比V培养的外植体大得多(图。4a) 是的。在V和A培养的外植体中POD活性不同。外植体POD活性仅为7.5% 单位:克- 1在领取的那天。V培养的外植体POD活性达到20.7 U·g- 172岁 h和24.0 单位:克- 1在144小时;然而,在a中培养的外植体的豆荚活性仅为11.3 u·g- 172小时,但迅速达到25.9 u·g−1.在144小时(图。4一种)。因此,高豆荚活性没有导致在V中培养的外植体的褐变。因为POD减少过氧化氢(H.2O2)诱导苯丙氨酸氨酶(PAL)酶活性的增加[34.],我们推断PPO是导致核桃外植体褐变的主要原因,而POD则减缓了酚类物质的快速积累。
A.不同培养基培养外植体PPO和POD活性的变化。每个值表示平均值±S.E.三个生物复制。星号表示不同学生的差异显著T以及:* *,P< 0.01。BJRPPO在外植体的褐变测定与5天然底物:亚1 =无碱酸,亚2 =多巴胺,亚3 = L-酪氨酸,亚4-羟基苯甲酸,亚5 = protocatechuic酸。在不同处理中的新鲜分离的蛋白质提取物在底物存在下孵育出指示的时间段。对照-1通道不含酶,对照-2泳道不含基材。5分钟后,2小时,4小时,图像均取得。V72:在V 72 H中培养的外植体的样品,V144:在V 144 H中培养的外植体的样品,A72:来自A 144的外植体的样品,A144:来自培养植体的样品在144小时内培养的外植体
褐变分析表明,不同基质对外植体PPO活性的影响不同。所有的样本都显示出多巴胺(o-二酚)反应4小时后。A治疗的样本显示了多巴胺和其他两种物质的高活性o-二酚(原儿茶酸和没食子酸),特别是在144 h(图。4b).然而,V处理的样品与原儿茶酸或l -酪氨酸没有反应,说明PPO活性水平较低。与JrPPO2相比,JrPPO1对单酚类具有更强的活性,不接受原儿茶酸作为底物,而JrPPO2对单酚类具有更强的活性o-双酚[30.]. 因此,我们的结果表明,处理A具有高JrPPO2活性。
的变化JrPPO表达在不同培养基培养的外植体
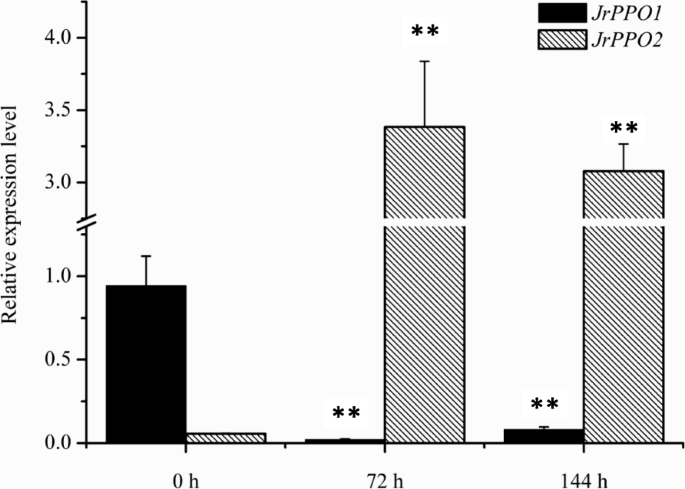
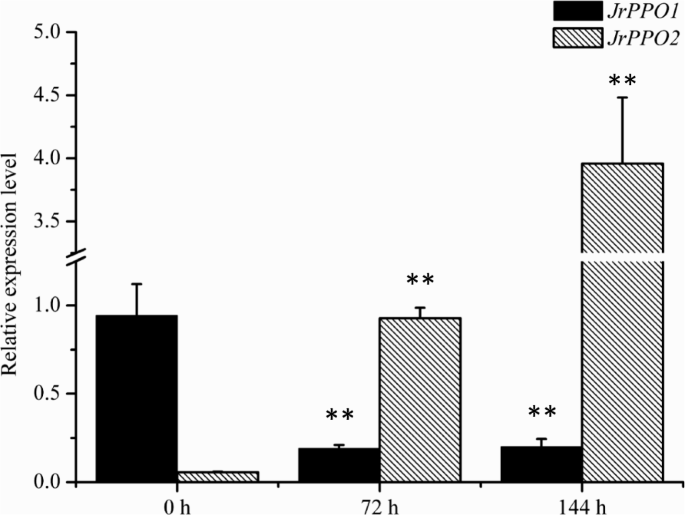
由于外植体PPO活性变化明显,我们克隆了PPO编码序列(JrPPO1公司和JrPPO2型)(另锉1:图S1和附加文件2)来研究基因表达模式。与采集外植体当天的表达量比较,JrPPO1公司表达在72小时显著下调 h和144 h在不同的介质中,而JrPPO2型表达显著上调(图。5和图。6).JrPPO1公司在A中培养72 h和144 h时,外植体的表达量都很低。JrPPO2型在外植体收集当天,外植体中的表达也很低;然而,在培养的外植体中的表达在72 h、 但在144时略有下降 h(图。5).JrPPO1公司在V培养的外植体中,72 h和144 h表达量较低JrPPO2型在V中培养的外植体中的表达在144小时上上调(图。6).的相对表达式JrPPO1公司和JrPPO2型在不同培养基中培养的外植体表现出相反的趋势,而趋势JrPPO2型表达量与PPO活性趋势相似,说明JrPPO2型在酚类化合物的褐变作用中起重要作用。
差异JrPPO核桃不同组织中的表达
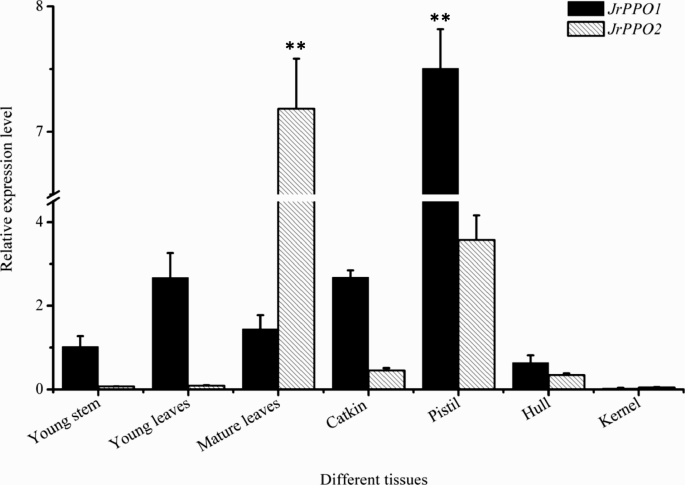
由于JrPPO1公司和JrPPO2型在脱南褐变期间的表达,我们分析了来自田间树木的不同组织中这些基因表达的变化(图。7).差异有统计学意义JrPPO1公司表达和JrPPO2型表达。JrPPO1公司在幼茎、幼叶、成熟叶、柔荑花序、雌蕊和苞壳中均有高表达JrPPO2型在成熟叶片、花絮和雌蕊中高表达。JrPPO1公司和JrPPO2型粒子中的表达水平低。不同组织中相同基因的表达也有显着差异。表达JrPPO1公司与其他组织相比,雌蕊中JrPPO2型在成熟叶片中显著高于其他组织。值得注意的是,JrPPO1公司和JrPPO2型在雌蕊中表达量高。这些结果表明,这两个基因之间可能存在着劳动分工的差异,从而导致它们在不同组织中的表达差异。褐变分析表明,不同底物对成熟叶、壳和幼茎的活性有不同的影响。从成熟叶片中提取的PPO活性较高o-二酚(多巴胺,原儿茶酸和没食子酸)(附加文件3.),这表明存在JrPPO2,这一结果与基因表达数据一致。
不同物种PPO的系统发育关系分析
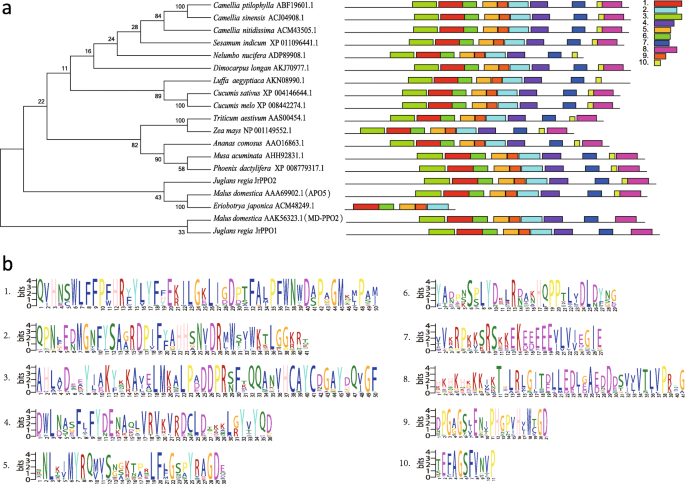
使用MEGA 7.0,我们评估了检索到的同源蛋白以及JrPPO1和JrPPO2蛋白,并报告了17个物种的序列(图。8). 在17种植物的蛋白质中,包括香蕉(Musa Acuminata.),日期(凤凰dactylifera), 小麦 (小麦), 玉米 (玉米)和苹果(海棠)核桃JrPPO1与苹果MD-PPO2(AAK56323.1)的PPO关系最为密切,核桃JrPPO2与苹果APO5(AAA69902.1)和枇杷(ACM48249.1)的PPO关系最为密切。系统发育树表明,枣树、香蕉、菠萝、小麦、玉米等单子叶植物种聚在一起,双子叶植物种聚在一起,蔷薇科植物(苹果、枇杷)种聚在一起,进一步说明PPOs在整个进化过程中具有保守性。
我们随后利用MEME软件分析了这些蛋白质序列之间的保守性。共鉴定出10个保守基序。五种常见的保守基序(基序1,− 2.− 5.− 6和 − 9) 在17种植物的19个PPO蛋白中发现了两个保守基序,并且在同一分支中的分布非常相似。除了来自枇杷,m .释放有(MD-PPO2)和j . regia(JrPPO1),16个PPOs含有保守基序1-10。m .释放有(MD-PPO2)和j . regia(JrPPO1)含有保守的基序1-9。基序2和基序9属于酪氨酸酶超家族(pfam00264),是cl02830超家族的唯一成员。基序4属于PPO中间结构域(pfam12142),是cl13563超家族的唯一成员。基序10和基序8属于PPO1洇KFDV结构域(pfam12143),是cl15965超家族的唯一成员。
讨论
外植体褐变与组织培养中酚类物质含量密切相关。核桃外植体在与使用插条和灭菌相关的环境条件下以及在培养基中存在水和盐时经历压力[35.]. 植物已经建立了一系列涉及细胞代谢、激素调节等方面的防御和保护系统[36.,37.],酚类物质含量增加,以抵御恶劣环境条件的影响,但酚类物质的高积累导致醌类物质产量增加,导致严重的褐变。本研究在A或V培养基中培养核桃外植体,早期积累了大量酚类化合物,可能是在收集和灭菌过程中受到损伤和胁迫所致。培养基的渗透性和流动性对于减少外植体褐变非常重要[4]. A外植体渗透性和流动性低,后期外植体分泌的有害物质不能迅速扩散,在外植体中积累;这些毒性作用会导致严重的褐变。V是一种颗粒吸附型阳离子交换剂,具有良好的渗透性和流动性;外植体产生的有害物质在V中传播迅速,褐变死亡率低。因此,在V培养基中进行初培养可以有效地降低核桃外植体的褐变。
植物可以通过积极和可逆的监管机制适应逆境[38.].褐变是由PPO [39.]及POD [40],在机械损伤和非生物胁迫的植物防御反应中,PPO和POD合成水平增加[41.]. 多酚氧化酶氧化酚类化合物形成醌,并进一步聚合醌形成黑色素化合物。然而,在H2O2,过氧化物酶也会氧化酚类和成型颜料[42.].H2O2浓度在正常植物组织中非常低,与PPO相比,POD较少参与褐变[43.].本研究的结果表明,Ⅴ中培养的外植体的豆荚活性显着大于72小时,v培养的外植体中的酚含量也明显低于A.机械损坏外植体可以诱导h的释放2O2在早期的阶段;特别是在A的涝渍条件下。PAL活性促进酚的合成并增加伤口诱导的毒性[44.].高水平的豆荚酶迅速降低了H引起的PAL活动2O2释放机械损坏后[34.]. PAL活性的降低减缓了在V。然而,POD活性在A培养的外植体早期较低,导致苯酚产量增加。在高活性PPO的催化作用下,酚类化合物生成大量醌类化合物,这些醌类化合物自聚形成棕色颜料。因此,A培养的外植体比V培养的外植体棕色。在144℃时,V外植体POD活性和酚含量较高,PPO活性较低 h、 使外植体发生轻微的褐变。因此,与POD相比,PPO可能是导致核桃外植体褐变的主要因素。
在完整的植物细胞中,质体定位的PPO与其酚类底物物理分离,主要分布在液泡中。细胞损伤破坏膜结构,多酚氧化酶氧化酚类物质形成醌[45.].魏和罗纳德的结果表明,褐变Pinus Virginiana轧机。抑制愈伤组织生长、芽分化和生根,与PPO积累有关[13.].苏格兰松芽诱导愈伤组织PPO活性(樟子松l)显著高于未褐变的未成熟胚胎[46.,47.]说明成熟组织诱导的愈伤组织PPO活性高导致细胞死亡[13.]褐变组织中PPO活性的增加是对这些愈伤组织培养物中的机械损伤和非生物胁迫的反应[48.]. 本研究将外植体切割灭菌后,置于A或V培养基中,造成进一步的胁迫,随后外植体中酚类化合物含量和PPO活性显著高于采集当天。值得注意的是,A培养基使伤口附近酚类物质的积累增加,加速了褐变反应,PPO活性在后期持续升高。A介质的渗透性和流动性较差;早期产生高水平的酚类化合物,高表达的JrPPO2型导致JrPPO2活性增加,从而产生大量醌。植物组织中的代谢被破坏,基因表达被下调或取消,这也是培养基中培养的外植体褐变相关死亡率高的原因。在V培养的外植体中,早期酚类物质的积累相对较低JRPOS公司表达缓慢上调,所以这些外植体在这段时间有效地修复了损伤。虽然酚类化合物在外植体中的含量和表达JrPPO在后期的阶段增加,此时,外植体已经逐渐适应外部环境,因此褐变死亡率低。
有两个PPO.苹果中表现出独特表达模式并与组织和发育相关的基因[48.].APO5.转录本只在花发育的后期被检测到,然而MD-PPO2型在花发育的所有阶段检测到转录物。在这项研究中,JrPPO2型,这与APO5.,在花器官中也高表达。此外,损伤导致表达量显著增加APO5.在树叶和水果里MD-PPO2型没有受到机械损伤的影响[48.].本实验将外植体切割后置于培养基中进行灭菌处理,引起非生物胁迫JrPPO2型过表达,这与APO5在苹果中的表达模式一致。在进化树的基础上,APO5与JrPPO2有着密切的关系,表明JrPPO2可能与植物的抗逆性有关。此外,基因的表达模式JrPPO1公司和JrPPO2型与之相反的是JrPPO2型类似于PPO活动的变化。因此推断出JRPPO2在酚类化合物的氧化中起着关键作用。此外,在其他物种中观察到的APO5和JRPPO2表现出在其他物种中观察到,而MD-PPO2和JRPPO1缺乏图案10。试图在组织褐变期间可以起作用的基序10,但是其功能需要进一步研究。
结论
酚醛含量的快速增加导致外植体的褐变和死亡,V媒体在短期内推迟了核桃外植体的酚类化合物的快速积累。因此,使用V作为原发性培养基有效地减缓了核桃射击顶端外植体的褐变并改善了存活百分比。JrPPO2型在外植体褐变中起关键作用。
方法
植物材料和治疗
6年生核桃(~ 10厘米长)嫩枝(j . regia简历。四月,从河北农业大学试验田收集了相同生长发育和管理条件下的乔木;北纬38°48′;东经115°24′),中国。采集这种样品不需要特别许可。嫩枝被切成3厘米的外植体,每个外植体有1或2个芽。每个外植体用含水的洗衣粉洗涤,表面用75%酒精消毒30分钟 然后是0.1%氯化汞(HgCl2)8分钟,在无菌蒸馏水中漂洗6次,然后在无菌v介质中培养[49.或媒体(表1)在管中。7天后,将所有外植体转移到新鲜的管中,在管中的培养基中,外植体的死亡百分比是在培养14天后确定的。将培养物保持在受控环境室中,其具有16-H光周期(由荧光灯泡提供的4 LX)和25℃的8小时暗时段。外植体分为两组:一组(60个外植体),用于确定死亡率;和其他组(60个外植体)用于RNA提取,表达分析和酚类含量和POD和PPO活性的测定。在0小时,72小时和144小时后收集样品。核桃(品种Zanmei)组织(拍摄,幼叶,成熟叶,Catkin,雌蕊,船体,船体和核组织)被分开地从Efhau的种植树上收获,并在冰上运输到PPO测定和器官特异性的实验室表达分析。将样品储存在-80℃以进行RNA提取和表达分析。
评价外植体存活率
六十外植体进一步分为3组,用于两组治疗,以计算培养14天后的存活百分比(包括在A-DKW培养基中的7天培养)。表皮没有棕色的外植体,叶柄掉下来,新芽的发芽被认为幸存下来。相反,外植体的表皮的外植体变成了棕色,叶柄没有脱落,而新芽没有发芽被认为死了。
PPO和POD测定
外植体切成小块,在液态氮中冷冻2,并用研磨机研磨成细粉。该冻干粉用于PPO和POD酶活性测定和总酚含量测定。
如HIGGINS所述从核桃组织中分离PPO [26.稍加修改。通过提取缓冲液[50 mM磷酸缓冲液(pH 6.8)、聚乙烯吡啶烷酮(PVP)(1%)、聚乙烯吡啶烷酮(PVPP)(2%)、Triton X-100(1%)和抗坏血酸(30 mM)]均质,从外植体中分离总蛋白。均质液(mL)与组织(g)的比例为5:1。均质后,抽提物离心(12000rpm, 4℃,20 min),上清置于−80℃保存至使用。试验按照Anosike [50.和Mishra [51.]:使用邻苯二酚作为底物,通过分光光度法在420℃下监测醌的生成 nm(UV-3200,中国上海马帕达)。PPO活性以每克新鲜外植体重量的单位来报告。
为了确定JrPPO1或JrPPO2是否在不同的阶段或组织中具有较高的活性,一个简单的褐变试验基本上被Panis描述[30.].如上所述,从等重量的外植体或不同组织中分离出总蛋白质(通过上清液)。随后如Zekiri所述纯化蛋白质[19.].在包含磷酸钠缓冲液的反应混合物中进行简单的褐变测定,不同底物[单苯酚(L-酪氨酸,4-羟基苯甲酸)和o-双酚(没食子酸,多巴胺,原儿茶酸)和酶溶液在25 摄氏度。在无酶的磷酸钠缓冲液中对每种底物进行一次对照测定。在无底物的磷酸钠缓冲液中对每种酶溶液进行另一对照测定。
提取POD蛋白的方法与提取PPO蛋白的方法相同。过氧化物酶活性测定方法如Tian [52.和Mishra [51.]:以愈创木酚为底物,在470 nm波长下用分光光度法监测愈创木酚聚合物的生产。POD活性以每克新鲜外植体质量单位表示。
总酚含量测定
根据Folin-Ciocalteu比色法测定总酚醛含量[53.]. 简而言之,每个样品(0.2 g) 在液体中研磨2之后将研磨样品和15ml 60%乙醇混合在一起。通过在25℃下通过超声处理90分钟后收集上清液。随后将上清液(600μL)加入到10ml蒸馏水中,1ml Folin-Ciocalteu试剂,以及2ml碳酸钠(10%)。将混合物在25℃温育120分钟后,用UV分光光度计(Shimadzu Corp.,Kyoto,Japan)测量其765nm处的吸光度。用作标准的Gallic acid,结果以每克的新鲜重量为单毫克的无碱酸等当量(GAE)。在该实验中包含三种重复。每次重复中使用至少15个样品。
DNA和RNA分离及逆转录聚合酶链反应(PCR)
幼叶在液态氮中冷冻2然后磨成细粉。采用DNA提取试剂盒(产品编号:DP350;天根,中国北京),以避免酚类干扰。将外植体和不同组织冷冻于液体氮中2然后磨成细粉。JrPPO1公司(GenBank登录号:MW273898)和JrPPO2型(GenBank登录号:MW273899)用引物扩增编码序列(CDS)JrPPO1公司化合物F(5′-CCATCGATCCAGTCTCTTCATGCTTTAC)− 3′),JrPPO1公司Comp-R(5′-GCTCTAGAAATATCGAAAGGCACTGCG公司− 3′),JrPPO2型Comp-F(5′-cggaattcgtaacttcgcaccaaagc)− 3′)和JrPPO2型采用Comp-R(5’-GCTCTAGATAACGTACCACAATTTCGCA-3’)进行分析JrPPO1公司和JrPPO2型序列分别。通过TA克隆试剂盒将片段克隆到pMDT19载体(产品编号:6013;豆类、大连、中国)。载体测序由生工生物技术(上海)有限公司完成(附加文件2).
使用分离试剂盒(产品编号:DP441;中国,北京,Tiangen)。将分离得到的RNA用二乙基磷氰酸酯(DEPC)处理后的无RNA水溶解,并用DNAse处理。用纯RNA通过商业试剂盒(产品编号:RR047A;天根,北京,中国)根据制造商的指南。将得到的cDNA稀释9倍,在−20℃保存,用于后续的RT-PCR和qRT-PCR检测。
JrPPO1公司和JrPPO2型实时定量PCR技术在表达分析中的应用
对于基因表达量化,通过Primer Premier 5.0软件设计了特异性引物JrPPO1公司和JrPPO2型基因。qRT-PCR实验使用FX96 Touch™Real-Time PCR检测系统(Bio-Rad)和TransStart Top Green qPCR SuperMix(产品编号:AQ131;转基因生物,中国北京)。的引物JrPPO1公司-F(5′-cgcaacctacctat-3′),JrPPO1公司-R(5'- ggtccacattcggtccacat-3'),JrPPO2型- f (5 ' -TGCCTTGACACCACCAAGTT-3 '),JrPPO2型-R(5’-ACAATCGGGAAGTTGACGCT-3’)用于分析JrPPO1公司和JrPPO2型分别转录物。JrACT2(NCBI参考文献:XM_018972062.1)与特定引物(5'-TCCACTGTTCCTGGTAT-3'和5'-ACCTCCCCAATCCAGACACTG-3')一起用作参考基因,用于计算相对表达水平。PCR混合物(20μl)由10μl2×转型顶部绿色QPCR超混合物组成,每个引物(10μm),1μl稀释的cDNA和7μlDDH2O. RT-PCR采用以下条件:95°C 5 min;30个循环94°C 10 s, 63°C 30 s, 72°C 45 s;最后在72°C下延长10分钟。每个样本进行3次实验(生物重复)。将每个反应中存在的cDNA总量归一化,作为内源控制,核桃肌动蛋白基因是coamplified。根据2计算相对表达水平——∆∆ct方法(54.].
统计分析
实验按完全随机设计建立。数据以3或6个独立生物重复的平均值±标准误差(SEs)表示。样本之间的统计差异通过学生的T-测试 (P< 0.05或0.01)。数据通过SPSS 20.0版本(IBM公司,Armonk, NY)和Excel 2010软件(Microsoft公司,Redmond, WA)进行分析。
系统发育树建设
从NCBI数据库(www.ncbi.nlm.nih.gov)(附加文件4).通过PFAM蛋白质数据库分析蛋白质的保守结构域(http://pfam.org/)[55.欧洲生物信息学研究所和基因结构显示服务器(GSDS;http://gsds.cbi.pku.edu.cn/)[56.]和meme(http://meme-suite.org/)提供PPO蛋白的网站。根据MEGA 7.0软件最大似然法构建系统发育树,bootstrap值为1000。
数据和材料的可用性
所有数据和资料均在主要论文和附加文件中提供,目前研究中产生的序列数据也可在GenBank中获得(检索号:MW273898和MW273899)(https://www.ncbi.nlm.nih.gov/genbank/).
缩写
- PPO:
-
多酚氧化酶
- 荚:
-
过氧化物酶
- v:
-
蛭石-DKW中型
- 答:
-
琼脂 - DKW中型
参考文献
- 1.
席瑞德,张义平。中国果树记录-核桃。北京:中国林业出版社;1996.35-8页。
- 2。
张志华,裴迪。核桃。北京:中国农业出版社;2018.4 - 5页。
- 3.
PEI D,LU XZ。中国核桃种质资源。北京:中国林业出版社;2011. p。17。
- 4.
高军,张平,薛建强,王双林,张锡兴。木本植物组织培养中酚类物质及其褐变效应研究进展。植物学报。2019;46(9):1645-54。
- 5。
杨赫,王家,周PC,萌,核桃外植体的组织培养。J安徽农业科学。2011; 39(28):17156-7。
- 6。
刘LY。核桃外植体褐变的研究在体外文化。催眠罪。2002;2:171–2.
- 7。
张武夫,高建,欧一赫,杨永平。核桃组织培养中褐变控制的初步研究。落叶果实。2003;35(3):4–7.
- 8。
刘股,韩邦。在体外核桃的繁殖(juglans regia.L.)。中国农业大学学报,1986;9(2):143–8.
- 9。
金Q,吴迪,陈GY,王JX。早期核桃外植体的原发性培养。J Tarim Univ。2008; 1:10-2。
- 10
水果和蔬菜的酶促褐变:综述:改进和创新。正确答案:Kuddus M,编辑。食品技术中的酶。施普林格、新加坡;2018:63 - 78。
- 11
周建华,周建荣,曾海华,王国宝,朱志平。园艺植物组织培养褐变及抗褐变技术研究进展。园艺学报,2000;27(增刊1):481-6。
- 12.
何毅、郭×、吕R、牛乙、帕萨普拉五世、侯平、蔡福、徐毅、陈福。小麦褐化愈伤组织形态及生化指标的变化麻疯树下胚轴。植物组织科学学报,2009;
- 13。
唐W,牛顿RJ。佛吉尼亚松多酚氧化酶的增加和多胺的减少与组织褐变有关(Pinus Virginiana磨。)。植物SCI。2004; 167(3):621-8。
- 14。
徐希杰、孙旭、陈迪、赖YY、李莉。水稻过氧化物酶基因的克隆与鉴定蝴蝶兰.植物学报。2011;43(4):2161-5。
- 15.
西迪克M,多兰KD。蓝莓多酚氧化酶的特性研究(Vaccinium corymbosuml .)。食品化学。2017;218:216-20。
- 16。
Selvarajan E、Veena R、Kumar NM。多酚氧化酶,超越酶褐变,综述。在:辛格J,沙玛D,库马尔G,沙玛N,编辑。可持续发展的微生物生物勘探。新加坡:施普林格;2018年。203–22.
- 17。
Araji S, Grammer TA, Gertzen R, Anderson SD, Mikulic-Petkovsek M, Veberic R, Phu ML, Solar A, Leslie CA, Dandekar AM。多酚氧化酶在核桃次生代谢和细胞死亡调控中的新作用。植物杂志。2014;164(3):1191 - 203。
- 18。
Steffens Jc,Harel E,Hunt MD。多酚氧化酶。在:Ellis,Kuroki GW,斯塔福德HA,编辑。植物次生新陈代谢的基因工程。纽约:全部媒体;1994年。275-312。
- 19。
核桃叶中酪氨酸酶的纯化和鉴定juglans regia.).植物化学。2014; 101:5-15。
- 20
Mishra BB、Gautam S、Sharma A。游离酚和多酚氧化酶(PPO)对茄子切后褐变的影响(茄属植物melongena).食品化学。2013;139(1 - 4):105 - 14所示。
- 21
关键词:丁香精油,鲜切莴苣,褐变,褐变,品质引用本文:食品化学。2017;214:432-9。
- 22
太阳能A,Colaric M,Usenik V,Stamear F.普通核桃年龄幼苗中所选黄酮类化合物,酚醛酸和醌的季节变化(juglans regia.l .)。植物科学。2006;170(3):453 - 61。
- 23
不同品种果实中的酚酸、丁香醛和胡桃素juglans regia.L食品化学杂志。2005;53(16):6390–6.
- 24。
陈F,李路,龚W.浅谈植物组织培养中的褐变。北霍尔科。2005; 29(2):69。
- 25。
施杰,风扇,延吉。多酚和相对酶对核桃嫁接的影响。J西北林业大学。2005; 20(1):80-3。
- 26。
Escobar MA、Shilling A、Higgins P、Uratsu SL、Dandekar AM。核桃多酚氧化酶的特性研究。美国社会科学杂志。2008;133(6):852–8.
- 27。
ZWKIRI F,Bijelic A,Molitor C,Rompel A.聚酚氧化酶的结晶和初步X射线晶体分析juglans regia.(jrPPO1)。学报。2014;F70:832-4。
- 28。
关键词:核桃,多酚氧化酶,多酚氧化酶,白叶枯病中国医学杂志。2016;141(2):119-24。
- 29。
marnez G, Pedro J, Crepeau MW, Puiu D, Gonzalez-Ibeas D, Whalen J, Stevens KA, Paul R, Butterfield TS, Britton MT, Reagan RL等。胡桃木(juglans regia.)基因组序列揭示了编码非结构多酚生物合成的基因的多样性。工厂J. 2016; 87(5):507-32。
- 30.
潘尼斯F,朗佩尔A。核桃酪氨酸酶同工酶(jrPPO1和jrPPO2)不同酶活性的氨基酸位置鉴定。Sci报告,2020年;10(1):10813.
- 31
Trautmann ia,visser jh。开发液体流动系统,以抑制瓜纳愈伤组织癌症的褐变(光argentatum灰色的)。植物细胞组织组织。1989; 16(1):39-46。
- 32
关键词:香蕉,液体培养基,快繁,培养植物组织科学与技术,1993;32(1):55-60。
- 33
有效的微传播协议麻疯树使用液体培养基。j crop sci biotech。2018; 21(1):89-94。
- 34
Dӧrnenburg H, Knorr D.利用马铃薯诱导子和高压诱导酶褐变的评价(马铃薯)悬浮培养作为植物组织的模型系统。农业化学学报。1997;45(10):4173-7。
- 35
冯德德,王烨,陈杰。褐变在植物组织培养中的研究进展。Acta Agri Zhejiangensis。2015; 27(6):1108-16。
- 36。
吴国玺,张平。复合药剂对鲜切莲藕护色效果的研究。食品科学技术2006;5:111–4.
- 37。
过氧化氢诱导的苯丙素途径诱导临时浸没生物反应器(TIBs)中植物的防御反应。植物科学。2012;195:71-9。
- 38。
李国良,吴慧霞,孙永强。蛋白质组学及其在植物干旱胁迫响应中的应用进展。西北植物学报2015;35(10):2132-40。
- 39。
李玲,吴艳,范军,欧阳娟(水杨酸对鲜切板栗酶促褐变的抑制作用)齿栗叶mollissima)通过竞争性地抑制多酚氧化酶。食品化学。2015; 171:19-25。
- 40.
多酚氧化酶和过氧化物酶在鲜切甜瓜褐变中的作用。农业化学学报。2008;56(1):132-8。
- 41.
关键词:褐变,总酚含量,PPO, POD, PAL活性蝴蝶兰外植体在体外. 催眠罪。2006;33(3):671–4.
- 42.
关键词:荔枝果实,酶褐变,酶促褐变,酶促褐变食品化学。2004;88(3):443 - 6。
- 43.
迈耶。植物和真菌中的多酚氧化酶:去向何方?复习一下。Phytochemi。2006;67(21):2318 - 31所示。
- 44
Kang HM, Saltveit ME。创伤诱导的PAL活性被热休克处理抑制,诱导热休克蛋白的合成。杂志杆菌。2003;119(3):450 - 5。
- 45
琼斯am,saxena pk。抑制苯丙烷化生物合成青蒿L.:一种减少植物组织培养中氧化褐变的新方法。公共科学图书馆一号。2013;8(10):e76802。
- 46
lakkanen H, Häggman H, Kontunen-Soppela S, Hohtola A.组织褐变在体外苏格兰松栽培物:过氧化物酶和多酚氧化酶的作用。杂志杆菌。1999;106(3):337 - 43。
- 47
Laukkanen H,Rautiainen L,Taulavuori E,Hohtola A.苏格兰突出芽的褐化过程中细胞结构和酶活性的变化。树生理。2000; 20(7):467-75。
- 48。
在富士苹果的营养发育和生殖发育过程中,两种多酚氧化酶均有差异表达。植物科学。2001;161(6):1145 - 52。
- 49。
赵光贵,张志华,王海霞,赵艳萍,高原,王松,牛建民。一种降低核桃外植体褐变率的培养基和培养方法2019-6-28。CN107318649B P / OL。
- 50.
Anosike EO,Ojimelukwe PC.椰壳多酚氧化酶的部分纯化和性质,Xanthosoma sagittifolium.实验机器人。1982;33(3):487-94。
- 51.
Mishra BB,Kumar S,Wadhawan S,Hajare Sn,Saxena S,更多V,More V,Gautam S,Sharma A.荔枝果皮的褐变:多酚氧化酶,过氧化物酶,苯丙氨酸氨裂解酶的作用和γ辐射的作用。J Food Biochem。2012; 36(5):604-12。
- 52.
天泉,徐义,江铝,王Y.东豆桃酶活性和质量属性响应受控大气条件的变化。科学科学版。2001; 34(6):656-61。
- 53.
[10]赵光刚,牛建民,云英,刘坤,王胜,文静,王辉,张忠。核桃壳结构、细胞和物理性质的关系。中国科学(d): 569 - 574。长的矮Sci。2019;54(2):275 - 81。
- 54.
Livak KJ,Schmittgen TD。应用实时定量PCR和2- ΔΔct方法。方法。2001;25(4):402–8.
- 55.
Finn RD, Coggill P, Eberhardt RY, Eddy SR, Mistry J, Mitchell AL, Potter SC, Punta M, Qureshi M, sangrador vegas a . pam蛋白家族数据库:走向更可持续的未来。核酸杂志2016;44(D1): D279-85。
- 56
郭A,朱Q,陈X,罗J. GSDS:基因结构显示服务器。易川。2007; 29(8):1023-6。
致谢
我们还要感谢Jin Zhao博士,Yi Gao女士和Shijuan Dour博士对数据分析和稿件的宝贵建议。
基金
河北省自然科学基金资助项目(no . C2019204270);河北省高校科技研究项目(no . QN2019159);河北省人力资源厅海外留学人员科研基金资助项目(no . c2019045)。关键词:岩石力学,抗剪强度,抗剪强度,抗剪强度研究经费用于研究设计、样本收集、数据分析或解释以及撰写论文。
作者信息
从属关系
贡献
SZ和ZZ设计了研究。SZ,HW,KL和LY进行了实验,分析了数据并写了纸张。LL,JY,XA和PL参加了数据分析。所有作者读并批准了稿件的最终原稿。
相应的作者
伦理宣言
道德认可和参与同意
核桃是我国分布广泛的果树之一,并非濒危物种。核桃树来自河北农业大学实验田。采集核桃样品不需要特别许可证。
出版许可
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图。S1。
的结果JRPOS公司CDS放大。
附加文件2
测序数据JrPPO1公司和JrPPO2。
附加文件3:图S2。
JRPPO在不同组织中的褐变测定,包括5天然底物:亚1 =无碱酸,亚=多巴胺,亚3 = L-酪氨酸,亚4 = 4-羟基苯甲酸,亚5 = protocateChuic酸。从归档树木的不同组织的2g组织的新鲜分离的蛋白质提取物在底物存在下培养在底物中进行时间段。对照-1通道含有没有酶和对照-2通道没有含有基材。在5分钟后进行照片,2小时,4小时。NS:来自幼虫的样品,OL:来自成熟叶片的样品,胡:来自船体的样品,Ke:来自核的样品。
额外的文件4。
17种PPO蛋白的序列比对。
额外的文件5。
原始图像
权利和权限
开放访问本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
赵松,王浩,刘凯。et al。角色JrPPO核桃外植体褐变中的S。BMC植物BIOL.21,9(2021)。https://doi.org/10.1186/s12870-020-02768-8
收到:
接受:
出版:
关键字
- 核桃
- 外植体
- 蛭石
- 苯酚
- JrPPO