摘要
背景
alfalfa(Medicago Sativa.L.)是一种多年生豆类,广泛种植,作为一个高营养价值牲畜饲料。开花时间是一种重要的农艺性质,有助于生产苜蓿干草和种子。然而,苜蓿中开花时间调节的潜在分子机制并不顺利。
结果
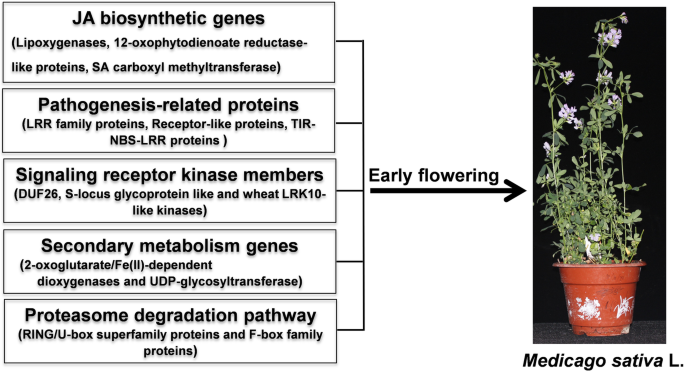
本研究对一株早花基因型80和一株晚花基因型195的开花表型进行了表征。结果表明,新叶茉莉酸(JA)含量的降低和JA生物合成基因(脂氧合酶、12-氧二烯酸类还原酶蛋白和水杨酸羧甲基转移酶)的下调可能在基因80型的早花表型中起重要作用。进一步的研究表明,基因编码与发病相关的蛋白质。亮氨酸富重复序列(LRR)家族蛋白、受体样蛋白、toll-白细胞介素样受体(TIR)-核苷酸结合位点(NBS)-LRR类蛋白)和信号受体激酶家族成员[LRR蛋白,未知功能的激酶结构域26 (DUF26)和小麦富亮氨酸重复受体样激酶10 (LRK10)样激酶]与苜蓿早花有关。此外,参与次级代谢(2-羟戊二酸/铁(II)依赖的双加氧酶和udp -糖基转移酶)和蛋白酶体降解途径[真正有趣的新基因(RING)/U-box超家族蛋白和F-box家族蛋白]也与苜蓿的早花有关。
结论
综合表型、生理学和转录组学分析表明,激素生物合成和信号途径、发病相关基因、信号受体激酶家族基因、次生代谢基因和蛋白酶体降解途径基因是苜蓿早期开花的主要原因。这将为今后苜蓿开花期的研究提供新的见解,并为优化这一重要性状提供遗传改良策略。
背景
alfalfa(Medicago Sativa.L.)是一种多年生豆科牧草,因其叶片中粗蛋白质和营养物质含量高,在世界各地广泛种植作为家畜饲料[1那2].而开花时间是苜蓿采收时间的重要决定因素,采收时间对苜蓿牧草品质、青贮、产量和产量均有影响[3.].早期开花可以改善切屑的数量,饲料产量和全年生产苜蓿;它还可以帮助避免雨季或种子生产的干旱胁迫,并提高与中国温带半干旱大陆气候相关的冬季居高力[4.]. 尽管如此,紫花苜蓿花期调控的分子机制仍不清楚。
过去的开花时间研究发现了模式植物拟南芥、水稻(Oryza.satival .)、小麦(小麦青稞(Hordeum Vulgare.l .) [5.那6.].这些途径可以分为两类:光周期、春化和环境途径与环境条件相关,而自主、赤霉素和年龄途径则与内源信号有关,这些信号与花整合因子基因的上调或下调有关开花轨迹T.(英国《金融时报》),开花基因座C.(FLC.),康斯坦斯(CO.),Constans1过表达的抑制(SOC1级)[7.那8.那9.].此外,小的非编码RNA和表观遗传途径在调节植物中的开花时间来发挥重要作用[10.].例如,在植物成体阶段,miR156是靶标SQUAMOSA发起人BINDING-LIKE(SPL)通过在拍摄顶点中的花促进基因的上调表达诱导开花[11.]和开花位点D组蛋白去甲基化酶下调FLC.表达与介导H3K4去甲基化相关,从而促进拟南芥开花[12.].早期的研究还表明茉莉激活(JA)转录因子MYC2那MYC3,MYC4通过与之互动来负面调节开花时间英国《金融时报》,外源JA可延缓拟南芥开花时间[13.].应用外源脱落酸(ABA)或诱导过表达ABI5,一个脱落酸敏感突变体5,通过FLC.表达也能导致拟南芥开花延迟[14.那15.].此外,像受体样激酶(RLK)家族蛋白在开花时间调节中涉及的内部和外部信号的感知中发挥着关键作用[16.].例如,Flor1,在拍摄性中表达的富含亮氨酸的重复(LRR)蛋白,物理地与氨基(Ag,疯箱转录因子)进行物理相互作用,并在早期的开花单生物学中诱导和拟南芥Flor1.突变体表现出延迟的开花表型[17.]. CURVY1是一种新的受体样蛋白激酶,对拟南芥开花时间和种子产量也有反应[18.].此外,泛素-蛋白酶体系统是一个主要的分解代谢途径,参与植物生长发育和包括花发育在内的生理过程。泛素标记靶蛋白主要通过E1(泛素激活酶)、E2(泛素偶联酶)、E3(泛素-蛋白连接酶)进行,然后由26S蛋白酶体介导降解[19.]. 例如,PUB13是一种具有E3泛素连接酶的U盒蛋白,它与HFR1(远红光中的长下胚轴1)发生物理相互作用以调节拟南芥的光形态发生和开花时间[20.].然而,他们的苜蓿同源物是否参与了花期调控尚不清楚。
利用不同开花期苜蓿茎尖或叶片样品进行的研究表明,参与碳水化合物代谢、苯丙酸生物合成和免疫的蛋白质对开花时间有反应[4.那21.]. 然而,有关苜蓿新叶开花时间调控的分子机制却知之甚少,新叶是苜蓿从营养期向花期过渡的过程。研究表明,叶片发育和花器官分化受共同的同源异型因子控制[22.].例如,敲下了AG基因导致叶片发育的重新编程,影响关键调节基因的表达(TRIPTYCHON那APETALA3和激动人心)拟南芥叶片[22.那23.].因此,我们假设这些代谢基因在早期开花阶段期间可能在苜蓿的新叶片中起重要作用。这里,集成的表型,生理学和转录组分析表明,激素生物合成和信号传导途径基因,发病机制相关(PR)基因,信号传导受体激酶家族基因,二次代谢基因和蛋白酶体降解途径基因可能导致早期开花表型苜蓿。
结果
表型和内源激素含量
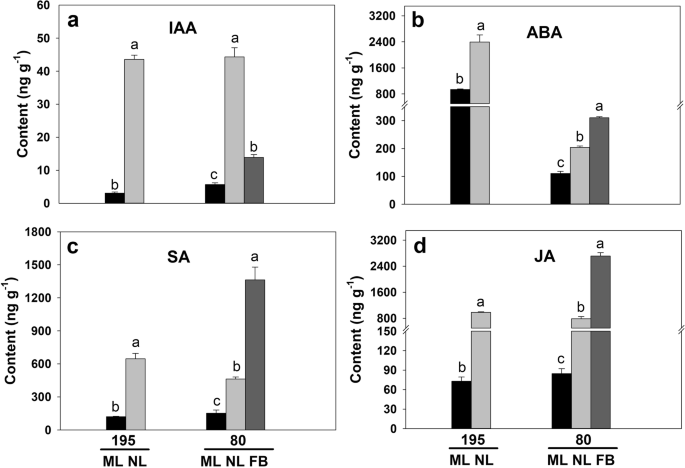
在控制生长室内条件下的开花时间测定中,植株被修剪以保持相同的高度。基因型80在种植后25天开始开花,平均株高为30.95 cm,而晚花基因型195的平均株高仅为19.73 cm。1a).基因型195在播种后50天开花。在种植后25天,当基因型80开花时,测定了两种基因型成熟叶(ML)、新叶(NL)(包括顶端分生组织)和花芽(FB)内源激素含量。1b和c;图。2模拟)。结果表明,两基因型NL中生长素(IAA)、ABA、水杨酸(SA)和JA含量均显著高于ML,而基因型80中NL和ML激素水平的差异小于195。2模拟)。此外,除IAA外,基因型80中FB的激素含量显著高于ML和NL(图1)。2模拟)。综上所述,基因型80比基因型195具有更高的激素从新叶到花芽的转运效率。
叶子和花蕾的转录组分析
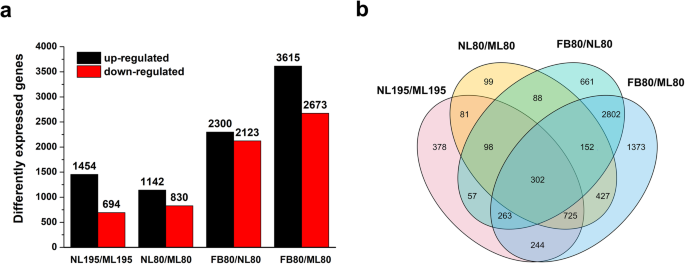
为了进一步研究基因型80中早期开花表型的分子基础,我们在两种基因型的ML,NL和FB中进行转录组分析(表1).共获得101.13 Gb的clean reads, Q30 %(质量分数≥30的碱基百分比)和GC %(鸟嘌呤和胞嘧啶)分别为93.69和42.28%。通过NCBI非冗余蛋白数据库(NR)、Nucleotide序列数据库(NT)、Clusters of Orthologous Groups of proteins (COG)、基因本体论(GO)、京都基因和基因组百科全书(KEGG)、Swissprot和Interpro (E-value < 10− 5.).然后,使用31,962个编码序列的转录本(N50为1866 bp,平均长度为1336 bp)进行进一步的功能分析(表1)1). 我们在195型和80型中分别鉴定了2148(1454上调/694下调)和1972(1142上调/830下调)NL和ML之间的差异表达基因(DEG),其中942和766 DEG分别在195型和80型中独家表达(图。3.a和b;附加文件1:表S1)。此外,基因型80的FB和NL之间鉴定出4423个(2300个上调/2123个下调)DEGs,基因型80的FB和ML之间鉴定出6288个(3615个上调/2673个下调)DEGs,其中基因型80的2802个共同的DEGs对早花有反应(图。3.a和b;附加文件1:表S1)。
激素相关基因对早花的响应
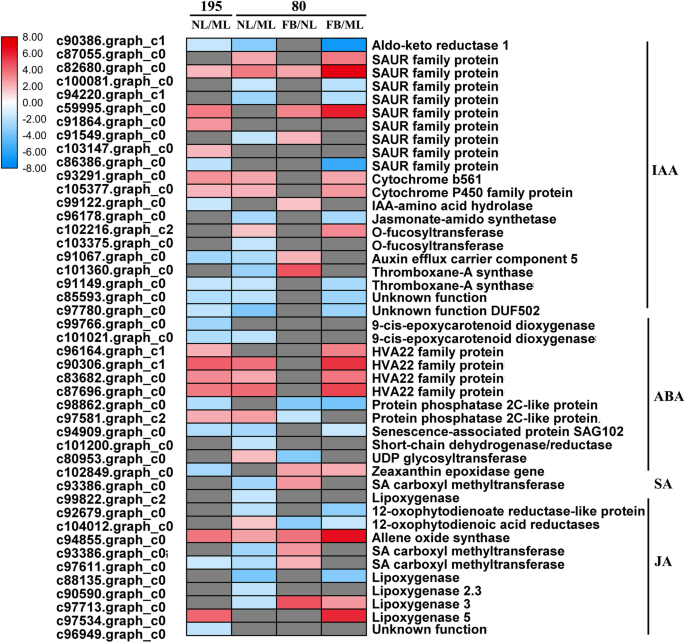
激素水平的显著变化促使我们进一步研究激素相关基因的转录水平。分析发现,基因型195(NL195/ML195)和基因型80(NL80/ML80)的IAA、ABA、SA和JA代谢和信号通路中分别有27和34个DEG(介于NL和ML之间)。4.a、 b和5.;额外的文件2:表S2)。在基因型80中与mL相比,在N1161AA代谢和信号传导途径基因中的16个IAA代谢和信号传导途径基因中的11个显着下调(图。5.;额外的文件2:表S2)。与基因型195的ML相比,13个IAA相关基因中有7个在NL中下调,例如编码SAUR家族蛋白、o-岩藻糖基转移酶、生长素外排载体组分5和血栓素-A合酶的基因(图。5.;额外的文件2:表S2)。此外,与ML相比,基因型195的10个DEG(5个下调/5个上调)和基因型80的8个DEG(3个下调/5个上调)在NL中富集(图。5.;额外的文件2:表S2)。这些主要涉及ABA代谢和信号通路,包括ABA响应蛋白,9-CIS-环氧基甲丙酮类二氧化根酶和HVA22样蛋白质编码基因(图。5.;额外的文件2:表S2)。在基因型80中与ML相比,在NL中,在NL中,编码SA羧基甲基转移酶(SAMT)和脂氧合酶的两个相关基因在NL中显着下调,但在基因型195中未富集(图。5.;额外的文件2:表S2)。9个茉莉酸生物合成基因中,有7个在基因80的NL中较ML显著下调;与基因195相比,四个与ja相关的基因中有两个在NL中表达下调,包括编码12-氧植物二烯酸还原酶样蛋白、丙烯氧化物合成酶和脂氧合酶的基因(图1)。5.;额外的文件2:表S2)。这些结果进一步表明,下调这些激素相关基因可能对基因型80的早花产生负面影响。80基因型中,FB与NL之间和FB与ML之间分别鉴定出16个和27个与激素代谢及信号通路相关的DEGs;这些基因包括参与ABA信号转导的基因和编码生长素响应蛋白、SAMT、丙烯氧化物合酶和脂氧合酶3的基因(图)。5.;额外的文件2:表S2)。
与发病和代谢相关的基因对早花的响应
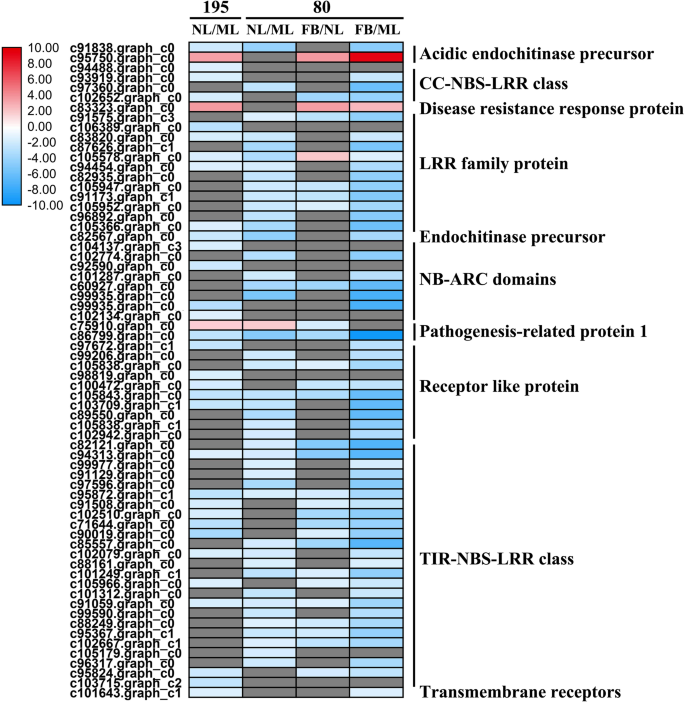
基因型195的35个DEGs(3个上调/32个下调)和基因型80的45个DEGs(1个上调/44个下调)与ML相比在NL中显著富集。这些主要包括与Toll白细胞介素样受体(TIR)-核苷酸结合位点(NBS)-LRR和卷曲线圈(CC)-NBS-LRR类相关的基因编码LRR家族蛋白、NB-ARC(APAF-1、R蛋白和CED-4共享的核苷酸结合接合器)结构域包含蛋白和受体样蛋白(图。4.a、 b和6.;额外的文件2:表S2)。同时,在基因型80中,FB和NL之间有29个DEGs(3个上调,26个下调),FB和ML之间有57个DEGs(2个上调,55个下调)2:表S2)。我们发现,在基因型195中,NL和ML之间的66个代谢deg(43个上调,23个下调)显著富集;而82个这样的DEG(47个上调,35个下调)在基因型80中富集。这些主要包括编码2-酮戊二酸和Fe(II)依赖性氧合酶超家族蛋白(2OG加氧酶)、查尔酮合酶、漆酶和UDP糖基转移酶超家族蛋白(UGTs)的基因(图。4.a、 b和6.;额外的文件2:表S2)。在基因80型中,FB和NL之间存在50个(40个上调,10个下调)差异,FB和ML之间存在78个(50个上调,28个下调)差异2:表S2)。总之,这些发现表明,与基因型195相比,下调更多PR基因,在开花后基因型80中升高了更多的新陈代谢相关基因。
受体样激酶家族基因对早花的反应
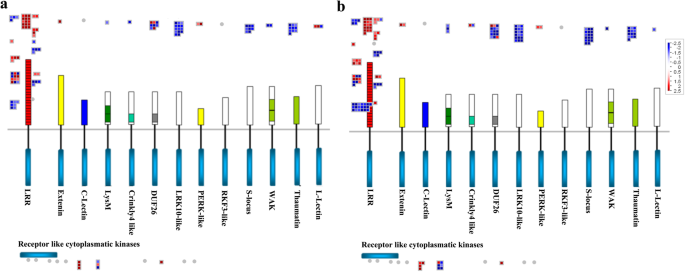
此外,我们还观察到了受体样激酶家族基因在开花初期表达的差异。例如,在基因型195中鉴定出117个NL和ML之间的DEG(48个上调,69个下调),在基因型80中鉴定出162个这样的DEG(52个上调,110个下调),主要包括编码细胞质激酶,LRR激酶,DUF 26(未知功能域26)受体样激酶,小麦LRK10(富含亮氨酸重复受体样激酶10)样受体激酶和S位点糖蛋白样激酶(图。4.a、 b和7.;额外的文件2:表S2)。同时,在基因型80中鉴定了在基因型80中鉴定出在FB和NL之间的83°(24个上调和59℃下调)和177℃(57个上调和120个下调)(附加文件2:表S2)。综上所述,这些结果表明,基因型80比基因型195对早期开花有更多的受体样激酶基因表达下调。
蛋白酶体相关基因对早花的响应
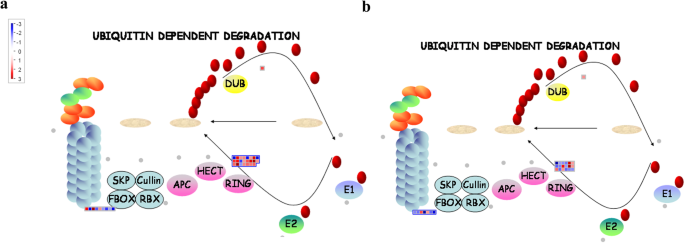
195基因型共鉴定出32个NL与ML之间的蛋白酶体相关的deg(21个上调,11个下调),80基因型共鉴定出25个上调,16个下调。这些基因主要编码F-box家族蛋白、真正有趣的新基因(RING) /U-box超家族蛋白和s -核糖核酸酶结合蛋白(图)。4.a、 b和8.;额外的文件2:表S2)。同时,在基因型80中鉴定FB和N1(四个上调和六个下调)和32°之间的FB和NL(16个上调和16个下调)之间的10℃(图。8.和9.;额外的文件2:表S2)。这些结果表明,响应于基因型80中的早期开花,下调更多的蛋白酶体相关基因。
RNA-seq鉴定DEGs的qRT-PCR验证
我们从195基因型中随机选择15个经转录组分析鉴定的NL和ML之间的deg进行qRT-PCT验证。15个DEGs中有6个与RNAseq数据吻合较好。这些基因包括参与ABA信号转导的基因,以及编码β -amyrin合成酶R(酪氨酸激酶家族蛋白、LRR受体样激酶和RING/U-box超家族蛋白的基因。对于基因型80,NL和ML之间所有DEGs的表达均表现出RNAseq数据与qRT-PCR分析的高度相关性;同样,FB和NL之间的6个DEGs和11个DEGs也显示出RNA-seq数据与qRT-PCR分析的良好一致性(图1)。10.;额外的文件3.:表S3)。
讨论
苜蓿的早期开花与激素新陈代谢有关
激素在控制植物生长发育中起着独特的作用,特别是在开花过程中[24.那25.].例如,蟾蜍蛋白生物合成,信号传导或极性制造型传输的破坏可以广泛抑制花序的启动[15.那26.]而外源ABA或JA能显著延缓花的转变[13.那14.]. 外源水杨酸是通过抑制植物生长来诱导开花的FLC.表达和增加英国《金融时报》那CO.,SOC1级在烟草中的表达(烟草l .) [27.],浮萍属paucicostata[28.]和拟南芥[29.]. 在本研究中,早花基因型80的新叶与成熟叶的激素含量(IAA、ABA、SA和JA)之比低于晚花基因型195。与此一致,在表型80中,11个生长素相关基因在NL中表达下调,这些包括编码SAUR家族蛋白、o-岩藻糖基转移酶、生长素外排载体组分5和血栓素-A合酶的那些。与基因型80中的ML相比,NL中有7个JA相关基因表达下调,包括编码脂氧合酶、12-氧代二烯酸还原酶样蛋白和SAMT的基因。同时,我们观察到基因型80的FB中JA生物合成相关基因上调,如编码SAMT和lipoxygenase3/5的基因,我们在基因型80的FB中检测到更高的ABA和SA含量,以及更高的HVA22家族蛋白和SAMT编码基因转录水平,与基因型195相比。已知ABA主要在花蕾和花序组织中诱导AtHAV22表达,而SAMT催化SA产生水杨酸甲酯,在拟南芥和白茶中具有抗病性(山茶花Sinensis.l .) [30那31那32].因此,基因80型的早花表型可能受到JA生物合成基因的负调控,这些激素的交互网络也可能促进了苜蓿的早花。
苜蓿的早期开花与病因相关和信号受体激酶基因有关
植物对生物和非生物胁迫的反应通常是将更多的资源从生长发育中转移出来,以促进早期开花[9.].例如,被真菌和细菌病原体感染的拟南芥植物显示出加速的开花时间和增加的花卉积分基因的转录水平英国《金融时报》和Gigantea.。进一步的研究表明,在拟南芥中上调了编码受体样蛋白的19个基因 -Fusarium oxysporum-抗性突变体[9.那33].本研究中,80型新叶中97%的PR基因表达下调,其中编码11个LRR家族蛋白、7个受体样蛋白和18个TIR-NBS-LRR类蛋白的基因表达显著下调。与195型相比,80型有67.9%的激酶信号通路相关基因表达下调,包括74个LRR蛋白中的38个、15个DUF26激酶中的12个、30个小麦lrk10样激酶中的30个、16个s位点糖蛋白样激酶。先前的研究表明,过度表达TaBRI1(芸苔类固醇-不敏感1),直立的在拟南芥和番茄中分别诱导早花和增大鳞片大小,并且番茄LRR受体样激酶的过度表达增强了抗旱性[34那35]. 另外,过表达AtLRK10L1.2是小麦LRK10样激酶的同源物,对ABA信号转导和抗旱性具有积极响应,这与拟南芥早期开花有关[16.].结果表明,在田间试验中,基因型80在遭受病原菌攻击和非生物胁迫的同时,也表现出了开花早的特征。同样,与晚花基因195相比,基因80的发病相关和信号受体激酶基因显著下调。
苜蓿的早花与次生代谢和蛋白质降解有关
2-酮戊二酸/Fe(II)依赖的双加氧酶在次生代谢产物合成中起着多种作用,并在花发育过程中催化差向异构化和去甲基化[36那37].例如,PKDM78和JMJ14型,其中2-氧化含量,抑制了花卉积分试剂基因的表达英国《金融时报》那AP1.那SOC1级,LFY.通过介导染色质H3K4去甲基化,从而抑制拟南芥的花转化[38那39].本研究中,基因型80的新叶中10个2OG加氧酶中有8个显著下调,说明2OG加氧酶可能对早花产生负面影响。此外,有研究报道,糖基转移酶催化植物次生化合物的糖基化,以维持细胞稳态,调节植物生长发育[40].糖基转移酶基因的异位过度表达UGT87A2和PtGT1被发现抑制了FLC.在拟南芥和烟草中分别表达和增加花整合子基因的表达,从而导致开花早型[40那41]. 与基因型195相比,基因型80的新叶中有7种UDP糖基转移酶显著上调;与基因型80的成熟叶或新叶相比,这些基因在花芽中也显著上调ugt.基因80可能在调控早花过程中起关键作用。广泛存在的泛素/蛋白酶体系统通过参与信号转导级联、病原体防御和生物和非生物胁迫反应影响植物发育[19.].例如,HOS1(渗透响应基因的高表达1),一种含环形手指的E3泛素连接酶,对拟南芥的致态丰度和延迟开花时间进行负面调节[42].相比之下,FKF1 F箱蛋白与CDF1(循环DOF因子1)物理地相互作用以诱导其降解,从而增加CO的表达,这促进拟南芥早期开花[43].此外,F-Box蛋白不明飞行物(不寻常的花卉器官)与AP3启动子联合以增强LFY.转录[44].与这些已发表的数据一致,我们发现与基因型80相比,在基因型195中的新叶片中显着上调了11个环/ U形盒超家族蛋白的九个,表明这些泛素/蛋白酶体相关基因可能是开花时间的负调节器。与基因型195相比,七个F盒系列蛋白中的六个在基因型的新叶中显着下调,表明这些F箱蛋白可以在苜蓿中促进早期开花。这些发现表明,二次新陈代谢基因和蛋白质降解基因对于苜蓿的开花时间调节可能是必不可少的。
结论
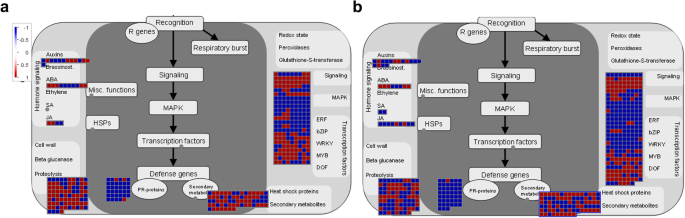
根据表型、生理和转录组分析,新叶中JA含量的降低和JA生物合成基因(包括脂氧合酶、12-氧二烯酸还原酶类蛋白和SAMT)的下调可能在调控紫花苜蓿早花表型中起重要作用。进一步的分析表明PR.基因(包括编码LRR家族蛋白、受体样蛋白和TIR-NBS-LRR类蛋白的基因)、编码信号受体激酶家族成员的基因(包括DUF26和小麦LRK10样激酶)、编码2OG加氧酶和UGT的二次代谢基因,蛋白酶体降解途径基因(如编码RING/U-box超家族蛋白和F-box家族蛋白的基因)也有助于苜蓿早期开花的建立(图。11.). 综上所述,我们的研究结果为苜蓿早期开花的调控机制提供了深入的见解,并为今后苜蓿的功能鉴定和遗传改良提供了新的靶基因。
方法
植物材料和生长条件
如前所述,美国农业部国家植物种质系统提供了苜蓿基因型80(登录号PI183404,在印度收集)和基因型195(登录号PI584512,在加拿大收集)[45]. 幼苗移栽到北京中国农业大学Shangzhuang实验站(116.32)O.E, 40.14O.n)在2018年。连续两年的开花时间调查表明,基因型80在2018年和2019年的基因型早于基因型20天开始花20天。我们将其克隆物系从切屑传播,并在25°的受控气候增长室中繁殖它们的克隆物系。23°C(日/夜),具有16-H Photopheriod,650 mmol m-2S.-1光照强度和60%相对湿度。三个重复以随机完全区组设计排列,每个重复包含三株(来自一致基因型的同一克隆)在单独的花盆中生长。
总RNA提取、RNA- seq文库构建及测序
基因型80和基因型195第一次开花时,每个重复采集3株植株的成熟叶片、新叶(包括顶端分生组织)和花蕾。收获的组织立即在液氮中冷冻,并在-80°C保存以提取RNA。总RNA根据制造商的说明使用Trizol试剂(Invitrogen公司,美国)提取。DNase处理后,采用美国安捷伦生物分析仪2100 (Agilent Bioanalyzer 2100)测定RNA的质量和浓度,对比值≥2.0、RNA完整性数(RIN)≥8的样本进行转录组测序。根据制造商的建议,使用NEBNext®Ultra™Illumina®(NEB, USA) RNA文库预备试剂盒生成RNA文库。文库在Illumina Hiseq 2000平台(Illumina, USA)上进行测序,生成端对reads。为了质量控制,FASTQ格式的原始读取通过内部Perl脚本进行处理,之后包含适配器序列的读取被删除,获得了15个苜蓿样品的100.13 Gb的干净读取。接下来,计算干净reads的Q30、gc含量和序列重复水平。所有下游分析均在高质量的清洁读数上进行。非冗余ungenes的从头组装采用trinity程序(v20131110) [46].
单基因功能注释及差异表达基因分析
在e值阈值≤10的情况下,通过BLAST搜索NR、NT、protein family (Pfam)、COG、Swiss-Prot、GO、KEGG等公共数据库对unigenes进行功能注释− 5.。使用DESEQ R包(V1.10.1)进行不同组织之间的抗度的鉴定[47]和GENES | LOG2折叠变化| > 1.5 and an adjustedP.-价值< 0.05被认为是差异表达。为了对所鉴定的蛋白质进行分类和功能分析,利用植物学方法对其同源物进行了鉴定Medicago Truncatula.基因组数据库(https:///phytozome.jgi.doe.gov/pz/portal.html# !info?alias=org_mtruncatula.,mt4.0v1,电子值<10− 5.),以及MapMan软件(https://mapman.gabipd.org/download(V3.5.1R2)进行开花时间相关调控网络分析。维恩图和热图用TBtools (https://github.com/cj-chen/tbools/releases.).
苜蓿内源ABA、IAA、JA和SA分析
测定基因型80和195叶片(与RNA-seq分析所用叶片相同)中内源激素含量。ABA、IAA、JA和SA采用以前报道的方法提取纯化[45那48].简单地说,在液氮中研磨~ 50 mg的冷冻组织,与500 μL的吲哚丙酸提取缓冲液(2:1稀释)和50 μL的内标物(2H6.阿坝州,2H2IAA,2H5.是的,和2H4.SA)。将混合物以15000g离心5分钟,将上清液与1mL氯仿混合,并溶解在100μl甲醇中,并根据CaO等人与串联质谱(LC-MS)偶联液相色谱法。[48] . 根据内标标准曲线计算每种激素的含量,并归一化为与三个生物重复相关的鲜重(FW)。
16个DEGs的qRT-PCR验证
总RNA从用于RNA-seq分析的相同样本中分离,使用RNAprep纯植物试剂盒(天根,中国北京)按照制造商的说明。使用Takara mlv逆转录酶(Takara Bio, Inc., Otsu, Japan)合成第一站cDNA,该酶用于Bio- rad CFX96实时PCR检测系统上的qRT-PCR分析,该系统有4个生物重复体,并使用SYBR Premix Ex Taq (Takara Bio, Inc., Otsu, Japan)。随机选取16个unigenes使用基因特异性qRT-PCR引物进行qRT-PCR分析(附加文件3.:表S3)。2——ΔΔCT方法 [49]计算各基因对内源对照的相对表达量肌动蛋白。
统计分析
所有数据采用一般线性模型在SAS 9.0 (SAS Institute, Cary, NC)中进行方差分析(ANOVA)。Fisher最不显著性差异检验(LSD,P.Ma等用< 0.05来确定治疗之间的显著差异[50].
数据和材料的可用性
RNA-seq数据已存入NCBI,注册号为PRJNA602419 (https://dataview.ncbi.nlm.nih.gov/object/PRJNA602419).
缩写
- 英国《金融时报》:
-
开花轨迹T.
- FLC公司:
-
开花基因座C.
- CO:
-
康斯坦斯
- SOC1:
-
Constans1过表达的抑制
- SPL:
-
SQUAMOSA发起人BINDING-LIKE
- JA:
-
jasMonate-astivated.
- 美国律师协会:
-
脱落酸
- 第五章:
-
脱落酸敏感突变体5
- RLK:
-
受体激酶
- LRR:
-
富含亮氨酸的重复
- 公共关系:
-
Pathogenesis-related
- 国际宇航科学院:
-
生长素
- 南非:
-
水杨酸
- SAMT:
-
SA羧基甲基转移酶
- TIR-NBS-LRR:
-
Toll-Interleukin样受体 - 核苷酸结合位点-LRR
- CC-NBS-LRR:
-
线圈NBS LRR
- NB-ARC:
-
APAF-1,R蛋白和CED-4共享的核苷酸结合衔接子
- 2、加氧酶:
-
2-氧代摩托酸盐和Fe(II) - 依赖氧酶超家族蛋白质
- Bri1:
-
Brassinosteroid-Insensitive1.
- CDF1编号:
-
循环DOF因子1
- 飞碟:
-
不寻常的花卉器官
- UGTS:
-
UDP-Glycosyltransferase总科的蛋白质
- 第26页:
-
未知函数的域26
工具书类
- 1。
对苜蓿进行分子改良,提高产量和在变化环境中的适应性。植物细胞环境。2018;41(9):55 - 71。
- 2。
库马尔S。苜蓿改良的生物技术进展。苹果基因杂志。2011;52(2):111–24.
- 3.
Adhikari L,Makaju SO,Missaoui AM。四倍体苜蓿开花时间和生物产量的QTL定位(Medicago Sativa.l .)。BMC植物BIOL。2019; 19(1):359。
- 4.
风扇W,GE G,刘y,王W,刘L,贾Y.与代谢组学相结合的蛋白质组学:分析不同生长阶段苜蓿营养变化的内部原因。BMC植物BIOL。2018; 18(1):78。
- 5.
Andrésf,屈曲。对季节性提示的开花反应的遗传基础。NAT Rev Genet。2012; 13(9):627-39。
- 6.
Blümelm,dally n,jung c.在农作物中开花时间调节 - 我们从拟南芥中学到了什么?CurrOgin Biotech。2015; 32:121-9。
- 7.
Fornara F,de Montaigu A,库普兰G。拟南芥开花的控制。牢房。2010;141(3):550.
- 8.
苜蓿开花位点T同源物MsFTa的分离与功能鉴定(英文)Medicago Sativa.l .)。国际分子科学杂志。2019;20(8):1968。
- 9.
里昂R、鲁苏A、斯蒂勒J、鲍威尔J、礼仪JM、哈萨克斯坦K。水稻开花时间与防御关系的研究拟南芥-Fusarium oxysporum互动。公共科学图书馆一号。2015;10(6):e0127699。
- 10。
王G,KöhlerC.开花植物繁殖中的表观遗传过程。J Exp Bot。2017; 68(4):797-807。
- 11.
王杰。MiR156介导的年龄途径的开花时间调节。J Exp Bot。2014; 65(17):4723-30。
- 12.
拟南芥rna结合蛋白FCA需要赖氨酸特异性去甲基化酶1同源物来下调FLC。摩尔细胞。2007;28(3):398 - 407。
- 13。
王赫,李毅,潘杰,娄德,胡毅,于德。bHLH转录因子MYC2、MYC3和MYC4是茉莉酸介导的拟南芥开花抑制所必需的。摩尔植物。2017;10(11):1461–4.
- 14
王Y,Li L,YE T,Lu Y,Chen X,Wu Y. ABA对花卉过渡的抑制作用是由Abi5在拟南芥中介导的。J Exp Bot。2013; 64(2):675-84。
- 15
Campos-Rivero G,Osorio-Montalvo P,Sánchez-Borges R,US-Camas R,Duarte-Akéf,De-La-PeñaC.植物激素在开花中的信号传导:一个表观遗传的观点。J植物理性。2017; 214:16-27。
- 16
LIM CW,Yang Sh,Shin Kh,Lee Sc,Kim Sh。小麦LRK10的ATLRK10L1.2,拟南芥orthologog涉及ABA介导的信号传导和抗旱性。植物细胞代表2015; 34(3):447-55。
- 17.
Torti S,Fornara F,Vincent C,Andrésf,Nordströmk,GöbelU,Knoll D,Schoof H,Conceand G.拟南芥拍摄分析在花卉过渡期间的分析鉴定了不同的调节模式和富含少氨酸的重复蛋白开花。植物细胞。2012; 24(2):444-62。
- 18.
加乔莫EW,吉诺巴蒂斯特L,凯费拉T,赛德尔WM,科托尼SO。拟南芥CURVY1(CVY1)基因编码一种新的受体样蛋白激酶,调控细胞形态发生、开花时间和种子产量。BMC植物生物学。2014;14(1):221.
- 19.
Sharma M.植物U字箱(PUB)蛋白在压力与发育中的作用。植物压力。2013; 7:1-9。
- 20.
李W,戴L,王格。PUB13,U字箱/臂E3连接酶,调节植物防御,细胞死亡和开花时间。植物信号表现。2012; 7(8):898-900。
- 21.
关键词:苜蓿,花期,茎尖,蛋白质组学,蛋白质组学Plant Mol Biol Rep. 2019;37(4): 265-76。
- 22。
汤姆森B,韦尔默F。花发育的分子调控。当前顶级开发生物。2019;131:185–210.
- 23。
óMaoiléidighds,wuest se,Rae l,拉加尼A,Ryan Pt,Kwasniewska K,Das P,Lohan Aj,Loftus B,Graciet E,Weller F。C函数调节器静止拟南芥生殖花器官身份规范的控制。植物细胞。2013; 25(7):2482-503。
- 24。
赵丽华,尹俊杰,安国强。环境因子对花期的控制。中国农业科学。植物j . 2017; 90(4): 708 - 19所示。
- 25。
戴维斯SJ。将激素整合到植物的花转化途径中拟南芥. 植物细胞环境。2009;32(9):1201–10.
- 26
郑毅、赵毅。生长素在花发育中的作用。综合植物生物学杂志。2007;49(1):99–104.
- 27
李永平,李永平。酚类物质对烟草组织培养芽形成和生长的影响。杂志。1965;18(2):386 - 402。
- 28
水杨酸和苯甲酸在光周期不敏感的Lemna paucicostata LP6开花过程中的作用。植物杂志。1992;100(3):1541 - 6。
- 29.
马丁内斯C、庞斯E、普拉茨G、莱昂J。水杨酸调节开花时间和联系防御反应和生殖发育。植物J。2004;37(2):209–17.
- 30.
CN,CCC,Zentella R,Pan Sm,Ho Th。Athva22在拟南芥中的基因家族:系统发育关系,ABA和应力调控和组织特异性表达。植物mol biol。2002; 49(6):633-44。
- 31.
Koo YJ,Kim MA,Kim EH,Song JT,Jung C,Moon JK,Kim JH,Seo HS,Song SI,Kim JK,Lee JS,Cheong JJ,Choi YD.水杨酸羧甲基转移酶的过度表达降低了水杨酸介导的细菌耐药性拟南芥. 植物分子生物学。2007;64(1–2):1–15.
- 32.
4 .邓伟伟,王荣,杨涛,Ln J,张兆忠。茶树水杨酸羧基甲基转移酶的功能表征及其在白茶萎蔫过程中的香气化合物。农业化学学报。2017;65(50):11036-45。
- 33.
拟南芥对病原菌侵染的发育响应。植物杂志。2003;133(1):339 - 47岁。
- 34。
Singh A、Breja P、Khurana JP、Khurana P。小麦油菜素类固醇不敏感1(TaBRI1)与TaSERK基因家族成员相互作用,导致拟南芥开花早和种子产量提高。公共科学图书馆一号。2016;11(6):e0153273。
- 35。
Villagarcia H, Morin AC, Shpak ED, Khodakovskaya MV。截短的ERECTA蛋白表达修饰番茄生长拟南芥. J实验机器人。2012;63(18):6493–504.
- 36。
贾B,贾X,金凯,Jeon Co。2-氧代劳拉特/ Fe(II) - 依赖氧酶的集成视图 - 细菌中的功能。Biochim Biophys Acta Gen Subj。2017; 1861(2):323-34。
- 37。
法罗SC,法奇尼PJ。植物代谢中2-羟戊二酸/铁(II)依赖双加氧酶的功能多样性植物科学与技术,2014;
- 38
陆飞、崔×、张S、刘丙、曹×。JMJ14是一种H3K4脱甲基酶,调控拟南芥的开花时间。Cell Res.2010年;20(3):387–90.
- 39
杨伟、姜丁、姜杰、何勇。植物特异性组蛋白H3赖氨酸4去甲基酶抑制拟南芥的花转变。植物J。2010;62(4):663–73.
- 40。
关键词:杨树,木质素,糖基转移酶,烟草abstract:实验机器人,2012;63(7):2799-808。
- 41。
王斌,金世华,胡海峰,孙玉国,王玉华,韩平,侯BK.拟南芥糖基转移酶UGT87A2通过开花位点C调控开花时间。新植物醇。2012;194(3):666–75.
- 42。
拉扎罗A、瓦尔弗德F、皮涅罗M、贾里洛贾。拟南芥E3泛素连接酶HOS1在开花的光周期调控中负调控CONSTANS丰度。植物细胞。2012;24(3):982–99.
- 43.
Imaizumi T、Schultz TF、Harmon FG、Ho LA、Kay SA。FKF1 F-box蛋白介导拟南芥CONSTANS阻遏子的循环降解。科学。2005;309(5732):293–7.
- 44.
Chae E, Tan QK, Hill TA, Irish VF。拟南芥F-box蛋白是调节花发育的转录辅助因子。发展。2008;135(7):1235 - 45。
- 45.
[15]葛玲,张凯,曹旭,翁勇,刘斌,毛平,马旭Medicago Truncatula.腋芽发展中涉及MSCYP20-3B的环疗素家族和功能分析。Mol Biol rep. 2020; 47(2):907-19。
- 46。
Grabherr Mg,Haas Bj,Yassour M,Levin JZ,Thompson Da,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q.从RNA-SEQ数据的全长转录组件没有参考基因组。NAT BIOTECHNOL。2011; 29(7):644。
- 47。
RNA-Seq数据在基因水平上的差异表达- DESeq包。德国海德堡:欧洲分子生物学实验室;2012.
- 48。
Cao J,Li M,Chen J,Liu P,Li Z. MeJA对内源性JA缺乏症的拟南芥代谢物的影响。SCI批准。2016; 6:37674。
- 49。
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25(4):402 - 8。
- 50.
Ma X,徐Q,Meyer Wa,Huang B.高高浮虫根茎发育的激素调节(季)与控制呼吸和氨基酸代谢的蛋白质组学变化相关。Ann Bot。2016; 118(3):481-94。
致谢
我们感谢a&l科学编辑(www.alpublish.com)在编写本手稿期间的语言援助。
资金
该研究得到了中国天然科学基金(31760698),宁夏农业育种项目(2019Nyyz0401),宁夏的主要研发项目(2019BBF02022-042),宁夏大学一流的纪律建设项目(生态学,Nxylxk2017b06),以及中央大学的基本研究资金(2018 QC144)。创始身体在研究和收集,分析和解释的设计中没有作用,数据和撰写手稿。
作者信息
从属关系
贡献
DM、BL和XM设计并执行了实验;DM、BL和XM撰写了手稿;XM和PM构思了这项研究,监督了项目,并编辑了手稿。LG、YW、XC和FL协助进行实验。所有作者都阅读并批准了最后的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
基因型195和80的DEGs注释。
附加文件2:表S2。
195和80基因型DEGs功能分类的Mapman显示。
附加文件3:表S3。
195和80基因型经RNA-seq鉴定的差异基因序列的qRT-PCR验证。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用这篇文章
马丹,刘斌,葛磊。et al。苜蓿新叶早花调控途径的鉴定与表征(Medicago Sativa.L.)通过转录组分析。BMC植物生物学21,8(2021)。https://doi.org/10.1186/s12870-020-02775-9
收到了:
公认:
发表:
关键字
- 苜蓿
- 开花时间
- 新的叶子
- 激素
- 转录组