摘要
背景
米饭是典型的单圈植物和重要的谷物作物。米花的结构单元是小尖峰和小花,花器官发展和刺激萌发会影响水稻繁殖和产量。
结果
在这项研究中,我们发现了一种新的长护颖(lsl2)来自EMS人口的突变体。首先,我们映射了lsl2基因在Indel7-22和Indel7-27标记之间,包含一个25 kb的区域。水稻基因组注释显示该区域存在4个候选基因。通过基因预测和cDNA测序,我们证实了目的基因在lsl2突变体是等位的长无菌LEMMA1(G1)/细长空颖(避署),以下简称为lsl2.对LSL2和LSL2蛋白的进一步分析显示出一种氨基酸变化,即,与LSL2相比,LSL2中丝氨酸(SER)79至脯氨酸(Pro)的突变,并且该突变可能改变蛋白质的功能。K.Nockout实验表明,lsl2基因负责长不育外稃表型。的lsl2该基因可能通过降低种子发芽率来减轻穗萌发所引起的损害,但其他农艺性状没有发生变化lsl2突变体。一起携带,我们的结果表明了lsl2基因在水稻育种中具有一定的应用前景。
结论
的lsl2基因对长期无菌引理表型负责,可以通过降低种子萌发率来降低穗萌发引起的损伤。
背景
心肺腺植物的花卉形式是多种多样的,花形态是授粉系统所诱导的遗传计划,物理力和外力之间的相互作用的结果[1].鉴定花器官和控制分生组织的命运是建立这种多样性的必要条件。在双子叶植物中,花通常由(从外部到内部的轮)萼片(轮)、花瓣(轮)、雄蕊(轮)和雌蕊(轮)组成。基于分子和遗传分析的几个eudicot种,包括拟南芥蒂利亚纳金鱼草(金鱼草majus)和喇叭花(佩妮矮牵牛),有人提出了一个ABC模型,该模型基于A/B/C/D基因组的组合来确定每个器官的特征并控制花分生组织的决定[2,3.,4,5,6,7].根据该模型,三种同源基因控制着花器官的形成。A功能基因独立地指定萼片形成;A-和B函数基因的组合决定了花瓣标识;B-和C函数基因共同调节雄蕊开发;只有C函数基因指定最内心的心皮。这种遗传模型不仅适用于逊扣,还适用于单子叶,包括一些草种,如米饭(栽培稻L。)和玉米(玉米)[8,9,10.,11.,12.].
米饭是一种典型的单圈植物和重要的谷物作物,小尖峰和小花是米花的结构单元。小穗是水稻花序的主要单位,含有肥沃的小花香和一对无菌lemmas(也称为“无菌雷姆玛”)[13.],小花组由一个引理,两个鹦鹉(相当于花瓣),六个雄蕊和雌蕊[14.,15.].
之前的一项研究表明sepallata.(9月)亚家族成员和LOFSEP子群麦斯- 箱基因在米花的发展中发挥着重要作用。在花开发期间,两个SEP3同系物和OsMADS7/8表达在内部的三个轮轴上,具有冗余功能[16.].除了OsMADS7和OsMADS8,绿叶船体灭菌1(oslhs1.),OsMADS5和osmads34 / pap.2据报道,在花卉发展中的作用[17.].一些早期研究发现OsMADS34 / PAP2调节小穗分生组织的身份以及胚珠和不育外稃的发展。在Osmads34/pap2突变体,不育的外稃伸长形成叶状或外稃状器官[17.,18.,19.].evolution和序列分析的结果OsMADS34 / PAP2支持稻米无菌泌乳来自退化的小花状引理的假设,其被命名为基本的雷姆玛[19.].长无菌外稃1 (g1)/拉长空颖(ele)编码一个含有duf640的蛋白质,该蛋白质决定了不育外稃的身份。的突变G1 / ELE.诱导不育外稃成为外稃样器官[20.,21.].有趣的是,不育外稃中的自然突变在异源四倍体基因组中引起类似的同源性转换选用grandiglumis,这表明无菌lemmas可能构成一系列改性的引理同源物G1 / ELE.[20.].
虽然控制水稻中生殖器官的发展的分子机制是众所周知的,但长期无菌引理的作用以及是否影响水稻的农艺性质仍不清楚。在这项研究中,长不育外稃2(lsl2),一种新的强突变等位基因G1,鉴定为中华11号(ZH11)背景。我们映射lsl2,分析了LSL2蛋白的3-D结构,发现LSL2蛋白质遗留了一种氨基酸变化,即丝氨酸(SER)79对脯氨酸(Pro)的突变,并且这种变化可能会改变LSL2蛋白的结构。我们还表现出分子克隆lsl2并对其农艺性状进行了分析lsl2突变体。综上所述,结果表明lsl2对水稻杂交育种有一定的应用价值。
方法
植物材料
籼稻大米CO39和japonica.ZH11由福建农林大学植物免疫中心提供,福建省农业科学院水稻研究所保存。从菌株中筛选出ZH11背景的长株不育外稃突变体2以甲基磺酸乙酯(EMS)处理的种群命名长不育外稃2(lsl2).2016年和2017年,大约800个单独的植物1在福建省农业科学院福州实验站田间种植M2群体和6000株单株。
在2018年夏天,lsl2突变体与水稻品种CO39和ZH11杂交,作为花粉供体。F1春季在海南省三亚市(北纬18.14,东经109.31)试验站播种2种子收获。F2种子lsl2福建省福州福州(北纬26.08号纬度,119.28号电源)播种,苏州夏季播种。植物身高,每株植物数,旗叶长度和宽度,每穗小穗数,种子设定率在成熟时测量。在成熟后检查突变体与野生型植物的分离比。
所有的植物都是按照标准的商业程序种植的。行距为13.3 ~ 26.4 cm,田间管理基本遵循常规农业管理方式。
构建映射人口
的lsl2突变体(japonica.)用CO39杂交(籼稻)制作映射人口。F2通过F的自交叉构建人口1群体中1084个突变表型植株2选择群体进行精细映射。
微卫星分析
简单序列重复(SSR)引物从已发表的水稻数据库(http://www.grachene.org/microsat/ssr.htm1.).通过手动比较之间的基因组序列来设计诱导标记japonica.(简历。Nipponbare) [22.] 和籼稻(cv。93-11)[23.].首先,细菌人工染色体(BAC)的克隆序列japonica.和籼稻比较,然后使用底漆总理5.0来设计两种稻米之间的多晶型区域的引物,用于基因定位。
PCR(聚合酶链反应)扩增和标记物检测
利用CTAB法从冰冻的水稻叶片中提取植物DNA [24.],微不足道的修改。对于PCR扩增,每20μL反应混合物含有30ng的DNA,每个引物的0.4μm,以及2×ES标签Mastermix(染料)。使用以下程序进行扩增程序:在94℃下在94℃下进行2分钟,在94℃,55℃下的33个循环,30℃,72℃,30秒,最终延伸2分钟72°C。通过溴化乙锭染色,在3%琼脂糖凝胶中电泳进行PCR产物[25.].
膨胀的分离分析
通过大量分离分析(BSA)鉴定与目的基因相关的标记。随机选取15株突变株的叶片DNA2群体构建突变体DNA文库。从水稻基因组中提取的DNA进行分析,根据SSR标记在水稻基因组中的分布来检测连锁lsl2突变体和CO39(作为对照)。与突变基因相关的标记带与发现的突变基因相同lsl2突变体。
分子映射lsl2基因
突变的带类型(lsl2 lsl2)和野生型ZH11 (LSL2 LSL2)分别表示1和3,杂合子植物(lsl2 lsl2)被指示为2. MapMaker版本3.0软件用于链接分析lsl2轨迹和SSR标记[26.],利用MapDraw V2.1软件估算遗传距离[27.].本研究中获得的联系地图几乎等于先前报告的[28.].
首先,从米分子图中选择326个SSR标记,以分析多态性lsl2和CO3929.].在这些标记中,有205对显示多态性,根据这205对标记,从F中筛选出15个突变株和15个正常株2对种群进行连锁分析lsl2轨迹。其次,为了将该基因划分到更小的区域,我们从F2人口lsl2× CO39和indel标记用于预测水稻基因组间的多态性可能性lsl2和CO39通过比较来自Nipponbare (http://rgp.dna.affrc.go.jp/)和籼稻品种93 - 11 (http://rice.genomics.org.cn/).
物理地图建设
使用CV的细菌人工染色体(BAC)和P1衍生的人工染色体(PAC)克隆进行生物信息学分析。Nipponbare由国际水稻基因组测序项目(IRGSP)发布(IRGSP,http://rgp.dna.affrc.go.jp/irgsp/index.html.)来构建目标基因的物理图谱。将克隆固定在目标基因的结合标记上,并通过BLAST (http://爆炸/ bl2seq / b12.html www.ncbi.nlm.nih.gov).
生物信息学相关分析
基于现有的序列注释数据库预测候选基因(http://rice.plantbiology.msu.edu/;http://www.tigr.org/).DNA和氨基酸序列lsl2和LSL2使用Clustal X version 1.81进行了完全比较。预测和分析了lsl2和lsl2蛋白的三维结构(https://swissmodel.expasy.org/).单倍型分析lsl2和LSL2也进行了(http://www.rmbreeding.cn/Genotype/haplotype).
定向诱变LSL2在含有CRISPR/Cas9基因的水稻中
的LSL2在ZH11基因的第一个外显子长度为106 bp的一个gRNA间隔子上靶向。特异性高的gRNA间隔序列(补充表)1)是利用CRISPR-plant数据库和网站设计的[30.,并对再生植株中靶基因的基因组编辑突变进行了评价。采用PCR方法检测基因的缺失和插入。从转基因crispr编辑的品系中选择PCR产物进行测序,确定特异性突变。采用退化序列译码方法解决双峰[31.].CRISPR / CAS9研究中使用的引物列于补充表中1.
RNA提取和表达状态LSL2RT-qPCR(定量逆转录PCR)
根据制造商的协议使用试剂盒(Magen, IF210200)进行RNA提取。用Nanodrop进行总RNA质量检测,确定RNA浓度;测定RNA完整性的非变性琼脂糖电泳。
的表达式状态验证LSL2,选择空颖片和外稃/外稃进行qPCR。反转录合成cDNA,利用Primer5软件设计QPCR引物,根据NCBI数据库(QPCR - f -5 ' ccgggactggcagaccttca3 ', QPCR - r -5 ' gtcgcatcgccgtcgttca3 ')评价QPCR引物的特异性。构建表达水稻基因的泛素结合酶E2被归一化为内参基因[32.].对三种生物重复中的每一个进行三种技术重复。
发芽率的测定
每个水稻材料在植物光培养箱中培养24 h;每种材料萌发100粒种子,每种材料重复萌发4次。按标准发芽试验方法进行发芽试验。发芽床由纸组成,试验在25℃下进行。2 d后记录萌发种子数,7 d后连续记录萌发率。保持湿度和温度条件。
结果
主要农艺性状lsl2
为了阐明水稻花发育的调控基因,我们在ems诱变群体中筛选了一个小花突变型,并鉴定了一个小花突变型长不育外稃2(lsl2)ZH11背景中的突变体。表型比较lsl2突变体和野生型ZH11植物呈现在表格中1.结果表明,在株高、穗长、有效穗数、每穗颖花数、结实率、千粒重、粒长和粒宽等主要农艺性状上差异不显著。
表型观察和分析lsl2突变体
在植物阶段,ZH11的表型和lsl2植株无明显差异,但从孕穗期到成熟期,小穗表现出不同的表型1和图。1a, b).不育外稃LS12突变体明显长于Z11的突变体,尽管小尖头的其他组分相同(图。1a,b)。有趣的是,在谷物尺寸或糙米大小没有显着差异lsl2成熟后ZH11(表1和图。1c, d)。
我们比较了种子的发芽率lsl2和Zh11种子。第二天,野生型Zh11工厂开始发芽(69.3%),但是lsl2突变体勉强开始发芽(2.3%)(图。2和表格2).与野生型植物相比lsl2从第2天到第4天,突变体的发芽率明显降低(表)2).
遗传分析lsl2突变体
确定是否lsl2突变体是由单一基因引起的,然后我们越过了lsl2突变与z11。F1表型正常,F2人口展出孟德尔隔离(表3.).实际上,野生型和突变植物之间的偏析对应于两个F中的3:1分离比2人口(χ2= 0.124 ~ 0.462,P> 0.5),表明lsl2突变表型由单个隐性基因控制。
初始定位lsl2基因
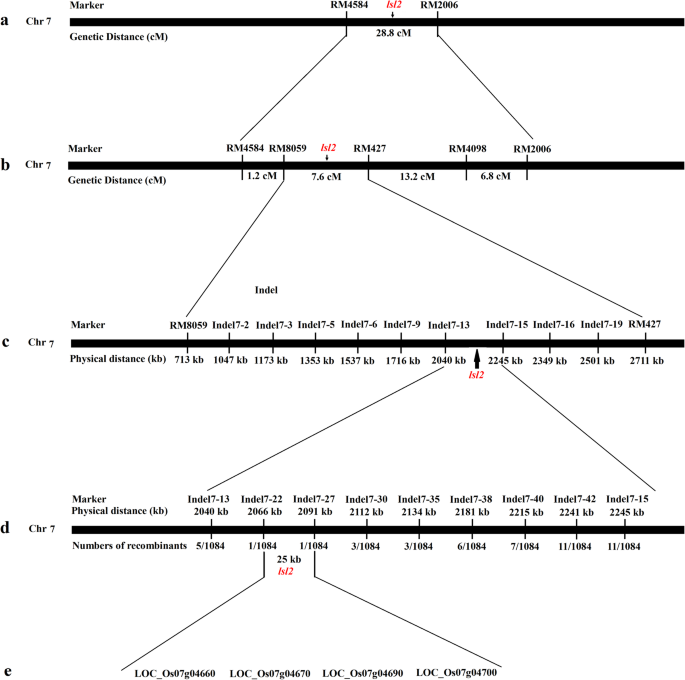
来确定是哪个基因突变导致了lsl2表型,然后我们绘制lsl2基因。研究发现,位于水稻7号染色体上的两个SSR标记RM4584和RM2006与193 F的突变性状相关2个人。根据重组频率计算RM4584与RM2006之间的遗传距离为28.8 cM。因此,lsl2位于28.8厘米的区域,位于由SSR标记RM4584和RM2006侧翼的染色体7上(图。3.一个)。
精细映射lsl2基因
将基因描绘为较小区域,使用已发表的标记构建RM4584和RM2006之间的精确图(表4).通过遗传联系分析,lsl2基因定位在RM8059和RM427分子标记之间,距离为7.6 cM。3.b).为了进一步定位,所有重组基因使用9个多态标记进行基因分型(表)4).结果表明lsl2基因位于Indel7-13和Indel7-15分子标记之间,物理距离为205 kb(图2)。3.c和表4).对于精细的映射lsl27个多态indel标记用于重组基因的筛选(表1)4)检测到1、1、3、3、6、7和11个重组植株(图。3.d)。因此,我们精确地局限于lsl2Indel7-22和Indel7-27之间的分子标记,物理距离为25.0 kb。
25.0 kb区域的候选基因
4个候选基因(LOC_Os07g04660, LOC_Os07g04670, LOC_Os07g04690和LOC_Os07g04700)在这个25.0 kb的区域被注释(图)。3.e)。根据可用的注释数据库,这四个基因都具有相应的全长cDNA。LOC_OS07G04660编码白棕色复合同源蛋白16,LOM_OS07G04670,LOM_OS07G04690和LOM_OS07G04700分别编码DUF640域域的蛋白质,UDP-Arabinose 4-eBimerase 1和MyB系列转录因子。
序列分析lsl2基因
为了分析导致突变表型的基因,我们对ZH11和ZH11中的上述4个基因进行了测序lsl2在野生型ZH11与野生型ZH11之间,LOC_Os07g04670仅有1-bp的变化(T - to - C)lsl2突变体植物。其他三个基因的序列没有观察到其他差异。因此,我们推测LOC_Os07g04670位点对应于lsl2.有趣的是,这G1 / ELE.编码DUF640结构域蛋白的基因,存在于该位点[20.].根据表型相似性和定位分析结果,我们假设长不育外稃表型lsl2可能是由LOC_OS07G04670基因座的乘积的功能变化引起的。这些结果表明了lsl2基因可能是等位基因G1 / ELE..
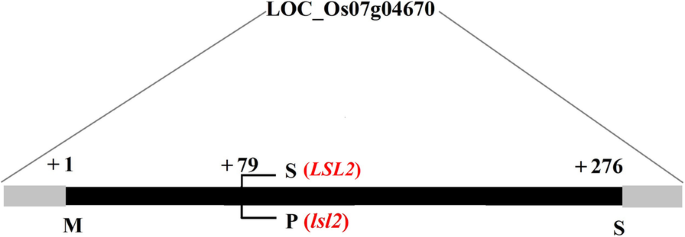
对开放阅读片段(ORF)的分析LSL2基因(LOC_Os07g04670)显示一个外显子,没有内含子。lsl2是一个1-bp突变体,导致一个丝氨酸(Ser)和一个脯氨酸(Pro)交换(图。4).Ser是极性氨基酸,而Pro是非极性氨基酸。因此,这种突变可能会改变蛋白质的功能。
的lsl2基因负责长不育外稃表型
证实该突变表型可归因于lsl2,我们检查了是否淘汰LSL2结果表明,在ZH11品种中产生长时间的不育外稃表型。设计了一个序列特异性引导RNA (sgRNA)来敲除LSL2利用CRISPR/Cas9基因编辑系统进行基因编辑。我们一共获得了3个独立事件的3个植物,并通过测序确认其在靶位点进行插入和缺失(表)5).
然后我们研究了这三个纯合子株系成熟后的穗部特征,发现这三个株系都表现出一个长不育外稃表型(图。5),这表明敲除LSL2导致长时间不育外稃突变表型。
QPCR确定表达状态LSL2
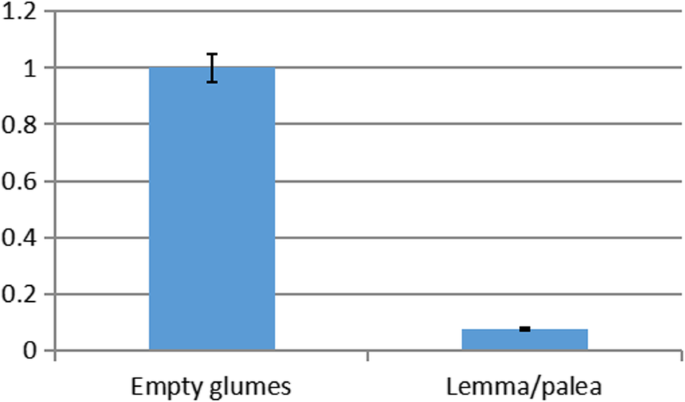
的表达式状态验证LSL2,选择空颖片和外稃/外稃进行qPCR。结果表明LSL2在空血糖和雷姆玛/宫颈中显着表达,并且空血糖中的表达水平显着高于LEMMA / PALEA中的表达水平(图。6).
LSL2蛋白与LSL2蛋白之间的三维结构分析
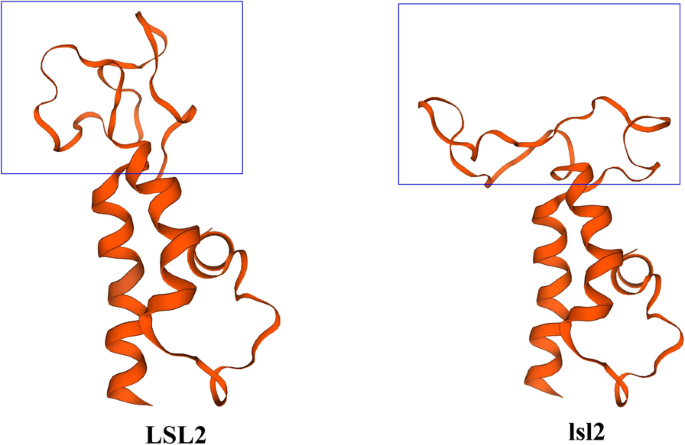
进一步模拟蛋白质的三维结构,揭示了lsl2和lsl2蛋白之间的变化(图。7).此外,LSL2的79残基从Ser到Pro的变化引起了蛋白结构的显著变化(图)。7).
单倍型分析LSL2基因
为进一步研究其遗传和进化特征LSL2基因,我们进行了CNCGB和CAAS数据库中可用的3000序列水稻基因组的SNP(单核苷酸多态性)呼叫和单倍型分析[33.]并找到492个单倍型LSL2在15份以上的水稻资源材料中,包括49个单倍型2).然而,未发现单倍型或SNPlsl23000个水稻基因组序列中的突变体。
讨论
空颖和外稃发育的机制
决定外稃发育的分子机制不同于参与空颖发育的分子机制[13.].据报道,两个基因,G1 / ELE.和OsMADS34 / PAP2,确定空胶粒的身份[13.].研究表明了G1 / ELE.基因是保持空血糖的身份的关键[20.].同样,林等人。研究表明OsMADS34 / PAP2基因在空颖发育中起关键作用[19.].通过分析Osmads34/pap2Lin等人提出空颖片来源于引理,并将其命名为基本引理[19.].OsMADS1指定lemma和PALEA的身份,并将空鹭与雷姆玛/守特区分开[34.,35.].
然而,对于空颖片的身份存在一些有争议的解释,包括真颖片和外稃。例如,研究表明,空颖片是两个较低的退化小花的残余[20.], Lin等以同样的方式假设空颖片是从外稃中派生出来的,并以降解的外稃来命名这些空外稃[19.].随着越来越多的调控外稃发育的基因被克隆和鉴定,并进一步分析其在空颖中的表达,这些发现将为确定空颖的特性提供线索。
在这项研究中,我们剔除了LSL2利用CRISPR/Cas9基因编辑系统,得到3个独立的序列,分别为1号线插入1-bp, 2号线缺失2-bp, 3号线缺失1-bp。进一步的穗部性状分析表明,这3个株系均表现出长不育外稃表型。5和表格5),这种表型与之相同lsl2突变体。因此,lsl2结果表明,该基因与长不育外稃表型有关。
进一步的研究和外稃发育的分子证据将为确定空颖的身份提供线索。进一步的研究还需要揭示在基于外稃的颖片鉴定中发挥作用的关键基因。
遗传和进化分析LSL2基因
3000测序水稻基因组的单倍型分析显示了492个单倍型LSL2基因(补充表2).然而,没有单倍型或SNPlsl2在3000个测序的水稻基因组中发现了含有T-to-C突变体的突变体。我们推测,这个位点的突变在自然选择中会被强选择,而只会是人工选择的结果。例如,的表型lsl2可能与育种者的期望不一致;因此,通过手动选择逐渐消除这种突变。
因为对LSL2和LSL2的三维结构的模拟表明,T-to-C氨基酸的变化改变了蛋白质的结构(图。7),我们推测这一变化可能会影响LSL2的特定功能,如其与靶蛋白的结合活性。
施工前景分析LSL2基因
虽然lsl2突变不影响主要农艺性状,无论是影响水稻的内部特征仍然不清楚。萌发率的比较lsl2和ZH11种子表明lsl2突变体显然从第二天到第四天的发芽率明显降低了(表2).我们认为,造成这种差异的最可能的原因是lsl2可能会抑制胚胎的生长。
水稻中的穗萌发与种子萌发率密切相关。在全球杂交水稻的生产中,穗萌发是一种突出的问题,影响水稻产量和加工质量,这些影响导致不同程度的经济损失[36.].在这项研究中,我们发现lsl2诱变通过降低种子发芽率来降低穗萌发所引起的危害。有趣的是,水稻的其他农艺性状没有受到影响lsl2突变体(表1).因此,lsl2基因在水稻育种中具有特定的应用前景。首先,育种者可以使用优异的常规水稻品种使用lsl2.第二,lsl2基因由单个隐性基因控制(表3.);因此,育种家可以利用分子标记辅助选择将该基因转移到恢复系和不育系中,以培育杂交水稻新品种。
结论
在这项研究中,我们发现了一种新的长护颖(lsl2)来自EMS人口的突变体,发现了lsl2lsl2蛋白中丝氨酸(Ser) 79突变为脯氨酸(Pro),与lsl2蛋白相比,lsl2蛋白的单氨基酸变化可能改变lsl2蛋白的功能。本研究结果表明lsl2突变体可能通过降低种子发芽率来减少穗萌发所造成的危害。
数据和材料的可用性
在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。基因组序列LSL2,可于NCBI资料库(http://www.ncbi.nlm.nih.gov/),GenBank的数量是AB512480.1。
缩写
- 苏维埃社会主义共和国:
-
简单序列重复
- indel:
-
插入/删除
- ZH11:
-
Zhonghua11
- BAC:
-
细菌人工染色体
- PAC:
-
P1衍生的人工染色体
- SNP:
-
单核苷酸多态性
- EMS:
-
乙显示出
- lsl2:
-
长不育外稃2
- RT-qPCR:
-
定量逆转录PCR
参考
- 1。
De Craene LR。理解花发育在被子植物花进化中的作用:从历史和物理动力学角度的澄清。acta botanica yunnanica(云南植物研究);
- 2。
王志强,王志强。花发育的遗传调控。植物学报。大自然。1991;353:31-7。
- 3.
植物生物学:花的四重奏。大自然。2001;409:469 - 71。
- 4.
花发育的ABC模型。咕咕叫医学杂志。2017;27:r887 - 90。
- 5。
Ali Z,Raza Q,Atif RM,Aslam U,Ajmal M,Chung G.谷物花器官身份的遗传和分子控制。int j mol sci。2019; 20(11):2743。
- 6。
王红梅,童春成,张胜。兰花开花/花发育研究进展。植物学报。2017;12(5):e132245。
- 7。
王志强,王志强。植物花发育的分子调控。Curr Top Dev Biol. 2019; 131:185-210。
- 8.
Nagasawa N,Miyoshi M,Sano Y,Satoh H,Hirano H,Sakai H,Nagato Y.女超人1,下垂的叶子基因控制水稻花器官的特性。发展。2003;130:705-18。
- 9.
Yamaguchi T,Lee Dy,Miyao A,Hirochika H,G,Hirano HY。两个C类的功能多样化麦斯基因盒OSMADS3和osmads58.在栽培稻.植物细胞。2006;18:15-28。
- 10。
drreni L, Jacchia S, Fornara F, Fornari M, Ouwerkerk PB, An G, Colombo L, Kater MM. d谱系麦斯- 箱基因OsMADS13控制水稻胚珠同一性。植物j . 2007; 2:690-9。
- 11.
徐伟,陶建华,陈明杰,drreni L,罗志军,胡勇,梁文奇,张db。之间的相互作用花匠号码4.和花卉归属基因在调节米花开发中。J Exp Bot。2017; 68:483-98。
- 12.
胡y,梁wq,尹cs,杨xl,ping bz,李斧,贾河,陈mj,罗枣,蔡q,赵xx,张db,袁z.奥姆曼德与稻米花卉归属基因的互动作用.莫尔植物。2015; 8(9):1366-84。
- 13。
刘MJ,李赫夫,苏·伊斯兰,李维克,施希。G1 / ELE.除了确定空颖片的身份外,在叶柄外稃发育中的功能。植物学报2016;7:1006。
- 14。
尤科达H,Nagato Y.大米的花发育。J Exp Bot。2011; 62:4719-30。
- 15.
Lombardo F,Yoshida H.解释雷姆玛和宫殿同源物:从水稻花突变体的观点。前植物SCI。2015; 6:61。
- 16。
崔瑞芬,韩建平,赵淑珍,苏康明,吴芳,杜新强,徐庆军,Chong K, thissen G,孟Z.水稻E类花同源性基因的功能保护与分化(英文)栽培稻).植物j . 2010; 61:767 - 81。
- 17。
Kobayashi K, Maekawa M, Miyao A, Hirochika H, Kyozuka J。胰胨phytomer2.(PAP2),编码SEPALLATA亚家族麦斯- 盒子蛋白,积极地控制水稻中的小穗营销标识。植物细胞生理。2010; 51:47-57。
- 18.
高XC,梁WQ,YIN CS,JI SM,王HM,SU X,GUO C,KONG HZ,Xue HW,Zhang DB。的sepallata.例如基因OsMADS34是水稻花序和小穗发育所必需的。植物杂志。2010;53:728-40。
- 19.
林小林,吴芳,杜晓强,史晓伟,刘勇,刘淑娟,胡义祥,thi ßen G,孟zsepallata.例如基因OsMADS34揭示了大米的“空彩血糖”(栽培稻spikelets实际上是基本的lemmas。新植物。2014; 202:689-702。
- 20。
Yoshida A, Suzaki T, Tanaka W, Hirano HY.同源基因长不育引理(G1)规定了水稻小穗的无菌引理特征。PROC NATL ACAD SCI。2009; 106:20103-8。
- 21。
鸿吕,钱Q,朱浦,唐德茨,黄祖,高升,李米,古梅,程泽。El erstrains从开发lemmas中的空虚的困境。j遗传学基因组学。2010; 37:101-15。
- 22。
Goff Sa,Ricke D,Lan Th,Presting G,Wang R,Dunn M,Glazebrok J,Sessions A,Oeller P,Varma H,Hadley D,Hutchison D,Martin C,Katagiri F,Lange Bm,Moughamer T,夏Y,Budworth P,Zhong J,Miguel T,Paszkowski U,张S,COLBERT M,Sun WL,Chen L,Cooper B,Park S,Wood TC,Mao L,鹌鹑P,Wing R,Dean R,Yu Y,ZharkhA,Shen R,Sahasrabudhe S,Thomas A,罐头R,Gutin A,Puss D,Reid J,Tavtigian S,Mitchell J,Eldredge G,Scholl T,Miller RM,Bhatnagar S,Adey N,Rubano T,Tusneem N,Robinson R,Feldhaus J,Macalma T,Oliphant A,Briggs S.水稻基因组的序列(粳稻).科学。2002;96:920 - 100。
- 23。
Yu J,胡锦涛SN,王J,黄GK年代,李SG,刘B,邓YJ,戴L,周Y,张XQ,曹M L,刘J,太阳JD,唐JB,陈YJ黄XB,林W,你们C,通W, Cong LJ耿约,韩寒YJ,李,李W,胡锦涛《GQ》,黄XG,李WJ,李J,刘ZW,李L,刘JP, Q,心不在焉,刘JS,李,李,王XG,卢H,吴TT,朱M,倪PX,汉族H,董W,任XY,冯XL,崔P,李XR,王H,徐X,翟,徐Z,张军,他SJ,张詹,徐JC,张KL,郑XW,董JH,曾庆红王寅,道L, J,谭J,任XD,陈XW他J,刘DF,田W,田CG夏HG,保QY,李G,高H,曹T,王J,赵WM,李P,陈W,王XD,张Y,胡J F,王J,刘年代,杨J,张G,熊YQ,李志玖,毛L,周CS,朱Z,陈瑞生,郝宝林,郑文敏,陈淑英,郭伟,李国杰,刘树清,陶明,王静,朱丽华,袁丽阳,HM。水稻基因组草图(籼稻).科学。2002;296:79 - 92。
- 24。
穆雷MG,汤普森WF。快速分离高分子量植物DNA。核酸Res. 1980; 8:4321-5。
- 25。
Panaud O,Chen X,McCouch SR。稻米微卫星和简单序列长度多态性(SSLP)的微卫星及其表征(栽培稻L).孟根,1996;252:597-607。
- 26。
Lander ES, Green P, Abrahamson J, Barlow A, Daly MJ, Lincoln SE, Newberg LA。一种交互式计算机程序包,用于构建实验种群和自然种群的初级遗传连锁图。基因组学。1987;1:174 - 81。
- 27。
刘力,萌杰。MapDraw:Amicrosoft ExcelMacrofor绘制基于给定遗传联系数据的遗传联系地图。希尔提塔斯(北京)。2003; 25:317-21。
- 28。
Rahman Ml,Chu Sh,Choi Ms,乔Yl,江WHZ,Piao Rh,Khanam S,Cho Yi,Jeung Ju,Jena Kk,Koh HJ。识别水稻中一些农艺性状的QTLS使用introgression系列Oryaza minuta.摩尔细胞。2007;24:16-26。
- 29。
mcouch SR, Teytelma L, Xu YB, Lobos KB, Clare K, Walton M, Fu BY, Maghirang R,李志康,邢永忠,张庆芳,Kono I, Yano M, Fjellstrom R, Declerck G, Schneider D, Cartinhour S, Ware D, Stein L.水稻2240个SSR新标记的开发与定位oryza setiva l).DNA研究》2002;9:257 - 79。
- 30。
谢建斌,张建文,杨亚宁。在模式植物和主要作物中crispr - cas9介导基因组编辑的高度特异性引导RNA间隔体的全基因组预测摩尔。2014;7:923-6。
- 31。
MA XL,Chen Lt,Zhu QL,Chen Yl,Liu Yg。通过直接测序PCR,快速解码序列特异性核酸酶诱导的杂合和双晶突变。产品。莫尔植物。2015; 8:1285-7。
- 32。
Jain M,Nijhawan A,Tyagi Ak,Khurana JP。通过定量实时PCR验证家务基因作为研究水稻基因表达的内部控制。Biochem Bioph Res Co. 2006; 345:646-51。
- 33。
李ZK,傅,高,王烨,王Ws,xu jl,张f,赵xq,郑tq,zhou yl,张g,太ss,xu jb,ws h,杨m,niu yc,王m,王m,li yh,Bian LL,Han XL,Li J,Liu X,Wang B. 3,000米基因组项目。傻瓜。2014; 3:7。
- 34。
Prasad K, Parameswaran S, Vijayraghavan Usha。OsMADS1,是一种水稻MADS-box因子,控制着外稃和外稃中特定细胞类型的分化,是一种早期花器官的调节因子。43植物J 2005;(6): 915 - 928。
- 35。
王丽,曾晓强,庄辉,沈永林,陈辉,王志伟,龙继成,凌云华,何光华,李云飞。异位表达OsMADS1在水稻中引起矮化和小穗的改变。植物生长规律。2017;81(3):433-42。
- 36。
王智,唐华。外源ABA对紫花苜蓿穗萌发的影响1在杂交水稻种子生产中。Acta Agron Sin。2000; 26(1):59-64。
致谢
不适用。
资金
福建省公益性行业(农业)科研专项(No. 2020R11010016-3);福建省农业科学院青年技术创新团队(No. 2020R11010016-3);基金资助:国家自然科学基金资助项目(No. 2019 J01011040);这三个资助者为我们的研究提供了资金支持。
作者信息
隶属关系
贡献
DY计划并进行了实验和数据收集,并将手稿写在所有作者中。NH,XZ,YZ,ZX,CC和FH参与进行实验,数据收集和分析。所有作者讨论了结果并为最终手稿做出了贡献。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:补充表1。
用于合成GRNA间隔物的引物序列和CRISPR编辑突变体的基因分型。
附加文件2:补充表2。
单体型分析LSL2。(多克斯17 kb)
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
杨东,何楠,郑旭东。et al。克隆长护颖(lsl2),调节水稻穗萌发的单隐性基因(栽培稻L。).BMC植物BIOL.20,561(2020)。https://doi.org/10.1186/s12870-020-02776-8
已收到:
接受:
发表:
关键字
- 大米(栽培稻L。)
- 长护颖突变体
- 分子标记
- 基因克隆
- 应用前景
- 穗萌发