抽象的
背景
已有研究表明ABFs(脱落酸应答转录因子)是参与非生物胁迫应答的重要ABA信号转导元件。然而,关于ABFs在肿瘤中的作用却知之甚少Triticum aestivum..此外,尽管在其他物种中鉴定了各种ABF,但ABF转录因子之间的系统发育关系尚未在陆地植物中全身调查。
结果
在这项研究中,我们系统地从土地植物中收集了ABF,分析了这些的系统发育关系沛富基因。的沛富基因存在于我们调查的所有陆地植物中,包括苔藓、石松、单子叶植物和双子叶植物。此外,这些沛富基因是文学性地分为七个亚组,通过基因结构,蛋白质性质和基序图案的变异支持的差异。我们进一步表明表达了沛富基因在不同的组织和发育阶段是不同的,并由一个或多个环境胁迫诱导。此外,我们还发现了三种小麦沛富(TaABF1那Taabf2,和TaABF3通过干旱胁迫显着诱导。与野生型(WT)植物相比,转基因拟南芥植物overexpressingTaABF3耐旱性增强。
结论
这些结果为了解植物之间的系统发育关系提供重要的基础工作沛富基因。我们的结果也表明TaABFs可以参与调节对非生物应激的植物反应。
背景
干旱是一种主要的环境压力,影响植物生长,生存,分配和生产力。植物在分子,细胞和生理过程中发育了复杂机制,以应对环境压力以存活[1].胁迫条件诱导植物产生胁迫反应基因[2那3.].植物激素脱落酸(ABA)是一种重要的激素,可调节植物中一些关键的生物过程,例如气孔运动,适应干旱胁迫,种子萌发[4.那5.那6.那7.].当植物遇到不利的环境胁迫(如长时间的渗透胁迫)时,内源ABA产生。由于这些增加的ABA水平,一些应激反应基因表达。额外的研究表明,许多应激反应基因也可以通过外源ABA的应用来诱导[2那7.那8.那9.].
ABA以一种独特的方式检测胁迫,并通过诱导ABA与ABA受体RCARs/PYR1/PYLs结合的双负调控途径在植物细胞中作为内源性信使,形成为PP2Cs提供活性位点的复合物。这抑制了PP2C作为该通路的负调节者的能力,导致SnRK2作为下游信号传导的正调节者和随后的靶蛋白磷酸化的诱导[10.那11.].因此,在ABA存在下,PP2CS被灭活以抑制SNRK2磷酸酶活性。然后,SNRK2可以启动ABA响应的调节途径并激活最重要的CIS.-element ABA响应元素(ABRE)以调节在渗透胁迫条件下许多基因的表达。随后,通过酵母单杂交方法,通过使用Abres作为诱饵分离Bzip转录因子的亚组[12.那13.]. bZIP转录因子亚组的基因主要通过调控胁迫相关基因参与渗透胁迫反应。在拟南芥,将九组-A BZIP蛋白酶被发现为β/ ABF的同源物,并将血症发生分为两种亚壳,ASB / ABF亚家族(ABF1,ABF2 / ISB1,ABI5 / ATDPBF亚家族(ATDPBF1 /ABI5,ATDPBF2,ATDPBF3 / ASB3和ATDPBF4 / EEL)[14.].ABF / ISB家族成员具有四个保守结构域,包括位于C-末端(其包括高度保守的BZIP结构域和C4结构域)中的两个,并且位于N-末端(包括C1,C2和C3域)[15.].
迄今为止,所有这些arsb / abf.基因拟南芥在功能性的特征。这四个基因(ABF1那ABF2 / areb1.那ABF3和ABF4 / areb2.)主要在营养组织中表达[12.那13.那16.那17.].此外,诱导ABF1对非生物胁迫反应的表达变化很小[18.], 尽管ABF2 / areb1.那ABF3和ABF4 / areb2.在ABA和渗透胁迫下显著上调[12.那13.那14.那17.那18.那19.那20.].这四种基因的异位表达拟南芥表明了这一点ABF1是一个功能性同源物ABF2 / areb1.那ABF3和ABF4 / areb2.;和ABF2 / areb1.那ABF3和ABF4 / areb2.ABA信号传导组分是否响应非生物应激[16.那17.那18.那20.那21.].而且,这是areb1areb2abf3三重突变体和areb1areb2abf3abf1四重突变体表现出较高的干旱敏感性,并通过损害ABA和渗透胁迫响应基因的表达来降低ABA敏感性[18.那22.]. 此外,许多ARB / ABFS.在不同的物种中已经显示出对渗透胁迫有更高的耐受性[23.那24.那25.那26.那27.].几项研究报告说arsb / abf.转基因农业植物对耐旱性差异显着增加,对生长很少或没有影响[23.那25.那26.].
面包小麦(Triticum aestivum.L.)是地球上种植最广泛的作物,占人类消耗的总卡路里的大约五分之一[28.].因此,小麦产量和生产影响了全球经济。然而,它的生产率经常受到水资源稀缺的阻碍,使得改善的干旱容忍许多繁殖计划的重要目标。虽然有几项研究表明ABF对非生物压力的重要性,但我们对小麦的ABFS知识仍然非常有限。在这项研究中,我们系统地描述了植物ABF的特征,包括基因成员,系统发育关系,基因结构,蛋白质结构相似性和差异和基因表达。我们对小麦进行了额外的功能分析沛富基因TaABF3通过研究转基因植物的耐旱性拟南芥植物。研究结果为理解植物间的系统发育关系提供了一个重要的框架沛富进一步加深了我们对小麦功能和机制的认识沛富干旱胁迫应答的基因。
结果
植物AREB/ABF家族的鉴定与分析
基于植物血统数据库中列出的34个基因组,我们执行了一个基因组频闪搜索使用拟南芥ABF1、AREB1/ABF2、AREB2/ABF4、ABF3氨基酸序列。我们在29种陆生植物中发现了候选abf,包括苔藓、石松、单子叶植物和双子叶植物。在我们鉴定的ABF序列中,有些蛋白质的氨基酸残基较短(少于200个氨基酸)。这些短序列在随后的分析中被排除。最后收集190条abf样序列进行进一步分析。我们对这190个蛋白质序列进行了SMART和Pfam分析,所有的蛋白质序列都被归类为含有bZIP结构域的蛋白家族(Pfam: 00170)。
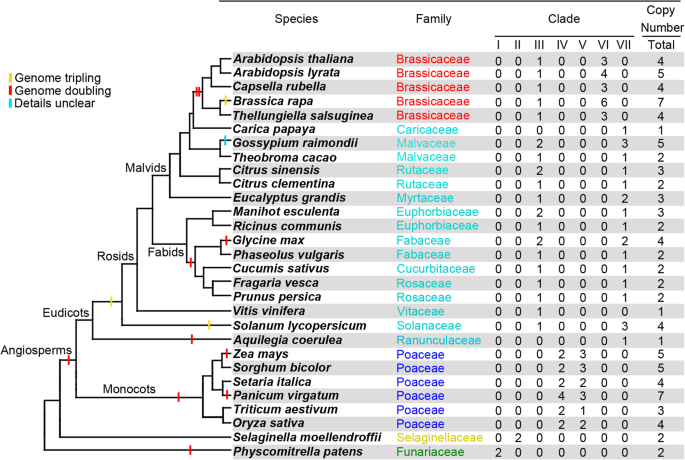
先前的研究报道植物类群a bZIP家族蛋白可分为两大类,AREB/ABF和ABI5/AtDPBF亚家族[14.].因此,我们使用190个全长ABF类似的基因序列构建了最大可能性(ML)树(附加文件1:图S1)。我们的结果表明,这些ABF样序列被分成两个主要的曲线,称为A组和B,每个序列具有95个鉴定的序列。A组包含所有实验特征的ASB / ABF,包括拟南芥那Thellungiella salsuginea和米阿巴[14.那15.].根据先前表征的基因,例如ABI5 / ATDPBF1,ATDPBF2,areB3 / ATDPBF3和EEL / ATDPBF4 [14.] B组被归类为ABI5 / ATDPBF Subfamilies。因此,组序列被指定为ABF,包括进一步分析(附加文件2:表S1)。各物种的ABF数量如图所示。1.总之,苔藓Physcomitrella金属盘和淋巴结Selaginella Moellendorffii有两份abf。在单子叶中,除小麦、玉米和玉米外,所有物种都只有4个abf拷贝Panicum Virgatum..ABF拷贝数不同,从一到七,在eudicots中。这表明发生了几种重复事件。米饭中ABF副蛋白的数量,拟南芥, 和Thellungiella.本研究观察符合以前的研究[14.那15.].
数量沛富每个物种的副缘及其分支的分布。物种树是基于植物群落(http://www.phytozome.net).属内分枝点上的星形表示基部属(A. Coerulea.)和核心的eudicots
我们进一步分析了95个ABF蛋白的蛋白质长度、分子量和pI值(附加文件)2:表S1)。结果表明,abf的长度和分子量范围为254 ~ 485个氨基酸残基,27.81 ~ 52.95 kD,平均389个氨基酸残基,42.16 kD。Aquilegia Coerulea_ABF1是最长最大的ABF(485个氨基酸残基,52.95 kD)柑橘sinensis._abf3是最短和最小的ABF(254个氨基酸残基和27.81 kd)。Zea Mays._ABF5的pI值最小,为5.44,而柑橘sinensis._ABF3的值最高,为10.42。枝支III、枝支VI和枝支VII中abf的pI值非常接近,而枝支I、枝支II、枝支IV和枝支V中abf的pI值变化很大。有趣的是,演化支V的abf显示出维持酸性pI值的趋势,平均为6.97,而在属于其他演化支的95个abf中,有83个的碱性pI值(大于7)1;附加文件2:表S1)。
植物ABFS的系统发育和结构分析
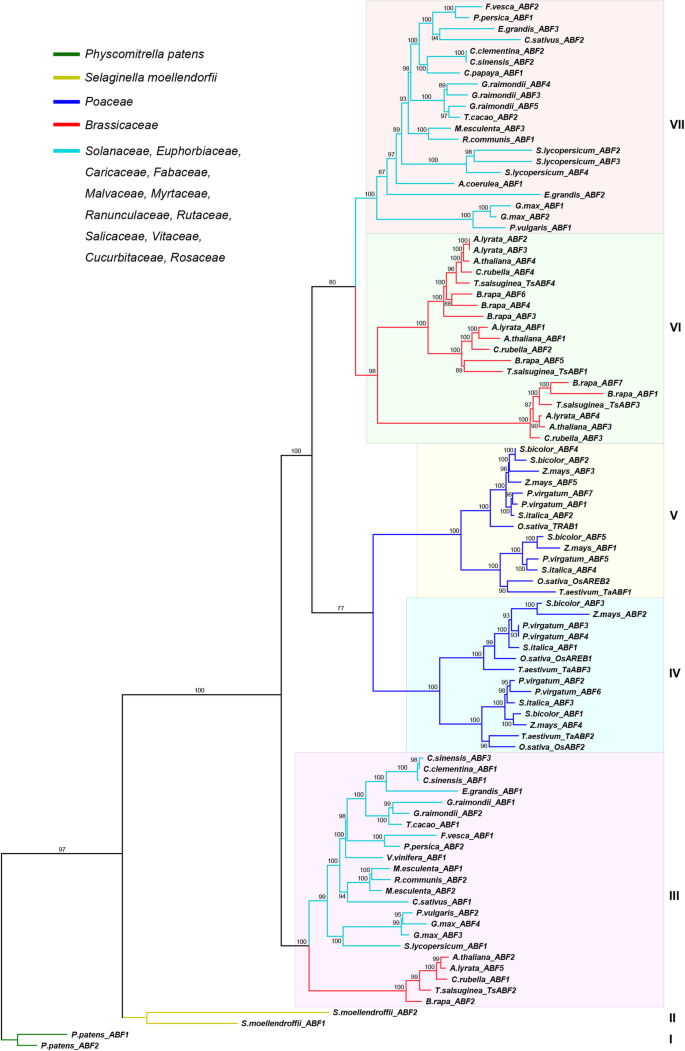
为了更好地了解含有土地植物中的ARB / ABF成员的进化关系,我们使用95 ABF的全长蛋白质序列进一步构建了毫升树。根据该系统的载体值(85%或更高)的系统发育树,ABF可以分为七个片状(C片至VII)(图。1;如图。2).在系统发育树内,来自苔藓的ABFSPhyscomitrella金属盘和淋巴结Selaginella Moellendorffii组成两个独立支队,划为支队I (P.Patens._沛富)至II (s.moellendorffii._沛富).单焦点可以放入接下来的两个片状,IV和V.申子可分为三个片状:III,VI和VII。
值得一提的是系统发育树(图。2)与植物沸石所示的物种树对齐(图。1)来自苔藓的ABFS(Physcomitrella金属盘)和淋巴结(Selaginella Moellendorffii)形成陆地植物的两个基础谱系。单子镜和eudicot ABF在系统发育树上更接近,形成两种单胞状片。为了进一步调查ABF系统发育树的准确性,我们分析了每个个体基因的外显子/内含子组织(附加档案3.:图S2)。95.沛富,一个人有一个外显子;三有两个外影;四有三个外显子;71有四个外显子,13个有五个外显子,两个有六个外显子,而两个有七个外显子。在每个思工内,基因结构沛富相对节省,邻近沛富具有相似的外显子/内含子结构。然后我们研究了所有的内含子阶段沛富基因结构。有三类内含子相:第0阶段内含子,第1阶段内含子和相2内含子。我们的分析表明,内含子相位模式(0,0,0)和(0,0,0,0)是跨越95个土地植物的主要模式沛富(附加文件3.:图S2)。这表明我们构建了一个系统发育树沛富陆地植物中的基因高度准确。
主题组成和植物ABF的安排
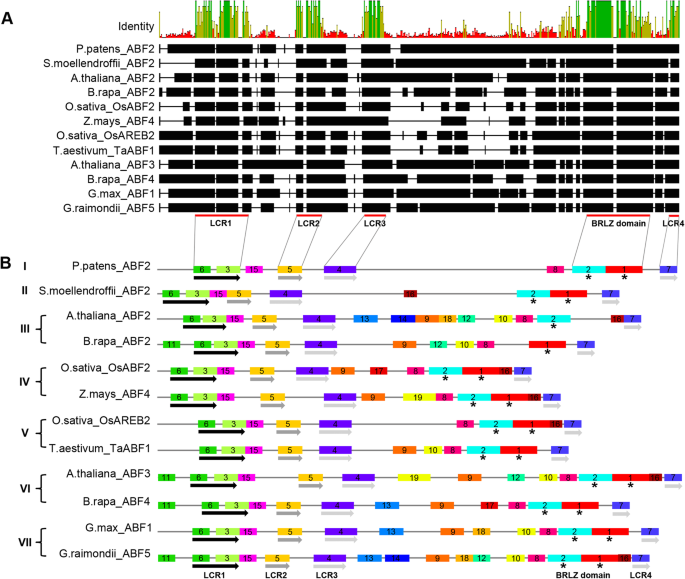
为了更好地了解植物ABF之间的系统发育关系,我们对齐所有ABF序列以更好地识别保守的氨基酸残基。基于对准,35个氨基酸残基在88 ABF中完全保守(八个短ABF除外)。我们进一步使用智能计划在95株ABF中确定了保守的主题。最后,我们在所有ABF中发现了FIVECORERARERED蛋白质基序,其是BRLZ结构域和其他四个低复杂性区域(LCR 1-4;图。3.一种;附加文件4.:图S3)。ABFS属于碱性亮氨酸拉链(BZIP)域转录因子家族,我们发现BRLZ结构域在所有植物序列中高度保守(图。4.).
然而,SMART对abf中存在的母序的综合识别能力有限,因此我们使用MEME程序来识别abf之间母序排列的保守性和差异性。我们在abf中发现了20个不同的母题。图中显示了七个主要演化支中基序的出现和排列。3.b和附加文件5.:图S4。在20个主题中,所有ABF都共享8个图案,所有ABF都是BRLZ结构域(MOTIF 1和2)的组件,另外四个保守的低复杂性区域(用于LCR1,MOTIF 5的MOTIF 3和6,用于LCR3的MOTIF 4,用于LCR3和LCR4的主题7)。接下来,我们在土地植物ABF中检查了非保守的主题组成。然后,基于LCR主题和BRLZ结构域的位置,我们将ABF分为四个区域(图。3.b):区域1是LCR1,区域2是LCR1和LCR2之间的零件,区域3是LCR3和BRLZ结构域之间的部分(LCR2和LCR3之间没有基序),并且区域4是零件在BRLZ域和LCR4之间。在这四个中,地区2和4在陆地上的植物中高度保守(它们主要由图案15和16组成)。较少的保守是区域1,其主要由图中III,VI和VII中的基序11组成。区域3是最分歧的区域:在Clades I,III,IV,V,VI和VII中观察到图案8;在III,IV,VI和VII中发现了图案9和10;在I III,V,VI和VII的Clades III,V,VI和VII中发现了图案12和17;图案III,VI和VII中发现了图案13和14;图案18在III和VII中发现了18个;图案19在IV和VI中发现了; and motif 20 was found in clade V (Fig.3.b)。我们在一起,植物ABF的保守和非保守的主题模式,我们识别在系统发育树中匹配的图案。
植物的表达分析沛富基因
获取表达式配置文件拟南芥的表达式数据拟南芥eFP浏览器(http://bar.utorto.ca/efp/cgi-bin/efpweb..CGI)。我们发现表达了拟南芥ABF模拟显示组织分化。例如,A.thaliana_ABF1在根中显示出显着更高的表达,以及A.thaliana_ABF2在种子中显示出显着更高的表达,表明ABF Paralogs遵循组织子官能化的趋势。我们发现IMI中的ABF Paralogs(A.thaliana_ABF2)的表达水平高于演化枝VI的同源(A.thaliana_ABF1那A.thaliana_ABF3;附加文件6.:图S5A)。我们接下来研究了其他植物ABF基因的表达谱。我们的结果表明大豆(大豆)和常见的豆(phoudolusulus vulgaris.)ABF Paralogs在叶子,根和鲜花中表达比其他组织更多,并且在Clade III中的ABF伞病(G.max_ABF3那P.vulgaris_ABF2)具有比CLADE VII常规蛋白酶更高的表达水平(G.max_ABF1那G.max_ABF1那P.vulgaris_ABF1)(附加文件6.:图S5B和C)。在单子叶中,我们研究了来自水稻(栽培稻),发现o.sativa_osabf2.(CLADE III)表达水平更高O.sativa_TRAB1那o.sativa_osareb1., 和o.sativa_osareb2.(附加文件6.:图S5D)。玉米的五个ABFS(Zea Mays.)除了用于组织中的类似表达模式z.mays_abf3.,在所有组织中表达较少(附加文件6.:图S5E)。植物abf的表达分化表明了abf的功能分化。
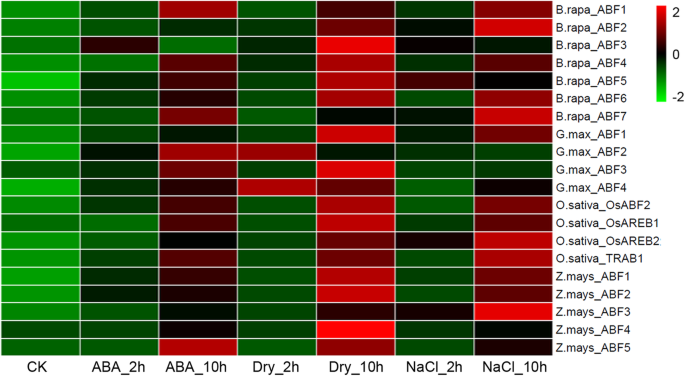
我们还调查了表达Arabidopsis ABFS.在非生物胁迫下使用微阵列表达数据。结果表明,所有的表达拟南芥ABA诱导ABA,冷温度,干旱条件和高盐度,但诱导程度不同。A.thaliana_ABF1低温显著诱导;A.thaliana_ABF2受干旱条件的显著诱导;A.thaliana_ABF3由ABA,干旱条件和盐显着诱导;和A.thaliana_ABF4是由干旱条件和盐(附加文件7.:图S6)。我们进一步调查了其他植物的表达沛富利用实时荧光定量PCR (qRT-PCR)对非生物胁迫(ABA、干旱和高盐度)进行检测。从热图中,我们发现表达最多沛富由ABA,干旱条件和高盐度诱导。除了B.Rapa_abf7.那G.max_ABF2, 和z.mays_abf3.,所有ABFS都被干旱条件显着诱导。ABFS在ABA介导的非生物应激反应中闻所可及,这意味着它的显着诱导沛富基因可能在植物适应环境压力中发挥至关重要的作用(图。5.).
分子表征及表达分析TaABFs
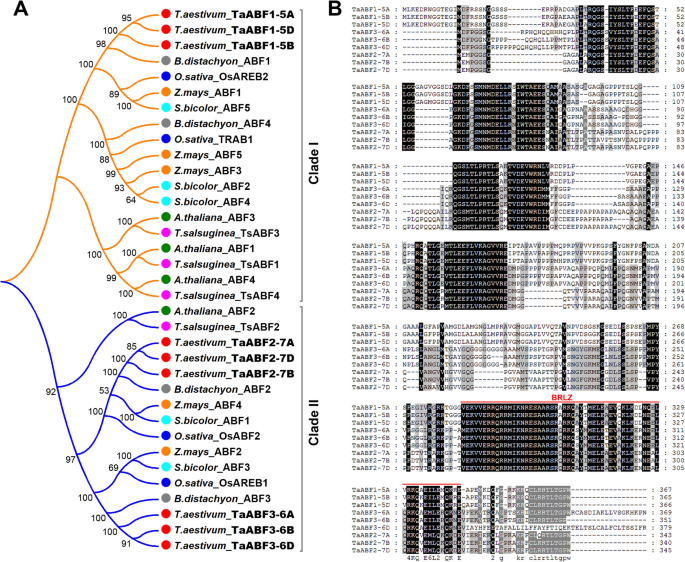
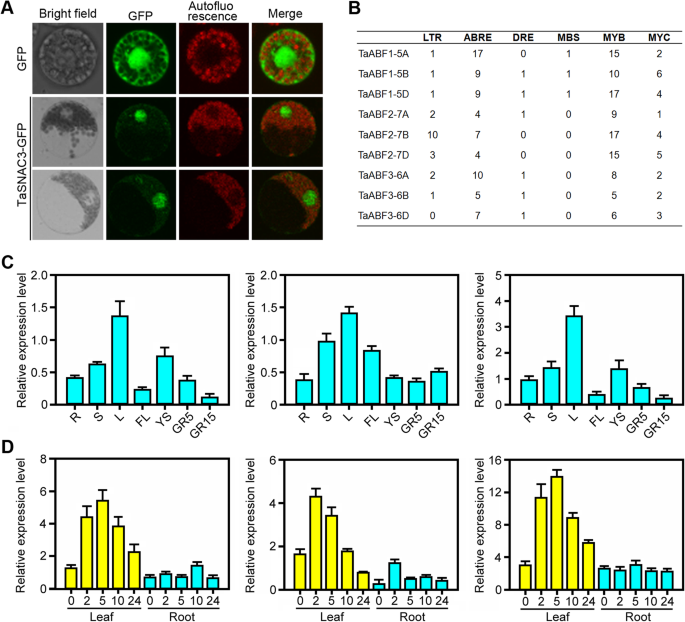
系统发育分析表明Taabfs可能在规范小麦中的非生物应激反应方面发挥作用。我们克隆了三个Taabf.小麦的基因简历.中国的春天。每个基因在小麦A、B、D基因组中有三个同源成分;我们叫他们TaABF1-5A / B / D那taabf2-7a / b / d, 和taabf3-6a / b / d.额外的系统发育分析表明,Taabf1与水稻奥拉地雷布2最密切相关,Taabf2与水稻osabf2最密切相关,Taabf3与水稻奥拉地雷布最密切相关(图。6.一种)。蛋白质序列的分析显示Taabf显示55-98%的序列相似度(图。6.b) 是的。然后我们分析了TaABF3的亚细胞定位,首先构建了表达盒,并将TaABF3与GFP蛋白融合。融合蛋白在细胞中瞬时表达拟南芥原生质体。我们使用荧光显微镜来分析并揭示Taabf3-GFP融合蛋白在转化细胞中的细胞核中公共定位,而对照GFP均匀地分布在整个细胞中(图。7.a).这些结果证实TaABF3是一个核定位蛋白。
分子表征及表达分析TaABFs.一种TaABF3蛋白的亚细胞定位。35S:GFP为阳性对照。B.几种应力分布相关CIS.-启动子区域的元素(~ 2 kb)的TaABFs.LTR,低温响应元件;ABRE ABA-responsive元素;衣服,dehydration-responsive元素;MBS、MYB结合位点参与干旱诱导;MYB, MYB识别站点;MYC, MYC识别网站。C表达概况TaABFs在不同的组织中。r,五叶阶段小麦幼苗的根;S,在五叶阶段的小麦幼苗茎;L,小麦幼苗叶子在五叶阶段;FL,标题阶段的旗帜叶;YS5,早期启动阶段的幼穗;GR5,5天后5天后;GR15,5天后的5天后。D.表达模式TaABFs在干旱胁迫处理下。X轴数字表示受干旱胁迫的时间点。误差条表示来自三个独立生物实验的标准偏差
检查表达式模式TaABFs,我们首先确定了CIS.-element在转录起始密码子上游~ 2kb处的促进区,发现了许多CIS.-启动子中与应激反应相关的作用元件Taabf.s。这包括LTR(低温响应元件),MYB(MYB识别站点),MYC(MYC识别位点),MBS(涉及干旱诱导的MYB绑定部位),ABRE(ABA响应元件)和DRE(脱水 -响应元件)(图。7.b)。为了更好地了解Taabfs响应干旱条件的作用,我们在来自各种组织和干旱条件下的RNA上执行定量实时PCR(QRT-PCR)。考虑到小麦自主基因的高度序列相似性,PCR引物设计用于放大三个保守的轨迹Taabf.homeologs;的相对表达式级别TaABF1代表所有三个的组合表达Taabf.家庭(TaABF1-5A那TaABF1-5B和TaABF1-5D).结果表明,taabf在幼苗叶片中含量较高(图2。7.C)和干旱胁迫条件下,所有的TaABFs在小麦叶中上调(图。7.d)。
过度的TaABF3具有抗旱能力拟南芥
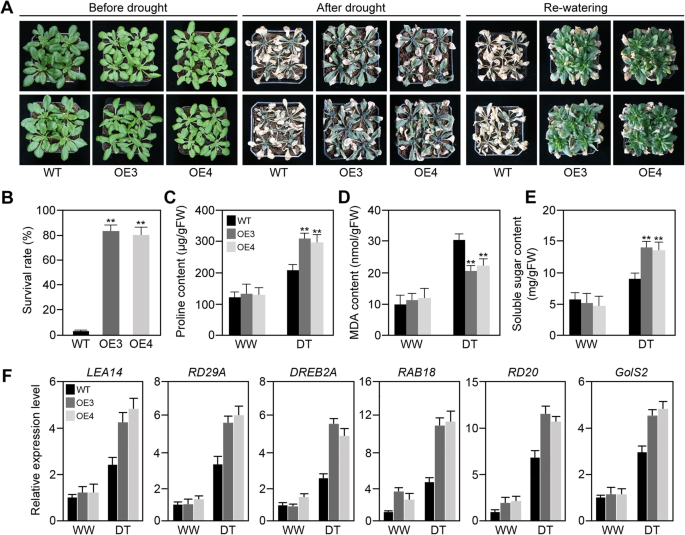
为了更好地了解TaABFs在植物非生物胁迫耐受中的作用,我们制作了35S :: Taabf3-GFP转基因拟南芥行。然后选择3个独立的转基因株系35S :: Taabf3-GFP转基因拟南芥表现出更高的表达水平TaABF3为了进一步分析它们对干旱胁迫的反应(补充资料)8.:图S7)。然后,将转基因和载体转化(WT)植物的耐旱性进行了比较。我们越来越多了35S :: Taabf3-GFP转基因植株在土壤中放置3周,然后保持水分约14天。经过干旱处理和6天的复水~ 65-75%的转基因植物存活下来,而~ 8%的野生植物存活下来(图。8.A和B)。
测定脯氨酸含量、丙二醛(MDA)含量和可溶性糖含量35S :: Taabf3-GFP转基因和WT植物(图。8.一部)。结果表明,在水分充足和干旱条件下,转基因株系的脯氨酸含量和可溶性糖含量均显著高于野生型,MDA含量显著低于野生型。我们还检测了几个已知的干旱响应基因在转基因株系中的表达,包括拟南芥 -同源的lea14.[29.],RD29A型[30.],Dreb2a.[31.],rab18[32.],RD20[33.], 和GOLS2.[34.].这些结果表明,所有这些基因在35S :: Taabf3-GFP转基因线(无花果。8.f).总体而言,这些发现表明过度表达TaABF3在拟南芥可提高转基因植物的耐旱性。
讨论
转录因子(TFS)是一组调节蛋白,其通过与特异性结合调节基因表达CIS.- 目标基因的启动子中的元素[35.].尽管许多研究揭示了AREB/ABF转录因子在应对非生物胁迫中的关键作用[16.那17.那18.]我们对ABF的了解仍然有限。以前的研究主要集中于研究ABF /γB蛋白的功能,而ABF的系统发育研究仅限于某些模型植物,例如Physcomitrella金属盘那Selaginella Moellendorffii那拟南芥和米饭[14.].为了推进对ABF参与压力反应和其他生物过程的理解,首先要了解他们的演变和多样性至关重要。在本研究中,我们从可用的基因组数据库中收集大多数土地植物组-A BZIP TFS(图。1;附加文件2:表S1),并对全编码序列进行系统发育分析。这允许我们在bZIP TFs中识别ABF分支(图。2),基因的内含子/外显子结构(附加文件3.:图S2)和特征蛋白质结构域(图。3.;如图。4.;附加文件4.:图S3;附加文件5.:图S4)。我们接下来从公共表达数据库中提取所选植物的表达谱,并探讨了土地植物演化期间的伞病基因的功能差异(图。5.;附加文件6.:图S5;附加文件7.:图S6)。此外,我们全身研究了Taabf3的靶基因的功能(图。6.;如图。7.;如图。8.).我们研究的目标是提供植物ABFS的整体情况,并深化我们对小麦功能和机制的了解沛富响应非生物胁迫的基因。
在蛋白质水平,土地植物中的ABFS含有许多相同的结构特征,所有ABF都有四个保守的LCR基序和一个BRLZ结构域(图。3.一种;附加文件4.:图S3)。但是,ABF蛋白也存在差异。例如,LCR3基序和BRLZ结构域之间的蛋白质结构表现出高度可变(图。3.b) 是的。这一区域需要更多的研究来进一步阐明不同分支的陆生植物ABF在结构和功能上的差异。
强大的系统发育树是追踪进化历史的必不可少的沛富基因。随着测序技术的进步,越来越多的植物基因组被测序和释放。在本研究中,我们调查了34个不同的植物基因组,收集了95个ABF基因。除藻类外,所有陆生植物中都存在ABF候选植物,包括低地植物(苔藓和石松植物)和高地植物(单子叶植物和双子叶植物)。越来越明显的是,在胚胎植物(陆生植物)中存在而在叶绿素基因组测序中缺失的基因家族,都起源于祖先陆生植物进化而来的那种藻类。这表明沛富基因家族起源于藻类向陆生植物的进化过程。以往的研究支持单一起源理论的陆地植物,起源于轮藻绿藻[36.那37.].从含水到气态环境中移动各种植物以不同的物理条件,这导致其结构和生理学的特殊变化。涉及来自血管植物的类黄素,木质素,植物激素和来自血管植物的枝胞植物的不同的代谢途径来自蜂迷藻类的主要代谢结构[36.].在此过程中,各种基因家族演化和帮助土地植物适应挑战新的环境条件,其中包括非生物压力源。它可能是沛富基因可被多种非生物胁迫诱导,参与对非生物因子的应激反应[16.那17.那18.].ABFS的这种演变可能在允许植物适应土地上的条件方面发挥着重要作用。
我们对系统发育关系的分析表明,ABF基因家族接受了导致七种不同亚壳的两种变化(图。2).第一个实例发生在后Selaginella Moellendorffii和Physcomitrella金属盘从一个共同的祖先分歧,种子植物。这种情况与土壤植物中的已知差异模式一致,其中Selaginella Moellendorffii和Physcomitrella金属盘是种子植物的前身。在这一事件之后,ABF基因家族可能局限于其历史功能。然而,我们的系统发育树显示,在种子植物中发生了第二例类似于ABF的重复。先前的研究发现,发生在现存被子植物祖先身上的全基因组复制(WGD)事件产生了每个基因的精确拷贝[38.那39.].单古氏体在他们的历史中看到了许多WGD的情况,这肯定对高级实例负责沛富基因(图。1)[40].单克罗斯的所有ABFS都被发现在IV和V的克莱德和v中,这是单古氏体进化史上早期复制事件的证据。相比之下,Eudicot ABF都是在Clades III,VI和VII中发现的。Clade III的成员是ParalogsArabidopsis ABF2.,而支系VI的成员是ABF1那ABF3, 和ABF4。第七分支的成员与第六分支的成员更为相似,但在第七分支的副官中找不到拟南芥.所有这一切都是ABF的功能相似性的证据,而片状之间的差异表示曲折之间的功能分化。最近的研究表明,当反应非生物压力源时,ABFS参与ABA信号传导[16.那17.那18.那19.那20.那21.那22.那23.那24.那25.那26.那27.],虽然功能差异沛富基因仍然稀缺。有研究发现,ABF2、ABF3、ABF4在调节aba介导的Chl降解以及叶片衰老中发挥重要作用拟南芥[41.].这表明了abf功能的进化差异,但为了理解abf谱系中的实际差异,还需要进一步的研究。
响应能力沛富非生物胁迫的基因强烈表明,它们在适应不断变化的环境条件方面发挥着作用。我们的qRT-PCR分析进一步揭示了这一切Taabf.干旱胁迫诱导的基因(图。7.).调查角色Taabf.非生物应激反应中的基因,TaABF3变成了拟南芥,并通过RT-PCR证实其过表达(附加文件8.:图S7)。与WT植物相比,转基因植物显示出显着改善的干旱和耐盐性(图。8.).始终如一地,包括几种应激响应基因,包括lea14.那RD29A型那Dreb2a.那rab18那RD20, 和GOLS2.被发现是显着上调的TaABF3转基因拟南芥在干旱胁迫下(图。8.).这项研究强烈表示TaABF3增加转基因的耐受性拟南芥植物到干旱条件。现有研究表明,TF基因的过表达可以减缓转基因植物的生长[42.那43.那44.那45.].我们还密切监测了生长和形态特征TaABF3转基因拟南芥结果发现,转基因植物的莲座叶的大小略有减少(图。8.).
结论
总之,我们的研究提供了对植物ABF基因的综合分析,包括系统发育关系,基因结构,蛋白质结构和性质,以及表达谱。系统发育分析与基因结构和基序组合物结合聚集植物ABF分为七个不同的枝条。此外,表达分析表明,植物ABFS已被非生物应激广泛诱导。进一步的功能分析TaABF3长台拟南芥表明他们可以赋予植物的耐旱耐受性。我们的结果将有助于阐明植物中的富含植物的血管谱系的功能,并提供用于鉴定植物中非生物应激反应的候选基因的线索。
方法
植物材料和应力处理
在进行四种植物物种后(Brassica Rapa.那大豆那栽培稻, 和Zea Mays.)在不同的胁迫条件下,我们检测了沛富.我们获得了Brassica Rapa.简历。ZS11,大豆简历。Jidou-7,栽培稻简历。Nipponbare,Zea Mays.简历。来自西北A&F大学的B73,尽管这些菌株也可以从中国作物种质资源信息系统中获得(http://www.cgris.net/zhongzhidinggou/index.php.).根据以下内容进行生长条件和应力条件的应用:在湿滤纸上,我们在25℃下萌发了1‰(v / v)TOPSIN-M灭菌的种子3天。然后在25℃下在16小时光/ 8H暗光周下在16小时光/ 8H暗光周期下,使用Hoagland营养溶液在25℃下的16小时光/ 8h暗光周期下繁殖发芽的种子。然后将脱落酸(ABA)施加到培养的幼苗上,然后进行高盐度条件,最后,干旱条件。将三周的幼苗置于200mmol / L NaCl溶液中,用于高盐度处理,进入ABA治疗的100μmol/ L ABA培养溶液,以及干旱治疗的干净替补席上(其中在25℃和相对湿度下脱水40-60%)。在使它们进行胁迫条件下,收集整个幼苗0,2和10小时。我们在每个时间点从每种植物物种中收集至少五个幼苗,而每个实验进行三次。随后将所有样品在液氮中冷冻并在RNA提取之前在-80℃下冷冻。
沛富基因鉴定
为拟南芥, abf (AREB1/ABF2, AREB2/ABF4, ABF1和ABF3)在Phytozome数据库进行TBLASTN查询(http://www.phytozome.net/).我们使用34种植物物种,包括藻类(Chlamydomonas Reinhardtii.那Coccomyxa子面素软糖C-169型,micromonas pusilla.CCMP1545,Ostreococcus lucimarinus, 和Volvox Carteri.)、苔藓(Physcomitrella Patens)lycophyte (卷柏moellendorffii)单子叶植物(Triticum aestivum.那栽培稻那Panicum Virgatum.那高粱双色那Setaria Italica., 和Zea Mays.)和eudicots(Aquilegia Coerulea那rabidopsis lyrata.那拟南芥蒂利亚纳那Brassica Rapa.那Capsella风疹那卡里卡番木瓜那柑橘克莱门蒂娜那柑橘sinensis.那Cucumis sativus那桉树茅那Fragaria Vesca.那大豆那Gossypium raimondii.那Manihot Esculenta.那Mimulus Guttatus.那phoudolusulus vulgaris.那Prunus Persica那萝藦那Solanum lycopersicum.那Thellungiella salsuginea那Theobroma Cacao., 和vitis Vinifera).我们使用Simple Modular Architecture Research Tool (SMART;http://smart.emblheidelberg.NORMAL = 1)来识别含有bZIP和其他常见域的蛋白质结构的abf。计算pI/Mw工具,从ExPASy (http://web.expasy.org/compute_pi/),得到理论分子质量和等电点Pi值。
系统发育树建设
translatorx服务器(http://translatorx.co.uk/)[46.用来对齐编码序列(CDS),而我们进行了jModelTest分析[47.]确定最适合的模型。我们使用在线程序RAxML创建了一个ML(最大似然)树(http://www.trex.uqam.ca/index.php?action=RAXML&PROJECT =TREX.)[48.],通过使用100个bootstrap样本的最佳拟合模型。无花果树(http://tree.bio.ed.ac.uk/software/FIGTREE /)用于可视化系统发育树。
基因结构分析分析和保护基序检测
在线基因结构显示服务器(GSDS;http://gsds.cbi.pku.edu.cn.)来评估内含子和外显子的分布以及内含子的相模式。模因诱导程序的多重期望最大化http://meme.nbcr.net/meme/cgi-bin/meme.cgi)用于获得ABF蛋白的功能基序,使用这些参数:最大矩阵数= 20,最佳基序宽度= 6至100个残基,图案分布=任何数量的重复。
沛富基因表达谱
采用qRT-PCR方法评估不同胁迫条件下ABF的表达模式,采用TRIZOL试剂(biotop)从三个独立实验中的至少5株幼苗中分离总RNA。用无rnase - DNAse (Takara)处理总RNA以去除遗传污染。使用Nanodrop1000 (Thermo Scientific产品,美国)测量总RNA水平,同时在每个样本的0.8%琼脂糖凝胶上运行5 μg总RNA,以验证RNA的数量和完整性。用重组M-MLV逆转录酶和总RNA (1 μg)与1 μg Oligo (dT)23 (Promega)混合合成cdna。PCR条件为95°C预变性10 min, 95°C预变性40次,15 s, 60°C预变性40次,30 s。内部控制是TaActin(traests1a01g274400).我们应用了量化方法(2——ΔCt)并使用三个生物复制近似表达变化[49.].附加文件9.:表S2概述了本研究中使用的引物。
TaABF3-GFP融合蛋白的亚细胞定位
中国西北农林科技大学康振生实验室提供Triticum aestivum.简历。中国的春,这被用于功能分析TaABF3.全长CDS序列TaABF3用PCR扩增小麦简历.具有特异性引物的中国春天塔布布亚细胞定位测定。然后将其置于二元载体pcamv35s :: gfp中BamH我和XBA.I,寻找TaABF3的亚细胞定位。通过测序获得阳性克隆,并通过上述方法获得小麦叶肉原生质体[50.].共聚焦显微镜(Olympus,FluoviewTM FV300,日本)用于评估GFP荧光。
的变换拟南芥和孤立TaABF3
中国西北农林科技大学康振生实验室提供拟南芥生态型哥伦比亚,被用来改变TaABF3.我们放大了全长开放阅读框架TaABF3从小麦cv。利用基因特异性引物与花椰菜花叶病毒(CaMV) 35S启动子克隆到pGreen0029-GFP载体中。然后我们引入重组载体(35S :: Taabf3-GFP) 进入根癌土壤杆菌,并采用花浸法[51.]改变它拟南芥(拟南芥蒂利亚纳;生态型哥伦比亚)。T.1将种子置于含2%蔗糖和50 mg/mL卡那霉素的MS培养基上鉴定转化子。表型分析采用纯合子T3.植物。
抗旱试验
我们放置了已发芽的,7天大的转基因拟南芥将MS培养基上的植物放入带有130的花盆中 g吉菲混合物和蛭石的2:1混合物,用于进行耐旱性测定。在最佳条件下生长的32天龄植株(22 °C,相对湿度60%,16/8 在干旱胁迫条件下,将植株的水分保持14天 几天之后,给它们浇水,让它们恢复健康。然后我们计算了6天后存活下来的植物数量。在每项试验中,每一株系至少有48株植物与野生型(WT)植物进行了对比分析。显示的统计数据基于三个独立实验获得的数据。我们用了学生的T.- 以分析转基因和WT植物之间的差异。
测量脯氨酸,MDA和可溶性糖水平
我们根据制造商的说明,使用检测试剂盒(Solarbio)测定了转基因植株和WT植株在干旱胁迫10天(大部分叶片开始枯萎)后的脯氨酸含量、MDA水平和可溶性糖水平。
统计分析
每个实验至少进行三次。所示数据为三个独立重复的平均值±标准差(SD)。一个学生的T.- 最低用于执行统计分析,而P.< 0.05为差异有统计学意义P. < 0.01 was considered extremely significant.
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从相应作者处获得。
缩写
- 阿坝:
-
脱落酸
- ABFS:
-
脱落酸响应性转录因子
- 伊稳定石:
-
ABA响应元件
- 爆破:
-
基本的局部对齐搜索工具
- CD:
-
编码序列
- Dre:
-
dehydration-responsive元素
- 地理:
-
基因表达综合
- 走:
-
基因本体论
- GSDS:
-
基因结构显示服务器
- 电感电容电阻测量:
-
低复杂性区域
- LTR:
-
低温响应元件
- MBS:
-
MYB绑定位点涉及干旱诱导性
- MEME:
-
主题诱惑的多重期望最大化
- ML:
-
最大似然
- MYB:
-
MYB认可网站
- 我的C:
-
MYC识别网站
- PI:
-
等电点
- 聪明的:
-
简单的模块化建筑研究工具
- TFs:
-
转录因素
工具书类
- 1。
关键词:NAC,转录因子,非生物胁迫,植物abstract:生物化学与生物物理学报,2012;
- 2。
山口Shinozaki K,Shinozaki K。细胞对脱水和冷应激的反应和耐受中的转录调控网络。植物生物学年鉴。2006;57:781–803.
- 3.
朱JK。植物的非生物胁迫信号与响应。牢房。2016;167(2):313–24.
- 4.
Finkelstein rr,gampala ss,摇滚CD。种子和幼苗中的脱落酸信号传导。植物细胞。2002; 14(SUP):S15-45。
- 5。
Himmelbach A,Yang Y,Grill E.继电器和脱落酸信号传导的控制。CurrOp植物BIOL。2003; 6(5):470-9。
- 6。
Munemasa S, Hauser F, Park J, Waadt R, Brandt B, Schroeder JI。脱落酸调控气孔开度的机制。植物生物学杂志。2015;28:54 - 62。
- 7。
Hauser F,Li Z,Waadt R,Schroeder Ji。快照:脱落酸信号。细胞。2017; 171(7):1708。
- 8。
朱杰克。植物中的盐和干旱胁迫信号转导。Annu Rev植物Biol。2002; 53:247-73。
- 9。
富士塔Y,富士塔M,Shinozaki K,Yamaguchi-Shinozaki K. ABA介导的转录调节,响应植物中的渗透胁迫。j植物res。2011; 124(4):509-25。
- 10。
关键词:PP2C,磷酸酶,脱落酸,调控因子科学。2009;324(5930):1064 - 8。
- 11.
Park Sy,Fung P,Nishimura N,Jensen Dr,Fujii H,Zhao Y,Lumba S,Santiago J,Rodrigues A,Chow TF,Alfred Se,Bonetta D,Finkelstein R,Pronte NJ,Desveaux D,Rodriguez PL,McCourt P,朱杰,施罗德·吉,沃尔克曼,Cutler SR。脱落酸通过开始蛋白质的Pyr / Pyl族抑制2C型蛋白磷酸酶。科学。2009; 324(5930):1068-71。
- 12.
崔H,洪俊,哈俊,姜俊,金世贤。abf是ABA响应元件结合因子家族。中华医学杂志。2000;275(3):1723-30。
- 13。
关键词:拟南芥,碱性亮氨酸zipper转录因子,干旱,高盐中国科学:地球科学;2000;
- 14。
藤田y,yoshida t,yamaguchi-shinozaki k。富含血管介导的转录的ASB / ABF-SNRK2途径的关键作用,以响应植物渗透压的渗透胁迫。physiol植物。2013; 147(1):15-27。
- 15.
Vysotskii DA, de Vries-van Leeuwen IJ, Souer E, Babakov AV, de Boer AH。salsuginea Thellungiella ABF转录因子的结构、表达谱及与14-3-3调控蛋白的相互作用植物信号处理研究进展。2013;
- 16。
康杰,崔嗨,我是金茜。拟南芥碱性亮氨酸拉链蛋白介导应激反应性脱落酸信号。植物细胞。2002;14(2):343–57.
- 17。
Fujita Y,Fujita M,Satoh R,Maruyama K,Parvez MM,Seki M,Hiratsu K,Ohme-Takagi M,Shinozaki K,Yamaguchi-Shinozaki K.CaB1是一种依赖于干旱胁迫的新型ABRE依赖性ABA信号的转录激活因素拟南芥的耐受性。植物细胞。2005; 17(12):3470-88。
- 18。
4个拟南芥AREB/ABF转录因子在脱落酸信号转导中SnRK2激酶下游的基因表达中起主导作用。植物细胞环境。2015;38(1):35-49。
- 19。
Fujii H, Chinnusamy V, Rodrigues A, Rubio S, Antoni R, Park SY, Cutler SR, Sheen J, Rodriguez PL, Zhu JK。脱落酸信号通路的体外重建。大自然。2009;462(7273):660 - 4。
- 20.
Furihata T,Maruyama K,Fujita Y,Umezawa T,Yoshida R,Shinozaki K,Yamaguchi-Shinozaki K.脱离酸依赖性多立体磷酸化调节转录活化剂AMB1的活性。Proc Natl Acad SCI U S A. 2006; 103:1988-93。
- 21.
王Z,苏g,李米,ke q,金sy,李h,黄j,xu b,邓xp,kwak ss。过表达Arabidopsis ABF3增加对多种非生物应激的耐受性,并减少紫花苜蓿的叶片尺寸。植物理性生物化学。2016; 109:199-208。
- 22.
Yoshida T,Fujita Y,Sayama H,Kidokoro S,Maruyama K,Mizoi J,Shinozaki K,yamaguchi-Shinozaki K. areb1,areb2和Abf3是母版转录因子,可协同调节依赖于干旱胁迫耐受性的ABRE依赖的ABA信令。要求ABA进行全激活。工厂J.2010; 61(4):672-85。
- 23.
哦,宋思,金ys,jang hj,金sy,金m,金yk,nahm bh,金jk。拟南芥CBF3 / DREB1A和转基因水稻的ABF3增加对非生物胁迫的耐受性而不会稳定生长。植物理性。2005; 138(1):341-51。
- 24.
Chinnusamy v,朱记,Sunkar R. Gene在植物中冷应激适应过程中的基因调节。方法Mol Biol。2010; 639:39-55。
- 25.
Orellana S,Yañezm,espinoza a,verdugo我,gonzáleze,ruiz-lara s,casaretto ja。转录因子SlareB1赋予干旱,盐胁迫耐受性和调节番茄中的生物和非生物应激相关基因。植物细胞环境。2010; 33(12):2191-208。
- 26.
关键词:干旱胁迫,狗尾草(Setaria italica), aba, re -binding protein, SiARDP实验机器人。2014;65(18):5415-27。
- 27.
Kerr Tc,Abdel-Mageed H,Aleman L,Lee J,Payton P,Cryer D,Allen Rd。两种含量的异位表达增加了棉花(Gossypium hirsutum)的耐旱性。植物细胞环境。2018; 41(5):898-907。
- 28.
IWGSC。使用完全注释的参考基因组转移小麦研究和育种的限制。科学。2018; 361(6403)。https://pubmed.ncbi.nlm.nih.gov/30115783/.
- 29.
百马克M, Hincha DK。拟南芥胚胎发生晚期丰富蛋白及其编码基因。BMC基因组学。2008;9:118。
- 30.
Nakashima K,Fujita Y,Katsura K,Maruyama K,Narusaka Y,Seki M,Shinozaki K,Yamaguchi-Shinozaki K. Abi3-和ABA响应基因的转录调控,包括RD29B和RD29A在种子,发芽胚胎和拟南芥幼苗中的转录调控.植物mol biol。2006; 60(1):51-68。
- 31。
Sakuma Y,Maruyama K,Osakabe Y,Qin F,Seki M,Shinozaki K,Yamaguchi-Shinozaki K.拟南芥转录因子Dreb2a的功能分析,参与干旱反应基因表达。植物细胞。2006; 18(5):1292-309。
- 32。
倪立德等。胁迫诱导的拟南芥脱氢酶的积累和组织特异性定位。中国生物防治学报,2001;
- 33。
Aubert Y,Vile D,Pervent M,Aldon D,Ranty B,Simonneau T,Vavasseur A,Galaud JP。RD20是一种应激诱导的糖蛋白,参与拟南芥的气孔控制,蒸腾和耐旱性。植物细胞生理。2010; 51(12):1975-87。
- 34。
Selvaraj Mg,Ishizaki T,Valencia M,Ogawa S,Dedicova B,Ogata T,Yoshiwara K,Maruyama k,Kusano M,Saito K,Takahashi F,Shinozaki K,Nakashima K,Ishitani M.拟南芥的过度表达改善转基因水稻的耐旱性,并增加了该领域的谷物产量。植物Biotechnol J. 2017; 15(11):1465-77。
- 35。
关键词:转录因子,DNA识别,多样性,复杂性,转录因子科学。2009;324(5935):1720 - 3。
- 36。
陆生植物的起源和早期进化。大自然。1997;389:33-9。
- 37。
Morris JL, Puttick MN, Clark JW, Edwards D, Kenrick P, Pressel S, Wellman CH, Yang Z, Schneider H, Donoghue PCJ。早期陆地植物进化的时间尺度。美国国家科学院学报2018;115(10):E2274-83。
- 38。
Jiao YN、Wickett NJ、Ayyampalayam S、Chanderbali AS、Landher L、Ralph PE、Tomsho LP、Hu Y、Liang HY、Soltis PS、Clifton SW、Schlarbaum SE、Schuster SC、Ma H、Leebens Mack J、Deparphilis CW。种子植物和被子植物的祖先多倍体。《自然》2011;473:97–100.
- 39。
Jiao YN, Paterson AH。陆地植物进化过程中与多倍性相关的基因组修饰。Philos Transact Royal Soc London Series B. 2014;369:20130355。
- 40。
娇妮,李吉,唐鹤,帕特森啊。综合同步和系统发育分析揭示和古代基因组重复在单子古典中。植物细胞。2014; 26:2792-802。
- 41。
高号,高J,朱X,宋y,李z,仁g,周X,kuai b. abf2,abf3和abf4通过叶绿素分解基因的转录激活和衰老相关的转录激活ABA介导的叶绿素降解和叶片衰老拟南芥中的基因。莫尔植物。2016; 9(9):1272-85。
- 42。
孙y,风扇xy,cao dm,tang w,他k,zhujy,他jx,bai my,zhu s,哦,e,紫苏s,金威,ji h,wong wh,rhee sy,王玉。乌乳甾类固醇信号转导与拟南芥植物生长调控转录网络的整合。DEV细胞。2010; 19(5):765-77。
- 43.
4 .张伟,阮静,何天宇,于涛,张伟。拟南芥脱落酸和非生物胁迫应答基因的全基因组定位。植物生理学报,2014,54(5):767 - 774。生物信息学。2005;21(14):3074 - 81。
- 44.
鲁Z,俞H,熊,王j,娇y,刘g,静音,萌x,胡x,qian q,fu x,王y,李j。转录激活剂理想植物的基因组宽结合分析架构1揭示了一个复杂的网络调节稻田架构。植物细胞。2013; 25(10):3743-59。
- 45.
Birkenbihl RP,Kracher B,Somssish Ie。在早期制动触发免疫期间诱导三个拟南芥毛骨转录因子的基因组宽结合。植物细胞。2017; 29(1):20-38。
- 46.
Abascal F, Zardoya R, Telford MJ。TranslatorX:由氨基酸翻译引导的核苷酸序列的多重比对。核酸杂志2010;38:W7-13。
- 47.
Posada D. jModelTest:系统发育模型平均。中国生物医学工程学报。2008;25(7):1236 - 1236。
- 48.
Stamatakis A. Raxml-VI-HPC:最大基于似然的系统发育分析,有数千个分类群和混合模型。生物信息学。2006; 22(21):2688-90。
- 49.
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据-ΔΔct方法。方法。2001; 25(4):402-8。
- 50。
拟南芥叶肉原生质体:一种用于瞬时基因表达分析的多功能细胞系统。Nat Protoc。2007;2(7):1565 - 72。
- 51。
阵伤SJ,弯曲AF。花卉浸:农杆菌介导的拟南芥转化的简化方法。工厂J. 1998; 16(6):735-43。
确认
我们感谢审稿人检查我们的手稿和编辑编辑的论文。我们感谢西北农林科技大学生物信息中心的成员们的有用的输入。
资金
该研究得到了西北A&F大学的人才基金(Z111021602的授予。资助者在研究和收集,分析和解释的设计中没有作用,以及编写手稿。
作者信息
从属关系
贡献
HM构思并发起了这项研究;HM设计了实验;FL、FM、YZ和SL进行了实验。HM对数据进行分析并撰写稿件。所有作者已阅读并批准最终稿件。
相应的作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有利益冲突。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
29种植物物种中血管发育关系的影响。土地植物组-A BZIP TFS分为两个主要的碎片,指定为ASB / ABF和ABI5 / ATDPBF Subfamilies。
附加文件2:表S1。
陆生植物ABF蛋白特性及其枝支分布。基因鉴定来自植物染色体数据库。
附加文件3:图S2。
95株植物基因结构示意图沛富.细线代表内含子,厚条代表外显子。基因结构上方的数字表示内含子阶段。底部绘制带有基对单元(BP)的秤条。
附加文件4:图S3。
对准95种植物ABF蛋白序列。使用在佐动软件中实现的CLUSTALW产生的对准,并表示为粗线(对齐的字符)和细线(间隙)。总结标识和表明氨基酸残基的数量的刻度条在顶部绘制。
附加文件5:图S4。
95个ABF蛋白的组合基序图。粗线表示ABF蛋白。不同颜色的盒子代表了使用MEME程序识别的独立和不同的图案。上面显示了一个表示氨基酸残基数量的比例尺。图案大致按比例画成盒子。
附加文件6:图S5。
基因表达谱沛富植物中的副鸟。从中提取基因表达数据拟南芥意大利(http://jsp.wiigelworld..org/expviz/expviz.jsp),大豆(大豆那http://soybase.org/soyseq/)、红豆(phoudolusulus vulgaris.那http://plantgrn.noble.org/PvGEA/SearchVisual.jsp),玉米(Zea Mays.那http://www.plexdb.org/index.php.)和米饭(栽培稻那http://www.plexdb.org/index.php.).
附加文件7:图S6。
基因表达谱沛富帕拉戈尔科州拟南芥蒂利亚纳在不同的非生物胁迫下。通过Web从AtgenExpress MicroArray数据库获得平均归一化表达式值http://jsp.wiigelworld.org/expviz / expviz.jsp。
附加文件8:图S7。
RT-PCR分析TaABF3转基因中的转录水平拟南芥行。
附加文件9:表S2。
本研究中使用的引物。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
李,F.,梅,F.,张,Y。等等。基因组范围分析arsb / abf.土地植物基因谱系与功能分析TaABF3在拟南芥.BMC植物BIOL.20.558 (2020). https://doi.org/10.1186/s12870-020-02783-9
已收到:
公认:
发表:
关键词
- 沛富
- 陆地植物
- 系统发育关系
- 表达分析
- TaABFs
- 干旱胁迫