抽象的
背景
棉花基因组的测序和注释为揭示更多的生理和功能信息提供了有力的理论支持。植物同源结构域(PHD)蛋白家族已被报道参与调节植物的各种生物过程。然而,它们的功能研究尚未在棉花上进行。
结果
在本研究中,108,55和52博士学位基因在g .分子那g . raimondii就, 和g . arboreum,分别。共297博士学位三种棉花种类的基因,拟南芥,米饭分为五组。我们进行了染色体位置,系统发育关系,基因结构和保守域分析GhPHD基因。GhPHD在每种染色体上不均匀地分布基因。但是,更多GhPHD基因分布在AT_05,DT_05和AT_07染色体上。Ghphd蛋白描述了保守域,和GhPHD表现出类似基因结构的基因聚集在一起。此外,全基因组重复(WGD)分析表明纯化选择大大促进了功能性维持GhPHD基因家庭。基于RNA-SEQ数据的表达模式分析显示最多GhPHD基因表现出清晰的组织特异性时空表达模式,阐明了多种功能ghphds.在植物生长发育中。此外,分析CIS.-作用元素揭示了ghphds.可能会响应各种非生物和植物激烈的应力。在这方面,一些GhPHD基因表现出对非生物和植物激烈的应激的良好反应。此外,共表达网络分析表明ghphds.是植物生长发育所必需的,而GhPHD对非生物和植物激情应激的基因反应可能有助于改善植物耐受性的不利环境条件。
结论
本研究将提供有用的信息,以促进有关的重要作用的进一步研究GhPHD基因家庭在植物生长和发展中。
背景
植物经常面临各种非生物和生物胁迫条件。非生物胁迫包括热、冷、干旱和盐胁迫,而生物胁迫主要来自细菌、真菌、病毒和昆虫。这些非生物和生物胁迫显著降低了全球作物的质量和生产力[1那2].为了适应这种不利的环境,植物已经建立了全面的机制来打击应力信号并减轻它们对植物生长和发展的影响[3.].植物激素在调节发育过程和信号转导网络中起着重要作用,这对各种非生物应力进行了响应。芸苔类固醇(Br),茉牛水(Ja),嗜酸性植物蛋白(Ga),水杨酸(SA),植物蛋白和脱落酸(ABA)调节植物生长,发育,压力和防御反应[4.那5.那6.那7.那8.那9.那10那11,但是植物激素是如何调节生长和压力平衡的还不清楚。
锌指蛋白是许多蛋白质家族的一部分,广泛分布于真核生物。“锌指”是半胱氨酸和/或组氨酸与锌原子配合形成局部肽结构的序列基序,这是其特定功能所必需的。“手指”结构母题分为不同类型,如tfiia型锌指(EPF1, SUPERMAN) [12那13、WRKY家族(WRKY1、2、3)、gata1型蛋白(NTL1) [14那15],DOF家族(DOF1)[16那17戒指型(COP1)[18],Phd-Finger家族(Athat3.1和Zmhox1a)[19那20.]、LIM家族(SF3) [21那22,以及其他未分类的类型。植物同源结构域(PHD)锌指是在一些染色质结合蛋白中发现的小阅读域。在植物中,PHD蛋白通常是具有一个或多个PHD结构域的锌指蛋白,该结构域具有一个由大约60个氨基酸组成的Cys4-His-Cys3锌结合基序[23].值得注意的是,半胱氨酸与组氨酸之间或PHD结构域半胱氨酸残基之间的氨基酸数量是保守的,而第二氨基酸(在倒数第二半胱氨酸残基之前)通常是芳族氨基酸,如色氨酸[24].
自发现第一个PHD蛋白HAT3.1 (Histone acetyltransferase 3.1)以来拟南芥,更多PHD蛋白已被鉴定参与染色质结构和转录的许多生理和生化过程[25].在拟南芥dr蛋白MMD1 (Male减数细胞死亡1)/DUET在雄性减数细胞中特异性表达,参与减数分裂过程中基因表达的调节,突变MMD1.基因导致男性减数分裂细胞的死亡[26那27那28].真核生物的表观遗传调控是通过染色质标记和小RNA物种之间复杂的信号相互作用来实现的。atvim1(甲基化的变体1)在DNA甲基化 - 组蛋白界面中的作用,以维持浓缩异色体拟南芥[29].此外,PHD蛋白还参与调节植物对非生物胁迫的反应,改变植物的生长发育[30.那31].在大豆中,发现6个alfin1型PHD蛋白对盐、冷、干旱和ABA处理有反应。例如,GmPHD2改善转基因的耐盐性拟南芥植物与野生型植物相比[32].在拟南芥,Atvin3(vernalization 3)蛋白质与改性组蛋白的体外结合,改变Phd-Finger结构域的结合特异性并加速体内含量的络合反应[33].在种子萌发期间艾尔PHD-PRC1复杂的影响种子发育基因从与H3K4me3相关的活跃状态到与H3K27me3相关的抑制转录状态,从而促进种子萌发[34].PHD蛋白GSR1(锗抑制素抵抗源位1)是用于种子萌发的疾病介导的遗传网络的成员,形成核心压力ARF16(营养响应因子16)调节种子萌发[35].因此,PHD蛋白在生命的生物过程中发挥着不可替代的作用。
目前,已经在几种植物中研究了博士学位蛋白质,例如拟南芥,杨树(杨树trichocarpa) [36],玉米(Zea Mays.) [30.],莫斯竹子(Phyllostachys Edulis.) [37),胡萝卜(胡萝卜胡萝卜L.)[38], 土豆 (Solanum Tuberosum.) [39]和梨(Pyrus Bretschneideri.) [40].然而,棉花PHD蛋白家族的综合鉴定和鉴定至今尚未开展。陆地棉(gossypium hirsutum)是世界上最重要的天然纤维作物。最近,完整基因组序列和注释的可用性g .分子[41],g . arboreum[42], 和g . raimondii就[43]提供了识别和表征的绝佳机会博士学位棉花中的转录因子。在本研究中,我们进行了全基因组分析、组织表达模式分析、不同胁迫和植物激素处理下的相对表达水平分析以及共表达网络分析GhPHD陆地棉的基因。我们的结果表明GhPHD基因参与各种植物生长和发育过程,植物激素介导GhPHD反对非生物胁迫的基因。
结果
基因组棉花棉蛋白鉴定
基于蛋白质序列的同源性,在三种棉质物种中鉴定了108,52和55个PHD蛋白质g .分子那g . arboreum, 和g . raimondii就,分别。此外,鉴定出39个和43个PHD蛋白拟南芥和大米,分别(表S1).在108个GHPD蛋白中,56个成员属于AT亚基因组,52个成员属于DT子组。预测的生物物理特征ghphds.(表1)表明,GhPHD蛋白的长度范围为159 aa (GhPHD28) ~ 2231 aa (GhPHD39),平均长度为741 aa。GhPHD蛋白分子量范围为17.76 kD (GhPHD28) ~ 247.42 kD (GhPHD39),平均为93.09 kD。GhPHD蛋白的等电点(pI)范围为4.58 (GhPHD38) ~ 10.41 (GhPHD103),平均为6.89。亚细胞定位结果显示,93个GhPHD蛋白位于细胞核,10个位于细胞质,5个位于细胞外。
系统发育分析,染色体定位和基因复制
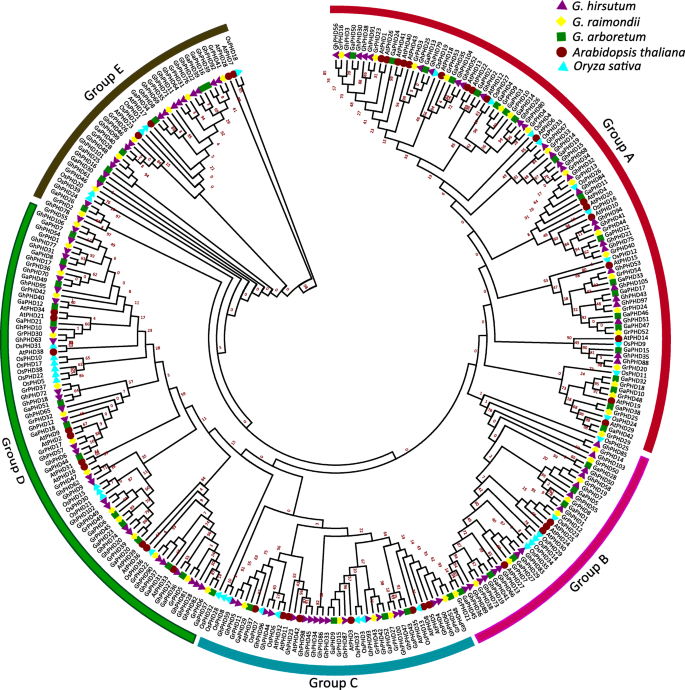
为了了解水稻中PHD蛋白的系统发育关系,拟南芥和棉,我们构建了一个NJ系统发育树和分类的Phd蛋白分为五组(A-E)(图。1).其中,二倍体与异源四倍体棉花之间的大部分同源PHD蛋白聚在同一个分支,系统发育关系具有最大的同源性。每一组都包含这5种PHD蛋白,其中A组和D组是第一和第二大组,分别包含97个和79个成员。而在B、C、e组中PHD成员相对较少。染色体定位分析显示108人GhPHD基因位于26条染色体上,其中13条染色体来自At亚基因组,13条染色体来自Dt亚基因组。S1和表格S2).更深入的见解表明,AT_05,AT_07和DT_05染色体包含更多数量的基因(八个GhPHD每个基因上都有),并在顶部密集分布。然而,有些染色体只包含两条GhPHD基因,例如AT_10,AT_11,DT_03和DT_11。
我们进一步调查了整个基因组重复(WGD)活动GhPHD基因。结果是73GhPHD基因对描述节段复制和四个基因对显示串联复制事件(表2),表明WGD是主要贡献者GhPHD基因家族扩张。复制基因对期间在进化过程中可能经过三种替代性释放,即非官能化,新官能化和子功能化[44].为了研究人类的进化史GhPHD基因,这ka / ks.计算器2.0用于计算同义词和非同义替代率。这ka / ks.76对重复基因对的比例小于1,说明GhPHD基因经历了纯化选择压力,功能性分歧有限。但是,只有一个基因对ka / ks.大于1,表示正选择压力的发生。综上所述,净化选择压力在功能维护方面的贡献较大GhPHD陆地棉的基因。
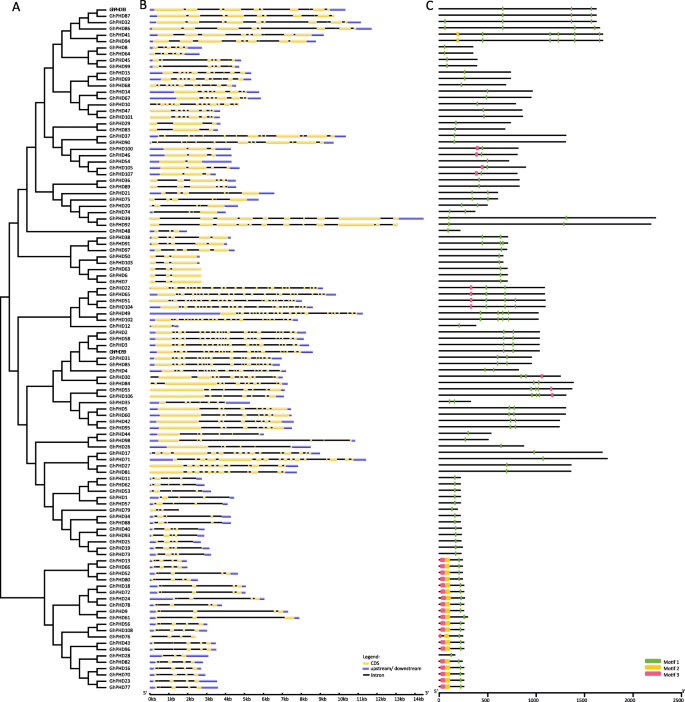
基因结构及保守基序分析
为了更好地了解高地棉中GHPRD蛋白的相似性和多样性,我们分析了系统发育树,外显子性结构和保守的主题。根据蛋白质同源性,保守的基因结构和基序分布,系统发育树被分组GHP2蛋白(图。2).GHPHD49显示了26个外显子的最长基因组序列,而GHP2.显示只有两个外显子的最短基因组序列(图。2和表格S3.).此外,在所有GHPP蛋白中鉴定了总共三个基序,并且所有GHPLD蛋白质都具有典型的PHD结构域(即,图案1)。系统发育树表明21只GHPHD蛋白质在疏水膜中聚集。除了GHPHD28外,所有其他GHPHD蛋白质含有三个具有相似基因结构和基序分布的基序(图。2).
蛋白质序列对准表明,GHPRD蛋白具有典型的Cys4-His-Cys3基序,其由约60个氨基酸组成,并伴有九个保守的氨基酸残基(图。S2).保守的组氨酸(H)从第四个保守的半胱氨酸(C)中被4个氨基酸和随后的保守的半胱氨酸(C)残基中的2个氨基酸分离出来。组氨酸(H)之前的第三和第四保守半胱氨酸(C)被一种或两种氨基酸隔开,但其他保守氨基酸之间的间隔数不确定。而GhPHD17、GhPHD27、GhPHD71和GhPHD81具有最大的同源性,但具有较少的保守PHD结构域(图1)。2和无花果。S2).
CIS.表演元素分析
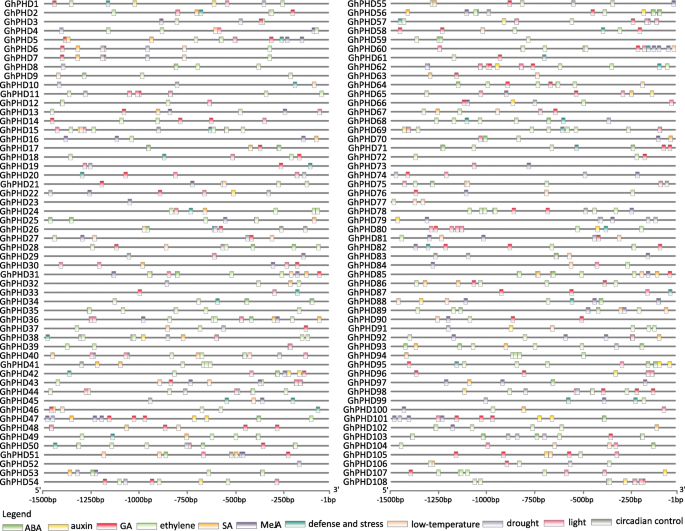
许多研究表明博士学位基因参与各种应激反应[30.那31那37].阐明…的假定功能ghphds.在不同的压力下,我们首先确定了CIS.-启动子区域中响应胁迫和植物激素的作用元件。我们确定了许多CIS.- 响应ABA(ABRE),助产工(TGA和AUXRRR-CORE),GA(TATC-BOX,P-BOX,CARE和GARE),乙烯(ERE),SA(TCA)和MEJA(CGTCA).这些结果表明,共有85个GhPHD其次是ABA、GA和MeJA。73GhPHD基因有CIS.- 应对三种或更多种植物激素的元素。有趣的是,启动子GhPHD5那GHPHD47.那GHPHD56, 和GHPHD65.基因含有CIS.- 对上述六种植物激素反应的元素。此外,我们发现许多非生物应力响应元素(富含TC的重复,MB和LTR),昼夜节律控制元件和光响应元件(G箱)也存在于各种的启动子中GhPHD基因(图。3.和表格S5).这些结果表明GhPHD基因可以参与各种信号转导途径,例如植物激素,光反应和非生物应激,并在调节植物生长和发育方面发挥重要作用。
组织特异性表达模式GhPHD基因
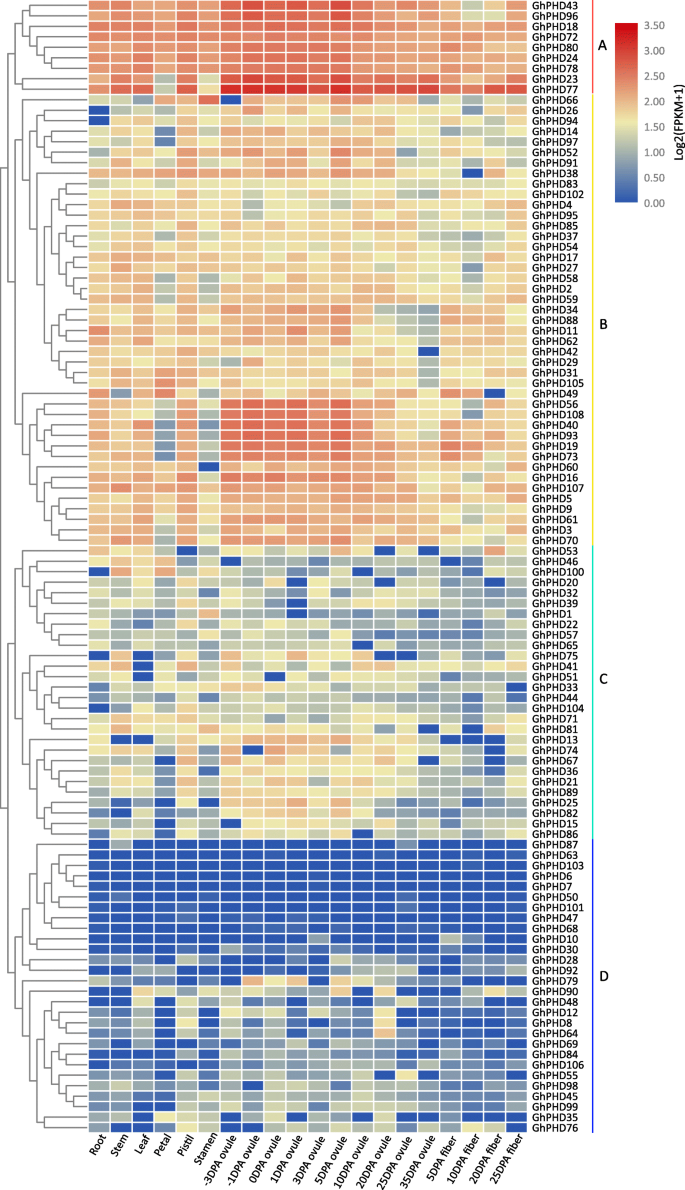
预测生理功能GhPHD利用在线转录组数据分析棉花生长发育相关基因的组织特异性表达谱GhPHD不同组织中的基因,如根、茎、叶、花瓣、雄蕊、雌蕊、胚珠和纤维。根据表达特征和层次聚类(图。4.),GhPHD基因主要聚为四组(A-D)。九个GhPHDA组基因在所有组织中均有高表达,表明它们可能在植物生长发育中发挥重要作用。特别是,GHPHD23.和GHPHD77.在胚珠和纤维组织中表达量最高,说明这两个基因可能参与了胚珠和纤维的发育。此外,43ghphds.B组在所有组织中显示出较低的表达水平,而六个GhPHD基因(GHPHD56那GHPHD108那GHPHD40那GHPHD93.那GHPHD19, 和GHPHD73.)主要在胚珠发育的早期表达,表明它们可能在胚珠和种子发育中起重要作用。而且,GhPHDC组中的基因显示胚珠中的更高表达水平。然而,GhPHDD组基因在所有观察组织中均表达不佳。这些结果表明ghphds.可能参与调节棉花的生长发育,特别是在胚珠和纤维的发育。
识别与压力相关的博士学位高地棉花的基因
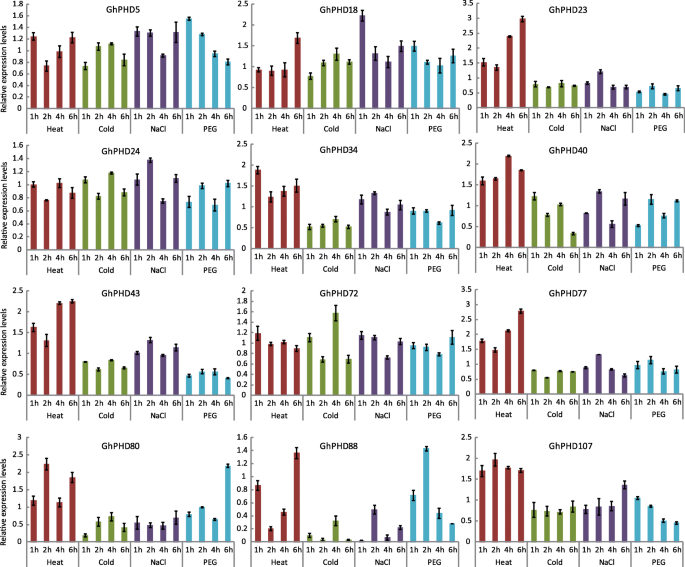
转录组数据分析显示66GhPHD基因在热,冷,盐和干旱处理下具有更高的表达水平(图。S3.).为了进一步估计答复ghphds.在非生物胁迫下,我们用热,冷,盐和干旱治疗了四周的棉幼苗,并观察到相对表达水平12GhPHD基因(图。5.).相对表达水平GHPHD18在所有压力下都有上调,表明这一点GHPHD18可能涉及多种应激反应机制。GHPHD23.是否仅在热处理时上调,说明GHPHD23.对热刺激有积极的反应。此外,GHPHD34那GHPHD40, 和GHPHD43.热处理和盐处理后上调,而GHPHD80和GHPHD88.在不同时间点耐高温、耐旱性上调。此外,我们发现GhPHD5对盐和干旱进行上调GHPHD72.和GHPHD107分别对抗盐和热量。这些结果表明GhPHD基因可能参与非生物胁迫,以改善不利环境中的植物耐受性。
鉴定GhPHD基因对植物激素的反应
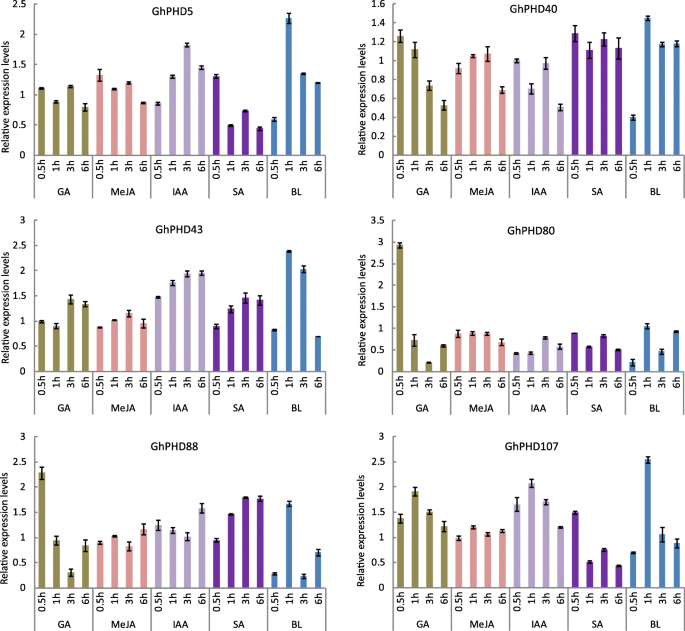
以进一步确定GhPHD用GA、MeJA、IAA、SA和BL处理4周龄棉花幼苗,确定了对植物激素响应的基因的相对表达变化GhPHD基因(图。6.).相对表达水平GhPHD5在MeJA、IAA和BL处理后显著增加。而GhPHD5在SA治疗后0.5小时后显示出更高的表达表明GhPHD5可以响应多种植物激素信号转导途径,这与事实一致GhPHD5启动子包含CIS.- 与多种植物激素有关的元素。GHPHD40在SA治疗下显着上调,表明GHPHD40对SA信号积极响应。相似地,GHPHD43.在所有植物激素治疗下显着上调,特别是在BL下。相对表达水平GHPHD80和GHPHD88.在GA处理0.5 h后达到峰值。相对表达水平GHPHD88.在SA治疗下逐渐增加。而且,GHPHD107表达显着增加到GA,IAA和BL处理1小时后的最大水平。这些结果表明GhPHD基因参与调节多种植物激素信号转导途径。
共表达网络与功能模块g .分子和g . arboreum
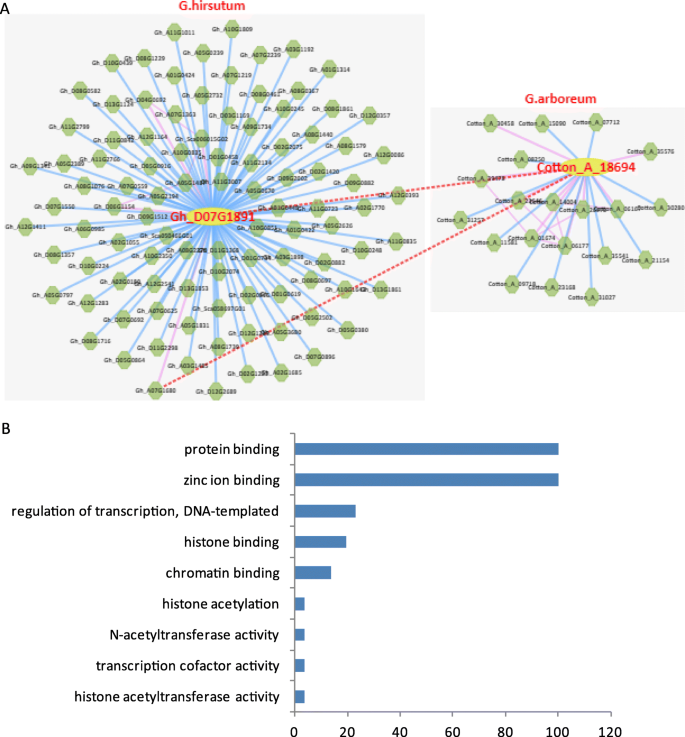
基因共表达网络分析是根据基因表达数据的相似性构建的网络图,反映基因之间的表达调控关系[45].我们分析了联合表达网络GhPHD利用ccNET软件,对多个共表达基因和相互作用蛋白进行了预测S6).在这其中,GhPHD5与植物特异性DNA连接酶正共表达,该酶与种子萌发和DNA修复有关。此外,GhPHD5还与SLOMO蛋白正共表达,SLOMO蛋白是一种F-box蛋白,用于维持生长素稳态和正常芽分生组织侧器官起始时间[46]说明这一点GhPHD5可参与蟾蜍素信号转导途径的调节,并介导种子萌发和器官形成来调节植物生长和发育。相似地,GHPHD18与调控FLC(开花位点C)表达的高亲水性蛋白相互作用[47],显示与参与分生组织的shaggy相关激酶正共表达,表明GHPHD18可能影响分生组织的开花时间。此外,GHPHD34与ERF(乙烯反应因子)亚家族负共表达b - 1,参与乙烯信号通路并应对非生物应激。GHPHD107积极的发生与ARF-GAP和小块土地可能参与了生长素和乙烯的信号通路。更有趣的是,我们预测了许多蛋白质会与GHPHD88.,如富亮氨酸重复蛋白激酶(LRRK)、胚胎发育晚期丰富蛋白(LEA)、AP2/B3转录因子、R2R3因子、DREB亚家族A-2、纤维素合成酶、赤霉素调节家族蛋白(GRP)和乙烯反应因子(ERF)(图)。7.和表S6),这表明GHPHD88.可以参与许多生理过程,如植物生长和发育,植物激素信号转导和应激反应。此外,基因本体(GO)分析ghphds.表明蛋白质结合和锌离子结合是最丰富的官能术语(图。7.b),这与现有的结果一致,即半胱氨酸残基对锌离子(Zn2+)和Zn2+-半胱氨酸配合物是蛋白质结构、催化和调控的关键介质[48].
总之,ghphds.参与调节棉花生长和发育,特别是胚珠和纤维发展。此外,ghphds.不仅响应多种植物激素信号转导途径,而且还改善棉花对不利环境的耐受性,如热,盐和干旱等不利环境。特别,GhPHD5那GHPHD80那GHPHD88.在他们的反应中突出。结合了共同表达基因和相互作用蛋白的预测结果,我们推断植物激素可以通过通过植物激素改善植物耐受性GhPHD基因及其辅助因子,但其调控机制和相互作用网络仍有待进一步研究。
讨论
系统发育分析和重复
利用系统发育树分析了棉花、水稻和水稻中PHD蛋白之间的进化关系拟南芥.总共297个PHD蛋白被分为5组(A- e)。棉花PHD蛋白与AtPHD蛋白的关系比OsPHD蛋白的关系更密切,这与棉花的进化关系一致。拟南芥和米饭。虽然g . arboreum基因组大约是两倍g . raimondii就结果表明,GrPHD蛋白比GaPHD蛋白多。两个二倍体和一个异源四倍体的PHD蛋白在系统发育树中分布紧密,这与陆地棉A和D基因组杂交进化的事实相一致[49].
我们确定了108个GHPD蛋白g .分子基因组,这是比以前确定的PHD蛋白家族成员拟南芥,玉米,土豆和梨[30.那39那40].更多的主要原因ghphds.陆地棉发生了多倍体化,促进了基因复制。陆地棉是一种异源四倍体棉g . arboreum(一个2基因组)和g . raimondii就(D5.基因组)[49].旱地棉的AT和DT亚基组供体是直向性亲属,并占据相同数量的正交基因,导致重复和加倍GhPHD陆地棉的基因。因此,总共的总和Gaphd.基因和格尔德基因大致等于GhPHD基因。以前的研究报告称,基因重复,包括全基因组重复,分段重复,串联复制和转置事件是基因家族扩张的主要原因[50那51].在本研究中,共鉴定出77对重复基因对GhPHD家庭,包括73个分段重复的对和四个串联重复对(表2).这ka / ks.最值GhPHD复制基因对小于1,表明GhPHD家庭经历了强烈的净化选择压力。净化选择占主导地位GhPHD基因,在两种重复的基因座,增加的固定下消除有害功能突变,并保留了新重复基因的功能[52].
保守氨基酸残基、蛋白质基序及基因结构分析
保守氨基酸残基分析表明GhPHD结构域在进化过程中高度保守。GhPHD结构域的氨基端包含由50 ~ 80个半胱氨酸残基排列规则的氨基酸组成的Cys4-His-Cys3锌指基序,是锌离子结合和蛋白质结构的重要介质[48].此外,GhPHD蛋白共鉴定出3个基序,且基序分布相对保守,说明GhPHD蛋白可能发挥不同的生理功能,不同支系GhPHD蛋白之间的细微差异可能与棉花生长发育和抗逆性有关。
基因结构可以由插入/缺失事件确定,并且是预测基因演化和新功能生成的重要参数[53].基因结构分析表明,重复基因具有相似的基因结构,内含子长度不同,说明内含子长度可能在基因功能多样化中起主要作用GhPHD基因。在本研究中,我们发现内含子数量从1到25不等,但大多数GhPHD基因中包含2到11个内含子,这支持了先前的研究,即棉花是一种新的进化物种,在进化的早期阶段内含子数量会减少[54].
GhPHD组织、非生物胁迫和激素胁迫中的基因表达
许多研究表明PHD蛋白是植物减数分裂和减数分裂后等发育过程中转录调控的主要介质[55],萌发[34],花粉成熟[56,花期[57],胚胎绩效启动和根瘤发芽[55那58].基因的表情概况显示ghphds.可能在棉花增长和发展中发挥重要的监管作用,特别是在胚珠和纤维的开发过程中。此外,我们还确定了一些GhPHD陆地棉对非生物胁迫和植物激素的响应基因。的分析CIS.作用元素和幼苗处理试验表明GhPHD基因可能会响应非生物应激并参与植物激素的信号转导。例如,GhPHD基因(GhPHD5那GHPHD40那GHPHD43.那GHPHD80, 和GHPHD88.)对高温、盐和干旱具有积极的响应,可能是提高植物逆境耐受能力的重要遗传材料。
研究表明,植物激素可能调节植物对非生物胁迫的反应。生长素反应因子(ARFs)是一种调控生长素反应基因表达的转录因子[59那60].在应力下的ARF的转录水平的显着上调表明它们是植物造成抗反环境的潜在介质[61那62].乙烯反应因子属于AP2/ARF转录因子家族中的ERF亚家族,广泛参与植物发育、植物激素反应、抗病和逆境反应[63那64].在本研究中,共表达网络分析表明GhPHD基因可以通过植物激素信号传导途径改善对非生物应激的植物耐受性。例如,GhPHD5可以通过调节养羊酸稳态来改善热量,盐和干旱的耐受性。相似地,GHPHD34和GHPHD107可能参与生长素和乙烯信号转导途径提高耐热性,促进生长发育。GHPHD88.调节各种植物激素和非生物胁迫的信号转导,促进生长发育。虽然ghphds.在生活过程中是不可或缺的,生理功能ghphds.非生物胁迫与植物激素之间的相互作用有待进一步研究。
结论
本研究共鉴定了297个PHD蛋白,包括5种植物g .分子那g . arboreum那g . raimondii就、大米和拟南芥.基于系统发育分析,将PHD蛋白分成五组。节段复制事件是扩展的主要贡献者GhPHD高地棉花的基因家庭。此外,重复的基因对GhPHD基因家族可能经历了功能差异,因为它们在不同组织中的表达模式不同。组织特异性表达模式表明ghphds.对胚珠和纤维的生长发育非常重要。植物激素和胁迫处理及共表达网络分析表明ghphds.可能通过植物激素信号转导途径提高其对不利环境的耐受性。本研究为了解棉花生长发育的功能机制提供了重要基础知识,为棉花抗非生物胁迫和植物激素刺激育种提供了候选基因。
方法
序列检索,多序列比对,系统发育分析
棉花基因组序列及信息(g .分子那g . raimondii就, 和g . arboreum),来源于CottonFGD (https://cottonfgd.org/) [65].Hmmer(https://www.ebi.ac.uk/tools/hmmer/)软件采用默认参数搜索相应的蛋白质序列,并以保守的PHD结构域序列作为查询。利用BLAST程序对PHD序列进行同源性进一步鉴定。PHD蛋白的保守结构域由Pfam预测[66]和聪明[67] 软件。使用Clustal X进行PHD蛋白的多序列对准[68].Mega 6.0 [69使用邻接(NJ)算法使用默认参数和1000引导复制来构建系统发育树。使用扩展性预测了GHPHD蛋白的分子量(MW),等电点(PI)和肉汁值[70], GhPHD蛋白的亚细胞定位由大提琴v2.5服务器预测[71].
染色体位置,基因结构和保守的主题
的位置信息GhPHD从CottonFGD网站下载的一般特征格式(GFF)文件中获得基因[65].ghphds.使用MapInspect映射到染色体上(https://mapinspect.software.informer.com/).用于外显子-内含子结构分析GhPHD使用在线基因结构显示服务器(GSDS 2.0)程序绘制其结构图[72].使用在线工具箱Multiple Expectation maximization for Motif Elicitation (MEME 5.0.5)研究GhPHD蛋白的保守基序[73].MEME的优化参数如下:重复次数,任何;最大主题数,50;以及每个基序的最佳宽度,在6到300个残留物之间,并仅保留与e值相关的主题
鉴定CIS.- 传递元素和基因表达模式
在转录开始现场之前的1500 bp启动子序列GhPHD基因从CottonFGD网站下载[65].这CIS.- 在...中的元素GhPHD启动子区域预测使用植物顺式作用调节元件网站[75].组织表达模式GhPHD利用棉花在线转录组数据进行基因分析,并用TBtools绘制热图[74].本研究利用根、茎、叶、花瓣、雄蕊、雌蕊、胚珠(−3、−1、0、1、3、5、10、20、25、35 DPA)和纤维(5、10、20、25、25 DPA)的转录组数据。ccNET软件[76]来分析基因共表达网络关系。
植物材料、非生物胁迫和植物激素处理
陆地棉ZM24是中国农业科学院棉花研究所选育的短季棉品种。首先,将ZM24种子在装满水的圆锥形瓶中室温预发芽48 h。将预发芽的种子移入培养温度为30℃、光周期为光照16 h、黑暗8 h的液体培养基中。用油菜素内酯(BL, 10 μM)、赤霉素(GA, 100 μM)、吲哚-3-乙酸(IAA, 100 μM)、水杨酸(SA, 10 μM)和茉莉酸甲酯(MeJA, 10 μM)处理4周龄棉花幼苗0.5、1、3和6 h。同样,4周龄的棉花幼苗在热(38°C)、冷(4°C)、NaCl (200 mM)和聚乙二醇(20%质量分数)处理1、2、4和6 h。实验中,未处理的样本作为对照组。采集的叶片立即在液氮中冷冻,保存在−80℃,用于RNA提取和RT-qPCR分析。在非生物胁迫和植物激素处理下,每个处理20株棉花幼苗,每个试验设3个生物重复。
RNA提取和RT-QPCR分析
使用RNAPREP纯植物试剂盒(多糖和多酚富含)(天根,中国)提取收集棉花叶子的总RNA。在或者der to synthesize the first-strand cDNA, the EasyScript All-in-One First-strand cDNA synthesis SuperMix for RT-qPCR kit (TransGen, Beijing, China) was used in accordance with the manufacturer’s protocol and the cDNA was used as template for subsequent RT-qPCR reaction. RT-qPCR was performed using TransStart Top Green qPCR SuperMix (TransGen, Beijing, China) in LightCycler 480 (Roche, Basel, Switzerland). Each PCR reaction was performed in triplicate, and three biological replicates were quantified.Ghhistone 3.(加入基因库。AF024716)用作内部控制[77].相对表达水平按前面所述计算[78].用于RT-QPCR分析的引物在表中列出S7.为了进行统计分析,RT-qPCR数据被认为是正态分布,我们进行了双尾Student’sT.-测试在Microsoft Excel 2007。
数据和材料的可用性
本文中使用或分析的数据已包含在本文中和其他材料中。支持本研究结果的基因组序列和注释数据集可供选择:
答:芥:https://www.arabidopsis.org
o .漂白亚麻纤维卷:http://plants.ensembl.org/index.html
g .分子那g . arboreum, 和g . raimondii就:https://cottonfgd.org/
缩写
- GH:
-
gossypium hirsutum
- 遗传算法:
-
Gossypium Arboreum.;
- gr:
-
Gossypium raimondii.
- 操作系统:
-
栽培稻
- 在:
-
拟南芥
- 分区:
-
天post-anthesis
- 博士:
-
植物同性律域
- NJ:
-
Neighbor-joining
- ARF:
-
助线响应因子
- MMD1:
-
男性Meiocyte死亡1
- Vim1:
-
甲基化的变体1
- VIN3:
-
春化不敏感3
- GSR1:
-
萌发素抵抗轨迹1
- BR:
-
Brassinosteroide
- BL:
-
油菜素内酯
- 遗传算法:
-
吉布林素
- 国际宇航科学院:
-
Indole-3-acetic酸
- SA:
-
水杨酸
- 惩罚:
-
茉莉酸甲酯
- 阿坝:
-
脱盐酸
- 等:
-
乙烯
- CK:
-
cytokinin.
- PEG:
-
聚乙二醇
- RT-qPCR:
-
定量实时聚合酶链反应
- 走:
-
基因本体论
- WGD:
-
全基因组重复
- FLC:
-
开花轨迹C
- ERF:
-
乙烯反应的因素
- GRP:
-
赤霉素监管家庭蛋白质
- lea:
-
晚期胚胎发生丰富
- LRRK:
-
富含亮氨酸重复蛋白激酶
参考
- 1。
Deinlein U,Stephan Ab,Horie T,Luo W,Xu G,Schroeder Ji。植物盐耐腐蚀机制。趋势植物SCI。2014; 19(6):371-9。
- 2.
Hossain Ma,Li Z-G,Hoque Ts,Burritt Dj,Fujita M,Munné-博世S.热或冷灌注诱导的植物中非生物胁迫的交通:关键调节因子和可能的机制。原生质。2018; 255(1):399-412。
- 3.
关键词:植物,非生物胁迫,分子机制,非生物胁迫组学。2012;16(4):188 - 99。
- 4.
Planas-Riverola A,Gupta A,Betegón-Putze I,Bosch N,IbañesM,Caño-Delgado AI。芸苔类固醇信号在植物开发中和适应压力。发展。2019; 146(5):DEV151894。
- 5.
关键词:油菜素内酯,植物,非生物胁迫,抗逆性方法《Mol Biol》杂志。2017; 1564:193 - 202。
- 6.
关键词:茉莉酸,植物,非生物胁迫,生理机制生物催化农业生物技术。2019;20:101210。
- 7.
Colebrook eh,Thomas Sg,Phillips Al,Hedden P.Gibberellin信号传导在植物反应对非生物胁迫的作用。J EXP BIOL。2014; 217(1):67-75。
- 8。
Khan Mir,Fatma M,Per Ts,Anjum Na,Khan Na。植物中的水杨酸诱导的非生物应激耐受性和潜在机制。前植物SCI。2015; 6:462。
- 9。
Pandey v,Bhatt Id,Nandi Sk。第20章 - 植物胁迫耐受性养肝信号传导的作用与调节。在:Khan Mir,Reddy PS,Ferrante A,Khan Na,编辑。植物信号传导分子。剑桥:木头出版;2019. p。319-31。
- 10。
Leng P,Yuan B,Guo Y.脱落酸在果实成熟中的作用和对非生物胁迫的反应。J Exp Bot。2014; 65(16):4577-88。
- 11.
脱落酸和非生物胁迫耐受性-不同层次的调控。植物生理学杂志。2014;171(7):486-96。
- 12.
Takatsuji H,Mori M,Benfey Pn,Ren L,Chua NH。特异性在矮牵牛花瓣和幼苗中表达的锌指DNA结合蛋白的表征。Embo J. 1992; 11(1):241-9。
- 13.
[16]张国平,李建平。拟南芥花轮边界的维持。植物生理学杂志,1999,15(3):457 - 464。自然。1995;378(6553):199 - 203。
- 14.
Omichinski JG,Clore Gm,Schaad O,Felsenfeld G,Trainor C,Appella E,Stahl SJ,Gronenborn Am。GATA-1的含Zn的DNA结合结构域的特异性DNA复合物的NMR结构。科学。1993; 261(5120):438-46。
- 15.
Daniel-Vedele F,Caboche M.烟草cDNA克隆编码Gata-1锌手指蛋白与真菌氮代谢调节器同源。Mol Gen Genet。1993; 240(3):365-73。
- 16.
Yanagisawa S. Dof dna结合蛋白含有一种新的锌指基序。植物生态学报,1996;
- 17.
Yanagisawa S,Izui K.两种玉米DNA结合蛋白的分子克隆在结构上不同但与相同的序列基序相互作用。J Biol Chem。1993年; 268(21):16028-36。
- 18.
冯·阿尼姆AG,邓新文。拟南芥COP1的环指基序定义了一类新的锌结合结构域。生物化学杂志。1993;268(26):19626-31。
- 19。
Schindler U, Beckmann H, Cashmore AR. HAT3.1,一种新的拟南芥同源结构域蛋白,包含一个保守的半胱氨酸丰富区域。植物j . 1993; 4(1): 137 - 50。
- 20。
Zmhox1a是一个新的玉米同源盒基因的产物,它与萎缩的26 bp反馈控制元件相互作用。EMBO j . 1992; 11(9): 3367 - 74。
- 21。
桑切斯-加西亚一世,兔子TH。LIM结构域:在锌指状蛋白质中发现的一种新的结构基序。趋势麝猫。1994;10(9):315 - 20。
- 22。
关键词:锌指蛋白,向日葵,花粉特异性,cDNA植物j . 1992; 2(5): 713 - 21所示。
- 23。
Kaadige Mr,Ayer de。在PF1的植物同源域锌指1的植物的多元区是必要的,并且足以用于特异性磷酸钠结合。J Biol Chem。2006; 281(39):28831-6。
- 24。
Bienz M. Phd手指,核蛋白质相互作用域。趋势Biochem SCI。2006; 31(1):35-40。
- 25。
Martin DG,Baetz K,Shi X,Walter KL,MacDonald Ve,Wlodarski MJ,Gozani O,Hieter P,Howe L. YNG1P植物同性恋的手指是甲基组蛋白粘合模块,识别赖氨酸4-甲基化组蛋白H3。Mol细胞Biol。2006; 26(21):7871-9。
- 26。
在拟南芥雄性减数分裂过程中,DUET基因是染色体组织和进程的重要组成部分,编码一个PHD指状蛋白。发展。2003;130(24):5975 - 87。
- 27.
拟南芥MALE MEIOCYTE DEATH1基因编码一种PHD-finger蛋白,该蛋白是雄性减数分裂所必需的。植物细胞。2003;15(6):1281 - 95。
- 28.
在拟南芥雄性减数分裂过程中,染色质蛋白DUET/MMD1控制了减数分裂基因TDM1的表达。公共科学图书馆麝猫。2015;11 (9):e1005396。
- 29.
Woo HR, Pontes O, Pikaard CS, Richards EJ。VIM1是一种甲基胞嘧啶结合蛋白,用于着丝粒异染色质化。基因Dev。2007;21(3):267 - 77。
- 30.
王Q,刘继,王Y,赵y,姜h,程b.玉米博士学基因系列的系统分析显示了一种涉及非生物应激反应的亚家族。int j mol sci。2015; 16(10):23517-44。
- 31.
Alam I,Liu CC,Ge HL,Batool K,杨YQ,Lu Yh。基因组调查,博士学位基因的进化和表达分析揭示了芸苔属Rapa L.BMC基因组学的开发和非生物应激反应过程中不同的作用。2019; 20(1):773。
- 32。
魏伟,黄杰,郝玉军,邹海峰,王华伟,赵建勇,刘学勇,张伟坤,马斌,张建军,等。转基因拟南芥中大豆gmphd型转录调控因子可提高拟南芥的抗逆性。《公共科学图书馆•综合》。2009;4 (9):e7209。
- 33。
拟南芥中一个改变的PHD-finger蛋白加速了春化反应。植物信号处理技术研究进展[j] .中国生物医学工程学报,2017;
- 34。
Molitor Am,Bu Z,Yu Y,Shen Wh。Arabidopsis Al PHD-PRC1复合物通过H3K4ME3-〜H3K27ME3染色态转换促进种子发芽的抑制种子发育基因。Plos Genet。2014; 10(1):E1004091。
- 35。
YE Y,Gong Z,Lu X,Miao D,Shi J,Lu J,Zhao Y.萌发素抗性遗迹1编码涉及疾病介导的种子休眠和萌发的Phd手指蛋白。工厂J. 2016; 85(1):3-15。
- 36.
吴S,董Q,江汉,蔡河,Xiang Y.杨树植物植物蛋白家族的基因组鉴定,分类及表达分析。基因。2016; 575(1):75-89。
- 37.
高y,刘H,王Y,李F,Xiang Y.摩尔竹(Phyllostachys Edulis)各种治疗中Phd-Finger基因和表达模式分析的基因组。植物理性生物化学。2018; 123:378-91。
- 38.
吴晓军,李明勇,阙飞,王飞,徐志升,熊爱生。胡萝卜PHD家族转录因子的全基因组分析(胡萝卜胡萝卜L.)揭示了非生物胁迫的进化和响应。植物生理学学报。2016;38(3):67。
- 39.
关键词:茄属植物,ph -finger基因,全基因组鉴定,表达分析《公共科学图书馆•综合》。2019;14 (12):e0226964。
- 40。
[11]曹勇,韩勇,李东,李东,李东,林勇,蔡勇。中国梨(Pyrus bretschneideri) PHD-finger基因家族的系统分析和比较及其在果实发育中的作用。Funct Integr Genomics. 2018;18(5): 519-31。
- 41。
张T,胡y,江w,方l,guan x,陈j,张j,saski ca,scheffler,btelly dm等。异丙型棉花(Gossypium hirsutum L. Acc.TM-1)的测序提供了一种用于纤维改进的资源。NAT BIOTECHNOL。2015; 33(5):531-7。
- 42。
李F,风扇G,王k,Sun F,元y,歌,李Q,ma z,lu c,zou c等。栽培棉质棉花型arboreum的基因组序列。NAT Genet。2014; 46(6):567-72。
- 43。
Paterson AH, Wendel JF, Gundlach H, Guo H, Jenkins J, Jin D, Llewellyn D, Showmaker KC, Shu S, Udall J等。棉基因组的重复多倍体化与可纺棉纤维的进化。大自然。2012;492(7429):423 - 7。
- 44。
Lynch M, Conery JS。重复基因的进化命运和后果。科学。2000;290(5494):1151 - 5。
- 45。
Rao X,Dixon Ra。植物生物学的共表达网络:为什么以及如何。Acta Biochim Biophys Sin。2019; 51(10):981-8。
- 46。
Lohmann D,Stacey N,Breuninger H,Jikumaru Y,Muller D,Sicard A,Leyser O,Leyser O,yamaguchi S,Lenhard M.在拟南芥中射击分泌射击分类的侧向器官启动的正常时机所必需的.植物细胞。2010; 22(2):335-48。
- 47。
Searle I,He Y,Turck F,Vincent C,Fornara F,Kröbers,amasinoRa,屈曲因子FLC通过抑制拟南芥中的分娩能力和全身信号传导来赋予春化的开胃反应。基因开发。2006; 20(7):898-912。
- 48。
PACE NJ,Weerapana E. Zinc结束半胱氨酸:不同的功能和结构图案。生物分子。2014; 4(2):419-34。
- 49。
Wendel J,Grover C.分类和棉花属的演变,Gossypieum;2015年。
- 50.
布兰科G,伍尔夫KH。从重复基因的年龄分布推断模式植物物种广泛的古多倍性。植物细胞。2004;16(7):1667 - 78。
- 51.
鞭毛le,wendel jf。基因重复与植物进化新颖性。新植物。2009; 183(3):557-64。
- 52.
Tanaka KM, Takahasi KR, Takano-Shimizu T.通过掩盖有害的功能缺失突变,增强了一个新出现的重复基因的固定和保存。麝猫研究》2009;91(4):267 - 80。
- 53.
徐G,郭成,山H,孔H.外显子系统结构中重复基因的分歧。Proc Natl Acad Sci U S A. 2012; 109(4):1187-92。
- 54.
Roy SW,Penny D.植物内含子损失和增益的模式:内含子损失占主导地位的进化和基因组的O. Sativa和A. Thaliana的比较。mol Biol Evol。2007; 24(1):171-81。
- 55.
在拟南芥减数分裂过程中,AtSCC2是胚胎发生和姐妹染色单体结合所必需的。植物j . 2009; 59(1): 1-13。
- 56。
摘要/ abstract摘要:持续性绒毡层细胞1 (PERSISTENT TAPETAL CELL1)是水稻绒毡层细胞死亡和花粉发育所必需的一种蛋白质。植物杂志。2011;156(2):615 - 30。
- 57。
Lopez-Gonzalez L,Mouriz A,Narro-Diego L,Bustos R,Martinez-Zapater Jm,Jarillo Ja,Pineiro M.染色蛋白依赖于拟南芥花卉积分器基因依赖于植物特异性Phd蛋白质。植物细胞。2014; 26(10):3922-38。
- 58。
Schlereth A,Moller B,Liu W,Kientz M,Flipse J,Rademacher eH,Schmid M,Jurgens G,Weijers D. Monopteros通过调节移动转录因子来控制胚胎根起因。自然。2010; 464(7290):913-6。
- 59。
钱德勒JW。生长素反应的因素。植物细胞环境学报。2016;39(5):1014-28。
- 60。
关键词:植物生长素,输出控制,生物信息学实验机器人。2018;69(2):179-88。
- 61。
Bouzroud S, Gouiaa S, Hu N, Bernadac A, Mila I, Bendaou N, Smouni A, Bouzayen M, Zouine M. M.生长素响应因子(ARFs)在番茄对生物和非生物胁迫的响应中起着潜在的调节作用。《公共科学图书馆•综合》。2018;13 (2):e0193517。
- 62。
关键词:铁皮石斛,生长素,非生物胁迫,响应因子国际分子科学杂志。2017;18(5):927。
- 63。
MüllerM,Munné-博世S.乙烯反应因子:激素和应力信号中的关键调节中心。植物理性。2015; 169(1):32-41。
- 64。
Huang Py,Catinot J,Zimmerli L.拟南芥免疫乙烯反应因子。J Exp Bot。2016; 67(5):1231-41。
- 65。
Zhu T,Liang C,Meng Z,Sun G,Meng Z,Guo S,Zhang R. Cottonfgd:棉花综合功能基因组数据库。BMC植物BIOL。2017; 17(1):101。
- 66。
Sonnhammer El,Eddy SR,Birney E,Bateman A,Durbin R. PFAM:多个序列比对和蛋白质结构域的肝脏谱。核酸RES。1998年; 26(1):320-2。
- 67。
Leatunic I,Bork P. 20年的智能蛋白质域注释资源。核酸RES。2018; 46(D1):D493-D496。
- 68。
Larkin Ma,Blackshields G,Brown NP,Chenna R,McGettigan Pa,McWilliam H,Valentin F,Wallace Im,Wilm A,Lopez R等人。Clustal W和Clustal X 2.0版。生物信息学。2007; 23(21):2947-8。
- 69。
Tamura K,SteCher G,Peterson D,Filipski A,Kumar S. Mega6:分子进化遗传学分析6.0版。mol Biol Evol。2013; 30(12):2725-9。
- 70.
Artimo P, Jonnalagedda M, Arnold K, Baratin D, Csardi G, de Castro E, Duvaud S, Flegel V, Fortier A, Gasteiger E,等。ExPASy: SIB生物信息资源门户。核酸研究2012;40(Web服务器版本):W597-603。
- 71.
于长生,林志坚,黄继坤。基于n肽组成的支持向量机预测革兰氏阴性菌蛋白的亚细胞定位。蛋白质科学。2004;13(5):1402 - 6。
- 72.
[11]胡斌,金军,郭爱娥,张宏,罗军,高光。GSDS 2.0:基因特征可视化升级服务器。生物信息学,2015,31(8):1296 - 7。
- 73.
作者简介:Bailey TL, Boden M, Buske FA, Frith M, Grant CE, Clementi L, Ren J, Li WW, Noble WS。MEME SUITE:用于主题发现和搜索的工具。核酸研究2009;37(Web服务器版):W202-8。
- 74.
Chen C,夏R,陈H,他是TBOOLS,生物学家的工具包与用户友好的界面集成了各种HTS数据处理工具。生物XIV。2018年:289660。
- 75.
Lescot M, Dehais P, Thijs G, Marchal K, Moreau Y, Van de Peer Y, Rouze P, Rombauts S. PlantCARE:植物顺式调控元件数据库和启动子序列分析工具的入口。中国生物医学工程学报,2002;30(1):125 - 125。
- 76.
yuq, Xu W, Zhang K, Zhang L, Yi X, Yao D, Wang C, Zhang X, Zhao X, Provart NJ, et al. ccNET:棉二倍体和多倍体共表达网络功能模块数据库。核酸研究2017;45(D1): D1090-d1099。
- 77.
万强,关欣,杨宁,吴华,潘敏,刘波,方玲,杨松,胡勇,叶伟,等。GhMML3_A12双向转录的小干扰rna调控棉纤维发育。新植醇。2016;210(4):1298 - 310。
- 78.
Livak KJ,Schmittgen TD。使用实时定量PCR和2的相对基因表达数据分析(-Delta Delta C(T))方法。方法。2001; 25(4):402-8。
确认
一个也没有。
资金
基金资助:国家自然科学基金重大专项(no . 31690093)。资助人没有参与研究的实验设计、数据收集和解释,也没有参与论文的撰写。
作者信息
隶属关系
贡献
H.W.和G.Q.构思和设计了这些实验。H.W.和M.G.进行了实验。H.W.和l.z分析了数据。H.W.写了这篇论文。Z.Y.和Z.W.对论文进行了修改。所有作者阅读并批准了最终的稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。我们的研究不涉及任何人或动物科目,材料或数据。本研究中使用的植物材料由中国农业科学院棉花研究所提供,并在机构,国家和国际准则之后自由参加研究目的。
同意出版
不适用。
相互竞争的利益
作者声明了该研究在没有任何商业或财务关系的情况下进行的,这可能被解释为潜在的利益冲突。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1
.染色体的位置GhPHD26条染色体上的基因g .分子.染色体的数目显示在每条染色体的顶部。比例尺表示以Mb为单位的长度。
附加文件2:图S2
.与典型的C的108GHD蛋白和PHD基序的保守结构域的对准结果4.HC.3.模型
附加文件3:图S3
.表达概况GhPHD在寒冷,热,盐和干旱下的基因。表达特征为108 GhPHD利用现有的转录组数据对四种胁迫处理下的基因进行了研究。1 h、3 h、6 h、12 h分别表示不同胁迫处理后的时间。基因名称和亚家族显示在右边。带有颜色的块表示相对表达式级别ghphds.
附加文件4:表S1
.来自g .分子那g . raimondii就那g . arboreum那答:芥, 和o .漂白亚麻纤维卷
附加文件5:表S2
.染色体定位及基因注释GhPHD基因g .分子
附加文件6:表S3
.成绩录 - 108的特征GhPHD基因
附加文件7:表S4
.主要胁迫分布与植物激素有关CIS.的启动子区域中的-定位元素GhPHD基因
附加文件8:表S5
.数量CIS.- 在启动子中的元素GhPHD基因
附加文件9:表S6
.共表达网络分析结果
附加文件10:表S7
.本研究的RT-qPCR引物
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
吴,H.,郑,L.,Qanmber,G。等等。植物激素介导的植物同源域(博士)家族对旱地棉花的非生物胁迫(gossypium hirsutumSPP。)。BMC植物杂志21,13(2021)。https://doi.org/10.1186/s12870-020-02787-5
已收到:
公认:
发表:
关键词
- 棉花
- 博士学位
- 转录因子
- 植物激素
- 抗压力能力
- 共表达网络
- 转录组分析