摘要
背景
在植物中,组成型光形态形成因子1 (CONSTITUTIVELY photomphogenic 1, COP1)是光周期响应的关键负调控因子。然而,cop1相互作用蛋白1 (CIP1)的生物学功能及CIP1- cop1相互作用的调控机制尚不完全清楚。
结果
在这里,我们找到了苹果MdCIP1基于拟南芥的基因AtCIP1基因。表达模式分析表明MdCIP1在苹果的不同组织中组成性表达,并在转录水平上响应应激和激素信号。异位表达MdCIP1补充拟南芥的表型CIP1.MdCIP1抑制苹果愈伤组织中花青素合成。此外,生化分析表明,MdCIP1可以通过其螺旋-螺旋结构域与MdCOP1蛋白相互作用MdCIP1-OX / cop1-4在光学发生中具有类似的表型cop1-4突变体,暗示COP1是背景CIP1..此外,瞬时转化实验表明,MdCIP1抑制了mdcop1介导的花青素生物合成。
结论
综上所述,本研究发现MdCIP1作为抑制因子,通过MdCOP1调控苹果的下胚轴伸长和花青素生物合成。
背景
从种子萌发到幼苗发育,植物精确地受各种环境因素调节。光是影响植物生长,发展和繁殖的最重要的环境因素之一。植物通过光合作用将光能转化为化学能量并将其存放在植物中。它们还可以通过光感受感测光信号,然后调节植物生长和发展的整个生命周期[1那2].植物主要依靠三种光感受器来感测阳光和透射光信号,即植物植物(红色和远红光受体),加密(蓝光受体)和UVR8(UV-B轻受体)[3.那4.那5.].
被光激活后,感光体进入核,并直接与一系列因素进行传输光信号,从而改变植物的转录模式,最终导致光膀胱[6.那7.].光形态建成是幼苗发育的关键。当种子在土壤中发芽时,幼苗加速下胚轴伸长,从土壤中伸出。光照后,下胚轴的伸长受到抑制,而子叶则迅速扩张[8.].此外,叶绿素和花青素的生物合成也是光膀胱的典型特征[8.那9.].在光信号转导的过程中,组成型光学1(COP1)是最重要的负因子,位于感光体的下游[10.].COP1是一种保守的RING型E3泛素连接酶,参与植物生长发育、哺乳动物细胞生长和代谢等多种生物生理过程[11.].
在植物中,COP1通过降解光形态建成启动子LONG HYPOCOTYL In FAR-RED 1 (HFR1)、LONG AFTER FAR-RED LIGHT 1 (LAF1)和ELONGATED HYPOCOTYL 5 (HY5)来调控幼苗的生长发育;在光照条件下,COP1位于细胞质内,从而促进下游底物的生物合成,促进光形态建成[12.那13.那14.].此外,COP1涉及植物开花,气孔开放和关闭,生物节奏和水果发展[15.那16.那17.].此外,COP1还参与植物防御反应、激素信号转导和miRNA生物合成[18.那19.那20.那21].
COP1蛋白包含一个n端环指基序,接着是一个螺旋-螺旋结构域和WD40重复序列,在拟南芥中已经分离出几个COP1相互作用蛋白(CIPs) [22那23那24那25那26那27那28].其中,CIP4和CIP7与COP1的卷曲-卷曲结构域相互作用,该结构域位于细胞核内,具有转录激活活性。CIP4和CIP7也是光形态建成的正调控因子,也是COP1潜在的直接下游靶点[25那27].但是,CIP4和CIP7的功能是不同的。CIP7表达的减少导致光依赖花青素和叶绿素生物合成的减少,但不影响下胚轴的伸长。而CIP4表达的降低抑制了下胚轴伸长和叶绿素含量,不影响花青素合成[25那27].CIP8是一个RING-H2连接酶,可以与COP1蛋白相互作用。在体外,CIP8也可以通过泛素连接酶e2依赖的方式降解HY5,但其生物学功能尚不清楚[26那28].
先前的研究发现,在体外,CIP1与COP1的卷曲-卷曲结构域相互作用[24].但CIP1的生物学功能及CIP1- cop1相互作用的生物学意义尚不完全清楚。在这里,我们发现了苹果的同源基因MdCIP1负调节光膀膀胱。此外,MDCIP1与MDCOP1相互作用,并在MDCOP1介导的途径中抑制苹果花青素生物合成。
结果
MdCIP1的蛋白质结构
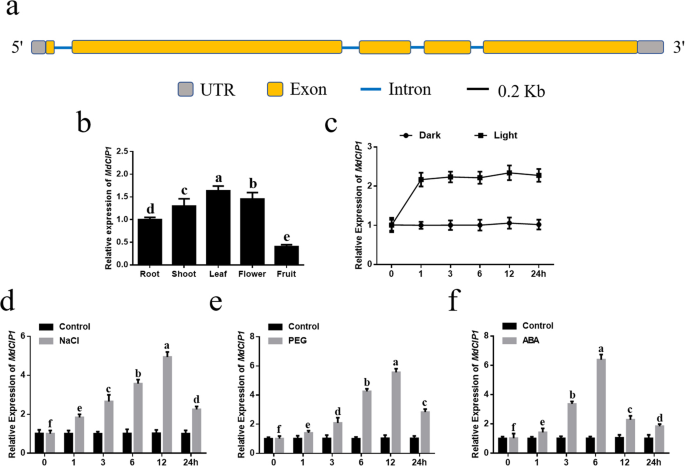
苹果MdCIP1(MDP0000230486.利用拟南芥AtCIP1的蛋白序列(AT5G41790),从Apple Genome V1.0 Predicted peptide数据库中敲除该基因。经过SMART蛋白质二级结构分析(http://smart.embl-heidelberg.de/smart/set_mode.cgi?normal=1), MdCIP1包含一个潜在的线圈-线圈结构域,对应于全长MdCIP1的aa 251-684,类似于AtCIP1(图S1b).然后利用Pymol程序和VMD软件预测MdCIP1和AtCIP1的三维结构。令人惊讶的是,MdCIP1和AtCIP1的三维结构高度相似,尽管它们的蛋白质序列相似度只有30%(图S1a、c)。
表达式模式MdCIP1
通过基因结构显示服务器2.0的分析,发现MdCIP1该基因包含5个外显子,4个内含子,编码1640个氨基酸(图1)。1一种)。为了分析组织特异性表达MdCIP1,转录水平MdCIP1在根,射击,叶,花和水果被检测到。发现表达水平MdCIP1叶片和水果中较低(图。1b)。对的响应MdCIP1还分析了光和黑暗的条件。1小时后的轻微治疗后,表达MdCIP1迅速增加。随着光照时间的延长,表现为MdCIP1没有明显变化。暗处理中,表达量无显著性差异MdCIP1(图5)1C)。对的响应MdCIP1还检查了应力和激素信号。结果,在盐和PEG治疗的早期阶段,MdCIP1表达量显著上调,12 h后达到最大值,随后下降(图5)。1d,e)。对的响应MdCIP1与盐处理和PEG处理相比,处理6 h后达到最大值。1F)。这些结果表明MdCIP1可以在转录水平上对应激和激素信号作出反应。
MdCIP1抑制光形态发生
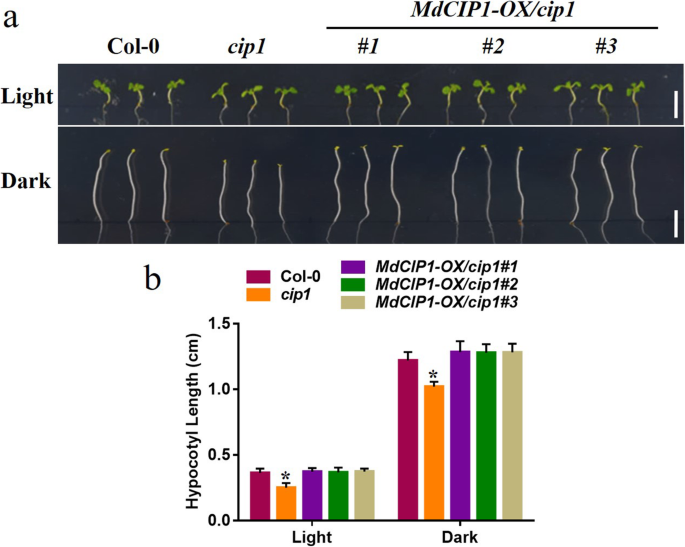
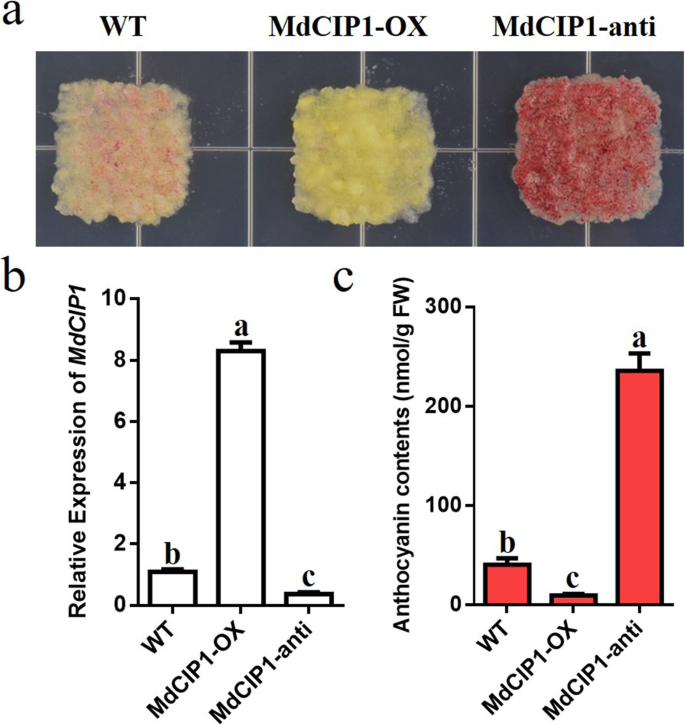
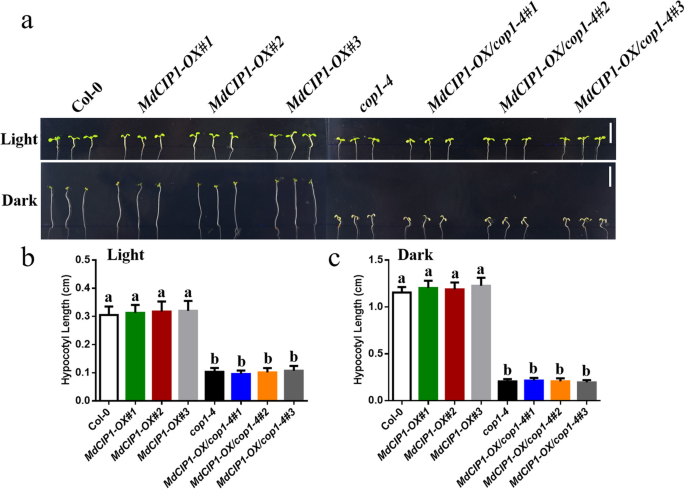
探讨CIP1在光学发生中的功能,CIP1.突变体,MdCIP1获得了异源过表达系及其杂交拟南芥材料。这些材料在DNA水平上被鉴定(图S2).测定了光照和黑暗条件下幼苗的下胚轴长度。因此,下胚轴CIP1.在光和暗条件下突变体比野生型短(图。2)[29].MdCIP1过度的CIP1.突变体补充了该基因的表型CIP1.突变体(无花果。2).这说明AtCIP1和MdCIP1在光形态建成中起抑制作用,在功能上是保守的。为了进一步了解MdCIP1在苹果中的作用,本研究对其进行了研究MdCIP1-OX和MDCIP1-反构建转基因苹果愈伤组织(图。3.b).愈伤组织花青素合成结果显示,与野生型相比,MdCIP1-OX积累的花青素较少,MdCIP1-anti积累的花青素明显较多(图5)。3.这表明MdCIP1抑制了苹果愈伤组织中花青素的合成。
MDCIP1与MDCOP1交互
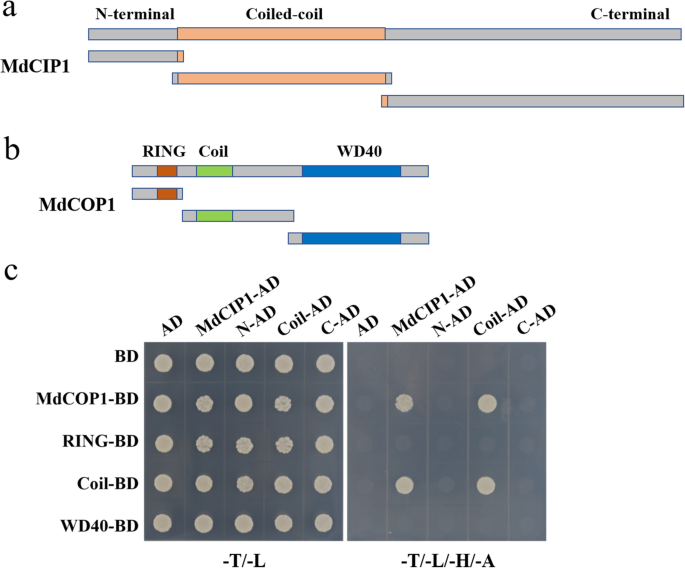
AtCIP1通过其卷曲-卷曲结构域与AtCOP1蛋白相互作用[24].推测MdCIP1与MdCOP1相互作用,并通过Y2H实验进行验证。根据蛋白结构域分析,MdCIP1分为n端、一个螺旋-螺旋结构域和c端;MdCOP1包含一个RING基序、一个线圈-线圈结构域和WD40重复序列(图1)。4.a,b)。Y2H结果表明,MDCIP1还通过其卷绕线圈域与MDCOP1的卷曲卷域相互作用(图。4.c).此外,还使用下拉实验来验证这种相互作用。结果显示,His-MdCOP1蛋白只被GST-MdCIP1 CC蛋白拉低,而没有被GST蛋白拉低,表明MdCIP1的卷曲-卷曲结构域在体外与MdCOP1发生物理作用(图S3.).MdCIP1也与AtCOP1相互作用(图S4.),类似于AtCIP1-AtCOP1。
COP1是背景CIP1.
为了测试是否CIP1.依赖COP1在光膀膀胱那这cop1-4突变体,MdCIP1-OX和MdCIP1-OX / cop1-4经DNA检测得到并证明(图S5.).有趣的是,异位过度表达MdCIP1在cop1-4突变体的下胚轴表型与突变体相似cop1-4,无论光或暗处理(图。5.).在成人阶段,MdCIP1-OX / cop1-4也充分展示了cop1-4,矮化和分枝(图S6.).这个结果表明COP1是背景CIP1..
MdCIP1通过mdcop1依赖的途径抑制花青素的生物合成
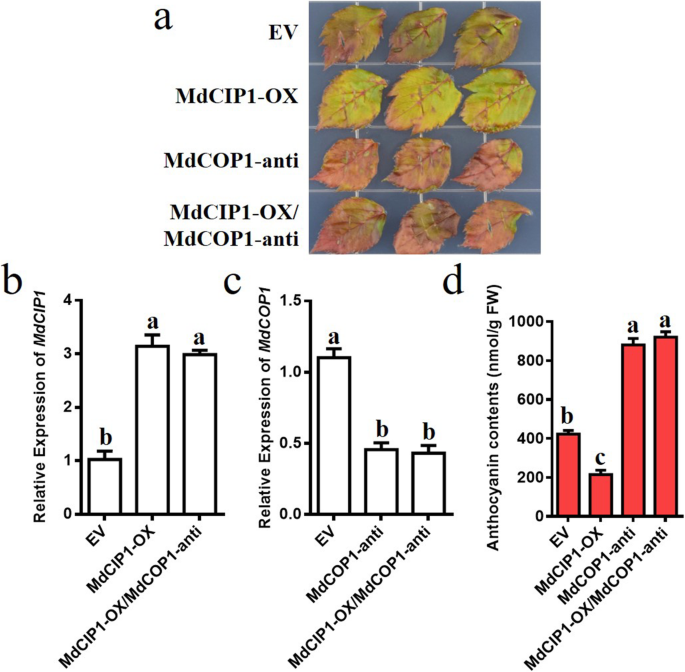
通过瞬时侵染观察MdCIP1和MdCOP1在花青素合成中的作用。空向量作为控件。因此,MdCIP1MdCIP1-OX感染后,表达上调,花青素下降;这MDCOP1.mdcop1抗感染后,表达下调,花青素增加(图。6.模拟)。当混合感染时,MDCIP1-OX / MDCOP1-抗的花青素含量等于MDCOP1-anti的花青素含量(图。6.模拟)。这说明MdCIP1通过MdCOP1抑制苹果叶片花青素的生物合成。
讨论
`在拟南芥中,CIP1编码1586个氨基酸,其相对分子量高达182.02kDa [24].MdCIP1蛋白含有1640个氨基酸,相对分子质量为182.92 kDa。虽然MdCIP1和AtCIP1的蛋白序列相似度只有30%,但它们的3D结构非常相似(图S1).这说明CIP1蛋白的氨基酸序列在不同物种间进化过程中存在较大差异,但维持蛋白质结构的关键氨基酸保持不变。结构决定功能,进一步表明CIP1蛋白在进化过程中可能具有保守功能。数字2表明,MDCIP1和ATCIP1抑制了光膀胱,这可能证明这一点。
MdCIP1-OX / cop1-4与的表型相似cop1-4,表明这一点CIP1.位于上游COP1(无花果。5.;无花果。6.).CIP1可以通过其卷绕线圈区域与COP1蛋白相互作用[24].提示CIP1可能在蛋白水平上调控COP1。COP1有三个结构域:RING结构域负责招募泛素结合酶E2,卷曲-卷曲结构域负责二聚并与COP1- spa相互作用形成COP1- spa配合物,WD40重复区负责与底物相互作用[11.那30.].spa与COP1相互作用,增强COP1 E3泛素连接酶活性[31那32那33].最近,鉴定了一种新型COP1相互作用蛋白COP1抑制剂2(CSU2)[34].CSU2位于核内,通过它们的线圈-线圈区域与COP1相互作用。CSU2通过潜在中断COP1或COP1- spa相互作用的二聚来抑制COP1 E3泛素连接酶活性[34].然而,CIP1作为一种细胞骨架相关蛋白,在下胚轴细胞的细胞质中呈现纤维状模式[24].最近的研究表明,细胞质中的COP1在黑暗中普遍降解下胚轴细胞中的微管相关蛋白波衰减2-LIKE 3 (WDL3) [35那36].推测CIP1可能通过调控细胞质中的COP1蛋白参与WDL3的降解,这与CSU2不同。
对于苹果来说,花青素是很重要的,它不仅在很大程度上决定了苹果的色泽,而且具有抗氧化和清除活性氧的作用[37那38].花青素是一类关键的次级代谢产物,由结构基因编码的一系列酶(PAL,CHS,CHI,F3H,DFR,AN和UFGT)合成,并由MYB-BHLH-WD40转录复合物调节[39那40].花青素的生物合成受到环境和激素信号的影响[38那41].MDMYB1及其等位基因(MDMYB10和MDMYBA)通过激活结构基因的转录来促进花青素生物合成MdDFR和mduf3gt.[42那43].研究发现MDBT2加速了MDMYB1通过蛋白酶体途径的降解,从而消极调节氮缺乏诱导的花青素生物合成[44].同时,ABA、损伤、干旱胁迫和强光也通过“mdbt2 -靶蛋白- mdmyb1”模块(靶蛋白分别为MdbZIP44、MdWRKY40、MdERF38和MdTCP46)诱导花青素生物合成[45那46那47那48那49].MdCOP1通过MdMYB1蛋白的泛素降解负调控苹果果实花青素生物合成和果皮着色[50].本研究发现,MdCIP1抑制花青素的生物合成,MdCOP1参与了这一过程(图。6.).的启动子活性AtCIP1可以通过渗透应激和ABA诱导,ATCIP1积极参与ABA反应[29].MdCIP1响应转录水平的激素和环境信号(图。1).推测MdCIP1-MdCOP1-MdMYB1通路也可能被用于揭示激素和环境信号对花青素生物合成的调控机制,为激素和环境对果实着色的影响提供了新的视角。
结论
MDCIP1,MDCOP1的上游调节剂,通过与苹果中的MDCOP1相互作用,在缺口伸长率和花青素生物合成中起着抑制作用。
方法
植物材料和生长条件
“Orin”苹果愈伤组织由日本果树研究所的Takaya Moriguchi教授提供,已广泛应用于同行实验室[51那52].将‘Orin’苹果愈伤组织培养于含6-BA 0.4 mg/L、2,4- d 1.5 mg/L和3%蔗糖的MS培养基上,培养温度为25℃。苹果愈伤组织在黑暗中每隔3周进行继代培养。
具有从“GL-3”名为“GL-3”的“Royal Gala”中分离出高的再生能力的线路已被广泛应用于同伴实验室[53那54].我们声明,植物材料的收集符合机构、国家或国际准则。“GL-3”苹果培养苗由中国沈阳农业大学张志宏教授提供。GL3苹果培养苗在MS + 6-BA 0.5 mg/L、GA 0.1 mg/L培养基上培养3.在25℃,光照16 h,黑暗8 h条件下,0.2 mg/L NAA和3%蔗糖。采用山东农业大学实验站5年生‘GL-3’苹果树进行组织表达分析。为进行表达谱分析,分别用光、暗、NaCl、PEG和ABA处理1个月的苹果培养苗[55].在黑暗中预处理培养幼苗一天,其中一半用光处理(100μmol/ m2/ s),另一半用黑暗治疗。将培养幼苗在液体培养基中进行预处理一天,然后分别转移至含有150mmol / L NaCl,10%PEG6000和100μmol/ L aba的液体培养基。在治疗后,在0,1,3,6,12和24小时下进行整个幼苗以进行后续分析。每次治疗至少三种独立的生物重复进行。
拟南芥生态型Columbia-0 (Col-0)为野生型,来源于拟南芥生物资源中心(ABRC)。的CIP1.(Salk_070302)突变体由中国南开大学的清 - 邱龚教授提供,该教授最初从Abrc获得[29].的cop1-4突变体由中国上海师范大学杨洪泉教授提供[23].将表面灭菌的拟南芥种子播种在1/ 2ms + 1%蔗糖的培养基上。将种子在4°C的黑暗中保存3 d,然后转入22°C的16 h光期。
矢量建筑和植物转型
以‘GL-3’培养苗叶片为材料,克隆其编码序列MdCIP1和MDCOP1..Col-0幼苗的叶子用于克隆编码序列AtCOP1.得到转基因线,编码序列和反义片段MdCIP1或MdCOP1经SalI和BamHI双酶切插入pRI101载体根癌土壤杆菌菌株GV3101用于转化苹果疾病和拟南芥,以及35S :: MDCIP1-OX转基因拟南芥35 s:: MdCIP1-OX那35 s:: MdCIP1-anti和35 s:: MdCOP1-anti分别获得了转基因愈伤组织。拟南芥和苹果愈伤组织的转化方法参见[56那57].向量构造的引物显示在附加文件中1:表S.1.
RNA提取和QRT-PCR分析
采用RNA plant Plus Reagent Kit(中国CWBIO)提取植物材料总RNA,采用PrimeScript第一链cDNA合成试剂盒(日本Takara)进行反转录实验。qRT-PCR使用UltraSYBR混合物(CWBIO,中国),并在ABI Step One Plus系统(ABI,美国)上运行。Md18S用作参考基因。QRT-PCR程序在以下条件下进行(40个循环):95℃,持续15s和60℃。QRT-PCR测定法由三个独立的生物学和三种技术重复进行。2-ΔΔct采用相对转录本水平计算方法[58].具体的引物列在附加文件中1:表S1。
蛋白质序列比对及三维结构预测
蛋白质序列对准由DNAMAN软件进行。通过Phyre预测蛋白质3D结构2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index),利用Pymol程序v6.5.1得到复合材料。采用VMD软件v1.2.1计算均方根偏差(RMSD)值以反映匹配[59].基因组序列MdCIP1选择基因并从植物血红素V12.1下载(https://phytozome.jgi.doe.gov/pz/portal.html).
酵母双杂交(Y2H)试验
不同的截断部分MdCIP1通过EcoRI和BamHI双酶切与pGAD424 (AD)连接。不同的截断部分MDCOP1.通过EcoRI和BamHI双酶切与pGBT9 (BD)连接。不同的截断部分AtCOP1通过EcoRI和Sali双重消化连接到PGBT9(BD)。根据酵母转化系统2方案(CLONTECH)进行Y2H测定。使用乙酸锂方法将两种质粒共转化到Y 2 H株中并在28℃下培养。酵母在酵母选择性培养基中生长缺乏色氨酸和亮氨酸(-T / -L),然后缺少色氨酸,亮氨酸,组氨酸和腺嘌呤(-t / -1 / -h / -a)[60].引物显示在附加文件中1:表S1。
下拉试验
通过EcoRI和SalI双酶切将MdCOP1全长序列导入pET-32a (His)中。通过BamHI和SalI双酶切将MdCIP1的线圈结构域引入pGEX-4 T-1 (GST)中。重组质粒转化大肠杆菌BL21 (TransGen Biotech)分别表达His-MdCOP1和GST-MdCIP1 CC蛋白。按照Pierce™GST Spin纯化试剂盒(Thermo Fisher Scientific)的说明进行下拉实验。然后分别用抗his抗体和抗gst抗体进行western blot检测。
总花青素含量的测定
为积累花青素,在低氮(0.2 mmol/L硝态氮)培养基上培养15天,在17℃强光下添加UV-B,培养7 d。取约0.1 g的样品浸泡在1ml提取缓冲液(95%乙醇:1.5 M HCl = 85:15, v/v)中,室温下避光过夜。在530、620和650 nm波长下用分光光度计测定吸光度。ODλ= (530——一个620) - 0.1 (a650——一个620).花青素含量按OD值计算λ/ξλ× V/m × 106.(nmol×g−1鲜重;V:体积;m:重量;ξλ: 4.62 × 104.)[61].
测量下胚轴长度
拟南芥材料包括Col-0,CIP1.那cop1-4那MdCIP1-OX / cip1 # 1/2/3那MdCIP1-OX / cop1-4 # 1/2/3用来量化下胚轴的长度。种子在4℃的黑暗中保存3 d。将种子移栽于光下(16 h光/8 h暗)或暗条件下,在22℃下生长5 d。使用ImageJ软件测量下胚轴长度。每种材料大约有20个下胚轴被定量。实验进行了至少三个独立的生物重复。
苹果叶片的瞬时转化
转化35S::MdCIP1-OX (pRI101- mdcip1)、35S::MdCOP1-anti (pRI101- asmdcop1)和EV (pRI101)质粒根癌土壤杆菌应变GV3101。从20天的苹果培养苗上剪下的叶片进行培养农杆菌,真空吸2次20分钟。在低氮(0.2 mmol/L硝态氮)培养基中添加UV-B, 17℃,培养3 ~ 5 d。采集叶片进行基因表达分析和花青素含量测定[62].需要大约60个叶子所需的每个实验,并进行至少三种独立的生物重复。
可用性数据和材料
关于本研究的所有数据已包含在当前稿件或附加文件中的表格和/或图形中。Apple Genome数据库V1.0可用MDCIP1(MDP0000230486)和MDCOP1(MDP0000245133)序列(https://www.rosaceae.org/)[50];ATCIP1(AT5G41790)和ATCOP1(AT2G32950)序列可在Arabidopsis数据库中获得(https://www.arabidopsis.org/).
缩写
- COP1:
-
既定的photomorphogenic 1
- LAF1:
-
长后远红光1;
- HY5:
-
细长的下胚轴5
- HFR1:
-
在远红的长下胚轴1
- CIP:
-
COP1-interacting蛋白质
- 温泉:
-
抑制巴- 105
- WDL3:
-
Wave-dampened 2 3
- CSU2:
-
COP1抑制器2
- 朋友:
-
苯丙氨酸氨基丙氨酸
- Chi:
-
查耳酮异构酶
- CHS:
-
查耳酮合酶
- DFR:
-
Dihydroflavonol 4-reductase
- F3H:
-
黄烷酮3-羟化酶
- UFGT:
-
黄酮类化合物3-O-葡糖基转移酶
- 答:
-
花青素合成酶
- Y2H:
-
酵母双杂交
- 智能:
-
简单的模块化建筑研究工具
- ABRC:
-
拟南芥生物资源中心
参考文献
- 1。
王海英,邓晓文。高等植物光敏色素a依赖的信号网络解剖。植物生态学报,2003;
- 2.
焦颖,刘os,邓晓伟。高等植物的光调控转录网络。李文杰。2007;8(3):217-30。
- 3.
林俊杰。蓝光受体与信号转导。植物细胞。2002;14(增刊):S207-25。
- 4.
李杰,李克,王鹤,王德克。Phytochrome信号传导机制。拟南芥书。2011; 9:E0148。
- 5.
Rizzini L,Favory JJ,Cloix C,Faggionato D,O'Hara A,Kaiserli E,Baumeister R,Schäfere,Nagy F,Jenkins Gi,Ulm R.对拟南芥UVR8蛋白的UV-B对UV-B的感知。科学。2011; 332(6025):103-6。
- 6.
黄X,欧阳X,邓XW。除了对光膀胱的抑制之外:在光信号中的COP / DET / FU的角色切换。CurrOp植物BIOL。2014; 21:96-103。
- 7.
COP1/SPA E3泛素连接酶的调控植物生物学杂志。2018;45:18-25。
- 8.
苏利文,邓晓文。从种子到种子:光受体在拟南芥发育中的作用。Dev杂志。2003;260:289 - 97。
- 9.
关键词:光调控植物生长发育;Curr Top Dev Biol. 2010; 91:29-66。
- 10。
刘os,邓晓文。光形态形成抑制因子COP1和DET1: 20年后。植物科学,2012;
- 11.
易超,邓锡文。cop1 -从植物光形态建成到哺乳动物肿瘤形成。细胞生物学杂志。2005;15(11):618-25。
- 12.
Osterlund MT, Hardtke CS, Wei N, Deng XW。拟南芥光调控发育过程中HY5的靶向失稳大自然。2000;405(6785):462 - 6。
- 13.
SEO HS,Yang Jy,Ishikawa M,Bolle C,Ballesteros Ml,Chua NH。COP1的LAF1 ubiquitch控制光学发生并被SPA1刺激。自然。2003; 423(6943):995-9。
- 14.
杨·克,杨杰,SEO HS,Chua NH。HFR1是由COP1 E3连接酶的靶向,用于在Phytochrome期间的翻译后蛋白水解。基因开发。2005; 19(5):593-602。
- 15.
刘立,张YC,李Qh,桑义,毛泽东,连HL,王升,杨总。COP1介导的致癌症患者涉及在拟南芥中开花的密集色调调节。植物细胞。2008; 20(2):292-306。
- 16.
Khanna R,Li J,Tseng Ts,Schroeder Ji,Ehrhardt DW,Briggs WR。COP1共同调节气孔闭合所需的细胞骨骼过程和电生理学反应。莫尔植物。2014; 7(9):1441-54。
- 17.
Zoratti L,Karppinen K,Luengo Escobar A,HäggmanH,Jaakola L.轻控制的黄酮类生物合成在水果中。前植物SCI。2014; 5:534。
- 18.
关键词:拟南芥,低温,光信号,低温适应,低温调节美国国家科学院学报2011;108(39):16475-80。
- 19.
Cho Sk,Chaabane SB,Shah P,Poulsen CP,Yang SW。COP1 E3连接酶保护Hyl1保留microRNA生物发生。NAT Communce。2014; 5:5867。
- 20.
Kim JY, Jang IC, Seo HS。COP1通过其E3泛素连接酶的活性调节AtSIZ1的功能来调控非生物胁迫反应。植物科学与技术,2016;
- 21。
于永文,王杰,史宏,顾金堂,董建国,邓新文,黄荣发。盐胁迫和乙烯拮抗调控COP1核质分配,控制种子萌发。植物杂志。2016;170(4):2340 - 50。
- 22。
Deng XW, Matsui M, Wei N, Wagner D, Chu AM, Feldmann KA, Quail PH. COP1是一种拟南芥调控基因,编码一个同时具有锌结合基序和G β同源结构域的蛋白。细胞。1992;71(5):791 - 801。
- 23。
McNellis TW, von Arnim AG, Araki T, Komeda Y, Miséra S, Deng XW。一个cop1突变体的等位基因序列的遗传和分子分析表明多个蛋白质结构域的功能作用。植物细胞。1994;6(4):487 - 500。
- 24。
Matsui M,Stoop Cd,von Arnim Ag,Wei N,Deng XW。Arabidopsis COP1蛋白质特异性地与细胞骨架相关蛋白质CIP1的体外相互作用。Proc Natl Acad Sci U S A. 1995; 92(10):4239-43。
- 25.
Yamamoto YY,Matsui M,Ang LH,Deng XW。COP1交互蛋白在拟南芥中析出基因表达中的作用。植物细胞。1998; 10(7):1083-94。
- 26.
Torii Ku,Stoop-Myer CD,Okamoto H,Coleman Je,Matsui M,Deng XW。光致压抑制作用COP1的环形手指基序与新型拟拉拟南芥蛋白的环-H2基序相互作用。J Biol Chem。1999年; 274(39):27674-81。
- 27.
Yamamoto YY,DENG X,MATSUI M. CIP4,一种新的COP1靶标是拟南芥光学发生的核局部阳性调节因子。植物细胞。2001; 13(2):399-411。
- 28.
Harttke CS,Okamoto H,Stoop-Myer C,Deng XW。拟南芥COP1相互作用蛋白8(CIP8)的泛骨蛋白连接酶活性的生物化学证据。工厂J. 2002; 30(4):385-94。
- 29.
Ren C,Zhu X,张P,龚Q.拟南芥COP1 - 相互作用蛋白1是ABA反应的阳性调节因子。Biochem Biophys Res Communce。2016; 477(4):847-53。
- 30.
邓新文。识别与拟南芥COP1的WD40重复结构域特异相互作用的结构基序。EMBO j . 2001; 20(1 - 2): 118 - 27所示。
- 31.
赛jo Y, Sullivan JA, Wang H, Yang J, Shen Y, Rubio V, Ma L, Hoecker H, Deng XW。COP1-SPA1相互作用定义了光敏色素a介导的HY5活性调节的关键步骤。基因Dev。2003;17:2642-7。
- 32.
朱丹,Maier A, Lee JH, Laubinger S, Saijo Y, Wang H, Qu LJ, Hoecker U, Deng XW。拟南芥中包含组成型光形态形成因子1和抑制PHYA蛋白的复合物的生化特性。植物细胞。2008;20:2307-23。
- 33。
Sheerin DJ,Menon C,Zur Oven-Krockhaus S,Enderle B,Zhu L,Johnen P,Schleifenbaum F,Stierhof Yd,Huqe E,Hiltbrunner A.光激活的Phytochrome A和B与SPA系列互动以促进光学发生通过重组COP1 / SPA综合体进行拟南芥。植物细胞。2015; 27:189-201。
- 34。
徐丹,林芳,蒋勇,凌杰,Hettiarachchi C, Tellgren-Roth C, Holm M,魏宁,邓晓伟。拟南芥COP1 SUPPRESSOR 2通过其卷曲-卷曲结构域结合抑制COP1 E3泛素连接酶活性。公共科学图书馆麝猫。2015;11 (12):e1005747。
- 35。
关键词:拟南芥,下胚轴,光调控,蛋白酶体降解,微管调节蛋白植物细胞。2013;25(5):1740 - 55。
- 36。
李楠,刘X,王X,周y,李h,李杰,毛泽东cop1介导微管相关蛋白Wdl3的暗特异性降解调节拟南芥缺口伸长率。Proc Natl Acad Sci U S A. 2017; 114(46):12321-6。
- 37.
水果和蔬菜中花青素的发生、分析及其在人体营养中的作用。蔬菜作物研究。2008;68:5-22。
- 38.
果实中花青素生物合成调控的新见解。植物科学,2013;
- 39.
Hichri I, Barrieu F, Bogs J, Kappel C, Delrot S, Lauvergeat V.近年来黄酮类化合物生物合成途径的转录调控研究进展。实验机器人。2011;62:2465-83。
- 40.
苹果果实中花青素的生物合成。Hortic j . 2018; 87:305-14。
- 41.
艾伦AC,海伦斯RP, WA。给水果着色的MYB转录因子。植物科学,2008;13:99-102。
- 42.
光诱导MYB基因表达调控红苹果花青素合成。植物杂志。2006;142:1216-32。
- 43.
苹果果实的红色是由MYB转录因子MdMYB10的活性引起的。植物j . 2007; 49:414-27。
- 44.
王XF,jp,liu x,su l,你cx,hao yj。硝酸盐响应蛋白MDBT2通过与MDMYB1转录因子相互作用来调节花青素生物合成。植物理性。2018; 178:890-906。
- 45。
安建平,姚建峰,徐荣荣,尤春霞,王新飞,郝永杰。苹果bZIP转录因子MdbZIP44调控脱落酸促进的花青素生物合成。植物细胞环境。2018;41:2678-92。
- 46。
安建平,张新文,尤春霞,毕淑琴,王新飞,郝元杰。MdWRKY40促进损伤诱导的花青素合成,与MdMYB1相关,并经历mdbt2介导的降解。新植醇。2019;224:380 - 95。
- 47。
安建平,刘永杰,张新文,毕淑琴,王新飞,尤春霞,郝永杰。不同光强下BT2-TCP46-MYB1模块对苹果花青素合成的动态调控机器人学报。2010;30(10):1394 - 1399。
- 48。
jp,王xf,hao yj。BTB / TAZ蛋白MDBT2集成了多种激素和环境信号,以调节苹果中的花青素生物合成。J Intent Plant Biol。2020; 62(11):1643-6。
- 49.
安建平,张新文,毕淑琴,尤春霞,王新飞,郝元杰。ERF转录因子MdERF38促进干旱胁迫诱导的苹果花青素合成。植物j . 2020; 101:573 - 89。
- 50.
李莹莹,毛凯,赵超,赵学勇,张海林,舒海瑞,郝永杰。在苹果中,MdCOP1泛素E3连接酶与MdMYB1相互作用,调节光诱导的花青素生物合成和红色果实着色。植物杂志。2012;160(2):1011 - 22所示。
- 51.
Hao YJ,Kitashiba H,Honda C,Nada K,Moriguchi T.精氨酸脱羧酶和鸟氨酸脱羧酶基因在苹果细胞中的表达和胁迫芽。J Exp Bot。2005; 56(414):1105-15。
- 52.
康辉,张廷涛,付丽丽,尤翠霞,王新飞,郝永杰。苹果环- h2蛋白MdCIP8通过与MdCOP1相互作用调节花青素积累和下胚轴伸长。植物科学。2020;301:110665。
- 53.
戴H,李W,韩克,杨y,ma y,李h,张z.苹果苹果农杆菌高再生能力和易感性的幼苗克隆的发展。SCI Hortic。2013; 164:202-8。
- 54.
耿东林,陈晓萍,沈旭兴,张勇,李晓伟,蒋丽娟,谢玉平,牛庆平,张杰,黄晓红,马富伟,管庆民。MdMYB88和MdMYB124通过调节根导管和细胞壁来增强苹果的抗旱性。植物杂志。2018;178(3):1296 - 309。
- 55.
张友,张克,王格,王y,齐ch,赵q,你cx,li yy,hao yj。R2R3 MYB转录因子MDMYB30通过调节切割蜡生物合成来调节植物抵抗病原体。BMC植物BIOL。2019; 19(1):362。
- 56.
阵伤SJ,弯曲AF。花卉浸:农杆菌介导的拟南芥转化的简化方法。工厂J. 1998; 16(6):735-43。
- 57.
谢晓波,李松,张瑞芳,赵杰,陈永昌,赵青,郝永杰。bHLH转录因子MdbHLH3促进苹果花青素的合成和果实在低温下的着色。植物细胞环境。2012;35(11):1884-97。
- 58。
张春林,毛凯,周丽娟,王国良,张云龙,李云英,郝永杰。苹果长链酰基辅酶a合成酶的全基因组鉴定及不同胁迫下的表达分析。植物生理学报,2018;
- 59。
齐Ch,江H,赵XY,毛泽东,刘HT,李伊,郝yj。Malus Domestica中Mdcer家族的表征,认证和基因表达模式。园艺植物杂志(HPJ)。2018; 5(1):1-9。
- 60。
任yr,杨yy,张r,你cx,赵q,郝yj。MDGRF11,苹果14-3-3蛋白,充当干旱和耐盐性的正调节剂。植物SCI。2019; 288:110219。
- 61。
李HS,柳条L.荔枝果实皮中的花青素色素。食品科学,1991;56:466-8。
- 62.
安建平,王新峰,张新文,徐海峰,毕淑琴,尤春霞,郝永杰。一个苹果MYB转录因子调节耐寒性和花青素生物合成,并经历miel1介导的降解。植物营养与肥料学报;2010;
确认
我们感谢中国南开大学的龚庆秋教授提供的CIP1.突变体。我们感谢中国上海师范大学的洪泉教授,为提供cop1-4突变体。我们感谢中国沈阳农业大学张志宏教授提供的“GL3”苹果栽培苗。我们感谢日本果树科学国家研究所的Takaya Moriguchi教授提供“Orin”苹果愈伤组织。
资金
山东省自然科学基金项目(no . ZR2018MC021, no . J18KA174);国家自然科学基金项目(no . U1706202);农业部作物遗传与种质创新国家重点实验室开放基金项目(no . ZW202008);国家重点研发计划(2018YFD1000200)。资助者在构思、设计或实施该项目中没有任何角色。
作者信息
从属关系
贡献
YJH, XFW, HK设计研究,分析数据,撰写稿件。HK、TTZ和LLF进行了实验。YXY和CXY提供了技术援助。所有作者均已阅读并批准稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
本研究中使用的引物。
附加文件2:表S1-4。
本研究中呈列的缺核长度和花青素含量的数据。
额外的文件3。
MdCIP1、MdCOP1、AtCIP1、AtCOP1的编码及蛋白序列。
额外的文件4。
本研究中呈现的原始凝胶/污染图像。
附加文件5:图S1。
MdCIP1和AtCIP1的蛋白结构比较。图S2。识别的MdCIP1-OX / cip1拟南芥幼苗的DNA水平。图S3。在体外下拉实验中,MdCIP1的线圈区与MdCOP1相互作用。图。S4。MdCIP1与AtCOP1相互作用。图S5。识别的MdCIP1-OX / cop1-4拟南芥幼苗的DNA水平。图S6。MdCIP1-OX / cop1-4介绍了cop1-4成体阶段的表型。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
康浩,张廷德。傅,你。等等。苹果mdcop1互作蛋白1负调控下胚轴伸长和花青素合成。BMC植物杂志21,15(2021)。https://doi.org/10.1186/s12870-020-02789-3
收到了:
公认:
发表:
关键词
- CIP1.
- COP1
- 苹果
- 下丘脑
- 花青素