摘要
背景
NAC转录因子(TFs)是由一个大基因家族编码的植物特异性蛋白。它们在植物生长发育、叶片衰老以及对生物或非生物胁迫的响应等多种生物过程中发挥着重要作用。一些NAC转录因子的功能已被鉴定主要在模式植物。然而,在猕猴桃果树上对NAC转录因子的研究还很少。
结果
全基因组n鉴定了基因,分析了它们的系统发育、基因组结构、染色体位置、共连关系、蛋白质特性和保守基序。此外,还对猕猴桃新品种的果实发育过程进行了评价猕猴桃eriantha“Ganlu 1”。以及所有这些的表达方式n采用实时荧光定量PCR方法对甘露1号果实发育过程中的基因进行分析。共鉴定142个NAC转录因子,系统发育分为23个蛋白亚家族。它们的基因组结构n基因表明它们的外显子在1到10之间。对染色体位置的分析表明,在142个染色体中有116个nS分布在所有29个猕猴桃染色体上。此外,基因组基因表达分析显示,142中的125例表达n可以在水果样品中检测基因。
结论
我们的全面研究提供了关于n猕猴桃果实的基因及其表达模式。本研究可为今后的功能识别提供参考n涉及猕猴桃果实发育的基因。
背景
猕猴桃属于猕猴桃,这是一种含有50多种物种的大型属,中国是猕猴桃的原始中心[1].Kiwifruit的果实被称为“果实之王”,因为其具有显着高的维生素C含量和富含人类健康的营养矿物质。通过拓扑资源的驯化和选择,已经开发了许多猕猴桃品种,所以猕猴桃已成为世界各地种植最广泛种植的果树之一[2那3.那4.].猕猴桃物种是雌雄植物,它们从雌花的卵巢由几个心皮形成。他们的新鲜浆果通常含有很多种子[5.],这有助于在复杂环境下成功繁殖。Kiwifruit Berry Fruit的发展从施肥开始,直到种子成熟[6.].据报道,在果实发育过程中答:对'Hort16a',果实形态,生长和发展的许多方面与番茄(Solanum lycopersicum.)的果实,除了在果实成熟过程中延缓自催化乙烯的产生,当果实开始衰老[6.那7.].
在大多数情况下,基因结构可以与表达分析相结合,以洞察基因功能预测。通常,结构相近的基因具有相似的功能,识别基因家族是基因功能检测的有效途径。然而,到目前为止,在猕猴桃基因组中发现的基因家族很少。值得注意的是,基因组序列答:对“红羊”基因组项目完成后即可上线[3.].转录因子(TFS)是一类蛋白质,其通过结合调节靶基因的时间和/或空间表达独联体- 他们的启动子地区的再调节元素[8.].植物TFs,包括AP2、bHLH、ARF、MYC、WRKY和NAC,是许多生物过程中必不可少的调节因子[9.那10那11那12那13].在那些TFS中,NACS在植物中的不同发展过程中起重要作用,例如植物生长,侧根形成,叶片衰老和果实成熟和软化[14那15那16那17].
NAC蛋白家族是植物中最大的TF家族之一。典型的NAC蛋白在其n端包含一个保守的NAC结构域,该结构域由大约150个氨基酸组成,在c端有一个高度可变的转录调控区域[18那19].自1996年首次报道NAC蛋白以来[20.] NAC蛋白质家族已在几种植物物种中鉴定,例如拟南芥蒂利亚纳[19], 白饭 [21],杨树[22],葡萄藤[23和亚洲梨[24].此外,功能有若干n基因已在模型植物中被发现。过度表达AtATAF1,一个n基因的答:芥,增强植物对干旱胁迫的耐受性[25].OverexpressingOsNAC10提高水稻抗旱性和产量[26].PopNAC122杨树通过减少细胞大小和细胞数量来降低株高生长[27].NAC蛋白除了在逆境响应和植物生长中起调节作用外,还在果实发育中起重要的调控作用。在番茄中,SlNAC4和NOR-like 1的NAC TFs已被鉴定为番茄果实成熟的阳性调控因子[17那28].和番茄SLNAC1.基因可以通过乙烯依赖和脱落酸依赖途径改变果实色素沉着和软化[16].草莓(Fragaria chiloensis.), FcNAC1蛋白通过调节果胶代谢参与水果软化[29].和黄瓜(Cucumis sativus),12n基因被确定为13个微rna的靶标,它们参与了果实发育[30.].
尽管NAC TFS在压力响应和发育过程中发挥潜在作用,但最多的特定功能n目前对猕猴桃的基因研究还很缺乏,尤其是对猕猴桃的基因研究。到目前为止,还没有系统的分析n在猕猴桃中进行了基因家族研究。在本研究中,NAC蛋白的全基因组鉴定进行了基因组答:对“弘扬”。并对系统发育、基因结构、染色体定位和蛋白质特性进行了全面的研究。此外,还对猕猴桃新品种的果实发育过程进行了评价答:eriantha“Ganlu 1”。以及所有这些确定的相对表达n在其发育阶段的“GaNLU 1”的果实中,通过定量实时PCR(QRT-PCR)方法研究了基因。我们的结果对于Kiwifruit的克隆和功能识别是有价值的n基因。表达的分析数据将提供揭示NAC TFS对Kiwifruit果实生长和发育的调节机制的基本信息。
结果
水果开发答:eriantha“Ganlu 1”
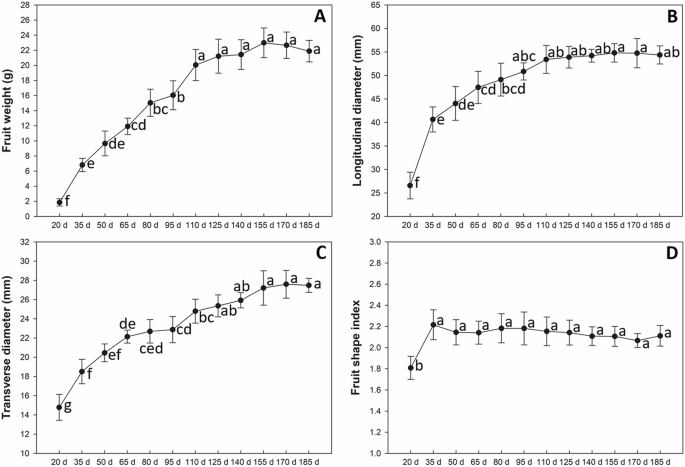
如图1所示。1甘露1号果实开花后20天至185天发育过程中,不同阶段果实外观变化明显。果实大小在发育早期(20 DAF ~ 35 DAF)迅速增加。从50天起及以后观察了果皮内的种子。在这个过程中,种子的颜色由黄色(50 DAF),到红棕色(80 DAF),再到黑色(110 DAF)。1).
此外,分析了果实,纵向直径,横向直径和果实形状指数。果子重量在20个DAF至110 DAF的发育期间迅速增加(图。2a).果实纵径在发育早期(20 ~ 35 DAF)快速增加,然后缓慢增加(35 ~ 110 DAF),在发育后期(110 ~ 185 DAF)趋于稳定(图5)。2b)果实横径的变化趋势与纵径不同。果实横径在20 ~ 65龄期呈快速增长趋势,在95 ~ 125龄期出现第二个生长高峰(图1)。2C)。然而,果实形状指数的值显着增加到20至35个DAF,然后它们保持相同直至185个DAF(图。2d)。
猕猴桃NAC转录因子及其序列特征
我们发现总共有142个n基因组中的基因答:对'宏阳',他们被指定为ACNAC001.来AcNAC142,根据猕猴桃基因组数据库(http://kiwifruitgenome.org/)(额外的文件1).我们的分析证实,每个被鉴定的AcNAC蛋白都包含一个NAM结构域(PF02365.15),这是NAC TF蛋白家族的一个特定的保守结构域(附加文件2).此外,这些AcNAC蛋白也表现出序列相似性拟南芥NAC蛋白质(附加文件3.).
它们的编码序列(CDS)长度AcNAC基因在438 ~ 1962 bp之间。这些AcNAC蛋白含有145 - 653个氨基酸,平均328个氨基酸(附加文件)4.).分子量为15,926.35至74,381.42Da,平均值为37,227.39Da。这些NAC蛋白的预测等电点为4.39至10.24(附加文件4.).
NAC蛋白的系统发育关系
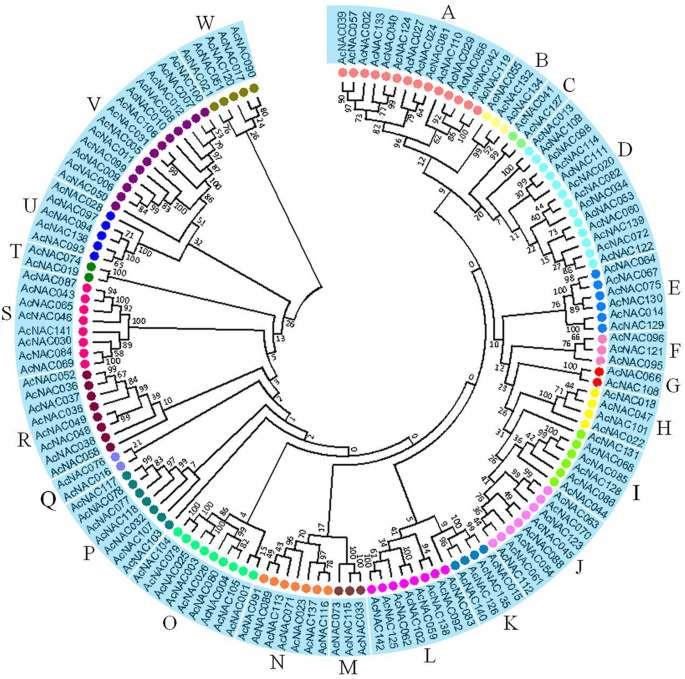
根据猕猴桃NAC蛋白的无根系统发育树,我们可以将猕猴桃NAC蛋白家族划分为23个亚家族。为简便起见,这些亚科按字母顺序排列为A ~ W(图1)。3.).其中亚科、亚科包括14 AcNACs成员,紧随其后的是13日在亚D和V, 9 O, 8日在J L R和S, 7 N和P, E 6和我,5 U和W, 4 H和K, 3 B, F和m .然而,亚科的C、G, Q和T每个只包含两个NAC成员(无花果。3.).
此外,研究NAC蛋白的系统发育关系来自猕猴桃和拟南芥,使用猕猴桃的所有NAC蛋白质序列和那样构建系统发育树以及拟南芥.系统发育树表明猕猴桃的NAC蛋白和拟南芥可以分为26个亚属,将其指定为亚家族A到Z(附加文件5.).在大多数情况下,来自两个系统发育树的相同亚壳(图。3.和额外的文件5.)中含有相同的成员(如A、C、E、F、G、H、I、J、K、L、M、N、O、Q、S、T、U和V亚科)。3.)在猕猴桃和猕猴桃NACs构建的系统发育树中聚类为B亚科拟南芥(附加文件5.).AcNAC058、AcNAC090、AcNAC103和AcNAC139的病例相似。3.额外的文件5.).以上四种NAC蛋白与之相应拟南芥nac形成X, Y, Z新子族(附加文件5.).此外,F亚科、I亚科、R亚科和V亚科成员均来自猕猴桃;相反,其他22个亚科的NAC成员来自猕猴桃和拟南芥(附加文件5.).这些结果可能表明猕猴桃中NAC成员在这四个亚科中的特殊功能。
基因组长度,基因结构和保守的蛋白质基序
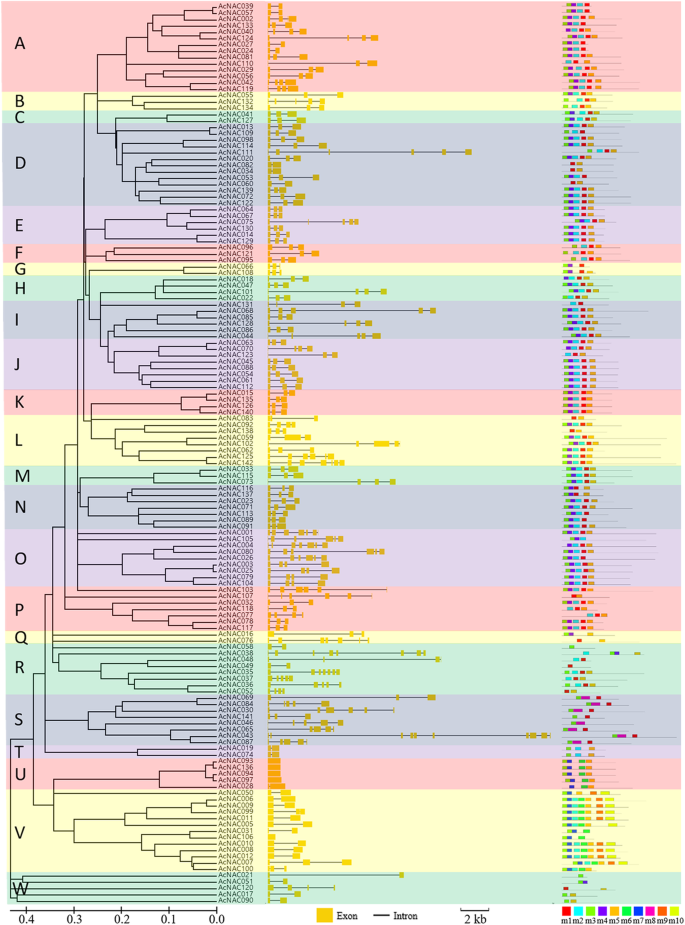
其中142AcNAC基因组织,基因组结构非常不同。出口数量,67AcNACS包含3个外显子(47.2%),25个外显子(14.6%),19个外显子(13.4%),11个外显子(7.7%),8个外显子(5.6%),5个外显子(3.5%),其余5个外显子n基因(3.5%)AcNAC093那AcNAC136那AcNAC094那AcNAC097和AcNAC106每个人只有一个外显子,没有含有任何内含子。除了,ACNAC038.包含8个外显子(0.7%)AcNA043含有10个外显子和9个内含子(0.7%)(图。4.额外的文件6.).所有这些AcNAC,平均外显子数为3.4,内含子数为2.4。4.).
这些核酸碱基的长度AcNAC基因也很大,它们的基因组长度在555bp和20,432bp之间,平均基因组长度为3592.3bp(图。4.额外的文件6.).
对于那些142 NAC蛋白,通过使用MEME模型检测10个保守的基序(图。4.额外的文件7.).所有这些NAC蛋白都包含至少一个保守基序。这些基序分布在大多数NAC蛋白质的n端。一般而言,同一亚科内的近缘nac具有相似的基序组成。在AcNAC蛋白家族中,142个成员中有120个包含motif 3,这是其保守结构域的标志。
染色体地点和联合关系AcNAC基因
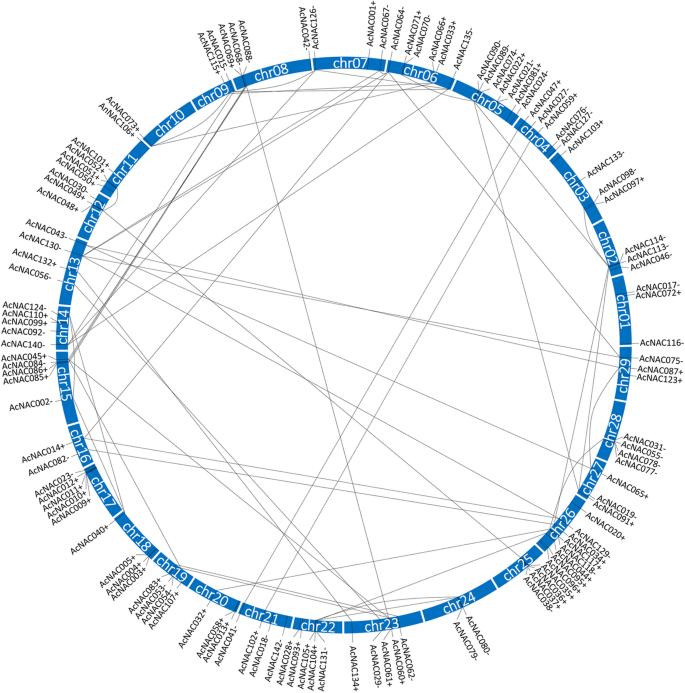
这142个染色体中有116个染色体位置AcNAC从Kiwifruit基因组数据库中获得基因(附加文件8.).116年AcNACS分布在29条猕猴桃染色体上。这种分布既不相等也不随机。它们的方向是正向(+链)或反向(−链)。的数量AcNAC每个单独的CHR的基因为1(CHR10)至8(CHR26)和平均数AcNAC一个CHR的基因为4(图。5.).
用于分配AcNAC这些染色体上的基因,在116个染色体中有62个AcNAC53.4%的基因分布在正向链(+链)上,116个基因中有54个分布在正向链(+链)上AcNAC分布在反向链( - 股)上的基因(46.6%)(图。5.额外的文件8.).但是,其余26的染色体位置信息AcNAC这些基因无法从猕猴桃基因组数据库中获得。
此外,根据复制的块在答:对鉴定‘红羊’基因组,共时关系的基因对49对。5.),其基因组块信息显示在附加文件中9..
的表达模式n果实发育过程中的基因
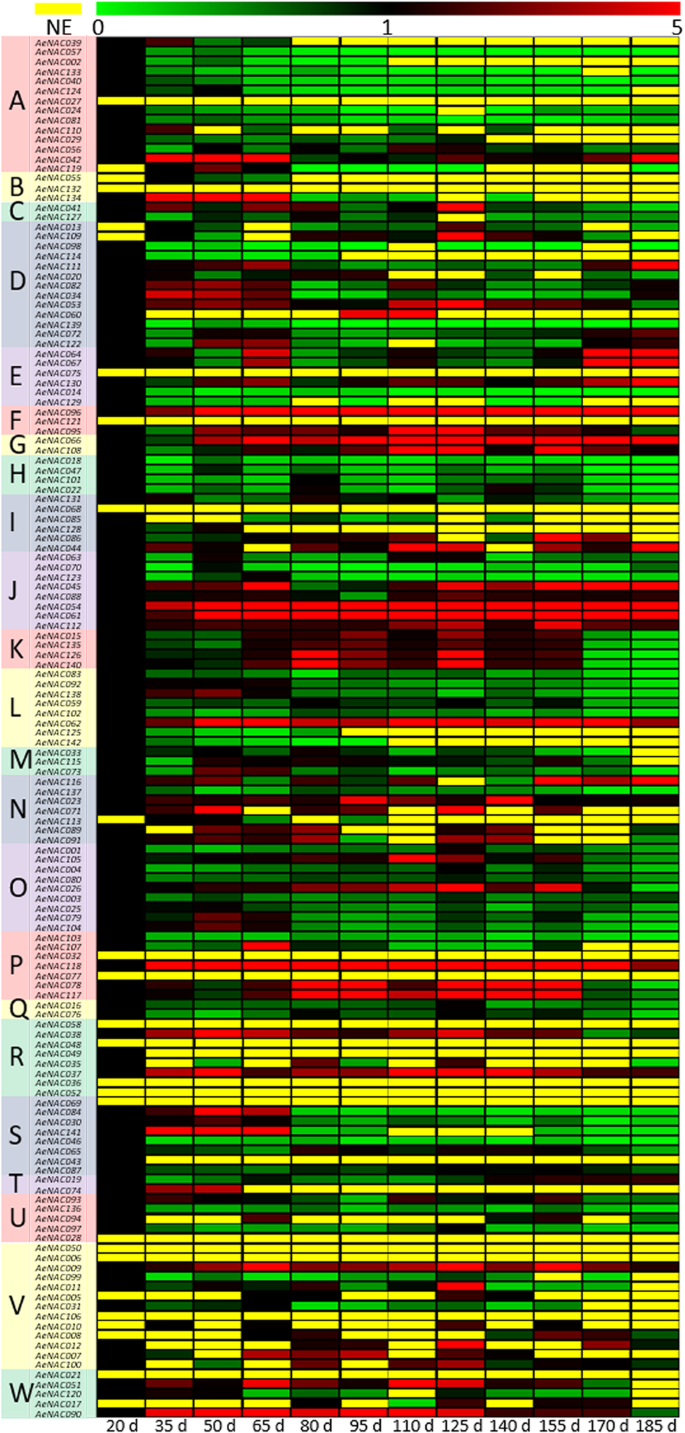
所有这142的相对表达水平n采用qRT-PCR方法对不同发育阶段果实的基因进行分析。相应基因的表达水平AcNACs(ACNAC001.来AcNAC142) 在答:eriantha“Ganlu 1”(AENAC001.来AeNAC142)进行了分析。142的表达模式数据AeNAC基因在附加文件中显示10.在这些基因中,有74个n在整个发育过程中坚持在水果中表达,51岁AeNACS在某些发育阶段的部分水果样品中表达。但是,表达为17AeNAC果实各阶段均未检测到相关基因答:eriantha甘露1号在整个发育过程中(图1。6.额外的文件10).
在74AeNAC在所有水果样品中表达的基因,表达模式也很大。与对照(20 DAF)相比,28AeNACS在某些阶段显示下调模式,9AeNACS在某些阶段表现出上调的模式。此外,28AeNACS在某些阶段表现为下调或上调。此外,6AeNACs(Aenac037.那AENAC054.那AENAC061那AeNAC062那AeNAC096和AeNAC118)与对照相比,在发育过程中表现出所有水果样品中的更高表达水平。相反,4AeNACs(AENAC014那AeNAC046那AeNAC103和AeNAC139)与对照相比,在每个阶段显示表达水平降低。有趣的是,只有一个的表达水平AeNAC的基因,AeNAC087,在整个果实发育过程中没有改变(图。6.额外的文件10).在这些不同的亚家族中,所有来自H亚家族(AENAC018那AeNAC047那AeNAC102, 和AENAC022)表达表达趋势降低,这些结果可能表明其在水果发育中的相似和负面作用。但是,在Subfamilies J或O中,一些成员显示出显着的不同表达特征,这也提出了n结构相似的基因可能功能不同。总之,那些积极或消极的关系之间n表达和水果开发可能表明他们可能的角色在调节猕猴桃的水果开发方面,尽管它们可能以复杂和多样化的方式行事。
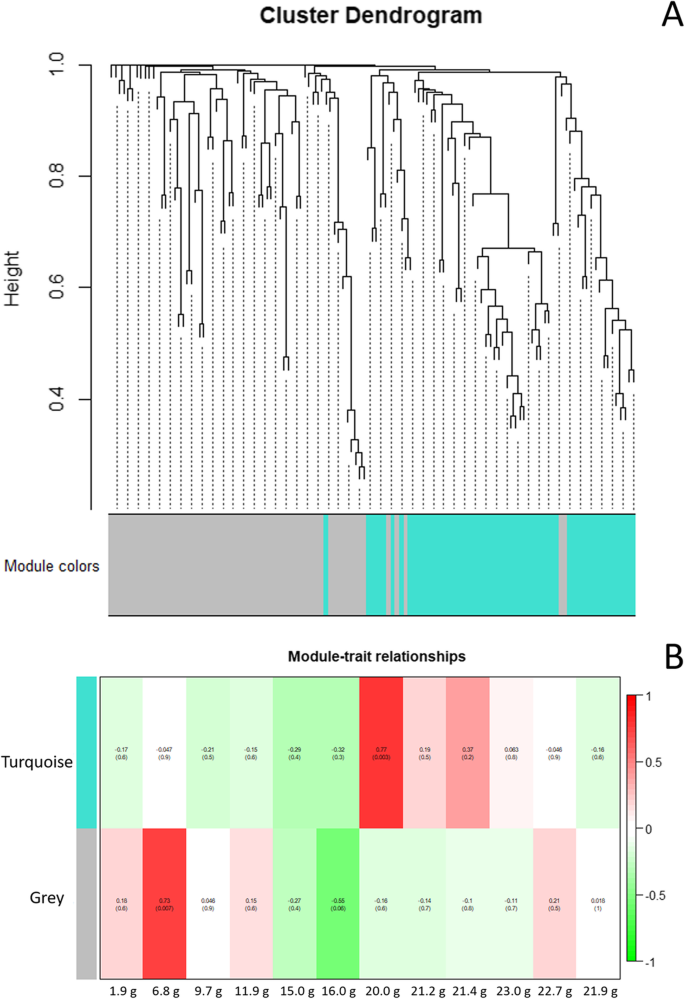
加权基因共表达网络分析(WGCNA)显示,142个基因中分别鉴定出两个模块(绿松石色和灰色)AeNAC基因(图。7.一种)。模块 - 特质关系表明,模块绿松石与中间和晚果发育阶段相关,模块灰色主要与早期发育阶段相关(图。7.b)。此外,网络关系n模块绿松石和模块灰色中识别的基因显示在附加文件中11和额外的文件12,分别。
讨论
高等植物果实发育是一个复杂的过程,受到多种生物学和分子机制的控制,并受环境因素的影响[31].了解与果实发育和成熟相关的调控途径对提高果实品质具有重要意义。转录调控是控制果实发育和成熟的有效途径。在这些多个TF基因中,有很多n基因在调节果实发育中起着重要的作用。例如,在番茄中,SLNAC033.和SlNAC064通过调节乙烯生物合成和细胞壁代谢相关基因的调节表达进行控制果实发展[17那28].值得注意的是,很少有人知道的监管角色n基韦特水果开发的基因。
NAC蛋白质是一个大型植物特异性TF家族。自NAC的第一个报告以来[20.],许多研究已经在不同植物物种中的NAC家族进行。例如,已识别出105种NAC蛋白拟南芥[19,大米140元[21, 163杨树[22], 74 in葡萄藤[23]和185年在亚洲梨[24].大量的n不同植物物种的基因表明,它们可能在进化过程中广泛扩展。迄今为止,还没有对猕猴桃基因组中NAC家族的系统研究。本研究基于猕猴桃的全基因组数据,共鉴定了142个猕猴桃NAC蛋白。这些NAC蛋白聚类成23个亚家族。值得注意的是,F、I、R和V四个亚科的NAC成员都来自猕猴桃(附加文件5.),表明这些基因可能有不同的祖先拟南芥在进化过程中。有趣的是,也发现了类似的案件n番茄基因家族[32].因此,我们推测这些猕猴桃特有n基因在猕猴桃植物中可能起着特殊的作用。
在本研究中,每个AcNAC蛋白都包含一个保守的NAM结构域(PF02365.15),这是NAC TF蛋白的一个特异性特征[18].通过分析染色体位置AcNAC基因,我们发现了116个AcNACS分布在所有29个猕猴桃上。其中,一些AcNAC基因在某些chrs上显示出“聚集”分布模式,例如,AcNAC085那AcNAC086那AcNAC084Chr15,ACNAC009.那ACNAC010那ACNAC011那ACNAC012Chr17,ACNAC035.那ACNAC036.那ACNAC037.那ACNAC038.Chr25(无花果。5.).值得注意的是,大多数n同一“基因簇”内的基因属于同一亚科,它们具有相似的长度和基因组结构,以及相同的保守基序(图1)。3.,无花果。4.).值得一提的是,在苹果和番茄中,相同chr上的许多相邻相关基因(基因簇)也表现出相似的结构。据报道,它们是由串联复制事件产生的,这是全基因组复制的结果[33那34].类似地,在猕猴桃基因组的进化过程中,NBS-LRR基因的分布表明,串联复制事件也发生了[3.].此外,大量的谬误n从基因组块中提取的基因对表明,基因组进化过程中也发生了片段复制事件。因此,我们假设n基因可以部分由串联重复和在猕猴桃基因组的进化过程中的串联复制和节段性重复事件引起的,这也可能对猕猴桃基因组中其他基因的扩展产生重要影响。
确认n封闭基因涉及水果发育,所有这些142的基因组表达n在新的猕猴桃栽培品种的发育果实中检查了基因答:eriantha“Ganlu 1”。特别是三n的基因,AENAC054.那AENAC061, 和AeNAC118在果实发育过程中表现出结构性高表达水平。此外,这些n通过使用WGCNA也将基因鉴定为轮毂基因。总体而言,水果发育与相关的基因表达之间的阳性相关性n基因可能表明了猕猴桃生长和发展中的潜在监管作用。此外,据报道,一些NAC蛋白涉及果实发展以及植物生长。被证明是SLNAC4和NOR-LICE 1是番茄中成熟的果实正常调节剂[17那28].在香蕉(穆萨acuminata),提出了四种NAC蛋白(MANAC016,MANAC083,MANAC094和MANAC095)在基于基因表达分析的纸浆熟练过程中起作用[35].FCNAC1参与草莓(Fragaria chiloensis.通过激活)FcPL,这参与了水果细胞壁改造[36].拟南芥NAC.基因的AtNAP和JUB1积极调节水果衰老和植物长寿[37那38].此外,在木本植物苹果(Malus Domestica.)和杨树(Populus Trichocarpa.),两个n的基因,MdNAC1和PopNAC122,被报道减少过表达转基因植物的生长[27那39].尽管如此,进一步了解更多遗传证据n猕猴桃生长发育的基因。
方法
植物材料和果实发育
果树的答:eriantha“Ganlu 1”被邦新县猕猴桃研究所(28°70'n,115°38'e),江西省,中国江西省的种质资源托儿所种植。在发育过程中分别在20,35,50,65,80,95,110,125,140,110,110,125,140,110,1170和185个DAF上收集水果样品(图。1).将无种子的外果皮切成薄片,在液氮中快速冷冻,在−80°C保存至使用。
为了评估在发育过程中,测量在每个阶段收集的水果的纵向直径和横向直径。为每个实验测量至少8个果实。通过单向ANOV和TUKEY的多个比较测试评估数据(P. < 0.05) using SPSS Statistics software (version 20).
基因组 - NAC蛋白质家族的范围鉴定
基因组序列数据答:对'Hongyang'从Kiwifruit Genome数据库下载[3.它们用于识别NAC TF蛋白家族的成员。首先,我们通过BioEdit软件进行了本地BLASTP程序搜索[42]针对使用105的Kiwifruit的所有这些基因组蛋白序列拟南芥NAC蛋白序列(附加文件3.)从中下载拟南芥资讯资源网站(https://www.arabidopsis.org/)作为期望值(E-value) < 1.0的查询。其次,预测的NAC蛋白序列答:对也从植物转录因子数据库(http://planttfdb.cbi.pku.edu.cn/),收集猕猴桃中完整的候选NAC蛋白。采用上述两种方法收集的候选材料进行进一步鉴定。采取了三个步骤来核实所有这些候选人。首先,pam 32.0数据库的隐马尔可夫模型(HMMs) (http://pfam.xfam.org/)用于鉴定E值<1.0下的每种蛋白质序列的NAM结构域(PF02365.15)[43].第二,国家生物技术信息中心保守域名(https://blast.ncbi.nlm.nih.gov/还剥削了确认所有已识别的序列的NAM结构域的存在[44].排除了不含NAM结构域或具有其他蛋白家族的模糊结构域的蛋白序列。第三,我们仔细检查了所有这些候选序列,并手工排除了长度小于130个氨基酸的蛋白质序列。最后,这些剩余的蛋白序列被认为是NAC TFs答:对(acnac),并用于后续评估。
采用LaserGene软件(version 7.1)分析AcNAC蛋白的预测等电点和分子量。采用DNAMAN软件(6.0版)对AcNAC蛋白及其相应相似序列进行多序列比对分析拟南芥.
Kiwifruit NAC蛋白的系统发育分析
为了分析AcNAC蛋白的系统发育关系,我们使用默认参数的MUSCLE方法对这些AcNAC蛋白进行了多次序列比对[45].使用MEGA软件(版本5.05),采用邻居连接方法构建无根系统发育树,共引导重复1000次[46].应用上述方法构建了猕猴桃NAC蛋白的系统发育树拟南芥.
蛋白质结构与保守基序分析
关于基因组染色体位置和每个CD的信息AcNAC基因从Kiwifruit Genome数据库下载。每个人的基因组长度和内含子/外显子组织AcNAC基因结构显示服务器(版本2.0)显示基因(http://gsds.cbi.pku.edu.cn/)[47].基因组长度和外显子的细节AcNAC基因(ACNAC001.来AcNAC142)载于附加档案6..
利用在线模因工具(版本5.1.1;http://meme-suite.org/).每个序列使用零或一次出现,motif宽度设置在19到50个残基之间。
染色体分布分析和基因同步分析
的相对位置AcNAC并分析了不同CHRS的基因及其染色体方向(+链或-链)。详细信息见附加文件8..
探讨共时关系n基因组中的基因答:对‘红阳’,信息成对同源n具有常见基因组嵌段的基因是从Kiwifruit基因组数据库中获得的,并用于显示联合症关系n基因。详细信息见附加文件9..
全基因组表达分析n发育果实基因及其基因共表达网络分析
使用RNA分离试剂盒(华月阳,北京,中国)提取冷冻水果样品的总RNA,一步是用DNase i去除基因组DNA。大连,中国)。
澄清表达式模式n发育果实中的基因答:eriantha'ganlu 1',所有那些142的相对表达式AeNAC采用LightCycler 480实时荧光定量PCR (Applied Biosystems, Waltham, MA, USA)对基因进行qRT-PCR分析。采用特异性引物进行qRT-PCR分析AcNAC序列为模板(附加文件13).结果用2——ΔΔCT方法 [48].的猕猴桃肌动蛋白基因(GenBank登录号:FG515334.1)(附加文件13)作为内标,对cDNA样本进行标准化。每个试验设3个重复。
为了直观地描述表达结果,与对照(检测到表达的第一天,主要是20 DAF)相比,> 2.0或< 0.5的相对表达量分别被指定为增加或减少表达量。同时,当相对表达量的fold change在0.5 ~ 2.0之间时,这些表达结果被定义为不变。
此外,确定所有这些之间的相关性AeNAC使用平均相对表达量数据(附加文件10)。n带有R包的基因[49].按照前面的方法获取模块及其对应的基因网络数据[44这些数据被用于识别枢纽基因。并进行了模块-发育性状关联分析[50].用于WGCNA的关键R脚本参数(最佳beta值和共表达式矩阵)显示在附加文件中14.
可用性数据和材料
支持本文结论的数据集可从Kiwifruit Genome数据库,拟南芥信息资源站点,GenBank数据库中在线提供,或者包含在文章中的其他文件中。
缩写
- cd:
-
编码序列
- CHR:
-
染色体
- 唔:
-
隐藏的马尔可夫模型
- NE:
-
没有表达
- QRT-PCR:
-
定量实时聚合酶链反应
- TF:
-
转录因子
- WGCNA:
-
加权基因共表达网络分析
参考文献
- 1.
弗格森·艾尔,黄鹤培遗传资源:驯化和繁殖。正确答案:Janick J,编辑。园艺的评论。霍博肯:Wiley;2007年。
- 2.
Laing WA, Bulley S, Wright M, Cooney J, Jensen D, Barraclough D, MacRae E.一种高度特异性的l -半乳糖-1-磷酸磷酸酶在抗坏血酸生物合成途径上。美国国家科学院学报2004;101:16976-81。
- 3.
邓黄年代,丁J, D,唐W,太阳H,刘D, L,牛X, X,孟M, Yu J,刘J,汉族Y, W,张D,曹年代,魏Z,崔Y,夏Y,曾庆红H,保K, L,最小值Y,张H,苗族M,唐X, Y朱,隋Y,李G,太阳H,曰J,太阳J,刘F,周L, Lei L,郑X,刘M, L,黄歌J,徐C,李J, K,钟,BR, G,肖F,关键词:猕猴桃,基因组,基因组草图猕猴桃对.Nat Commun。2013;4:2640。
- 4.
公园ys,im mh,火腿ks,kang sg,park yk,namiesnik j,Leontowiczh,Leontowicz M,Katrich E,Gorinstein S.有机和常规生长猕猴桃生物活性化合物的营养和药物性质。植物食品嗡嗡声。2013; 68:57-64。
- 5.
奇异果:植物学综述。正确答案:Janick J,编辑。园艺的评论。Westport: AVI Publishing Company, Inc;1984.
- 6.
Richardson Ac,Boldingh Hl,Mcatee Pa,Gunaseelan K,Luo Z,Atkinson Rg,David Km,Burdon Jn,Schaffer RJ。二倍体猕猴桃的水果开发,猕猴桃对“Hort16A”。中国生物医学工程学报,2011;
- 7.
Giovannoni JJ。果实发育和成熟的遗传调控。植物细胞。2004;16:s170 - 80。
- 8.
AtNAP是一个NAC家族的转录因子,在叶片衰老过程中起着重要作用。植物j . 2006; 46:601-12。
- 9.
Yamasaki K,Kigawa T,Inoue M,Watanabe S,Tateno M,Seki M,Shinozaki K,Yokoyama S.结构和植物特异性转录因子DNA结合结构域的演化起源。植物理性生物化学。2008; 46:394-401。
- 10.
Tisza v,Kovácsl,鲍洛赫A,Heszky L,Kiss E. Faspt的表征,一种从非中小学草莓果中编码BHLH转录因子的刮刀基因。植物理性生物化学。2010; 48:822-6。
- 11.
Lee JM,Joung JG,McQuinn R,Chung My,Fei Z,Tieman D,Klee H,Giovannoni JJ。组合转录组,番茄果实中的遗传多样性和代谢物分析表明,乙烯响应因子SLERF6在成熟和类胡萝卜素积累中起重要作用。工厂J. 2012; 70:191-204。
- 12.
张丹,任玲,岳建华,史永波,卓丽华,王玲,沈晓红。基于rna测序的茎发育和矮化调控转录组分析爱情花早熟ssp。胶雷顿(雷顿)。基因。2015;565:252 - 67。
- 13.
KATO H,Motomura T,Komeda Y,Saito K,Kato A.过度表达n转录因子家庭基因ANAC036结果在矮化表型拟南芥蒂利亚纳.J植物理性。2010; 167:571-7。
- 14.
谢问。拟南芥NAC1在下游转换TIR1下游以促进横向根部发育。基因开发。2000; 14:3024-36。
- 15.
Olsen An,Ernst Ha,Leggio LL,Skriver K.NAC转录因子:在结构上独特,功能多样化。趋势植物SCI。2005; 10:79-87。
- 16.
马楠,冯红,孟x,李丹,杨丹,吴聪,孟Q.番茄的过表达SLNAC1.转录因子改变水果的色素沉着和软化。中国生物医学工程学报,2014;
- 17.
朱米,陈克,周S,涂呀,王Y,Dong T,Hu Z.一种新的番茄NAC(NAM / ATAF1 / 2 / CUC2)转录因子,SLNAC4,作为果实成熟和类胡萝卜素积累的正调节因子.植物细胞生理。2014; 55:119-35。
- 18.
参与器官分离的基因拟南芥:杯状子叶突变体的分析。植物细胞。1997;9:841-57。
- 19.
关键词:NAC,基因型,基因型,基因型,基因型,基因型栽培稻和拟南芥蒂利亚纳.DNA Res。2003; 10:239-47。
- 20.
Souer E,Van Houwelingen A,Kloos D,Mol J,Koes R.在胚胎和花中的图案形成需要喇叭花的无顶部分泌基因,并在分生和原始界限中表达。细胞。1996年; 85:159-70。
- 21.
关键词:水稻,NAC转录因子,组织特异性,胁迫响应,系统序列分析分子基因,2008;280:547-63
- 22.
8 .胡锐,齐刚,孔勇,孔丹,高强,周刚。大豆中NAC结构域转录因子基因家族的综合分析Populus Trichocarpa..中国生物医学工程学报。2010;10:15 15。
- 23.
关键词:NAC结构域,转录因子,转录因子,基因家族葡萄.植物细胞代表2013;32:61-75。
- 24.
关键词:梨,NAC,转录因子,全基因组鉴定,功能预测植物生物学杂志。2018;18:214。
- 25.
吴勇,邓震,赖杰,张勇,杨超,尹斌,赵强,张玲,李勇,杨超,谢强拟南芥ATAF1在非生物和生物胁迫响应中的作用。细胞研究》2009;19:279。
- 26.
郑js, Kim YS, Baek KH, Jung H, Ha SH, Choi YD, Kim M, Kim JK。根系比表达OsNAC10在大田干旱条件下提高水稻的耐旱性和产量。植物杂志。2010;153:185 - 97。
- 27.
格兰特耶和华州,福吉诺T,BEERS EP,Brunner AM。涉及控制血管细胞分化的NAC结构域转录因子的表征拟南芥和杨树。足底。2010;232:337-52。
- 28.
高毅,魏伟,赵旭,谭旭,范智,张勇,景勇,孟l,朱斌,朱华,陈杰,蒋传忠,Grierson D,罗勇,傅德强。NAC转录因子no -like1是番茄果实成熟的一个新的正调控因子。Hortic杂志2018;5:75。
- 29.
Carrasco-Orellana C,Stappung Y,Mendez-Yañeza,Allan Ac,Espley RV,Plunkett BJ,Moya-Leon Ma,Herrera R.裂纹复合转录因子FCNAC1的表征Fragaria chiloensis.水果。Sci众议员2018;8:10524。
- 30.
刘X,王t,巴塞洛缪e,黑色k,dong m,张y,杨s,cai y,xue s,weng y,人h. nac转录因子综合分析及其在黄瓜水果脊柱发育过程中的表达及其表达(Cucumis sativusL.)。Hortic Res。2018; 5:31。
- 31。
Tanou G,Minas是,Karagiannis E,Tsikou D,Audebert S,Papadopoulou KK,Molassiotis A.硝普钠和臭氧在Kiwifruit成熟生理中的影响:一种组合基因和蛋白表达突出方法。Ann Bot。2015; 116:649-62。
- 32。
金杰夫,王寨,他qy,wangjy,李pf,徐杰,郑sj,风扇w,杨杰。番茄中NAC转录因子家族的基因组鉴定及表达分析(Solanum lycopersicum.)。BMC基因组学。2020;1:288。
- 33。
Velasco R, Zharkikh Affourtit J, Dhingra, Cestaro, Kalyanaraman,丰塔纳P,博SK, Troggio M, Pruss D, Salvi年代,Pindo M, Baldi P, Castelletti年代,Cavaiuolo M,科波拉G,科斯塔F, Cova V,木豆RA, Goremykin V, Komjanc M, Longhi年代,Magnago P, Malacarne G, Malnoy米,米凯莱蒂D, Moretto M, Perazzolli M, Si-Ammour, Vezzulli年代,辛尼E,·G·菲茨杰拉德LM, Gutin N, Lanchbury J, Macalma T,米切尔JT,里德J,沃代尔B, Kodira C,陈Z, Desany B, F Niazi,帕默M, Koepke T, Jiwan D, Schaeffer年代,Krishnan V,吴C,楚VT,圣王,维克J,道Q,穆拉兹,Stormo, Stormo K, Bogden R,新的D,斯特拉,Vecchietti,卡特尔MM, Masiero年代,Lasserre P, Lespinasse Y,艾伦•交流总线V, Chagne D,克劳赫RN, Gleave美联社,Lavezzo E,福塞特是的,Proost年代,Rouze P, Sterck L, Toppo年代,Lazzari B,赫楞RP, Durel CE、Gutin, Bumgarner再保险,加德纳,量有多少米,埃霍尔姆M, Van de同行Y, Salamini F,中提琴r的基因组驯化的苹果马吕斯×家庭borkh。)。NAT Genet。2010; 42:833-9。
- 34。
番茄基因组联盟。番茄基因组序列提供了对肉质水果进化的见解。大自然。2012;485:635-41。
- 35.
关键词:NAC,转录因子,全基因组鉴定,转录因子家族穆萨Acuminata以及果实成熟过程中的表达分析。国际分子科学杂志。2020;21:634。
- 36.
Carrasco-Orellana C, Stappung Y, Mendez-Yañez A, Allan AC, Espley RV, Plunkett BJ, Moya-Leon MA, Herrera R.表征成熟相关转录因子FcNAC1来自Fragaria chiloensis.水果。Sci众议员2018;八24。
- 37.
寇X,沃特金斯CB,甘SS。拟南芥AtNAP调节果实衰老。实验机器人。2012;63:6139-47。
- 38.
吴A,Allu Ad,Garapati P,Siddiqui H,Dortay H,Zanor Mi,Asensi-Fabado Ma,Munné-Bosch S,Antonio C,Tohge T,Fernie AR,Kaufmann K,Xue GP,Mueller-Roeber B,Balazadeh S。Jungbrunnen1,反应性氧物种响应性NAC转录因子,调节寿命拟南芥.植物细胞。2012;24:482 - 506。
- 39.
贾丹,龚晓,李敏,李超,孙涛,马峰。一种新型苹果NAC转录因子基因的过表达。MdNAC1,赋予转基因苹果中的矮化表型(Malus Domestica.).基因。2018;9:229。
- 40.
金洪俊,南HG,林波。NAC转录因子在叶片衰老中的调控网络。《植物生物学》2016;33:48-56。
- 41.
NAC转录因子在植物生物和非生物胁迫响应调控中的作用Microbiol前面。2013;4:248。
- 42.
altschul sf,madden tl,schffer aa,张俊,张z,米勒w,lipman dj。Papped Blast和Psi-Blast:新一代蛋白质数据库搜索程序。核酸RES。1997年; 25:3389-402。
- 43.
El-Gebali S, Mistry J, Bateman A, Eddy SR, Luciani A, Potter SC, Qureshi M, Richardson LJ, Salazar GA, Smart A, Sonnhammer ELL, Hirsh L, Paladin L, Piovesan D, Tosatto SCE, Finn RD. 2019年pam蛋白家族数据库。核酸图谱2019;D1: D427-32。
- 44.
Marchler-Bauer A,Bo Y,Han L,Han L,Han L,Han L,Langzycki CJ,Lu S,Chitsaz F,Derbyshire Mk,Geer Rc,Gonzales Nr,Gwadz M,Hurwitz di,Lu F,Marchler GH,Song Js,Chrenthi N,王Z,山下ra,张d,郑c,geer ly,bryant sh。CDD / Sparcle:通过子类域架构的功能分类蛋白质。核酸RES。2016; 45:D200-3。
- 45.
埃德加钢筋混凝土。MUSCLE:多序列比对,高精度,高通量。核酸杂志2004;32:18 1792 - 7。
- 46.
Tamura K,Peterson D,Peterson N,SteCher G,Nei M,Kumar S. Mega5:使用最大可能性,进化距离和最大判定方法的分子进化遗传学分析。mol Biol Evol。2011; 8:2731-9。
- 47.
[11]胡斌,金军,郭爱娥,张宏,罗军,高光。GSDS 2.0:基因特征可视化升级服务器。生物信息学。2015;31:1296-7。
- 48.
Livak KJ,Schmittgen TD。使用实时定量PCR和2的相对基因表达数据分析——ΔΔCT方法。方法。2001;25:402-8。
- 49.
Langfelder P,Horvath S.WGCNA:用于加权关联网络分析的R包。BMC生物信息学。2008; 9:559。
- 50。
关键词:基因工程,转录因子,转录因子柑橘晚熟甜橙突变体及其野生型转录组的果实成熟。《公共科学图书馆•综合》。2016;11:e0154330。
致谢
我们非常感谢李明军博士(中国杨凌西北农林科技大学)在研究中的智力投入。感谢赵涛博士(中国杨凌西北农林科技大学)在基因表达分析方面提出的重要建议。我们也非常感谢韩慧斌博士(江西农业大学,中国南昌)帮助我们修改了论文。
资金
本研究由国家自然科学基金项目(31760559、31760567和31960588)、江西省科技厅重点研发计划项目(20192ACB60002)和江西农业大学博士创业基金项目(9232307422)资助。资助机构没有参与研究设计、收集、分析、解释数据和撰写手稿。
作者信息
从属关系
贡献
大部分实验由D.J.和L.C.完成。D.J.写了这篇论文。z . j和y . h辅助RNA的分离。H.F.进行了加权基因共表达网络分析。G.L.帮助进行了基因表达分析。X.X、c.h.和D.J.提供了资金支持。所有作者均已阅读并批准稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
同意出版物
所有作者都同意出版。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1。
AcNAC基因及其在基因组中鉴定的预测编码或蛋白质序列猕猴桃对“弘扬”。
附加文件2。
隐马尔科夫模型识别AcNAC蛋白及其保守的NAM结构域。
附加文件3。
Kiwifruit NAC蛋白的相似性和相应的NAC蛋白拟南芥.
附加文件4。
ACNAC蛋白的主要信息及其相应编码序列(CDS)的长度。
附加文件5。
猕猴桃和猕猴桃NAC蛋白的系统发育树拟南芥.系统发育树由Mega软件(5.05)构造使用邻接方法,具有1000个引导复制。NAC蛋白的亚属蛋白由不同的颜色表示,并且它们的名称标有大写字母。
附加文件6。
基因组长度,外显子数量和长度AcNAC基因。
附加文件7。
AcNAC蛋白中保守基序的氨基酸残基序列。
附加文件8。
染色体位置和分配方向AcNAC基因。
附加文件9。
Synteny关系和他们的基因组块AcNAC基因对。
额外的文件10。
142的相对表达式数据n果实发育过程中的基因猕猴桃eriantha“Ganlu 1”。
额外的文件11。
通过加权基因共表达网络分析,对来自绿松石模块的输入基因进行了表达比较的丰富聚类信息。
额外的文件12。
通过加权基因共表达网络分析,对灰色模块中的输入基因进行了表达比较的丰富聚类信息。
附加文件13.
引物序列用于相对表达分析AeNAC用实时荧光定量PCR方法检测基因。
额外的文件14。
最优beta值的关键R脚本参数和共表达矩阵用于加权基因共表达网络分析。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
贾丹,蒋哲,傅宏。et al。全基因组鉴定与综合分析n参与猕猴桃果实发展的家庭基因(猕猴桃).BMC植物杂志21日,44(2021)。https://doi.org/10.1186/s12870-020-02798-2
已收到:
公认:
发表:
关键字
- 猕猴桃
- NAC转录因子
- 猕猴桃eriantha
- 水果开发
- 基因表达