- 研究文章
- 开放访问
- 发布:
DNA甲基转移酶和脱甲基酶基因家族的基因组鉴定及分析Dendrobium Officinale.揭示它们在多糖积累中的潜在功能
BMC植物生物学体积21.文章编号:21.(2021)
摘要
背景
DNA甲基化是涉及许多生物过程的调节,包括植物发育,次生新陈代谢和对应激的反应的保守和重要的表观遗传改性。然而,没有关于鉴定细胞苷-5 DNA甲基转移酶的信息(C5酶)DNA去甲基酶(DMTase.)兰花中的基因Dendrobium Officinale..
结果
在这项研究中,我们对DoC5-MTase和DodMTase基因家庭D. Officinale..综合保守基序分析、基因结构分析和系统发育分析,8个DoC5-MTases被划分为4个亚家族(DoCMT、DoDNMT、DoDRM、DoMET), 3个DodMTases被划分为2个亚家族(DoDML3、DoROS1)。多个CIS.-作用元件,特别是应激响应元件和激素响应元件,在启动子区被发现DoC5-MTase和DodMTase基因。此外,我们调查了表达概况DoC5-MTase和DodMTase在10种不同的组织中,以及在非生物胁迫下(冷和干旱)和幼苗阶段的转录物丰富,在野生型体,芽和植物中。有趣的是,大多数DOC5-MTases都被下调,而Dodmtase被冷应激上调。在幼苗阶段,DoC5-MTase随着生长的进行,表情逐渐减少,但是DodMTase表达增加。
结论
这些结果为阐明了DOC5-MTASE和DODMTase在次生代谢物生产中的作用和对非生物胁迫的反应的作用提供了依据D. Officinale..
背景
胞嘧啶DNA甲基化是一种进化上保守的表观遗传修饰,对基因表达、印记、植物发育、果实成熟、转座子活性调控和逆境反应的调控至关重要[1,2,3.].哺乳动物甲基化主要发生在对称CG上下文中,而植物DNA甲基化在所有序列上下文中发生,包括CG,CHG和CHH,其中H代表A,C或T [4]. 在植物中,DNA甲基化分为两类:维持DNA甲基化和从头DNA甲基化。植物胞嘧啶DNA甲基化可分别通过甲基转移酶1(MET1)、色甲基化酶3(CMT3)以及CG、CHG和CHH位点的结构域重排甲基化酶2(DRM2)和CMT2维持[2,3.,4,5,6].此外,DRM主要通过24 nt小干扰rna引导的DNA甲基化途径,负责所有序列上下文(CG、CHG和CHH)的从头DNA甲基化[3.,4].
通常,植物中DNA甲基化的确切状态取决于拮抗性DNA甲基化和去甲基化的动态。与DNA甲基化相比,其催化通过单个DNA甲基转移酶如MOT1,CMT2,CMT3或DRM2测定,有源DNA去甲基化需要一系列涉及CG,CHG和CHH的COM,CHG和CHH的切除切除5-甲基胞嘧啶的酶[2].在植物中,该方法最初通过双官能DNA糖基糖酶催化,包括沉积物1(ROS1),Demeter(DME),demeter-γ类似的凹痕的2(DML2)或Demeter样3(DML3)的阻遏物途径[1,3.].
越来越多的证据表明植物DNA甲基化和去甲基化与各种环境应力密切相关,包括冷[7],干旱[8],热量[9,重金属[10],盐[11]和紫外线应力[12].此外,DNA甲基化和去甲基化也在调节水果发育和成熟方面发挥不可或缺的作用[3.,13,14,以及次级代谢[15,16,17]. 不同品种间花青素含量的差异马吕斯有明显“Granny Smith”和“Golden Delicious”被认为是由于两个品种中v-myb禽成髓细胞增生病毒致癌基因同源(MdMYB1)启动子的不同DNA甲基化水平,改变了MdMYB1特异性转录本水平的不同积累,进而影响了苹果皮肤中红色色素的形成[18]. 同样,温度依赖的DNA去甲基化是采后温度影响白肉桃果肉花青素生物合成的关键因素(Prunus Persica).增加花青素生物合成相关基因的表达水平,包括苯丙氨酸氨 - 裂解酶(PPPAL.)、肉桂酸4-羟化酶(PPC4H.),4-香豆酸辅酶A连接酶(pp4cl.),黄烷酮3-羟化酶(PpF3H),类黄酮3′-羟化酶(PpF3'H),二氢烷醇4-还原酶(PpDFR),花青素合成酶(PpANS)以及转录因子基因,基本helix-loop-helix3 (ppbhlh3.),与这些基因启动子的低甲基化水平有关[19].另外,水稻胚乳中的奥罗斯1介导的DNA去甲基化限制了α0urone细胞层的数量,因此奥罗酮1突变体含有更多的非淀粉多糖,脂质,蛋白质,维生素和矿物质而不是野生型[20.].鉴于DNA甲基化和去甲基化对于许多生物过程至关重要,C5酶和DMTase.已经在几种植物种类中鉴定并表征了基因,例如Thale Cress(拟南芥) [21.],花生(arachis hypogaea.) [22.,油菜籽(芸苔属植物显著) [23.]、蓖麻(里纳斯市政府) [24.], 番茄 (茄属植物lycopersicum) [25.]和茶树(山茶花Sinensis.) [26.].但是,迄今为止,没有研究尚未侧重于识别和分析C5酶和DMTase.兰花中的基因,Dendrobium Officinale.基于基因组分析的Kimura et Migo。
D. Officinale.兰科植物,是一种历史悠久的滋补食品和传统中草药,因为其茎中含有丰富的活性次生代谢物,尤其是具有抗炎、抗肿瘤和抗氧化活性的水溶性多糖[27.,28.].以前的研究表明D. Officinale.WSP可以改善非生物应激(例如干旱和盐胁迫)耐受性,因为它们可以作为相容的溶质和增强来自渗透压的环境的水吸收[29.,30.,31.].此外,大多数因果兰科兰花紧紧地粘附在树皮或岩石的表面上,使得它们通常经历环境压力(例如,冷热胁迫和水赤字)。因此,D. Officinale.已进化出缓解恶劣生境的理想品质,例如景天酸代谢、假鳞茎、肉质贮藏器官和厚叶[32.].的D. Officinale.参考基因组是公开的[33.,34.]. 一些具有药用作用的生物活性化合物,如多糖和生物碱,已被鉴定和功能分析[28.,29.,30.,35.,36.]. 但是,没有关于C5酶和DMTase.基因D. Officinale.是可用的。为了研究DNA甲基化和去甲基化是否参与活性化合物的生物合成调控,在基因组引导下发现和表征C5酶和DMTase.基因D. Officinale.被执行。本研究为兰科植物中这两种表观遗传调节酶的功能研究提供了有价值的信息D. Officinale.以及分析整个植物王国内的进化关系。
结果
基因组 - 范围识别与结构分析C5酶和DMTase.基因D. Officinale.
报告的爆炸分析A. Thaliana.和水稻C5-mTase和DMTase蛋白质全部D. Officinale.基因组鉴定出8种DoC5酶和3种DodMTase蛋白(表1)1).八DoC5-MTase基因(DoMET1,docmt1,docmt2.,docmt3.,DoDRM1,DoDRM2,DoDRM3和dodnmt2.)代码蛋白由324(DODNMT2)至1534(Domet1)氨基酸组成,类似于atc5-mtases.(383至1534)[21.].DOC5-MTASES的MW从36.43到173.71kDA之间变化,PI范围为5.00至9.16(表1).3个domtase蛋白全长为1380 (DoDML3) ~ 1903 (DoROS1b)氨基酸,开放阅读框(ORF)为4143 ~ 5712 bp,相对分子量为156.56 ~ 212.56 kDa, pI为6.70 ~ 7.85(见表)1).对于DoDNMT2( - 0.235)观察到最高肉重值,以及Docmt1( - 0.626)的最低值,表明所有D. Officinale.DoC5-MTase和DodMTase蛋白是亲水的(表51).根据其推定的亚细胞定位,DoDRM1位于细胞质中,而其他10个蛋白位于细胞核中。这些发现与结果一致里纳斯市政府不同的DRM成员位于不同的细胞器中[24.].除了核定位信号外,RcDRM3可能位于线粒体,RcDRM1可能位于叶绿体或线粒体[24.].
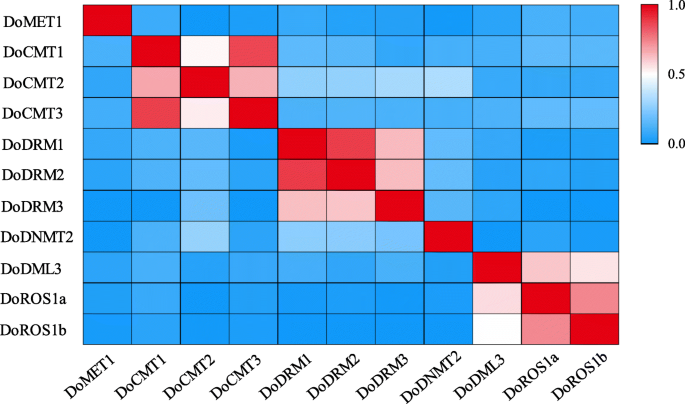
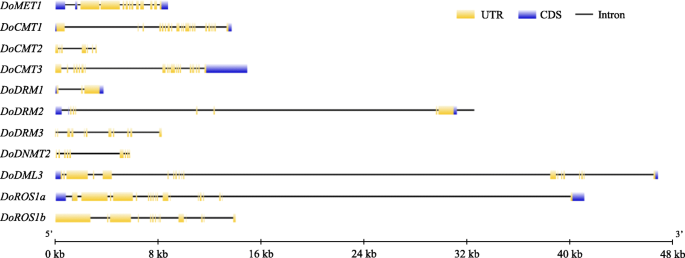
序列相似性D. Officinale.还分析了DOC5-MTASE和DODMTase蛋白。与DoDMTase蛋白相比,DOC5-MTase蛋白相互显示出低的身份,表明不同的DOC5-MTase蛋白可能具有多样化的功能。DOCMT1和DOCMT3以及DODRM1和DODRM2共享比其他DOC5-MTASE蛋白更高的相似性。在DoDMTase蛋白中,Doros1a和doros1b之间的序列相似性最高(图。1).这些结果表明,某些序列可能是重复的DoC5-MTase和DodMTase基因。另外,该算法的编码区域DoC5-MTase基因被5-28内含子打断,而那个DodMTase被34-39个内含子打断。在这些中,DodMTase内含子数量最多的基因是多德姆利3, 尽管DoDRM1包含最少的内含子(图。2).
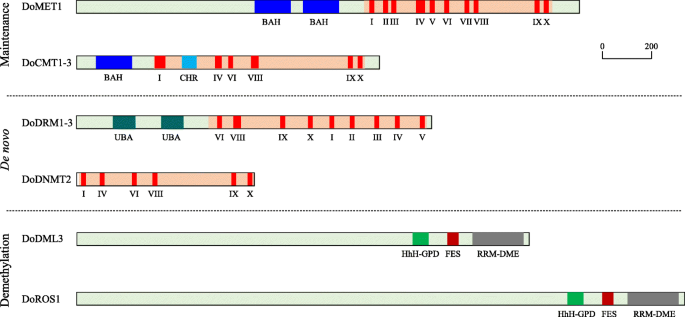
虽然在所有已鉴定的DoC5-MTase和DodMTase蛋白中,具有保守结构域的催化c端结构域普遍存在,但n端在每个亚家族中表现出不同的保守结构域组合。结构分析表明,8个doc5 - mtaase蛋白根据其一级结构的不同结构特征分为4组:DoMET1包括在n端包含两个BAH结构域的MET组,DoCMT1、DoCMT2和DoCMT3包括在n端只包含一个BAH的CMT组,DoDRM1、DoDRM2和DoDRM3包括在n端包含UBA结构域的DRM组,而DoDNMT2是DNMT组中唯一没有n端保守结构域的成员。所有的DoC5-MTase蛋白都包含羧基c端催化结构域,其保守基序I、IX、VI、VIII、IV和X以特定的顺序排列,而n端结构域的差异可能是不同DoC5-MTase蛋白不同作用的关键(图1)。3., 数字S1,S2,S3,S4,S5和S6).此外,Dodmtase蛋白含有三个保守的结构域,HHH-GPD,FES和RRM-DME。这些结果表明Dodmtase蛋白的大多数域都是高度保守的。
C5-MTase和DM酶的序列对准和保守基序分析D. Officinale.
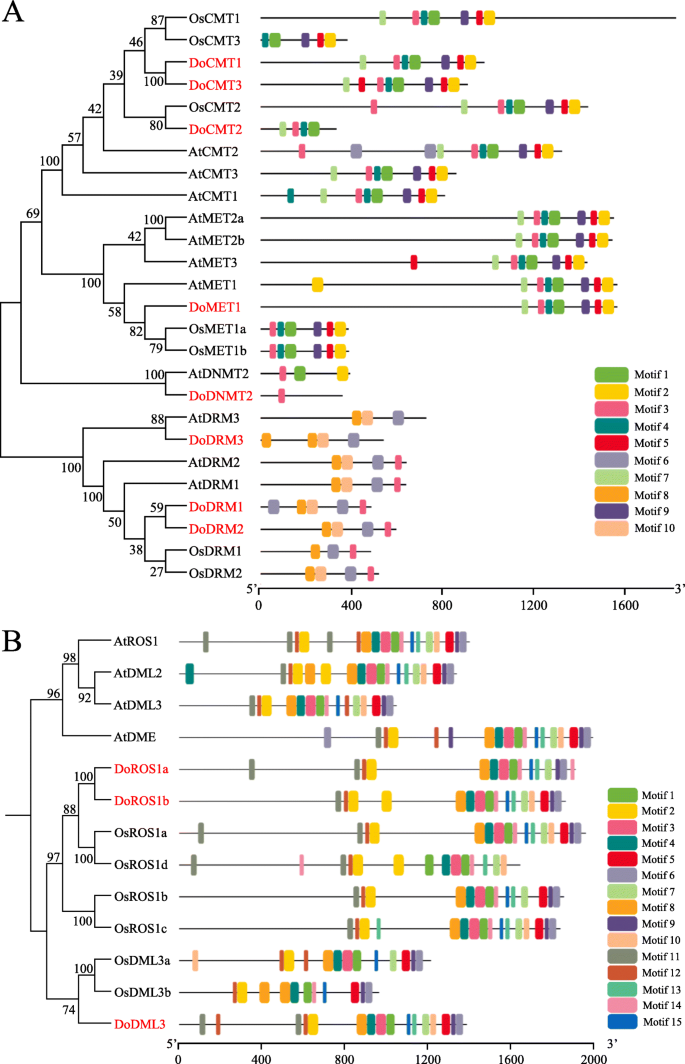
为了进一步探索DOC5-MTASE和DODMTase蛋白的保护和分歧,MEME MOTIF搜索工具用于识别保守的图案D. Officinale.和A. Thaliana.,三象的模型植物,和o.苜蓿,一种单子叶模式植物。在这些C5-MTase蛋白中,共鉴定出10个保守基序。基序长度在29 - 50个氨基酸之间,基序数量在1 (DoDNMT2) - 10 (AtCMT2)之间。motif 6、8和10在DRM亚家族中高度保守。基序1、2、3、4、5和9位于c端区域,是CMT和MET亚家族中主要的保守基序。除OsCMT3、AtDRM3和DoDRM3外,motif 3位于所有C5-MTase蛋白中(图1)。4一个,图S7、表S2).
因此,dMTase蛋白基序在A. Thaliana.,D. Officinale.和o.苜蓿使用MEME套件分析,并鉴定了15个保守的图案,被指定为泳学1至15个。从18至50个氨基酸的基序的长度范围为10-50个氨基酸,并且每个DMTase蛋白中的基序的数量在10和15之间变化。在所有DMTase蛋白中,基序1,2,4和12在所有DMTase蛋白中高度保守。在13个DMTase蛋白中的12个中发现图案3,6,7,8,9和15,在13个DMTase蛋白中的11个中观察到基序5,11和14,在13个DMTase蛋白中的10个中观察到基序10和13(如图。4b、 数字S8、表S3).可以推断,C5-MTase和DMTase蛋白共同的基序可能与保守的生物学功能相关,但是少数蛋白质的那些可能与基因特异性有关。
C5-MTases和DM酶的系统发育分析D. Officinale.以及其他植物种类
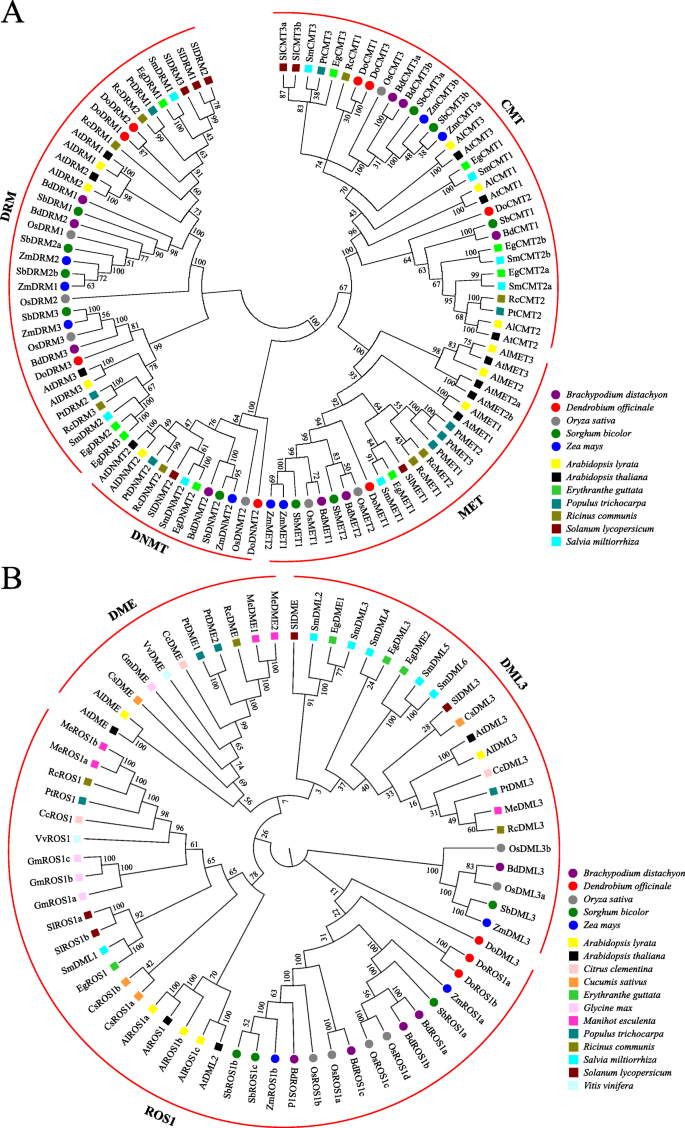
为了阐明植物中C5-mTases的系统发育关系,来自五种单圈子的103 c5-mTase蛋白序列(b . distachyon,D. Officinale.,o.苜蓿,S. Bicolor.和z梅斯)和七个双旋肌(A. Lyrata.,A. Thaliana.,大肠guttata,p . trichocarpa,r .普通的,S圣女果和S. Miltiorrhiza.)用于构建相应的系统发育树(表S4). C5-mtase自然分为4个亚家族,分别为CMT、DRM、MET和DNMT组的35、32、12和24个成员(图1)。5一种)。与DRM亚家族相比,MET,CMT和DNMT Subfamilies更加类似,属于相同的群集。DRM亚家族是系统发育树中最大的,而DNMT亚家族是最小的并且仅包含12种植物物种的12个成员。遇到的亚家族隐患Domet1并且可以进一步分为DiCot和单子偶像组。类似地,CMT,DRM和DNMT2亚壳也可以分为单子偶像组和DICOT组。
C5-MTase的系统发育分析(一个)和dmtase(b)的蛋白质。双子叶和单子叶分别用圆形和正方形表示。艾尔,rabidopsis lyrata.;在,拟南芥;BD,Broachypodium distachyon.; 复写的副本,柑橘克莱门德纳;计算机科学,Cucumis巨大成功;做的,Dendrobium Officinale.; 如,Erythranthe guttata;通用,甘氨酸最大; 我,木薯耐;操作系统,栽培稻;PT,毛果杨;钢筋混凝土,里纳斯市政府;SM,萨尔维亚米尔蒂希萨;Sl,茄属植物lycopersicum;SB,高粱; Vv公司,vitis Vinifera;ZM,玉米
因此,将69个DMTase蛋白聚集成三种正交曲线,分别指定为DME,DML3和ROS1基团,其分别覆盖11,22和36个构件(图。5b,表S5).根据构造的系统发育树,ROS1和DML3基团可以进一步分为单子叶和二孔亚组。然而,DME组仅限于DICOTS,表明DME可能是DICOTS中的系统源性单晶晶。总体而言,这些发现表明C5-MTA酶和DMTase蛋白可能在单焦点和双斑点中行使不同的功能。
DOC5-MTase和DoDMTase的蛋白质 - 蛋白质相互作用
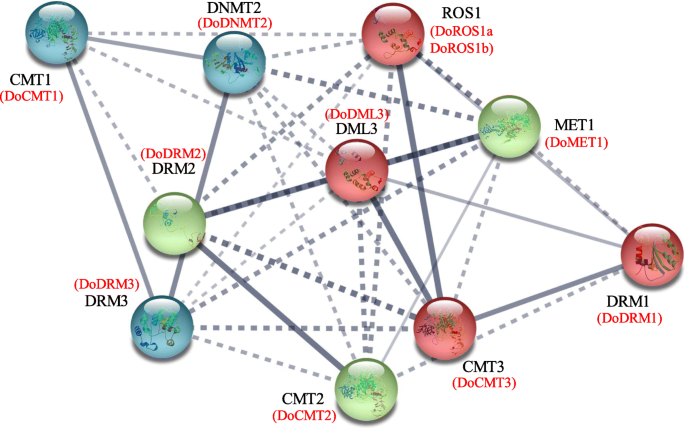
使用A. Thaliana.同源物,用弦11工具构建Doc5-MTase和DoDMTase蛋白的蛋白质 - 蛋白质相互作用网络。因此,DOC5-MTase和DoDMTase与相应的A. Thaliana.同源蛋白(无花果。6).Doros1a和Doros1b对Atros1高度同源,分别为56和42%的同一性。在给定的置信水平(0.70)的情况下观察到CMTS,DRM和MET之间的强相互作用,表明它们可以通过蛋白质 - 蛋白质相互作用网络或通过形成蛋白质复合物来调节整体DNA甲基化水平。ROS1和DMLS与C5-MTASES,特别是CMTS和DRM相互作用,表明可以通过C5 -MTase和DMTase动态地容纳全局DNA甲基化水平。因此,C5-mTase和DMTase可以形成往复负反馈回路,其动态地影响总甲基化水平。
分析CIS.- 为......DoC5-MTase和DodMTase基因
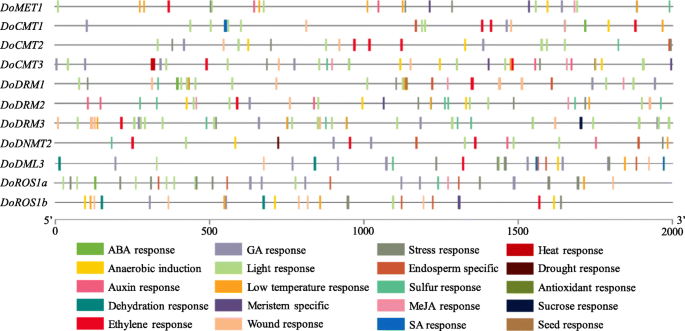
植物的生长发育受多种因素的调控CIS.-基因调控元件。在这里,各种各样的CIS.- 从2000-BP上游监管区域开采并分析了含有激素敏感,亮响应,应力响应,组织特异性和其他元素的元素,并分析DoC5-MTase和DodMTase使用PlantCare网站的基因(图。7, 数字S9.、表S6).在推定的推动者中发现组织特异性元素(12/244),包括在胚乳(6/12)中,芽和根系(5/12)和种子(1/12)DoC5-MTase和DodMTase基因。激素响应元件(70/244),响应ABA(18/70),毒素(9/70),乙烯(6/70),GA(18/70),Meja(18/70)和SA(1/70),也被广泛观察到。多生物和生物应激相关元素(69/244),包括响应厌氧诱导(11/69),脱水(6/69),干旱(1/69),热(2/69),低温(17/69),压力(15/69)和伤害(17/69),大部分富集。这些研究结果表明DoC5-MTase和DodMTase基因可能在对寒冷和干旱胁迫的反应中发挥重要作用D. Officinale..
转录本丰度分析DoC5-MTase和DodMTase基因D. Officinale.
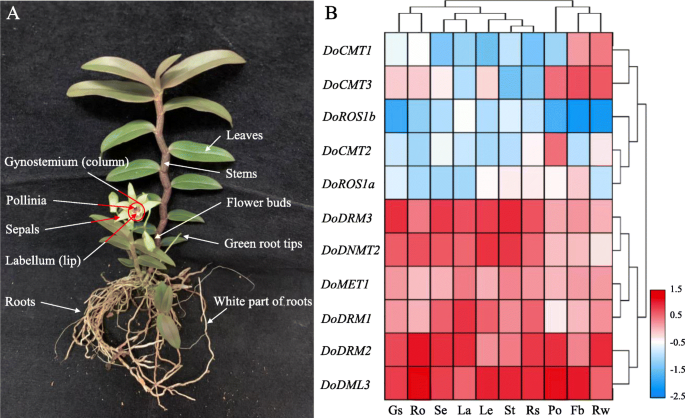
C5-MTases和dMTases作为DNA甲基化的主要参与者,在植物生长发育中起着重要作用。为初步探讨DoC5-MTases和DodMTases的生物学功能,对8个转录本丰度进行了研究DoC5-MTase和三DodMTase花蕾的基因,绿根尖端,牙科纤维术(柱),唇缘(唇),叶子,花花素,萼片,茎,根和白色部分的两岁,田苗圃成长D. Officinale.工厂确定。结果表明DoC5-MTase和DodMTase可以在测试的器官中测定基因,但观察到显着的差异表达模式。根据分层群集(图。8b),转录性丰富DoC5-MTase和DodMTase基因可以大致分为两组,低表达组和高表达组。低表达组的成员(docmt1,docmt2.,docmt3.,doros1a.和doros1b.)通常在大多数组织中保持相对较低的表达水平,FPKM值在0.64到9.36之间。然而,多个基因在特定器官中高度表达,例如docmt1在花蕾和根的白色部分,docmt2.在波利尼亚,和doros1a.在花蕾。此外,高表达组的成员(DoDRM1,DoDRM2,DoDRM3,DoMET1,多德姆利3和dodnmt2.)在所有10个器官中以高水平表达,FPKM值范围为12.55至47.47,特别是DoDRM2和多德姆利3这些基因可能在植物生长发育中起着重要作用。此外,共有81.82%(9/11)的DoC5-MTase和DodMTase基因在花芽、花粉和根的白色部分有中高表达,而在雌蕊和根中有63.64%(7/11)。
的时间-空间表达模式DoC5-MTase和DodMTase不同器官的基因D. Officinale..一个不同的D. Officinale.在这项研究中使用了器官。b转录水平DoC5-MTase和DodMTase基因在十D. Officinale.器官。表达式值平均值的Log2转换用于使用TBTOOLS软件生成热映射。颜色标度中的蓝色和红色分别表示低调和高转录物表达。FB,花蕾;GS,Gynostemium(专栏);La,Labellum(唇);le,叶子;Po,Pollinia;ro,根;RT,绿根提示; Rw, white part of roots; Se, sepals; St, stems
表达式模式DoC5-MTase和DodMTase基因对环境压力的反应
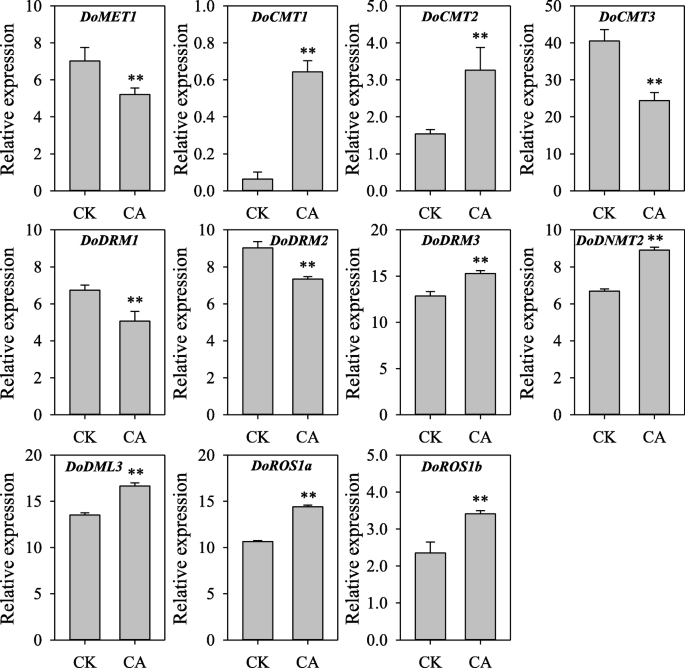
D. Officinale.是一种附生兰花,在树干和悬崖上生根,通常暴露于各种环境压力,特别是干旱和寒冷的压力。调查的反应DoC5-MTase和DodMTase寒冷胁迫下的基因,D. Officinale.RNA-seq数据(37.分析了20小时的环境温度(CK,20℃)和冷(CA,0℃)处理。冷治疗差异调节表达DoC5-MTase和DodMTase基因(图。9). 与未驯化的对照组相比docmt3.,DoDRM1,DoMET1和DoDRM2被抑制在1.12- 2.48倍之间。相比之下,多德姆利3,dodnmt2.,doros1a.,DoDRM3,docmt1,docmt2.和doros1b.在1.14-和7.55折之间提高,最高docmt1和最低的DoDRM3平均提高3.79倍。
转录水平DoC5-MTase和DodMTase基因响应冷应激。相对表达通过以前量化D. Officinale.RNA-seq数据(34.]分别在室温(CK, 20°C)和低温(CA, 0°C)下处理20 h。误差条表示三个单独实验的平均值±SD(标准差),并通过三个独立重复进行量化。条形图上的星号表示CK与CA之间存在显著差异p< 0.01基于学生的t以及。CA, 0°C冷处理;CK,控制在20°C
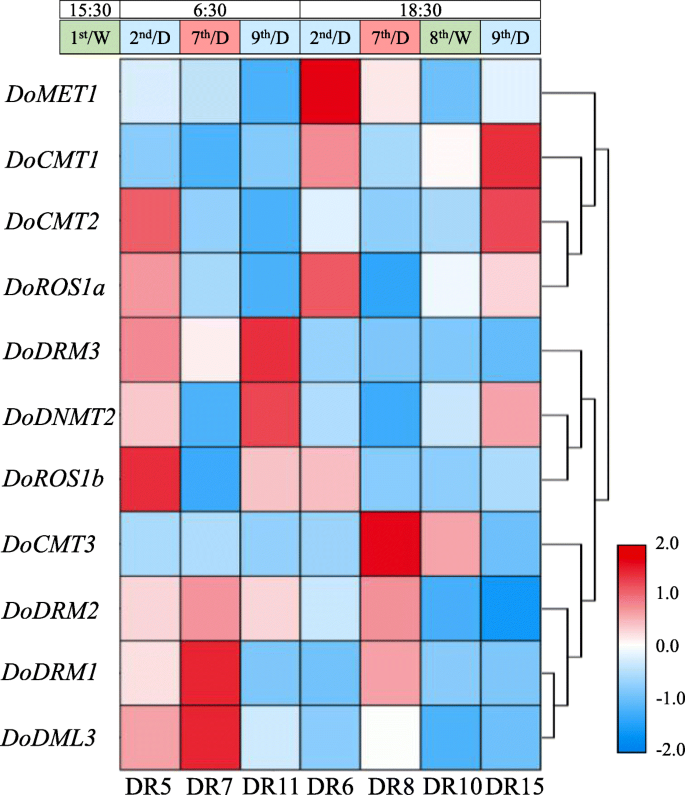
探讨…的潜在作用DoC5-MTase和DodMTase,通过分析RNA-seq数据来评估其转录本丰度[32.]在不同的干旱处理下。如图1所示。10,DoMET1干旱7天,黎明(−1.04倍)和黄昏(−1.32倍)均下调。DoDRM3在干旱期间,在黎明( - 1.14倍)和黄昏( - 1.05倍)两者上也被下调7天,但下调(没有折叠变化≤-1.2)并不重要。转录水平多德姆利3和doros1b.在整个7天的干旱胁迫下保持高(与其他基因1.56至52.36倍)保持高(1.56至52.36倍)。随着时间的推移,随着干旱压力的增加,表达DoDRM1,DoDRM2和docmt3.在整个7天的干旱胁迫下,在黎明(分别为1.93-,1.05-和1.01倍,1.93-1.05和1.01倍,它们的表达在黄昏(分别为12.41-,1.14-和2.45倍)。反过来,docmt1,docmt2.,doros1a.,doros1b.和dodnmt2.在干旱7天的清晨,表达量分别为−1.45、−1.71、−1.24、−2.66和−1.26倍;黄昏时,表达量分别为−1.88、−1.23、−1.56、−1.58和−1.13倍。的表达dodnmt2.再次治疗后被上调1.42倍。总体而言,表达水平DoC5-MTase和DodMTase基因受寒冷和干旱胁迫显著影响。
转录水平DoC5-MTase和DodMTase基因响应干旱胁迫。通过LOG2转换产生热图的平均值d . officinale DoC5-MTase和DodMTase受干旱处理的基因。D. Officinale.第1天浇灌幼苗,第2天至第7天晾干,第8天再浇水,如图所示。S10.在不同时间收集样品,DR5 / DR6,DR7 / DR8和DR11 / DR15分别在2ND,第7和第9天的06:30和18:30挑选,DR10在18:30收获第8天。颜色标度的蓝色和红色分别表示低调和高转录物表达
转录水平DoC5-MTase和DodMTase在积累过程中的基因D. Officinale.多糖
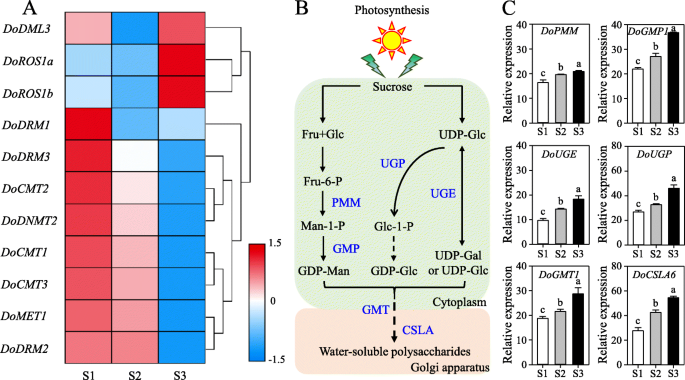
D. Officinale.是一种珍贵的中草药,具有丰富的次级代谢物,特别是WSP,占34.06-43.27%w / w [28.),在它的茎。此外,航空D. Officinale.在不同的发育期间累积。阐明潜在的角色DoC5-MTase和DodMTase研究结果表明,与WSPs生物合成相关的基因的转录水平与WSPs生物合成相关的基因的转录水平有关。11一种)。的表达DodMTase基因(多德姆利3,doros1a.和doros1b.)在不同生长阶段(从原球茎状体到长成苗)WSP含量均显著升高,WSP含量在93.71 ~ 183.74 mg g范围内逐渐升高- 1(图S11D) 以及6个关键基因的上调(DOPMM,Dogmp1.,DoUGP,倍,狗1和文件6)参与了WSPs的生物合成(图。11C)。相比之下,在相同的阶段,所有的转录水平DoC5-MTase基因(DoMET1,docmt1,docmt2.,docmt3.,DoDRM1,DoDRM2,DoDRM3和dodnmt2.)明显减少。此外,转录水平DodMTase基因(多德姆利3,doros1a.和doros1b.)与WSP含量呈正相关(Pearson’s相关系数)R2分别为0.57、0.87和0.79)。相比之下,表达DoC5-MTase基因(DoMET1,docmt1,docmt2.,docmt3.,DoDRM1,DoDRM2,DoDRM3和dodnmt2.)与WSP含量呈负相关(Pearson的相关系数R2 = − 0.94, − 0.95, − 0.83, − 0.92, − 0.66, − 0.90, − 0.96, and − 0.86, respectively). These findings suggest thatDoC5-MTase和DodMTase基因共同在WSPs的积累中发挥作用。
转录水平DoC5-MTase和DodMTase基因,以及参与WSPs生物合成的基因,在不同的发育阶段。一个表达模式DoC5-MTase和DodMTase不同发育阶段的基因。b提出了WSP的生物合成途径D. Officinale..c在不同发育阶段中涉及WSP生物合成的基因的表达模式。这三个发育阶段是果实状的体(S1),芽(S2)和植物(衍生自衍生自果实状体,S3),其分别在发芽后2,4和10个月内收集。通过LOG2转换产生热图的平均值d . officinale DoC5-MTase和DodMTase不同发育阶段的基因。颜色标度中的蓝色和红色分别表示低调和高转录物表达。在C中,误差条表示三个单独实验的平均值±SD(标准偏差),并用三个独立的重复量化。下方的不同小写字母表示不同阶段的显着差异p<0.05基于Duncan的多个范围测试。CSLA,纤维素合成酶A;FRU,果糖;gal,半乳糖;glc,葡萄糖;GMP,GDP-MANNOSE PYROPHORYLASE;男人,曼诺斯;PMM,磷腺癌;UGE,UDP-葡萄糖映像酶;UGP,UDP-葡萄糖磷苷酶; WSP, water-soluble polysaccharide
讨论
D. Officinale.是一种传统的中草药,由于其丰富的生物活性成分,如多糖,生物碱,黄酮和氨基酸,这是一种传统的中国草药,这是一千年的滋补品和珍贵的食物,例如多糖,生物碱,黄酮和氨基酸[27.,38.].在该兰花中发现并鉴定了许多参与生物活性次生代谢物生物合成的基因。但是,在次生代谢物的形成期间,没有任何信息可以调节基因表达的表述因子(DNA甲基化和去甲基化)D. Officinale..目的:阐明DNA甲基化和去甲基化的调控作用D. Officinale.我们在全基因组水平上鉴定了DoC5酶和DodMTase基因。这个CIS.-对这些基因的作用元件、保守基序、系统发育关系、蛋白质相互作用和序列特征进行了综合分析。
根据这一点D. Officinale.参考基因组[33.,34.]发现并鉴定了总共八种DOC 5-MTase和三种DoDMTase基因(表1).然而,C5-MTase和dMTase基因家族的数量在A. Thaliana.(15)、洋蓟(Cynara cardunculus) (17)S. Miltiorrhiza.(14)高于D. Officinale.(11)。自从此以来D. Officinale.基因组(1.35 GB)约2- 11倍A. Thaliana.(125 MB)[39.],全球朝鲜蓟(725 MB)[40] 和S. Miltiorrhiza.(558 MB) [41.,提示DoC5-MTase和DodMTase可能存在基因缺失或突变事件D. Officinale.. 此外,A. Thaliana.包含四个MET基因,而D. Officinale.只有一个(图。4,5),表明在演变期间的遇到基因的丧失D. Officinale..中也没有发现DMEo.苜蓿或D. Officinale.,不像在A. Thaliana.(图。4,5). 虽然ROS1是在D. Officinale.,它包含两个副病虫戈,Doros1a和doros1b(图。4,5)推测ROS1基因重复的发生。在以前的研究中,有756个基因家族在进化过程中扩展,而804个基因家族在进化过程中收缩D. Officinale.[34.]. 甲基化相关基因与全基因组复制和串联复制以及基因缺失事件有关[42.,43.],从而导致基因数目之间的差异D. Officinale.和其他植物物种,比如A. Thaliana.,地球朝鲜蓟和S. Miltiorrhiza.. 基因复制和丢失事件在基因进化中起着关键作用DoC5-MTase和DodMTase基因家族,这与研究草莓属vesca[44.]和茶厂[26.]. 综上所述Doros1.以及失去德梅和DoMET1暗示DoC5-MTase和DodMTase可能存在功能冗余和分歧。
系统发育分析表明DOC5-MTase分为四种等级,包括满足,CMT,DRM和DNMT(图。3.,4,5),这在双色斑点和单焦点中高度保守,例如A. Thaliana.[21.] 和o.苜蓿[45.]. DodMTase分为两类,DML3和ROS1(图。2),这与Dicots的结果不一致,例如A. Thaliana.[21.和花生(arachis hypogaea.) [22.],但与单子叶植物的结果一致,如水稻和玉米[46.].这表明DME可以在DICOTS中是系统源性单晶晶。此外,每个C5-mTase或DMTase亚家族进一步分为二萝萝卜和单子偶联基团(图。5).通过MEME分析验证了这些结果,并且在每个子簇内相似,但在每个子簇内具有相似的基板,但不同簇之间的发散(图。5),表明双子叶和单子叶在C5-MTases和dMTases的进化过程中可能采取不同的策略。
在基因家族内,含有相同域和主题的基因可能具有类似的作用。胞嘧啶-5 DNA甲基化,包括DE Novo和维持DNA甲基化,由C5-MTases和DM酶进行拮抗控制。CMT,DRM和符合人均分别负责维持CHG,CHH和CG甲基化,而DRM是主要的Novo C5-MTase [1,2,4]. DNMT2具有转移RNA甲基转移酶活性[47.]但其在胞嘧啶-5甲基化中的作用仍然未知。DNA甲基化在生长和发展中起着关键作用。的DRM1DRM2CMT3三重突变导致矮小表型,部分不育,生长缓慢A. Thaliana.[48.].DNA甲基化也与果实成熟的调控有关。涉及rna导向的DNA甲基化的基因,包括FvCMT3.1版,FvCMT3.2版,FVDRM1.3,FvDRM3.1,从而导致草莓成熟过程中的DNA低甲基化[49.].对于DNA去甲基酶,ROS1.功能障碍可以沉默的表达RD29A.基因,因为它的高甲基化RD29A.启动子(50.].DME激活母亲FIS2.,FWA.,m等位基因的表达,并负责胚乳基因印迹和种子活力[51.].SLDML2., 一种ROS1.通过激活DNA去甲基化和促进果实成熟基因的表达,如中国北车,PSY1,林[13].OsROS1a公司在雌雄配子体中都起着不可替代的作用[52.], 尽管OsROS1c型增强表达和转换Tos17在水稻愈伤组织[53.].这表明,C5酶和DMTase.来自集群的基因也可能参与不同的生物过程。
越来越多的证据表明C5-MTases和DMTases涉及非生物应激响应[7,8,9].在本研究中,大量激素,光,和应力响应CIS.- 在启动子区域中检测到的元素DoC5-MTase和DodMTase基因(图。7). 除此之外,CIS.-作用元件起着分子开关的作用,参与应激诱导基因表达的转录调控,调节各种生物过程[54.].此外,非生物胁迫可以通过产生新的等位基因引起胞嘧啶DNA甲基化的变化,从而可能影响转录本的丰度[55.].这种效果可能会占对成绩丰富的重大变化DoC5-MTase和DodMTase在冷应力下(图。9)和干旱胁迫(图。10).与前一项研究一致[56.],CIS.- 患有压力诱导角色的元素DoC5-MTase和DodMTase,可以响应多重应激信号并影响基因表达。
值得注意的是,DNA甲基化和去甲基化参与了次级代谢的调节。水溶性多糖是重要的次生代谢产物,对水溶性多糖的商品化质量起着重要的作用D. Officinale.[33.].WSP的内容在不同的部分D. Officinale.不同(茎>叶>根)[38.].在此,DoC5-MTase和DodMTase在花芽、合蕊部、唇瓣、叶、花粉、根、萼片和茎中,基因的转录水平存在显著差异。8).趋势doros1a.表达与WSP含量一致,而趋势docmt3.表情与上述相反,表示DoC5-MTase和DodMTase与WSP的生产相关联。此外,冷应激可以显着提高WSP含量D. Officinale.[31.,37.].有趣的是,三DodMTase基因上调,8DoC5-MTase基因表达下调(图。9)响应于冷应激或幼苗发育期间(图。11).DNA甲基化抑制基因转录。相反,DNA去甲基化增强了基因转录。冷处理可能通过增加DNA去甲基化和减少DNA甲基化来激活参与WSPs生物合成的酶。综上所述,DoC5-MTase和DodMTase可能共同作用,通过调控DNA甲基化水平来影响WSPs的积累,但其机制需要更详细的研究。
结论
根据这一点D. Officinale.参考基因组,八DoC5-MTase基因和三DodMTase基因被发现和鉴定。系统发育分析表明,8DoC5-MTase基因分为四类,DoCMT,多德姆,圆顶,Dodnmt..这三个DodMTase基因被分组成多洛斯和Dodml.亚科。表达谱DoC5-MTase和DodMTase这些基因表明它们在WSPs积累和逆境响应中具有重要的功能D. Officinale.. 这些发现将有助于揭示DoC5酶和DodMTase在机体次生代谢和应激反应中的可能作用D. Officinale.,并提供建设性线索,以进一步探索兰花中DOC5-MTASE和DODMTase的表观遗传机制。
方法
植物材料和实验治疗
D. Officinale.“中科1号”(高wsp线,49.5% w/w;中国科学院华南植物园段军教授进行遗传育种,批准号:20180003,网站:https://www.cas.cn/syky/201810/t20181031_4668440.shtml)植物在中国科学院南中国植物园,中国科学院,中国科学院南方植物园栽培和适应。组织特异性mRNA表达模式DoC5-MTase和DodMTase在营养期(2、4和10个月后),对原球茎样体、芽和植株(来源于原球茎样体)的基因进行了评估D. Officinale.种子在半强度Murashige和Skoog培养基上萌发[57.], 分别;数字S10A,B,C),以及10种组织,包括花蕾,牙龈粪(柱),萼片,唇膏(唇),叶,根,茎,Pollinia,树根和生殖阶段的绿根尖端(将幼苗移植到塑料罐后14个月;图。8一种)。将四个月的幼苗置于受控气候室中,具有12小时光/ 12-H暗循环,80%相对湿度和60μmolm- 2 s- 1在0℃(冷处理)和20°C(用于环境控制)的光合活性辐射分别为20小时。所有取样材料都没有任何昆虫,疾病或机械损伤。每种处理每种治疗是三种复制,每种条件至少具有10个独立的植物。在液氮中冷冻后立即储存所有这些样品在-80℃下储存。
胞嘧啶-5 DNA甲基转移酶和去甲基化酶基因的鉴定
的D. Officinale.从在线草药OMICS数据库中检索基因组(http://herbalplant.ynau.edu.cn/) [33.],或从DDBJ/EMBL/GenBank下载,登录码SUB764497[34.].胞嘧啶-5特异性dna甲基化酶(PF00145)的隐马尔可夫模型(HMM),从PFAM数据库(http://pfam.xfam.org/),使用c5 - mtaase蛋白,HMMER软件版本3.2.1 (http://hmmer.org/).同样,从PFAM数据库中下载螺旋-发夹-螺旋、Gly/Pro-rich环(HhH-GPD, PF00730)和RNA识别基序去甲基化酶(rrmdme, PF15628)的HMMs作为探针,搜索dMTase蛋白。之后,C5-MTase和dMTase蛋白从D. Officinale.通过基于本地HMM的搜索程序验证(E-VALUE≤1E−10).随后,保留了这些候选蛋白,作为“胞嘧啶-5 DNA甲基转移酶”或“DNA脱甲基化酶”或“DNA脱甲基酶”进行了最佳的“C5-MTASE”或“HHH-GPD和RRM-DME”命中,以进一步与保守的域数据库确认(NCBI-CDD,https://www.ncbi.nlm.nih.gov/cdd)以及简单的模块化架构研究工具(SMART,http://smart.embl-heidelberg.de/).冗余序列和不完全含有不特性PF00145,PF00730或PF15628基序的蛋白质被移除。鉴定的所有推定的甲基转移酶和脱甲基酶基因列于表中S1. 用ExPASy工具计算了DoC5酶和DodMTase蛋白的疏水性、分子量和等电点的总平均值(http://web.expasy.org/protparam.).植物MPLOC(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)被用来预测亚细胞定位DoC5-MTase和DodMTase基因。
系统发育树建设
利用DNAMAN version 6.0软件(Lynnon Biosoft, Foster City, CA, USA)对不同植物物种之间的C5-MTase和dMTase蛋白进行多序列比对,包括A. Lyrata.,A. Thaliana.,Broachypodium distachyon.,柑橘克莱门德纳,Cucumis巨大成功,Erythranthe guttata,甘氨酸最大,木薯耐,栽培稻,毛果杨,r .普通的,S圣女果,萨尔维亚米尔蒂希萨,高粱,玉米和vitis Vinifera,从Phytozome 12.1.6版(https:////phytozome.jgi.doe.gov/pz/portal.html#).为了验证使用DNAMAN的序列对准,还使用CLUSTALX 2.1程序进行C5-MTase和DMTase蛋白的多次对准[58.].结果文件用于构建具有分子进化遗传学分析(Mega X)软件的系统发育树[59.]基于邻居连接方法[60]有1000个引导复制。根据DoC5酶和DodMTase与相应基因的系统发育关系对其进行了分类A. Thaliana.C5-MTase和dMTase蛋白。
保守基序,基因结构和蛋白质 - 蛋白质相互作用分析
使用多重预期最大化来分析所有DOC5-MTase和DoDMTase蛋白的保守基序(MEME,http://meme-suite.org/)软件版本5.0.5,按照模因指令上传氨基酸序列。所有的编码序列和基因组序列DoC5-MTase和DodMTase使用基因结构显示服务器2.0版(GSDS,http://gsds.cbi.pku.edu.cn/).字符串11工具(https://string-db.org.)用于构建蛋白质蛋白质相互作用网络。
RNA制备和RT-QPCR分析
从14个月大的花、叶、根和茎中提取总RNAD. Officinale.移植后使用RNAout2.0试剂(Tiandz Inc., Beijing, China)如前所述[25.].RNA用RNase-free DNase I (Takara Bio Inc., Kyoto, Japan)纯化。1 μg总RNA用PrimeScript Reagent Kit with gDNA Eraser (Takara Bio Inc.)按照供应商说明合成第一链cDNA。将所得cDNA按1:50稀释,作为模板进行RT-qPCR分析。RT-qPCR采用LightCycler 480仪器(罗氏诊断,曼海姆,德国)在96孔板上进行,iTaq™Universal SYBR®Green Supermix (Bio-Rad Laboratories, Hercules, CA, USA),经鉴定扩增程序40个周期,如前所述[28.].表达的结构上d . officinale肌动蛋白(NCBI登录号:JX294908)用作标准化cDNA浓度变化的内部标准。另外,分析了从至少三种独立生成的cDNA样品中衍生的至少三种生物学复制。的特异性引物序列C5酶和DMTase.基因列于表中S1.
转录组分析DoC5-MTase和DodMTase基因表达
表达概况DoC5-MTase和DodMTase在室温(20°C)和低温(0°C)下培养20 h的基因[34.].RNA-seq序列从NCBI sequence read archive (SRA)数据库中获得,登录号为SRR3210613、SRR3210621、SRR3210626、SRR3210630、SRR3210635和SRR3210636。的转录丰度DoC5-MTase和DodMTase经受干旱和复水处理的基因,D. Officinale.第1天给幼苗浇水,第2天至第7天保持不浇水模拟自然干旱胁迫,第8天再浇水。分别于第2天(DR5和DR6)、第7天(DR7和DR8)和第9天(DR11和DR15)的06:30和18:30以及第8天(DR10)的18:30采集样本。DR5(SRR7223299)、DR6(SRR7223298)、DR7(SRR7223301)、DR8(SRR7223300)、DR10(SRR7223296)、DR11(SRR7223295)和DR15(SRR7223297)的RNA序列数据从Wan等人提供的NCBI SRA下载[32.]. 所有干净的读数都与D. Officinale.参考基因组[33.,34.]使用HISAT2软件[61]默认值参数。在确定最终的转录组后,Stringtie软件[62通过量化FPKM值来估算MRNA的差分转录水平。所有转录物的表达水平通过计算每千碱基(FPKM)计算碎片。差异表达DoC5-MTase和DodMTase基因定义为log2(折叠变化)> 1或<− 1具有统计学意义(p<0.05)。此外,具有倍数≥1.2的靶向基因被定义为上调基因,并且倍数≤-1.2的那些被认为是下调的基因。
确定WSP内容的测定D. Officinale.在三个发展时期
使用如前所述的酚硫酸方法量化WSP含量[31.].简而言之,粉末样品(0.3g)D. Officinale.原球茎状体、嫩枝和植株用80%乙醇水溶液(v/v)在80°C条件下提取2 h,去除小分子量化合物。用100 mL蒸馏水在100℃下重新提取2 h,然后用Whatman 1号滤纸(中国广州从源仪器有限公司)过滤。滤液在UV-6000分光光度计(上海梅塔什仪器有限公司,中国上海)上,以488 nm的葡萄糖标准曲线为基础,用苯酚-硫酸法测定WSP的含量。
统计分析
所有数据都表示为每种确定的三于三个独立的生物重复的平均值±标准误差。使用IBM SPSS版本22.0 for Windows(IBM Corp.,Armonk,Ny,USA)进行统计分析。CK和CA之间的转录物水平的显着差异p< 0.01根据学生的t以及。除非另有说明,否则所有数据都是通过使用对差异分析(ANOVA)进行比较,然后进行Duncan的多个范围测试p<0.05。通过软件TBTOOLS生成热图(https://github.com/CJ-Chen/TBtools),其颜色尺度表示表达值平均值的log2变换,蓝色表示低表达,红色表示高表达。相关分析采用Pearson相关系数(R2) 在p<0.01。
数据和材料的可用性
支持本文结论的数据集包含在文章及其附加文件中。目前研究中使用的所有数据和植物材料可以从相应的作者获得合理的要求。
缩写
- C5-MTase:
-
Cytosine-5 DNA甲基转移酶
- CMT3:
-
色甲基酶3
- DME:
-
德米特
- DML2:
-
demeter-like 2
- DML3:
-
demeter-like 3
- dMTase:
-
DNA demethylase
- DRM2:
-
区域重新排列甲基酶2
- FPKM:
-
每百万每千季碎片
- 肉汁:
-
疏水性的总平均值
- 嗯:
-
隐藏的马尔可夫模型
- 兆:
-
分子进化遗传学分析
- MEME:
-
主题启发的多重期望最大化
- 大都会1:
-
甲基转移酶1
- 兆瓦:
-
分子量
- 子:
-
打开阅读框
- pI:
-
等电点
- ROS1:
-
沉默抑制物1
- RT质量控制报告:
-
逆转录定量聚合酶链反应
- WSP:
-
水溶性多糖
参考
- 1.
朱杰克。由DNA糖基酶介导的活性DNA去甲基化。Annu Rev Genet。2009; 43:143-66。
- 2。
张浩,郎忠,朱继康。植物DNA甲基化的动态与功能。Nat Rev Mol Cell Biol. 2018; 19:489-506。
- 3.
刘锐,郎铮。植物活性DNA去甲基化的机制与功能。中国生物医学工程学报(英文版);
- 4.
律师:Jacobsen SE。植物和动物DNA甲基化模式的建立、维持和修饰。纳特·雷夫·吉内特。2010;11:204–20.
- 5。
Zemach A,Kim My,Hsieh ph,Coleman-Derr D,Eshed-Williams L,Thao K,Harmer SL,Zilberman D.的拟南芥核小体重组子DDM1允许DNA甲基转移酶进入含H1的异染色质。牢房。2013;153:193–205.
- 6.
Parrilla-Doblas JT,Roldán-Arjona T,Ariza Rr,Córdoba-cañerod。植物中的活性DNA去甲基化。int j mol sci。2019; 20:E4683。
- 7.
关键词:冷驯化,DNA甲基化,耐热性,生长速率芸苔属植物拉伯.实验机器人。2017;68:1213-24。
- 8.
Gangquency Dr,Crisp Pa,Eichten SR,Pogson BJ。的拟南芥DNA甲基汞在转基因干旱胁迫下是稳定的。植物理性。2017; 175:1893-912。
- 9
ma y,min l,王m,王c,赵y,李y,方q,吴y,xie s,ding y,su x,hu q,张q,李x,张x。中断基因组甲基化高温对微孔流产和花药盲目的影响有明显影响。植物细胞。2018; 30:1387-403。
- 10.
Chen X,Schönbergerb,Menz J,Ludewig U. DNA甲基化的可塑性和锌缺乏下的基因表达拟南芥根。植物细胞生理学。2018;59:1790–802.
- 11.
关键词:盐胁迫,大豆,长链非编码rna,甲基化,甲基化模式BMC基因组学。2019;20:730。
- 12.
Marfil C,IbañezV,Alonso R,Varela A,Bettini R,Masuelli R,Fontana A,Berli F.太阳紫外-B辐射,水缺损和脱落酸喷雾处理引起的葡萄DNA甲基化和多酚含量的变化。植物理性生物化学。2019; 135:287-94。
- 13。
郎z,王y,唐k,唐d,datsenka t,cheng j,zhang y,handa ak,zhu jk。DNA去甲基化在番茄果实激活中的DNA去甲基化危重作用及番茄果实中熟抑制基因的抑制作用。Proc Natl Acad Sci U S A. 2017; 114:E4511-9。
- 14。
关键词:柑橘果实,DNA甲基化,发育,成熟度美国国家科学研究院2019;
- 15.
Zha L,Liu S,Liu J,Jiang C,Yu S,Yuan Y,Yang J,Wang Y,Huang L. DNA甲基化影响绿原酸生物合成金银花粳稻通过介导LjbZIP8调控苯丙氨酸解氨酶2的表达。植物科学与技术,2017;
- 16
关键词:组蛋白乙酰化,DNA甲基化,过氧化物酶体,β-氧化拟南芥. 美国国家科学院学报。2019;116:10576–85.
- 17
关键词:辣椒,DNA甲基化,果实成熟,植物激素实验机器人。2020;71:1928-42。
- 18
马长青,景长军,常斌,严建勇,梁宝文,刘玲,杨永忠,赵志勇。启动子甲基化对MdMYB1表达水平决定了两个非红苹果品种果皮中花青素的积累水平。BMC植物生物学。2018;18:108.
- 19
朱YC,张B,艾伦AC, lin Wang K,赵Y,王K,陈KS,徐CJ。DNA去甲基化参与了桃花青素积累的温度依赖性调节。植物j . 2020; 102:965 - 76。
- 20。
刘俊,吴X,姚X,yu r,larkin pj,liu cm。DNA脱甲基酶OSROS1中的突变导致增厚的阿列松和水稻颗粒中的营养价值提高。Proc Natl Acad Sci U S A. 2018; 115:11327-32。
- 21。
Ogneva ZV、Dubrovina AS、Kiselev KV。老年人DNA甲基化及甲基转移酶和脱甲基酶基因表达的年龄相关性改变拟南芥.BIOL植物。2016; 60:628-34。
- 22。
王平,高聪,边X,赵S,赵C,夏H,宋H,侯L,万S,王X。野生和栽培花生胞嘧啶-5dna甲基转移酶和脱甲基酶家族的全基因组鉴定和比较分析。前植物科学。2016;7:7.
- 23。
范思,刘H,刘继,华W,徐S,李继。油菜籽DNA甲基酶和去甲基酶基因家族的系统分析(芸苔属植物显著盐胁迫和热胁迫后的表达变化。国际分子科学杂志。2020;21:953。
- 24。
Victoria D,Aliki K,威尼斯K,Georgios M,Zoe H.胞嘧啶-5 DNA甲基转移酶和DNA脱甲基酶基因家族的空间和时间表达里纳斯市政府在种子发展和干旱胁迫期间。植物生长调节。2018; 84:81-94。
- 25。
Cao d,ju z,gao c,mei x,fu d,zhu,罗y,zhu b.胞质型鉴定细胞苷-5 dna甲基转移酶和去甲基酶茄属植物lycopersicum.基因。2014; 550:230-7。
- 26。
Zhu C,张S,周C,陈L,Fu H,Li X,Lin Y,Lai Z,Guo Y.细胞苷-5 DNA甲基转移酶和DNA脱甲基酶基因家族在茶叶植物中的基因组调查和转录分析(山茶花Sinensis.)在非生物胁迫和枯萎的加工下。peerj。2020; 8:E8432。
- 27。
Teixeira da Silva JA, Ng TB。在医学和药学上的重要性芽筋物种。应用微生物生物技术。2017;101:2227-39。
- 28。
yu z,他c,teixeira da silva ja,罗j,杨z,段J. GDP-Mannose Transioner基因(DoGMT) 从Dendrobium Officinale.甘露聚糖是植物生长发育过程中生物合成的关键物质。植物科学。2018;277:43-54。
- 29。
何超,于志,Teixeira da Silva JA,张杰,刘旭,王旭,张旭,曾生,吴坤,谭杰,马刚,罗军,段杰。Dogmp1.从Dendrobium Officinale.有助于水溶性多糖的甘露糖含量,并在盐胁迫反应中发挥作用。Sci众议员2017;7:41010。
- 30.
于卓,何超,张刚,董伟,罗军,段杰倍与水溶性多糖有关Dendrobium Officinale.具有增强的非生物胁迫耐受性。植物细胞组织器官培养。2017;131:579-99。
- 31.
关键词:低温,采后,生物活性,生物活性abstractDendrobium Officinale.茎。波萨斯匹配Biol Technol。2019; 148:97-106。
- 32.
关键词:甘油三酯,RNA-seq,转录组分析石斛兰catenatum.SCI数据。2018; 5:180252。
- 33.
闫朗,王X,刘虎,田义,莲俊,杨河,郝S,王X,杨S,李Q,齐S,李琦,齐S,施,鄂·奥克姆M,MA X,Zhang J,Ding Z,Zhang G,王某,董y,盛j。基因组Dendrobium Officinale.说明了重要的中国传统草本植物兰花的生物学。摩尔。2015;8:922-34。
- 34.
张克,徐q,卞c,蔡维克,yeh cm,刘k,yoshida k,张l,张s,陈f,shi y,su y,zhang y,chen l,yin y,林m,黄h,Deng H, Wang Z, Zhu S, Zhao X, Deng C, Niu S, Huang J, Wang M, Liu G, Yang H, Xiao X, Hsiao YY, Wu W, Chen Y, Mitsuda N, Ohme-Takagi M, Luo Y, Van de Peer Y, Liu Z. The石斛兰catenatumLindl基因组序列提供了对多糖合成酶,花卉发育和自适应演进的见解。SCI REP。2016; 6:19029。
- 35.
1-脱氧-d -木酮糖-5-磷酸合酶和1-脱氧-d -木酮糖-5-磷酸还原异构酶的克隆与表达Dendrobium Officinale..植物细胞组织器官邪教。2016;125:381-5。
- 36。
朱勇,朱玲,李丹,金强,宋聪,蔡勇,范慧,林勇DoMYC2从Dendrobium Officinale..植物细胞组织器官培养。2017;129:533-41。
- 37。
吴Z,江W,陈S,Mantri N,陶Z,江C。从基因的冷转录组和代谢组的观点Dendrobium Officinale.:冷适应过程中代谢和基因调控网络的全局重编程。植物科学与技术,2016;
- 38。
关键词:水溶性多糖,分离,结构特征,生物活性引用本文芽筋植物。生物碳水化合物膳食纤维。2013;1:31 - 47。
- 39。
Cheng CY, Krishnakumar V, Chan AP, Thibaud-Nissen F, Schobel S, Town CD. Araport11:一个完整的重新注释拟南芥参考基因组。植物j . 2017; 89:789 - 804。
- 40。
Acquadro A, Barchi L, Portis E, Mangino G, Valentino D, Mauromicale G, Lanteri S.基因组重建技术Cynara cardunculus分类群获得染色体尺寸DNA变异。SCI REP。2017; 7:5617。
- 41。
罗许H,歌J, H,张Y,李问,朱Y,徐J,李Y,歌C,王B,太阳W,沈G,张X,钱J,霁,徐Z,罗X,他L, C, C太阳,燕H,崔G,李X, X,魏J,刘J,王Y,海沃德,纳尔逊D, Ning Z,彼得斯RJ,陈七X, s .药用植物的基因组序列分析萨尔维亚米尔蒂希萨. 摩尔植物。2016;9:949–52.
- 42。
Keller TE, Yi SV。DNA甲基化和重复基因的进化。美国国家科学院学报2014;111:5932-7。
- 43。
PEI L,张L,Li J,Shen C,邱P,Tu L,张X,王M.追踪植物中甲基化相关基因的起源和演化史。BMC植物BIOL。2019; 19:307。
- 44。
GU T,Ren S,Wang Y,Han Y,Li Y. DNA甲基转移酶和去甲基酶基因的表征草莓属vesca.Mol Gen Genomics。2016; 291:1333-45。
- 45。
Ahmad F,Huang X,Lan H,Huma T,BaO Y,Huang J,张H. DNA(胞嘧啶-5)甲基转移酶家庭在水稻中的综合基因表达分析(栽培稻l .)。Genet Mol Res. 2014; 13:5159-72。
- 46。
钱y,Xi Y,Cheng B,朱S.玉米DNA甲基转移酶基因家族的基因组型鉴定及表达分析。植物细胞代表2014; 33:1661-72。
- 47。
Jeltsch A,Ehrenhofer-Murray A,Jurkowski TP,Lyko F,Reuter G,Ankri S,Nellen W,Schaefer M,Helm M.DNMT2在核酸甲基化中的机制和生物学作用。RNA Biol。2017; 14:1108-23。
- 48。
曹晓明,李国强,李国强。的角色拟南芥DRM的甲基转移酶新创DNA甲基化和基因沉默。咕咕叫医学杂志。2002;12:1138-44。
- 49。
程J,NIU Q,Zhang B,Chen K,Yang R,Zhu JK,张Y,朗Z.草莓果实中RDDM下调。基因组Biol。2018; 19:212。
- 50
龚Z,莫拉莱斯·鲁伊斯T,阿里扎·RR,罗尔丹·阿乔纳T,大卫·L,朱·JK。ROS1,基因沉默的抑制因子拟南芥,编码DNA糖基化酶/裂解酶。细胞。2002;111:803-14。
- 51.
张Xq,fischer rl,huh jh,hsieh tf。Demeter指导活性DNA去甲基化的催化核心拟南芥. 美国国家科学院学报。2019;116:17563–71.
- 52.
小野A、山口K、田中福田S、Terada R、三井T、Iida S。基因的空突变ros1a.因为水稻的DNA去甲基化不能传递给后代。植物j . 2012; 71:564 - 74。
- 53.
La H, Ding B, Mishra GP, Zhou B, Yang H, Bellizzi Mdel R, Chen S, Meyers BC, Peng Z, Zhu JK, Wang G. A 5-甲基胞嘧啶DNA糖化酶/裂解酶去甲基化逆转录转座子Tos17并促进其在水稻中的转换。美国国家科学院学报2011;108:15498-503。
- 54.
Yamaguchi-Shinozaki K,Shinozaki K.组织CIS.-在渗透和冷胁迫响应启动子中的作用调节元件。植物科学,2005;10:14 - 15。
- 55.
赛科D、王C、寿H、舒尔茨MD、奇亚伦扎S、努绍姆L、小埃克、惠兰J、李斯特R。应激诱导的基因表达驱动相邻重复元件的瞬时DNA甲基化变化。伊莱夫。2015;4:e09343。
- 56.
程明,廖文敏,郭文伟,林平。的拟南芥乙烯反应因子1通过与不同基因的结合调控非生物胁迫反应基因的表达CIS.-作用元素响应不同的应力信号。植物杂志。2013;162:1566 - 82。
- 57.
一种用于烟草组织培养的快速生长和生物测定的修正培养基。杂志。1962;15:473 - 97。
- 58.
Larkin MA、Blackshields G、Brown NP、Chenna R、McGettigan PA、McWilliam H、Valentin F、Wallace IM、Wilm A、Lopez R、Thompson JD、Gibson TJ、Higgins DG。Clustal W和Clustal X 2.0版。生物信息学。2007;23:2947–8.
- 59.
陈建平,李建平,李建平:基于遗传算法的分子进化遗传分析。《生物学报》2018;35:1547-9。
- 60。
Saitou N,Nei M.邻居加入方法:一种重建系统发育树的新方法。mol Biol Evol。1987; 4:406-25。
- 61。
Kim D, Paggi JM, Park C, Bennett C, Salzberg SL.基于图的基因组比对和HISAT2和hisat基因型的基因分型。生物科技Nat》。2019;37:907-15。
- 62。
ertea m,pertea gm,antonescu cm,chang tc,mendell jt,salzberg sl。Stringtie使得能够从RNA-SEQ读取改进转录组的重建。NAT BIOTECHNOL。2015; 33:290-5。
致谢
我们感谢实验室所有同事的帮助、建议和讨论。感谢编辑和审稿人对本稿件的评价和提出建设性意见。
资金
该研究得到了中国国家自然科学基金(Grant Numpers 32000257和31871547),广东省重点区研发项目(授予2020年2022221001)和中国的国家重点研发计划(授予2018YFD1000406)。资金机构没有参与研究设计,数据收集和分析,或准备稿件。
作者信息
隶属关系
贡献
JD和JATDS监督该项目。Zy,Jatds和JD构思了研究计划和设计的研究。ZY,GZ,CZ,CH,CS和MZ进行了研究,ML进行了生物信息学分析,ZY和JATDS分析了数据。ZY写了稿件,ZY和JATDS修订了这份手稿。所有作者都已读取并同意发布的稿件版本。通讯作者。君段。所有作者阅读并认可的终稿。
相应的作者
伦理宣言
伦理批准并同意参与
不适用。
出版许可
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1
.本研究采用引物进行RT-qPCR分析。实时反转录定量PCR (RT-qPCR)基因特异性引物采用PrimerQuest工具设计(http://www.idtdna.com/Primerquest/Home/Index).的d . officinale肌动蛋白该基因来自NCBI(GenBank登录号JX294908)。F、 前进;R、 反转
附加文件2:表S2
.基于模因结果的DoC5-MTase保守基序分布(http://meme-suite.org/)分析
附加文件3:表S3
. 基于模因分析的DodMTase保守基序分布(http://meme-suite.org/)分析
附加文件4:表S4
.11个测试物种中C5-mTase基因的信息
附加文件5:表S5
.16个被测物种的dMTase基因信息
附加文件6:表S6
.的数量CIS.的启动子区中的-元素DoMTase和DMTase.基因
附加文件7:图S1
.met1蛋白序列的序列对准D. Officinale.和A. Thaliana.
附加文件8:图S2
.CMT蛋白序列的序列比对D. Officinale.和A. Thaliana.
附加文件9:图S3
.序列比对DRM蛋白序列D. Officinale.和A. Thaliana.
附加文件10:图S4
.DNMT2蛋白序列比对D. Officinale.和A. Thaliana.
附加文件11:图S5
.DML3蛋白序列比对D. Officinale.和A. Thaliana.
附加文件12:图S6
.的ROS1蛋白序列比对D. Officinale.和A. Thaliana.
附加文件13:图S7
. 基于模因分析的DoC5酶中保守基序的分布
附加文件14:图S8
.根据模因分析结果,DodMTase中保守基序的分布
附加文件15:图S9
.的数量CIS.的启动子区中的-元素DoC5-MTase和DodMTase基因
附加文件16:图S10
. 实验方案D. Officinale.幼苗在持续干旱治疗和灌溉。绿色箭头在15:30表示灌溉时间,洋红色箭头表示实验取样时间。白色条表示光周期,黑条表示黑暗时期
附加文件17:图S11
.幼鱼WSP含量D. Officinale.茎在三个不同的发育阶段(原球茎状体,芽和小苗)。(A-C) 3个发育阶段(原球茎状体、芽状体和苗状体,分别为S1、S2和S3),分别对应萌发后2个月、4个月和10个月。(D)幼苗原球茎状体、嫩枝和植株中WSP的含量D. Officinale.茎。误差条表示三个单独实验的平均值±SD(标准偏差),并进行了3次重复。条形图上的不同字母表示在的不同阶段有显著性差异p<0.05基于Duncan的多个范围测试。DW,干重。WSP,水溶性多糖
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
玉,Z.,张,G.,Teixeira da Silva,J.A.等等。DNA甲基转移酶和脱甲基酶基因家族的基因组鉴定及分析Dendrobium Officinale.揭示其在多糖积累中的潜在作用。BMC植物BIOL.21,21(2021)。https://doi.org/10.1186/s12870-020-02811-8
收到了:
接受:
出版:
关键词
- Dendrobium Officinale.
- DNA甲基转移酶
- 压力
- 水溶性多糖