- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 出版:gydF4y2Ba
DNA甲基叶绿素和转录组的综合分析显示菠萝中凸轮光合作用的表观遗传调节gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21gydF4y2Ba,商品编号:gydF4y2Ba19gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
相比C3和C4植物,甘菊酸代谢(CAM)光合作用具有更高的水分利用效率,是一种重要的固碳途径,尤其在干旱环境中。然而,DNA甲基化在CAM光合作用调控中的作用尚未完全了解。gydF4y2Ba
结果gydF4y2Ba
在这里,我们对菠萝叶片的非光合组织(白基)和光合组织(绿梢)进行了时间DNA甲基组和转录组分析。在CG和CHG胞嘧啶序列背景下,这两种组织的DNA甲基化模式和水平大体相似。然而,在基因和转座子区域,与绿梢组织相比,白色基部叶组织的CHH甲基化在昼夜过程中降低。在不同的昼夜周期,我们在绿梢和白基之间鉴定了数千个局部差异甲基化区(dmr)。我们还发现,数千个与DMRs重叠的基因在白基和绿叶组织中的昼夜差异表达,包括一些重要的CAM通路相关基因,如beta-CA、PEPC、PPCK和MDH。gydF4y2Ba
结论gydF4y2Ba
总之,这些详细的DNA甲基组和转录组图谱提供了对DNA甲基化变化的洞察,增强了我们对DNA甲基化和CAM光合作用之间关系的理解。gydF4y2Ba
背景gydF4y2Ba
干旱是影响植物和农作物的生长和发展的最重要的非生物胁迫之一[gydF4y2Ba1gydF4y2Ba那gydF4y2Ba2gydF4y2Ba,导致大量生产损失。与C3和C4植物相比,甘菊酸代谢(Crassulacean acid metabolism, CAM)植物具有更高的水分利用效率(WUE),对干旱和半干旱地区具有更好的适应能力。gydF4y2Ba
菠萝 (gydF4y2Baananas comosus.gydF4y2Ba)是一个主要的热带作物,代表世界热带水果生产的20%以上[gydF4y2Ba3.gydF4y2Ba].菠萝水果用作新鲜和加工的产品,全球菠萝生产约为2580万公吨新鲜水果[gydF4y2Ba4.gydF4y2Ba].菠萝也是研究CAM光合作用以提高水分利用效率的模式植物。在CAM植物中,叶片的气孔在白天关闭,减少了蒸发蒸腾,但在夜间开放吸收二氧化碳(COgydF4y2Ba2gydF4y2Ba).co.gydF4y2Ba2gydF4y2Ba被吸收的苹果酸在夜间以四碳酸苹果酸的形式储存在液泡中。在白天,苹果酸可以被运输到叶绿体中并转化为一氧化碳gydF4y2Ba2gydF4y2Ba用于光合作用。公司gydF4y2Ba2gydF4y2Ba在Rubisco附近积累,降低了其加氧酶活性[gydF4y2Ba5.gydF4y2Ba].这个系统的好处是CAM植物通过在白天关闭气孔来减少水分流失,同时也提高了光合效率。CAM的机理和演化已被广泛研究[gydF4y2Ba6.gydF4y2Ba那gydF4y2Ba7.gydF4y2Ba那gydF4y2Ba8.gydF4y2Ba那gydF4y2Ba9.gydF4y2Ba那gydF4y2Ba10gydF4y2Ba].例如,许多推测参与菠萝CAM固碳模块的基因已经被鉴定出来[gydF4y2Ba6.gydF4y2Ba,它们中的许多在不同的叶组织中受到不同的调控[gydF4y2Ba11gydF4y2Ba].gydF4y2Ba
DNA甲基化是一种可遗传的表观遗传修饰,存在于大多数真核生物中,包括植物、动物和真菌[gydF4y2Ba12gydF4y2Ba那gydF4y2Ba13gydF4y2Ba]. 在contrast to animals, where DNA methylation occurs mostly at the CG cytosine sequence context, DNA methylation in plants can occur at CG and CHG (where H is A, T, or C) as well as the CHH context [14gydF4y2Ba那gydF4y2Ba15gydF4y2Ba那gydF4y2Ba16gydF4y2Ba]. 迄今为止,植物DNA甲基组研究已经探讨了甲基化在种子发育、开花期、杂种优势和基因进化中的作用[gydF4y2Ba17gydF4y2Ba那gydF4y2Ba18gydF4y2Ba那gydF4y2Ba19gydF4y2Ba那gydF4y2Ba20.gydF4y2Ba].众所周知,许多植物在不同的胁迫和环境刺激下会发生全基因组DNA甲基化变化[gydF4y2Ba2gydF4y2Ba那gydF4y2Ba21gydF4y2Ba那gydF4y2Ba22gydF4y2Ba那gydF4y2Ba23gydF4y2Ba].例如,Liang和同事发现全基因组DNA甲基化水平gydF4y2Ba杨树gydF4y2Ba在干旱胁迫下比对照条件下增加了[gydF4y2Ba24gydF4y2Ba].最近的一项水稻研究强调了3个不同品种(IR64,胁迫敏感;耐旱Nagina 22日;Pokali,耐盐性)。具体来说,我们观察到这三个品种的DNA甲基化存在巨大差异,并且发现许多差异甲基化区域与差异表达基因相关[gydF4y2Ba25gydF4y2Ba].gydF4y2Ba
在菠萝中,DNA甲基化在乙烯诱导开花过程中起着重要作用[gydF4y2Ba26gydF4y2Ba].最近完成了菠萝的基因组,并将继续促进这种物种的许多研究领域,并且目前的工作侧重于使用时间和空间甲膜和转录组分析对DNA甲基化对凸轮途径相关基因的调节障碍。绿色和白叶时间过程中DNA甲基化模式和水平的比较使我们允许我们广泛地研究CAM途径相关基因的表观遗传变异。结合RNA-SEQ数据,许多凸轮途径相关基因显示时间(Diel时间过程)和空间(绿色和白叶)表达的差异,以及与差异甲基化区域相关,特别是在CHH的环境中。总之,这些结果表明DNA甲基化在CAM途径相关基因调节中的关键作用,并对科学和农艺界进行凸轮工程的表观遗传修改的潜力提供了见解。gydF4y2Ba
结果gydF4y2Ba
DNA甲基化途径基因在菠萝基因组中是保守的gydF4y2Ba
关于植物DNA甲基化的大部分知识来自模型植物的研究gydF4y2Ba拟南芥gydF4y2Ba.随着菠萝基因组的研究,对菠萝DNA甲基化途径基因的同源性研究成为可能。鉴定菠萝的同源基因gydF4y2BaA. Thaliana.gydF4y2BaDNA甲基化途径基因,我们通过使用BLAST和HMM算法搜索菠萝的注释蛋白编码基因。基于蛋白质相似性和域保护,我们发现大多数DNA甲基化途径基因gydF4y2BaA. Thaliana.gydF4y2Ba包括MET1、CMT2、CMT3和DRM2,(表gydF4y2Ba1gydF4y2Ba). 在菠萝中也发现了参与RNA定向DNA甲基化(RdDM)途径的基因,包括AGO4、DCL3和NRPE5。RNA-seq数据被分析作为菠萝中这些基因功能的一个指标,并且所分析的大多数DNA甲基化途径基因在一个相对较高的水平上表达(平均FPKM=10.6;中位数FPKM=7.1;10 在RNA序列数据中。结果表明,菠萝DNA甲基化途径相关基因在菠萝中保留并发挥功能。gydF4y2Ba
菠萝基因组DNA甲基化的单碱基分辨图谱gydF4y2Ba
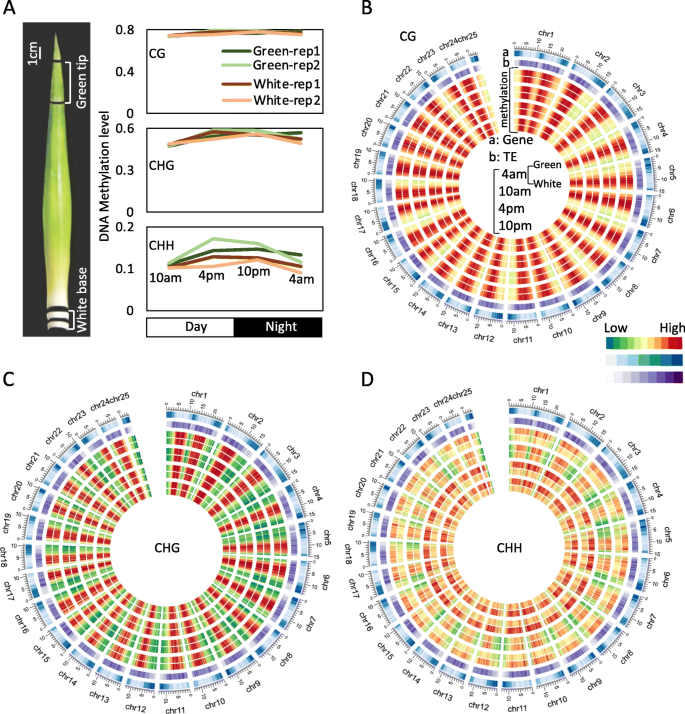
为探索菠萝光合作用(绿色尖)和非光合作用(白色基部)叶片组织之间的DNA甲基化模式,我们在上午4点(午前)、上午10点、从叶片组织的绿尖(光合作用)到白基部(非光合作用)的24小时周期的下午4点(子午后)和下午10点(非光合作用),进行了亚硫酸氢盐全基因组测序(WGBS)(图。gydF4y2Ba1gydF4y2Ba).经过对适配器序列的修剪和对低质量reads的过滤,绿色和白色组织样品在4个时间程(每个时间程有2个生物重复)中总共产生了约9.3亿对末端reads,导致参考基因组的覆盖率约为730倍(补充表)gydF4y2Ba1gydF4y2Ba).在参考基因组中大约70%的胞嘧啶被至少四个不同的重复读数覆盖(10 AM作为示例,补充图gydF4y2Ba1gydF4y2Ba).我们还观察到从叶绿体控制中未甲基化的C至T的平均亚硫酸氢盐转化率超过98.7%,并且每个样品的两个生物重复的BS-SEQ数据彼此高度相关(相关系数> 0.95)(补充表gydF4y2Ba2gydF4y2Ba).总之,我们的数据是可重复的,足以进行进一步分析。gydF4y2Ba
接下来研究了基因组CG,CHG和CHH甲基化水平,发现除了CHH甲基化之外,在不同时间的绿色尖端和白色碱基之间的基因组平均DNA甲基化水平非常相似(图。gydF4y2Ba1gydF4y2Baa).这一发现与对水稻和水稻的研究数据一致gydF4y2Ba拟南芥gydF4y2Ba,其中相同植物的不同发育阶段的平均DNA甲基化非常相似,除了高度专业化的组织,例如胚乳和花粉营养核[gydF4y2Ba17gydF4y2Ba那gydF4y2Ba27gydF4y2Ba那gydF4y2Ba28gydF4y2Ba那gydF4y2Ba29gydF4y2Ba].使用具有步骤100kb的500kb滑动窗口计算沿染色体沿染色体的甲基胞嘧啶(MC)的分布(图。gydF4y2Ba1gydF4y2BaB-D)。与其他植物中的发现一致,CG,CHG和CHH序列上下文的全局DNA甲基化曲线显示出严重甲基化的脑大分子区域(图。gydF4y2Ba1gydF4y2BaB-D)。与CG和CHG序列背景不同,不同时间的绿色尖端的CHH甲基化显着高于白色碱基中的甲基化,尤其是在脑熵区域中,其中也富集TES(图。gydF4y2Ba1gydF4y2Bad)。我们发现菠萝的MC分布与先前报告的水稻和高粱分布不同[gydF4y2Ba30.gydF4y2Ba那gydF4y2Ba31gydF4y2Ba]绿色和白色菠萝叶组织之间还存在差异(10 AM作为示例,补充图gydF4y2Ba2gydF4y2Ba). 特别是,尽管菠萝绿叶组织在所有序列背景下都表现出双峰模式,但在菠萝白叶组织、水稻和高粱中仅观察到CG和CHG的双峰模式。这种差异表明非CG甲基化,特别是CHH背景下的甲基化,在绿叶组织中比在白叶组织中更有效地维持。gydF4y2Ba
光合作用和非光合作用菠萝叶片在基因和TE区域有不同的DNA甲基化模式gydF4y2Ba
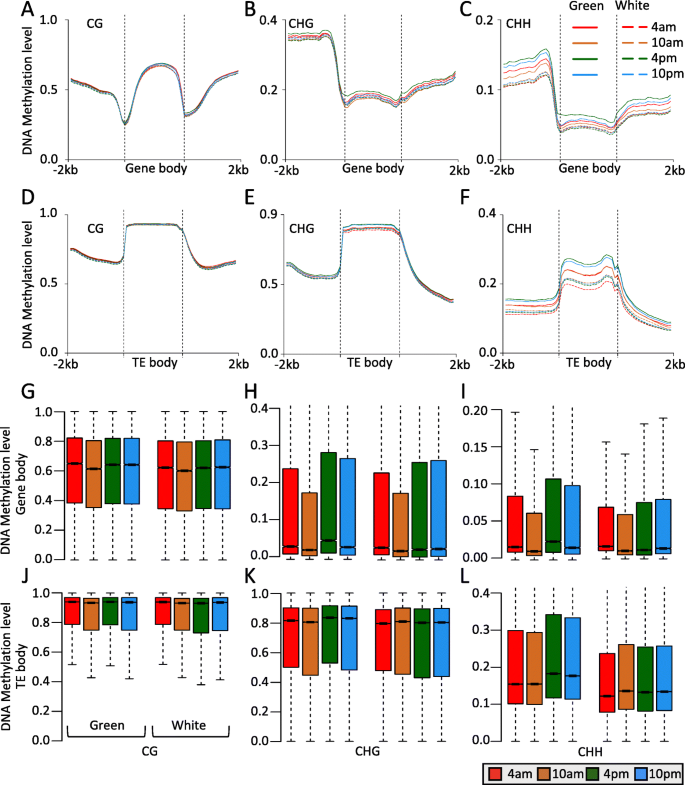
DNA甲基化在CG和CHG序列背景下的不同时间过程中的绿色尖端和白色基碱之间类似,但在CHH上下文中非常不同(图。gydF4y2Ba1gydF4y2Ba).为了探索不同基因组结构的甲基化模式,我们检测了基因和TE区域的DNA甲基化谱。与全基因组平均DNA甲基化分析一致,我们发现CG DNA甲基化在任何时候都与绿尖和白碱基相似。这种现象在基因和TE区域是一致的(图。gydF4y2Ba2gydF4y2Ba值得注意的是,在不同的时间内,非cg DNA甲基化在绿尖和白碱基上有很大的差异,尤其是CHH DNA甲基化(Fig. a和d)。gydF4y2Ba2gydF4y2Bab-c和e-f)。绿尖CHH-DNA甲基化显著高于白底CHH-DNA甲基化,并呈现时间节律性变化(甲基化在4 pm和10 pm,但在4时下降 上午10点 这可能与菠萝叶片的光合作用有关,如CAM途径。gydF4y2Ba
菠萝绿尖与白色底叶基因和转换元件区DNA甲基化模式的比较。gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2BaCG元图(gydF4y2Ba一个gydF4y2Ba),更改(gydF4y2BabgydF4y2Ba),和CHH(gydF4y2BacgydF4y2Ba)绿尖与白基部基因的甲基化。gydF4y2BadgydF4y2Ba-gydF4y2BafgydF4y2BaCG元图(gydF4y2BadgydF4y2Ba),更改(gydF4y2BaegydF4y2Ba),和CHH(gydF4y2BafgydF4y2Ba)在一天时间过程中,绿色尖和白色基之间转座因子的甲基化。gydF4y2BaggydF4y2Ba-gydF4y2Ba我gydF4y2Bacg的boxplot(gydF4y2BaggydF4y2Ba),更改(gydF4y2BahgydF4y2Ba),和CHH(gydF4y2Ba我gydF4y2Ba)绿尖与白基部基因的甲基化。gydF4y2BajgydF4y2Ba-gydF4y2BalgydF4y2Bacg的boxplot(gydF4y2BajgydF4y2Ba),更改(gydF4y2BakgydF4y2Ba),和CHH(gydF4y2BalgydF4y2Ba)绿色顶端和白色碱基间转座因子区域的昼夜甲基化gydF4y2Ba
为了进一步研究Diel DNA甲基化水平的基因和TE区域,我们专注于基因和TE体积而不是侧翼区域。从时间DNA甲基化数据中,我们将基因和TE区域的DNA甲基化水平与不同时间进行比较,并观察到基因和TE区域的昼夜甲基化变化。所有上下文DNA甲基化在清晨(10AM)中降低,并在不同时间的绿色和白叶组织的午后(4 PM)增加(图。gydF4y2Ba2gydF4y2BaG-J),除了白叶组织中TE区域的CHG和CHH DNA甲基化(图。gydF4y2Ba2gydF4y2Bak-l)。在基因的上游和下游区域也发现了类似的结果(补充图gydF4y2Ba3.gydF4y2Ba). 与基因和TE区的metaplot分析一致,我们发现绿色末端的非CG DNA甲基化高于白色碱基,尤其是CHH背景。总的来说,我们的结果表明,dieldna甲基化模式和水平的绿色和白色基地,以及CHH甲基化应该发挥关键作用,在这一昼夜循环。gydF4y2Ba
DNA甲基化与基因表达的关系gydF4y2Ba
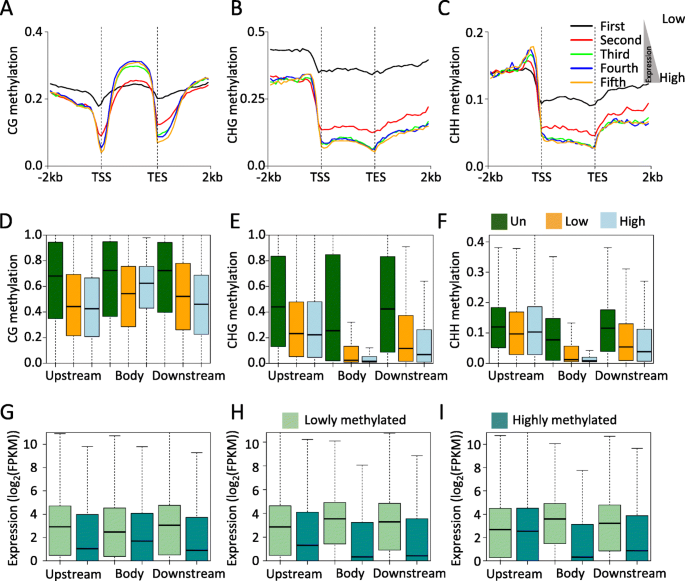
明确确定DNA甲基化与基因表达相关[gydF4y2Ba16gydF4y2Ba那gydF4y2Ba32gydF4y2Ba]. 中等表达的基因比低表达或高表达的基因有更多的甲基化,并且启动子DNA甲基化通常与基因表达负相关,除非在某些情况下它促进基因表达[gydF4y2Ba18gydF4y2Ba那gydF4y2Ba33gydF4y2Ba那gydF4y2Ba34gydF4y2Ba那gydF4y2Ba35gydF4y2Ba].为了研究菠萝叶片组织中DNA甲基化对基因表达的调控,我们初步检测了绿叶组织中所有表达基因的CG、CHG和CHH甲基化水平(以上午10点为例)。表达基因按表达水平按比例分为5组:表达量最低的基因为第一组,表达量最高的基因为第五组。与之前对其他植物物种的研究一致,中度表达的基因在CG序列上下文的基因体区域中甲基化程度最高,也就是说,在我们的研究中,第四组基因的甲基化程度最高(图。gydF4y2Ba3.gydF4y2Ba) (gydF4y2Ba16gydF4y2Ba那gydF4y2Ba18gydF4y2Ba].第一组基因的非cg甲基化程度在基因体和侧翼均最高,第二组基因的非cg甲基化程度也高于其余基因。这些数据表明,非cg甲基化在抑制基因表达中发挥作用(图。gydF4y2Ba3.gydF4y2Bac)。gydF4y2Ba
基因表达与DNA甲基化的相关性分析。gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2BaCG基因表达与DNA甲基化的比较分析(gydF4y2Ba一个gydF4y2Ba),更改(gydF4y2BabgydF4y2Ba),和CHH(gydF4y2BacgydF4y2Ba)序列上下文。gydF4y2BadgydF4y2Ba-gydF4y2BafgydF4y2BaCG差异表达基因的DNA甲基化分析(gydF4y2BadgydF4y2Ba),更改(gydF4y2BaegydF4y2Ba),和CHH(gydF4y2BafgydF4y2Ba)序列上下文。gydF4y2BaggydF4y2Ba-gydF4y2Ba我gydF4y2Ba不同甲基化基因在CG中的表达分析(gydF4y2BaggydF4y2Ba),更改(gydF4y2BahgydF4y2Ba),和CHH(gydF4y2Ba我gydF4y2Ba).显示了上游、基因体和下游区域gydF4y2Ba
我们还观察到促进剂和下游区域中的CG,CHG和CHH甲基化水平在最低表达基因中最高。为了进一步检查DNA甲基化和基因表达之间的关系,我们分析了不同遗传区域(启动子,基因体和下游区域)的三组基因(未抑制,低表达和高表达基因)的DNA甲基化水平。与未抑制的基因相比,在所有三种遗传区域的Cg,Chg和ChH甲基化差异显着降低(Mann-Whitney测试,gydF4y2BaPgydF4y2Ba-价值< 0.001)(图。gydF4y2Ba3.gydF4y2BaD-F)。另外,除了在基因体中的Cg甲基化和启动子区域中的CHH甲基化之外,低表达基因的甲基化水平显着高于不同遗传区域的高表达基因。最近在木薯的研究以及基因表达的基因体Cg甲基化也与基因体均相关[gydF4y2Ba18gydF4y2Ba]. 因此,根据目前对其它植物的分析和研究,基因体CG甲基化可能与基因表达正相关[gydF4y2Ba36gydF4y2Ba].我们接下来聚焦低于低甲基化基因,并检查它们之间的表达水平差异。类似于上述结果,低甲基化基因比高甲基化基因更高度表达,这对于除启动子CHH甲基化之外的三种遗传区域中的所有三种序列背景(Mann-Whitney测试)是一致的gydF4y2BaPgydF4y2Ba-价值< 0.001)(图。gydF4y2Ba3.gydF4y2Bag-i)。总之,这些数据表明DNA甲基化和基因表达之间的关系取决于基因区域以及胞嘧啶序列背景。gydF4y2Ba
菠萝叶片Diel-DNA甲基化的调控gydF4y2Ba
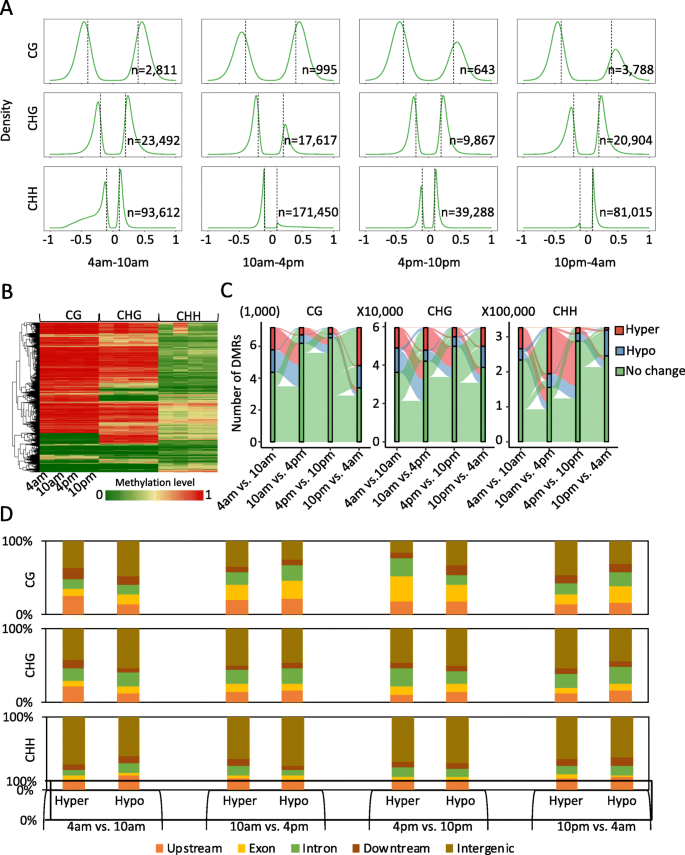
全基因组DNA甲基化水平和模式在绿色叶尖组织和白色基部叶组织相似。为了研究光合叶片组织的diel-DNA甲基化模式,我们首先使用100bp窗口计算每个序列背景下的平均加权DNA甲基化水平[gydF4y2Ba37gydF4y2Ba],并识别出绿叶组织不同日变化过程中甲基化水平显著不同的区域(以下简称差异甲基化区域,DMRs)。连续时间比较,我们发现CHH型差异甲基化区数量最多,CHG型次之,CG型次之。这也意味着CHH甲基化在调控绿叶组织昼夜节律中的作用比CG和CHG甲基化更重要。gydF4y2Ba4.gydF4y2Baa).此外,我们发现CHH DNA甲基化变化在一天中上午10时至下午4时最大,与上午10时相比,下午4时表现为高甲基化。为了进一步研究三种不同序列上下文(CG、CHG和CHH)中DNA甲基化变化之间的相关性,我们比较了不同序列上下文的DMRs,发现DMRs在三种序列上下文中没有重叠。例如,上午10点CHH的高甲基化区域不一定在CG和CHG序列背景下高甲基化。gydF4y2Ba4.gydF4y2Bab) ;这些CHH高甲基化区域 am在其他时间变成低甲基化区或无甲基化改变区。这种现象在CG和CHG甲基化中也是一致的(图。gydF4y2Ba4.gydF4y2BaC)。此发现与不同DIEL期间的绿色尖端和白色基底或白色基座之间的DMRS比较一致(补充图gydF4y2Ba4.gydF4y2Ba). 我们的分析表明,DNA甲基化变化是不同时期绿梢的动态变化,可能在这一昼夜循环中起着重要作用,特别是在CHH背景下。gydF4y2Ba
接下来,我们研究了DNA甲基化在整个时间过程中发生变化的区域的基因组特征。我们检测了基因启动子(转录起始位点上游2 kb)、外显子、内含子、基因下游区域和基因间区域的DMRs重叠程度。虽然差异的DNA甲基化发生在许多位置,我们发现大多数DMRs富集在基因间区域。此外,不同时间过程的不同比较,dmr富集区域也有很大差异(图5)。gydF4y2Ba4.gydF4y2Bad)。例如,除了非基因区域中的DMRS之外,DMR最富集在迄今为如4A至10:00至10点之间的促进剂区域,而外显子最富集在下午4点至晚上10点。该结果与DMRS的上述比较分析一致,其显示在DIEL时间过程中的绿色尖端中DNA甲基化的动态变化。gydF4y2Ba
DMR相关差异表达基因的表征gydF4y2Ba
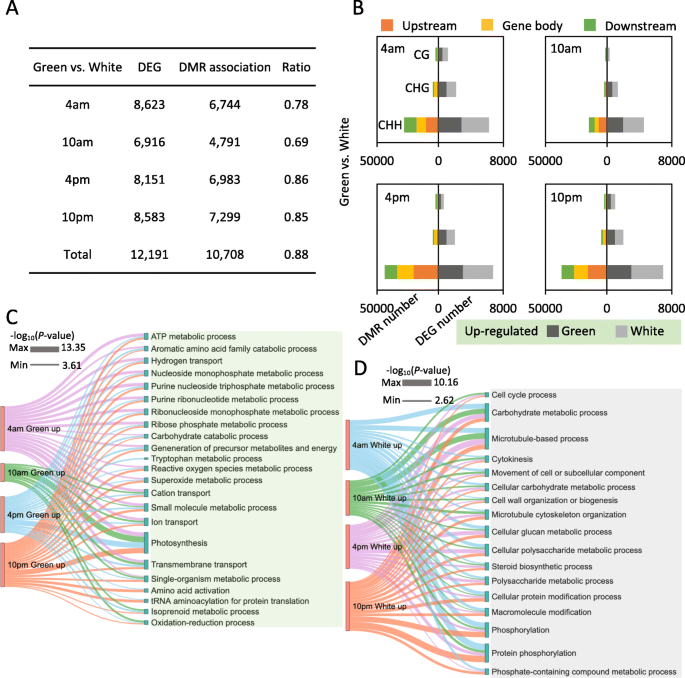
为了研究DNA甲基化差异对菠萝叶组织基因表达差异的影响,我们为DNA甲基化分析中使用的相同组织生成了RNA-seq文库,并鉴定了差异表达基因(DEG)(补充表gydF4y2Ba3.gydF4y2Ba). 我们还将我们的转录组数据与之前研究的转录组数据进行了比较,发现我们的数据具有高度的可重复性,并且彼此一致(补充图1)gydF4y2Ba5.gydF4y2Ba那gydF4y2Ba6.gydF4y2Ba].我们首先专注于绿色尖端和白色基地之间不同DIEL时间课程的差异表达基因。在不同时间阶段鉴定大约12,191次,并且在4m(8623)时鉴定了最差异表达的基因,最少在10m(6916)(图6916)(图。gydF4y2Ba5.gydF4y2Baa).对于这些deg,我们发现大量的deg与差异甲基化区域(DMRs)有关。例如,12191个DEGs中有10708个(87.8%,10708个)与DMRs重叠,其中大部分是chh型DMRs(图1)。gydF4y2Ba5.gydF4y2Bab) 是的。这一结果与绿尖和白底一致(补充图gydF4y2Ba6.gydF4y2Ba及补充图gydF4y2Ba7.gydF4y2Ba).结果表明,大量基因跨越Diel时间过程差异表达,并且Diel DNA甲基化变化对于菠萝叶的这种转录动态至关重要。gydF4y2Ba
我们将DMR相关基因定义为在上游2000bp或下游2000bp区域或基因体内与DMR重叠的基因。不同时间在绿尖、白基和绿尖与白基和对比中分别鉴定出5778、2710和10708个dmr相关的deg。了解dmr相关DEGs在菠萝叶日期组织中的关键作用。我们对绿尖和白基部不同时期的dmr相关DEGs进行了基因本体论(GO)术语富集分析。对于绿尖与白基和dmr相关的deg比较,我们将这些基因分为绿尖上调基因和白基和上调基因,分别进行GO分类分析。结果表明,这两组基因具有非常不同的功能类别。绿尖中DMR相关上调的DEGs在光合作用、跨膜和离子转运途径中显著富集(图1)。gydF4y2Ba5.gydF4y2Bac).相反,白基中DMR相关上调的DEGs在蛋白磷酸化、碳水化合物代谢和微管基础过程中富集(图)。gydF4y2Ba5.gydF4y2Bad)。gydF4y2Ba
对于不同时期绿尖中dmr相关的DEGs,涉及跨膜运输、光合作用、光收获、离子稳态过程的基因高度富集(补充图)gydF4y2Ba6.gydF4y2Ba).对于白色碱基中dmr相关的DEGs,氧化石墨烯功能分析显示与光合作用、氧化还原过程和碳水化合物代谢过程相关的基因富集(补充图)gydF4y2Ba7.gydF4y2Ba).我们的数据表明DNA甲基化改变调节绿色和白色叶片组织之间的基因表达差,并且可能参与调节凸轮光合作用过程的源极汇关系。gydF4y2Ba
DNA甲基化调节CAM途径相关基因gydF4y2Ba
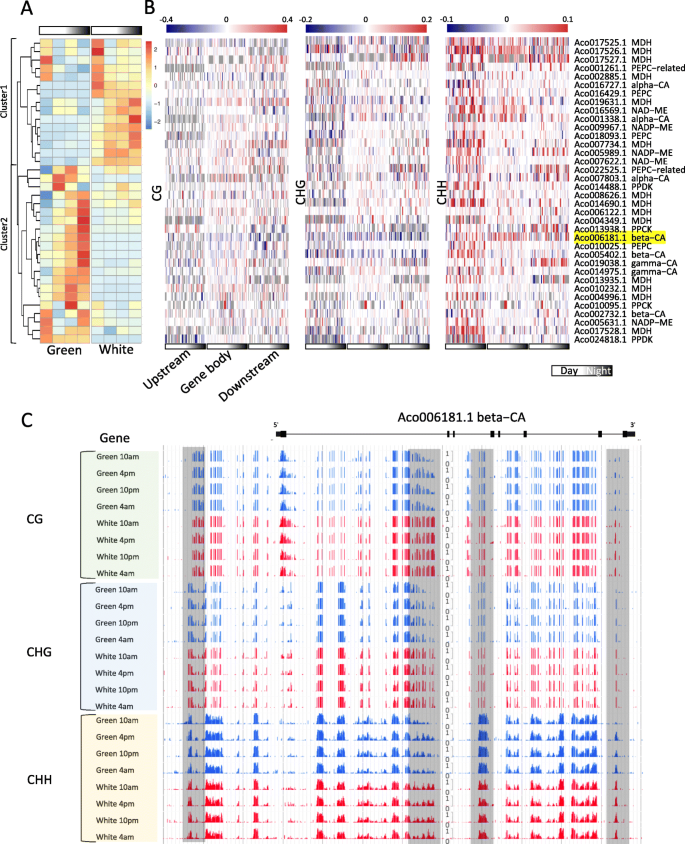
因为dmr相关DEGs的GO分析表明,在光合作用、光信号、碳水化合物代谢过程和跨膜转运途径中发挥主要调控作用的基因富集(图)。gydF4y2Ba5.gydF4y2Ba,补充图6和补充图gydF4y2Ba7.gydF4y2Ba),接下来我们将关注已知在CAM途径中发挥关键作用的基因。前期研究通过同源搜索和表达谱分析,确定有38个基因参与菠萝CAM过程的固碳模块[gydF4y2Ba6.gydF4y2Ba].我们发现,大部分在不同日龄的绿色和白色叶片组织中有差异表达,并分为两个簇。簇2基因在绿尖呈节律性表达,而在白色基部低表达;簇1基因在白基部呈节律性表达,而在绿尖呈节律性表达。gydF4y2Ba6.gydF4y2Baa).这些CAM基因大部分是不同日期绿叶和白叶组织之间的dmr相关DEGs,包括碳酸酐酶(CA)、磷酸烯醇式丙酮酸羧化酶(PEPC)、苹果酸脱氢酶(MDH)、磷酸烯醇式丙酮酸羧化酶激酶(PPCK)和丙酮酸正磷酸盐二烷基化酶(PPDK)(图)。gydF4y2Ba6.gydF4y2Bab,补充表gydF4y2Ba4.gydF4y2Ba),其中大部分也已通过我们的qRT-PCR验证(补充图)gydF4y2Ba8.gydF4y2Ba和补充表gydF4y2Ba5.gydF4y2Ba).CA基因负责CAM光合作用中的二氧化碳固定。在光合绿色尖端中高度表达了三种β-CA和两个γ-CA基因,但在非光合白碱基中略微表达。以前的研究表明,只有β-CA基因只能是碳固定的主要蛋白质,而不是其他CA基因。在本研究中,我们鉴定了跨越基因体和所有三种β-CA基因的侧翼区域的大量CHH型DMR。例如,我们鉴定了位于ACO006181.1(β-CA)基因体区域中的几个DMRS,并且与白色碱相比,这些区域在不同DIEL时期的绿色尖端中表现出降低的DNA甲基化(图。gydF4y2Ba6.gydF4y2Bac) 是的。我们推测这些DMRs可能与绿尖和白基之间β-CAs基因表达的差异有关。gydF4y2Ba
此外,我们还发现,参与CAM相关途径的许多基因由DNA甲基化进行调节,例如运输术,糖酵解和葡糖生成。研究了几种基因是菠萝的候选物,以将真空蔗糖水解为己糖,并在早期或晚发期显示峰表达,例如ACO023030.1,ACO023036.1和ACO017533.1。所有这三个菌酸转化酶基因家族的成员显示了Diel表达模式和相关的绿色尖端和白色基底之间的许多DMR(补充表gydF4y2Ba7.gydF4y2Ba). Aco005379.1是液泡己糖输出者的候选基因,先前在绿色组织中高表达,但没有表现出明显的昼夜循环[gydF4y2Ba11gydF4y2Ba]. 但我们发现该基因在绿色叶尖高表达,在夜间表达高峰(10) 下午)。在Aco005379.1的基因体和侧翼区域共有56个DMRs,其中大部分是CHH型DMRs(补充图1)gydF4y2Ba9.gydF4y2Ba,补充表格gydF4y2Ba6.gydF4y2Ba).gydF4y2Ba
在菠萝基因组中,有九种酶参与糖酵解和糖异生。所有这九种酶在绿色尖端的表达量都高于在白色基部的表达量[gydF4y2Ba11gydF4y2Ba]绿色叶尖有节律性表达,白色叶尖有节律性表达。但监管机制仍不清楚。我们发现这9种酶都与许多dmr重叠。例如,Aco024971.1(磷酸三糖异构酶)基因体和侧翼区域有30个DMR(补充表)gydF4y2Ba7.gydF4y2Ba).许多研究表明,昼夜节奏相关基因和编码基因的一些转录因子在光合途径中发挥基本作用。我们还分析了在二极管时间期间的绿色和白色组织之间的菠萝昼夜性相关基因和疯子箱转录因子基因的表达变化,发现它们的许多表达是通过DNA甲基化的变化来调节(补充表gydF4y2Ba8.gydF4y2Ba和gydF4y2Ba9.gydF4y2Ba) [gydF4y2Ba38gydF4y2Ba那gydF4y2Ba39gydF4y2Ba].综上所述,大量参与cam相关通路的基因受到DNA甲基化的调控。gydF4y2Ba
讨论gydF4y2Ba
在本研究中,我们制作了菠萝叶组织的时间和空间全基因组单碱基分辨率DNA甲基组图谱和转录组图谱,极大地增强和补充了CAM通路研究的知识。比较光合绿叶组织和非光合白基叶组织的甲基化水平,发现CG和CHG甲基化在全球范围内没有显著差异,但在不同的昼夜过程中,白基叶组织的CHH甲基化显著低于绿叶组织。除了大量的DMRs位于基因间区域外,我们还发现许多DMRs与基因体和侧翼区域重叠。以往的研究表明,启动子甲基化往往与下游基因的抑制有关,但对基因体DNA甲基化的作用仍存在争议。然而,最近的研究表明,基因体DNA甲基化可以改变基因的表达[gydF4y2Ba40gydF4y2Ba].在菠萝叶片的二极管时间过程中存在明显的动态局部DNA甲基化变化。我们假设绿色尖端或白色碱叶组织中的动态DNA甲基化变化应与凸轮相关途径有关。通过在不同Diel时间过程中的绿色和白色菠萝中的模拟Diel DNA甲基化模式,我们能够识别与凸轮光合途径相关的差分甲基化变化。通过组合DNA甲基化数据和转录组数据,我们可以鉴定大量DMR相关的DEG,其通常富集在凸轮周期的几个重要生物途径中,例如光合作用,照明收获,碳水化合物代谢,转运蛋白和蛋白质磷酸化。菠萝基因组(Alpha-Ca,Beta-Ca和Gamma-Ca)中有三个Ca基因系列,但只有β-CAS在绿色尖端高度表示,并且显示Diel表达模式[gydF4y2Ba6.gydF4y2Ba].我们发现菠萝基因组中的3种β - ca在绿色顶端和白色基底组织中均有不同的表达,并与许多DMRs,特别是CHH背景相关。gydF4y2Ba
目前许多有关CAM途径的研究都集中在CAM途径相关基因的进化和转录组分析上[gydF4y2Ba7.gydF4y2Ba那gydF4y2Ba11gydF4y2Ba]. 在gydF4y2BaGuzmania monostachia,gydF4y2Ba人们发现叶尖上调基因主要集中在气孔运动、色氨酸代谢过程、叶绿素合成过程和天冬氨酸代谢过程的调控。然而,叶基的上调基因主要与水分缺乏、淀粉和蔗糖代谢过程有关[gydF4y2Ba41.gydF4y2Ba]. 这些结果与我们的发现一致,表明核心CAM相关基因以及诱导型和组成型CAM植物之间的步骤是相似的。gydF4y2Ba
凤梨叶被描述为具有从顶端到基部的形态生理梯度[gydF4y2Ba42.gydF4y2Ba那gydF4y2Ba43.gydF4y2Ba那gydF4y2Ba44.gydF4y2Ba]. 在一个dd我tion, previous studies of leaf segment RNA-seq data in pineapple, rice, and maize all suggest that fructose transporter (SWEET17) plays an essential role in exporting fructose from leaf sheath. They proposed that leaf tip and base within the same pineapple leaf play the role of sink and source cycle [11gydF4y2Ba]. 在our transcriptome data, we found that many genes involved in sucrose transporter, hexose transporter, glycolysis and gluconeogenesis were also associated with different methylation divergence, such as Aco005379.1, Aco023036.1, Aco005368.1 and Aco024987.1. We believed that DNA methylation plays a critical role of sink and source cycles daily between leaf tip and base by regulating the expression level of these transporters encoding genes. Gene duplication and expansion was initially proposed to be the driven force for the evolution of the CAM pathway [45.gydF4y2Ba].然而,它仍然是争议的,许多研究表明,应该通过CAM相关基因的差异表达而不是基因剂量来演变凸轮途径[gydF4y2Ba7.gydF4y2Ba那gydF4y2Ba10gydF4y2Ba那gydF4y2Ba11gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
DNA甲基化已长期被认为是基因表达调控,重复元素沉默的机制,并对植物发育和应力反应起着关键作用。在这里,我们展示了在菠萝叶凸轮循环期间的空间和时间DNA甲基化和转录组变化。我们的结果强烈表明,许多关键凸轮调节基因的转录调节涉及DNA甲基化,并为其他作物改善提供凸轮工程的表观遗传识别。gydF4y2Ba
方法gydF4y2Ba
植物材料,图书馆建设和排序gydF4y2Ba
在本研究中,植物材料gydF4y2Baananas comosus.gydF4y2Bavar。gydF4y2BaComosus.gydF4y2Ba品种MD-2从广西农业科学院获得(22.84)gydF4y2Ba。gydF4y2Ba108.48 N,gydF4y2Ba。gydF4y2BaE).植物材料的鉴定由GAAS进行,原始植物从Del Monte公司获得(gydF4y2Bawww.delmonte.comgydF4y2Ba).该凭证标本保存于中国福建农林大学植物保护学院植物标本室。从菠萝D叶的两个区域(绿色尖和白色基部)中提取DNA (gydF4y2Baananas comosus.gydF4y2Bavar。gydF4y2BaComosus.gydF4y2Ba使用Qiagen DNeasy植物迷你试剂盒和BS-SEQ文库使用Truseq纳米DNA LT试剂盒(Illumina)制备品种MD-2),如前所述[gydF4y2Ba32gydF4y2Ba].对于每种组织类型,对应于两个生物重复的两个文库在Hiseq x十系统(Illumina)上测序,以获得每个制造商的指令的配对端150-BP读数。gydF4y2Ba
从用于BS-SEQ文库的相同组织中提取总RNA,并且每种制造商的指示(Illumina)使用具有PolyA mRNA选择的Truseq制备试剂盒制备RNA-SEQ文库。汇集了三个库(仅用于10个AM样本的图书馆)并测序,以获得Illumina Hiseq x十系统的配对端150-BP。gydF4y2Ba
BS-SEQ数据分析gydF4y2Ba
对于每一个BS-seq数据的生物复制,使用Trimmomatic对亚硫酸氢盐转换的reads进行裁剪,并使用BSMAP v2.90对菠萝参照基因组进行比对[gydF4y2Ba46.gydF4y2Ba].每100bp读取长度允许四个不匹配,只保留唯一映射的读数以进一步分析。使用来自叶绿体基因组的平均DNA甲基化水平估计转化率。使用非重叠100-BP窗口的平均DNA甲基化水平计算两个生物重复之间的相关性,以及gydF4y2Ba和()gydF4y2Ba在R软件中的功能(gydF4y2Bawww.r-project.orggydF4y2Ba). 使用三个独立区域的平均加权DNA甲基化水平生成基因和TE区域的Metaplots:上游区域(100 bp bin大小)、基因体(20个比例bin)和下游区域(100 bp bin大小)。差异甲基化区(DMRs)是由DMRcaller测定的,DMRcaller是一种多功能的R/生物导体[gydF4y2Ba47.gydF4y2Ba].gydF4y2Ba
RNA序列数据分析gydF4y2Ba
RNA-SEQ通过Trimmomatic修剪RNA-SEQ读数,并通过HISAT2 V2.1.0对准菠萝参考基因组[gydF4y2Ba48.gydF4y2Ba使用默认参数,并且只保留唯一的映射读取。使用StringTie v1.3.3b对表达值进行量化[gydF4y2Ba48.gydF4y2Ba]作为FPKM(每百万百百万映射读数的碎片)。DESEQ2 V1.22.2用默认参数鉴定差异表达基因(DEG)[gydF4y2Ba49.gydF4y2Ba]. 射线M的RNA序列数据。等人(2015年)从NCBI生物项目PRJNA305042下载,仅在4 上午10点 上午4点 pm和10 考虑pm时间点进行比较。目前工作中的相同RNA序列分析管道是在这些公共数据集上进行的,即FPKM> 以0.5为表达量,进行热图和Pearson相关系数分析。gydF4y2Ba
中存在的验证gydF4y2Ba
采用RNA提取试剂盒(中国上海欧米茄生物科技有限公司)从“D”叶片中提取用于实时PCR分析的总RNA,该试剂盒与BS-seq和RNA-seq分析处于同一阶段。收集同一片叶的叶尖绿色组织和叶基白色组织,于上午10:00、下午4时、下午10时和上午4时用液氮快速冷冻,如图所示。gydF4y2Ba1gydF4y2Ba显示。将这些样品储存在-80°C冰箱中,直至总RNA提取。用无核酸酶的水稀释总RNA。根据供应商的说明,使用M-MLV逆转录酶(Promega)将1μg纯化的总RNA逆转录成25μL反应体积的cDNA。QRT-PCR反应与定量试剂盒(Trans,北京,中国)进行,程序:95°C为30秒;40次95℃的循环5秒,60°C为30秒;95°C 15秒。对于每个条件,进行三种技术复制和至少三种独立的生物重复。PCR引物列于补充表中gydF4y2Ba5.gydF4y2Ba.gydF4y2Ba
去浓缩分析gydF4y2Ba
DMR相关基因的GO富集是通过使用OmicShare工具(数据分析的免费在线平台)进行的(gydF4y2Bawww.omicshare.com/toolsgydF4y2Ba)具有超高度测试。只有术语gydF4y2BaPgydF4y2Ba- 尺寸小于0.01用于进一步分析。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本文报告的数据保存在基因表达综合数据库(GEO)中(登录号GSE120401)。gydF4y2Ba
缩写gydF4y2Ba
- CAM:gydF4y2Ba
-
景天酸代谢gydF4y2Ba
- RdDM公司:gydF4y2Ba
-
RNA定向DNA甲基化gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- WGBS:gydF4y2Ba
-
亚硫酸氢盐全基因组测序gydF4y2Ba
- FPKM:gydF4y2Ba
-
每千碱基每百万次读取的片段gydF4y2Ba
- DMRs公司:gydF4y2Ba
-
DNA甲基化区域gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
工具书类gydF4y2Ba
- 1.gydF4y2Ba
王伟士,潘亚杰,赵晓琴,Dwivedi D,朱丽华,Ali J,傅斌,李泽坤。干旱诱导水稻位点特异性DNA甲基化及其与抗旱性的关系实验机器人。2011;62(6):1951-60。gydF4y2Ba
- 2.gydF4y2Ba
Yong Villalobos L、Gonzalez Morales SI、Wrobel K、Gutierrez Alanis D、Cervantes Perez SA、Hayano Kanashiro C、Oropeza Aburto A、Cruz Ramirez A、Martinez O、Herrera Estrella L。甲基组分析揭示了表观遗传变化在调控拟南芥对磷饥饿反应中的重要作用。美国国家科学院学报。2015;112(52):E7293–302。gydF4y2Ba
- 3.gydF4y2Ba
Coveca。Comision Veracruzana de Comercializacion Agropecuaria。México:Gobierno del Estado de Veracruz;2002年。gydF4y2Ba
- 4.gydF4y2Ba
统计人员:gydF4y2Bahttps://www.statista.com/statistics/298505/global-pineapple-production/gydF4y2Ba. 2016gydF4y2Ba
- 5。gydF4y2Ba
Cushman JC。Crassulacean酸性代谢。对干旱环境的塑料光合适应。植物理性。2001; 127(4):1439-48。gydF4y2Ba
- 6。gydF4y2Ba
Ming R,VanBuren R,Wai CM,Tang H,Schatz MC,Bowers JE,Lyons E,Wang ML,Chen J,Biggers E等。菠萝基因组与CAM光合作用的进化。纳特·吉内特。2015;47(12):1435–42.gydF4y2Ba
- 7。gydF4y2Ba
张玲,陈飞,张国强,张永强,牛森,熊金生,林志,程志明,刘志军。通过比较转录组学和碳固定途径的基因组学揭示兰科植物丙戌酸代谢的起源和机制。植物j . 2016; 86(2): 175 - 85。gydF4y2Ba
- 8。gydF4y2Ba
Chomthong M,Griffiths H。促进景天酸代谢系统整合的模型方法。植物J。2020;101(4):951–63.gydF4y2Ba
- 9gydF4y2Ba
白奕,戴×,李奕,王莉,李伟,刘奕,程奕,秦奕。菠萝叶片中景天酸代谢(CAM)光合途径lncRNAs的鉴定与特性研究。Sci代表,2019年;9(1):6658.gydF4y2Ba
- 10.gydF4y2Ba
陈莉、辛妍、魏灿、刘杰、明瑞。顺式元素在景天酸代谢和光合作用进化中的作用。园艺研究,2020年;7:5.gydF4y2Ba
- 11.gydF4y2Ba
Wai CM,VanBuren R,Zhang J,Huang L,Miao W,Edger PP,Yim WC,Prist HD,Meyers BC,Mockler T,等.菠萝CAM光合作用的时空转录组学和microRNA动态。植物J。2017;92(1):19–30.gydF4y2Ba
- 12.gydF4y2Ba
法律Ja,Jacobsen SE。建立,维持和修饰植物和动物的DNA甲基化模式。NAT Rev Genet。2010; 11(3):204-20。gydF4y2Ba
- 13.gydF4y2Ba
Chan SW,Henderson IR,Jacobsen SE。园艺该基因组:拟南芥中的DNA甲基化。NAT Rev Genet。2005; 6(5):351-60。gydF4y2Ba
- 14.gydF4y2Ba
Cokus SJ,Feng S,Zhang X,Chen Z,Merriman B,Haudenschild CD,Pradhan S,Nelson SF,Pellegrini M,Jacobsen SE。rapgun拟南芥基因组的血硫酸盐测序显示DNA甲基化图案。自然。2008; 452(7184):215-9。gydF4y2Ba
- 15.gydF4y2Ba
Feng S, Cokus SJ, Zhang X, Chen PY, Bostick M, Goll MG, Hetzel J, Jain J, Strauss SH, Halpern ME,等。植物与动物甲基化模式的保存与分化。中国科学:地球科学;2010;gydF4y2Ba
- 16。gydF4y2Ba
Zhang X,Yazaki J,Sundaresan A,Cokus S,Chan SW,Chen H,Henderson IR,Shinn P,Pellegrini M,Jacobsen SE等.拟南芥DNA甲基化的全基因组高分辨定位和功能分析。牢房。2006;126(6):1189–201.gydF4y2Ba
- 17。gydF4y2Ba
在水稻胚乳中,局部DNA甲基化激活基因。美国国家科学研究院学报2010;gydF4y2Ba
- 18。gydF4y2Ba
王H,贝恩G,翟J,冯S,法尔格伦N,泰勒NJ,巴特R,卡灵顿JC,雅各布森SE,奥辛I。木薯CG基因体DNA甲基化变化及重复基因的进化。美国国家科学院学报。2015;112(44):13729–34.gydF4y2Ba
- 19。gydF4y2Ba
Lin JY, Le BH, Chen M, Henry KF, Hur J, Hsieh TF, Chen PY, Pelletier JM, Pellegrini M, Fischer RL, et al. .大豆和拟南芥种子甲基化的相似性和非cg甲基化的缺失不影响种子发育。美国国家自然科学学报2017;114(45):E9730-9。gydF4y2Ba
- 20.gydF4y2Ba
兰斯·克,Wardenaar R,Oka R,Van Hulten Mha,Guryev V,Keurentjes JJB,STAM M,Johannes F.父母DNA甲基化状态与表观遗传杂交种中的杂种物有关。植物理性。2018; 176(2):1627-45。gydF4y2Ba
- 21.gydF4y2Ba
Secco D,Wang C,Shou H,Schultz MD,Chiarenza S,Nussaume L,Ocker Jr,Whelan J,Hister R.应激诱导基因表达驱动相邻重复元件的瞬时DNA甲基化变化。Elife。2015; 4。gydF4y2Ba
- 22.gydF4y2Ba
徐R,王Y,郑H,Lu W,Wu C,Huang J,Yan K,杨G,Zheng C.盐诱导的转录因子MyB74由拟南芥中的RNA定向的DNA甲基化途径调节。J Exp Bot。2015; 66(19):5997-6008。gydF4y2Ba
- 23.gydF4y2Ba
关键词:农药,甲基化,水稻,基因表达,甲基化Sci众议员2016;6:18985。gydF4y2Ba
- 24.gydF4y2Ba
梁丹,张震,吴华,黄超,帅平,叶春英,唐松,王勇,杨磊,王杰,等。Single-base-resolution methylomes的gydF4y2Ba杨树trichocarpagydF4y2Ba揭示DNA甲基化和干旱胁迫之间的关联。BMC Genet。2014; 15(4):S9。gydF4y2Ba
- 25.gydF4y2Ba
关键词:水稻,甲基化,干旱,盐胁迫,基因表达Sci众议员2015;5:14922。gydF4y2Ba
- 26.gydF4y2Ba
王杰、李兹、雷敏、傅毅、赵杰、敖敏、徐莉。DNA甲基组和转录组的整合分析揭示了菠萝乙烯诱导开花的途径基因。Sci代表2017;7(1):17167.gydF4y2Ba
- 27。gydF4y2Ba
Seymour DK,Koenig D,Hagmann J,Becker C,Weigel D. DNA甲基化模式的演变在基因组组织中的差异驱动。Plos Genet。2014; 10(11):E1004785。gydF4y2Ba
- 28。gydF4y2Ba
Walker J,Gao H,张J,Aldridge B,Vickers M,Higgins JD,Feng X.性谱系特异性DNA甲基化调节拟南芥的MeIosis。NAT Genet。2018; 50(1):130-7。gydF4y2Ba
- 29。gydF4y2Ba
Kawakatsu T,Nery JR,Castanon R,Ecker JR.种子发育和萌发过程中的动态DNA甲基化重构。基因组生物学。2017;18(1):171.gydF4y2Ba
- 30gydF4y2Ba
李X,朱茹,胡f,ge s,ye m,xiang h,张g,zheng x,张h,张s等人。植物基因表达中DNA甲基化的栽培和野生水稻静脉内甲状腺素和调节作用的单基分辨率图。BMC基因组学。2012年; 13:300。gydF4y2Ba
- 31gydF4y2Ba
Turco GM, Kajala K, Kunde-Ramamoorthy G, Ngan CY, Olson A, Deshphande S, Tolkunov D, Waring B, Stelpflug S, Klein P,等。高粱DNA甲基化与血管化相关的基因表达调控。新植物学家。214(3): 1213 - 2017; 29。gydF4y2Ba
- 32.gydF4y2Ba
王丽、谢杰、胡杰、兰乙、游丙、李芙、王梓、王赫。比较表观基因组学揭示了马铃薯和番茄中重复基因的进化。植物J。2018;93(3):460–71.gydF4y2Ba
- 33.gydF4y2Ba
张H,郎Z,朱JK。植物DNA甲基化的动态和功能。Nat Rev Mol细胞生物学。2018;19(8):489–506.gydF4y2Ba
- 34.gydF4y2Ba
雷敏,张浩,朱建荣,唐凯,谢松,朱家康。拟南芥DNA甲基化与活性去甲基化之间的调控联系。国家自然科学基金资助项目:国家自然科学基金资助项目。gydF4y2Ba
- 35.gydF4y2Ba
郎忠,王勇,唐凯,唐丹,达森卡,程杰,张勇,韩达AK,朱家康。DNA去甲基化在番茄果实成熟诱导基因激活和成熟抑制基因抑制中的关键作用美国国家科学研究院2017;114(22):E4511-9。gydF4y2Ba
- 36.gydF4y2Ba
Takuno S, Seymour DK, Gaut BS。拟南芥物种间基因体甲基化转移的orthologis进化动态。中国生物医学工程学报。2017;34(6):1479-91。gydF4y2Ba
- 37.gydF4y2Ba
Schultz MD,Schmitz RJ,Ocker Jr。“平整”用于分析单基分辨率DNA甲基胚间的竞争范畴。趋势类型。2012; 28(12):583-5。gydF4y2Ba
- 38.gydF4y2Ba
关键词:菠萝,MADS-box,开花基因网络,日表达BMC基因组学。2020;21(1):1 - 16。gydF4y2Ba
- 39。gydF4y2Ba
沙姆达A,Wai Cm,Ming R,Yu Q.基因组注释和全局转录组分析显示菠萝的昼夜循环转录因子。基因组Biol Evol。2017; 9(9):2170-90。gydF4y2Ba
- 40。gydF4y2Ba
基因体甲基化可改变基因表达,是癌症治疗的靶点之一。癌细胞。2014;(4):577 - 90。gydF4y2Ba
- 41gydF4y2Ba
Mercier H, Rodrigues MA, Andrade S, Coutinho LL, Gobara BNK, Matiz A, Mioto PT, Goncalves AZ. C3-CAM凤梨的叶片转录谱。《公共科学图书馆•综合》。2019;14 (10):e0224429。gydF4y2Ba
- 42gydF4y2Ba
Pikart Fc,马拉贝西马,Mioto Pt,Goncalves Az,Matiz A,Alves FRR,Mervier H,Aidar MPM。弱凸轮在水资源赤字下溴尿剂量的光合代谢活动的贡献。植物理性生物化学。2018; 123:297-303。gydF4y2Ba
- 43gydF4y2Ba
关键词:盆栽凤梨,氮代谢,空间分布,功能分区植物生理学杂志。2011;gydF4y2Ba
- 44.gydF4y2Ba
铵离子通过增加苹果酸转运和抗氧化能力,增强了单穗古生代(Guzmania monostachias) CAM光合作用,并抵消了干旱效应。实验机器人。2018;69(8):1993-2003。gydF4y2Ba
- 45.gydF4y2Ba
蔡杰,刘×,范内斯特K,Proost S,蔡卫科,刘克伟,陈立杰,何Y,徐Q,卞C,等。蝴蝶兰基因组序列分析。纳特·吉内特。2015;47(1):65–72.gydF4y2Ba
- 46.gydF4y2Ba
Xi Y,Li W. BSMAP:全基因组二硫酸突序列映射程序。BMC生物素。2009; 10:232。gydF4y2Ba
- 47.gydF4y2Ba
Catoni M, Tsang JM, Greco AP, Zabet NR. DMRcaller:一种多功能的R/生物导体包,用于检测和显示CpG和非CpG环境中的差异甲基化区域。核酸研究。2018;46(19):e114。gydF4y2Ba
- 48.gydF4y2Ba
Pertea M, Kim D, Pertea GM, Leek JT, Salzberg SL.转录水平的RNA-seq实验与HISAT, StringTie和Ballgown。Nat Protoc。2016;11(9):1650 - 67。gydF4y2Ba
- 49.gydF4y2Ba
DESeq2对RNA-seq数据的fold change和dispersion的调节估计。基因组医学杂志。2014;15(12):550。gydF4y2Ba
致谢gydF4y2Ba
我们感谢实验室成员和同事提出的意见和讨论。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了福建省自然科学基金(2018年J06006)的支持,到了中国国家自然科学基金的H.W(No.U1605212至Y.Q.,以及31701874至X.Z.)。福建省大学新世纪优秀人才的优秀青年人才和计划计划,福建省卓越青年基金和杰出的青年学者到H.W.资金机构对数据的设计和数据的设计没有影响,以及编写稿件的研究和收集,分析和解释。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
H.W.构思了这个项目并设计了研究;H.W.和Y.Q.设计了实验;Y.S.和H.W.进行甲基化分析;Y.S, X.Z, X.C.和M.Y.进行了转录组和DNA甲基组分析;Y.S.和H.Z.进行CAM分析;M.Y.和x.c收集了组织。H.W.写了这篇论文。所有作者均已阅读并批准稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
所有的作者都同意了手稿。gydF4y2Ba
利益争夺gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商说明gydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.“创作共用公共领域”豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条提供的数据,除非信用额度中另有规定。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
史,Y.,张,X.,常,X。gydF4y2Baet al。gydF4y2BaDNA甲基族和转录组的综合分析显示菠萝中凸轮光合作用的表观遗传调节。gydF4y2BaBMC植物BIOL.gydF4y2Ba21,gydF4y2Ba19(2021)。https://doi.org/10.1186/s12870-020-02814-5gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
公认gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02814-5gydF4y2Ba
关键字gydF4y2Ba
- 表观遗传学gydF4y2Ba
- DNA甲基化gydF4y2Ba
- 转录组gydF4y2Ba
- ananas comosus.gydF4y2Ba
- 光合作用gydF4y2Ba