- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
在强光胁迫下,蛋白酶体抑制迅速加剧光抑制并阻碍恢复gydF4y2Ba衣藻reinhardtiigydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba, 文章编号:gydF4y2Ba22gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
蛋白酶体去除真核细胞中的调节蛋白,并控制多种植物过程。蛋白酶体定位于细胞质和细胞核,但它们在植物生物学中的作用最近已经扩展到叶绿体,在那里它调节TOC复合物。这是控制核编码的叶绿体蛋白的输入,它重塑了叶绿体蛋白质组,促进了适当的发育转变。蛋白酶体对TOC复合物的调节也可以缓解产生活性氧的应激源。这些最新的进展促使我们确定蛋白酶体抑制是否能迅速改变由强光诱导的光抑制引起的光合作用过程。gydF4y2Ba
结果gydF4y2Ba
在光胁迫下测定了蛋白酶体抑制对光系统II的短期影响gydF4y2Ba衣藻reinhardtiigydF4y2Ba,它允许对叶绿素荧光和细胞活力进行双重监测。在低光下48小时后,蛋白酶体抑制不影响活力或光学化学,但细胞浓度降低和细胞体积增加。两小时的高光应力损害了蛋白酶体抑制细胞中的照相系统II的效率,如通过FV / FM的降低和电子传输速率所确定的。蛋白酶体抑制细胞中的升高的光抑制不是由细胞活力或叶绿素含量的降低引起的。从光抑制的恢复恢复在Mg132处理的细胞中,并抑制了重建培养的生长。蛋白酶体抑制降低了Novo蛋白质合成,这可能限制了重塑蛋白质组的能力,从而阻碍了调整到高光应力的能力。gydF4y2Ba
结论gydF4y2Ba
蛋白酶体参与保护光系统II免受光抑制。除了强光胁迫,其他的胁迫源——包括金属、干旱和盐——也会在叶绿体中产生活性氧。因此,植物蛋白酶体的维持可能有助于在非生物胁迫下保护光合作用,从而在不利条件下提高作物产量。gydF4y2Ba
背景gydF4y2Ba
植物的最佳发育和增长取决于它们在环境限制期间调整光合作用的能力。植物 - 包括盐,重金属或干旱产生的各种细胞室内的反应性氧(ROS)遇到的威胁,包括叶绿体[gydF4y2Ba1gydF4y2Ba].高光(HL)胁迫还会产生ROS,使叶绿体的抗氧化能力受到抑制,从而导致光化学作用减弱,这一过程被称为光抑制[gydF4y2Ba2gydF4y2Ba].光化学的减少限制了作物的产量,并可以决定植物在具有挑战性的环境中生存的能力。gydF4y2Ba
在HL胁迫下,光系统(PS) II和PSI都产生ROS。超氧化物能破坏主要在PSI中发现的蛋白质中的铁硫簇[gydF4y2Ba3.gydF4y2Ba和铁氧还蛋白[gydF4y2Ba4.gydF4y2Ba].然而,与PSI相比,PSII更容易受到光抑制,包括单线态氧和超氧化物的产生[gydF4y2Ba5.gydF4y2Ba].为了对抗光抑制的有害影响,叶绿体在HL胁迫过程中可以进行各种调节;PSII中有充分记录的变化包括天线尺寸减小、PSII反应核心中受损D1蛋白的修复、非光化学猝灭和类囊体解堆积[gydF4y2Ba6.gydF4y2Ba].除了PSII的改变外,叶绿体的有效应激反应也需要蛋白质组重构。由于约90%的叶绿体蛋白是核编码的,应激时质体蛋白组的调节需要通过TIC/TOC从胞质中适当输入前体蛋白(gydF4y2BatgydF4y2BaRanslocon在呢gydF4y2BaogydF4y2Ba表示“外部的/gydF4y2Ba我gydF4y2Ba神经网络的gydF4y2BacgydF4y2Ba氯骨质蛋白复合物[gydF4y2Ba7.gydF4y2Ba].gydF4y2Ba
在细胞水平上,应激诱导的蛋白质组调节由转录重编程和蛋白质降解共同控制[gydF4y2Ba8.gydF4y2Ba].选择性蛋白质降解由泛素-蛋白酶体途径(UPS)控制[gydF4y2Ba9.gydF4y2Ba].在此过程中,靶蛋白被标记蛋白泛素,需要E1泛素激活酶、E2结合酶和E3泛素连接酶的协同作用;总的来说,这种翻译后修饰将泛素化蛋白递送到位于细胞核或细胞质中的蛋白水解蛋白酶体。蛋白酶体去除控制各种细胞过程,包括细胞分裂的短期调节蛋白[gydF4y2Ba10gydF4y2Ba,营养摄取[gydF4y2Ba11gydF4y2Ba,微管组装[gydF4y2Ba12gydF4y2Ba(Wang et al., 2011),以及调节光形态建成和应激反应的激素信号[gydF4y2Ba13gydF4y2Ba那gydF4y2Ba14gydF4y2Ba].此外,蛋白酶体去除应激导致的受损(如氧化或错误折叠)蛋白质,包括蛋白质中硒半胱氨酸的错误结合[gydF4y2Ba15gydF4y2Ba].然而,严重的应激可以降低植物中的蛋白酶体活性,例如盐[gydF4y2Ba12gydF4y2Ba那gydF4y2Ba16gydF4y2Ba]重金属,以及强光强度[gydF4y2Ba17gydF4y2Ba].在哺乳动物系统中观察到,蛋白酶体损伤可能源于应激诱导的ROS积累[gydF4y2Ba18gydF4y2Ba]和chlamydomonas [gydF4y2Ba19gydF4y2Ba].gydF4y2Ba
即使叶绿体不包含蛋白酶体,UPS仍然牵涉到塑化过程。最近,E3连接酶SP1被发现定位于叶绿体外膜[gydF4y2Ba20.gydF4y2Ba它控制着TOC蛋白的泛素化机制。SP1突变的拟南芥在发育和衰老的早期阶段改变了类囊体的堆积和叶绿体的生物发生,这可以解释为TOC复合物不能适当地控制发育过渡过程中所需蛋白质的输入。SP1突变也降低叶绿素含量,从黑暗转移到连续的光。此外,SP1还在非生物胁迫中维持叶绿体蛋白组平衡中发挥作用[gydF4y2Ba21gydF4y2Ba].过表达SP1的拟南芥增强了对产生ROS的应激源的耐受性,包括百草枯,它通过在叶绿体中产生超氧化物来诱导光抑制。SP1突变体的压力加剧,这可以解释为他们不能减少TOC复合体;随后在应激过程中无法调节蛋白质输入,导致ROS在质体中积累,增加对盐和百草枯的敏感性。然而,高光胁迫无法在SP1水平改变的植物中产生表型。gydF4y2Ba
蛋白酶体还介导了由应激诱导的ROS积累导致的受损叶绿体的清除。在此过程中,胞质E3连接酶PUB4标记损伤叶绿体[gydF4y2Ba22gydF4y2Ba在一个被称为噬菌的过程中被除去。与野生型拟南芥相比,拟南芥具有较强的抗逆性gydF4y2Bapub4gydF4y2Ba在控制条件下突变体的叶绿体较多,在强光下表现出明显的生长阻滞。gydF4y2Ba
总的来说,这些最新的进展已经开始揭示蛋白酶体在胁迫或发育转变中优化叶绿体过程中的作用。蛋白酶体装配突变的拟南芥在持续光照下发育迟缓[gydF4y2Ba23gydF4y2Ba,并且现在已经提出了可以解释这些观察结果的机制。由于蛋白酶体抑制引起的多效性效应,界定蛋白酶体如何影响植物化学仍然是一个挑战。例如,在产生单线态氧的光胁迫下,蛋白酶体是否能抵抗光抑制的有害影响尚不清楚。然而,潜在地暗示了蛋白酶体在光胁迫中的参与,gydF4y2Ba衣藻gydF4y2Ba中性红光敏剂处理产生单线态氧,并在2小时内增加14个编码蛋白酶体亚基的转录本[gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
本研究的目的是确定在蛋白酶体抑制下PSII的光合效率是否发生改变gydF4y2BaChlamydomonas Reinhartdtii.gydF4y2Ba通过高光应力挑战的细胞。我们试图在降低生存能力或叶绿素含量之前发生蛋白酶体抑制细胞中加剧的光抑制。本研究的另一个目的是确定PsII是否延迟了蛋白酶体抑制细胞中的PSII恢复,如果这会改变群体的后续生长。本研究揭示了蛋白酶在光抑制期间实现最佳光合效率的作用,我们讨论了如何将该数据集成到更广泛的植物应激生理学理解中。gydF4y2Ba
结果gydF4y2Ba
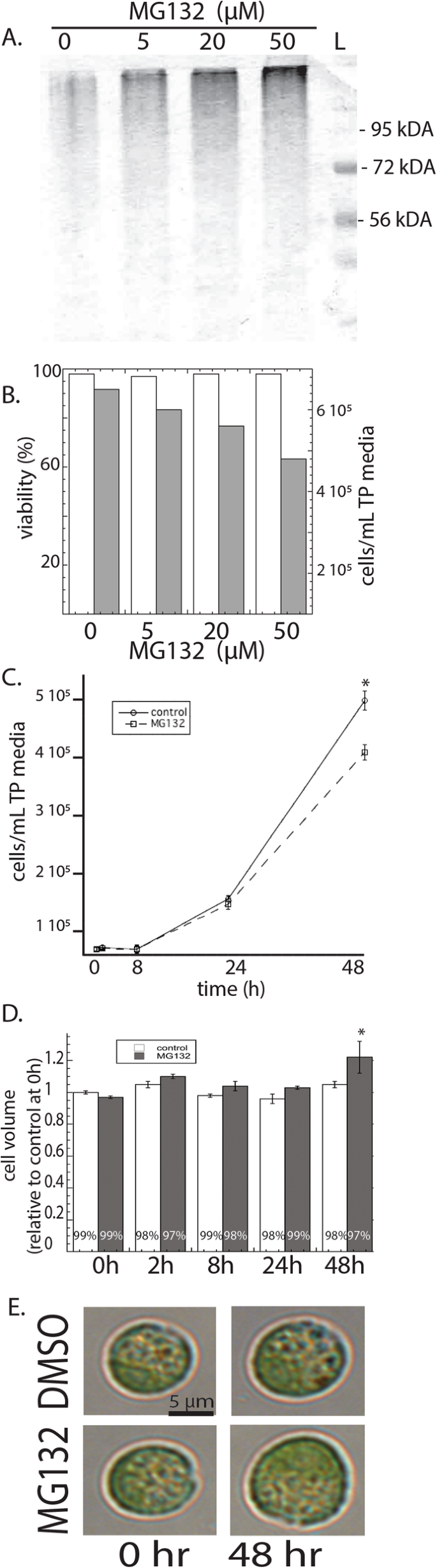
我们最初希望确定蛋白酶体抑制剂MG132对衣原体生长的影响,以确定它是有毒的。文化(10.gydF4y2Ba5.gydF4y2Ba细胞毫升gydF4y2Ba−1gydF4y2Ba)分别用0、5、20和100 μM MG132处理2 d。泛素化蛋白以剂量依赖的方式在mg132处理的细胞中积累,显示了蛋白酶体抑制剂的有效性(图)。gydF4y2Ba1gydF4y2Baa).蛋白酶体抑制不影响细胞活力,但降低细胞分裂率(图1)。gydF4y2Ba1gydF4y2Bab).后续实验均使用20 μM MG132,因为该浓度对蛋白酶体有充分的抑制作用,且48 h后细胞分裂不明显减少。进一步分析表明,20 μM MG132在8或24 h后没有改变种群生长(图2)。gydF4y2Ba1gydF4y2BaC)。在48小时,Mg132降低细胞浓度,但与未处理的细胞相比,平均细胞体积增加20%(图。gydF4y2Ba1gydF4y2Bad, e)。gydF4y2Ba
蛋白酶体抑制剂MG132对衣藻的影响。gydF4y2Ba一个gydF4y2Ba在SDS-PAGE电泳对48小时后,0,5,20和50μmmg132的效果对48小时后的泛素蛋白水平进行评估。gydF4y2BabgydF4y2Ba用20μmmg132处理的衣原体为48小时,通过流式细胞细胞测定点活力和细胞浓度。白色和黑色柱分别代表左轴和右轴的可行性和细胞浓度。gydF4y2BacgydF4y2Ba在不同时间点(0、8、24和48 h)测定20 μM MG132对衣原体培养细胞浓度的影响。gydF4y2BadgydF4y2Ba测定20 μM MG132处理和未处理细胞在不同时间点的细胞体积。gydF4y2BaegydF4y2Ba20μmmg132对细胞体积的影响;将细胞与mg132一起生长48小时,然后使用光学显微镜进行成像。显示的是五种复制培养的手段和标准误差,其代表另外两种实验重复。星号表示显著差异(gydF4y2BapgydF4y2Ba< 0.05)。L-ladder kDA——kilodaltongydF4y2Ba
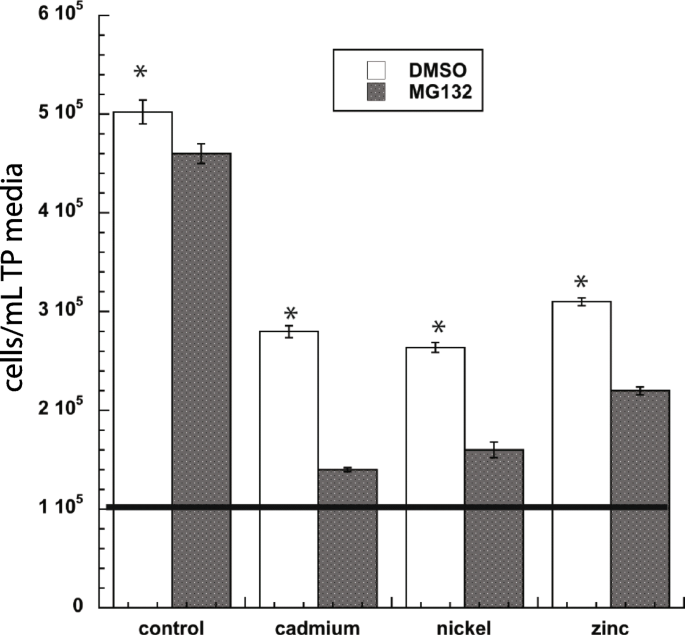
来证明蛋白酶体抑制在gydF4y2Ba衣藻gydF4y2Ba在含有或不含MG132的应激源的刺激下,细胞生长2小时,然后用镍、镉或锌处理2天。通过细胞浓度的降低,蛋白酶体抑制大大增加了对金属的敏感性(图)。gydF4y2Ba2gydF4y2Ba).然而,这些金属已知能诱导定位于细胞质、叶绿体和线粒体的ROS,从而阻碍除光合作用外的各种代谢过程。因此,没有对PS II效率进行分析。gydF4y2Ba
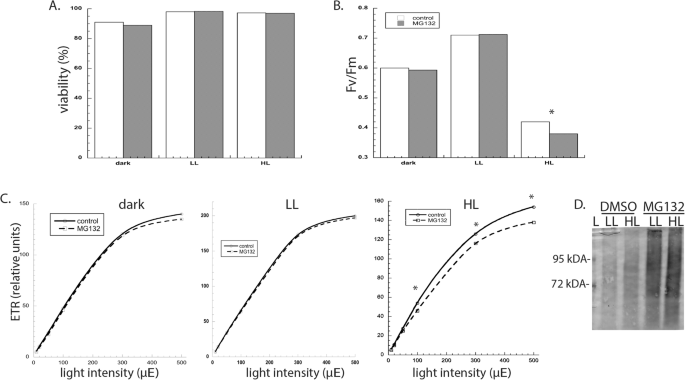
相反,我们专注于理解蛋白酶体抑制对具有不同光长的细胞中的蛋白酶体抑制的短期影响。将培养物+/-Mg132在L1中,然后在黑暗和低光(L1)中转移24小时,或高光(HL)2小时。尽管与LL条件相比,暗处理降低细胞浓度,但Mg132处理在任何条件下都不会拮抗细胞存活,因为活力范围为97至99%(图。gydF4y2Ba3.gydF4y2Baa).在24 h的黑暗或低温条件下,蛋白酶体抑制并不影响Fv/Fm值,Fv/Fm值是衡量光系统II中光化学反应效率的指标;此外,不同光强下的电子传递率(ETR)没有差异(图)。gydF4y2Ba3.gydF4y2Ba公元前)。相比之下,Mg132治疗加剧了光燃烧的影响。HL的生长减少了两小时后细胞中的FV / FM和ETR。Western印迹分析证实,在此时间框架(4小时)期间累积的泛素蛋白质水平,从而证实了MG132效力;泛染蛋白的水平不受HL的影响(图。gydF4y2Ba3.gydF4y2Bad)。gydF4y2Ba
蛋白酶体抑制对(gydF4y2Ba一个gydF4y2Ba) 可行性,gydF4y2BabgydF4y2BaPSII的最大光化学效率(Fv/Fm)gydF4y2BacgydF4y2Ba衣藻细胞在三种不同光照条件下生长的ETR。在黑暗或弱光条件下生长的藻类测量48小时,在强光条件下生长的藻类测量2小时。gydF4y2BadgydF4y2Ba在低光和强光下培养4 h,观察20 μM MG132对细胞的影响。图中显示的是5个重复培养的平均值和标准误差,这代表了至少5个其他实验重复的叶绿素荧光测量和2个实验重复的流式细胞术测量。误差棒太小,无法绘制。星号表示显著差异(gydF4y2BapgydF4y2Ba< 0.05)。L-ladder;LL -低光;HL -高亮度;ETR:电子传递速率gydF4y2Ba
最佳光合效率与叶绿素含量密切相关。本研究的目的是确定受蛋白酶体抑制的细胞在HL 2小时内Fv/Fm值的下降是否独立于叶绿素含量的变化。如预期的那样,与在LL中生长的细胞相比,HL降低了叶绿素a和b,但不影响叶绿素a:b比值(表2)gydF4y2Ba1gydF4y2Ba).然而,4小时的蛋白酶体抑制没有改变叶绿素含量生长在LL或HL。此外,在不同条件下的培养中,存活率没有改变。mg132处理的细胞蛋白质含量增加;由于蛋白酶体介导的蛋白质水解被抑制,这一结果是预料之中的。gydF4y2Ba
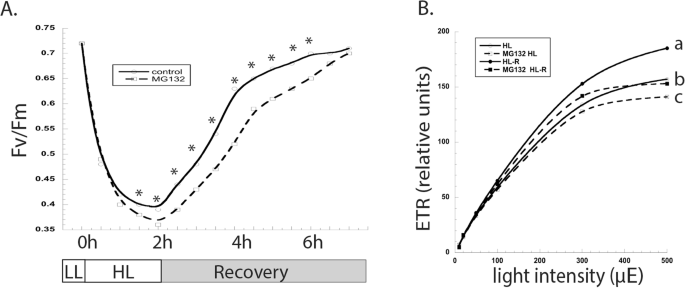
接下来,我们假设蛋白酶体抑制会改变细胞从光抑制中恢复的能力。将细胞在L1下或不含Mg132的2小时生长,然后对HL或2小时进行另外2小时;这是在黑暗中恢复。与Mg132处理的细胞相比,FV / FM值在未处理的细胞中更快地回收(图。gydF4y2Ba4.gydF4y2Ba一种)。在恢复5小时后,两种培养物之间的FV / FM值相同。尽管恢复了FV / FM值,但光线曲线显示,蛋白酶体抑制衰减在高光强度下的电子传输速率的回收率(图。gydF4y2Ba4.gydF4y2Bab)。gydF4y2Ba
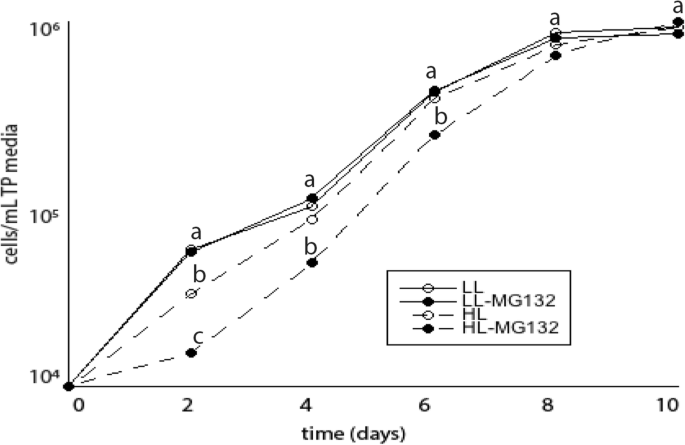
鉴于FV / FM值最终可以在用Mg132处理的照片抑制细胞中恢复,我们假设蛋白酶体抑制细胞中的短期照片对细胞群具有更长的术语后果。为了解决这个问题,将未处理和处理的培养物暴露于L1或HL两小时,将该点细胞转移到N型新鲜TP培养基中,没有Mg132并在L1上生长。4天后,与未处理的细胞相比,抑制蛋白酶体抑制细胞中的群体抑制细胞较慢(图。gydF4y2Ba5.gydF4y2Ba).然而,8天后,细胞浓度在不同培养物之间没有差异。gydF4y2Ba
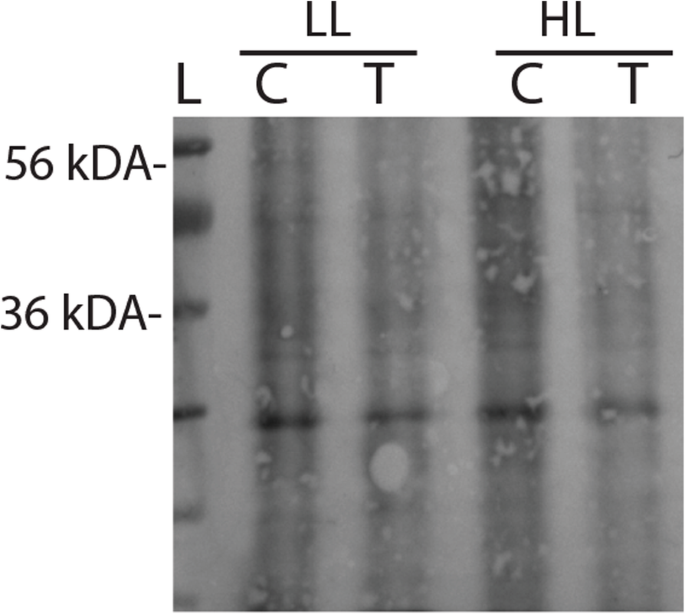
我们的最后一个目标是确定为什么蛋白酶体受抑制的细胞在高光照射2小时后表现出光合作用减少。对衣藻蛋白酶体的分析没有发现在拟南芥中发现SP1同源物,gydF4y2Ba大豆gydF4y2Ba那gydF4y2Ba奥雅萨苜蓿gydF4y2Ba和苔藓gydF4y2BaPhyscomitrella金属盘gydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。然而,在拟南芥中抑制蛋白酶体已经被证明会减少氨基酸库并抑制蛋白质合成[gydF4y2Ba25gydF4y2Ba].我们假设,在光胁迫下,蛋白质合成的减少可能导致PSII活性的降低,因此测量了蛋白质合成gydF4y2Ba衣幕gydF4y2Ba.Mg132治疗降低了De Novo蛋白的合成,从嘌呤霉素化蛋白的降低估计(图。gydF4y2Ba6.gydF4y2Ba).然而,蛋白质合成不受轻微处理的影响。gydF4y2Ba
讨论gydF4y2Ba
最近在高等植物中发现的E3连接酶可以调节叶绿体蛋白的输入和受损叶绿体的降解,揭示了蛋白酶体和叶绿体之间的新关系;这些进展可能有助于解释为什么在蛋白酶体组装中含有突变的拟南芥植物此前被报道对强光敏感[gydF4y2Ba23gydF4y2Ba].这些发现开辟了叶绿体生物学的新方向,并促使我们确定蛋白酶体抑制是否改变了光抑制过程中的光合作用。我们的数据表明,MG132引起的蛋白酶体抑制加剧了光抑制,并抑制了细胞从强光胁迫中恢复的能力。据我们所知,我们的研究首次报道了蛋白酶体活性与PSII在光抑制过程中的保护之间的直接联系。gydF4y2Ba
与高等植物相比,以衣藻为模型研究蛋白酶体抑制是否影响光抑制具有优势。因为蛋白酶体在无数的过程中发挥作用,它的损伤有许多长期的细胞后果,我们试图通过使用一个模型来避免在光合细胞中快速吸收MG132,其生存能力可以被跟踪。此外,我们能够在蛋白酶体被抑制后不久测量叶绿素荧光和活力在同一样品中。有趣的是,蛋白酶体抑制48 h后,细胞大小增加,这与之前报道MG132处理的拟南芥根细胞大小增加的结果一致[gydF4y2Ba26gydF4y2Ba].gydF4y2Ba
我们专注于蛋白酶体抑制在HL挑战的细胞中的短期分支实验。通过Fv/Fm和电子传输速率的降低,蛋白酶体抑制2小时后,HL损伤光系统II 2小时。此外,与未受蛋白酶体抑制的细胞相比,受蛋白酶体抑制的细胞从光抑制中恢复需要更长的时间。MG132处理4 h后对存活率和叶绿素含量没有影响;因此,使用衣藻可以让我们确定光化学的差异不是细胞死亡或叶绿素浓度变化的结果。此外,与高等植物相比,衣藻只有一个叶绿体;因此,我们可以进一步排除mg132处理后细胞的光抑制增加是由于叶绿体减少或无法去除受损的叶绿体的结果。考虑到MG132如何迅速降低Fv/Fm,我们直接将蛋白酶体抑制细胞中光抑制的增加归因于叶绿体过程的损伤;然而,我们不能排除多效效应可能导致mg132处理的细胞对HL的敏感性。gydF4y2Ba
虽然我们的实验揭示了蛋白酶体保护藻类免受光抑制的破坏作用,但一个精确的机制尚不清楚。衣藻蛋白组未发现SP1或PUB4同源物;Arabdopsis中的这些E3连接酶[gydF4y2Ba20.gydF4y2Ba那gydF4y2Ba22gydF4y2Ba]和其他高等植物分别调节叶绿体的进口或受损叶绿体的去除。由于蛋白酶体介导应激期间的转录重编程,包括激素信号,因此在MG132处理的细胞中观察到的光抑制增加可能是细胞无法正确应对应激的更广泛后果[gydF4y2Ba13gydF4y2Ba那gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
也有可能是蛋白酶体抑制干扰了光抑制后的叶绿体蛋白质组重构。蛋白酶体抑制降低氨基酸水平,可迅速(2-5小时)减少拟南芥植物的蛋白质合成[gydF4y2Ba27gydF4y2Ba那gydF4y2Ba25gydF4y2Ba)、酵母和动物细胞系[gydF4y2Ba28gydF4y2Ba].尽管光抑制损伤了光系统II和细胞色素b6f复合物中的许多蛋白质,但其中大多数是叶绿体编码的蛋白质(如D1和PetD),可以迅速被替换[gydF4y2Ba5.gydF4y2Ba].替代PSII受损成分的能力,如D1,可以改善光抑制的效果。例如,具有Deg1突变的拟南芥(Deg1是去除受损D1的蛋白酶)易受HL光抑制增强的影响[gydF4y2Ba27gydF4y2Ba].gydF4y2Ba
可以降低Mg132中的蛋白质合成限制Psii中修复核编码蛋白的能力?HL期间对核编码PSII蛋白(例如PSB蛋白O-S)的损害较小,因此与PSII中的塑体编码蛋白相比,周转速度慢[gydF4y2Ba5.gydF4y2Ba].但是,对这些蛋白质的损害确实发生,并且降低了PSBO,PSBQ和PSBR扰动PSII效率的水平[gydF4y2Ba29gydF4y2Ba那gydF4y2Ba30.gydF4y2Ba].在烟草,gydF4y2Ba假单胞菌gydF4y2Ba感染降低了PsbO的水平,这归因于观察到的ROS的增加[gydF4y2Ba31gydF4y2Ba].PSBO蛋白是氧不变复合物的组分,该蛋白质的水平与在压力期间PSII活性的增加相关,例如冷治疗[gydF4y2Ba32gydF4y2Ba].有趣的是,gydF4y2Ba假单胞菌gydF4y2Ba还释放可直接抑制蛋白酶的效应分子[gydF4y2Ba33gydF4y2Ba].因此,这种联系揭示了蛋白酶体抑制和光抑制之间可能的联系。我们的实验并没有揭示蛋白酶体抑制是否改变质体中的蛋白质合成,或仅限于胞质。然而,由蛋白酶体抑制引起的胞质蛋白合成的急剧减少可能会阻止或限制核蛋白(如PsbO、铁氧还蛋白、gydF4y2Ba等gydF4y2Ba)在胁迫后被导入叶绿体。gydF4y2Ba
众所周知,在高等植物中,蛋白酶体可以保护植物免受各种应激源(包括许多重金属)引起的有害影响。以前已知蛋白酶体损伤加重硒中毒gydF4y2Ba衣藻gydF4y2Ba[gydF4y2Ba19gydF4y2Ba,现在可以扩展到重金属和高光压力。在mg132处理的细胞中2h HL降低了细胞浓度,4天后在缺乏蛋白酶体抑制剂的TP培养基中恢复;这种长期影响可能是由蛋白酶体抑制的细胞无法有效地从光抑制和未展开的蛋白质反应中恢复来解释的[gydF4y2Ba34gydF4y2Ba源自于错误折叠蛋白质的积累。gydF4y2Ba
环境压力源可导致ROS积累,包括过氧化物,可直接损害蛋白酶体活动[gydF4y2Ba18gydF4y2Ba].越来越多的证据表明,蛋白酶体活性下降在严重的非生物胁迫。亚硒酸盐胁迫8 h后,衣藻的蛋白酶体活性下降近2倍;这与活性氧的积累有关[gydF4y2Ba19gydF4y2Ba].高等植物在盐胁迫下也表现出蛋白酶体活性的下降[gydF4y2Ba12gydF4y2Ba]和重金属[gydF4y2Ba16gydF4y2Ba].在此背景下,如果非生物胁迫降低了植物的蛋白酶体活性,则会加剧光抑制。在逆境中维持蛋白酶体的活性可能使植物从光抑制中更快地恢复。gydF4y2Ba
结论gydF4y2Ba
本研究旨在验证蛋白酶体参与保护植物免受光抑制损伤的假设。使用gydF4y2Ba衣藻gydF4y2Ba作为一个模型,我们证明了蛋白酶体抑制在生存力或叶绿素含量变化之前加剧了光抑制。因此,我们得出结论,这些数据支持蛋白酶体在改善光抑制中发挥作用的假设。由于其他不利条件——盐、干旱和金属——可以产生ROS,我们还得出结论,植物在逆境中的最佳蛋白酶体活性可能会缓解光抑制,最终提高作物产量。gydF4y2Ba
方法gydF4y2Ba
生长条件gydF4y2Ba
衣藻reinhardtiigydF4y2Ba(野生型菌株CC-1690)是从衣原体资源中心(Minnesota,Mn,USA大学)获得的,并在低照明下缺乏碳源的三磷酸盐(TP)培养基(20μE; 16 h/8 h light dark cycle) and shaking (150 rpm) at 24 °C. pH was monitored every 2–3 days and adjusted if necessary to pH 7–7.3. Unless otherwise stated, all experiments used cells grown in TP media containing either 0.1%(v/v) dimethyl sulfoxide (DMSO) (control).
或20μM溶解在0.1%DMSO中的Mg132。gydF4y2Ba
细胞活力和浓度测定gydF4y2Ba
根据制造商的协议(Umaripore,USA),使用藻类计数和活力套件进行细胞活力和浓度的估计。使用Muse®流式细胞仪(Millipore,USA)分析与活性探针混合的细胞。使用来自五种单独的培养物的技术重复性测定可行性,并进行两种后续实验重复以确保一致性。gydF4y2Ba
蛋白酶体抑制对细胞活力的影响gydF4y2Ba
在不同的时间点,监测蛋白酶体抑制剂MG132对细胞活力和浓度的影响,最高可达48 h。在初始浓度为10gydF4y2Ba5.gydF4y2Ba细胞毫升gydF4y2Ba−1gydF4y2Ba含0、5、20和100 μM MG132的TP介质。除特别说明外,所有后续实验均使用浓度为20 μM的MG132,该浓度被证明是有效的,对存活率没有显著影响。gydF4y2Ba
蛋白酶体抑制对金属暴露细胞活力的影响gydF4y2Ba
来证明蛋白酶体抑制在gydF4y2Ba衣藻gydF4y2Ba在20 μM MG132或不添加20 μM MG132培养2 h后,分别用镍、镉或锌处理2 d。在100 μM的镉、镍和锌中生长的细胞显示了蛋白酶体抑制的毒性作用;文化(gydF4y2BangydF4y2Ba= 5),在TP培养基中初始包含10gydF4y2Ba5.gydF4y2Ba细胞/ml,孵育48 h,用流式细胞仪测定细胞活力和浓度。gydF4y2Ba
蛋白酶体抑制对暴露于高光应力的电池存活的影响gydF4y2Ba
在用强光(HL)胁迫细胞之前,在LL条件下分别用或不用MG132处理细胞2小时。蛋白酶体抑制对HL应激细胞活力的影响是通过生长来确定的gydF4y2Ba衣藻gydF4y2Ba对照细胞在20 μE弱光(LL)条件下生长。gydF4y2Ba
我们还试图监测添加或不添加MG132以及LL或HL的海藻培养物的长期恢复情况;这种回收率通过测量细胞浓度来监测。细胞在LL下培养4小时,或在LL下培养2小时,然后在HL下培养2小时,然后离心(1500gydF4y2BaggydF4y2Ba).将微球重悬于50 mL不含MG132的TP培养基中,将初始培养细胞浓度稀释至10gydF4y2Ba4.gydF4y2Ba细胞毫升gydF4y2Ba−1gydF4y2Ba.细胞在LL下培养10天,每2天测定细胞浓度,测定细胞恢复情况。gydF4y2Ba
显微镜gydF4y2Ba
通过在Olympus BX51显微镜上使用QCapture软件捕捉到的细胞图像分析,在ImageJ中估计蛋白酶体抑制对细胞体积的影响。分别用或不用MG132处理细胞24小时,然后将细胞置于显微镜载玻片上。从5次重复培养中测量细胞体积,每个重复分析大约40-50个细胞。gydF4y2Ba
光合作用的分析gydF4y2Ba
叶绿素含量gydF4y2Ba
在2ml细胞中测量叶绿素(10gydF4y2Ba6.gydF4y2Ba用或不生长mg132处理的细胞/ ml)(gydF4y2Ba我gydF4y2Ba) 4小时或(gydF4y2Ba2gydF4y2Bal 2小时,HL 2小时。离心5min后细胞成球(1500gydF4y2BaggydF4y2Ba).从3 mL培养液中提取1 mL N,N-二甲基甲酰胺微丸中的叶绿素a和叶绿素b,并用分光光度法测定[gydF4y2Ba35gydF4y2Ba然后在750 nm处减去浊度。gydF4y2Ba
叶绿素荧光gydF4y2Ba
叶绿素荧光在黑暗条件下生长48小时,弱光条件下生长48小时,强光条件下生长2小时。在使用手持AquaPen叶绿素荧光仪(Photon System Instruments;伯拉第斯拉瓦(捷克共和国)。可变荧光和最大荧光的比值(Fv/Fm),表示光系统II的最大光化学效率,测量了5个分离培养的重复,并按前面所述计算[gydF4y2Ba36gydF4y2Ba].在不同光强(10、20、50、300和500 μE)条件下,适应黑暗环境的藻类的光曲线可以产生电子传递速率。在强光胁迫后,细胞在黑暗中恢复5h。每30 min测定Fv/Fm,估计光抑制后的光合恢复。gydF4y2Ba
蛋白质电泳gydF4y2Ba
蛋白酶体抑制的效果是通过测量泛素化蛋白的积累来监测的,就像以前在衣藻中所做的那样[gydF4y2Ba19gydF4y2Ba].将MG132处理过或未处理过的细胞置于100 mL TP缓冲液中,在弱光下培养,然后在1500℃离心gydF4y2BaggydF4y2Ba在指定的时间点。蛋白在500uL的蛋白提取缓冲液(100mm NaCl, 50mmtris, pH 7.5, 0.5%(v/v) TritonX-100和1 mM二硫苏糖醇)中提取,使用四次反复冻融循环。用分光光度法测定蛋白质浓度(AgydF4y2Ba595gydF4y2Ba)使用Bradford方法。将50μg变性蛋白质加载并在8%SDS-PAGE凝胶上分离并转移至PVDF膜。使用泛素抗血清(Sant Cruz Biotechnology)测定Chlaymdomonas中的ubliquited蛋白的免疫反应性,如前所述[gydF4y2Ba19gydF4y2Ba].gydF4y2Ba
最初由Schmidt等人开发的非放射性SUnSET方法估计蛋白质合成[gydF4y2Ba37gydF4y2Ba],后来在植物中改良[gydF4y2Ba31gydF4y2Ba].简单地说,将含MG132或不含MG132的细胞在LL条件下培养2 h,然后转入LL条件下培养2 h或HL条件下培养2 h,最后用40 μM嘌呤霉素处理20 min;嘌呤霉素与新生多肽结合并导致终止。用嘌呤霉素抗血清免疫印迹法检测含有嘌呤霉素的截断蛋白。将30 μg蛋白质加载到15%的SDS-PAGE凝胶上,并在上述变性条件下运行。用购自美国爱荷华大学的嘌呤霉素抗体(PMY-2A4)孵育膜2小时。使用PMY-2A4抗体1:1000稀释。新合成的含有嘌呤霉素的蛋白用与碱性磷酸酶结合的二抗检测(1:10 000稀释45分钟)。gydF4y2Ba
统计和生物信息分析gydF4y2Ba
使用Kaleida-Graph软件程序(Synergy software)进行统计分析,并包括学生t检验和方差分析(ANOVA)。gydF4y2Ba
在衣藻中使用BlastP (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/gydF4y2Ba).拟南芥SPI的比对gydF4y2Ba大豆gydF4y2Ba那gydF4y2Ba奥雅萨苜蓿gydF4y2Ba和苔藓gydF4y2BaPhyscomitrella金属盘gydF4y2Ba在Clustal Omega进行。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在本研究中使用和/或分析的数据集可从通讯作者在合理要求。gydF4y2Ba
缩写gydF4y2Ba
- ETR:gydF4y2Ba
-
电子传递速率gydF4y2Ba
- HL:gydF4y2Ba
-
强调gydF4y2Ba
- 噢,gydF4y2Ba
-
弱光gydF4y2Ba
- PSII:gydF4y2Ba
-
光系统IIgydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- TOC:gydF4y2Ba
-
在叶绿体外膜上的移位子gydF4y2Ba
- UPS:gydF4y2Ba
-
泛素蛋白酶体途径gydF4y2Ba
参考gydF4y2Ba
- 1.gydF4y2Ba
活性氧:代谢、氧化应激和信号转导。植物学报2004;55:73 - 99。gydF4y2Ba
- 2.gydF4y2Ba
Pospíšil P.光系统II对光和温度胁迫的反应产生活性氧。植物学报2016;7:1950。gydF4y2Ba
- 3.gydF4y2Ba
陈志强,陈志强。植物中铁硫簇的形成。植物生态学报。植物学报。2011;16:18-26。gydF4y2Ba
- 4.gydF4y2Ba
谷胱甘肽介导亚硒酸盐还原生成的超氧化物对铁还蛋白铁硫簇的破坏作用。植物生理生化。2016;106:228-35。gydF4y2Ba
- 5.gydF4y2Ba
Li L, Aro EM, Millar AH。光抑制中的光损伤和蛋白质周转机制。植物学报2018;23:667-76。gydF4y2Ba
- 6.gydF4y2Ba
Erickson E,Wakao S,Niyogi KK。轻微的压力和光保护gydF4y2Ba衣藻reinhardtiigydF4y2Ba.工厂J. 2015; 82:449-65。gydF4y2Ba
- 7.gydF4y2Ba
理查森LG, Singhal R, Schnell DJ。叶绿体蛋白靶向与植物发育和胁迫反应的整合。BMC医学杂志。2017;15:118。gydF4y2Ba
- 8.gydF4y2Ba
刘建新。植物内质网蛋白的质量控制及其与环境胁迫响应的关系。植物细胞。2010;22:2930-42。gydF4y2Ba
- 9.gydF4y2Ba
泛素26S蛋白酶体蛋白水解途径。植物学报2004;55:55 - 90。gydF4y2Ba
- 10.gydF4y2Ba
陈建平,张建平,张建平,等。植物细胞周期依赖的蛋白质水解:蛋白酶体抑制剂MG132产生的破坏盒通路和中期阻滞的鉴定。植物细胞。1998;10:2063 - 75。gydF4y2Ba
- 11.gydF4y2Ba
黄志刚,黄志刚。植物营养物质的泛素化利用。植物学报2013;4:452。gydF4y2Ba
- 12.gydF4y2Ba
王S,Kurepa J,Hashimoto T,Smalle Ja。拟南芥皮质微管阵列的盐应激诱导的拆卸涉及26S胰蛋白酶体依赖性螺旋1的降解。植物细胞。2011; 23:3412-27。gydF4y2Ba
- 13.gydF4y2Ba
Santner A,Estelle M.植物激素信号传导中的最近进展和新兴趋势。自然。2009; 459:1071-8。gydF4y2Ba
- 14.gydF4y2Ba
李增佳。蛋白质泛素化介导的非生物胁迫耐受性。J Exp Bot. 2012; 63:599-616。gydF4y2Ba
- 15.gydF4y2Ba
通过泛素-蛋白酶体途径去除畸形硒蛋白gydF4y2Ba基础pinnatagydF4y2Ba.acta botanica yunnanica(云南植物研究). 2012;gydF4y2Ba
- 16.gydF4y2Ba
Pena LB, Zawoznik MS, Tomaro ML, Gallego SM。重金属对向日葵叶片蛋白质水解系统的影响。臭氧层。2008;72:741-6。gydF4y2Ba
- 17.gydF4y2Ba
Yabuta Y, Osada R, Morishita T, Nishizawa-Yokoi A, Tamoi M, Maruta T, Shigeoka S.拟南芥NAC转录因子在20S和26S蛋白酶体调控中的作用。植物科学。2011;181:421-7。gydF4y2Ba
- 18.gydF4y2Ba
王学军,黄磊,黄丽丽。26S蛋白酶体复合物在氧化应激中的调控作用。Sci信号。2010;3:ra88。gydF4y2Ba
- 19.gydF4y2Ba
泛素-蛋白酶体途径保护莱茵衣藻抗亚硒酸盐毒性,但随着活性氧积累而受损。AoB植物。2014;6:1-11。gydF4y2Ba
- 20.gydF4y2Ba
黄卫东,黄卫东,黄卫东,黄卫东。叶绿体生物发生受泛素-蛋白酶体系统的直接调控。科学。2012;338:655-9。gydF4y2Ba
- 21.gydF4y2Ba
泛素E3连接酶SP1调控叶绿体蛋白导入对植物抗逆性的影响。咕咕叫医学杂志。2015;25:2527-34。gydF4y2Ba
- 22.gydF4y2Ba
泛素促进了去除受损叶绿体的质量控制途径。科学。2015;350:450-4。gydF4y2Ba
- 23.gydF4y2Ba
通过对拟南芥26S蛋白酶体调控粒子的遗传分析,揭示了其在光胁迫中的重要性以及在发育过程中RPT2 n端所起的特殊作用。植物信号行为。2012;7:973-8。gydF4y2Ba
- 24.gydF4y2Ba
Fischer BB, Krieger-Liszkay A, Eggen RI。光敏剂中性红(ⅰ型)或玫瑰红(ⅱ型)在光下诱导的氧化应激引起不同的分子反应gydF4y2Ba衣藻gydF4y2Bareinhardtii。植物科学。2005;168:747-59。gydF4y2Ba
- 25.gydF4y2Ba
范Hoewyk D.使用非放射性日落方法检测蛋白酶体抑制拟南芥根系中的蛋白质合成减少。植物方法。2016; 12:20。gydF4y2Ba
- 26.gydF4y2Ba
胜X,Wei Q,Jiang L,Li X,Gao Y,王L.不同程度的蛋白酶体故障程度可能是通过预防细胞分裂和促进自噬真空的根本生长的各种影响。Plos一个。2012; 7:E45673。gydF4y2Ba
- 27.gydF4y2Ba
Kapri-Pardes E,Naveh L,Adam Z. thylakoid腔蛋白酶Deg1参与了从拟南芥中的光素内的照相系统II的修复。植物细胞。2007; 19:1039-47。gydF4y2Ba
- 28.gydF4y2Ba
丁琪,Dimayuga E, Markesbery WR, Keller JN。蛋白酶体抑制诱导蛋白质合成的可逆损伤。美国实验生物学学会联合会j . 2006; 20:1055 - 63。gydF4y2Ba
- 29.gydF4y2Ba
Allahverdiyeva Y, Suorsa M, Rossi F, Pavesi A, Kater MM, Antonacci A, Tadini L, Pribil M, Schneider A, Wanner G, Leister D.缺氧复合物PsbQ和PsbR亚基的拟南芥植株表现出PSII超复杂组织和短期适应机制的改变。植物j . 2013; 75:671 - 84。gydF4y2Ba
- 30.gydF4y2Ba
杨志强,王志强,王志强,等。光抑制作用下PSII氧进化复合物亚基的释放和活性氧介导的损伤。植物生理学报。2004;45:243-50。gydF4y2Ba
- 31.gydF4y2Ba
程德德,张血,太阳XB,赵米,太阳,咸肉。光合作用和烟叶叶片光合液的光合造成的烟雾造成的光素抑制损坏,由PseudomonasSyryring PV诱导。Tabaci在轻微和黑暗条件下。BMC植物BIOL。2016; 16:29。gydF4y2Ba
- 32.gydF4y2Ba
引用本文:张志刚,张志刚,张志刚,等。psbO基因的表达模式及其在光合器官驯化中的作用[j]gydF4y2Ba季gydF4y2Ba和gydF4y2Baf . pratensisgydF4y2Ba.植物生理学报。2012;34:1915-24。gydF4y2Ba
- 33.gydF4y2Ba
高瑞尔,谢伦伯格,巴赫曼,阿彻,胡贝尔,鲍威尔,等。植物病原毒性因子通过一种新的机制抑制真核蛋白酶体。大自然。2008;452:755-8。gydF4y2Ba
- 34.gydF4y2Ba
布什kt,goldberg al,nigam sk。蛋白酶体抑制导致热冲击响应,内质网伴侣和热能诱导。J Biol Chem。1997年; 272:9086-92。gydF4y2Ba
- 35.gydF4y2Ba
Porra RJ, Thompson WA, Kriedemann PE。测定四种不同溶剂提取叶绿素a和b的精确消光系数和联立方程:用原子吸收光谱法验证叶绿素标准品的浓度。生物物理学报1989;975:384-94。gydF4y2Ba
- 36.gydF4y2Ba
麦克斯韦·K,约翰逊叶绿素荧光-实用指南。J Exp Bot. 2000; 51:659-68。gydF4y2Ba
- 37.gydF4y2Ba
一种监测蛋白质合成的非放射性方法。Nat方法。2009;6:275-7。gydF4y2Ba
确认gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
本研究得到了授予DVH的NSF-RUI资助(MCB 1615318)。国家科学基金会在这项研究中的作用是资助主要研究者和设计和执行实验、收集和分析数据以及撰写手稿的学生。国家科学基金会还提供资金来支付与实验相关的费用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
本研究由DVH构思。FM, CB, LP, DVH进行实验,采集数据,分析数据。手稿是DVH写的。除CB最近去世外,所有作者都已阅读并通过了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
DVH是BMC《植物生物学》编委会成员。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
衣藻不具有陆生植物中发现的SP1 E3连接酶。SP1在衣藻(Chlamydomonas)、小立碗藓(Physcomitrella patens)、水稻(Oryza sativa)、拟南芥(Arabidopsis thaliana)和甘氨酸(Glycine max)中的排列(上)和进化分化(下)。#- SP1的存在;−缺乏SP1。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
门多萨,贝里,C,普雷斯蒂贾科莫,L。gydF4y2Baet al。gydF4y2Ba在强光胁迫下,蛋白酶体抑制迅速加剧光抑制并阻碍恢复gydF4y2Ba衣藻reinhardtiigydF4y2Ba.gydF4y2BaBMC植物杂志gydF4y2Ba20.gydF4y2Ba22(2020)。https://doi.org/10.1186/s12870-020-2236-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
公认gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-2236-6gydF4y2Ba