摘要
背景
B-BOX (BBX)蛋白是一类锌指转录因子,能够调控植物的生长发育和承受胁迫反应。在植物中,BBX基因家族已在拟南芥,大米和西红柿。然而,目前还没有对葡萄中BBX基因进行系统分析。
结果
在这项研究中,有24条葡萄藤BBX(VvBBX)基因经综合生物信息学分析鉴定。随后,对染色体定位、基因结构、保守结构域、系统发育关系、基因复制等进行了研究独联体-对作用元素进行分析。系统发育分析划分VvBBX基因分为五个亚组。很多的独联体- 与植物发育相关的元素,在启动子中鉴定出植物发育,激素和/或应激反应。VvBBX基因。的组织特异性表达动力学VvBBX基因证明了VvBBXs可能在植物生长发育中起重要作用。从转录组数据和qRT-PCR的转录产物分析推断,11VvBBX基因在不同的果实发育阶段下调,而三个VvBBX基因差异。也有人推测VvBBX基因可能涉及多种激素信号(ABA,乙烯,GA3和CPPU)作为转录调节剂,以调节浆果发育和成熟。vvbbx22.似乎对多种激素信号,包括ABA、GA3乙烯和CPPU都有响应。一些VvBBX铜、盐、涝、旱胁迫均对其有较强的诱导作用。此外,表示vvbbx22.提出其参与多种功能,包括叶片衰老,非生物应激反应,水果发育和激素反应。
结论
我们的结果将为功能研究提供参考BBX并强调了其在葡萄果实发育和成熟中的作用。研究结果将有助于我们更好地理解其复杂性BBX研究了葡萄耐非生物胁迫的基因家族,为未来葡萄特异基因的功能鉴定提供了有价值的信息。
背景
锌指转录因子是植物界最重要的转录因子家族之一,在植物的生长发育和对环境刺激的响应中发挥着重要作用[1,2].锌指转录因子根据其个体的结构和功能特征进一步划分为几个亚科。BBX蛋白属于锌指转录因子,近年来因其多种功能受到越来越多的关注。植物中的BBX蛋白由n端一个或两个保守的BBX结构域和c端一个CCT (CONSTANS, CO-like和TOC1)结构域组成。B-BOX基序在蛋白质相互作用和转录调控中发挥重要作用[3.,4].CCT结构域参与核运输和转录调控[5,6,7].在拟南芥,已经鉴定了32个BBX蛋白,并且根据B型域的存在以及CCT结构域的存在,将这些成员分为五个亚组[3.].随后,越来越多的证据表明,植物BBX蛋白在多种生理生化过程中发挥着关键作用,如花的诱导[8,9[光膀胱[10,11.,避影反应[12、类胡萝卜素生物合成[13]和生物和非生物应激反应[14,15].
君士坦斯(有限公司)/ atbbx1.是第一个被调查的BBX基因拟南芥,是通过触发的表达来控制开花时间的中心协调者开花轨迹T.(英国《金融时报》)基因16.,17.,18.].CO.突变体在漫长的一天下显着延迟开花,而在长期和短日期的情况下共同表达转基因植物[19.,20.,21.].还有其他BBX基因,如BBX4.,BBX7,和BBX32已发现,这是调节开花时间[22.,23.,24.].已经鉴定了至少十个BBX基因作为早期光血管发生的调节剂。十分之一,BBX4.,BBX21,BBX22,BBX23正调控植物光形态发生[22.,25.,26.,27.),而BBX19,BBX20,BBX24,BBX25,BBX28和BBX32光形态发生的负调控因子在拟南芥[11.,28.,29.,30.].例如,BBX28通过抑制表达式来负调节光膀胱HY5并经历COP1介导的降解[11.].一些BBX基因还通过介导细胞伸长率来显示它们在避免阴影中的功能[12,31.,32.].
BBX蛋白也参与非生物应激响应和激素信号通信网络。例如,BBX18和BBX23正性热形成调节剂和缺陷突变BBX18和BBX23导致热响应性缺口伸长率降低[15].在拟南芥,BBX24最初被隔离为耐盐蛋白(STO)并增加酵母细胞中的耐盐活性[33.].过度表达BBX24在拟南芥在高盐度条件下提高根部的生长[34.].在菊花,CmBBX24除了延迟开花时间外,还能增强耐寒和耐旱能力[18.].BBX基因还揭示了它们在植物激素信号转导中的作用。atbbx18(AtDBB1a)是嗜碱(GA)信号通路中的阳性调节剂[35.),而BBX20(AtBZS1)对芸苔类固醇信号网络进行负面调节[28.].有趣的是,BBX蛋白还表明他们在果实的发展中表达了它们的重要性,特别是在花青素和类胡萝卜素生物合成中。MDBBX22(mdcol11.)参与mdhy5介导的信号转导,调控苹果果皮中花青素的积累[36.].SLBBX20通过直接激活植物合酶1,促进番茄中叶绿体的发育和类胡萝卜素积累[13].
由于其经济重要性和基本营养,葡萄是世界上最广泛种植和最普遍消费的水果作物之一[37.,38.].虽然BBX家族已被确定在拟南芥西红柿、梨和苹果[3.,39.,40,41.,却没有全面的研究BBX迄今为止已经报道了葡萄树的基因。随着葡萄基因组的释放[42.]我们有更好的可能性来系统地调查推定的功能BBX基因在小道消息。在这项研究中,24个非冗余成员VvBBX对葡萄藤的基因家族进行了表征。在此基础上,研究了不同胁迫条件下的基因结构、系统发育关系、组织表达谱和表达谱。我们的结果VvBBX基因将为进一步的功能表征提供基础BBX基因在小道消息。
结果
的识别VvBBX基因在葡萄树
为了鉴定和获得葡萄基因组中的BBX基因,采用拟南芥使用DNatools软件将BBX蛋白用作查询以对本地葡萄基因组数据库进行搜索。然后,采用B盒域(PFAM00643)的隐马尔可夫模型(HMM)轮廓来执行葡萄基因组的全球搜索。在分析保守域并去除冗余序列后,共24个推定VvBBX在葡萄藤中发现了基因。为了命名和一致性,这些VvBBX基因的命名来源于VvBBX1到vvbbx24这取决于它们和梨的同源性BBX成员,基于他们相似的数量BBX葡萄藤和梨之间的家庭[40].VvBBX的详细信息列于表中1,包括基因名称、蛋白质长度、染色体位置、分子量、理论等电点、脂肪指数和肉汁。24个VvBBX蛋白的分子量和长度不同,氨基酸长度从127 (VvBBX22)到474 (VvBBX7)不等。VvBBX22的分子量最低,为14.26 kDa,而VvBBX7的分子量最高,为51.43 kDa。这些蛋白的理论等电点变化范围为4.29 (VvBBX21) ~ 9.01 (VvBBX24),脂肪指数变化范围为47.66 (VvBBX23) ~ 78.38 (VvBBX24)。所有VvBBX蛋白的肉汁均小于零,说明VvBBX蛋白具有亲水性1).预计大多数VVBBX蛋白由狼Psort位于核上,但其中一些可以位于其他亚细胞室内,例如叶绿体和细胞质(表1).
VVBBX基因家族的蛋白质序列和系统发育分析
VvBBX蛋白的长度变化很大,从127到474个氨基酸。其中8个VvBBXs含有两个B-BOX结构域和一个保守的CCT结构域。9个成员由两个B-BOX域组成,但没有CCT域。两个VvBBX包含一个B-BOX和一个CCT域,五个VvBBX包含一个B-BOX域(附加文件1:图S1)。蛋白质序列对准和图案标志显示VVBBXS的B盒1和B盒2结构域具有类似的保守氨基酸残基,并且CCT结构域在VVBBX蛋白中也高度保守(附加文件2:图S2和附加文件3.:图S3)。这些域的图案标志显示在附加文件中2:图S2,其对应位置见附加文件3.:图S3。
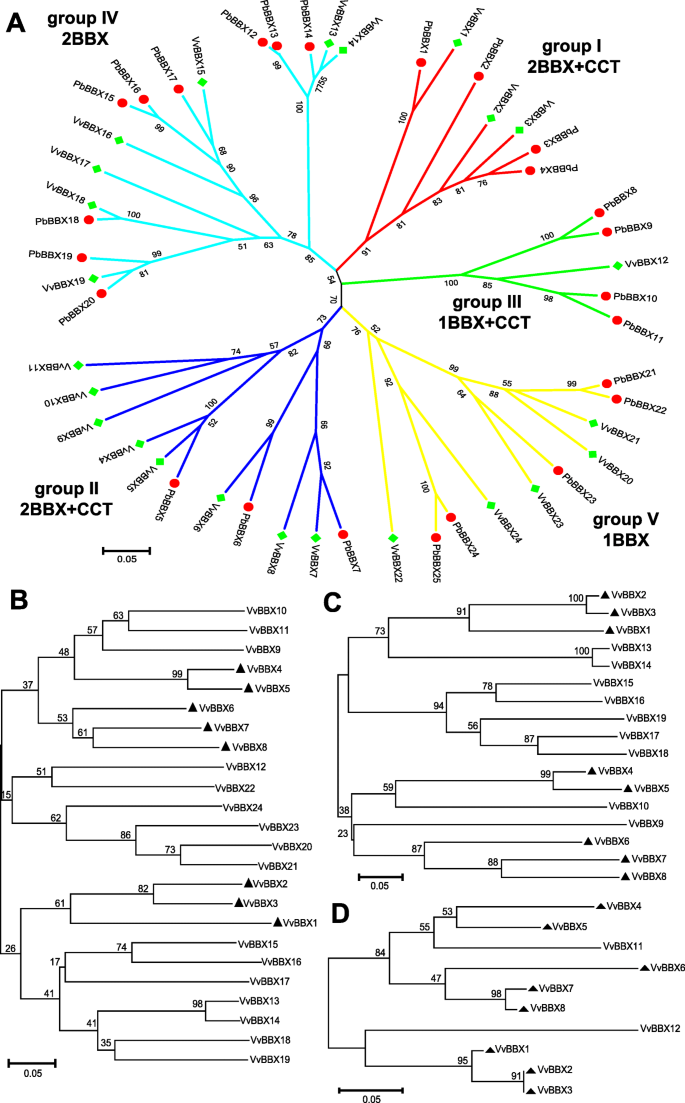
为了探索VvBBX成员的进化关系和功能分化,我们分别利用VvBBXs和梨BBXs (PbBBXs)全长氨基酸序列,在MEGA中采用邻域连接法和最大似然法构建系统发育树(图2)。1a和附加文件4:图S4)。如图所示在系统发育树中(图。1a和附加文件4:图S4),根据系统发育分析,VVBBX系列分为五个亚组,并与之前的梨,番茄和以前的研究一致拟南芥[3.,39.,40].此外,为了更好地了解BBX成员的分类,我们还使用最大似然法构建了VvBBXs、PbBBXs、AtBBXs和SlBBXs的系统发育树(Additional file)5:图S5)。如图中所示(附加文件)5:图S5),所有BBX蛋白也分为五个亚组和来自葡萄和梨聚集在一起的大多数BBX成员。此外,B盒1的序列(图。1b),b箱2(图。1c)和cct(图。1D)域也分别用于系统发育分析。子组I、II和III的成员都包含B-BOX和CCT域,但VvBBX9和VvBBX10只拥有两个B-BOX域。与之相反,IV和V子组的成员没有CCT结构域,分别只有两个或一个B-BOX结构域。子组I和子组II中的8个VvBBXs都包含了这三个域,它们可以分为两组(图2)。1b、c、d)。其中3个(VvBBX1、2,3)聚在子组I中,而子组II中的其他5个成员也聚在一起。
VvBBXs的染色体定位、基因复制和基因结构分析
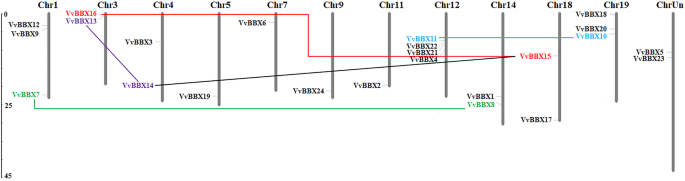
了解基因组分布和基因复制VvBBX基因,22VvBBX19条染色体中有11条的基因分布不均匀,其余2条基因(VvBBX5和vvbbx23.)还没有按照目前的葡萄藤基因组组装成任何染色体(图。2).其中,染色体12的数量最多VvBBX基因(四),而只有一个VvBBX基因定位于第5、7、9、11号染色体。三个VvBBX基因位于染色体1和19和2中的每一个上VvBBX基因分别分布在第3、4、14和18号染色体上。2).
串联重复和节段重复在基因家族的进化和扩展中经常发生。串联复制通常导致基因簇,而节段复制可能导致家庭成员分散[43.].VvBBX基因家族中只有一个串联双复制簇(VvBBX11/VvBBX22)在葡萄12号染色体上被鉴定出来。然后,在葡萄基因组中鉴定出VvBBX基因家族的5对重复片段(VvBBX7/VvBBX8、VvBBX10/VvBBX11、VvBBX13/VvBBX14、VvBBX14/VvBBX15和VvBBX15/VvBBX16)(见图)。2).结果表明,在葡萄树中VVBBX基因家族的扩展中,分段重复事件可能比串联复制更重要。此外,我们还计算了节段性基因对的Ka / ks的值,其可以用作进化期间基因选择压力的指示剂。我们的研究结果表明,所有KA / KS值小于1,表明VvBBX基因主要是在净化选择的影响下进化的(附加文件6:表S1)。
为了更好地了解进化关系VvBBX通过比对基因的cDNA序列和相应的基因组DNA序列,研究了内含子/外显子结构。如附加文件所示7:图S6,外显子数量为1到5。VvBBX13和VvBBX14外显子含量最高(5)vvbbx22.和vvbbx24只有一个外显子VvBBXs.此外,在同一组中发现了高度相似的基因结构VvBBX基因。例如,所有三个VvBBXs在我含有两个外显子的小组中,第二组内的大多数成员都有四个外显子,除了VvBBX9(附加文件7:图S6)。这些结果表明,VvBBX基因家族在进化过程中发生了外显子的增加或减少,基因结构揭示了VvBBX基因家族的进化关系。
的识别独联体-促进剂中的元素VvBBX基因
更好地理解转录调节和基因功能VvBBX, 这独联体- 在启动子区域中的元素VvBBX(翻译开始站点上游的2kB基因组DNA序列)用于搜索PlantCare数据库(附加文件8:图S7,附加文件9:表S2)。如预期的那样,常规启动子元件cat -box和TATA-box在所有基因中均发现VvBBX启动子。一系列的独联体鉴定了植物生长和发育,培养植物激素反应和应力响应的元素(附加档案8:图S7,附加文件9:表S2)。如图所示。4,涉及分类表达的猫盒在12个启动子中鉴定出来VvBBX基因。在10株玉米中发现了玉米醇溶蛋白代谢调控因子(O2位点)VvBBX基因。此外,在启动子中还发现了种子特异性调控元件(RY元件)和胚乳表达调控元件(GCN4_motif)VvBBX基因。在参与激素反应的顺式作用元件中,21、18、17和12的启动子中发现了脱落酸响应元件(ABRE)、乙烯响应元件(ERE)、MeJA响应元件(CGTCA-motif和TGACG-motif)和赤霉素响应元件(GARE-motif、P-box和TATC-box)VvBBX基因分别。在9和5中还观察到水杨酸响应元件(TCA元素)和肿瘤响应元件(AUXRRR-CORE和TGA元素)VvBBX基因(附加文件8:图S7,附加文件9:表S2)。在应激相关反应元素中,ARE是最丰富的参与厌氧诱导的元素VvBBX基因。一些与压力相关的(低温、干旱和创伤)独联体-作用元件也发现在启动子区域VvBBX基因(附加文件8:图S7,附加文件9:表S2)。此外,还发现了许多光响应元件在VVBBX的启动子区域中发现,包括盒子4,G盒,G盒,GATA-MOTIF,GT1-MOTIF,I-BOX,MRE,TCCC-MOTIF和TCT-主题。
器官特异性表达模式分析VvBBX基因在葡萄树
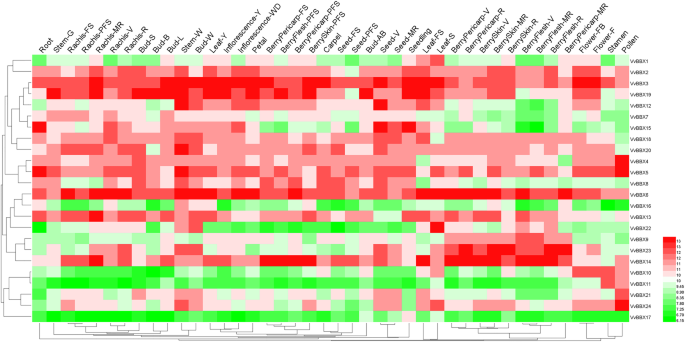
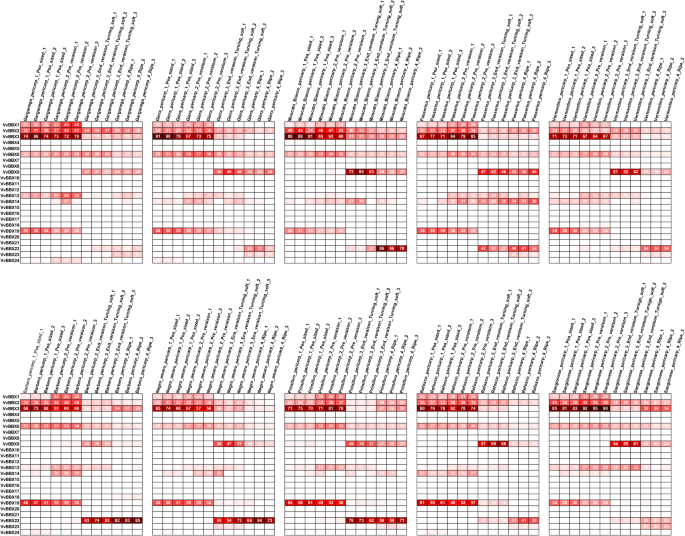
为了研究假定的角色VvBBX葡萄开发中的基因,有机特异性表达模式VvBBXs在V. Vinifera简历。来自GEO数据集(GSE36128)的石首鱼全球基因表达图谱,通过微阵列分析获得了42个不同发育阶段的不同器官/组织(图)。3.额外的文件10:表S3)。如图所示。3.,一些VvBBX基因在不同的器官/组织中表现出类似的表达曲线,而其他VvBBXs显示了组织特异性的转录本积累模式,可能表明了VvBBX基因在葡萄园生长和发育过程中。例如,四个VvBBX(VvBBX2,3.,5和6)基因在几乎所有被检测组织中普遍高表达,而VvBBX16和VvBBX17在所有被测组织中均以极低水平表达。
葡萄VvBBX基因在不同器官、组织和发育阶段的表达谱基于分析的所有组织中每个基因的平均表达值标准化数据。基于平均Pearson的距离度量和“平均连杆”方法,基因分层集群。红色和绿色盒子分别表明每个基因的高表达水平。Bud-Ab,爆发后的芽;Bud-B,Bud爆;Bud-W,冬芽;Bud-L,潜在的芽;Bud-s,Bud膨胀;Flower-F,开花; Flower-FB, flowering begins; FS, fruit set; Inflorescence-Y, young inflorescence with single flowers separated; Inflorescence-WD, well-developed inflorescence; Leaf-FS, mature leaf; Leaf-S, senescing leaf; Leaf-Y, young leaf; MR, mid-ripening; R, ripening; PFS, post fruit set; Stem-G, green stem; Stem-W, woody stem; V, véraison
一些VvBBX基因在特定器官/组织中显示出非常高的水平。例如,三个VvBBX(vvbbx4.,21.和24.)基因在花粉中的表达量高于其他组织,表明它们是葡萄花粉生长发育过程中重要的信号转导蛋白。VvBBX1和vvbbx22.在Senescing Leaf中表现出高度的表达,这表明它们可能会参与叶子参加。vvbbx20.在木茎(stem - w)中表达量较高,表明木质部和韧皮部在木质部次生生长过程中参与木质素化。VvBBX15在幼苗,根和种子(种子v)中优先表达,这提出了VvBBX15在三个组织中扮演重要角色。此外,两个副VvBBX在分段重复中,显示出类似的表达模式。例如,vvbbx7.和VvBBX8基因结构相似,基序组成相同,在浆果中表达丰度低。VvBBX10和VvBBX11在雄蕊中表达量较高。(图。3.额外的文件10:表S3)。值得注意的是,vvbbx6.,VvBBX14,和vvbbx23.在浆果中高度表达,这表明这些基因可能在浆果发育和成熟中发挥重要作用。这些结果引起了我们调查表达模式VvBBX不同果实开发和成熟阶段的基因。
的表达模式VvBBX浆果发育和成熟过程中的基因
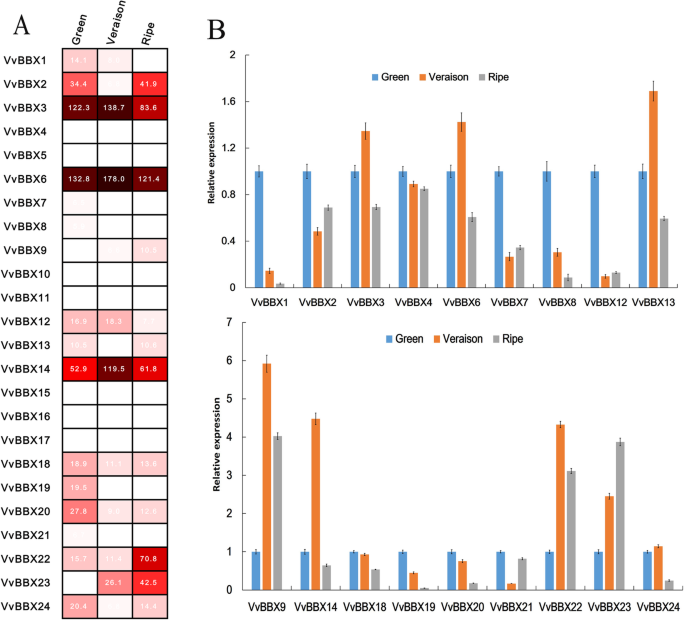
来理解的势函数VvBBX在浆果发育和成熟的基因中,转录表达模式为24VvBBX利用NCBI基因表达综合(GEO)数据集(GSE77218)的表达谱,对葡萄果实发育三个阶段的基因进行了研究。不同的成员VvBBX各基因在不同的果实发育阶段表现出不同的转录本积累模式。如图所示。4一种,VvBBX3,vvbbx6,和VvBBX14在成熟过程中表现出相对高的表达水平,而六VvBBX基因(VvBBX5,10,11.,15,16.和17.)在不同的浆果发育阶段几乎检测不到(图。4一个额外的文件11.:表S4)。11.VvBBX基因是下调的表达模式,而三个VvBBX基因在果实发育过程中表达上调。4一个额外的文件11.:表S4)。例如,的表达式级别VvBBX1为中度,从霉变到成熟期逐渐减少。类似于VvBBX1,但在较小程度上,VvBBX18,vvbbx19,和vvbbx20.青果期表达量最高。vvbbx22.和vvbbx23.在果实发育过程中表达量显著增加,并在成熟期达到采摘期(图。4一个额外的文件11.:表S4)。
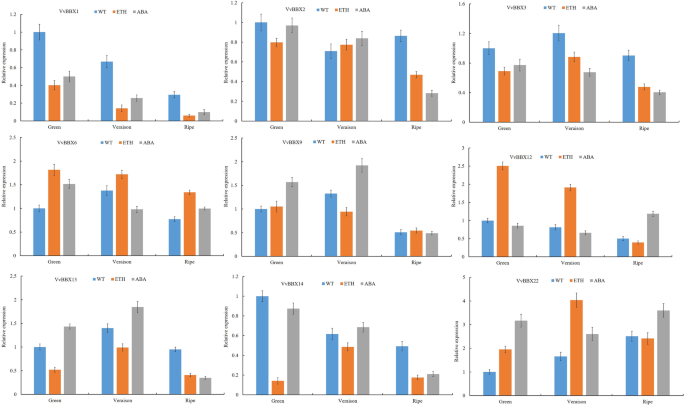
以验证转录丰度VvBBX通过微阵列数据,qRT-PCR分析所有18个可检测到的基因VvBBX在三个浆果发育阶段进一步进行基因。如预期的那样,QRT-PCR结果与RNA-SEQ数据高度一致,除了VvBBX13和vvbbx24(图。4b).例如,表示VvBBX1和vvbbx23.在浆果发育和成熟过程中,分别显着下降和增加。VvBBX18,vvbbx19,和vvbbx20.也描绘了在青果期的最高表达(图。4b)。所有这些结果与来自RNA-SEQ数据的数据一致。但是,表达概况VvBBX13和vvbbx24与RNA-Seq数据不一致。VvBBX13RNA-Seq数据显示,成熟期表达量最高,而qRT-PCR结果显示,成熟期表达量最高。vvbbx24通过qRT-PCR分析,在veraison berry中表达量较高,而RNA-Seq数据显示在绿莓期表达量最高(图2)。4b)。所有这些结果都暗示了一些VvBBX各基因表达模式不同,在果实发育和成熟过程中可能起重要作用。
提供有关浆果发育和成熟功能的更多信息VvBBX利用NCBI GEO数据集(GSE62744和GSE62745)的微阵列数据,研究了10个不同葡萄品种之间的转录本积累模式,其中包括4个不同的果实发育阶段(开花后20d豌豆大小的浆果期、浆果在变浆前开始接触阶段,变浆结束时浆果软化阶段,以及收获时浆果完全成熟阶段[44.].如图所示。5,成绩单累积概况VvBBX3和vvbbx6.在葡萄果实成熟过程中仍然相对强烈但逐渐减少,这与来自RNA-SEQ数据的数据相对应。VvBBX9和vvbbx22.在End_veraison和成熟期优先表达,RNA-Seq数据也观察到类似的表达模式。相反,VvBBX1和vvbbx19.与RNA-Seq和qRT-PCR分析结果一致(图2)。4).另外,12VvBBX在所有10个葡萄种品种中,基因在果实中表现出轻微或没有表达。所有这些结果表明有些结果VvBBX基因在葡萄果实发育中可能发挥多种重要作用。
VvBBX基因响应外源ABA,乙烯,GA3.和保护激素
植物激素最初是植物中的调节因子,同时,BBX蛋白在激素信号通路中的作用是葡萄葡萄酒的稀缺。揭示潜在的角色VvBBX响应于(脱钙酸)ABA和乙烯处理的基因,QRT-PCR用于分析表达VvBBX该基因在葡萄果实成熟过程中表达量较高。如图所示。6,表示VvBBX1通过在整个浆果发育和成熟时期的术前ABA和乙烯处理中受到显着抑制,表明这一点VvBBX1对果实的成熟具有负调控作用(图。6).相似,VvBBX2,VvBBX3和VvBBX13似乎在成熟阶段被抑制,这意味着葡萄藤中的这两个基因可能是果实成熟的负调节器。vvbbx6.和VvBBX9乙烯和ABA治疗分别略微增加。VvBBX12在绿化和绿化阶段被上调了吗VvBBX14外源乙烯处理后,在绿期和成熟期表达下调(图。6),说明VvBBX12和VvBBX14在乙烯信号通路的响应中可能具有相反的功能。值得注意的是,成绩单的水平vvbbx22.在ABA和乙烯处理中在绿色和Veraison阶段显着上调(图。6),表明vvbbx22.可能在ABA和乙烯处理中发挥积极作用。
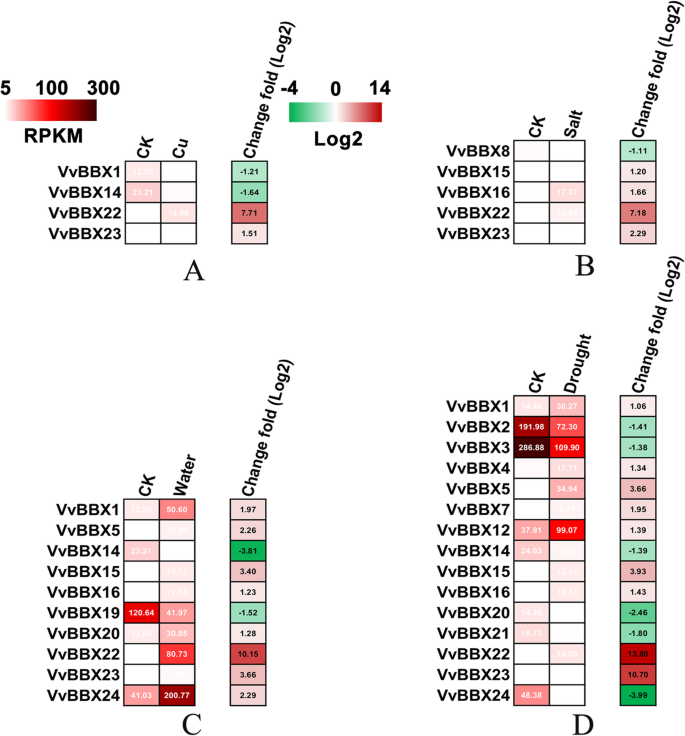
目前,GA3.以及通常用于增加果实重量、生产无籽葡萄和抑制赤褐色生长的氯吡脲(CPPU) [45.].因此,我们进一步调查了潜在的作用VvBBX基因响应GA3和PAPU通过先前的RNA-SEQ数据[45.].如附加文件所示12:表S5,表示vvbbx7.,VvBBX8和VvBBX12明显增加,而且vvbbx21.,vvbbx22.和vvbbx24GA3和CPPU处理显着降低(附加文件12:表S5)。
的表达模式VvBBX不同非生物胁迫下的基因
铜、盐、涝、旱是葡萄园常见的非生物胁迫。来理解势能函数VvBBX我们收集了上述四种胁迫(干旱胁迫,20 d, SRP074162,渍水胁迫,48 h, SRP070475,盐胁迫,48 h)下葡萄植株的RNA-seq数据集2Int。中国科学(d辑),2018,19,4019,铜应力,24h,参见附加文件9: Sci表S2。2015年5月,17749)。总的来说,VvBBX与Cu和NaCl处理相比,各基因对涝渍和干旱胁迫的响应更大(图2)。7额外的文件13:表S6)。其中,两个VvBBXs(vvbbx22.和vvbbx23.)显着诱导Cu处理的样品和两个VvBBXs(VvBBX1和VvBBX14),铜胁迫下调(图。7额外的文件13:表S6)。在盐压力下,四个VvBBX基因是上调的,而且只是上调VvBBX8被抑制。相比之下,10VvBBX基因在涝渍胁迫下被鉴定为差异表达基因,其中只有VvBBX14和vvbbx19.基因表达下调,其余基因表达上调(图。7额外的文件13:表S6)。响应干旱压力,九VvBBX基因表达了表达式模式和六个VvBBXs或多或少减少(图。7额外的文件13:表S6)。值得注意的是,四VvBBXs(VvBBX1,14,15和16.)对至少三种治疗方法有反应。有趣的是,vvbbx22.通过所有四种类型的压力强烈诱导至少7倍,表明这一点vvbbx22.可能是用于减轻非生物胁迫的候选基因。类似于vvbbx22.,但在较小程度上,vvbbx23.在不同的环境压力下也会产生显著的变化。7额外的文件13:表S6)。
葡萄BBX蛋白的亚细胞定位
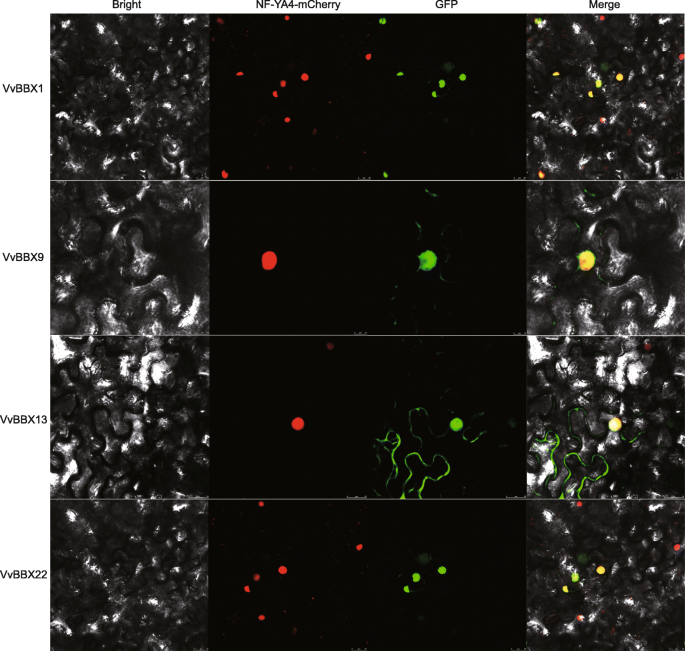
转录因子的核定位对其调控功能至关重要。此前的研究表明,BBX蛋白主要位于细胞核,如梨中的PbBBX4、PbBBX5和PbBBX13 [40].首先通过狼Psort预测VVBBX蛋白的亚细胞定位(表1).它们的十七个具有高概率位于核中。选择在果实中特异性表达的四个基因(VVBBX1,9,13和22)用于瞬时表达测定尼古利亚娜·宾夕法尼亚州表皮细胞。如图1中所示。8,表达的融合蛋白VvBBX1-GFP、VvBBX9-GFP、VvBBX13-GFP和VvBBX22-GFP的绿色荧光信号,经mcherry标记的核标记NF-YA4-mCherry证实,特异性分布在细胞核内。值得注意的是,VvBBX13-GFP也定位于细胞质(图。8),与预测结果不一致(表1).这些结果表明,VvBBX1、VvBBX9和VvBBX22是核蛋白,与之前的结果一致[39.,40].
讨论
BBX蛋白是重要的转录因子之一,在调节植物的生长发育中起着重要的作用[4].迄今为止,BBX基因家族的特征和功能已经在几种植物中被鉴定出来,如拟南芥[3.)、大米(46.], 番茄 [39.], 梨 [40]和apple [41.].虽然综合分析了BBX到目前为止还没有研究葡萄园的基因家族,浆果开发和压力反应尚未研究。在这项研究中,我们进行了基因组的分析BBX通过对不同组织和发育阶段以及不同胁迫条件下葡萄基因的连锁群组成、系统发育关系、基因结构、复制事件、顺式作用元件、基因表达谱等方面的研究,探讨了葡萄基因在不同胁迫条件下的表达情况。对葡萄BBX基因的全基因组分析将为进一步研究该基因家族的功能奠定基础,为葡萄分子克隆奠定基础。
葡萄BBX基因家族的进化
从藻类到单子叶植物和双子叶植物,不同物种的基因组中都存在BBX基因,这清楚地表明BBX基因起源于古代[4,47.].总共24个VvBBX从葡萄藤基因组中鉴定出基因,其数量VvBBX基因比其他植物小得多,例如64马吕斯有明显[41.), 32拟南芥[3., 30米[46.], 29代表西红柿[39.].差异可能是由于这些基因组中的副杀虫基因的可变状态。例如,在葡萄胺中仅发现5对,而分段重复事件的22个旁级寄生酰基和9个副寄生基因对分别在苹果和米中鉴定出来。此结论进一步得到了前一项研究的支持d . officinale(19名成员)和P. Equestris.(16个成员),分别仅包括2对DoBBXs副同源基因和2对PeBBXs副同源基因[48.].此外,作文BBX不同亚群的基因在物种间也存在差异(附加文件)14:图S8)。在葡萄树中,具有两个串联B盒的BBX成员的数量加上CCT域,两个串联B盒,框1加上CCT和B盒1分别为8,9,2和5(附加文件14:图S8)。相应的数字是13、8、4和7英寸拟南芥[3.],而8,10,5和6在番茄中[39.].这些结果表明,不同物种的BBX基因可能有一个共同的祖先,并在单子叶和双子叶分化后经历了独立的扩展[40].
序列比对和系统发育分析表明,所有VvBBXs均可分为5个亚群,与各亚群基本一致拟南芥,番茄和梨BBXs [3.,39.,40].所有VvBBX来自I、II和IV亚群的基因在葡萄藤中有两个B-BOX结构域,除了VvBBX11(图。1a).与具有两种不同B-BOX类型的动物BBX相比,葡萄藤中两个B-BOX结构域的氨基酸序列更加保守,保持了相同的拓扑结构[49.].大多数绿藻只有一个B盒域。然而,在单细胞绿藻中发现了两个B盒子域衣原体,暗示B-box复制事件在某些情况下早于陆生植物的殖民化[4,49.,50.].BBX蛋白在进化过程中迅速扩增,在整个植物界高度保守,表明BBX蛋白可能在陆生植物的适应中发挥重要作用[4,50.].
串联复制和分段重复事件在植物演变期间在基因家族成员的扩展中发挥着至关重要的作用[43.].进一步阐明膨胀机制VvBBX分析了葡萄基因家族的串联重复事件和节段重复事件。结果表明,8VvBBX基因(vvbbx7./VvBBX8,VvBBX10/VvBBX11,VvBBX13/VvBBX14,VvBBX14/VvBBX15,VvBBX15/VvBBX16)参与了片段复制(图。2).此外,只有一对基因VvBBX11/VvBBX22出现串联复制(图2)。2),表明分段重复更常见VvBBX基因。在一起,这些结果表明,分段和串联重复措施都有助于葡萄的扩张VvBBX基因家族在进化过程中。在葡萄的SBP-box和WRKY基因家族中也发现了相同的基因家族进化的潜在机制[51.,52.].此外,价值K一种/K还计算了分段基因对的s。通常,大于1,等于1,小于1的Ka / ks比分别表示阳性选择,中性选择和负选择。值得注意的是,所有葡萄胺基因对的Ka / ks比率小于1,表明这些基因对在其进化期间已经经历了明显净化的选择。
潜在的作用VvBBX植物生长和发展中的基因
积累研究表明BBX基因参与植物生长发育的多个方面,如幼苗光形态建成、遮荫、叶绿素积累、诱导花等[4].24的表达模式VvBBX利用表达图谱对42个不同发育阶段的葡萄组织中的基因进行了分析V.vinifera(简历。石首鱼)[53.].基因表达分析表明VvBBX根据基因在葡萄藤组织特异性反应中的表达丰度,基因可以被分类在一起,这可能反映了它们参与一个共同的代谢和/或发育过程。此外,一些VvBBX基因可能在特定的发育阶段具有独特的功能。
以前的研究也表明BBX基因参与花粉管的生长。例如,表达PbBBX5在梨花粉管中显著增加,提示其可能在梨花粉管生长中起关键作用[40].此外,vvbbx4.,orthologPbBBX5在花粉管中显示出相对高的转录活性,表明其潜在的参与花粉管生长和/或衰老。同样地,vvbbx24可能在葡萄中发挥类似的作用,因为它在花粉管中也高度表达。BBX基因参与开花的光周期途径。在拟南芥,BBX6 / COL5通过增强表达式在短日下促进开花英国《金融时报》[54.),而BBX7 / COL9.通过抑制表达式来负面调节开花有限公司和英国《金融时报》在漫长的一天[23.].BBX32 / EIP6在漫长的日期下,可能以共同独立的方式镇压开花[55.].VvBBX10和VvBBX11在花组织中有较高水平的表达,表明它们在花发育的调控中可能的作用。综上所述,我们的结果表明VvBBX基因不仅参与花粉管的发育,而且参与花的发育调控。
AtBBX21(也称为SALT TOLERANCE HOMOLOG 2, STH2)与拉长下胚轴5 (ELONGATED HYPOCOTYL 5, HY5)相互作用,被认为是光形态建成的关键信号调节因子,正向调节幼苗的光形态建成[56.].atbbx21,其显示在干燥和发芽种子中的表达,也涉及ABA信号传导和对照种子萌发[57.].在我们的研究结果,VvBBX15,最接近的同源物atbbx21在葡萄植株中,幼苗和veraison种子的相对表达量显著高于对照VvBBX15可能参与幼苗光学发生和种子发育。相反,atbbx24(国标),ATBBX25(某事)显示相反的功能atbbx21并抑制幼苗的光形态建成[29.,58.].vvbbx19.,与之密切相关atbbx24和ATBBX25,在幼苗中也有高水平的表达。结果推测vvbbx19.基因可能参与葡萄光膀胱血管发生,并显示出相反的功能VvBBX15.然而,vvbbx19.展示了更广泛和更少的组织特异性成绩单累积模式,例如芽,叶,花卉部件和水果。这些结果表明vvbbx19.基因可能参与多种生长发育阶段的调控功能。此外,CmBBX22在延迟叶片衰老和耐久的干旱严重程度中起着重要作用[59.].表达vvbbx22.显著高于其他组织,说明vvbbx22.可能会发挥类似的角色CmBBX22调节葡萄叶片衰老。总的来说,所有的VvBBXs在测试的大多数组织和发育阶段表达,这揭示了这一点VvBBX基因可以在各种发育和生物学过程中发挥多种重要作用。
VvBBX在葡萄园浆果开发和成熟过程中可能会发挥重要作用
葡萄贝瑞的发展和成熟是一种复杂的物理和生化过程,由各种转录网络和调节蛋白控制,例如MYB,BHLH和MADS-BOX [60.].越来越多的证据表明BBX基因参与花青素积累和浆果成熟[56.,61.,62.].例如,atbbx22直接促进表达生产花青素颜料1(PAP1.)通过与之相互作用和花青素生物合成基因AtHY5[56.,61.].突变atbbx22通过下调花色苷的积累PAP1.表达,这表明atbbx22通过调节MyB基因的表达来调节花青素合成[10,61.].苹果的研究提议MDBBX22(mdcol11.)涉及MDHY5介导的信号转导网络,并积极调节苹果皮中的花青素生物合成[36.].相反,MDBBX54(mdcol4.)通过抑制表达式抑制苹果皮中的花青素积累MdANS和MdUFGT它在花青素生物合成途径中编码基因。此外,MDBBX54间接抑制的表达mdmyb1.通过与MdHY5相互作用[63.].在大米、OSBBX14.也与oshy5.调控花青素的生物合成[64.].此外,成绩单积累macol1.在自然或乙烯诱导的果实成熟过程中,香蕉果肉中叶绿素含量显著增加,表明macol1.是一种转录激活剂,可能与香蕉果实成熟有关[62.].PaBBX28是高度联合表达的答,ch,F3H,F3'H,被认为是花青素生物合成的四个重要基因,提示BBX转录因子参与了甜樱桃花青素生物合成[65.].
小道消息,VvBBX18和vvbbx19.与之分享高同源性atbbx22和MDBBX54,在绿色浆果中表达量高(图。4),表明它们在葡萄果实发育的早期具有潜在的作用。VvBBX1表现出类似的高度表达VvBBX18和vvbbx19.在绿色浆果中,表明VvBBX1可能会执行类似的函数VvBBX18和vvbbx19..有趣的是,STRING V11的蛋白质相互作用网络揭示了两者VvBBX18和vvbbx19.显示出与VVHY5(附加文件15:图S9和附加文件16.:表S7)。这些结果与之前的研究一致拟南芥和苹果36.,61.,63.]并表示这一点VvBBX18和vvbbx19.可以通过Mdhy5介导的信号转导网络调节花青素积累或浆果发育。VvBBX14,同源物MDBBX22,在花青素积累和果实成熟过程中表达量最高。4,5).此外,VvBBX9,vvbbx22,和vvbbx23.在成熟浆果中优先表达,表明这三个基因可能参与了葡萄果实的成熟过程。
潜在的作用VvBBX对各种植物激素的反应
虽然葡萄果实被归类为非更年期果实,但包括ABA和乙烯在内的几种激素可能参与了葡萄果实成熟的控制。众所周知,ABA促进葡萄浆果成熟,在转色末期和成熟初期,浆果中ABA含量有较强的增加[66.].外源ABA处理导致浆果重量增加,可滴定酸度降低,总花青素含量增加[60.].乙烯可以影响葡萄园成熟期间的生理过程,包括浆果膨胀和花青素积累[67.].外源性乙烯处理刺激浆果着色,增强与花青素生物合成相关的基因的表达[68.].在Veraison的乙烯应用还通过增加水交换和细胞壁结构基因的表达来导致浆果扩张[69.].目前,作用VvBBX在ABA和乙烯信号传导途径中的基因仍然很差。在先前的研究中,通过Eth诱导了四种番茄BBX基因,所有这些都在其启动子中含有乙烯反应性CIS-ELEMIN(ORE)[39.].在拟南芥,atbbx21在ABI5启动子上用HY5和ABI5坐标,这些转录调节因子在音乐会上工作,以整合光线和ABA信令[57.].在我们的研究中,表达VvBBX1在整个浆果成熟期显著降低VvBBX基因(I-e,VvBBX2,vvbbx3,和VvBBX13ABA和乙烯处理对葡萄果实成熟也有抑制作用,提示这些基因可能在葡萄果实成熟过程中起负调控作用。相比之下,vvbbx22.在外源性ABA和乙烯处理后上调表达,暗示vvbbx22.对葡萄果实成熟有积极的调节作用。所有这些发现表明VvBBX基因可能涉及多种激素信号传导作为转录调节剂,以调节浆果发育和成熟。
此外,VvBBX基因可能归因于葡萄浆果膨胀和无籽。多种的VvBBX基因参与了对GA的反应3.和CPPU治疗,通常适用于增加浆果尺寸并抑制葡萄园的互感发展。例如,表达vvbbx7.,VvBBX8和VvBBX12明显增加,而且vvbbx21.,vvbbx22.和vvbbx24Ga明显减少3.和CPPU治疗(附加文件12:表S5)。目前的结果表明,本文检测到的大多数VVBBX基因在GA之后上调或下调3.和CPPU治疗,表明BBX转录因子可能对葡萄浆果膨胀和无籽的功能相反。有趣的是,表达了vvbbx22.对ABA、乙烯、GA3、CPPU等多种激素信号均有响应vvbbx22.通过调制多个激素信号通路来调节葡萄果实果实果实的多个方面。
潜在的作用VvBBX葡萄对不同非生物胁迫的响应基因
胁迫应答基因的转录调控是植物应对一系列非生物和生物胁迫的重要组成部分。转录因子是通过结合目的基因启动子区域的顺式作用元件来控制基因簇表达的主控调控因子。铜、盐、涝、旱等多种非生物胁迫对葡萄生长发育产生负面影响。先前的研究表明BBX基因参与各种非生物应激反应[39.,41.].在该研究中,一系列应激响应性CIS作用元件,例如,DRE,MBS和富含TC,经常发生在启动子区域中VvBBX基因(附加文件9表S2),与干旱、盐和渍水有关。所有24VvBBX基因具有至少一种应力响应性独联体- 为应对非生物应激的潜在功能表示它们的潜在功能(附加文件9:表S2)。在我们的发现中,有8个VvBBX(VvBBX1,5,15,16.,20.,22.,23.,24.)基因被诱导抵抗涝渍胁迫,其启动子中均含有ARE元件。此外,还有四个、五个、十个和十五个VvBBX显示潜在参与Cu,盐,涝和干旱的基因。结果表明大多数VvBBX基因在不同程度上受到不同程度的诱导或抑制。此外,这两个VvBBX15和VvBBX16在盐,涝和干旱处理中共同表达(上调)(图。7),表明这两个基因可以整合不同的应力信号。表达VvBBX1通过涝渍和干旱胁迫得到了增强,但在Cu压力下被拒绝,表明这一点VvBBX1可能有不同的机制来维持对各种非生物信号的保护。特别地,表示vvbbx22.在四种非生物胁迫下上调7-13倍(图。7),表明vvbbx22.可能在响应多种非生物压力网络时发挥重要作用。我们的结果与高表达相一致vvbbx22.在衰老的叶子中,暗示vvbbx22.可能在各种非生物胁迫下。描述的VvBBX响应于不同的非生物胁迫的基因将大大提高我们对不同非生物应力信号传导途径中发生的功能和串扰的理解。
结论
在这项研究中,24VvBBX在葡萄树中鉴定基因,并系统性和综合分析VvBBX进行基因家族,包括保守结构域,系统发育关系,基因结构,染色体位置,基因复制,顺式作用元件和表达模式分析。在VVBBX启动子序列中发现了许多顺式作用元件,表明这一点VvBBX基因涉及复杂的监管网络,控制对非生物胁迫的发展和反应。转录VvBBX在不同的组织和发育阶段和各种压力条件下表明VvBBX在葡萄生长发育中可能具有多种作用。转录组和qRT-PCR分析显示VvBBX基因可能通过调节多种激素信号通路在果实发育和成熟过程中发挥重要作用。总的来说,全基因组分析VvBBX将为葡萄葡萄酒中BBX基因的功能分析提供坚实的基础,并进一步研究几种BBX基因,了解其生物学功能。
方法
葡萄基因组BBX基因的鉴定
使用两种不同的程序来鉴定和解释葡萄树中的BBX基因作为之前的报告[70].首先,从拟南芥信息源(TAIR)数据库中下载了所有拟南芥BBX蛋白序列(http://www.arabidopsis.org)作为查询,利用blast p Program (E-value <1e-5)筛选葡萄基因组数据库。其次,利用pfam00643数据库建立b-box域隐马尔可夫模型(HMM)。http://pfam.xfam.org/)和(http://genomes.cribi.unipd.it/grape/)检索葡萄基因组数据库。随后,通过对Pfam (http://pfam.sanger.ac.uk/), InterProScan (http://www.ebi.ac.uk/Tools/pfa/iprscan/)及SMART (http://smart.embl-heidelberg.de/)数据库。通过扩展网站计算VVBBX蛋白的水大肠病(肉汁)的分子量,等电点(肉汁)(https://web.expasy.org/protparam/).利用WoLF PSORT (http://www.genscript.com/psort/wolf_ psort.html.).
VvBBXs系统发育树的构建及序列比对分析
Clustalw计划(版本2.1;http://www.clustal.org/)用于多个序列对准24个VVBBX蛋白。通过使用MEGA5.0程序邻接方法和自举分析(1000重复)构建基于VVBBXS蛋白质序列的系统发育树(1000复制)[71.].Pfam (http://pfam.xfam.org),Interprocan(http://www.ebi.ac.uk/interpro/search/sequence-search)和SMART (http:// smart.embl-heidelberg.de)程序。VvBBXs的主题标志是通过将序列提交到MEME网站(http://meme.nbcr.net/meme/cgi-bin/meme.cgi.).
染色体定位,基因结构和重复分析
所有VvBBX根据葡萄基因组CRIBI网站(http://genomes.Cribi.unipd.it/),并用MapInspect软件绘制地图。据此,得到了cDNA序列及其相应的基因组DNA序列VvBBX从葡萄基因组获得成员,然后通过使用GSDS软件进行比较编码序列及其相应的基因组序列(http://gsds.cbi.pku.edu.cn)来确定外显子-内含子的结构[72.].串联复制基因是通过检测其在特定染色体上的物理位置来确定的,并在葡萄染色体上被鉴定为相邻的副同源基因,只有一个以上的干预基因。联合分析,从植物基因组复制数据库下载并分析葡萄基因组中的连接块[73.].对于重复对,采用ParaAT和KaKs_Calculator计算VvBBX基因副配对之间的Ka(非同义替换率)、Ks(同义替换率)和进化约束(Ka/Ks)。
独联体-Element分析VVBBX基因启动子
每个2000 bps的启动子序列VvBBX基因编码区从CRIBI (http://genomes.Cribi.unipd.it/).Plantcare在线计划(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)用来搜索假设独联体表演元素(74.].
各种器官和不同浆果发育阶段的VVBBX表达概况
表达剖面VvBBX基因在A.V. Vinifera结果表明:cv ' Corvina '(克隆48)在不同发育阶段的不同器官中表现出明显的差异。微阵列数据来源于NCBI基因表达综合(GEO)数据集GSE36128 (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE36128)[53.].利用Multi Experiment Viewer (MeV)软件评估各基因在不同器官所有组织中的表达值均值,并进行图形表征[75.].的表达模式VvBBX从NCBI的基因表达(Geo)数据库中获得“富士野”葡萄水果发展阶段的基因(GSE77218)(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi),其通过RNA测序(RNA-SEQ)数据测量[76.].在整个生长季中,对3年生“藤野”葡萄树的果实分别在绿果膨大期(40DAF或DAF40)、版本期(65DAF或DAF65)和成熟期(90DAF或DAF90)取样3次。此外,根据从NCBI地理数据集(登录号为GSE62744和GSE62745)下载的RNA序列数据,研究了基因的表达VvBBX分析了10个不同葡萄品种四个浆果发育阶段的基因[44.].10个品种包括五个红皮肤浆果(Sangiovese,Barbera,Negro Amaro,Refosco和Primitivo)和五个白皮浆果(Vermentino,Garganega,Glera,Moscato Bianco和Passerina)。浆果在四个发展阶段进行了三次重复,豌豆大小的浆果阶段在开花后20D,浆果开始触摸舞台,刚刚在Veraison(Pre_veraison),浆果软化阶段(End_veraison),以及收获的完全成熟的浆果阶段。
植物生长条件和不同的激素治疗
选择在青岛农业大学果园标准田间条件下生长的4岁“藤森”葡萄树作为实验材料。为研究其基因表达特性VvBBX在果实发育和成熟的过程中,采集葡萄果实样品,在生长季的三个时间点:青果膨大期(50 DAF)、复熟期(70 DAF)和成熟/收获期(90 DAF)。
乙烯和ABA治疗(500 mg / L乙烯利(ETH, ethylene-releasing试剂)和100 mg / L ABA在0.02% (v / v)渐变20到1% (v / v)乙醇(用作表面活性剂)喷洒在葡萄浆果在绿色水果扩张阶段(40 DAF)同时控制果实喷洒在0.02% (v / v)渐变20和1% (v / v)乙醇。乙烯利、ABA和控制溶液用手持式喷雾器喷洒,直到流出。在生长季节,分别在绿果膨大期(50 DAF)、复熟期(70 DAF)和成熟/收获期(90 DAF)三个时间点采集处理和对照植株的浆果样品。所有样品均采集3次,立即用液氮冷冻,−80℃保存至使用。此外,为了研究的表达谱VvBBXs基因,为了响应GA3和CPPU,葡萄藤RNA-seq数据集从已发表的补充数据集中检索[45.].
表达VvBBX应激基因
为了研究VvBBXs响应于不同的应力处理(Cu,盐,涝和干旱胁迫),从NCBI数据库中检索响应涝渍和干旱胁迫的葡萄RNA-SEQ数据(SRP070475和SRP074162)(分别)(https://www.ncbi.nlm.nih.gov/sra/srp070475和https://www.ncbi.nlm.nih.gov/sra/?Term=srp074162)[77.,78.].从发布的补充数据集中检索响应Cu和Salt的表达型谱的RNA-SEQ数据[37.,79.].夏天黑色(杂交种V. Vinifera和V. Labrusca.)2岁的葡萄藤用于检测mRNA表达VvBBX在非生物胁迫下。用100μmCuso模拟盆栽葡萄植物的Cu应激4和0.8% NaCl处理盐胁迫[37.,79.].控制装置也用蒸馏水处理,并将装置浸入水中48小时进行涝渍处理[78.而干旱处理则是暂停浇水20天[78.].葡萄藤幼苗作为对照,在适当的条件下生长。所有类型的样品复制3次,在深度测序时分别从处理组和对照组的拍摄顶点的第3和第4片收集展开的叶片。RNA-seq数据的分析基于之前的方法[37.], RPKM (Reads Per Kilobase Per Million mapping Reads)值用于估计基因表达水平。利用R软件揭示VvBBX基因的热图(http://www.bioconductor.org/).
存在分析
总RNA样本由TIANGEN RNAprep pure (TIANGEN,北京,中国)按照制造商的说明提取,并去除残留的受污染基因组DNA, RNA用DNase I(无RNase;TaKaRa生物技术,大连,中国)。随后,使用PrimeScript RTase (TaKaRa Biotechnology, Dalian, China)从1.5 μg总RNA中逆转了第一链cDNA。用于qRT-PCR的引物采用Primer 3.0在线软件设计,引物详细序列见附加文件17.:表S8。使用SYBR®Premixm Ex Taq™(TaKaRa,日本)和Applied Biosystems公司7500 Real-Time PCR系统进行qRT-PCR。所有的实验都有三个生物重复。基因表达的相对水平由2-ΔΔct用肌动蛋白(AB073011)用作管家基因的方法[80].
亚细胞定位分析
为了验证VvBBX基因的亚细胞定位,从4年生藤本株系的cdna中扩增了VvBBX基因的4个全长开放阅读框(ORFs),分别为VvBBX1、9、13和22。在CaMV35S启动子的控制下,将扩增产物克隆到带有绿色荧光蛋白(GFP)的pCAMBIA1300载体中。基因特异性引物见附加文件17.:表S8。通过电穿孔,将4个VvBBXs重组质粒转染至农杆菌肿瘤术应变EH105。瞬态检测农杆菌属的表皮细胞尼古利亚娜·宾夕法尼亚州,如Sparkes等人(2006)所述[81.].使用激光共聚焦显微镜(Zeiss LSM700,德国)观察VVBBX-GFP的瞬时表达,并且使用MCHERRY标记的核标记(NF-YA4-M樱桃)来观察细胞核。
数据和材料的可用性
拟南芥,梨和葡萄葡萄酒BBX蛋白质序列从拟南芥信息源(TAIR)数据库中下载(http://www.arabidopsis.org)和gigadb数据库(http://gigadb.org/site/index)和葡萄基因组criibi网站(http://genomes.Cribi.unipd.it/),分别。表达谱的微阵列数据V. Vinifera从NCBI基因表达综合(GEO)数据集(登录号:GSE36128) (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE36128).从NCBI基因表达综合数据库(GSE77218)中获得了‘藤野’葡萄果实发育阶段表达谱的RNA-seq数据(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi).来自NCBI基因表达综合(GEO)数据库(GSE62744和GSE62745)下载了四个浆果开发阶段的10种不同葡萄品种的表达概况的RNA-SEQ数据https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi).针对GA3和CPPU的RNA-seq数据来源于已发表的补充数据集(https://doi.org/10.1016/j.scienta.2019.02.048).利用NCBI数据库(SRA登录号分别为SRP070475和SRP074162)检索葡萄植株对涝渍和干旱胁迫响应的RNA-seq数据(https://www.ncbi.nlm.nih.gov/sra/srp070475和https://www.ncbi.nlm.nih.gov/sra/?Term=srp074162).
缩写
- 伊稳定石:
-
脱落酸响应元件
- BBX:
-
变数寄存器
- COP1:
-
组成富有光骨膜1
- DAF):
-
开花后的日子
- 之前:
-
Ethylene-responsive元素
- 英国《金融时报》:
-
开花轨迹T.
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 嗯:
-
隐藏的马尔可夫模型
- HY5:
-
蛋白质长的胚乳5
- MEME:
-
MOTER MOTIF ELICITITE
- NJ:
-
邻接
- 子:
-
开放阅读框架
- PAP1:
-
生产花青素1
- QRT-PCR:
-
实时PCR
- RPKM:
-
读取每千基/百万映射读取
- STH2:
-
耐盐同源物2
- 停止:
-
耐盐蛋白质
参考文献
- 1.
Riechmann JL,听到JE,Reuber TL,Jiang CZ,Keddie J,Adam L等。拟南芥转录因子:真核生物全基因组比较分析。科学。2000;290:2105-10。
- 2。
Kiełbowicz-Matuk A.植物C2H2型锌指转录因子的参与应力反应。植物SCI。2012; 185-186:78-85。
- 3.
Khanna R,Kronmiller B,Maszle Dr,Conceand G,Holm M,Mizuno T,等。这拟南芥b盒锌指系列。植物细胞。2009;21:3416-20。
- 4.
Gangappa Sn,Botto JF。BBX植物转录因子家族。趋势植物SCI。2014; 19:460-70。
- 5。
Griffiths S, Dunford RP, Coupland G, Laurie DA。的进化CONSTANS-like大麦,水稻和拟南芥.植物杂志。2003;131:1855 - 67。
- 6。
Yan H,Marquardt K,Indorf M,Jutt D,Kircher S,Neuhaus G,等。在光学发生期间,STO / BBX24功能需要核定位和与COP1的相互作用。植物理性。2011; 156:1772-82。
- 7。
Gendron JM, Pruneda-Paz JL, Doherty CJ, Gross AM, Kang SE, Kay SA。拟南芥生物钟蛋白TOC1是一种DNA结合转录因子。中国科学院院刊2012;109:3167-72。
- 8。
Gonzálezschain ND, Díazmendoza M, Zurczak M, Suárezlópez P.马铃薯君士坦斯涉及以接枝传递方式涉及光周期结节。工厂J. 2012; 70(4):678-90。
- 9。
李y,宋DH,李DY,彝族J, Ryu CH,金正日SL, et al。oscol4.是eHD1上游的构成型开花阻遏物和αbosphyB的下游。工厂J.2010; 63:18-30。
- 10.
常春春,马鲁夫·金,吴树华。cop1介导的降解BBX22 / LZF1优化幼苗发展拟南芥.植物杂志。2011;156(1):228 - 39。
- 11.
林飞,姜勇,李军,闫婷婷,范利明,梁金生,等。B-BOX结构域蛋白28通过抑制转录因子的活性负调控光形态建成HY5并经历COP1介导的降解。植物细胞。2018; 30:2006-19。
- 12.
Crocco CD, Holm M, Yanovsky MJ, Botto JF。遮荫下B箱的功能。植物信号表现。2011; 6(1):101-4。
- 13。
熊c,罗d,林啊,张克,山磅,何p等。番茄B盒蛋白SLBBX20通过直接激活植物合酶1来调节类胡萝卜素生物合成,并靶向26s蛋白酶体介导的降解。新植物。2019; 221:279-94。
- 14。
Soitamo AJ, piipo M, Allahverdiyeva Y, Battchikova N, Aro EM.光在调制中具有特殊的作用拟南芥低温下的基因表达。BMC植物BIOL。2008; 8:13。
- 15.
丁L,王某,歌曲ZT,江yp,韩杰,路SJ等。两个B盒域蛋白,BBX18和BBX23,与ELF3相互作用并调节热敏性拟南芥.细胞批准。2018; 25:1718-28。
- 16。
puterill J, Robson F, Lee K, Simon R, Coupland g君士坦斯基因的拟南芥促进开花和编码蛋白质显示相似的锌指转录因子。细胞。1995;80(6):847 - 57。
- 17。
Robson F, Costa MMR, Hepworth SR, Vizir I, Reeves PH, Putterill J,等。开花时间基因中保守结构域的功能重要性君士坦斯通过分析突变等位基因和转基因植物证明。工厂J. 2001; 28:619-31。
- 18。
杨勇,马超,徐勇,魏强,兰辉,等。锌指蛋白通过调控赤霉素的合成来调控菊花的开花时间和非生物胁迫耐性。植物细胞。2014;26:2038-54。
- 19。
Suarez-Lopez P, Wheatley K, Robson F, Onouchi H, Valverde F, Coupland G。君士坦斯昼夜节奏和开花的控制之间的调解拟南芥.大自然。2001;410:1116-20。
- 20。
Samach A,Onouchi H,Gold Se,Ditta Gs,Schwarz-Sommer Z,Yanofsky Mf等。独特的角色君士坦斯目的基因在生殖发育拟南芥.科学。2000; 288:1613-6。
- 21.
等。光周期开花中康斯坦斯蛋白的光感受器调节。科学。2004;303:1003-6。
- 22.
邓晓伟,何志刚。拟南芥Constans-like3是红光信号传导和根生长的正调节器。植物细胞。2006; 18:70-84。
- 23.
程XF,王泽。过度表达COL9., 一种CONSTANS-LIKE基因,通过减少表达来延缓开花有限公司和英国《金融时报》在拟南芥.工厂J. 2005; 43:758-68。
- 24。
Tripathi P,Carvallo M,Hamilton EE,Preuss S,Kay SA。拟南芥B-BOX32与CONSTANS-LIKE3相互作用调控开花。中国科学技术大学学报2017;114:172-7。
- 25。
徐东,姜勇,李军,林峰,霍姆,邓晓伟。BBX21,拟南芥B盒蛋白,直接激活Hy5,并通过COP1靶向26s蛋白酶体介导的降解。Proc Natl Acad Sci U S A. 2016; 113:7655-60。
- 26。
徐东,姜勇,李军,霍姆,邓晓伟。B-box结构域蛋白BBX21促进光形态建成。植物杂志。2018;176:2365 - 75。
- 27。
张X,淮杰,尚f,徐g,唐w,jing y等。PIF1 / PIF3-HY5-BBX23转录因子级联影响光学发生。植物理性。2017; 174:2487-500。
- 28。
范晓燕,孙勇,曹冬梅,白明英,罗晓敏,杨慧娟,等。BZS1是一种B-box蛋白,促进油菜素内酯和光信号通路下游的光形态建成。摩尔。2012;5:591 - 600。
- 29。
Gangappa SN, Holm M, Botto JF。BBX24、BBX25与HYH、HY5 HOMOLOG的分子相互作用调节拟南芥幼苗发展。植物信号表现。2013; 8:E25208。
- 30.
王CQ,Sarmast MK,江J,Dehesh K.转录调节剂BBX19通过促进COP1介导的早期开花3降解来促进下胚植物生长Arabidbopsis.植物细胞。2015; 27:1128-39。
- 31.
Crocco CD, Holm M, Yanovsky MJ, Botto JF。AtBBX21和COP1基因互作调控遮荫。植物j . 2010; 64:551 - 62。
- 32.
王海根,张志林,李海英,赵旭,刘学明,Ortiz M,等。CONSTANS-LIKE 7调控拟南芥的分枝和遮荫反应。J Exp Bot. 2013; 64:1017-24。
- 33.
Lippuner V, Cyert MS, Gasser CS。两类植物cDNA克隆差异补充酵母钙调磷酸酶突变体,提高野生型酵母的耐盐性。生物化学学报1996;31:12859 - 66。
- 34.
Nagaoka S,Takano T.盐耐盐相关的蛋白质Sto与MyB转录因子同源物结合,并赋予耐盐性拟南芥.J Exp Bot. 2003; 54:2231-7。
- 35.
王启明,曾建新,邓克强,涂晓军,赵学勇,唐元元,等。在拟南芥中,DBB1a参与赤霉素稳态,作为蓝光介导的下胚轴伸长的负调控因子。足底。2011;233:13-23。
- 36。
Bai Sl,Saito T,Honda C,Hatsuyama Y,ITO A,Moriguchi T.苹果B盒蛋白,MDCol11,涉及UV-B和温度诱导的花青素生物合成。Planta。2014; 240(5):1051-62。
- 37。
LENG XP,JIA HF,SUN X,Shangguan LF,MU Q,Wang BJ等。对铜应力响应葡萄树的比较转录组分析。SCI REP。2015; 5:17749。
- 38。
LENG XP,Wang PP,Wang C,朱XD,Li XP,Li Hy等。葡萄果发育三个阶段参与类胡萝卜素代谢基因的基因组鉴定与表征。SCI REP。2017; 7:4216。
- 39。
褚振宁,王旭,李勇,于海英,李建华,吕永刚,等。番茄B-BOX基因家族的基因组组织、系统发育及表达分析。植物学报2016;7:1552。
- 40.
Cao yp,Han Yh,Meng Dd,Li Dh,jiao cy,金Q等。B盒基因:基因组鉴定,演变及其对梨花花粉生长的贡献(Pyrus bretschneideriREHD。)。BMC植物BIOL。2017; 17:156。
- 41。
刘旭,李锐,戴玉强,陈新世,王学勇。苹果B-box基因家族的全基因组鉴定及表达分析(马吕斯有明显borkh。)基因组。Mol Gen Genomics。2018; 293:303-15。
- 42。
jillon O, Aury JM, Noel B, Policriti A, Clepet C, Casagrande A, et al.;葡萄基因组序列表明主要被子植物门的祖先六倍体化。大自然。2007;449:463-7。
- 43。
Cannon SB,Mitra A,Baumgarten A,Young Nd,May G.节段性和串联基因重复在大基因家族中的演变中的作用拟南芥.BMC Plant Biol. 2004;4:10。
- 44。
Massonnet M,Fasoli M,Tornielli GB,Altieri M,Sandri M,Zuccolotto P等人。红白葡萄种品种中成熟的转录组族计划与浆果皮肤累积相关。植物理性。2017; 174:2376-96。
- 45.
徐烨,侯XD,冯杰,哈利尔 - 鲁克曼M,陶济姆。转录组测序分析揭示了通过在“闪耀的Muscat”葡萄上应用GA3和CPPU来消除赤褐色的机制。SCI Hortic。2019; 250:94-103。
- 46.
黄建云,赵晓波,翁小燕,王磊,谢文伟。水稻B-Box锌指基因家族:基因组鉴定、鉴定、表达谱分析和日变化分析。PLoS ONE。2012; 7 (10): e48242。
- 47.
同伴G, Niyogi KK。池塘浮渣基因组学:衣藻和骨球菌的基因组。植物细胞。2008;20:502-7。
- 48。
Cao Yp,Meng Dd,Han Yh,Chen Tz,jiao Cy,Chen Y,Jin Q,Cai Yp。B型箱基因的比较分析及其在石斛中各种治疗下的表达模式分析。BMC植物BIOL。2019; 19:245。
- 49。
Crocco CD,Botto JF。BBX蛋白在绿色植物中:洞察他们的演化,结构,特征和功能多样化。基因。2013; 531(1):44-52。
- 50.
Kenrick P,Crane Pr。土地上植物的起源和早期演变。自然。1997年; 389:33-9。
- 51.
侯慧敏,李军,高敏,Singer SD,王辉,毛丽丽,等。葡萄SBP-box家族基因的基因组组织、系统发育比较及差异表达。PLoS ONE。2013; 8 (3): e59358。
- 52.
王敏,王刚,梁永红,梁永红,等。葡萄藤的基因组和转录组分析(vitis Viniferal .)WRKY基因家族。Hortic杂志2014;1:16。
- 53.
Fasoli M,Dal Santo S,Zenoni S等人。葡萄牙表达Atlas揭示了将整个工厂驱动到成熟程序的深度转录组转变。植物细胞。2012; 24:3489-505。
- 54.
Hassidim M, Harir Y, Yakir E, Kron I, Green RM。过表达CONSTANS-LIKE 5可诱导短日生长的拟南芥开花。足底。2009;230:481 - 91。
- 55.
Park HY, Lee SY, Seok HY, Kim SH, Sung ZR, Moon YH。EMF1与参与调控花期的EIP1、EIP6或EIP9相互作用拟南芥.植物细胞杂志。2011; 52:1376-88。
- 56.
基于B-Box蛋白的盐耐受性同源蛋白(SALT TOLERANCE homolo2)拟南芥这会激活转录并积极调节光介导的发育。植物细胞。2007;19:3242-55。
- 57.
Xu DQ, Li JG, Gangappa SN, Hettiarachchi C, Lin F, Andersson MX, et al.对光的收敛和ABA信号的影响ABI5启动子。公共科学图书馆麝猫。2014;10 (2):e1004197。
- 58.
Gangappa Sn,Crocco CD,Johansson H,Datta S,Hettiarachchi C,Holm M,等。这拟南芥B-BOX蛋白BBX25与HY5相互作用,负调控BBX22的表达,抑制幼苗的光形态建成。植物细胞。2013;25:1243-57。
- 59.
刘yn,陈h,ping q,张紫杉,关泽,方文,等人。CMBBX22延迟叶片衰老的异源表达,提高了耐旱性拟南芥.植物细胞代表2019; 38:15-24。
- 60.
吴炳辉,王立军,王立军,等。浆果成熟:最近听到的小道消息。J Exp Bot. 2014;65(16): 4543-59。
- 61.
常C,李啊,陈L,陈某,Hsieh W,Shin J,等。LZF1,HY5调节的转录因子,功能拟南芥去黄液。工厂J. 2008; 54:205-19。
- 62.
陈杰,陈建勇,王金军,匡建峰,单伟,卢文杰。的分子特征和表达谱macol1., 一种CONSTANS-like香蕉果实中的基因。基因。2012;496:110-7。
- 63.
方慧聪,董永华,岳XX,陈小林,何立新,胡建峰,等。MdCOL4相互作用介导UV-B和高温之间的串扰,控制苹果果实的颜色。植物细胞杂志。https://doi.org/10.1093/pcp/pcz023.
- 64.
Kim DH,Park S,Lee Jy,Ha Sh,Lee JG,Lim Sh。水稻B盒蛋白,OSBBX14,细细调节水稻中的花青素生物合成。int j mol sci。2018; 19(8):2190。
- 65.
郭旭,王玉涛,翟志峰,黄天军,赵东,彭旭,等。双色樱桃果实光依赖花青素积累的转录组分析。植物生理生化。2018;130:663-77。
- 66。
研究了脱落酸生物合成基因表达、脱落酸积累与脱落酸促进葡萄果实成熟的关系。Aust J Wine R. 2009; 15:195-204。
- 67。
Chervin C,El-Kereamy A,Roustan JP,Latchea LJ,Bouzayen M.乙烯似乎是浆果开发和成熟的葡萄,一种非中生果实。植物SCI。2004; 167:1301-5。
- 68。
El-Kereamy A,Chervin C,Roustan JP,Cheynier V,Souquet JM,Moutounet M等。外源性乙烯刺激葡萄浆果中与花青素生物合成相关的基因的长期表达。physiol植物。2003; 119:175-82。
- 69.
Chervin C,Tira-Umphon A,Terrier N,Zouine M,Severac D,Roustan JP。通过乙烯的葡萄浆果膨胀刺激和对熟化转录物的影响。physiol植物。2008; 134:534-46。
- 70。
LENG XP,Wei HR,Xu XZ,GHUGE SA,贾DJ,刘GS,王YZ,元YB。Grapevine中TCP转录因子的基因组鉴定及转录分析。BMC基因组学。2019; 20:786。
- 71。
Tamura K,Peterson D,Peterson N,SteCher G,Nei M,Kumar S. Mega5:使用最大可能性,进化距离和最大判定方法的分子进化遗传学分析。mol Biol Evol。2011; 28:2731-9。
- 72.
胡湾,金吉,郭亚,张H,罗杰,高G. GSD 2.0:升级基因特征可视化服务器。生物信息学。2014; 31(8):1296。
- 73.
唐清,王X,鲍德·杰,明河,阿拉姆米,帕特森啊。通过繁殖的高血管植物基因图解开古老的六倍倍性。Genome Res。2008; 18:1944-54。
- 74.
Postel D, Vanlemmens P, Gode P, Ronco G, Villa P. Plant CARE,植物顺式作用调控元件的数据库和启动子序列硅分析工具的门户。核酸学报2002;30:325-7。
- 75.
Saeed Ai,Bhagabati Nk,Braisted JC,Sharov V,Howe Ea,Li Jw等。TM4微阵列软件套件。方法酶。2006; 411:134-93。
- 76.
上官丽芬,穆青,方旭,张克坤,贾海峰,李晓燕,等。rna测序揭示了餐桌葡萄果实发育过程中的生物网络。PLoS ONE。2017; 12 (1): e0170571。
- 77.
海德MS,张C,Kurjogi MM,Pervaiz T,Zheng T,Zhang CB等。通过生物化学,生理和RNA-SEQ分析揭示的葡萄树防御反应探讨。SCI REP。2017; 7:13134。
- 78.
朱晓东,李雪平,九圣,张昆,王超,方建国。通过对葡萄调控网络的分析,揭示了对渍水胁迫的响应和对损害程度的候选基因标记选择。R Soc Open Sci. 2018;5:172253。
- 79.
Guan L,Haider Ms,Khan N,Nasim M,Jiu St,Fiaz M等人。转录组序列分析详细阐述了葡萄树(vitis Vinifera对盐胁迫的响应。中华医学杂志。2018;19(12):4019。
- 80.
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术对相关基因表达数据进行分析−ΔΔCT方法。方法。2001;25(4):402 - 8。
- 81.
火花IA,散迹J,Kearns A,Hawes C.烟草植物中的荧光融合蛋白的快速,瞬态表达以及稳定转化的植物的产生。NAT PROTOC。2006; 1(4):2019-25。
致谢
我们感谢审阅者和编辑对此手稿的仔细阅读和有用的评论来扩展我们的审阅者和编辑。
资金
这项工作得到了中国国家重点研发项目XP愣(2019 yfd1001405)和YB元(2016 yfd0400100),青岛农业大学的高级科学研究基金会XP愣(665/1118011)和詹方(665/1119002),山东省自然科学基金,中国(ZR2017YL022),以及青岛市民生科技项目(# 18-8-1-428-nsh)。资助方不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
隶属关系
贡献
HRW主要负责数据分析和实验设计。PPW参与亚细胞定位和数据分析。JQC和CJL参与数据分析并进行qRT-PCR。YZW提供了实验材料。XPL和YBY负责项目和稿件的修改。JGF对手稿的撰写做出了贡献。所有的作者都评论、阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1
.VVBBX蛋白的结构。数字表示相应保守结构域的氨基酸长度和位置。蓝色,红色和绿色框分别表示B盒1,B盒2和CCT结构域。秤条代表100个氨基酸。
附加文件2图S2
.VVBBX蛋白中的保守结构域。A,B和C分别代表了B盒1,B盒2和CCT结构域的蛋白质对准。X轴表示域的保守序列。每个字母的高度表明所有蛋白质中的每种残留物保留。Y轴是相对熵的刻度,其反映了每个氨基酸的保守率。
图S3
.VvBBXs保守域的多序列比对。B-box 1 (A)、B-box 2 (B)和CCT (C)域的多重序列比对如图所示。使用DNAMAN7.0对序列进行比对。
附加文件4图S4
.葡萄和梨BBX基因的系统发育分析。采用ClustalX对葡萄(VvBBX)和梨(PbBBX)的BBX蛋白全长氨基酸序列进行比对,采用MEGA5.0最大似是法构建系统发育树。
附加文件5图S5。
葡萄树,梨,拟南芥和番茄中BBX基因的系统发育分析。来自葡萄(VVBBX),梨(PBBBX),拟南芥(ATBBX)和番茄(SLBBX)的BBX蛋白的全长氨基酸序列由CLUSTALX排列,并且使用MEGA5.0的最大似然法构建系统发育树.
附加文件6
.同源VvBBX基因对之间的Ka/Ks比值及差异。
附加文件7
.GSDS产生的VvBBX家族基因结构。黄色区域表示编码序列(CDS),蓝色区域表示基因的上游或下游,黑色区域表示内含子。比例尺表示DNA序列的长度。
图S7附加文件8
.葡萄VvBBX基因启动子顺式调控元件分析。VvBBX基因启动子区域(翻译起始位点上游2.0 kb)中每个顺式作用元件的数量。根据功能注释,顺式作用元件主要分为三类:植物生长发育顺式作用元件、植物激素响应顺式作用元件或与非生物和生物胁迫相关顺式作用元件(结果见附加文件)6:表S1)。
附加文件9表S2。
Grapevine BBX基因家族的启动子分析。
附加文件10表S3。
葡萄VvBBX基因在不同器官、组织和发育阶段的表达谱
附加文件11
.葡萄VvBBX基因在三个果实发育阶段的表达谱
附加文件12
.的表达式概要VvBBX基因对GA3和CPPU处理的响应。
附加文件13表S6。
VvBBX基因在非生物胁迫下的表达谱。
图S8.附加文件14
葡萄、拟南芥、水稻、番茄和梨的BBX家族成员。
图S9附加文件15
曲瓣VVBBX18和VVBBX19的蛋白质交互网络通过串。
附加文件16表S7。
曲瓣VVBBX18和VVBBX19的蛋白质交互网络通过串。
附加文件17表S8。
QRT-PCR和基因扩增的VVBBX基因的引物序列。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
魏,H.,王,P.,陈,J.et al。基因组 - 范围鉴定和分析变数寄存器葡萄基因家族揭示了其在浆果发育中的潜在功能。BMC植物BIOL.20,72(2020)。https://doi.org/10.1186/s12870-020-2239-3
收到了:
接受:
发表:
关键字
- 变数寄存器
- 葡萄藤
- 基因表达
- 浆果开发
- 应激反应