摘要
背景
烟草是重要的经济作物。打顶是烤烟的一种常见农业做法,旨在通过增加根部尼古丁的生物合成来增加叶片尼古丁含量。许多基因被发现在顶顶反应中表达差异,特别是与尼古丁生物合成有关的基因,但目前还没有对顶顶诱导的早期转录反应进行全面分析。为了详细了解烟叶顶顶后尼古丁生物合成的调节机制,我们对烟叶顶顶后尼古丁的转录组进行了测序烟草在顶部后的七个时间点上根。
结果
差异表达分析显示,4830个基因在所有时间点都对顶顶有反应。其中,9个参与尼古丁生物合成的基因家族和2个参与尼古丁运输的基因家族在抽顶后的24小时内发生了显著变化。差异表达基因(DEGs)对亲本种无明显偏好。qRT-PCR检测了9个参与尼古丁生物合成和植物激素信号转导的基因转录水平的显著变化。549个编码转录因子(TFs)的基因,根据转录水平时间-过程谱的相似性,形成了15个簇。在抽穗后最早时间点鉴定出336个参与植物激素信号转导的基因,包括与植物激素茉莉酸、脱落酸、生长素、乙烯和赤霉素功能相关的基因。
结论
我们的研究首次详细分析了topping in的早期转录反应n .烟草,并为进一步详细研究烟草根中尼古丁生物合成的调节确定了极好的候选。
背景
烟草(烟草L.)植物,打顶(定义为去除开花头和幼叶)是必不可少的栽培实践。打顶使植物从种子繁殖阶段转变为叶片营养阶段,这显著增加了叶片尼古丁含量[1].许多研究采用了各种实验技术,调查了烟草对顶部的反应[2,3.,4].尼古丁生物合成的上调,仅发生在根中,特别是生长中的根尖,是烟草植物对顶顶的典型反应之一。5].
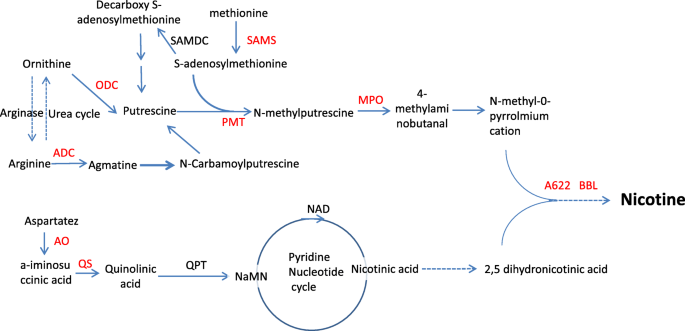
尼古丁在确立烟草的商业品质和保护植物抵御食草动物方面起着关键作用。尼古丁是一种与烟草应激反应相关的次生代谢物,在烟草根部打顶可重复促进尼古丁的生物合成[6].尼古丁由两个主要的含氮环组成,即吡咯烷环和吡啶环[7].吡咯烷环的生物合成涉及精氨酸脱羧酶(ADC) [8],鸟氨酸脱羧酶(ODC) [9]、s -腺苷甲硫氨酸脱羧酶(SAMDC)、s -腺苷l-甲硫氨酸合成酶(SAMS)、腐胺n -甲基转移酶(PMT) [10,11]和n -甲基腐胺氧化酶(MPO) [12,13].吡啶环的生物合成始于烟酸二核苷酸(NAD)生物合成途径。参与该途径早期代谢转化步骤的酶包括天冬氨酸氧化酶(AO)、喹啉酸合成酶(QS)和喹啉酸磷酸核糖转移酶(QPT) [14,15,16].A622基因(编码异黄酮还原酶样蛋白)负责尼古丁环偶联,BBL基因(编码小檗碱桥酶样蛋白)参与随后导致尼古丁的氧化步骤[17,18].
最近一份报告[19]采用抑制消减杂交(SSH)技术进一步研究了顶顶后24小时内烟草根系的转录反应。129个高质量表达序列标记被鉴定为代表DEGs,大多数参与应激/防御,次级代谢和信号/转录[19].尼古丁生物合成的调控一直被认为是一种复杂的生理反应,许多tf直接或间接参与了其调控[20.,21].通过对茉莉酸处理的两个消减cDNA文库的分析,进一步了解尼古丁生物合成途径的转录调控烟草benthamiana根,并通过检查病毒诱导基因沉默(VIGS)技术的影响。在69种TF中,6种(来自3个TF家族)影响尼古丁代谢NbbHLH1而且NbbHLH2(基本螺旋-环-螺旋)基因正调控尼古丁生物合成的茉莉酸激活,通过过表达[22].
虽然已经确定了烟草顶顶后调节尼古丁合成的特定基因,但还没有对烟草顶顶反应的转录调节网络的详细描述。的异位四聚体状态使情况进一步复杂化n .烟草的杂化形成的n的抗旱性(S-subgenome)和n tomentosiformis(t亚基因组),而这两个亚基因组对顶部的反应尚不清楚。在本研究中,我们对烟草顶芽后7个不同时间点(0、0.5、1、3、5、8和24小时)的烟草根转录组进行了测序。选择这些时间点是为了在早期阶段识别与尼古丁生物合成调控相关的候选基因,并通过TF基因表达时间过程谱的聚类发现尼古丁合成的上游调控因子,并比较两个亚基因组对顶峰的响应。这种综合的方法描述了烟草的转录反应,特别是关注尼古丁生物合成的早期调控,应该有助于促进这种作物的遗传改良。
结果
转录组测序和质量评估
利用18株烟草根的总RNA进行RNA测序(RNA- seq)文库构建。使用Illumina平台对18个RNA-Seq文库进行测序。在过滤掉低质量序列(质量分数< 25)后,获得了105 Gb的清洗数据,约为每个样本6gb。被清洗序列的GC含量从42.1到42.7%不等(附加文件6:表S1)。与参考基因组序列相匹配的清洁样本的测序率为91.6 ~ 97.8%(附加文件)6:表S1)。测序质量和基因表达水平在测序样本中基本一致(附加文件1:图S1)。
差异表达基因(DEGs)的鉴定与验证
计算烟草转录组基因的表达水平,并归一化为FPKM值(每千碱基的片段每百万片段映射)。各生物重复的Pearson相关系数均超过0.82。在不同时间点的样本之间的相关性方面,有些样本与其他时间点的样本之间的相关性较高。例如,与BWR24-1A相比,BWR3-2A的相关系数为0.96,与BWR5-2A的相关系数为0.952:图S2)。需要进一步的实验来阐明这一意想不到的观察结果。通过将各时间点的样品与t = 0样品进行比较,以折叠变化(FC) > 2和错误发现率(FDR) < 0.05为筛选标准,顶顶后共鉴定出4830个deg。一个几乎相同的数字(2082和2075基因)来自n tomentosiformis而且n的抗旱性基因组,分别(附加文件7:表S2)。值得注意的是,0.5 h时的deg数量(2562个)远远多于其他任何时间点,这表明在较早的时间有更多的基因对顶顶做出反应。在顶浆后1小时,deg的数量下降到最低水平(815个)。1a).然而,在t = 8小时观察到差异基因表达的第二次爆发(1756),随后在t = 24小时下降(图。1a).结果表明n .烟草根在顶后0.5小时和8小时产生两个不同的转录活性峰值。这一结果与抽穗后6个时间点特异性诱导的基因数一致,抽穗后t = 0.5 h的基因数最多,为1186个,抽穗后t = 8 h的基因数次之,为585个。1b)。
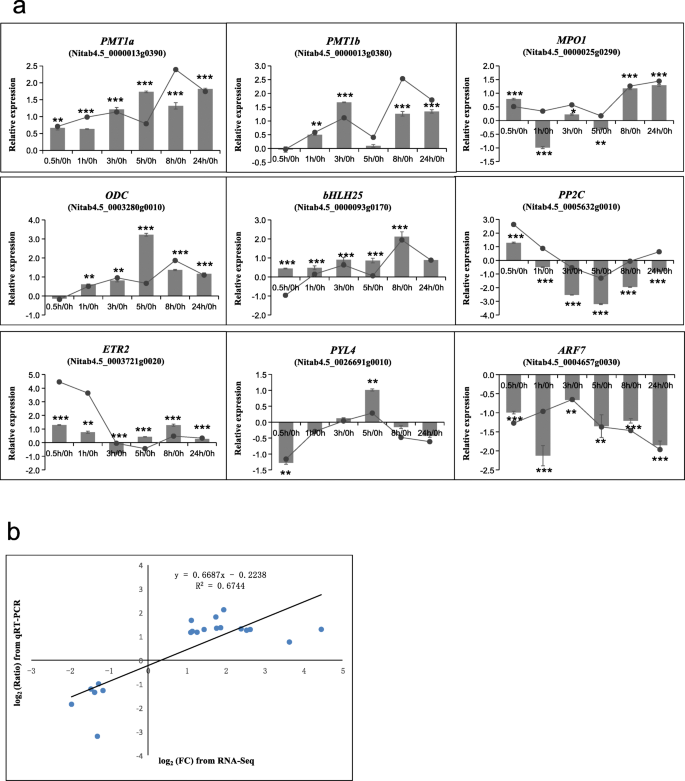
为了验证RNA-Seq的转录结果,我们选择了9个与尼古丁生物合成和植物激素信号转导相关的基因,并通过qRT-PCR检测了它们的转录应答。qRT-PCR分析的这些基因的表达趋势与相应时间点的RNA-Seq分析一致(图。2).RNA-Seq分析所选deg的变化与qRT-PCR (R2= 0.674)。这些结果证实了RNA-Seq检测到的基因表达的变化准确地反映了打顶后不同时间点的转录差异。
DEGs的功能分类及富集分析
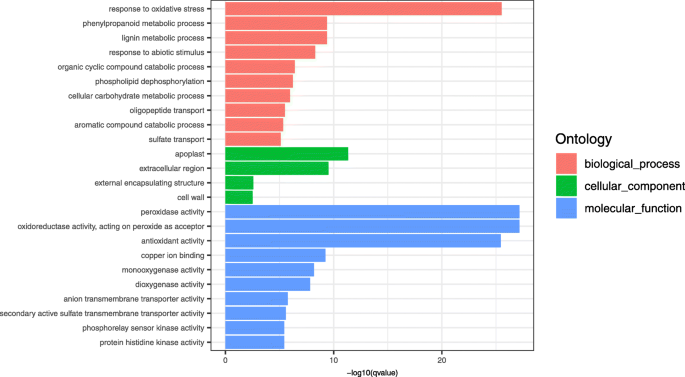
选取4830个在打顶后不同时间点表现出显著变化的deg进行进一步分析。基于它们的相对表达水平,使用层次聚类将这些DEGs分为不同的类别,根据根系在顶后不同时间点的转录反应的时间模式进行区分(附加文件3.:图S3)。通过GO(基因本体论)注释和KEGG(京都基因和基因组百科全书)路径分析,得到了这些基因的预测功能。根据GO术语注释,deg分布在42个功能术语中,如下:19个术语用于生物过程,12个术语用于分子功能,11个术语用于细胞成分(附加文件)4:图S4)。
对不同时间点制备的文库进行了氧化石墨烯富集分析,以对deg的假定功能进行分类(图2)。3.).GO富集类生物过程中的DEGs主要参与氧化应激反应(GO:0006979)、苯丙类代谢过程(GO:0009698)、木质素代谢过程(GO:0009808)和非生物刺激反应(GO:0009628)。GO富集类细胞成分的DEGs主要分布在外质体(GO:0048046)、细胞外区(GO:0005576)、外包封结构(GO:0030312)和细胞壁(GO:0005618)。GO分子功能富集类别的DEGs主要与过氧化物酶活性(GO:0004601)、抗氧化活性(GO:0016209)以及一系列转运蛋白活性(GO: GO:0006857、GO:0008272、GO:0008509、GO:0008271)相关(图。3.).
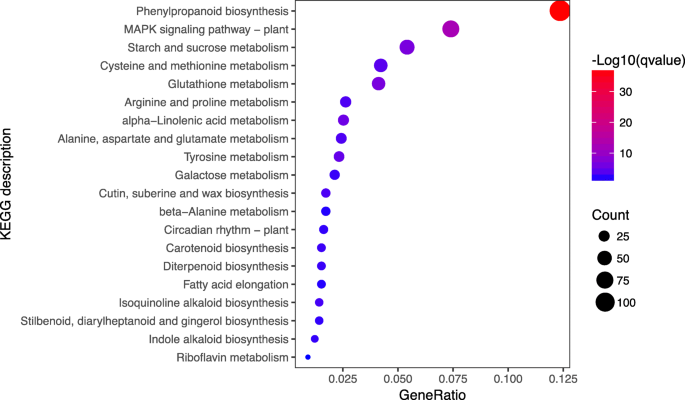
为了进一步研究差异表达转录本在顶顶反应中的功能,我们通过将序列映射到KEGG数据库类别进行富集分析。有KEGG注释的DEGs被分为28类,主要与信号转导(221类)、碳水化合物代谢(212类)、其他次生代谢产物的生物合成(166类)、萜类和多酮类代谢(69类)有关(附加文件)5:图S5)。KEGG富集分析还表明,DEGs在苯丙烷生物合成主要途径(ko00940)、淀粉和蔗糖代谢主要途径(ko00500)中显著富集,在植物MAPK信号通路(ko04016)中显著富集,它们对损伤的反应及其在次生代谢生物合成中的作用已在之前得到阐明[23,24,25(图。4).
DEGs参与尼古丁的合成和运输
我们进一步研究了由顶部激活的基因是否参与尼古丁的生物合成和运输。正如预期的那样,参与尼古丁生物合成的九个基因家族(AO,QS,ODC,ADC,地空导弹,PMT,A622, MPO,洗液)(图。5),以及两个与尼古丁转运有关的基因家族(伴侣,国家联盟),通过显示与先前报道的酶的主要序列至少93%的同源性,在DEG数据集中被发现(附加文件8:表S3)。所有基因均表现出转录上调的趋势,最多出现在打顶后8 h和24 h;我们的qPCR检测也验证了4个基因的表达变化(PMT1a, PMT1b, MPO, ODC)在相应的时间点(图;2).在尼古丁运输中编码MATE和NUP的基因家族都被发现上调(附加文件)8:表S3)。与所有deg的情况类似,大多数参与尼古丁合成和运输的deg都存在于两个亚基因组中。编码AO的一个DEG来自t亚基因组,编码MPO和ODC的所有DEG来自s亚基因组。
deg参与尼古丁的生物合成。实线和虚线分别表示已定义和未定义的反应,deg以红色表示。缩写:ADC,精氨酸脱羧酶;ODC,鸟氨酸脱羧酶;s -腺苷- l-蛋氨酸合成酶;s -腺苷甲硫氨酸脱羧酶;PMT,腐胺n -甲基转移酶;MPO, n -甲基腐胺氧化酶;AO,天冬氨酸氧化酶;喹诺酸酯合成酶; QPT, quinolinic acid phosphoribosyl transferase; A622, isoflavone reductase-like protein; BBLs, berberine bridge enzyme-like proteins. The genes with significantly up-regulated transcription levels are shown in red
转录因子(TFs)与表达模式的基因聚类
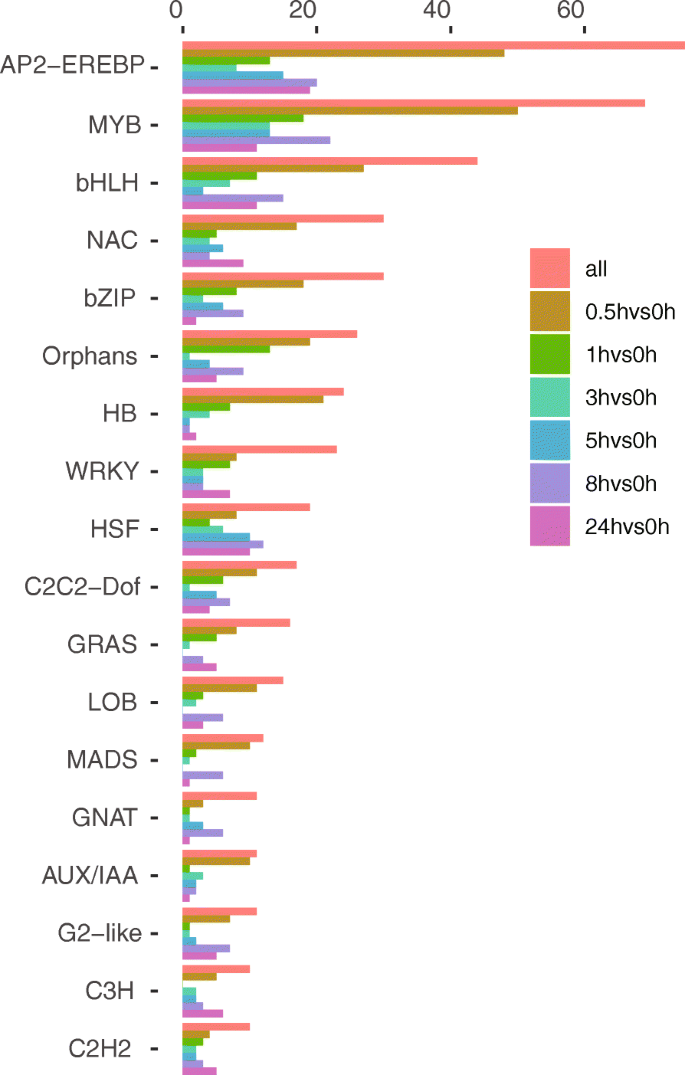
为了研究烟草抽顶后尼古丁生物合成的上游调控机制,我们接下来重点研究了烟草根转录组中表达的DEGs中的tf类型。在我们的研究中,共鉴定出549个编码tf的deg(附加文件9:表S4),共分为49个TF族。其中,t = 0.5 h时tf数量最多(355个),占所有tf的65%,上调240个,下调115个。其次是t = 8 h时间点(253个),占所有tf的46%,其中94个上调,159个下调。这表明许多tf基因参与了即时早期基因激活。值得注意的是,有18个家族包含10个以上的基因成员,它们分别是AP2-EREBP(75个)、MYB(69个)、bHLH(44个)、NAC(30个)、bZIP(30个)、Orphans(26个)、HB(24个)、WRKY(23个)、HSF(19个)、C2C2-Dof(17个)、GRAS(16个)、LOB(15个)、MADS(12个)、GNAT(11个)、AUX / IAA(11个)、G2-like(11个)、C3H(10个)和C2H2(10个)。6).
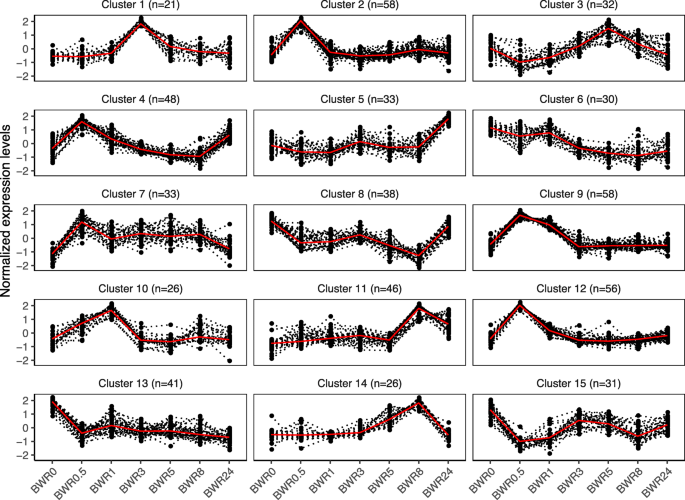
为了进一步研究特定tf对尼古丁生物合成调控网络的贡献,我们使用549个tf和与尼古丁生物合成途径相关的上调结构基因进行了聚类。获得了15个表达谱相似的聚类(图。7和附加文件10:表S5)。可以观察到,几个集群是相似的,但有微小的差异。例如,聚类2和12的tf在t = 0.5 h上调,聚类9和10的tf在0.5 - 1 h上调。然后他们回到顶部之前的表达水平(图。7).值得注意的是,尼古丁生物合成中上调的DEGs主要集中在簇11(20个DEGs)中,在加顶后t = 8 h和t = 24 h时,上调幅度最大(图2)。7和附加文件10:表S5)。在簇11中发现了bHLH家族和AP2-EREBP家族的17个基因,包括ERF189 (Nitab4.5_0003090g0030和Nitab4.5_0015055g0010)和ERF91 (Nitab4.5_0004620g0030)(附加文件)10:表S5)。
DEGs与植物激素信号转导有关
众所周知,植物激素对烟草打顶反应迅速,并影响烟草根中尼古丁的生物合成,因此我们研究了植物激素信号转导在烟草打顶诱导的转录反应中的作用。我们鉴定了336个deg,包括生长素(IAA)、脱落酸(ABA)、乙烯、赤霉素(GA)和茉莉酸(JA)的生物合成、代谢和作用相关的deg(附加文件)11:表S6)。参与IAA信号转导的53个DEGs包括ARF(生长素反应因子)家族(4)、AUX/IAA(生长素反应蛋白)家族(11)、AUX1(氨基酸转运蛋白)家族(22)、GH3 (GH3生长素反应启动子)家族(7)和SAUR(生长素反应SAUR蛋白)家族(9)。大多数与IAA信号通路相关的DEGs表达显著上调,在t = 0.5 h时,36个基因中有21个表达上调。在t = 8 h时,18个基因中有10个表达上调。在ABA信号转导途径中,鉴定出6个基因家族,包括PYL/PYR(脱落酸受体)家族(5)、SAPK(丝氨酸苏氨酸蛋白激酶)家族(2)、PP2C(蛋白磷酸酶2C)家族(28)、CIPK (cbl -相互作用蛋白激酶)家族(19)、CDPK(钙依赖性蛋白激酶)家族(9)和Calmodulin(钙调素样蛋白)家族(8)。在t = 0.5 h检测到43个表达变化,在t = 8 h检测到19个表达变化。83个DEGs与乙烯信号通路有关,包括AP2-EREBP(乙烯响应转录因子)家族(75)和ETR(乙烯受体)家族(8),大多数DEGs在t = 0.5 h时被鉴定出来(55)。GA和JA信号通路(分别为4个和3个基因家族)在打顶后也发生了显著的转录变化。
植物激素和尼古丁的定量
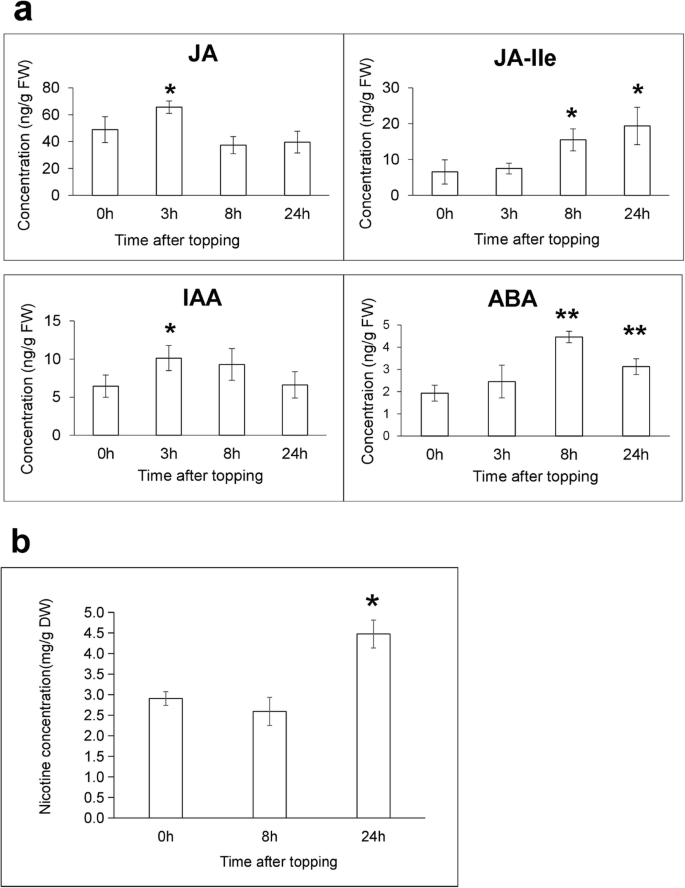
植物激素在调节植物防御和发育中起着至关重要的作用。为了深入了解植物激素影响烟草对打顶反应的机制,我们测量了打顶后不同时间点根样品中IAA、JA、JA- ile和ABA的水平。t = 3 h打顶诱导JA和生长素信号通路。t = 3 h时JA水平显著增加了近34% (P= 0.035,成对t在t = 8 h和t = 24 h时,降低了23.5和18.9%(图2)。8).复盖引起的JA- ile水平变化与JA的变化密切相关,在t = 24 h时,JA- ile水平显著提高至约3倍(P= 0.014,成对t试验)与未处理植物的对照。t = 3 h时IAA水平显著升高(P= 0.024,成对t测试),同时在t = 24小时下降到初始水平(图。8).t = 8 h时ABA水平逐渐升高至2.3倍(P= 0.0003,配对t测试),并在t = 24 h时达到1.6倍(P= 0.009,配对t测试),与未处理的植物相比。我们还测量了戒烟后的尼古丁含量。我们的分析表明,在t = 24小时,尼古丁含量显著增加至1.5倍(P= 0.01,成对t(图;8).
讨论
转录组测序和对顶顶的DEGs反应
尼古丁是烟草特有的副产物。在大多数烟草在植物中,它在根中合成,然后被运输到叶片,在那里积聚[26].尼古丁的合成和积累不仅受到各种环境因素的控制,而且还受到管理措施的控制,包括顶部[2,6].控制浇头诱导的生物碱生物合成增加的因素尚不清楚,但由于植物激素诱导信号的改变,在植物中涉及复杂的生理反应[11].为了更好地了解烟草对顶叶反应的机制,我们对烟草对顶叶反应的转录组进行了测序和分析n .烟草根在顶部后的早期时间点。我们共鉴定了4830个响应顶素的deg,它们分布在许多不同的分子功能类别中,包括次级代谢、植物激素信号转导、应激防御和其他代谢。
DEGs参与尼古丁生物合成和亚基因组转录偏好
我们检测到在抽顶后t = 24小时,每个生物重复4株植物的尼古丁水平变化为1.5倍,这与之前的报道一致[27].值得一提的是,在这个时间点上,每个含有单一植物的生物重复都没有检测到尼古丁含量的显著变化(数据未显示),这表明单个植物在短时间内的反应不同。然后,我们更仔细地检查了已知参与尼古丁生物合成和运输的基因的转录变化。在DEGs中鉴定出尼古丁生物合成途径中的9个基因家族。它们的功能包括吡啶环合成(AO而且QS)、吡咯烷环合成(ODC,ADC,PMT,地空导弹,MPO),以及两个尼古丁环的结合(A622而且洗液).鸟氨酸脱羧酶(ODC)催化多胺生物合成的第一步和限速步骤,将鸟氨酸转化为腐胺。下调的ODCRNAi转录水平导致尼古丁含量降低n .烟草[28,29].相应地,在我们的研究中,1ODCt = 8 h和t = 12 h时,基因表达显著上调。第二个例子涉及PMT,它将腐胺转化为n -甲基腐胺[30.].在之前的研究中,是5个PMT研究基因(NtPMT1a,NtPMT1b,NtPMT2,NtPMT3而且NtPMT4).转录本来源于NtPMT2而且NtPMT1b在顶部后的24小时内,其丰度增加最多(约3倍)[31].与这些发现一致,在我们的研究中,所有5个PMT基因的表达水平在顶后的不同时间点都显著上调(附加文件7:表S2)。SAMS提供了一个进一步的例子,它通过为PMT反应提供s -腺苷甲硫氨酸辅因子间接促进尼古丁的生物合成[32].在我们的研究中,有五个地空导弹基因在顶部后的早期时间点显著上调(附加文件8:表S3)。
QPT酶在尼古丁中吡啶部分的合成中起着关键作用烟草,除了在NAD(P)(H)合成中普遍存在外[33].烟草基因组包含两个重复的QPT基因(指定QPT1而且QPT2).QPT1在所有植物组织中均以基本水平表达,在顶端分生组织中表达水平稍高。相比之下,QPT2只在烟草根中表达,并与其他结构基因协调调节尼古丁生物合成[33,34].虽然QPT1而且QPT2QPT2基因(Nitab4.5_0000742g0010)在3 h和24 h的qPCR检测中均有显著上调(数据未显示)。
最后,我们考虑A622,在根中表达,可能参与尼古丁生物合成的最终缩合反应[35].的能力n glauca当使用RNAi方法下调基因表达,从而降低A622蛋白水平时,产生anabasine的效率显著降低。这导致植物的叶片中几乎检测不到吡啶生物碱的水平,即使在根尖组织受损后[18].在我们的工作中,表达A622在浇头后t = 8 h和t = 24 h显著上调(附加文件7:表S2),意味着A622正向调控偶联环最后一步烟碱的生物合成。与实验结果一致A622,洗液基因也被发现是在打顶后被诱导的,正如先前的报道[17].
n .烟草假设是两个亲本基因组杂交的结果(n的抗旱性而且n tomentosiformis).n tomentosiformis尼古丁含量比n的抗旱性在根和叶中[36].所有的deg,特别是那些参与尼古丁生物合成和运输的deg,对两个亚基因组中的任何一个都没有明显的偏好。需要更多的实验工作来阐明杂种优势的分子基础和杂交后戏剧性的驯化选择。
与尼古丁合成调控相关的差异表达转录因子
烟碱生物合成结构基因顶顶诱导的表达变化模式最初来源于对序列数据的生物信息学分析,但经qRT-PCR实验证实。因此,有理由推测,序列数据也可以用于识别在顶部后的早期时间点积极调节尼古丁产生的TF(s)。如前所述,许多tf在调节尼古丁生物合成中发挥重要作用,包括AP2/EREBP、bHLH、ARF和WRKY家族成员[37,38].AP2/EREBP家族是烟草基因组中最大的TF家族[39]和IX组亚家族的erf型tf,包括ERF1, ERF189,ERF32,最近已被确定为尼古丁生物合成结构基因的直接调节因子[22,33,40].第二大类tf显示诱导生物碱的生物合成烟草是类似myc2的bHLH家族MYC2,属于bhlh - tf家族,是保守茉莉酸盐信号的关键成分[41].它可以通过g盒介导的尼古丁结构基因的结合和激活,直接或间接地调节尼古丁的产生小块土地基因(42,43].王等。[44的过度表达NtMYC2a在田间测试中,转基因品系的尼古丁含量大大提高。尽管这种机制ARF1调节尼古丁合成仍不清楚,VIGS(病毒诱导基因沉默)的bHLH3而且ARF1结果与对照植物相比,尼古丁含量显著增加[22].此外,WRKY-R1WRKY家族第II族成员WRKY在烟草根中特异性高表达。这表明它可以调节与尼古丁合成相关的基因表达,比如PMT[37].
在我们的研究中筛选DEGs导致鉴定了549个注释为tf的DEGs,包括AP2 / EREBP(75),bHLH(44)WRKY(23),东盟地区论坛(4)家庭。(无花果。6和附加文件9:表S4)。为了阐明tf的共同调节模式,我们将所有DEG tf与尼古丁生物合成相关的结构基因聚类。我们发现簇11包含了28个结构和转运蛋白基因中的20个,以及bHLH和AP2-EREBP家族的17个基因。我们选择了bHLH家族7个基因中的一个(Nitab4.5_0000093g0110)进行RNAi研究,发现合成的植物显示出尼古丁水平的改变(未发表数据),这意味着在尼古丁生物合成中具有重要的调节作用。其他新发现的AP2/EREBP, bHLH, WRKY, ARF, MYB,南汽TF基因也可能参与尼古丁的生物合成,因为所有这些TF家族都被描述为在调节植物次生代谢中起作用[45,46,47].因此,这些是进一步实验的良好目标。
对顶顶反应的DEGs参与植物激素信号转导
植物激素在调节植物生长发育的许多方面起着关键作用,包括次生代谢。已知有五类主要的植物激素参与尼古丁生物合成的调节,包括JA、IAA、GA、乙烯和ABA [32,48,49,50,51].已知JA处理通过调控尼古丁生物合成酶的编码基因,有效诱导烟草尼古丁生物合成,包括QPT,ODC,PMT[34,38,52,53].杨等。[54]报道了JA对烟草BY-2细胞影响的分析,发现12个乙烯反应因子和4个与生物碱形成相关的基本螺旋-环-螺旋因子的转录水平升高。已知JAs在烟草尼古丁生物合成调控中与其他植物激素信号通路相互串扰的复杂网络中起作用。例子包括JA ZIM-domain 1(JAZ1)蛋白(JA信号的关键阻遏物),它在体内与DELLA蛋白(GA途径的阻遏物)相互作用[48),而NtPYL4(一种功能性ABA受体),其转录受JAs调控[49].
在本研究中,我们认为顶伤作为机械损伤的一种形式,激活JA信号是最早的事件之一。JA- ile是已知的唯一参与JA信号传导的JA衍生物,在抽顶后24小时内含量持续增加,表明在调节尼古丁生物合成中起着重要作用。在t = 0.5 h和t = 8 h时,两个jas编码基因的表达水平分别显著上调,这与观察到的JA和JA- ile水平升高一致。我们的实验数据也表明,在打顶后,JA和IAA浓度的变化模式相似。这与JA和生长素具有非常相似的信号传递机制的报道是一致的。然而,JA和IAA如何协同响应顶部刺激并调节尼古丁生物合成仍不清楚[37],并需要进一步调查。
由于植物激素的变化,调控网络下游的基因也出现了相应的变异。值得注意的是,所有编码AUX/IAA的基因都在t = 0.5 h时上调,这意味着IAA水平在较早的时间点上升。同样,所有ABA受体PYL基因在t = 0.5 h和t = 8 h时表达量均较低,表明突变所有供试表达影响烟草JA对尼古丁生物合成的反应。最后,在我们的研究中,我们发现大量与生长素信号、ABA信号、乙烯信号和赤霉素信号相关的调控基因在打顶后t = 0.5 h的表达水平显著改变,这表明在这些植物激素信号通路上迅速构建了具有串音的复杂网络,作为对打顶的早期反应(附加文件)11:表S6)。
结论
通过测序转录组n .烟草在抽顶后不同时间点的根中,鉴定出4830个表达水平不同的基因,包括11个与尼古丁生物合成和转运有关的基因家族,549个编码转录因子的基因,336个与植物激素信号转导有关的基因。这为未来的功能基因组学研究提供了很好的候选者,以说明烟草根中尼古丁的生物合成和调控。
方法
RNA提取,文库制备,转录组测序
的种子烟草云烟87号由云南省烟草农业科学院烟草种子库无偿提供。这些植物由宋仲邦博士鉴定。该标本在中国科学院昆明植物研究所植物标本室(资料编号:;西格里碳素集团- 001 - 1)。所有材料在商业盆栽土壤中在Percival PGC-10培养箱中生长8周,28°C,昼夜循环16小时。选择形态最相似的单株,去除最年轻的未展开叶片上方的尖顶。用水清洗根部,用手术刀片切除组织,在打顶后0、0.5、1、3、5、8和24小时取18个样本,每个时间点2-3个重复(附加文件6:表S1)。为了提取RNA,根组织被冷冻在液氮中,并用研钵和杵磨成粉末。根据制造商的说明,使用TRIzol (Invitrogen Life Technologies)提取RNA。使用Agilent 2100生物分析仪(Agilent Technologies)对提取的RNA进行质量和数量评估,并进行文库建设。扩增文库于2013年10月在华大基因(中国深圳)的Illumina HiSeq™2000测序仪上测序。读取以90 bp成对端格式生成。测序数据存入美国国家生物技术信息中心(NCBI)序列读取档案(SRA)数据库,登录号为SRP154415。
测序读数的绘制和基因表达的量化
在进一步分析之前,使用CutAdapt (http://code.google.com/p/cutadapt/)和Btrim [55].接下来,我们处理干净的读取并将其映射到烟草基因组(56]使用Hisat2 2.1.0版本[57使用默认参数。参考基因组可在Sol基因组网络网站(ftp://ftp.solgenomics.net/genomes/Nicotiana_tabacum/edwards_et_al_2017/assembly/Nitab-v4.5_genome_Chr_Edwards2017.fasta.gz).基因表达水平估计为FPKM(每千碱基外显子每百万片段映射读取的片段)值[58]使用袖扣软件1.2.1版本[59].
DEGs的鉴定与富集分析
利用Cufflinks中的cuffdiff程序计算t = 0 h样本与其他样本在不同时间点的基因表达差异[59].根据FPKM值的fold change (FC)来确定这些样本之间的基因丰度差异。绝对值为log的基因2折叠变化(FC)≥1和一个调整p-value (q-value)≤0.05定义为差异表达基因(DEGs)。采用参数“scale=row, cluster_rows=T, cutree_rows=8”的pheatmap对deg的FPKM值进行归一化聚类,利用R中的cutree函数估计类别数,在h = 4.8时得到8个类别。
基因本体论(GO)和京都基因和基因组百科全书(KEGG)分析分别鉴定了GO术语和代谢途径中DEGs的富集。为了实现DEGs的功能分类和通路可视化,使用KEGG自动注释服务器(KAAS)对DEGs的代谢通路进行默认参数预测。利用ClusterProfile R和WEGO富集KEGG通路和GO分析中的deg [60,61].一个纠正p值(问-value)≤0.05为KEGG通路和GO项显著富集的阈值。
通过表达谱分析尼古丁生物合成中差异表达的tf和deg的聚类
使用R包mfuzz对尼古丁生物合成中参与差异表达的tf和DEGs进行聚类,聚类编号为15,采用Dmin函数,其他为FPKM在顶顶后不同时间点的配置文件默认值。
所有deg的亚基因组分配
所有的deg被用作查询,对基因组中的所有注释蛋白进行搜索n tomentosiformis而且n的抗旱性.如果第一次命中的物种至少具有90%的身份,而第二次命中的身份值低于第一次命中的物种,则根据第一次命中的物种分配亚基因组。对于参与尼古丁生物合成和运输的deg,根据以前的报告进行了手动检查。
实时荧光定量PCR (qRT-PCR)
为确定RNA- seq检测的基因表达水平,如前所述,qRT-PCR检测使用从3个植物中平均混合的1 μg总RNA用于每个RNA- seq样品[62].使用DNase I去除残留的基因组DNA后,使用带有gDNA Eraser (Perfect Real Time)的PrimeScript RT试剂试剂盒(Takara, Japan)将RNA逆转录为cDNA。qRT-PCR采用LC480系统(Roche, SUI),在20 μL的反应体积中进行,并进行3个生物重复。对不同时间点的样品与烟草进行了3个技术重复肌动蛋白基因作为内标进行归一化,SYBR绿作为荧光色素。PCR采用三步法,95°C预变性30 s, 95°C变性30 s, 45个循环,每个引物对在最佳温度下退火20 s, 72°C延伸20 s,最后进行熔点曲线分析(95°C 15 s, 60°C 1 min, 95°C 15 s),检测扩增子特异性。基因表达水平的相对定量采用2-△△Ct方法。选取基因进行qRT-PCR验证的特异性引物序列根据同源基因间的分歧区域设计,列在附加文件中8:表S7。
测量尼古丁含量和激素水平
为了测量尼古丁含量,将根在105℃下干燥o加热30分钟,温度60℃oC代表3d。从4株植物中平均混合的每个样品(100 mg)与1 mL提取液(40%甲醇含0.5%乙酸(v/v))混合,并按照前面所述的高效液相色谱法定量尼古丁[63].进行3个生物重复,每个重复4个技术重复。为了定量植物激素,将大约200 mg的烟草根在液氮中研磨,并在每个样品中加入1 mL与内部标准物混合的乙酸乙酯。13C2是的,13C2-JA-Ile D4sa, D6-ABA和D5-IAA分别作为JA、JA- ile、SA、ABA和IAA的内标。植物激素的提取和定量已通过HPLC-MS/MS (LCMS-8040, Shimadzu)系统进行了描述[64].每个样品使用3个生物重复。
数据和材料的可用性
测序数据随后存入国家生物技术信息中心(NCBI)序列读取档案(SRA)数据库,登录号为SRP154415。
缩写
- A622:
-
异黄酮还原酶样蛋白
- 阿坝:
-
脱落酸
- ADC:
-
精氨酸脱羧酶
- AO:
-
天冬氨酸氧化酶
- AP2-EREBP:
-
乙烯反应性转录因子
- 东盟地区论坛:
-
生长素反应因子
- 桶:
-
小檗碱桥酶样蛋白
- CDPK:
-
钙依赖性蛋白激酶
- CIPK:
-
cbl相互作用蛋白激酶
- 度:
-
差异表达基因
- ETR:
-
乙烯受体
- FPKM:
-
每千碱基的转录本每百万的片段映射
- 走:
-
基因本体论
- 国际宇航科学院:
-
生长素
- 是:
-
茉莉酸
- JAZ1:
-
JA zimm -domain 1含有蛋白,茉莉基异亮氨酸(JA- ile)。
- KEGG:
-
京都基因与基因组百科全书
- MPO:
-
N-methylputrescine氧化酶
- NAD:
-
烟酸二核苷酸
- ODC:
-
鸟氨酸脱羧酶
- PMT:
-
腐胺N-methyltransferase
- PP2C:
-
蛋白质磷酸酶2C
- QPT:
-
喹啉酸磷酸核糖转移酶
- q:
-
Quinolinate合酶
- SAMDC:
-
S-adenosylmethionine脱羧酶
- 山姆:
-
S-adenosyl-L-methionine合成酶
- SSH:
-
抑制消减杂交
- TF:
-
转录因子
- 中收取:
-
病毒引起的基因沉默
参考文献
鲍德温。原生烟草中植物-草食动物相互作用的生态学分析。植物科学进展。2001;27(4):449 - 458。
Baldwin IT, Karb MJ, Ohnmeiss TE。N-15从硝酸盐到尼古丁的分配-一种损伤诱导的移动防御的产生和周转。生态。1994;75(6):1703 - 13所示。
Baldwin IT, Schmelz EA, Ohnmeiss TE。创伤诱导的根和梢茉莉酸库变化与烟碱合成相关Nicotiana-Sylvestris Spegazzini和来了。化学学报,1994;20(8):2139-57。
Kutchan TM。生物碱合成:药用植物代谢工程的基础。植物科学进展。1995;7(7):1059-70。
陈旭,孙松,刘峰,沈娥,刘玲,叶超,等。烟草根顶部响应性非编码rna的转录组谱(烟草).BMC Genomics, 2019;20:856。
王世生,史庆明,李文华,牛建峰,李佳杰,张福生。去除茎尖和侧芽对烤烟叶片中尼古丁浓度的影响。植物学报。2008;30(8):958-64。
Hakkinen ST, Tilleman S, Swiatek A, De Sutter V, Rischer H, Vanhoutte I, Van Onckelen H, Hilson P, Inze D, Oksman-Caldentey K-M,等。烟草中吡啶生物碱合成相关基因的功能特征。植物化学,2007;68(22 - 24):2773 - 85。
Tiburcio AF, Galston AW。精氨酸脱羧酶作为烟草生物碱腐胺的来源。植物化学,1986;25(1):107 - 10。
Imanishi S, Hashizume K, Nakakita M, Kojima H, Matsubayashi Y, Hashimoto T, Sakagami Y, Yamada Y, Nakamura K.茉莉酸甲酯对烟草细胞培养中编码鸟氨酸脱羧酶和其他参与尼古丁生物合成的酶的差异诱导。植物分子生物学,1998;38(6):1101-11。
桑德斯JW,布什LP。尼古丁生物合成酶活性烟草;不同生物碱水平的基因型。植物科学进展。1979;32(2):366 - 366。
Hibi N, Higashiguchi S, Hashimoto T, Yamada Y.烟草低尼古丁突变体的基因表达。植物细胞。1994;6:723-35。
张志刚,张志刚,张志刚。烟草n -甲基腐胺氧化酶的分子克隆。植物物理学报。2007;48(3):550-4。
Heim WG, Sykes KA, Hildreth SB, Sun J, Lu RH, Jelesko JG。克隆和特性烟草甲基腐胺氧化酶转录本。植物化学,2007;68(4):454 - 63。
瓦格纳R,费斯F,瓦格纳KG。烟碱通路酶活性在烟草愈伤组织中的调控:2。吡啶-核苷酸循环。足底。1986;168(3):408 - 13所示。
辛克莱SJ,墨菲KJ,伯奇CD,哈米尔JD。烟草中喹诺酸盐磷酸核糖转移酶(QPRTase)的分子特征。植物分子生物学,2000;44(5):603-17。
Katoh A, Uenohara K, Akita M, Hashimoto T.拟南芥NAD生物合成的早期步骤从天冬氨酸开始,发生在质体中。植物科学进展。2006;29(3):344 - 344。
Kajikawa M, Shoji T, Kato A, Hashimoto T.空泡定位小檗碱桥酶样蛋白在烟草尼古丁生物合成后期的必要条件。中国生物医学工程学报。2011;36(4):344 - 344。
德波尔KD,莱伊JC,艾特肯CD,苏AKK,哈米尔JD。A622基因烟草glauca(树烟草):在吡啶生物碱合成中的功能作用的证据。植物分子生物学杂志,2009;69(3):299-312。
齐玉春,郭海霞,李凯,刘文强。综合分析差异基因和miRNA谱,以发现烤烟根中的顶部响应基因。中国生物医学工程学报,2012;29(6):344 - 344。
徐松,Brockmoller T, Navarro-Quezada A, Kuhl H, Gase K,凌志,周伟,Kreitzer C, Stanke M,唐华,等。野生烟草基因组揭示了尼古丁生物合成的进化过程。中国科学(d辑),2017,26(3):344 - 344。
Kajikawa M, Sierro N, Kawaguchi H, Bakaher N, Ivanov NV, Hashimoto T, Shoji T.烟草尼古丁生物合成途径进化的基因组研究。中国生物医学工程学报,2017;29(2):344 - 344。
Todd AT, Liu EW, Polvi SL, Pammett RT, Page JE。功能基因组学筛选识别多种转录因子,调节生物碱的生物合成烟草benthamiana.植物学报,2010;26(4):589 - 596。
韩松,王长泉,王丽玲,姜娟。丝裂原活化蛋白激酶6对拟南芥根系生长的调控作用2 +基于−Na+盐胁迫下根细胞的通量。中国生物医学工程学报,2014;26(5):344 - 344。
李凯,杨峰,张刚,宋松,李勇,任东,苗勇,宋晓平。AIK1是一种丝裂原活化蛋白激酶,通过MKK5-MPK6激酶级联调控脱落酸反应。中国生物医学工程学报,2017;29(2):344 - 344。
李凯,杨峰,苗勇,宋cp .脱落酸信号通路参与丝裂原活化蛋白激酶级联模块AIK1-MKK5-MPK6的调控。植物信号与行为研究,2017;12(5):e1321188。
Y Chintapakorn,哈米尔JD。反义基因介导的腐胺n-甲基转移酶活性下调烟草.会导致阿纳他滨含量升高而尼古丁含量下降。植物化学学报,2003;29(1):457 - 457。
程郭傅Y, H, Z,王R, G,霍G,刘w . NtNAC-R1小说NAC转录因子基因在烟草根,响应拍摄分生组织的机械损伤。植物化学学报,2013;
Dalton HL, Blomstedt CK, Neale AD, gladow R, DeBoer KD, Hamill JD。下调鸟氨酸脱羧酶对腐胺相关代谢和生长的影响烟草.中国生物医学工程学报,2016;44(11):366 - 366。
德波尔KD,道尔顿HL,爱德华FJ,哈米尔JD。rnai介导的鸟氨酸脱羧酶(ODC)下调导致转基因中尼古丁含量降低和阿纳他滨水平升高烟草.植物化学。2011;72(4 - 5):344 - 55。
Xu BF, Timko MP。茉莉酸甲酯诱导烟草腐胺n -甲基转移酶基因的表达需要G-box和gc -motif元件。植物分子生物学杂志,2004;35(5):743-61。
Riechers DE, Timko议员。腐胺n -甲基转移酶基因家族的结构与表达烟草:栽培烟草进化起源的新线索。植物分子生物学。1999;41(3):387-401。
乙烯抑制茉莉酸诱导的尼古丁生物合成基因表达。植物物理学报,2000;41(9):1072-6。
Ryan SM, Cane KA, DeBoer KD, Sinclair SJ, brimcombe R, Hamill JD。烟草喹诺酸盐磷酸核糖转移酶(QPT)基因家族的结构与表达。植物科学学报,2012;
烟草尼古丁生物合成调控中重复初级代谢基因的募集。植物学报,2011;36(6):344 - 344。
田川,李志强,李志强,等。烟草生物碱的生物合成需要pip家族蛋白。植物分子生物学杂志,2009;69(3):287-98。
Sierro N, Battey JND, Ouadi S, Bovet L, Goepfert S, Bakaher N, Peitsch MC, Ivanov NV.参考基因组和转录组烟草的抗旱性而且烟草tomentosiformis.中国生物工程学报。2013;14(6)。
金文华,周强,魏玉峰,杨建民,郝福生,程志平,郭海霞,刘文强。NtWRKY-R1是一种新型转录因子,整合了顶损伤胁迫下IAA和JA信号通路烟草.8.前沿植物科学,2018;
王晓武,Bennetzen JL。烟草基因组学、遗传学及尼古丁生物合成基因研究现状与展望。中国生物医学工程学报,2015;29(1):344 - 344。
Rushton PJ, Bokowiec MT, Han S, Zhang H, Brannock JF, Chen X, Laudeman TW, Timko MP。烟草转录因子:茄科转录调控的新见解。植物科学进展。2008;37(1):344 - 344。
Sears MT, Zhang HB, Rushton PJ, Wu M, Han SC, Spano AJ, Timko MP。NtERF32:非nic2位点AP2/ERF转录因子,茉莉酸诱导烟草尼古丁生物合成所需。植物分子生物学杂志,2014;34(1):344 - 344。
杨晓东,陈志伟,陈志伟,陈志伟,等。环境胁迫下茉莉酸类植物的信号转导及其在植物体内的作用。植物分子生物学杂志,2016;91(6):673-89。
张海波,Bokowiec MT, Rushton PJ, Han SC, Timko MP。烟草转录因子NtMYC2a和NtMYC2b与NtJAZ1阻遏物形成核复合物,并在尼古丁生物合成中调节茉莉酸诱导的多个步骤。植物学报,2012;5(1):73-84。
烟草MYC2通过nic2位点ERF基因直接调控茉莉酸诱导的尼古丁生物合成基因。中国生物医学工程学报。2011;36(6):339 - 339。
王波,路易斯·RS,史俊,宋忠,高勇,李伟,陈红,曲荣。提高栽培烟草尼古丁含量的遗传因素。科学通报2015;5:17360。
韩艳,吴敏,曹玲,袁伟,董敏,王霞,陈伟,尚峰。正调控ccd4类胡萝卜素裂解双加氧酶基因的转录因子OfWRKY3的研究桂花.植物分子生物学,2016;91:485-96。
王鹏,杨超,陈红,罗玲,冷青,李松,韩忠,李霞,宋超,张霞,王东。转录因子研究揭示了不同非生物胁迫下转录因子的关键成员和调控网络芸苔属植物显著中国生物医学工程学报。2018;18:202。
王晓明,王晓明,王晓明,丁杰。植物对植物叶片和根系的直接和间接防御反应。国内植物。2019; 11 (1): plz003。
侯晓玲,李丽c,夏克峰,严YY,俞海峰。DELLAs通过竞争性结合JAZs调节茉莉酸信号。生物工程学报。2010;19(6):884-94。
Lackman P, Gonzalez-Guzman M, Tilleman S, Carqueijeiro I, Perez AC, Moses T, Seo M, Kanno Y, Hakkinen ST, Van Montagu MCE,等。茉莉酸信号通路涉及脱落酸受体PYL4在拟南芥和烟草中调节代谢重编程。美国国家科学院。108(14): 5891 - 2011; 6。
De Boer K, Tilleman S, Pauwels L, Vanden Bossche R, De Sutter V, Vanderhaeghen R, Hilson P, Hamill JD, Goossens A. APETALA2/乙烯反应因子和基本螺旋-环-螺旋转录因子协同介导茉莉酸诱导的尼古丁生物合成植物学报,2011;26(6):344 - 344。
Palazon J, Pinol MT, Altabella T, Cusido R, Serrano M.生长素诱导烟草愈伤组织游离态氨基酸和腐胺的调控及烟碱含量。植物科学进展。1987;29(1):1 - 3。
徐bf, Sheehan MJ, Timko MP。鸟氨酸脱羧酶(ODC)基因家族成员在转基因烟草中的差异诱导(烟草.简历。亮黄色2)茉莉酸甲酯处理细胞悬液。植物生长学报。2004;44(2):101-16。
Shoji T, Yamada Y, Hashimoto T.茉莉酸对根中腐胺n -甲基转移酶基因的诱导烟草的抗旱性.植物生理学报。2000;41(7):831-9。
杨燕,闫鹏,易超,李伟,柴勇,费林,高鹏,赵华,王勇,Timko MP,等。对茉莉酸处理过的BY-2细胞的转录组范围分析揭示了与烟草生物碱形成相关的新的转录调节因子。中国生物医学工程学报,2017;21(3):344 - 344。
Kong Y. Btrim:用于下一代测序技术的快速、轻量级适配器和高质量微调程序。基因组学。2011;98(2):152 - 3。
Edwards KD, Fernandez-Pozo N, Drake-Stowe K, Humphry M, Evans AD, Bombarely A, Allen F, Hurst R, White B, Kernodle SP,等。参考基因组烟草能够基于地图克隆涉及氮利用效率的同源位点。BMC基因组学杂志,2017;18(1):448。
Kim D, Langmead B, Salzberg SL. HISAT:低内存需求的快速拼接对齐器。光子学报。2015;12(4):357-60。
Mortazavi A, Williams BA, McCue K, Schaeffer L, Wold B.用RNA-Seq绘制和量化哺乳动物转录组。光子学报。2008;5(7):621-8。
robert A, Pimentel H, Trapnell C, Pachter LJB。利用RNA-Seq鉴定注释基因组中的新转录本。生物信息学。2011;27(17):2325 - 9。
叶健,张勇,崔华,刘健,吴勇,程勇,等。WEGO 2.0:用于分析和绘制GO注释的网络工具。核酸研究,2018;46:W71-5。
于刚,王乐林,韩勇,何启勇。ClusterProfiler:一个R包,用于比较基因集群之间的生物学主题。组学。2012;16(5):284 - 7。
邱达元,白世林,马继昌,张立龙,邵福军,张克坤,杨玉峰,孙涛,黄建林,周勇,等。基因组白杨x tremulavar。glandulosa克隆84 k。DNA res 2019;26(5): 423-31。
Onkokesung N, Gaquerel E, Kotkar H, Kaur H, Baldwin IT, Galis I. MYB8通过激活三种新的羟基肉桂酰辅酶a来控制诱导的酚酰胺水平烟草attenuata则.中国生物医学工程学报,2012;29(1):489 - 497。
吴杰,Hettenhausen C, Meldau S, Baldwin IT。草食性在受侵害和未受侵害的叶片区域迅速激活MAPK信号,但在受侵害的叶片之间不激活烟草attenuata则.植物学报。2007;19(3):1096-122。
确认
感谢宋忠邦博士提出的建设性意见和有益讨论。
资金
国家自然科学基金(31771414)、河南省高校科技创新人才计划(18HASTIT041)、111项目#D16014、云南烟草公司(2018530000241001)资助。资助者在研究设计、数据收集和分析、发表决定或手稿撰写方面没有发挥重要作用。
作者信息
从属关系
贡献
GS和BW构思并设计了这项研究。YQ, SB, YZ, TS, ZY, WL生成数据并进行分析。WL和BW提供了试剂和材料。QY, GS, DG和BW撰写了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
烟草打顶后各样品的FPKM密度。横轴表示样本日志10(FPKM),纵轴表示相应的概率密度。不同的颜色表示不同的样本。
附加文件2:图S2。
所有样本中不同生物复制的相关性。
附加文件3:图S3。
烟草打顶后不同时间点4830个DEGs的分级聚类分析。样品和处理方法列在每一栏下面。deg由不同的颜色定义,规范化的表达水平采用从低(蓝色)到高(红色)的颜色梯度。
附加文件4:图S4。
根据GO注释对deg进行分类统计。GO分类表示在横坐标上,纵坐标表示基因数量的百分比(左)和基因数量(右)。
附加文件5:图S5。
烟草打顶后DEGs的KEGG综述。图中的数字表示被注释到代谢途径的deg,百分比表示该计数与注释到总代谢途径的deg数量的比率。
附加文件6:表S1。
RNA-Seq数据的质量和映射率。
附加文件7:表S2。
顶部后根中deg的列表。
附加文件8:表S3。
DEGs参与尼古丁的生物合成和顶部后的运输。
附加文件9:表S4。
顶顶后差异转录因子。
附加文件10:表S5。
根据抽顶后的表达模式,聚类尼古丁生物合成中的tf和上调基因家族。
附加文件11:表S6。
脱冠后参与植物激素信号转导的DEGs。
附加文件12:表S7。
序列特异性引物用于qRT-PCR。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
秦,Y,白,S,李,W。et al。转录组分析揭示了烟草打顶后早期尼古丁生物合成调控的关键基因(烟草l.).BMC植物生物学20.30(2020)。https://doi.org/10.1186/s12870-020-2241-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-2241-9
关键字
- 烟草
- 一流的
- 转录组分析
- 差异表达基因
- 尼古丁的生物合成和调控