摘要
背景
这项研究确定了两种固体基质灌注方法对两种相同各种糖甜菜果实的特性变化的影响,这些甜菜水合物在活力水平不同。
结果
种子处理在每种级别的活力没有显着影响氦和表观密度,总孔隙体积和总孔隙率。然而,由于引发而增加了孔隙度的趋势。这可能是为什么种子激发显著增加中孔直径的高和低活力种子。这些变化增加了果皮中的水含量和种子,并在萌发过程中增加了水势。水果提取物的高水平电导率与低种子活力有关。低活力导致果皮的湿度较高,种子水分下降,并且还与果皮和种子的较低水位有关。
结论
果皮和种子的水分含量差异显著,表明果皮的自吸和水分流动问题,导致果皮水分扩散系数低。水分扩散系数低与种子萌发时间延长有关。
背景
水分有效性是决定种子萌发过程的基本因素之一。此外,水分的有效性还取决于发芽培养基的特性以及果实的形态、解剖和物理化学特性。最重要的环境因子包括水势梯度、萌发介质中的水分输送参数和土壤的电导率和扩散率[12].
甜菜果实由坚硬的果皮组成,果皮的质量从70%到80%不等。22.,33.生水果的。在果皮内,有一颗肾状的植物种子[2,8,13,14,19].甜菜的果皮可以限制封闭种子对水分和氧气的吸收[8,13,18,25.,27.,30.,31.,34.].Pericarp的上部覆盖有卵巢帽(鳃盖),在该盖帽上覆盖柱塞的残余物。有时,传输通道后,有一个孔留在卵巢帽中[27.].在果盖的另一侧,有一个地方是果实附着在嫩枝上的,称为基孔。基孔可能是水流向种子的最重要的地方[2,8,14,25.].Pericarp的结构,基础孔的大小及其组织填充程度是通过母体基因型的遗传确定。
48个波兰甜菜品种果实的扫描电镜分析已经表明,a甜菜皮由三层组成[28.].在种子腔附近的第一层由小硬石组成,具有较厚的细胞多层壁。化合物的大单晶存在于这一层中。果皮的中间层由细胞壁较薄的硬石组成。在这些硬石内部,有许多化合物的小晶体簇。果皮的第二层逐渐过渡到由薄壁组织细胞组成的第三层。然而,在一些商品品种的果实中,很难分离两层厚壁组织。
基部孔的果皮厚度为0.6 ~ 0.96 mm [27.].果皮薄壁组织层厚度与厚壁组织层厚度的比值决定了果皮的密度、水势和流经果皮的水量。果皮密度为0.56 ~ 1.10 g cm- 3.[27.].因为实质是松散的组织和厚壁组织紧凑密集,厚的厚壁组织组织是相对于整个果皮的厚度(例如,由于水果抛光),密度越高的果皮和总孔隙度越低水势的果皮是在给定的时间。
对化合物晶体的x射线分析表明,它们包括以下元素:钾、钙、镁、磷、氯和硫。根据对水果水提取物、钾、钠的分析[15在阳离子中,镁和钙占主导地位,而硝酸盐、氯化物、磷酸盐和草酸硫酸盐[16阴茎中的主要是占主导地位[18].晶体在种子自吸过程中溶于水,在果皮中形成低渗透势和高导电性的溶液[26.].这种溶液抑制了水分通过果皮,这反映在果皮水分扩散系数低[27.].
哈达(12和Blunk等[3.指出水流经果皮或种皮对种子萌发很重要。水流的量度之一是水的扩散系数。Podlaski [27.]评估了来自波兰48个甜菜育种系的生果实果皮水分扩散系数的值。种子萌发期果皮水分扩散系数平均为0.00134 cm2d- 1[27.].鹰嘴豆、豌豆和野豌豆种皮水分扩散范围为0.03 ~ 0.00009 cm2d- 1.较低的值是种皮水化程度低[12].
除了果皮中具有渗透特性的无机化合物外,还鉴定出了许多有机化合物:香草酸、对氧苯甲酸、阿鲁酸、香豆素酸、绿原酸、ABA、芦丁和原儿茶酸[10,13,14,30.,31.有趣的是,一些内源植物生长调节剂的水平,这些被证明影响发芽或早期根的生长,在果皮和真正的种子之间有很大的不同。因此,果皮在甜菜的萌发和幼苗生长过程中起着重要的作用[1].目前还缺乏关于这些抑制发芽的化合物是否会影响果皮中水分流动的信息。
对于水是否能穿透果皮的整个表面,或者是否有特殊的流动点(孔隙),即进入点,也没有明显的答案。Chachalis和Smith [6[展示在大豆种子涂层中存在高密度的深层和开放的孔隙与种子涂层的快速渗透性相连。根据Manz等人。[20.[微囊烟草种子末端是水的主要入口点。Juntilla的研究[18Podlaski [27.]覆盖果实的底部,鳃盖的顶部和硅胶糊周围的表面,表明水处理的主要点可能是基础孔隙。
果皮的低水势导致流向种子的水减少,形成了一种屏障。种子萌发前的水势约为- 1.0 MPa [4,27.因此,任何延迟这种水势水平的任何环境因素或种子属性都会延长发芽过程[29.].
为了提高甜菜种子的萌发率,通常采用启动法。催芽(增加萌发和出苗速度)的生理效应是众所周知的[7,11,21.,24.].然而,对于灌浆的效果是否以及在多大程度上取决于果皮属性的变化来增加水的流量,目前还缺乏认识。本研究试图回答这个问题。
方法
在整个纸张中,术语“果实”是指糖甜菜分散单元,“种子”是指植物学的真实种子,包括胚胎,perisperm和胚乳和种子涂层残余物。
的种子甜菜采自意大利罗马涅省Forlì-Cesena县切塞纳镇(经度(E) 12°15′44.6″;纬度(N) 44°09 ' 59.8″;海拔25米)。作为甜菜Spp.不属于濒危物种,用于科学目的的样本收集得到了当地立法的许可。华沙生命科学大学植物生理学专业Sławomir Podlaski教授参与了标本鉴定。该代金券标本并没有存放于任何公众可用的植物标本室。
材料
这项研究是在2013-2015年进行的。研究对象是来自两个波兰商业品种的甜菜果实Janosik活力水平不同。Janosik品种在2010年期间注册,它是正常类型的二倍体品种。它是抗rhizomonia的,没有螺栓膨胀,产生高根的根和技术糖产量,具有较低的糖蜜含量和良好的加工性能。在10℃和15℃下的种子的平均萌发率被认为是活跃的60%全水容量(FWC)的最佳滤纸中活力的标准。在14天后,果实批量的特征在于93%至99%的萌发能力(表格1).种子在波谷(意大利)种植和生产。收获和干燥的种子进行预清洗。然后种子被运到波兰,进行进一步的种子处理。每年种子都在室温和湿度下用棉袋储存。果实湿度的变化范围为8-9%。表中列出了2013-15年采集的水中抛光和漂洗的对照水果的特性1.
在2013年获得了高活力的最佳种子。在4天后,它们的特征在于高萌发能力,果实水提取物的最高萌发,最低导电性,相对高的总孔隙度和最大的中孔直径。
在开始试验之前,按照Kutnowska Hodowla Buraka Cukrowego Sp. z o. o. (KHBC)技术,将果实(包括对照组合)在20°C的水中抛光并冲洗2小时。KHBC是国有(波兰)甜菜育种公司。
采用两种引种技术:快速甜菜(QB) (Podlaski S., Wzorek H., Chrobak Z.,波兰的专利(Podlaski S., Wzorek H., Chrobak Z., 2005年6月29日)和Quick甜菜-1 (QB-1)波兰的专利, PL 216893, 2011年4月1日)。本研究中使用的两种方法都是基于固体基质引物(SMP)和沸石作为水载体。将种子按一定的比例、一定的时间与NK - 10ceca沸石钠盐混合,在专用筛上分离干燥。
Pericarp的物理性质
AGH科技大学陶瓷和耐火材料系在去除包皮和种子后对果皮的物理特性进行了评估。确定了以下物理参数:氦密度(氦比重计ACCuPyc 1330),它决定了在材料体积测量的基础上确定的无孔材料的密度;表观密度,即果皮的重量与具有气孔的果皮体积之比;总孔隙率(GeoPyc 1360,密度分析仪),即所有孔隙体积与总体积的比值以及中孢子直径(ASAP 2010 System) [23.].所有乐器都是从美国MicroMetrics公司获得的。
使用10氦气冲洗和5个体积测定重复进行氦密度测量。在测量之前,在105℃下将样品干燥,其质量约为1.4g。对于表观密度,总孔隙率和总孔体积测量测量在测量之前在105℃下干燥0.36g Pericarp样品。
吸附测定前,将1 g果皮样品在105℃脱气。吸附测定在液氮温度下,以氮气为吸附质进行。根据测量结果,材料的比表面积(S打赌)和中孔体积。
果皮和种子的水势和水含量
种子和果皮的水势决心使用露点微伏计HR-33 T和C-52测量室(美国Wescor Inc .)后2、8、24和48 h后把种子放在湿润滤纸的温度15°C和滤纸FWC湿度60%。试验共5个重复,种子和果皮在测量室内的孵化期为15 min。种子是人工从果皮上除去的。
在15℃、滤纸湿度60% FWC的条件下,将种子置于湿润的滤纸上,2、8、24、48 h后测定种子和果皮的含水量。材料在105℃下干燥6 h, 4个重复。结果以水在新鲜或干质量中的百分比表示。
果皮水分扩散系数
通过假设种子具有或多或少具有球形形状,仅通过基础孔发生水扩散,并且该种子不会在其腔内更换体积,可以使用曲柄扩散方程[9].
为了估算水分扩散系数,需要计算种子和果实的半径。假设每个果实的半径为种子厚度的一半,加上基部孔(水分进入的地方)的果皮厚度。取从种子腔中提取的种子长度的一半作为种子半径。所有的测量都是使用卢布林农业物理研究所制造的一种特殊的微米计进行的。
为了确定水分扩散系数,种子在温度为15°C、滤纸湿度为60% FWC的培养皿中发芽。在萌发6、8、24和48 h后,测定果皮和种子的含水量。水扩散系数决定了单位面积、单位时间内的扩散水量。在一定时间内,果皮和种子的水分含量差异越大,水分扩散系数越小。试验分三次重复进行。
水提取物的导电性
将3克水果与10倍于水果体积的去离子水混合。搅拌2 h后,用电导率仪CPC-505 (Elmetron)和EC−60电极(Elmetron)测量溶液的电导率。试验分三次重复进行。
种子萌发能力(GA)和萌发速度(GS)的评价
种子按照ISTA甜菜PN-79/R-65950的一般标准进行萌发,3个重复,每重复100粒种子。种子萌发在塑料(ABS)箱中进行,尺寸为220x130x40mm,在最佳水分条件下,在滤纸上,双褶条(2粒一排),等级3014,公称厚度0.22 μm,公称重量113 g m- 2(Whatman)和湿度60% FWC(24毫升水)在温度为10°C和15°C。种子的方向是随机的。在多用途环境试验箱MLR-350(三洋)的完全黑暗中进行发芽。
根据MTG = Σ(n我x维我) / N,其中N我是我,d的发芽种子的数量我为孵化期,以天为单位,N为萌发的种子总数。
统计分析
所得数据采用标准误差(SE)、方差分析(方差分析),图基测试(p< 0.05) (STAGRAPHICS Centurion版本18.1.06,64位)。相关及回归分析[35.,用来评价性状对之间的关系。在以后的表格中,是不同的资本和小写字母表示p< 0.05。
结果
果皮物理性质的评价见表2.结果具有果实性状的自然变异和果实种子提取困难等特点。
不同活力水平的种子发芽率对氦含量、表观密度、总孔隙体积和总孔隙率均无显著影响。虽然在总孔隙度上没有发现明显的差异,但可以观察到在种子启动的影响下孔隙度有增加的趋势。这可能是为什么种子激发显著增加中孔直径的高和低活力种子。在像果皮这样的多孔材料中,种子最容易从中孔吸收水分,特别是当种子在萌发末期具有较高的水势时。
种子活力较低与氦气含量和亲本密度增加、总孔体积和中孢子直径减小显著相关。可以假设,这可能会对流经果皮的水的流动产生负面影响,并可能会冲洗掉无机萌发抑制剂。
发芽试验开始后2、8、24和48 h,不同种子处理方式对果皮和种子含水量和水势的影响见表3.和4分别。
随着萌发过程在随后的时间间隔前进,果皮和种子含水量逐渐增加(表3.).在8 ~ 48 h期间,果皮含水量与对照籽粒含水量差异显著。
经8、24和48 h处理后,种子的果皮含水量均高于对照种子(1.1 ~ 5.5%)。
同样,在果皮的情况下,种子的含水量随着发芽过程的进行而增加。各时间间隔的种子水分含量较高,在2.8 ~ 6.1%之间。发芽试验开始后24和48 h, QB-1处理的果实与对照果实的种子含水量差异特别显著,分别为6.1和5.4%。
同一时间间隔内,种子的水势低于果皮的水势4).发芽试验开始后8和24 h,启动果果皮的水势始终高于对照果。
种子萌发后24 ~ 48 h,果皮和对照种子的水势增加幅度分别为−0.58 MPa和−0.80 MPa;
在从2至48小时的发芽期间,种子引发,特别是QB-1方法,显着增加了种子和果皮的水势。果皮和种子的水势特别显着增加,萌发的2至8小时。在此期间,对照种子的水电位增加1.82MPa,而QB-1方法引发的种子的水电位增加了4.85MPa。类似地,在对照种子果皮的情况下,水电位的增加是2.29MPa,并且在QB-1引发方法中,PericaRP为6.66MPa。
发芽试验开始24 h后,高活力对照果实的果皮含水量显著低于低活力种子的果皮含水量(8.4%)5).种子则是相反的关系。高活力对照果实的种子含水量显著高于低活力对照果实(5.4%)。
果皮含水量的差异在水势值中不明显。与具有较高水势较高的种子的果皮相比,来自低活力水果的果皮的特征在于较低的水潜力。较低的水含量(5.4-8.8%)的低活力种子也与较低( - 0.59和-0.76MPa)的水势相关。考虑到两层种子活力的值,与对照相比,灌注显着提高了种子的水含量和水势。
此外,种子启动使低活力果皮和高活力果皮的水分差异相对于对照有所减小。对照果皮水分含量差异为8.4%,启动果皮水分含量差异为2.0,启动果皮水分含量差异为1.4%。随着两种活力水平种子果皮含水率差异的减小,种子含水率差异增大。高活力对照种子的含水量比低活力对照种子的含水量高5.4%。QB法和QB-1法激发的高活力种子含水量分别比低活力种子高6.8和8.8%。
种子活力水平对果水浸出物的电导率有显著影响6).低活力种子的电导率比高活力种子高58%。对于2个活力水平,种子激发导致水提取物的电导率显著降低。因此,种子启动可能直接影响种子和果皮的水分含量。1和2)和Pericarp的水扩散系数(表7).
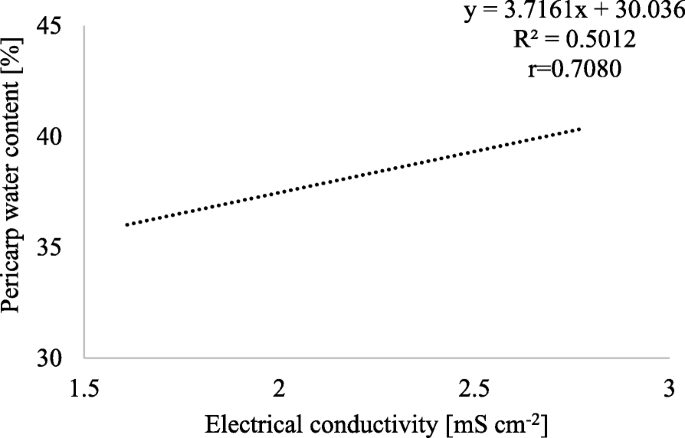
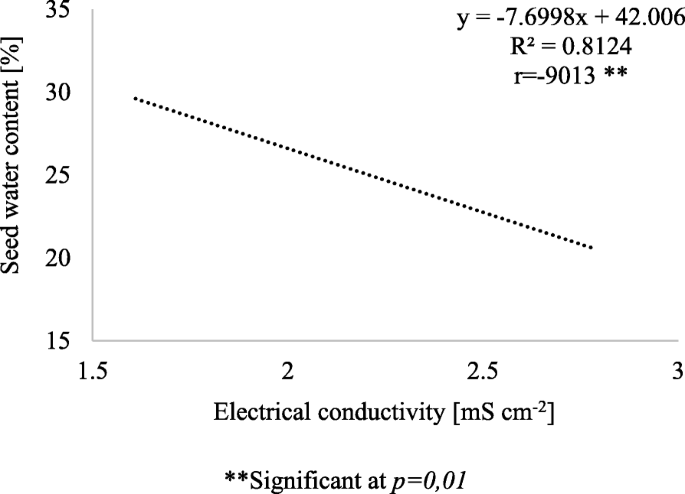
数据1和2结果表明,随着电导率增加1ms cm- 2时,果皮含水量增加3.7%,种子含水量减少7.6%。
水扩散系数决定了单位面积、单位时间内的扩散水量。不同种子处理和2种活力水平的果皮水分扩散率值见表7.
种子活力水平不同,果皮水分扩散系数存在显著差异。在同一时间间隔(6、24和48 h)和相同果实处理下,低活力种子的果皮水分扩散系数始终低于高活力种子。
在萌发的6至48小时的时间内,Pericarp水扩散系数的值相对恒定。种子灌注引起与对照种子相关的Pericarp水扩散系数的平均值显着增加0.01和0.03厘米2d- 1.
两组种子在14天后萌发能力相近,约为94-98%。相比之下,活力高的种子比活力低的种子萌发更快(0.39-0.99 d)8).
平均来看,对于2种不同活力水平的种子,两种激发方式均能显著促进种子萌发,其中QB法分别使种子萌发时间缩短1.29(高活力)和1.17(低活力),QB-1法分别使种子萌发时间缩短1.43(高活力)和1.91(低活力)。
QB-1激发法对高活力种子的催芽期仅为0.14天,而对低活力种子的催芽期则为0.74天。
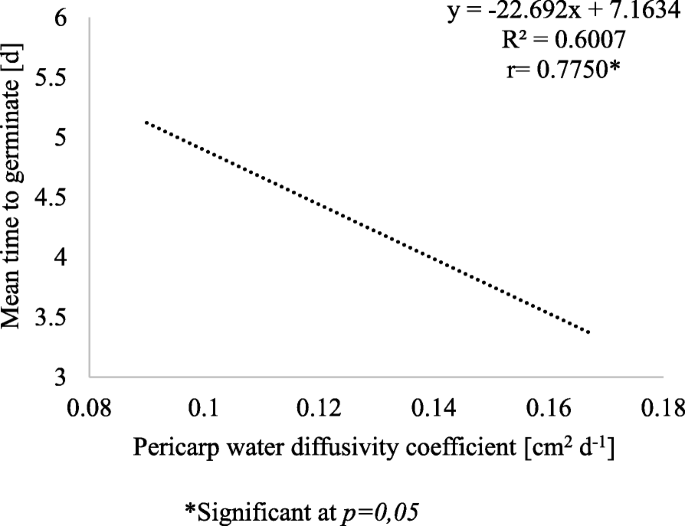
平均萌发时间(用于2级种子活力和3种水果处理方式的关系)和Pericarp水扩散系数在图2中示出。3..
发芽的加速在多大程度上是由于种子的生物学特性或果皮的理化特性的改变造成的,还很难说。这个问题的部分答案如图所示。3..相关分析和回归分析表明,果皮水分扩散系数的平均值影响10和15℃温度下测定的平均MTG值。果皮水分扩散系数平均值增加0.01 cm2d- 1平均发芽时间缩短0.2天。
讨论
本研究提供的数据表明,甜菜种子启动不仅引起了种子生理生化特性的一个相对众所周知的变化([5,21.,36., Herman等人,2007,[1,11),但也改变了果皮的性质,促进了水在果皮中的流动。所得结果按事件的逻辑顺序排列,显示出果皮水分扩散率与种子发芽率之间的关系。
没有研究表明水果处理显著影响氦和表观密度、总孔隙体积和总孔隙度。然而,在种子激发的影响下,总孔隙率有明显的增加趋势。这可能是种子激发使高活力和低活力种子的果皮中孔直径分别从3 ~ 20 nm和1 ~ 2 nm增加的原因。
结果表明,在种子萌发8 h后,果皮的水势增加尤为明显。类似的现象也发生在种子上。发芽8 h后,QB-1法处理的种子水势比对照高4.9 MPa。随后,差异减小,但在萌发过程完成之前,启动种子比对照种子具有更高的水势。因此,种子水势更快达到−1.0 MPa左右。根据布拉德福德[4,胚根(根尖)在此水平面上突出并超出盖层。
较低的种子活力对种子和果皮水分含量和水势的影响高于较高的种子活力。在同一间隔时间内,低活力增加了果皮含水量,降低了种子含水量,而在水势条件下,低活力的种子与果皮和种子的水势值降低有关。Snyder还研究了果实吸水率与果实成熟度的关系[34.萨利尼和博尔特[32.谁观察到不成熟的水果中的含水量较高。通过水性提取物的电导率相关的渗流器和种子的水含量和水势。该值可以是由无机盐形式的萌发抑制剂的含量测量。这些抑制剂的含量主要取决于种子成熟期间的环境条件和种子的成熟水平[26.].
种子渗滤液的电导率可作为种子活力测定的指标甘氨酸,菜豆,豌豆和芹菜种子[17].
增加果皮中的水含量与种子中的水含量的降低相结合的是水流通过终端的水流的证据,这通过果皮的水扩散系数的值降低证明。
生果(0.00134 cm)的平均果皮水分扩散率比较2d- 1)源自48个波兰甜菜品种库存[27.]和果皮商品品种的扩散率Janosik(0.10-0.15厘米2d- 1)清楚地表明在抛光,洗涤,分级和引发的形式中繁殖种子和适当的种子处理的繁殖种子的重要性。同样,Ignatz等人。[14]确认由于机械和抑制剂约束的组合,抛光和洗涤处理的组合抛光和洗涤处理导致发芽性能的显着改善。
具有低活力的果皮中Pericarp的含水量的增加伴随着果皮中的水势值降低。最有可能的是,低水位电位是由来自化学化合物的溶解晶体的渗透溶液形成引起的。Podlaski的研究[27.研究表明,低活力通常伴随着果皮中较高含量的化合物,这些化合物逐渐溶解,形成一种渗透溶液,抑制水分的吸收。
在该研究中,在种子萌发率和Pericarp水扩散系数之间发现了相关性。从这个陈述遵循实际结论,即PericaRP应该尽可能薄,不应含有无机化学化合物的晶体,有机抑制剂和引发技术应刺激水流通过它。
结论
- 1.
SMP法启动甜菜种子后,果皮中孔直径显著增大。
- 2。
中孔直径和总孔隙率的增加会增加果皮中的水含量和种子的水势值。
- 3.
种子活力低与果皮无机化学物质含量高有关,而果皮无机化学物质含量高与水浸提液电导率高有关。
- 4.
种子灌注和更高水平的活力与Pericarp的水扩散系数的较高值相关。
- 5。
果皮水分扩散系数越大,种子萌发速度越快。
可用性数据和材料
在当前研究中使用和/或分析的数据集可从通信作者在合理要求。
缩写
- 阿坝:
-
脱落酸
- ABS:
-
丙烯腈丁二烯苯乙烯
- 啊:
-
科技大学
- FWC:
-
全水产
- GA:
-
发芽能力
- g:
-
发芽速度
- ISTA:
-
国际种子试验协会
- KHBC:
-
Kutnowska甜菜育种公司
- MTG:
-
平均发芽时间
- QB:
-
快速的甜菜
- QB-1:
-
快速Beet-1
- SE:
-
标准错误
- 扫描电镜:
-
扫描电子显微镜
- SMP:
-
固体矩阵灌注
参考文献
- 1.
ABTS W.糖甜菜的萌发和早期生长(Beta寻常魅力L.)乙烯的功能。鲁汶:博士论文;2015年。
- 2。
甜菜花和种子的发育。中国农业科学1927;34:1-25。
- 3.
Blunk S, Malik AH, de Heer M, Ekblad T, Fredlund K, Mooney SJ, Sturrock CJ。用x射线计算机断层扫描(x射线CT)定量测定粒状和包被甜菜种子萌发行为的差异。生物医学工程学报。2017;3(4):044001。
- 4.
(in chinese)种子萌发与水分的关系。I:种子发育和萌发。Kigel J, Galili G. Marcel Dekker Inc.,纽约,351-396。
- 5。
Capron I, Corbineau F, Dacher F, Job C.甜菜种子启动:启动条件对种子萌发、11S球蛋白溶解和LEA蛋白积累的影响中国种子科学2000;10(3):243-54。
- 6。
Chachalis d,史密斯ml。大豆中吸收过程中水摄取的种子涂层调节(甘氨酸Max L. Merr。)。种子SCI技术。2001; 29(2):401-12。
- 7.
Chomontowski C,WZOREK H,Podlaski S.糖甜菜种子灌注对种子质量和性能的影响,在多元化的环境条件下萌发,出苗和生长。J工厂增长调节。2019年。https://doi.org/10.1007/s00344-019-09973-2.
- 8.
甜菜果实的稳定休眠。种皮作为氧的物理化学屏障。机器人Gaz。1976;137:274-8。
- 9.
扩散数学。牛津:布鲁内尔大学,克拉伦登出版社;1975.
- 10.
De Roubaix J,Lazar O.含有糖甜菜肾脏中含有的抑制性物质。in:pridham jb,编辑器。我:健康与疾病的植物中的酚类。伦敦:佩尔加蒙媒体;1960. p。35-42。
- 11.
王志强,王志强,王志强,等。处理条件和生化过程对种子激发的影响。中国农业科学。2012;7(2):178-88。
- 12.
Hadas A(2004)苗床准备:种子萌发的土壤物理环境。种子生理学手册。农业应用- arnold RL, Sanchez RA(编)。美国纽约宾厄姆顿霍沃斯出版社,第3-36页。
- 13。
引用本文:陈志强,陈志强,陈志强,等。甜菜(Beta vulgaris L.)萌发过程中1-氨基环丙烷-1-羧酸和脱落酸的研究进展。中国生物医学工程学报。2007;58(11):3047-60。
- 14。
甜菜工业种子技术和机械加工的生物化学基础。足底。2019;250:1717-29。
- 15.
甘蓝k,玉米甘露甜菜甜菜抑制剂I.将单钠草酸钠作为根生长抑制剂分离。PROC裁剪SCI SOC JPN。1974; 43(3):430-44。
- 16。
甜菜球的生长抑制因子2。作为萌发抑制物和下胚轴刺激物的硝酸钾的分离。作物科学与技术,1975;44(4):465-70。
- 17.
国际种子检验协会。《国际种子试验规则》,第1卷;2018.15 - 20页。
- 18.
Juntilla O.红甜菜果提取物中的萌发抑制剂(Beta寻常CV Rubra)。J Exp Bot。1976年; 27(99):827-36。
- 19.
Lukaszewska e,Sliwinska E.甜菜(Beta寻常L.)植物的大多数器官在营养和生殖阶段的发展中都是多种族。植物团体。2007; 20:99-107。
- 20.
利用核磁共振成像技术研究烟草种子萌发过程中水分的吸收和分配。植物杂志。2005;138:1538 - 155。
- 21.
麦当劳MB。种子启动。在:黑色m,bewley jd,编辑。种子技术及其生物学基础。谢菲尔德:谢菲尔德学术出版社;2000. p。287-325。
- 22.
影响单甘糖甜菜萌发和建立的因素。爱丁堡:理学学士学位论文:爱丁堡大学农学系;1981.1 - 81页。
- 23.
王志强,王志强,王志强,等。陶瓷材料科学。华沙:Wydawnictwo Naukowe PWN;1992.(波兰)。
- 24。
Paparella S, Araújo SS, Rossi G, Wijayasinghe M, Carbonera d。植物学报2015;34(8):1281-93。
- 25。
Perry da,哈里森jg。单结子糖甜菜萌发对水的敏感性研究。Ann Appl Biol。1974; 77:51-60。
- 26。
利用甜菜种子水浸液电导率测定甜菜种子的发芽能力和发芽率与发芽抑制剂含量的关系。种子科学技术。1986;14(3):631-40。
- 27。
甜菜果实特性对甜菜种子萌发、田间出苗和生长的影响。华沙:《论著与专题》,SGGW-AR出版社;1990.1 - 107页。(波兰)。
- 28。
甜菜果实特性对种子萌发、田间出苗和植株生长的影响。第三部分。影响果实和种子水分含量的因素。农业科学学报2000;113:31 - 9。
- 29.
陈志强,王志强,王志强,等。微球对甜菜种子萌发的影响[j]。Int农业物理学。2019;33:175 - 83。
- 30.
王志强,王志强,王志强,等。甜菜种子萌发与果皮对能量代谢的影响[j]。种子科学技术。1989;17:485-98。
- 31.
Santos DSB, Pereira MFA。糙皮对甜菜种子萌发的限制。种子科学技术。1989;17:601-12。
- 32.
张志强,张志强,张志强,等。甜菜种子萌发抑制因子去除的优化。农学。2019;9(763):1 - 11。
- 33.
王志强,王志强,王志强,等。种子大小对甜菜生长发育和产量的影响。中国农业科学(英文版);2012;
- 34.
斯奈德弗兰克-威廉姆斯。种球对甜菜种子萌发速度的影响。J Am Soc Sugar Beet Technol. 1959; 10:513-20。
- 35.
索卡尔RR, Rohlf FJ。生物测定学。第3版。纽约:WH Freeman & Co.;1995.
- 36。
甜菜种子品质与胚胎DNA合成的关系。种子科学技术。2002;30(3):597-608。
致谢
不适用。
资金
这项工作得到了波兰共和国科学和高等教育部的支持[批准号:PBS1/A8/15/2013]。资助方在研究设计,数据收集和分析,或手稿的准备中没有作用。这篇文章的发表是由波兰国家学术交流署资助的,是对外促进计划的一部分。
作者信息
从属关系
贡献
CC获得并解释了果皮理化性质的数据。SP监督了这个实验,并且是撰写手稿的主要贡献者。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
关键词:甜菜,SMP法,种子引物,果皮性状BMC植物BIOL.20.32(2020)。https://doi.org/10.1186/s12870-020-2246-4
收到了:
接受:
发表:
关键字
- 孔隙度
- 密度
- 含水量
- 水势
- 发芽