摘要
背景
生物营养真菌与宿主细胞密切接触以获取营养物质。糖被认为是病原体从宿主细胞吸收的主要碳源。植物-病原体界面上的糖的分配、交换和竞争是由糖转运体控制的。以往的研究表明,抗叶锈病(Lr)基因Lr67的自然变异TaSTP13该基因编码一种小麦糖转运蛋白,具有对所有三种小麦锈病和白粉病的部分抗性,这可能是由于异二聚化削弱了TaSTP13的糖转运活性。然而,一个尚未解决的主要问题是是否TaSTP13参与小麦对锈病和霉病的易感性。
结果
在本研究中,表达TaSTP13小麦叶片受柄锈菌striiformisf . sp。tritici(太平洋标准时间)和某些非生物处理。TaSTP13定位于质膜,具有同源低聚物的功能。此外,在酵母中鉴定了其运输活性的功能域。抑制TaSTP13降低小麦对太平洋标准时间大麦条纹花叶病毒诱导的基因沉默(VIGS)。而过度表达TaSTP13提升拟南芥对白粉病的易感性和导致叶片葡萄糖积累增加。
结论
这些结果表明TaSTP13是转录诱导的,有助于小麦对条锈病的敏感性,可能是通过促进细胞质己糖的积累,以真菌获取小麦的糖-太平洋标准时间交互。
背景
在卡尔文循环和糖异生过程中,高等植物源叶转化光合作用固定的CO2转化为糖,如蔗糖及其裂解产物、葡萄糖和果糖,它们是碳代谢、储存和运输的中心单位[1].这些糖不仅是植物基本生长过程的基本底物,也是主要的能量来源和碳前体[2].此外,糖是植物生命周期中直接或间接调节基因表达的关键信号分子[2].糖转运蛋白介导的糖区室化是植物生长和各种环境胁迫反应的主要决定因素之一[1,3.,4].
蔗糖是光同化物的主要长距离转运形式,在静水压力下从韧皮部输出到库组织的细胞质,然后通过特定的转运蛋白输入到库细胞中维持异养代谢和生长[5].这一输出步骤由SWEET蛋白、蔗糖转运蛋白或单糖转运蛋白介导(如果细胞外转化酶可用)[3.,5].这些大型的糖转运蛋白家族对糖的供应进行微调,以满足不同的代谢需求。糖转运蛋白(STPs)是单糖转运蛋白超家族的成员。有14个stp被发现拟南芥[1],稻米为29 [6], 23人在桶医[7].STPs是最具特征的糖转运蛋白群拟南芥,到目前为止,已详细确定了所有STP成员。所有拟南芥STPs (AtSTPs)已被表征为质膜定位的H+/己糖转运体,具有广泛的底物特异性,除了无功能的AtSTP5 [8], AtSTP7特异性表达l -阿拉伯糖和d -木糖[8],葡萄糖特异性转运蛋白AtSTP9 [9]和半乳糖特异性转运蛋白AtSTP14 [10].
病原体被认为是额外的汇,可以导致植物内糖分配的实质性变化。在植物-病原体界面上对糖的吸收、交换和竞争由糖转运体控制,它们的调节模式对于决定植物-病原体相互作用的结果至关重要[7].到目前为止,有越来越多的证据表明STPs在病原体入侵植物的糖转运中起着核心作用。例如,在拟南芥感染了白粉菌属cichoracearum,提高AtSTP4细胞壁转化酶,在βFRUCT1,与葡萄糖向库组织的转运有关[11].在葡萄藤对生物营养病原体感染的反应中,VvHT5,一个AtSTP13Ortholog,在从源到汇的转变过程中被转录激活并增强了汇强度[12].此外,当AtSTP13是诱发的,是促成的拟南芥通过让活的宿主细胞与之竞争来抵抗灰霉病葡萄孢菌对于受损组织释放的外体己糖[13].此外,AtSTP13在苏氨酸485位点被油菜素类固醇不敏感1相关受体激酶1 (BAK1)磷酸化,这增强了单糖摄取活性,从而与细菌竞争细胞外糖,从而限制了细胞外糖的可用性,剥夺了细菌的能量来源,从而限制了毒力因子的传递[14].显然,外质体糖控制可能构成一种宿主防御策略,限制了广泛的病原体,包括细菌和真菌。
柄锈菌striiformisf . sp。tritici(太平洋标准时间),小麦条锈病的致病因子,是一种专性生物营养真菌,从宿主细胞获取营养物质以生存。糖似乎是从宿主细胞运输到病原体的主要碳源[7].然而,关于糖转运的分子机制以及宿主在应对病原体入侵时的转运过程中诱导的分子反应知之甚少。先前的研究发现,Lr67(糖转运蛋白TaSTP13的自然突变)对所有三种小麦锈病(即条锈病、叶锈病和茎锈病)和白粉病提供了部分抗性,这可能是由于通过与功能性转运蛋白(TaSTP13)的异二聚来减少葡萄糖摄取的显性-负性效应。然而,更多的细节仍不清楚。例如,是否是TaSTP13小麦容易生锈和发霉?葡萄糖摄取减少是否与lr67介导的小麦抗性相关?在本研究中,表达TaSTP13小麦叶片受到胁迫后,同源基因显著诱导太平洋标准时间病理类型,CYR31和非生物治疗。亚细胞定位分析显示,TaSTP13位于质膜。其转运活性的一个关键功能域被鉴定为异种突变互补酿酒酵母.击倒的TaSTP13通过病毒诱导基因沉默(VIGS)系统促进了小麦的抗性太平洋标准时间.转基因拟南芥植物overexpressingTaSTP13对白粉病的敏感性增强,叶片中葡萄糖的积累增加。酵母双杂交(Y2H)和双分子荧光互补(BiFC)验证了TaSTP13的寡聚性。这些结果表明TaSTP13可能有助于小麦对太平洋标准时间通过增加真菌的糖供应。
结果
克隆及序列分析TaSTP13
的TaSTP13基因扩增自太平洋标准时间逆转录聚合酶链式反应(RT-PCR)检测感染Su11的cDNA样本。获得的TaSTP13序列随后被炸对t . aestivum简历。中国春(CS)基因组序列。结果表明,小麦基因组中有3个拷贝位于4A、4B和4D染色体上。这三个副本的假定编码序列仅在54个核苷酸上不同,共享98.62%的序列一致性(附加文件)1:图S1)。因此,从三个副本推导出的氨基酸序列共享99.42%的序列一致性(附加文件2:图S2)。与小麦品种Thatcher的LR67sus蛋白氨基酸序列相同,与撒切尔RL6077的Lr67res蛋白氨基酸序列不同[15]在两个关键的氨基酸残基:Gly144和Val387(附加文件3.:图S3)。在附加文件中显示了TaSTP13, LR67sus和LR67res的多比对3.:图S3。
的开放阅读框TaSTP13由1545个核苷酸组成,编码514个氨基酸的肽,计算分子量为56.71 kDa。使用TaSTP13蛋白质序列作为查询序列来搜索最新的数据库。通过这样做,发现了与其他植物物种相似度最高的stp。蛋白序列与大麦HvSTP13同源性99.32% (IPK Barlex登录号:HORVU4Hr1G067450);97.49%与stp13样蛋白同源性Brachypodium distachyon,BdMST4(GenBank登录号:XP_003558480.1);96.81%与水稻中的OsMST4 (stp13样蛋白)同源性(GenBank登录号:XP_015630449.1)。该系统发育树的TaSTP13与这些同源蛋白,以及STP家族成员来自拟南芥,建成了。这些结果表明,所有stp13样蛋白都形成了一个独特的分支,与其他分支不同拟南芥系统发生树中的STP家族成员(附加文件4:图S4),表明STP13在植物进化过程中是保守的。此外,与双子叶植物相比,TaSTP13与来自单子叶植物的stp13样蛋白的关系最为密切4:图S4)。这些结果表明,TaSTP13可能也是一种stp13样蛋白。
不同处理下TaSTP13的表达谱
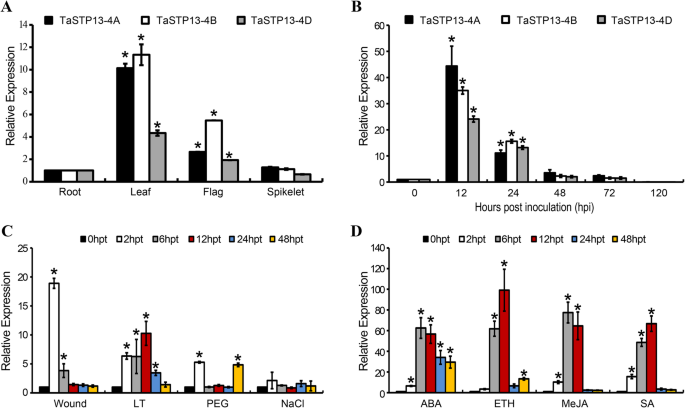
确定的表达模式TaSTP13在不同的小麦组织中,用特定的引物进行实时荧光定量PCR (qRT-PCR)(附加文件9:表S2)。与WheatExp的转录组数据一致(https://wheat.pw.usda.gov/WheatExp/), qRT-PCR检测出3份基因TaSTP13在根、叶、旗和小穗中普遍表达。1a).它们在绿叶中的转录本丰度明显高于其他组织(图。1a)。此外,TaSTP13也表达在茎和花(数据未显示)。转录组分析太平洋标准时间被感染的小麦叶片表明TaSTP13转录水平上调[16,17].为进一步证实表达特征的增加,转录本水平TaSTP13采用qRT-PCR检测。结果表明,三种基因的转录水平均有所下降TaSTP13在接种CYR31后12和24小时(hpi),其拷贝量分别急剧增加了25倍和10倍以上。1b)。
三个TaSTP13拷贝的表达模式。一个成绩单简介TaSTP13在不同的小麦组织中。从根、叶、旗和小穗中采集样品。的水平TaSTP13根组织定义为1;其他组织中的水平以相对比例表示。b三者的转录变化TaSTP13诱导的复制太平洋标准时间感染。在0、12、24、48、72和120 hpi收集感染CYR31的小麦叶片。成绩单简介TaSTP13-4A在非生物胁迫下(c)和外源激素(d).小麦叶片分别在0、2、6、12、24和48 hpt取样。表达水平归一化为TaEF-1a.的相对表达式TaSTP13采用比较阈值法计算(2——ΔΔCT).星号表示有显著差异(P< 0.01)根据学生的t以及。柱状图表示三个独立生物重复的平均值±标准差。ABA,脱落酸;乙,乙;MeJA,茉莉酸甲酯;SA,水杨酸;LT,低温;挂钩;聚乙二醇6000
此外,由于STPs受到许多非生物因子的强烈调控[1),TaSTP13测定了对各种环境压力源的反应。采用qRT-PCR方法测定了小麦叶片中3个拷贝在损伤、低温、PEG 6000和NaCl处理后的表达量。结果显示TaSTP13细胞表达在2 h时呈上升趋势,在损伤处理后呈下降趋势。1c、附加文件5:图S5A, C)。在低温胁迫下TaSTP13在治疗后2-24 h强烈诱导(hpt),并在12 hpt达到峰值(图;1c、附加文件5:图S5A, C)。TaSTP13转录本在PEG6000处理后2小时上调,随后从6 hpt下降到24 hpt,并在48 hpt时再次升高(图6)。1c、附加文件5:图S5A, C)。在NaCl处理下,的转录丰度没有变化TaSTP13与对照组比较(图;1c、附加文件5:图S5A, C)。
此外,TaSTP13用外源植物激素ABA (ABA)、乙烯(ETH)、茉莉酸甲酯(MeJA)和水杨酸(SA)处理小麦叶片,检测转录本水平。激素治疗后,TaSTP13诱导表达,在12 hpt达到峰值(图。1d、附加文件5:图S5B, D)。综合来看,这些结果清楚地表明TaSTP13对非生物因子,激素激发子和太平洋标准时间.
TaSTP13在质膜中的定位
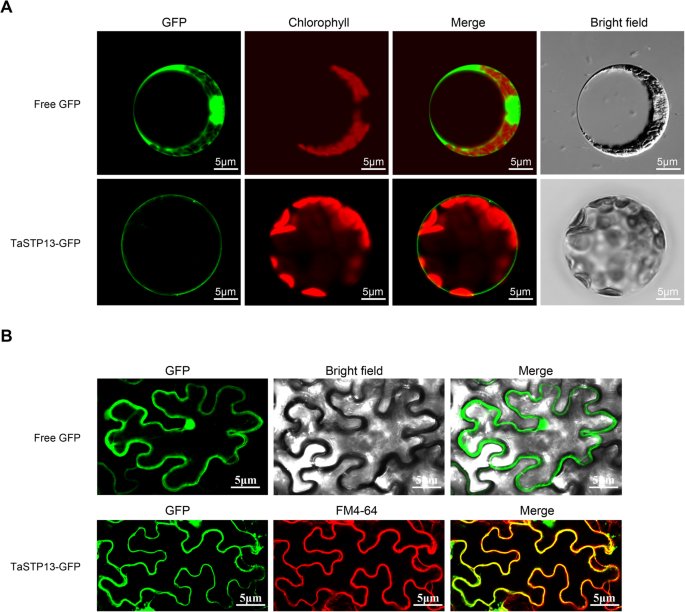
为了检测TaSTP13的亚细胞定位,构建了由菜花花叶病毒(CaMV) 35S启动子驱动的TaSTP13- GFP翻译融合。在整个细胞(包括细胞核)中发现了高荧光的游离GFP(对照)。2a - b)。TaSTP13-GFP融合主要分布在转化小麦叶片原生质体的外围(质膜)。GFP荧光显示TaSTP13-GFP融合蛋白的质膜关联(图。2a).同样,在烟草benthamiana在表皮细胞中,TaSTP13-GFP的GFP荧光信号与fm4 - 64标记的质膜重合(图;2b).因此,TaSTP13很可能是一种质膜定位的糖转运体。
TaSTP13的功能域分析
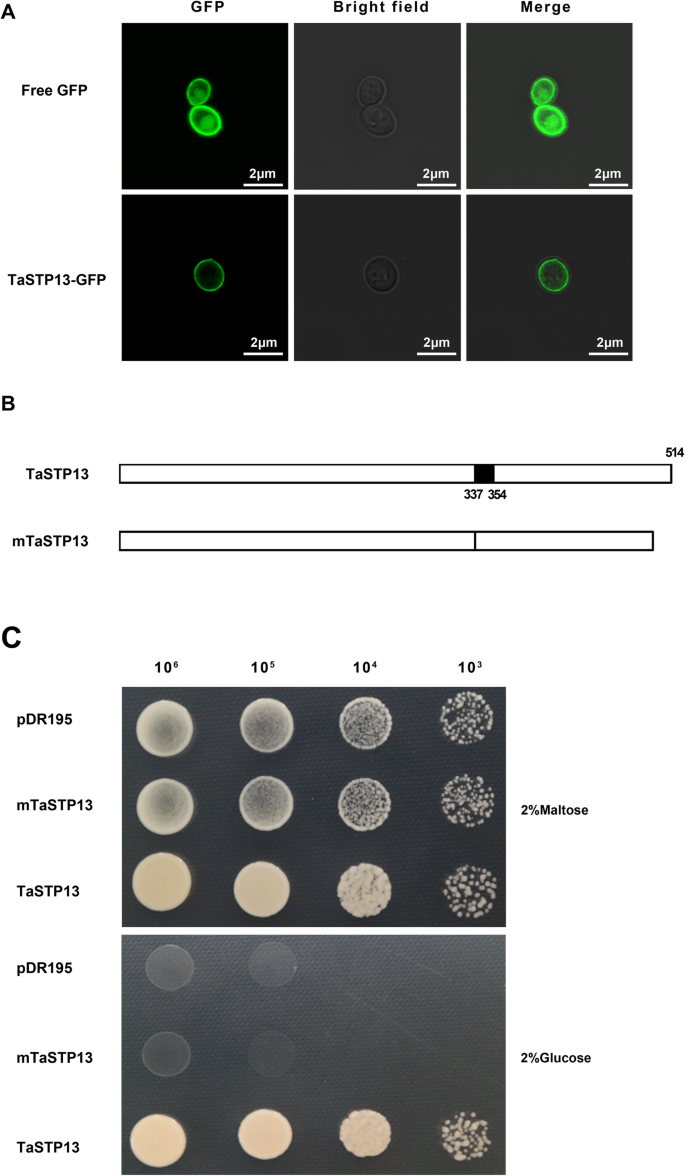
为了澄清在酵母中鉴定TaSTP13的功能是否合适,将TaSTP13- gfp融合物转化到酵母中(酿酒酵母)突变体,EBY。VW4000,缺乏己糖转运体,没有检测到己糖转运活性[18].荧光信号采用共聚焦显微镜监测。结果显示,当在酵母中表达时,TaSTP13-GFP也定位在质膜中(图2)。3.A),这与我们在植物细胞中发现的相似。因此,可以确定TaSTP13在酵母中的运输特性。
使用Interpro和ExPASy软件对TaSTP13的定域进行分析。结果显示,18个氨基酸(337-354)的一个区域可能对TaSTP13很重要。3.b).为了评估该区域是否对TaSTP13的转运活动起关键作用,mTaSTP13(TaSTP13缺少这个区域,图。3.b)采用重叠pcr扩增,并连接到pDR195载体上。重组质粒pDR195-mTaSTP13被引入EBY。VW4000突变。在以葡萄糖为唯一碳源的合成落差(SD)上测定了正转化子的生长。结果表明,在携带pDR195-的酵母菌株中未观察到菌落形成mTaSTP13或空pDR195质粒(图;3.c),而互补菌株携带pDR195-TaSTP13可以在葡萄糖为唯一碳源的培养基上正常生长(图;3.c).这些结果表明该结构域(氨基酸337-354)在功能上对TaSTP13至关重要。
击倒的TaSTP13增强小麦抗太平洋标准时间
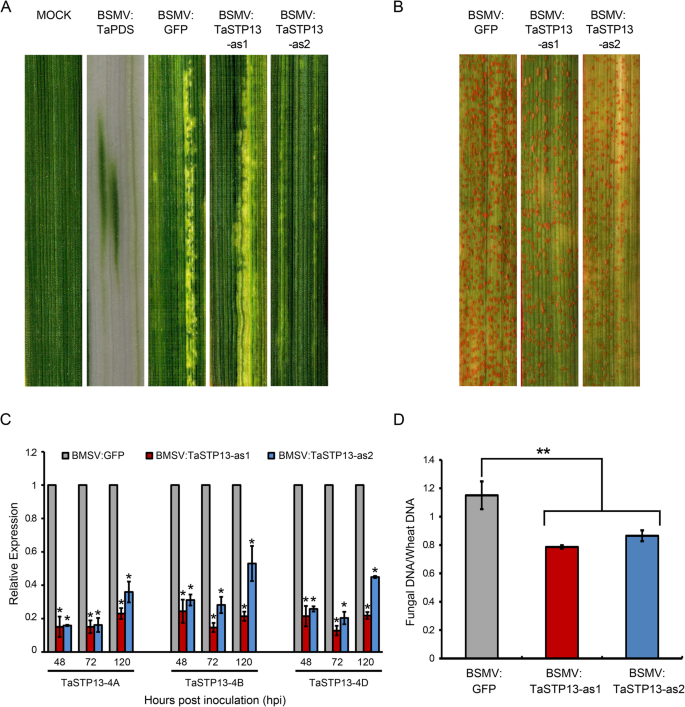
为了确定的功能TaSTP13在小麦的叶子上太平洋标准时间,本研究使用了VIGS。确保有三份TaSTP13一起沉默,两个TaSTP13-特定片段被选择(附加文件1:图S1)。如图所示。4a,接种BSMV的小麦植株表现出轻度的黄化花叶症状,BSMV有明显的光漂白表型:TaPDS-接种后12天感染的植株(dpi)(图;4a),作为VIGS效率的对照。随后,第四叶表面感染CYR31。减少锈病表型观察TaSTP13-沉默小麦幼苗在14 dpi(图;4b)。
沉默的TaSTP13在小麦-太平洋标准时间使用BSMV-VIGS系统进行交互。一个接种bsmv的小麦叶片在9-12 dpi时出现轻度绿斑花叶病症状;BSMV侵染植物的BSMV和光漂白现象明显:TaPDS.b预接种BSMV的第四叶病害表型:绿色荧光蛋白BSMV:TaSTP13-as1和BSMV:TaSTP13-as2在14 dpi挑战太平洋标准时间致病型CYR31。c相对转录水平TaSTP13打倒植物,控制小麦叶片。从感染BSMV的小麦第四叶中分离RNA样本:绿色荧光蛋白BSMV:TaSTP13-as1和BSMV:TaSTP13-as2在48,72和120 hpi与CYR31。的TaEF1α基因作为内部对照。d真菌和小麦生物量比通过总DNA含量在14 dpi通过绝对定量使用内部参考太平洋标准时间的基因,PstEF1,小麦基因,TaEF1α.数值代表三个独立样本的平均值±标准差。星号表示显著差异(*P< 0.05, **P< 0.01)来自BSMV:绿色荧光蛋白.使用Student 's量表评估差异t以及
qRT-PCR分析显示3个拷贝的表达TaSTP13被显著抑制,并且消声效率大约提高了50%(图;4c).通过qRT-PCR检测小麦叶片真菌生物量,研究疾病症状减轻是否与小麦叶片菌丝发育有关。结果显示,TaSTP13与对照植物相比,-沉默小麦幼苗的真菌生物量较低(图2)。4d).综上所述,这些结果表明TaSTP13导致VIGS作物小麦对条锈病的敏感性降低。
真菌生长的组织学TaSTP13可拆卸的植物
澄清疾病表型的减少TaSTP13 -敲除感染CYR31的小麦植株,真菌发育在不同程度太平洋标准时间镜检感染分期。在48 hpi时,吸器母细胞和吸器显著减少TaSTP13-沉默植物(图;5a-c, j)。然而,在48 hpi时,菌丝长度与对照植株相似6:图S6)。此外,真菌菌丝明显变宽,并有异常肿胀结构观察TaSTP13-击倒植物(图;5A c k-l)在72和120 hpi,菌丝扩散年代在TaSTP13 -与对照植物相比,沉默苗受到严格限制(图;5D-f, g-i, m-n)这些结果表明,击倒TaSTP13触发菌丝发育受阻,导致疾病表型减弱。
小麦BSMV感染后真菌生长及寄主反应的组织学观察绿色荧光蛋白接种后重组BSMV太平洋标准时间致病型,CYR31。BSMV接种后小麦叶片CYR31的生长:绿色荧光蛋白BSMV:TaSTP13-as1和BSMV:TaSTP13-as2 at 48 hpi (得了), 72 hpi (d-f)和120 hpi (胃肠道)在荧光显微镜下观察。j在48 hpi时记录每个感染单位的感染菌丝(HB)、吸器母细胞(HMC)和吸器(H)分支的数量。k在tastp13沉默的植物中,48 hpi时感染菌丝(IH)的宽度太平洋标准时间pathogtype CYR31。IH的宽度大致垂直于气孔下囊泡(SV)和IH的顶点。l接种BMSV的小麦在48 hpi时形成了异常膨胀的菌丝结构。异常肿胀的菌丝结构定义为菌丝,其宽度大于BSMV中IH的平均宽度:绿色荧光蛋白来华的小麦。TaSTP13-沉默植物在72 hpi时感染单位面积显著减少(米)及120 hpi (n).该值为每次50个感染部位的三个独立样本的平均值±标准差。星号表示差异显著(**P< 0.01)来自BSMV:绿色荧光蛋白接种植物。使用单向方差分析和学生方差分析来评估差异t以及
过度的TaSTP13促进拟南芥易患白粉病
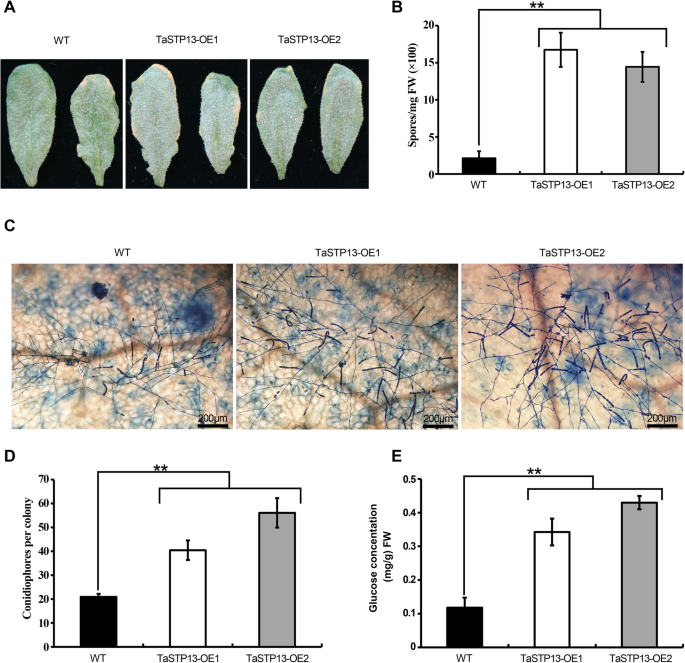
进一步研究可能的功能TaSTP13在植物-真菌相互作用中,我们生成了几个过表达的转基因株系(TaSTP13-OE)TaSTP13通过介绍TaSTP13过度表达构造成拟南芥.的表达TaSTP13在T3代不同转基因株系中,采用RT-PCR方法进行了确认(附加文件7:图S7)。用烟草白粉病株系接种2株转基因株系Golovinomyces cichoracearum(Gc) sicau1 [19].我们发现,TaSTP13-OE植株表现出明显增强的疾病易感性(图。6a - b)。与12 dpi时的结果一致,在真菌开始无性繁殖的5 dpi侵染早期,TaSTP13-OE植株每菌落的分生孢子明显多于Col-0。6c - d)。综上所述,过度表达TaSTP13可以促进拟南芥易患白粉病。
过度的TaSTP13结果是拟南芥易患白粉病。一个代表图像拟南芥指定基因型叶片在12 dpi感染烟草白粉病。请注意,TaSTP13过表达系比Col-0更敏感。b在12 dpi归一化到叶片鲜重(FW)时,定量指定基因型的孢子产量。数据为三个样本的平均值±标准差(n= 3,每人4片叶子),重复三次,结果相似。c特定基因型叶片上白粉病单菌落5 dpi的代表性显微图像。台盼蓝染色真菌结构。棒材,200 μm。d5 dpi时各基因型叶片上每菌落的分生孢子总数。柱状图显示了来自三个独立实验的组合数据(每个实验每种基因型至少计算了50个菌落)。e葡萄糖浓度TaSTP13过表达株系和野生型叶片。数值为三个独立生物重复的平均值±标准差。双星号表示有显著差异(P< 0.01)根据学生的t-检验和与WT比较的单因素方差分析。
由于质膜定位的TaSTP13可以将己糖转运到酵母细胞中,因此有理由推测TaSTP13病原体的诱导促进植物己糖的积累。为了验证这一假设,我们用高效液相色谱法分析了这些转基因株系叶片的糖浓度。结果表明,葡萄糖含量TaSTP13与野生型对照相比,过表达植物显著增加。6e).此外,其他糖没有观察到明显差异(数据未显示)。这些结果表明,TaSTP13在植物中是一种功能性糖转运体。
TaSTP13的寡聚
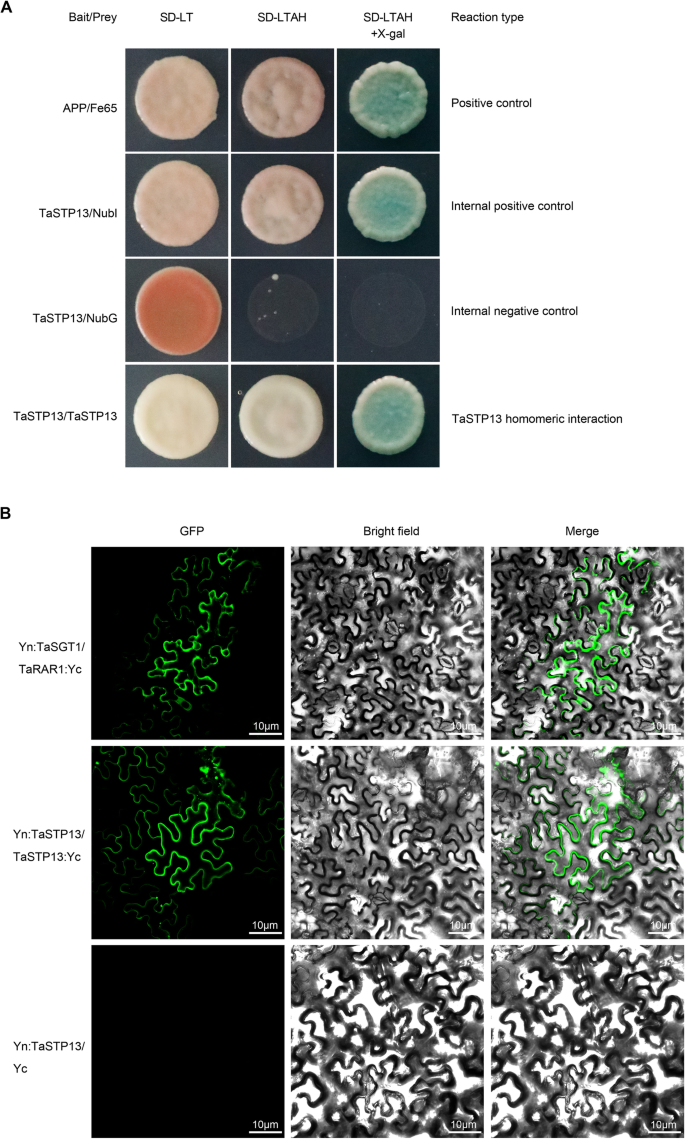
据报道,STPs可以自己形成二聚体[15].因此,可以想象,TaSTP13起着二聚体的作用。因此,TaSTP13与突变的n端半泛素蛋白(NubG)和c端半泛素蛋白(Cub)融合。通过监测酵母细胞生长,在含有X-Gal的SD介质(−Trp,−Leu,−Ade和-His)上测试了TaSTP13的寡聚化。细胞共同转化TaSTP13- ppr3n(−NubG)和pBT3N-TaSTP13(−Cub),可以在上述介质上生长(图。7一个)。
TaSTP13的均寡聚。一个使用LacZ作为报告基因,TaSTP13可以在自身内部形成同源二聚体,由分裂-泛素系统检测。以APP (A4淀粉样前体蛋白)和Fe65 (A4淀粉样前体蛋白结合家族B成员1)作为阳性对照。的相互作用TaSTP13-幼崽与NubI的WT变体(内阳性对照)或NubG的突变变体(内阴性对照)融合TaSTP13-结节融合试验。将含有所示质粒组合的酵母菌株NMY51细胞培养在选择性培养基上(含X-gal)。β-半乳糖苷酶在滴液中表达,可见正相互作用。酵母在SD培养基(−Leu,−Trp,−Ade和- His)上的生长分析。bBiFC检测TaSTP13均聚物。Yn:TaSGT1+TaRAR1:Yc(阳性对照)显示在前三面板,Yn:TaSTP13+TaSTP13:Yc显示在中间的三个面板中,Yn:TaSTP13+ Yc(阴性对照)显示在下方的三个面板中。农杆菌介导的指示结构的瞬时表达n benthamiana叶子。用共聚焦显微镜拍摄亮场和YFP荧光(绿色)图像并合并。所有试验均独立重复至少两次,结果可比较
为了评估TaSTP13在植物中的二聚化,我们进行了BiFC。将TaSTP13与nYFP和cYFP序列融合,融合蛋白在烟叶中瞬时共表达。在阳性对照(TaSGT1和TaRAR1)和共表达Yn的叶片中观察到强烈的绿色荧光信号:TaSTP13而且TaSTP13: Yc(无花果。7b).相反,阴性对照中没有可见荧光。因此,该结果证实了我们的假设,即TaSTP13蛋白可以形成同寡聚复合物。
此外,为了进一步确定TaSTP13是否与来自小麦的其他STP形成异质寡聚物,TaSTP13和TaSTP6之间的相互作用,一种STP增强了小麦对条锈病的敏感性[20.],如上所述,在酵母和烟草植物中进行了研究。结果表明,TaSTP13不能与TaSTP6相互作用(数据未显示),表明TaSTP13可能是一种均低聚物。
讨论
尽管小麦Lr67基因(一种自然突变TaSTP13)已被确定为对所有三种小麦锈病病原和白粉病的成体植物抗性基因[15],但还没有直接的证据表明TaSTP13小麦-锈病真菌相互作用。在本研究中,TaSTP13克隆,并分析其在多种处理下的表达模式。此外,功能TaSTP13由BSMV-VIGS系统在太平洋标准时间小麦感染和异源过表达拟南芥.我们的研究结果表明TaSTP13可能通过增加细胞质己糖的积累而促进小麦条锈病的易感性。
先前报道的STP家族成员被证明是质膜定位的单糖/H+同向转运(7].本研究结果显示,TaSTP13与来自其他植物的STP13样蛋白具有高度的序列相似性,这些蛋白质形成了一个独特的分支,不同于其他STP家族成员,在整个进化过程中表现出高度保守的STP13序列。因此,可以推断TaSTP13可能编码一种stp13样蛋白质。Moore等人发现TaSTP13可以接受葡萄糖、果糖、甘露糖和半乳糖作为底物[15].这种广泛的底物特异性类似于AtSTP13拟南芥[21]和大麦中的HvSTP13 [22].在小麦原生质体、烟草表皮细胞和酵母中的亚细胞定位分析表明,TaSTP13定位于质膜,这与先前描述的STPs一致[1].总之,这些结果表明,TaSTP13是一种广谱单糖转运蛋白,定位于质膜。
为了保持活性,膜蛋白需要短暂或永久地组装成聚合物[23].寡聚化被认为在糖转运特性调控中发挥重要作用,并可能有助于蛋白质稳定性[23].大量研究报告了植物糖转运体通常以均低聚物的形式存在[15].在本研究中,在BiFC和Y2H实验中,TaSTP13被证明能够形成低聚结构,这与一些STP和SWEET家族成员中发现的糖转运蛋白一致[15,24].最近,有报道称LR67通过与功能性转运蛋白(即TaSTP13)的异二聚作用限制小麦葡萄糖的摄取[15,22],表明在TaSTP13介导的己糖从外质体导入细胞质过程中,TaSTP13的均寡聚是必不可少的。
糖转运蛋白诱导的糖转运和分配是植物发育和应对生物和非生物胁迫的重要生理过程之一[1,3.,4].大量研究发现,STPs受病原体调控,在植物-病原体相互作用过程中参与糖转运[7].例如,AtSTP4从拟南芥是否在感染后被转录诱导大肠cichoracearum而且两光伏烟[11,25].此外,表达AtSTP13被上调p .两pv。番茄DC3000和b .灰质[13,21].在葡萄中,己糖转运体基因的转录水平,VvHT5,白粉病和霜霉病感染后显著增加[12].TaSTP13在小麦叶锈病感染早期也有较高的表达水平[26].同样,本研究结果显示TaSTP13被强烈地诱导Pst -被感染的小麦叶子说明TaSTP13可能参与小麦-锈病相互作用中糖的运输。此外,抄本丰富Lr67在感染叶锈病的小麦叶片中[15].转录差异似乎表明了这一点TaSTP13对不同锈病感染的反应不同。
此外,STPs也对非生物因子有反应,尽管它们在非生物胁迫下调节糖转运的精确作用在分子水平上仍然知之甚少[1].在拟南芥,增加AtSTP3而且AtSTP4表达可以瞬间增强对伤害的反应[25,27].AtSTP1而且AtSTP14转录水平显示昼夜节律振荡,并被发现是强烈的暗诱导[10,28].此外,的表达AtSTP13已被发现受到许多非生物因素的上调,包括各种激发子、化学物质、激素(即ABA、MJ、GA生物合成抑制剂、PAC和SA)和应激条件(即冷、热、缺氧、渗透、氧化和盐)[1,29].的转录反应VvHT5通过损伤和ABA处理诱导[12].最近,据报道,抄本丰富HvSTP13通过盐和ABA来增加大麦的含量[22].在这项研究中,TaSTP13发现损伤、LT、PEG和某些外源性激素处理对其有强烈的诱导作用,而Moore等人对此并不关心。[15].因此,可以推测,在不利条件下,由TaSTP13介导的糖区隔可能与应激适应有关。
前期研究表明,stp13样蛋白在植物-病原菌相互作用过程中糖转运中发挥重要作用[21,22].stp13样蛋白是否有助于宿主易感性或耐药性似乎取决于病原体获取糖的位置,尽管这些stp13样蛋白一直被发现可将糖从外质体运输到细胞质。例如,增加AtSTP13传输活动赋予拟南芥增强抵抗力b .灰质而且p .两pv。番茄DC3000通过还原异体己糖[13,21].然而,LR67通过从小麦宿主细胞质中窃取糖并降低其编码的功能转运蛋白的转运活性来抵抗吸器形成病原体、锈病真菌和白粉病Lr67等位基因(13,21].在本研究中,的作用TaSTP13在小麦-太平洋标准时间相互作用由BSMV-VIGS系统确定。疾病症状减轻,菌丝肿胀结构异常,菌落大小受限TaSTP13期间起着举足轻重的作用太平洋标准时间小麦侵染。据报道,STPs (hexose/H+转运体)可以催化己糖从外质体摄取到细胞质[1].因此,我们可以推断,细胞内的糖浓度是增加的TaSTP13超表达拟南芥叶子。此外,生物营养真菌,如锈病真菌或白粉病,通过被称为吸器的特殊喂养结构获得营养物质,生物营养病原体通过吸器与宿主细胞膜密切接触,并允许养分吸收[30.,31].因此,我们推断TaSTP13可以促进拟南芥增加真菌供糖对白粉病的易感性。与Moore等先前报道的结果相比[15],这些结果进一步表明,lr67介导的小麦抗锈病可能是由于TaSTP13的糖转运活性降低。此外,需要指出的是,未观察到明显的生长缺陷TaSTP13-沉默的小麦植株,与之前的研究结果一致拟南芥[21,32].一个可能的原因是stp之间的生理功能冗余。有趣的是,STP的功能冗余在植物-病原体相互作用中似乎并不高,这可能是因为不同STP家族成员在不同的病理系统中的贡献是不同的。
结论
连同本研究的结果和以前的报告提供了足够的间接证据来推断TaSTP13在小麦中起关键作用太平洋标准时间相互作用和可能参与了异体己体的增强导入太平洋标准时间入侵细胞。因此,TaSTP13可以作为候选基因编辑,使用CRISPR/Cas9系统创建抗锈病小麦品种。此外,潜在的机制需要进一步调查。为了完善我们对TaSTP13的确切功能机制的理解,鉴定其靶蛋白和调控其表达的特异性转录因子应该是未来研究的目标。
方法
植物材料、接种和处理
的拟南芥生态型Columbia-0,烟草benthamiana、小麦品种水原11号(Su11)来自于中国西北农林科技大学康振生教授研究室,用于本研究。烟草白粉病分离物GcSICAU1由王文明教授实验室(中国四川农业大学)提供,在23°C(光照16小时,暗8小时)的生长室中保存在烟叶上。拟南芥而且n benthamiana是按照[所描述的方法生长的33].
为了进行组织特异性基因表达测试,将小麦植株在16°C的生长室中生长14天,然后转移到另一个4°C的生长室中生长30天。然后在23°C下40天后,在完全花期的1/2时取样根、叶、花、茎、旗和小穗组织。在相对湿度为65%、温度为200 μmol m的生长室中进行小麦植株生长试验−2年代−1白光强度为16小时光:暗光周期为8小时。
Su11和太平洋标准时间致病型CYR31(剧毒)被用于小麦太平洋标准时间相互作用的研究。研究TaSTP1侵染小麦叶片的表达水平太平洋标准时间,叶片组织按照所述方法进行接种和采样[33].时间点的选择由[34].
对于不同的非生物胁迫源(即伤害、LT、PEG和NaCl),使用14天大的小麦幼苗,如所述[33].对于化学处理,14天大的幼苗在0.1% (v/v)乙醇中喷洒10 mM SA、1 mM MeJA、1 mM ETH或1 mM ABA。平行模拟对照,用0.1% (v/v)乙醇处理小麦叶片。在0、2、6、12、24和48 hpt分离小麦叶片进行RNA分离。
对于每个实验处理,进行了三个独立的生物复制。
RNA提取及基因表达分析
利用快速RNA分离试剂盒(华岳阳生物科技有限公司,北京,中国)提取小麦总RNA。大约2 μg总RNA用RevertAid第一链cDNA合成试剂盒(Thermo Fisher Scientific, Waltham, MA, USA)和寡核苷酸(dT)合成第一链cDNA。18底漆。靶基因表达水平归一化至TaEF-1α(GenBank加入号:Q03033)。所有qRT-PCR反应均在25 μ l的反应混合物中进行,其中含有UltraSYBR混合物(中国北京CWBIO有限公司),正向和反向基因特异性引物各10 pmol(附加文件)8:表S1)和2 μL反转录稀释cDNA(1:20)。使用CFX Connect RT-PCR检测系统(Bio-Rad, Hercules, California, USA)定量基因表达。qRT-PCR分析的数据来自3个生物重复,每组包含3个技术重复。对这些数据进行了比较分析-△△Ct方法(35].用Student 's评价统计学意义t以及。
TaSTP13基因克隆及序列分析
特定引物(附加文件9:表S2),从ATG到TGA,根据的orf进行设计TaSTP13信使rna。TaSTP13pcr扩增太平洋标准时间使用PrimeSTAR Max DNA聚合酶(TAKARA,北京)检测感染Su11的cDNA样本。将PCR产物亚克隆到pMD 19-T载体(Takara, Beijing, China)中进行测序。得到的片段与t . aestivum简历。中国春(CS)基因组数据来自ensemble Plants (http://plants.ensembl.org)和国际小麦基因组测序联盟(https://urgi.versailles.inra.fr/blast),并预测染色体位置。
使用DNAMAN v6.0 (Lynnon Biosoft, USA)进行多序列比对。采用邻域连接(NJ)方法推断多遗传关系,并使用MEGA v7.0软件进行1000个重复的自举测试[36].的氨基酸序列TaSTP13在ExPASy (http://www.expasy.org),以确定它们的物理化学性质。的表达式TaSTP13在WheatExp (https://wheat.pw.usda.gov/WheatExp/).
结构物、引物和菌株
DNA构建遵循标准分子生物学协议或Gateway技术(Invitrogen, California, USA)。DNA结构的更多细节在附加文件中列出8:表S1。所有引物和菌株都列在附加文件中9:表S2。
亚细胞定位
构造pK7FWG2-TaSTP13变成了根癌土壤杆菌用热休克法应变GV3101。经PCR验证的阳性转化子在含有spectomycin (50 μg/ml)和利福平(50 μg/ml)的LB培养基中培养,28℃,220转/分的震动培养箱中培养48 h。将细菌离心成球,重悬于10 mM MgCl渗透介质中2, 10 mm2 -(N-morpholino)乙磺酸MES, 200 μM乙酰丁香酮,pH 5.7)在室温(RT)下,在黑暗中浸泡3小时。的农携带结构pK7FWG2-TaSTP13被渗入烟草(n benthamiana树叶)。将叶片浸泡在由5 μM FM4-64 N-(3-三乙基氨基丙基)-4-(6-(4-(二乙基氨基)苯基)六三烯基吡啶二溴化铵(Invitrogen, USA)组成的PBS中10分钟,然后通过染色显示质膜。小麦叶片原生质体分离及pTF486-的瞬时表达TaSTP13构造按前面所述执行[37].通过Olympus FV1000共聚焦激光显微镜(Olympus, Tokyo, Japan)在488 nm激发激光下监测GFP荧光,经过18 h(原生质体)和2天(叶片)的转化。所有实验均独立重复3次,结果相当。
酵母中TaSTP13的功能域分析
在Interpro (https://www.ebi.ac.uk/interpro/) ExPASy (https://prosite.expasy.org/).mTaSTP13通过重叠PCR与附加文件中列出的内部引物克隆9:表S2。
空向量pDR195 [38],以及构造的向量(即pDR195-TaSTP13pDR195 -mTaSTP13pDR195 -绿色荧光蛋白和pDR195 -TaSTP13-绿色荧光蛋白),转化为己糖转运不足酿酒酵母变异EBY。VW4000 [18];这些转换是使用LiAc方法进行的[39]用于互补和亚细胞定位分析。在缺乏尿嘧啶(6.7 g L)的SD培养基上选择转化子−1酵母氮碱2 g L−1氨基酸(尿嘧啶)滴出混合物,2% (w/v)麦芽糖,1% (w/v)琼脂。通过PCR进一步验证潜在克隆。确定亚细胞定位酿酒酵母,含有pDR195-的酵母细胞TaSTP13-绿色荧光蛋白和pDR195 -绿色荧光蛋白(对照组)用激光扫描共聚焦显微镜观察,如上所述。此外,为了检验预测的结构域对TaSTP13的转运活性是否重要,阳性转化子在添加2% (w/v)麦芽糖的SD液体培养基上生长1天,并进行连续稀释(即103., 104, 105,和106细胞毫升−1用血细胞计定量)滴在含有葡萄糖作为唯一碳源的固体培养基上,在30°C下持续3天。
bsmv介导的TaSTP13基因沉默
来自编码序列的两个特定的VIGS序列区域(260 bp,核苷酸34-293;219bp,核苷酸1264-1482,附加文件1:图S1),在NCBI的BLASTN搜索中显示与其他小麦基因序列相似度最低,在STP家族中多态性最高的基因被选择来生成其基于γ rna的衍生质粒,如附加文件所述8:表S1。BSMV:绿色荧光蛋白以Vector为对照。病毒RNA分子的制备方法如下所述[40].植物被BSMV RNA(即BSMV:绿色荧光蛋白BSMV:TaPDS,BSMV:TaSTP13-as1和BSMV:TaSTP13-as2)遵循修改后的协议[41,42].接种病毒后10 ~ 12 d,用CYR31处理第四叶。然后在16°C下保持植株,在接种后48、72和120 h (hpi)取样第4片叶子,进行组织学观察和沉默效率。采用qRT-PCR进行基因沉默效率分析。接种14 d后,当真菌在叶片上大量生长时,感染表型为太平洋标准时间拍照并收集以作进一步分析。用每种BSMV病毒接种50株幼苗,进行三次独立接种。采用CTAB法提取基因组DNA [43].提取总基因组DNA太平洋标准时间——接种过的小麦叶子。相对生物量比通过比较得到PsEF1[44用…复制数字TaEF-1α复制数据。
所有引物都列在附加文件中9:表S2。
真菌生长的组织学观察
小麦叶片片段固定并漂白,如前所述[33].小麦胚芽凝集素(WGA)与Alexa Fluor 488 (Invitrogen, Carlsbad, CA, USA)结合用于染色太平洋标准时间感染结构如前文所述[45].使用Olympus BX-51显微镜(Olympus, Tokyo, Japan)检查染色组织中的感染部位,并使用cellSens Entry软件(Olympus, Tokyo, Japan)进行测量。各指数数据按前文所述获得[20.].对于统计分析,标准偏差,单向方差分析和t采用SPSS v17.0软件对三个独立样本进行检验。
拟南芥转化与接种
pK7FWG2 -TaSTP13构造被转移到农对菌株GV3101进行热休克浸花转化拟南芥[46].在含50 μg/ml卡那霉素的1 / 2 MS培养基上选择初级转化菌(T1)。通过显微镜和RT-PCR对选择标记抗性幼苗进行验证。然后将幼苗转移到一个装满土壤的花盆中,让其生长,直到下一代种子在生长室中产生。进一步分析了两个具有代表性的纯合子系。白粉病的接种方法和分生孢子计数方法与上述方法相同[47].
水溶性碳水化合物的提取与测定
叶子拟南芥为测定水溶性碳水化合物,如前所述收集[20.].提取水溶性碳水化合物,并按所述进行高效液相色谱[48].
Split-ubiquitin分析
用分裂-泛素Y2H体系检测TaSTP13的聚合[49].为了保证该系统的正确表达和功能,“诱饵”结构pBT3-N-TaSTP13,与猎物控制向量共同变换,表达野生型NubI(内阳性对照)部分和NubG(内阴性对照)部分。通过pBT3-N-的共转化来确定TaSTP13的自相互作用TaSTP13以及“猎物”向量pPR3N-NubG-TaSTP13。酵母菌落在30°C的SD-Leu-Trp培养基(SD-LT)上生长。通过监测细胞在SD-Leu-Trp-Ade-His培养基(SD-LTAH)和含有X-Gal的SD-LTAH上生长4天来评估TaSTP13的自我相互作用。阳性对照如前所述[20.].
BiFC化验
的ORFTaSTP13克隆为载体pSPYNE(R)173和pSPYCE(M) [50),分别。每对构念都被共同引入n benthamiana叶片如前所述[24].浸润2天后,用共聚焦激光扫描显微镜(Olympus FV1000)观察YFP荧光。进行了三个独立的生物重复。
统计分析
采用SPSS v17.0软件进行数据分析。用Student 's来确定统计学意义t-检验两组之间的比较和单因素方差分析(其次是LSD和Bonferroni检验)的多重处理的实验。在所有图中,值的分布以误差条的形式显示,表示平均值的标准偏差。
加入数据
本研究中使用的序列数据可在NCBI数据库(http://www.ncbi.nlm.nih.gov/),并附上下列登记编号:TaEF-1α(Q03033), AtUBC21 (AT5G25760), TaSTP13-4A (ALL26328.1), TaSTP13-4B (ALL26329.1), TaSTP13-4D (All26330.1), SbSTP13 (XP_002465636.1), ZmSTP13 (NP_001310214.1), SiMST4 (XP_004985175.1), PhMST4 (XP_025795007.1), OsMST4 (XP_015630449.1), BdMST4 (XP_003558480.1), HvSTP13 (IPK Barlex接入:HORVU4Hr1G067450), VvHT5 (AAT09979.1), GmSTP13 (XP_003539275.1), NtSTP13 (XP_016500201.1), LeHT2 (CAB52689.1), StSTP13 (XP_006359910.1), AtSTP13 (NP_198006.1), AtSTP1 (NP_172592.1), AtSTP2 (NP_172214.5), AtSTP3 (NP_200960.2), AtSTP4 (NP_188627.1), AtSTP5 (NP_174718.1), AtSTP6 (np_1886247.1), AtSTP7 (NP_192114.1), AtSTP8 (NP_197997.1), AtSTP10 (NP_188628.1), AtSTP11 (NP_197718.1), AtSTP12 (NP_193879.4), AtSTP14 (NP_177845.1)。
数据和材料的可用性
在本研究中产生的所有数据都包含在论文和支持信息文件中。
缩写
- 阿坝:
-
脱落酸
- BAK1:
-
油菜素类固醇不敏感1相关受体激酶1
- BiFC:
-
双分子荧光互补
- CaMV:
-
花椰菜花叶病毒
- CS:
-
中国的春天
- 宝宝:
-
c端半泛素蛋白
- Dpi:
-
天post-inoculation
- 乙:
-
乙烯
法案
甲基jasmonate
- fm4 - 64:
-
N-(3-三乙基氨基丙基)-4-(6-(4-(二乙基氨基)苯基)六三烯基二溴化吡啶
- 现病史:
-
小时post-inoculation
- 成:
-
治疗后数小时
- 迷幻药:
-
最小显著性差异
- LT:
-
低的温度
- NJ:
-
Neighbour-joining
- NubG:
-
n端半泛素蛋白
- 子:
-
开式阅读架
- 挂钩:
-
聚乙二醇
- 太平洋标准时间:
-
柄锈菌striiformisf . sp。tritici;
- 存在:
-
实时定量PCR
- rt - pcr:
-
逆转录聚合酶链反应
- 山:
-
水杨酸
- SD:
-
合成的辍学生
- stp:
-
糖转运蛋白
- 中收取:
-
病毒引起的基因沉默
- 编剧:
-
小麦胚芽凝集素
- Y2H:
-
酵母2台混合动力
参考文献
- 1.
拟南芥糖转运体(AtSTP)家族:最新进展植物生物学(Stuttg)。16 2010; 12(5): 35-41。
- 2.
伊芙兰AL,杰克逊DP。糖,信号和植物发育。中国科学(d辑:自然科学),2012;
- 3.
陈丽强,曲晓强,侯BH, Sosso D, Osorio S, Fernie AR, Frommer WB。SWEET蛋白介导的蔗糖外排是韧皮部转运的关键步骤。科学。2012;335(6065):207 - 11所示。
- 4.
Lemoine R, La Camera S, Atanassova R, Dedaldechamp F, Allario T, Pourtau N, Bonnemain JL, Laloi M, Coutos-Thevenot P, Maurousset L,等。糖的源-汇运输及其环境因素的调控。植物科学进展(英文版);
- 5.
高等植物蔗糖转运体的分子生理学研究。中国科学(d辑),2007;
- 6.
邓霞,安波,钟辉,杨军,孔伟,李艳。基于综合表达模式的水稻MST基因家族功能分化的新认识。基因(巴塞尔)。2019; 10:239。
- 7.
杜idy J, Grace E, Kuhn C, Simon-Plas F, Casieri L, Wipf D.植物中糖转运蛋白及其与真菌的相互作用。植物科学进展,2012;17(7):413-22。
- 8.
Rottmann T, Klebl F, Schneider S, Kischka D, Ruscher D, Sauer N, Stadler R.糖转运蛋白STP7对l-阿拉伯糖和D -木糖的特异性与典型的己糖转运蛋白STP8和STP12形成对比。中国生物医学工程学报,2018;36(3):344 - 344。
- 9.
张晓明,李志刚,张晓明,等。拟南芥花粉中葡萄糖特异性AtSTP9单糖转运体的功能鉴定及表达分析。植物科学进展。2003;33(1):102 - 102。
- 10.
李志强,李志强,李志强,等。拟南芥半乳糖转运蛋白AtSTP14的鉴定与鉴定。植物生理学报。2010;29(3):344 - 344。
- 11.
Fotopoulos V, Gilbert MJ, Pittman JK, Marvier AC, Buchanan AJ, Sauer N, Hall JL, Williams LE。在拟南芥中,单糖转运蛋白基因AtSTP4和细胞壁转化酶Atbetafruct1在真菌侵染赤霉(Erysiphe cichoracearum)时被诱导。植物科学进展。2003;32(2):821-9。
- 12.
马海燕,李丽娟,李丽娟。脱落酸参与葡萄胁迫诱导己糖转运蛋白(VvHT5)和细胞壁转化酶的协调调节,以应对生物营养性真菌感染。植物科学进展。2010;29(1):344 - 344。
- 13.
Lemonnier P, Gaillard C, Veillet F, Verbeke J, Lemoine R, couto - thevenot P, La Camera s拟南芥糖转运蛋白STP13的表达差异影响葡萄糖转运活性和对灰霉病的基础抗性。中国生物医学工程学报,2014;29(4):344 - 344。
- 14.
山田K, Saijo Y, Nakagami H, Takano Y.拟南芥糖转运蛋白活性对抗菌防御的调控。科学。2016;354(6318):1427 - 30。
- 15.
Moore JW, Herrera-Foessel S, Lan C, Schnippenkoetter W, Ayliffe M, Huerta-Espino J, Lillemo M, Viccars L, Milne R, Periyannan S,等。一种最近进化的己糖转运蛋白变体赋予小麦对多种病原体的抗性。植物学报。2015;47(12):1494-8。
- 16.
Dobon A, Bunting DC, Cabrera-Quio LE, Uauy C, Saunders DG。小麦和黄锈病之间的宿主-病原体相互作用诱导了基因表达的时间协调波。BMC基因组学,2016;17:380。
- 17.
郝艳,王涛,王凯,王霞,付勇,黄玲,康哲。转录组分析为小麦成体期抗条锈病的机理提供了新的认识。PLoS One. 2016;11(3):e150717。
- 18.
Wieczorke R, Krampe S, Weierstall T, Freidel K, Hollenberg CP, Boles E.同时敲除至少20个转运蛋白基因才能阻断啤酒酵母对已糖的吸收。中国农业科学,1999;29(3):344 - 344。
- 19.
李锐,张磊,杨霞,曹霞,王勇,马霞,钱然五,范杰,杨辉,尚杰,等。转录组分析揭示了促进烟草白粉病在拟南芥中生长的途径。植物叶绿素,2019;1(1):7。
- 20.
杨强,钱勇,钱伟,康忠,刘娟。aba诱导的糖转运蛋白TaSTP6促进小麦条锈病易感性。中国生物医学工程学报,2019;29(3):344 - 344。
- 21.
Nørholm MH, nouri - eldin HH, Brodersen P, Mundy J, Halkier BA。拟南芥高亲和己糖转运蛋白STP13的表达与程序性细胞死亡相关。中国农业科学,2006;29(4):457 - 457。
- 22.
Milne RJ, Dibley KE, Schnippenkoetter WH, Mascher M, Lui AC, Wang L, Lo C, Ashton AR, Ryan PR, Lagudah e。中国生物医学工程学报,2018;29(4):344 - 344。
- 23.
切切提C,派尔E, Byrne B.转运蛋白寡聚在结构和功能中的作用。生物化学学报,2019;47(1):433-40。
- 24.
宣耀华,胡一斌,陈丽强,soso D, Ducat DC,侯bh, Frommer WB。细菌和植物SWEET糖转运体家族低聚化的功能作用。中国科学:自然科学,2013;29(3):366 - 366。
- 25.
特鲁尼特E, Schmid J, Epple P, Illig J, Sauer N.拟南芥STP4基因的库特异性和胁迫调节:编码单糖转运蛋白的基因通过损伤、激发子和病原体挑战增强表达。《植物科学》1996;8(12):2169-82。
- 26.
Savadi S, Prasad P, Bhardwaj SC, Kashyap PL, Gangwar OP, Khan H, Kumar S.小麦与叶锈病病原相互作用中SAR和糖转运相关基因的转录变化。植物生长学报,2018;37(3):826-39。
- 27.
植物中单糖转运蛋白:结构、功能与生理。生物化学学报2000;1465(1-2):263-74。
- 28.
Stadler R, Buttner M, Ache P, Hedrich R, Ivashikina N, Melzer M, Shearson SM, Smith SM, Sauer N. AtSTP1在拟南芥保护细胞中昼夜和光调节的表达。植物科学进展。2003;33(2):528-37。
- 29.
Yamada K, Kanai M, Osakabe Y, Ohiraki H, Shinozaki K, Yamaguchi-Shinozaki K.高盐度条件下拟南芥根系单糖吸收活性与转运体基因表达谱有关。中国生物医学工程学报,2011;26(5):457 - 457。
- 30.
李志刚,李志刚,李志刚。蚕豆锈病菌侵染蚕豆过程中吸器对糖供给的影响。中国科学院学报(自然科学版),2001;29(3):344 - 344。
- 31.
Voegele RT, Wirsel S, Möll U, Lechner M, Mendgen K.一种新型转化酶的克隆和鉴定及宿主和病原体转化酶在感染过程中的表达模式分析。Mol植物-微生物相互作用。2006;19(6):625。
- 32.
史科菲尔德,毕永明,康德龙,罗思坦。STP13是一种己糖转运体,过表达可以促进拟南芥幼苗的生长和氮的利用。植物细胞环境学报。2009;32(3):271-85。
- 33.
刘娟,韩玲,怀斌,郑萍,常青,管涛,李东,黄玲,康忠。小麦碱性/中性转化酶下调与小麦条锈病宿主易感性的相关。中国生物医学工程学报,2015;26(3):344 - 344。
- 34.
王超,黄玲,Buchenauer H,韩强,张宏,康哲。小麦与小麦锈菌(puccinia striiformis f. sp. tritici)非亲和互作中活性氧(O2−和H2O2)积累的组织化学研究。中国植物病理学杂志,2007;21(4):344 - 344。
- 35.
Pfaffl兆瓦。一种新的实时RT-PCR相对定量数学模型。核酸研究,2001;29(9):e45。
- 36.
Kumar S, Stecher G, Tamura K. MEGA7:更大数据集的分子进化遗传学分析版本7.0。分子生物学杂志,2016;33(7):1870-4。
- 37.
马晓明,刘萍,薛强,季春,齐涛,郭军,郭军,康哲,小麦脂质转移蛋白AtDIR1 - 2在小麦抗性负调控中的作用。植物科学,2017;8:521。
- 38.
Rentsch D, Laloi M, Rouhara I, Schmelzer E, Delrot S, Frommer WB。NTR1在拟南芥中编码一种高亲和寡肽转运体。中国科学(d辑:自然科学)。
- 39.
Soni R, Carmichael JP, Murray JA。影响醋酸锂介导酿酒酵母转化的参数及快速简化程序的开发。大学学报。1993;24(5):455-9。
- 40.
张艳,白艳,吴刚,邹松,陈艳,高成,唐东。同时对TaEDR1 3个同源体进行基因组编辑,提高小麦抗白粉病能力。中国植物学报,2017;29(4):344 - 344。
- 41.
霍尔茨伯格,布罗西奥P,格罗斯C,波格GP。大麦条纹花叶病毒诱导单子叶植物基因沉默。植物学报,2002;30(3):315-27。
- 42.
史科菲尔德,黄林,黄志强,李志强。病毒诱导的六倍体小麦基因沉默系统的建立及其在lr21介导的叶锈病抗途径功能分析中的应用植物科学进展。2005;38(4):344 - 344。
- 43.
波雷夫斯基S,贝利LG,鲍姆BR。含高多糖和多酚成分植物CTAB DNA提取方法的改进。植物分子生物学杂志,1997;15(1):8-15。
- 44.
尹超,陈旭,王旭,韩青,康忠,胡尔柏。小麦条锈病真菌条锈菌吸器表达序列标签的生成与分析。BMC基因组学。2009;10:626。
- 45.
Ayliffe M, Devilla R, Mago R, White R, Talbot M, Pryor A, Leung H.水稻对锈病病原的非寄主抗性。Mol植物-微生物相互作用。2011;24(10):1143-55。
- 46.
刘志刚,张志刚,张志刚。农杆菌介导拟南芥转化的一种简化方法。植物学报,1998;16(6):735-43。
- 47.
肖s, Calis O, Patrick E, Zhang G, Charoenwattana P, Muskett P, Parker JE, Turner JG。非典型抗性基因RPW8在拟南芥中招募基础防御成分来抵抗白粉病。植物学报,2005;42(1):95-110。
- 48.
常青,刘娟,王强,韩玲,刘娟,李敏,黄玲,杨娟,康哲。小麦条锈菌对小麦叶片水溶性碳水化合物水平及光合速率的影响。《植物病理学杂志》,2013;84:131-7。
- 49.
斯塔加尔I,科洛斯坦斯基C,约翰逊N,特h。一种基于分裂泛素的遗传系统,用于分析体内膜蛋白之间的相互作用。中国科学院学报(自然科学版),1998;29(3):379 - 379。
- 50.
Waadt R, Schmidt LK, Lohse M, Hashimoto K, Bock R, Kudla J.植物中CBL/CIPK复合物的多色双分子荧光互补研究植物学报,2008;26(3):344 - 344。
确认
我们要感谢Eckhard Boles教授提供EBY。VW4000突变体,西北农林科技大学干旱区作物胁迫生物学国家重点实验室共享仪器平台,西北农林科技大学干旱区作物胁迫生物学国家重点实验室黄雪岭博士提供Real Time PCR技术协助。
资金
国家重点研发计划项目(no . 2016YFD0100602)和干旱区作物胁迫生物学国家重点实验室开放项目(CSBAA2019011)资助了本研究。资助机构在研究设计、数据收集和分析或手稿撰写方面没有任何作用。
作者信息
从属关系
贡献
BYH, ZSK和JL构思并设计了实验;BYH、QY、XBW、QLP进行实验;BYH和JL分析数据并撰写论文。所有作者讨论了结果并对手稿进行了评论。所有作者在提交前都已阅读并批准了最终版本的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
三种编码序列的多对齐TaSTP13副本和两个特定的VIGS序列区域。TaSTP13-4A,TaSTP13-4B,TaSTP13-4D代表TaSTP13分别从小麦基因组A、B和D中获得编码区。相同和相似的核苷酸分别用黑色和浅灰色表示。VIGS站点由一行表示。
附加文件2:图S2。
TaSTP13蛋白的多比对。TaSTP13- 4a、TaSTP13- 4b和TaSTP13- 4d分别是从小麦基因组A、B和D中推导出的TaSTP13蛋白。相同和相似的氨基酸残基分别用黑色、浅灰色和粉红色表示。
附加文件3:图S3。
TaSTP13和LR67蛋白的多比对。其中,TaSTP13- 4a、TaSTP13- 4b和TaSTP13- 4d分别是从小麦基因组A、B和D中分离出来的TaSTP13蛋白。相同和相似的核苷酸残基分别用黑色和浅灰色表示。区分LR67和TaSTP13的两个氨基酸残基被阻挡在红色框中。
附加文件4:图S4。
TaSTP13的系统发育分析。采用邻域连接法对MEGA7进行了系统发育树的构建。使用1000个自举重复来估计分组的置信水平。分支用蛋白质名称和GenBank登录号进行标记。
附加文件5:图S5。
成绩单简介TaSTP13-4B对非生物胁迫(A)和外源性激素(B)的反应TaSTP13-4D对非生物胁迫(C)和外源激素(D)的响应。小麦叶片在0、2、6、12、24和48 hpt取样。表达水平归一化为TaEF-1a.的相对表达式TaSTP13采用比较阈值法计算(2——ΔΔCT).显著差异用星号表示(P< 0.01)根据学生的t以及。柱状图表示三个独立生物重复的平均值±标准差。ABA,脱落酸;SA,水杨酸;乙,乙;MeJA,茉莉酸甲酯;LT,低温;挂钩;聚乙二醇6000。
附加文件6:图S6。
IH in的长度TaSTP13-沉默和控制植物在48 hpi。对照组和对照组间IH长度无显著差异TaSTP13沉默的植物。IH的长度从气孔下囊泡到最长的感染菌丝的顶端。数值表示为三个独立样本的平均值±标准差,每个样本有50个感染部位。采用单因素方差分析确定显著性。
附加文件7:图S7。
RT-PCR分析TaSTP13在TaSTP13-OE和野生型植物中的表达。AtUBC21用作控制(底部面板)。
附加文件8:表S1。
本研究中的DNA构建。
附加文件9:表S2。
本研究使用的引物和菌株。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
怀,B,杨,Q,韦,X。et al。TaSTP13可能是通过提高细胞质己糖浓度来提高小麦条锈病的易感性。BMC植物生物学20.49(2020)。https://doi.org/10.1186/s12870-020-2248-2
收到了:
接受:
发表:
关键字
- 小麦
- 条锈病
- 糖转运蛋白
- 磁化率
- 中收取