摘要
背景
冷胁迫是影响植物生长和生产力的主要环境因素之一,特别是对作物芸苔属植物显著它们能挺过寒冷的季节。直到最近,虽然一些基因和途径参与显著独立研究已经揭示了冷反应,但仍缺乏对关键调控因子和调控网络的全基因组识别。本研究对短日照条件下低温胁迫半冬季型和冬季型油菜的转录组进行了研究,主要目的是系统地鉴定油菜低温响应中的功能保守转录因子(functional保守转录因子,TFs)显著.
结果
在短日照条件下,半冬型油菜(158A)和冬型油菜(SGDH284)在7天低温胁迫下均观察到基因表达的全局调控。差异表达基因(DEGs)的功能分析表明,胁迫响应机制增强,光合作用受到抑制,半冬系对一些主要生物过程的抑制更为广泛。有超过400个转录因子对冷胁迫有差异表达,其中56个转录因子与已知的冷应答转录因子高度相似,在158A和SGDH284中有一致的调控,25个转录因子的靶点在总DEGs中过高。基于它们相互作用的进一步研究表明,几种tf在冷反应中起着关键作用显著.
结论
综上所述,我们的研究结果揭示了冷胁迫半冬季型和冬季型的基因表达的变化显著并提供了一个有价值的候选关键监管机构参与的集合显著对冷胁迫的响应,可以拓展我们对植物胁迫反应的认识,有利于未来油菜品种的改良。
背景
油菜籽(芸苔属植物显著L.)是世界上最重要的经济作物之一,在进化和长期栽培的情景下,为适应多样的气候,形成了春季型、冬季型和半冬季型三大生态型。长江流域是中国最重要的油菜籽生产生态区。长江流域的冬冬、半冬油菜种植时间为9月底至10月中旬播种,这意味着低温对油菜的生长和产量有一定的威胁。因此,确定油菜越冬进化的分子机制,不仅有助于我们更好地了解植物的环境适应,而且对中国和其他国家的农业发展具有重要意义。
冷驯化,即一段时间暴露在低但不结冰的温度下,会提高许多植物的抗冻性[1].在这一过程中,调节植物的一系列生化生理特性,并诱导基因表达的大规模改变。在过去的几十年里,人们对植物冷驯化的分子机制进行了大量的研究。CBFs/ dreb(冷结合转录因子/脱水反应元件结合因子)依赖信号是冷胁迫应答的关键和保守调控机制,在许多植物中都有发现,含有CBFs及其激活因子(如ICE1、CAMTA3和BZR1/BES1)和抑制因子(如MYB15、PIFs和EIN3)的成分[2,3.].同时,一些cbf不依赖的调控途径也参与了许多植物的冷反应,如植物激素生长素、脱落酸、乙烯、赤霉素和茉莉酸[4].
迄今为止,许多研究对冷胁迫油菜的生理生化和分子变化进行了研究。冷驯化后,细胞超微结构发生明显变化显著,例如细胞壁增厚及质膜内陷[5].此外,还检测到基因表达的广泛调控,包括一系列基因的转录本积累,如冷反应基因(COR)BN115(COR15)和BNCOR25[6,7],BN59(H+- atp酶亚基)[8],一半[9),多CBF年代(10,11]和一系列转录因子(tf),如APETALA2/乙烯反应因子和NACs [12,13].最近的研究也表明了microRNAs和lncRNAs在油菜低温胁迫响应中的潜在作用[14,15].但仍有不少问题有待解决,如以往的研究大多是在长日光周期条件下进行的,与实际现场生产中的短日条件相脱离。此外,尚不清楚已知的机制是否在遗传间保守,以及这些COR基因是如何调控的。
本研究对冷胁迫半冬型油菜(158A)和冬型油菜(SGDH284)经过7天冷处理后的转录组进行了比较分析,目的是揭示短日光周期下油菜低温响应的保守和关键调控因子。
结果
差异表达基因(DEGs)的鉴定及一般特征
高通量测序从半冬季型(158A)和冬季型(SGDH284)的每个样本中平均产生约650万个合格短读显著大约70%的系被映射到参考基因组(附加文件)1:表S1)。在至少一个样本中,当FPKM的截断值≥1时,在158A(40,277)和SGDH284(39,200)中检测到约40,000个基因的表达(约占整个集合的25%)。低温胁迫下158A和SGDH284的基因表达量明显高于对照,分别约为8.6和11.6%。
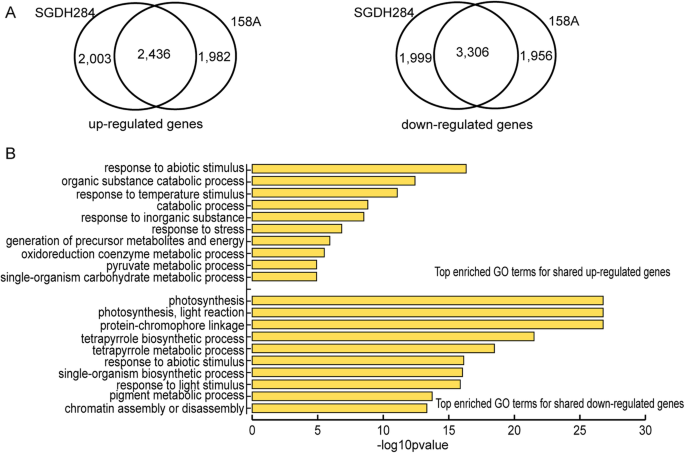
低温处理后,158A和SGDH284中约有10%的基因(约10000个基因)存在差异表达,其中2436个和3306个基因在两系中均持续上调和下调(图2)。1a).功能富集分析显示,共享的上调基因在负责各种环境胁迫的机制和与能量生产相关的分解代谢过程中显著富集,而共享的下调基因在与光合作用、胁迫响应和染色质组织相关的生物过程中富集(图2)。1b).分析系特异性DEGs的功能,发现冷胁迫158A与SGDH284在基因表达上存在显著差异。在半冬系158A中,下调的基因与有机氮化合物生物合成、微管运动、翻译和DNA复制等过程显著相关,而上调的基因主要与胁迫响应和转运蛋白相关。相比之下,冬季型系SGDH284的下调基因主要参与胁迫响应和氨基酸/糖/硫化合物代谢过程,而SGDH284特异性的上调基因富集于构成大分子生物合成和组蛋白泛素化相关过程(表2)1).进一步的研究表明,在158A特异性下调基因中发现了更多参与翻译、DNA复制和细胞周期调控的基因,而在SGDH284特异性上调基因集中发现了更多与核糖体生物发生相关的基因(附加文件)1:表S2),表明维持细胞活性的基本生物过程在半冬系158A中受到更显著的抑制。
一些先前鉴定的COR基因显著在本工作中收集的deg中发现。BN28(BnaAnng37980DKin1),BN115(BnaA03g56750DCOR15),BN59(BnaA07g34490DVHA-A)为首次鉴定的COR基因显著,其转录本在低温胁迫植物中积累[6,8,16].在本研究中,这些基因在158A和SGDH284中均表达上调,log2fold的变化范围为1.1 ~ 5.6。早期的研究也揭示了四个cbf样基因的转录本积累显著对低温的响应,例如,CBF5,CBF7,CBF16而且CBF17[10,11].CBF5(BnaC03g71900D),CBF7(BnaAnng34260D)和CBF16(BnaC07g39680D)在低温暴露158A和SGDH284时也上调(log2foldchange范围为2.4-4.4)。然而,确切的轨迹CBF17在所选的基因组版本(PRJEB5043_v1)中未确定,这可能归因于基因组注释时基因模型构建的差异。最相似的基因CBF17为BnaA08g30910D(同源性80%),但在本研究的冷胁迫株系中均无表达变化。
相比之下,其他一些已知COR基因的转录本积累可能不是158A或SGDH284在短日条件下冷驯化所必需的。例如,以前的报告显示BnCOR25而且一半都是在显著受冷应力[7,9].然而,在本工作的转录组学分析中发现BnCOR25或一半158A和SGDH284在低温暴露后均无显著变化。
冷胁迫下tf的表达显著
tf在植物对各种环境胁迫的反应中起着至关重要的作用,例如,在特征良好的模式生物中答:芥,基于综合策展和基因组数据挖掘方法,鉴定出超过1000种应激响应tf [17].在显著,共注释了5985个tf,其中许多tf参与了应激反应,如CBFs和一系列NACs [10,18].然而,目前尚缺乏系统的冷胁迫响应tf的鉴定。
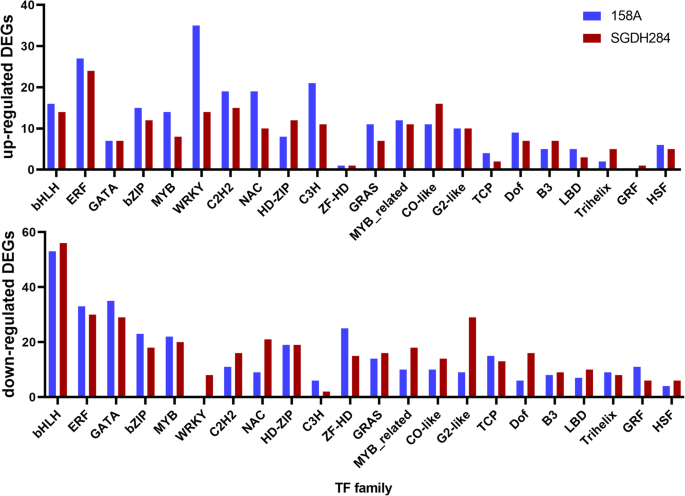
在这项工作中,估计得到了两个表达谱显著我们发现,在至少一个研究样本中,约40%的tf表达是可检测的(FPKM≥1)。在低温胁迫下,158A和SGDH284分别有692个和708个tf差异表达,其中2个系共有402个tf差异表达。所有差异表达的tf均属于54个科1:表S3和图。2).其中bHLH是最大的家族,每系中约有70个差异表达的bHLH型tf。但co样家系的不同表达成员比例最高(约50%)。有趣的是,在收集到的差异表达的tf中,一些家族成员在两个细胞系中大多表达下调(如bHLH、GATA和ZF-HD)或上调(如WRKY、C3H和DBB)。具体而言,在158A中,所有差异表达的WRKY基因(35个)均表达上调,而在SGDH284中,WRKY基因均表达上调(14个)和下调(8个)。此外,在158A和SGDH284中,几乎所有差异表达的GRFs(生长调节因子)都被下调。
确定涉及冷反应的关键调控因子
使用了两种策略来确定参与其中的关键监管机构显著对冷应激的反应。首先,通过同源性搜索,筛选出了128个与冷响应基因序列高度相似(氨基酸同源性为> 50%)的转录因子答:芥在158A和/和SGDH284中均有差异表达。其中,在158A和SGDH284中分别有19个和37个表达下调(如多个乙烯响应转录因子)和上调(如CBF1/2和ZAT6/10/12同源物)2).来源于STIFDB (Stress Responsive Transcription Factor Database)中的描述[17],这56个tf中的大多数也参与了对一些其他压力的反应,如干旱、光和盐。
此外,我们进行富集分析,发现目标蛋白在总DEGs中占比过高的tf,结果在158A和SGDH284分别富集51和55个tf(附加文件1:表S4)。其中25个tf由两行共享(表23.),包括一些与其他植物COR基因同源的基因,如CBF通路中的CBF7、CAMTA1和PIF4/7, RVE7和TCP21通过与CBF通路组分LHY和CCA1相互作用来调节生物钟[19,20.], BZIP44和CDF5对种子萌发和开花的影响[21,22],以及其他一些与多重应激反应相关的基因。值得注意的是,这25个tf中的1495和1520个潜在靶点分别在158A和SGDH284中差异表达,分别约占总数的15%。功能分析显示,这25个tf中有16个在光合作用、植物发育(如种子萌发、根系发育和昼夜节律)、氨基酸分解代谢和刺激反应等生物过程中富集(表2)3.).
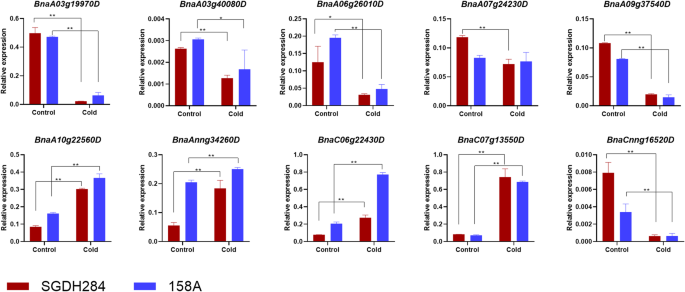
综上所述,基于同源搜索和TF富集的策略分别识别出56个和25个在158A和SGDH284中上调/下调的TF。选择其中10个,通过RT-qPCR检测其在冷胁迫条件下的表达变化(图2)。3.和附加文件1:表S5)。
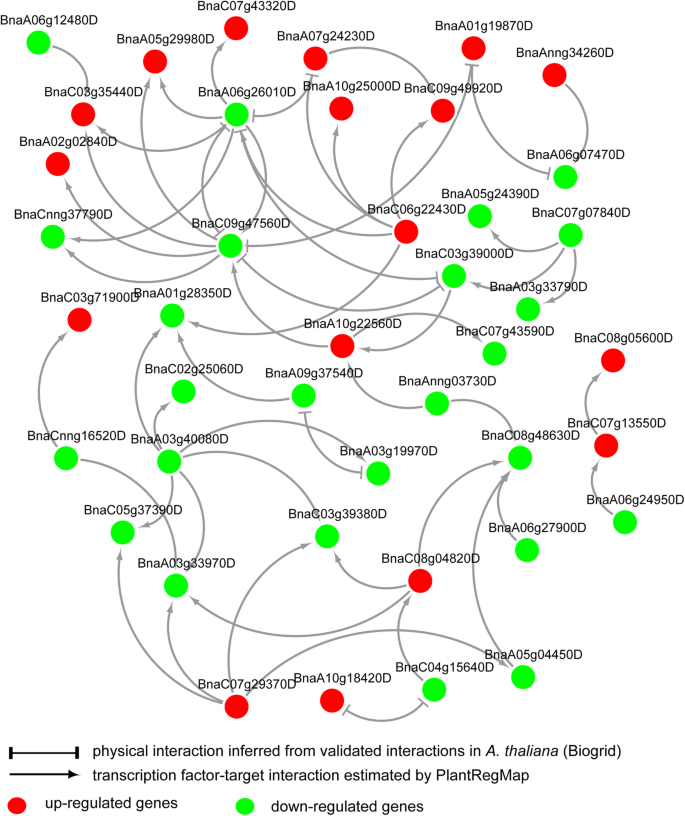
此外,从策展蛋白-蛋白作用中推断答:芥和预测的调节显著,构建了已识别的冷响应性tf的调控网络(图;4).根据构建的网络,一些转录因子在调控的初始步骤起作用,如BnaAnng34260D (CBF7)和BnaC07g07840D (BHLH77),而一些转录因子则调控多个其他转录因子的表达,如BnaA06g26010D (TCP7)和BnaC09g47560D (TCP21)和BnaA03g40080D (PIF7)。
讨论
试图进一步了解的分子机制显著对冷胁迫的响应,我们分析了冷胁迫半冬季型和冬季型的基因表达变化显著行。与其他植物的研究结果相似,约有10-15%的基因在应对冷胁迫时表达差异[23,24,25],也观察到基因表达的全局调节显著线158A和SGDH284低温暴露后。出乎意料的是,尽管158A和SGDH284在遗传学上有很高的相似性,但只有60%的deg是相同的。共享的DEGs表明低温胁迫植物具有一些共同的生化生理特征,如抗逆性增强和光合作用受到抑制。在许多植物中观察到冷驯化伴随光合作用的抑制,这是由于冷对电子传输和碳固定的影响,以及叶绿体中自由磷酸盐的有效性,这可以通过叶绿素a的含量来评估。26].此外,进一步对约40%的系特异性DEGs进行检测,发现冷胁迫158A和SGDH284的基因调控机制存在显著差异。胁迫响应相关基因在两组系特异性DEGs中均得到富集,而在158A和SGDH284中表达相反。同样,与基本细胞活动相关的生物过程在158A中被显著抑制,而在SGDH284中被增强。这与半冬季型生长是一致的显著一旦在田间遇到极冷温度,植株受到的抑制比冬季品种更显著。有趣的是,组蛋白H2B泛素化相关基因在SGDH284特异性基因中富集。已有报道表明,H2B单泛素化与转录激活有关,转录激活与调控角质层组成有关,从而保护植物免受非生物/生物胁迫,并通过调节生物钟基因的表达来促进植物的生长适应性[27,28,29].本研究表明,组蛋白H2B泛素化在SGDH284适应低温生存中起着至关重要的作用,但具体的作用和机制还有待进一步研究。
在这项工作中检查了先前特征的COR基因的表达。无论是半冬型还是冬型,多数基因表达上调显著,这与之前的报告一致。但有些人,就像BnCOR25而且一半,在任何一行的表达上都没有改变。我们注意到,在这项工作中,相对于短日光周期的积累BnCOR25而且一半在冷应力下显著在16 h光照/8 h暗循环下检测[7,9].因此,需要进一步研究这些差异是否由光周期引起。
从本工作的比较基因组学分析,特定TF家族成员在冷驯化中有上调或下调的趋势显著,如WRKY和GRF基因。WRKY基因参与植物对各种环境胁迫的反应[30.,31],部分WRKY基因上调显著对多种应力的反应在之前已经观察到[32,33].在半冬季型158A中,所有差异表达的WRKY基因均上调,表明其在158A抗寒性中起着重要作用。此外,GRFs通常在叶片和子叶中发挥调节细胞扩张的作用[34],而且是半冬季型显著在zy036中观察到GRF2在提高种子产油中的作用,其作用可能是通过调节细胞数量和植物光合作用[35].其中,GRF2a和GRF2b (BnaA01g00300D/BnaC07g46760D)在半冬型和冬型株系中均有下调,表明它们在光合作用调控中起保守作用。158A位点GRF基因下调较多,与冬季型表型一致显著冷胁迫后通常表现出较强的生理活性,且生长为半冬季型显著在寒冷的条件下,线条受到了更严重的限制。然而,这些事实是否与半冬季型油菜和冬季型油菜的不同低温响应机制直接相关,仍有待进一步研究。
基于同源性搜索和富集分析,分别预测了56个和25个冷响应tf,它们在半冬季型和冬季型中以相同的方式调控显著行。从目的基因的功能分析和重构的转录级联推测,几个转录因子在调节基因表达以增强抗寒性方面具有重要意义显著例如CBF7, BHLH77, TCP7, TCP21和PIF7,包括一些具有良好特征的COR基因,如CBF7和PIF7,这表明我们的策略是探索关键调控因子的有效方法。
结论
植物在低温环境下需要进行广泛的生化生理调节和基因表达调控。一些基因和途径在植物物种中发挥类似的作用,如CBFs和光合作用/叶绿体相关基因[36].然而,低温胁迫植物的基因表达也存在广泛的差异,这在很大程度上归因于固有的遗传差异。为了鉴定涉及的保守基因和途径显著我们比较了半冬型系158A和冬型系SGDH284的转录变化。胁迫响应机制增强,光合作用受到抑制显著冷驯化在种内具有保守性。然而,我们也发现大约40%的DEGs是系特异性的,这表明在环境适应过程中发生了调节机制的重塑。此外,参与了大约80个关键的tf显著通过综合策略预测冷反应。这些调控因子涵盖了主要的低温响应机制,并参与了大量基因的表达变异,为全面认识植物的胁迫响应机制提供了有价值的资料显著.
除了在这项工作和其他地方进行的转录组学分析,其他策略,如全基因组关联研究(GWAS)也在鉴定与农业性状相关的基因方面发挥了至关重要的作用[37,38,39],以及与植物对低温等不同环境胁迫的反应有关的基因座[40,41,42].考虑到基于转录组的分析通常用于评估组织特异性和阶段特异性调控的特点,因此期望应用包括转录组学、GWAS和表达数量性状位点(eQTL)等集成策略在内的多维研究方法来系统地描述植物冷应激机制显著在未来。
方法
植物材料和生长条件
芸苔属植物显著SGDH284和158A是本实验室从冬菜籽小孢子培养中筛选出的两个DH系Sollux还有半冬菜籽zhongyou9988,分别用于本研究。Sollux是由浙江省农业科学院倪锡源博士提供的,以及zhongyou9988是中国农业科学院石油研究所选育的我国商品性品种。在4 × 8孔花盆(54 × 28 × 7 cm)中,基质为土壤和珠光体,以3:1的比例播种。花盆移入植物生长室(Percival e - 36l),在25°C的短日光照周期(光照10小时/暗14小时)和60%的湿度下生长4周。冷处理时,将各品系幼苗的2盘移栽到另一个植物生长室中,温度为4℃,光照周期和湿度相同,冷处理7天。另设4盘幼苗为对照组,置于相同的植物生长室,光照和温度条件相同。处理后,从相同的托盘中收集6-8株植物的完全展开的第一片叶子,作为一个样本汇集在一起。叶子一从植物上割下来就被冷冻在液氮中。然后将样品保存在−80°C下进行进一步分析。
RNA提取和RNA测序
根据制造商的说明,使用TRIzol regent (Invitrogen, Carlsbad, USA)分离总RNA。用凝胶电泳和DU800分光光度计(BECKMAN, USA)检测RNA的数量和质量。每个样品共50 μg RNA (1000 ng/μL)用于RNA测序。RNA-seq应用Illumina NextSeq 500平台。根据制造商说明书(TruSeq RNA Sample Prep Kit, Illumina)构建8个文库并进行配对端测序。首先,利用附着寡聚(T)的磁珠对mRNA进行纯化,在片段缓冲液中切割成约375 bp的短片段。然后将纯化后的片段mRNA转化为双链cDNA,并在短片段的两端添加适配器。用AMPure XP珠去除不合适片段,通过PCR扩增构建测序文库。文库经Pico green染色(PicoGreen dsDNA检测试剂盒,Invitrogen, P7589)和荧光分光光度法(quantiflol - st荧光仪,Promega, E6090)检查后,经安捷伦2100 (Agilent 2100 Bioanalyzer, Agilent 2100;Agilent高灵敏度DNA试剂盒,Agilent, 5067-4626)。
鉴别差异表达基因
使用Trimmomatic (version 0.33) (LEADING:20, trails:20 SLIDINGWINDOW:4:20, MINLEN:25)对Illumina平台生成的原始读数进行质量控制[43].干净的reads然后被映射到的参考基因组芸苔属植物显著来自ensemble blplants (http://plants.ensembl.org,版本42)使用TopHat (v2.1.0)(默认设置)[44].使用袖扣(v2.2.1)重建转录组并计算表达水平。只收集至少一个样本中FPKM (Fragments Per Kilo bases Per Million reads)≥1的基因进行进一步分析。HTseq-count (version 0.11.2)用于计算定位到特征基因位点的短读数,DEseq2用于鉴定差异表达基因(DEGs) (foldchange≥2和p-value≤0.05)[45,46].
功能富集分析
本研究中的氧化石墨烯富集分析使用PlantRegMap提供的工具(http://plantregmap.cbi.pku.edu.cn) [47].在线服务器REViGO (http://revigo.irb.hr/)来去除GO项的冗余[48].
冷反应转录因子的鉴定
基于同源性的冷响应tf鉴定是通过比较显著基因对应激反应性tf的影响答:芥使用BLASTP工具(在长度上查询和命中序列的截断标识50%和覆盖率50%)。强调响应性tf答:芥已从基金资料库(http://caps.ncbs.res.in/stifdb2/) [17].此外,使用‘TF enrichment’工具通过PlantRegMap进行TF富集分析(截断p值0.05)[47].简言之,转录调控显著首次基于功能转录因子结合位点(FunTFBS)全基因组分析确定。随后,通过Fisher’s exactly检验,分别鉴定了冷胁迫158A和SGDH284中靶蛋白在总DEGs中所占比例过高的tf。
冷响应tf的相互作用网络
首先,之间的互动答:芥蛋白质从BioGRID中检索[49].中TFs的蛋白-蛋白相互作用显著然后根据估计的BLAST互惠最佳命中数来预测答:芥而且显著在PlantRegMap。tf之间的潜在规则显著从PlantRegMap (FunTFBS方法)中检索,然后使用内部开发的perl脚本将其与预测的蛋白质-蛋白质相互作用合并。利用Cytoscape(3.4.0)显示和分析构建的网络[50].
实时荧光定量PCR分析
为了验证基因的表达谱,随机选取10个deg进行实时荧光定量PCR (qRT-PCR)分析。每个处理收集三个样本用于总rna提取,这与RNA-seq中使用的样本不同。用FastQuant RT Kit(天根生物科技,北京,中国)反转录后,按照厂家说明书使用THUNDERBIRD SYBR qPCR Mix (TOYOBO,大阪,日本)和Mastercycler ep realplex (Eppendorf,德国)进行qRT-PCR反应。热循环条件如下:94°C持续2 min,然后在94°C和60°C分别持续10 s和20 s,然后在72°C持续20 s,循环40次。所有反应均重复进行三次actin7作为内参基因(登录号:Bra028615) [51].相对基因表达量采用2−ΔΔCt方法计算[52].
统计数据
另外指定,气本研究采用-平方检验来计算不同组间基因数量变异的显著性。
数据和材料的可用性
这项工作产生的原始数据可在BIGD项目PRJCA001621 (https://bigd.big.ac.cn/bioproject/browse/PRJCA001621).
缩写
- cbf:
-
冷结合转录因子
- 林后:
-
Cold-responsive
- 度:
-
差异表达基因
- 羧酸:
-
脱水响应元件结合因子
- 平:
-
生长调节因素。
- TFs:
-
转录因子
参考文献
- 1.
托马斯休曼氏金融。植物低温驯化:抗冻基因及其调控机制。植物化学学报,1999;50:531 - 531。
- 2.
史勇,丁勇,杨松。冷驯化中CBF信号的分子调控。植物科学进展,2018;23(7):623-37。
- 3.
刘勇,党鹏,刘玲,何超。气候变化下CBF-COR途径的冷驯化:来自拟南芥的经验教训。植物细胞学报,2019;38(5):511-9。
- 4.
石勇,丁勇,杨松。冷驯化过程中冷信号转导及其与植物激素的相互作用。中国生物医学工程学报,2015;26(1):344 - 344。
- 5.
李志强,李志强,李志强,等。低温对甘蓝型油菜(Brassica napus L. var. oleifera L.)叶片中酚类物质的影响。中国科学(d辑). 2002;30(5):344 - 344。
- 6.
韦尔廷尼克,李志刚,李志刚,李志刚。甘蓝型油菜低温调控基因cdna的克隆与鉴定。植物科学进展。1993;21(1):171-7。
- 7.
陈琳,钟华,任峰,郭qq,胡小鹏,李小宝。甘蓝型油菜(Brassica napus)一个新的冷调节基因COR25参与植物对冷胁迫的反应和耐受性。植物细胞学报,2011;30(4):463-71。
- 8.
王志强,李志强,李志强,李志强。甘蓝型油菜液泡体atp酶70 kDa亚基cDNA的克隆与表达。植物分子生物学,1995;28(5):943-8。
- 9.
李志强,李志强,李志强。低温诱导甘蓝型油菜hsp90转录本积累的研究。植物科学进展。1995;26(3):344 - 344。
- 10.
高俊梅,李志强,李志强,王志强。甘蓝型油菜4个CBF转录因子的调控与鉴定。植物分子生物学,2002;49(5):459-71。
- 11.
吕文奇,李文杰,李文杰,李文杰,李文杰,李文杰,李文杰。油菜CBF/ dreb1类转录因子对甘蓝型油菜光合能力和抗冻性的影响。植物生理学报,2005;46(9):1525-39。
- 12.
杜超,胡坤,鲜生,刘超,范军,涂军,付涛。油菜低温胁迫中AP2/ERF转录因子的动态转录组分析。中国生物医学工程学报。2016;29(3):1053-67。
- 13.
王波,郭旭,王超,马军,牛峰,张辉,杨波,梁伟,韩峰,蒋永强。油菜(Brassica napus L.)植物特异性NAC基因家族的鉴定和鉴定揭示了参与细胞死亡的新成员。中国生物医学工程学报,2015;26(4):395-411。
- 14.
meghan S, Basu U, Joshi RK, Kav NNV。冷胁迫甘蓝型油菜的生理研究及全基因组microRNA分析。植物物理学报。2018;132:1-17。
- 15.
Shea DJ, Nishida N, Takada S,板桥E,高桥S, Akter A, Miyaji N, Osabe K, Mehraj H, Shimizu M,等。长非编码rna芸苔属植物拉伯L.春化之后。科学报告。2019; 9(1): 9302。
- 16.
王晓明,李志强,李志强,李志强,李志强。甘蓝型油菜低温诱导基因与拟南芥kin1基因的互补序列。植物科学进展。1992;32(4):344 - 344。
- 17.
Naika M, shamer K, Mathew OK, Gowda R, Sowdhamini R. STIFDB2:植物胁迫响应转录因子数据库的更新版本,包括额外的胁迫信号、胁迫响应转录因子结合位点和胁迫响应基因。中国生物医学工程学报,2013;29(2):344 - 344。
- 18.
Hegedus D, Yu M, Baldwin D, Gruber M, Sharpe A, Parkin I, Whitwill S, Lydiate D.甘蓝型油菜NAC结构域转录激活子在生物和非生物胁迫下的分子表征。植物化学学报,2003;26(3):389 - 397。
- 19.
徐旭,蔡新红,陈志刚,陈志刚。拟南芥MYB蛋白早期光敏色素- responsive1是拟南芥从性昼夜节律振荡器的一个组成部分。植物学报。2003;15(10):2476-88。
- 20.
普鲁内达-帕兹JL,布雷顿G, Para A,凯SA。一种功能基因组学方法揭示了CHE是拟南芥生物钟的组成部分。科学。2009;323(5920):1481 - 5。
- 21.
iglesia - fernandez R, Barrero-Sicilia C, Carrillo-Barral N, Onate-Sanchez L, Carbonero P.拟南芥bZIP44:一种影响种子萌发和甘露聚糖酶编码基因AtMAN7表达的转录因子。植物学报,2013;26(5):369 - 369。
- 22.
Fornara F, Panigrahi KC, Gissot L, Sauerbrunn N, Ruhl M, Jarillo JA, Coupland G.拟南芥DOF转录因子冗余降低CONSTANS的表达,并对光周期开花应答至关重要。生物技术学报。2009;17(1):75-86。
- 23.
李国宝,戴恒胜,朱建科。拟南芥冷应答转录组及其ICE1的调控。植物学报。2005;17(11):3155-75。
- 24.
张涛,赵霞,王伟,潘艳,黄玲,刘霞,宗勇,朱林,杨东,付波。两种水稻基因型低温胁迫响应性的转录组分析。公共科学学报,2012;7(8):e43274。
- 25.
沃特斯AJ,马卡列维奇I,诺谢J,伯格哈特LT,好施CN,好施CD,施普林格NM。玉米非生物胁迫下基因表达反应的自然变异。植物学报,2017;29(4):344 - 344。
- 26.
Nievola CC, Carvalho CP, Carvalho V, Rodrigues E.植物对温度变化的快速响应。温度。2017;4(4):371 - 405。
- 27.
冯杰,沈文华。植物组蛋白单泛素化的动态调控与功能。植物科学进展(英文版);
- 28.
Himanen K, Woloszynska M, Boccardi TM, De Groeve S, Nelissen H, Bruno L, Vuylsteke M, Van Lijsebettens M.拟南芥需要Histone H2B单素化才能达到最大的生物钟基因转录水平。中国植物学报,2012;32(2):344 - 344。
- 29.
Menard R, Verdier G, Ors M, Erhardt M, Beisson F, Shen WH。组蛋白H2B单泛素化参与拟南芥角质层和蜡质组成的调控。植物生理学报。2014;36(2):455-66。
- 30.
王晓明,王晓明,王晓明,等。WRKY蛋白在非生物胁迫响应中的表达调控。科学世界,2015;2015:807560。
- 31.
Eulgem T, Rushton PJ, Robatzek S, Somssich IE。植物转录因子WRKY超家族。植物科学进展,2000;5(5):199-206。
- 32.
何颖,毛松,高原,朱玲,吴东,崔颖,李娟,钱伟。甘蓝型油菜WRKY转录因子在多重胁迫下的全基因组鉴定与表达分析。PLoS One. 2016;11(6):e0157558。
- 33.
杨波,蒋勇,拉赫曼MH, Deyholos MK, Kav NN。油菜WRKY转录因子基因鉴定及表达分析(芸苔属植物显著L.)对真菌病原体和激素治疗的反应。BMC植物生物学,2009;9:68。
- 34.
金俊华,崔东,Kende H. AtGRF家族转录因子参与拟南芥叶片和子叶生长。植物J:细胞和分子生物学。2003年,36(1):94 - 104。
- 35.
刘健,华伟,杨海林,詹根根,李荣军,邓伯峰,王晓峰,刘国华,王海辉。BnGRF2基因(来自甘蓝型油菜的grf2样基因)通过调节细胞数量和植物光合作用来提高种子油产量。应用物理学报,2012;29(10):379 - 379。
- 36.
Kenchanmane Raju SK, Barnes AC, Schnable JC, Roston RL。陆生植物低温耐受性:转录本和膜反应是保守的吗?植物科学:国际实验植物生物学杂志。2018; 276:73 - 86。
- 37.
李峰,陈斌,徐坤,吴娟,宋伟,Bancroft I, Harper AL, Trick M,刘晟,高刚,等。油菜籽粒质量与籽粒质量的全基因组关联研究。DNA Res:一份快速发表基因和基因组报告的国际期刊。2014; 21(4): 355 - 67。
- 38.
徐磊,胡凯,张震,关超,陈松,华伟,李娟,文娟,易斌,沈娟,等。全基因组关联研究揭示了油菜(Brassica napus L.)开花时间的遗传结构。DNA res 2016;23(1): 43-52。
- 39.
阿拉伯MM, Marrano A, Abdollahi-Arpanahi R, Leslie CA, Askari H, Neale DB, Vahdati K.伊朗波斯核桃群体结构全基因组模式和坚果相关性状的关联图谱j . regia700K SNP阵列。科学通报2019;9(1):6376。
- 40.
李陆胡G,李Z, Y, C,锣,燕年代,李G,王M,任H, H,关等。全基因组关联研究发现玉米萌发过程中耐冷性的多个遗传位点。科学通报2017;7(1):10840。
- 41.
刘超,陈凯,赵旭,王旭,沈超,朱勇,戴明,邱旭,杨荣,邢东,等。通过全基因组关联研究鉴定水培和盐田条件下水稻耐盐和产量相关性状的基因。大米。2019;12(1):88。
- 42.
刘志强,张志强,张志强,等。油菜抗冻性的全基因组关联研究。植物生物化学学报,2019;28(2):211-22。
- 43.
Bolger AM, Lohse M, Usadel B. Trimmomatic:一种用于Illumina序列数据的灵活修剪器。生物信息学。2014;30(15):2114 - 20。
- 44.
Trapnell C, Roberts A, Goff L, Pertea G, Kim D, Kelley DR, Pimentel H, Salzberg SL, Rinn JL, Pachter L.用TopHat和袖扣进行rna测序实验的差异基因和转录本表达分析。网络学报。2012;7(3):562-78。
- 45.
Anders S, Pyl PT, Huber W. HTSeq—用于处理高通量测序数据的Python框架。生物信息学,2015,31(2):166 - 9。
- 46.
Love MI, Huber W, Anders S.用DESeq2调节RNA-seq数据的折叠变化和分散估计。中国生物医学工程学报。2014;15(12):550。
- 47.
金J,田F,杨,孟YQ,香港L,罗J,高g . PlantTFDB 4.0:对中央在植物转录因子和监管中心交互。核酸研究,2017;45(D1): D1040-5。
- 48.
Supek F, Bosnjak M, Skunca N, Smuc T. REVIGO总结并可视化了基因本体术语的长列表。公共科学学报。2011;6(7):e21800。
- 49.
Oughtred R, Stark C, Breitkreutz BJ, Rust J, Boucher L, Chang C, Kolas N, O'Donnell L, Leung G, McAdam R,等。BioGRID交互数据库:2019年更新。核酸学报2019;47(D1): D529-41。
- 50.
香农P, Markiel A, Ozier O, Baliga NS, Wang JT, Ramage D, Amin N, Schwikowski B, Ideker T. Cytoscape:生物分子相互作用网络集成模型的软件环境。基因组学报,2003;13(11):2498-504。
- 51.
王智,陈勇,方浩,史宏,陈凯,张志,谭霞。不同胁迫条件下甘蓝型油菜定量逆转录聚合酶链反应归一化内参基因的选择。中国生物医学工程学报。2014;28(5):1023-35。
- 52.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25(4):402 - 8。
致谢
作者感谢浙江省农业科学院倪锡元博士提供的种子Sollux.
资金
本研究由美国科学促进会(AAAS)科技创新团队建设项目资助,项目编号15C0207,“长江下游新型转基因油籽杂交选育”,项目编号2018ZX08020001-005,浙江省杭州市科技发展计划项目,项目编号20160432B06和浙江理工大学科学基金项目,项目编号19042398-Y。资助机构在研究设计、数据收集和分析或手稿撰写方面没有任何作用。
作者信息
从属关系
贡献
概念化,l.k., Y.S., z.f;方法论,W.L.和z.f;软件,共晶;验证,L.K, W.L, Z.F.和D.Y.;形式分析,J.W.和D.Y.;调查,l.k., W.Y, J.G.和J.C.;资源,w.l., Y.S.和Z.F.;数据管理,D.Y.;写作-原稿准备,l.k., Z.F.和D.Y.;写作评论和编辑,D.Y.和Y.S.; visualization, L.K.; supervision, Y.S.; project administration, L.K., Y.S. and Z.F.; funding acquisition, L.K., W.L., D.Y. and Z.F. All authors read and approved the final manuscript.
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:
表S1。RNA-seq和短读映射的统计。表S2。系特异性差异表达基因在158A和SGDH284间GO项有显著差异。表S3。158A和SGDH284差异表达转录因子的统计。表S4。低温应答转录因子158A和SGDH284的富集分析。表S5。引物对用于检测所选转录因子的表达。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
柯,L.,雷,W.,杨,W。et al。低温应答转录因子的全基因组鉴定芸苔属植物显著lBMC植物生物学20.62(2020)。https://doi.org/10.1186/s12870-020-2253-5
收到了:
接受:
发表:
关键字
- 冷应激
- 转录因子
- 芸苔属植物显著
- 短暂的一天