摘要
背景
茎枝分支是植物适应环境变化的重要特征。独igolactones (SLs)是一种新发现的植物激素,具有抑制植物枝条分枝的作用。SL生物合成基因CCD7(类胡萝卜素裂解双加氧酶7)和CCD8在几种草本植物中已经发现利用它们的功能丧失突变体来调节分支。然而,角色为CCD7和CCD8由于缺乏相应的突变体,葡萄藤茎部分枝控制尚不清楚。
结果
在这里,我们使用CRISPR/Cas9系统编辑VvCCD7和VvCCD8葡萄杂交品种41B的基因。41B胚性细胞可以很容易地转化并用于相应转化植株的再生。测序分析显示,基因编辑已经成功地针对这两种疾病VvCCD41B胚性细胞中的基因。再生后,6个41B植株被鉴定为转基因植株CCD8-sgRNA表达盒。其中4株在靶区发生突变,被选为ccd8突变体。这些ccd8与相应的野生型植物相比,突变体的茎分枝增加。此外,在所测试的突变体中,在预测的脱靶位点未检测到脱靶突变。
结论
我们的结果强调的关键作用VvCCD8 .在控制葡萄藤枝条分枝上。
背景
对茎枝分枝的控制是植物优化生长以适应环境变化的一种适应性策略。芽的分枝是由腋芽的数量和出芽量决定的,芽的出芽量增加了分枝的灵活性[1]。生长素和细胞分裂素是植物芽枝分枝的主要调控因子。生长素被认为是芽生长的抑制剂[2,3.],而细胞分裂素则促进了这一过程[2]。然而,已建立的激素信号通路并不能完全解释芽生长的控制[4),表明存在其他监管机构。
己金内酯或其衍生物(SLs)是新发现的抑制腋芽生长的植物激素[5,6]。SLs是一类由类胡萝卜素合成的分子。两种类胡萝卜素裂解双加氧酶CCD7和CCD8已被证明是SLs生物合成所必需的[6,7]。CCD7和CCD8也被称为MORE AXILLARY BRANCHING3 (MAX3)和MAX4 in拟南芥[7,8]。CCD7和CCD8同源物也被发现存在于几种植物的独脚金内酯生物合成途径中,如水稻中的DWARF17 (D17)和D10 [9,10,11],豌豆中的RAMOSUS5 (RMS5)和RMS1 [8,12]和矮牵牛的顶端显性3 (DAD3)和DAD1的降低[13,14]。这些同源蛋白被发现参与分支控制,并且在相应的功能丧失突变体中报道了高度分支的表型[15,16]。此外,作为SL受体的α/β-折叠水解酶D14发生突变拟南芥而水稻则导致了茎分枝表型的增加[17,18,19]。SLs通过增加BRANCHED1(BRC1),它编码一种芽生长抑制因子[20.,21,22]。功能丧失突变BRC1影响芽的生长,导致芽分枝增加[20.,23]。同样,在杨树中,击倒BRC1受影响的射击结构[24]。
最近,研究人员提出用SLs来控制嫁接葡萄植株的接穗发育,以响应氮素有效性[j]。25]。此外,葡萄的过表达CCD7或CCD8基因拟南芥max3或max4突变体背景部分地恢复了它们的表型[25],暗示了…的潜在作用CCD7和CCD8在葡萄藤枝分枝。然而,到目前为止,在葡萄藤中还没有实验证据支持这两个基因在控制茎枝分枝中的作用。因此,这一作用仍有待在葡萄藤中证明。CRISPR/Cas9 (clustered regulatory interspaced short palindromic repeats/CRISPR-associated protein 9)系统是一种强大的靶向诱变工具,已成功应用于许多植物物种实现基因组编辑。该系统在葡萄品种的编辑中得到了有效的应用IdnDH(L-idonate脱氢酶),PDS(植物烯去饱和酶),和VvWRKY52基因(26,27,28]。这表明CRISPR/Cas9系统可以用于葡萄藤的精确基因组编辑。
在本研究中,我们使用CRISPR/Cas9技术编辑VvCCD7和VvCCD841B葡萄砧木基因。由于41B胚性细胞易于转化、选择和再生,因此选择这些细胞进行基因编辑实验。再生后,四个VvCCD8获得敲除系。的恢复ccd8与野生型植物相比,突变体表现出增加的枝条分枝。Sanger测序结果显示VvCCD8突变植物携带目标突变,在假定的非目标位点没有发生突变。总之,这些结果强调了葡萄基因组编辑的效率,并提供了证据VvCCD8对葡萄枝条分枝的控制起关键作用。
结果
靶标设计及CRISPR/Cas9载体构建
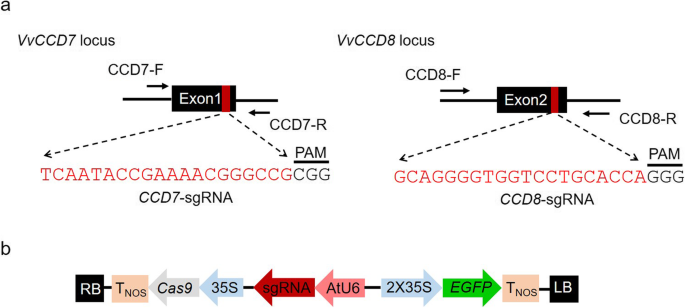
的VvCCD7(VIT_15s0021g02190)和VvCCD8(VIT_04s0008g03380)基因分别含有6和5个外显子。考虑到CRISPR/Cas9引起的靶向突变通常会导致帧移或终止密码子的产生[26,27],上游外显子将是基因编辑产生非功能性蛋白质的更好目标。的第一个外显子(Exon1)VvCCD7的第二个外显子(Exon2)VvCCD8分别作为CRISPR-Cas9基因编辑的靶点(图2)。1a).在sgRNA设计之前,对这两个基因的靶区进行了克隆和Sanger测序验证。结果表明VvCCD7和VvCCD8几乎与它们的引用序列相同(附加文件1:图S1)。用于靶向的sgrnaVvCCD7(CCD7-sgRNA)和VvCCD8(CCD8-sgRNA)进行相应的设计(图2)。1a).两个sgrna均由拟南芥U6启动子(AtU6),而表达化脓性链球菌Cas9由CaMV35S启动子(35S)控制。的EGFP(增强型绿色荧光蛋白)基因作为报告基因,快速选择高效转化的细胞(图2)。1b)。
的靶向诱变VvCCD7和VvCCD841B细胞中的基因
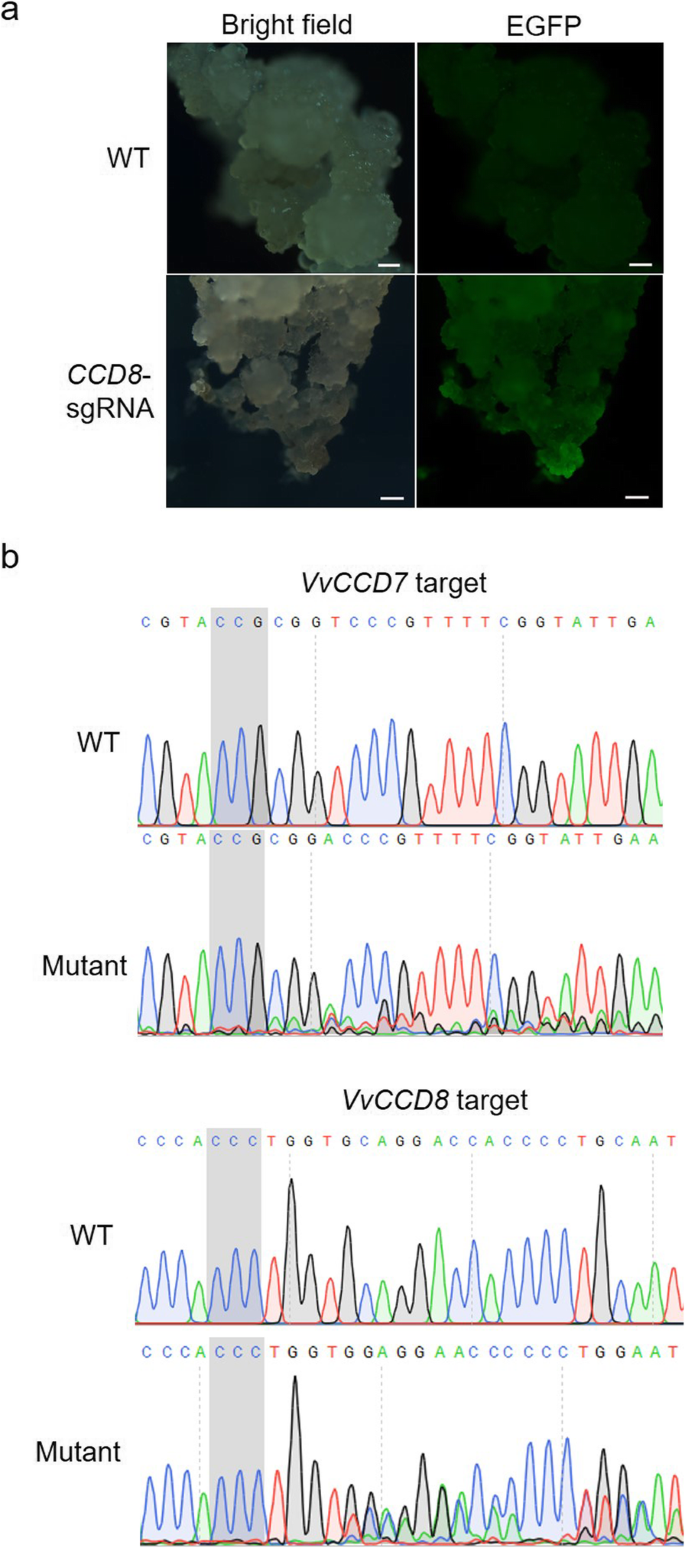
将构建的CRISPR/Cas9表达载体导入41B葡萄细胞农杆菌属介导的转换。通过EGFP荧光选择转化成功的细胞,而未转化的细胞则检测不到荧光信号(图2)。2a).对显示EGFP信号的41B细胞进行采样,并进行Sanger测序,以揭示靶位点是否存在突变。考虑到重叠峰的存在是靶向突变的典型指标,我们对测序色谱图进行了人工分析,以确定目标区域是否存在双示踪峰[29]。我们的测序结果(图2)2b)与野生型(WT)细胞色谱的单峰相比,阳性转化的41B细胞中存在重叠峰。这些结果清楚地表明存在靶向诱变VvCCD7和VvCCD8转化的41B细胞中的基因。
VvCCD8敲除系表现出增加的茎分枝表型
使用egfp荧光41B细胞进行植株再生。分别获得再生植株24株和73株CCD7-sgRNA和CCD8-sgRNA,分别为(图2)3.a).利用PCR筛选回收植株Cas9-specific引物(附加文件4:表1)。PCR结果显示CCD8-sgRNA再生植株6株含外源植株Cas9基因(图。3.B),表明转化率为8.2%(6/73)。相比之下,24个国家中没有一个CCD7-sgRNA选择的植株呈现外源Cas9基因(图。3.a)在6个选项中CCD8-sgRNA植物,4个(Plant #1, Plant #3, Plant #5和Plant #6)被鉴定为ccd8突变体(无花果。3.a)有趣的是,所有ccd8突变体的芽分枝增加,植株3号和6号有4个芽,植株1号有3个芽,植株5号有2个芽(图2)。3.c和d)。在这些突变植物中VvCCD8用Sanger测序法分析靶序列。对每个突变株进行了20个PCR扩增克隆测序。结果表明,1号和3号植株在靶位点包含两种类型的突变。第一个序列对应于一个核苷酸的插入,第二个序列对应于几个核苷酸的缺失(Plant #1为20 bp, Plant #3为11 bp)。3.e).这些结果表明这两个突变株可能是双等位的。根据测序结果,5号和6号植株只含有一种突变类型(图2)。3.e).植物6号突变体可能是纯合的,因为几乎所有测序的克隆(19/20)都含有相同的突变(1-bp插入)。相比之下,5号植物突变体可能是杂合子或嵌合的,因为在测序的克隆中发现了野生型和突变(1 bp缺失)序列(图2)。3.e)。这些不同的突变导致帧移变化,导致新的氨基酸序列突变(图2)。3.f)或终止密码子的产生(图2)。3.F)会导致翻译过早终止。
的识别VvCCD8敲除突变体。一个再生植物鉴定综述。b再生植株外源T-DNA插入物的PCR鉴定。该引物专为Cas9基因进行PCR鉴定。只有CCD8-sgRNA植物被鉴定为外源T-DNA插入。车道1-6代表不同的个体CCD8-sgRNA植物。质粒作为阳性对照(P),野生型基因组DNA作为阴性对照(N)。裁剪后的凝胶图像显示在这里,原始的,未裁剪的图像可以在附加文件中找到3.:图S3。c表型的VvCCD8敲除突变体。的嫩枝VvCCD8敲除突变体用黑色箭头表示。比例尺:0.5 cm。d四个分支的编号VvCCD8敲除突变体。e 4个靶点的测序结果VvCCD8敲除突变体。从每个突变株中扩增出基因片段,克隆到pLB载体上进行Sanger测序。对每个植株的20个克隆扩增子进行了分析。从突变体中鉴定出的突变序列如图所示。植物id显示在左边。右边显示了突变类型(红色)和相应的克隆数量(黑色)。这些不需要的序列从分析中被省略。f突变序列中氨基酸的突变见e。改变的氨基酸用红色表示,过早终止密码子用红色星号(*)表示。没有在图中显示的氨基酸(aa)的数目在括号中表示
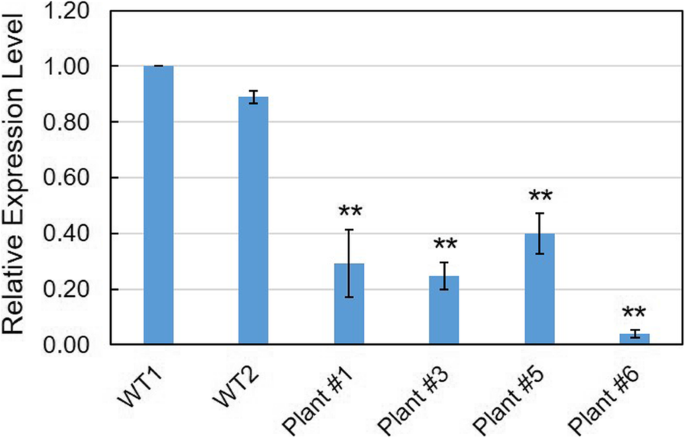
我们还研究了VvCCD8在这些突变植物中。结果表明VvCCD8与野生型植物相比,4个突变体的光合活性显著降低(图2)。4),提示在VvCCD8导致转录体衰减ccd8突变体。
未检测到脱靶效应ccd8突变体
为了确保在试验中观察到增强的芽分枝表型ccd8突变不是由于脱靶效应,我们调查了假定的基因组脱靶位点CCD81号和6号植物中的-sgRNA。根据序列的同源性预测推测的脱靶位点CCD8-sgRNA。在5个排名最高的潜在脱靶位点中,预计有2个位点定位于VIT_03s0091g00830和VIT_13s0019g01150序列的外显子(附加文件)5表2)。因此,选择这两个假定的脱靶位点进行进一步分析。利用特异引物从植株1号和植株6号中扩增出含有2个推测脱靶位点的DNA片段(附加文件)4:表1)。PCR产物克隆到pLB载体上,经Sanger测序验证。在潜在的脱靶位点未检测到突变(附加文件2:图S2),支持这一事实VvCCD8编辑在葡萄中是有效的,并且在葡萄中观察到分支表型的增加ccd8突变体是由于VvCCD8而且不会产生脱靶效应。
讨论
CRISPR/Cas9系统已经成为基因组编辑的强大工具,它在植物中产生突变体方面显示出巨大的潜力。在拟南芥,CRISPR/Cas9系统成功用于生产cbf突变体。这些突变体的特征揭示了CBF2在冷驯化依赖性冻结中发挥的重要作用[30.]。有趣的是,SBP-CNR和NAC-NOR转录因子被认为是番茄成熟的主要调控因子,其靶向诱变导致番茄延迟成熟或部分不成熟。这种表型与以前使用的原始番茄突变体惊人地不同[31],提示CRISPR/Cas9系统在基因功能研究中的巨大潜力。SLs被发现会阻碍芽的生长[5,6]、SL生物合成基因CCD7(MAX3),CCD8(MAX4)已被证明参与多种草本植物的分支控制,包括拟南芥、米饭及番茄[8,32,33,34]。在木本植物中,杨树MAX4(CCD8)敲低线显示出改变的分支模式[24]。在葡萄中,根据对葡萄分泌物的观察,有人认为SL可能参与了葡萄嫁接植株接穗结构的控制ccd-过表达转基因细胞可刺激种子萌发Phelipanche ramosa种子,和那葡萄的过度表达CCD7或CCD8相应的基因拟南芥突变体可以部分恢复突变表型[25]。然而,在葡萄藤中没有直接和明确的证据支持这一作用。
在本研究中,我们采用CRISPR/Cas9系统进行编辑VvCCD7和VvCCD8葡萄(41B砧木)基因。41B胚性细胞转化后,采用Sanger测序法检测目标突变。结果表明,设计的sgrna可以有效地指导这两个基因的靶向编辑(图2)。2b).通过再生获得整株植株,并通过PCR对转基因植株进行鉴定和筛选。只有6CCD8-sgRNA植物中含有外源的Cas9基因(图。3.b).本实验中41B细胞缺乏抗生素依赖性选择和再生率低可能是获得转基因植株率低的原因。在6株转基因植物中,4株被鉴定为ccd8突变体(无花果。3.a).正如所料,ccd8突变体表现出增加的枝分枝,这与之前的报道一致[13,15,16,24]。除5号植株外,所有突变体至少有3个芽,而WT植株一般只有1个芽(图2)。3.d).根据测序结果,5号植物可能是杂合的或嵌合的(图5)。3.e),表明葡萄植株的芽数与SLs浓度之间可能存在一定的关系。脱靶效应是应用CRISPR/Cas9技术时主要关注的问题。因此,我们研究了假定的基因组脱靶位点CCD8-sgRNA,未观察到脱靶突变(附加文件2:图S2)。这些结果排除了观察到的改变枝分枝的可能性ccd8突变是由脱靶突变引起的。
有趣的是,ccd8以41B砧木获得的突变体可用于嫁接试验,以进一步研究SLs在葡萄枝条分枝控制中的作用。最后,是否VvCCD7在茎枝分支中是否起同样的作用尚不清楚,尚待研究。要在这个方向上走得更远,就要尝试新的再生ccd7在未来可以实现突变植物。
结论
总的来说,我们的结果表明CRISPR/Cas9系统可以成功地用于敲除VvCCD7和VvCCD8葡萄的基因。此外,研究VvCCD8敲除葡萄植株揭示了该基因在控制葡萄茎分枝中的关键作用,从而为研究葡萄茎结构调控机制提供了第一个线索。
方法
sgRNA的设计与基因组编辑载体的构建
的目标区域VvCCD7和VvCCD8以引物CCD7-F/R和CCD8-F/R分别从41B胚性细胞中扩增出基因。扩增片段经Sanger测序验证。使用在线工具CRISPR-P v2.0将验证的序列作为sgRNA设计的输入[35]。同时对潜在的脱靶位点进行预测。然后通过同源重组(homologous recombination, HR)将设计的sgrna连接到pCACRISPR/Cas9载体上。PCR克隆、sgRNA设计和质粒构建如前所述[26]。将pCACRISPR/Cas9载体用Sma我和Xho我要移除成II(潮霉素磷酸转移酶II)基因,和EGFP从pCAMBIA2300-EGFP载体中扩增出的基因(NCBI加入号:NC_025025)通过HR插入线性化的pCACRISPR/Cas9载体中,使用ClonExpress II一步克隆试剂盒(Vazyme,中国)。实验中使用的引物见附加文件4表S1。
植物材料,转化和再生
葡萄胚性细胞来源于41B根(葡萄简历。夏色拉×葡萄? ?)由Dr. F. Lecourieux (EGFV, universit
将构造好的二值向量引入根癌土壤杆菌用冻融法转化菌株EHA105,用农共耕法[37]。共培养后,先用GM液体培养基洗涤2次,然后每隔一天在添加200 mg/L丁entin的GM培养基中传代1周。然后收集细胞,分成小组(~ 0.5 cm)2)进行EGFP检测。
为了诱导胚胎发生,将41B细胞转移到固体无激素再生培养基(不含NOA的GM培养基)上,在白色荧光灯下光周期16 h。在McCown木本植物培养基(Duchefa)中添加3%蔗糖、0.2 mg/L萘乙酸(NAA)、0.5 mg/L活性炭、7.5 g/L琼脂,长日(光照16 h /暗8 h)条件下再生植株。
基因组DNA的提取及外源T-DNA插入物的PCR鉴定
基因组DNA使用CTAB植物基因组DNA提取试剂盒(Aidlab,中国)根据制造商的说明制备。将分离的DNA作为PCR模板。PCR反应用Cas9-specific引物(附加文件4:表S1)使用Es Taq DNA聚合酶(CWBIO, China),按照制造商的方案。PCR产物经1%琼脂糖凝胶电泳检测,Sanger测序进一步证实。
桑格测序法
用CCD7-F/R和CCD8-F/R引物分别从41B细胞和再生植株中扩增出含有目标位点的DNA片段。从葡萄细胞中扩增的PCR产物被纯化并直接用于桑格测序分析(北京,青岛)。将41B植株扩增片段克隆到pLB-Simple载体(天根,中国)中,每个样本共测序20个克隆。
实时定量PCR测定
的表达谱VvCCD8采用实时荧光定量PCR技术(qRT-PCR)检测VvCCD8特定引物(附加文件4:表1)。葡萄肌动蛋白1(加入。以AY680701)为内控,采用2−ΔΔCT方法(38]。按照先前报道的方法进行qRT-PCR检测[26]。
非目标分析
进行脱靶分析VvCCD8迷人的线条。选择位于基因外显子的两个顶级假定脱靶位点进行脱靶分析。利用特异性引物扩增潜在的脱靶区(附加文件4(表S1),将这些片段克隆到pLB载体上,通过Sanger测序对至少6个克隆进行分析。
EGFP检测
使用Eclipse Ni-U荧光显微镜(Nikon, Japan)检测EGFP信号,激发波长为487 nm,发射波长为505 nm。以野生型细胞为阴性对照。
数据和材料的可用性
支持本文结论的数据集和本研究使用的材料可通过与通讯作者(zl249@ibcas.ac.cn)。
缩写
- CCD:
-
类胡萝卜素裂解双加氧酶
- CRISPR / Cas9:
-
簇状调控间隔短回文重复序列/ crispr相关蛋白
- EGFP:
-
增强型绿色荧光蛋白
- 通用汽车:
-
Glycerol-maltose介质
- hptII:
-
潮霉素磷酸转移酶
- 马克斯:
-
更多腋下分枝
- 乙酰天冬氨酸:
-
萘乙酸
- 诺亚:
-
萘甲氧基乙酸
- 存在:
-
实时定量PCR
- sgRNA:
-
单导RNA
- SLs:
-
Strigolactones
参考文献
- 1.
梁军,赵丽,查利斯R,雷泽欧。独角金内酯对菊花茎部分枝的调控作用。中国生物医学工程学报,2010;31(1):391 - 391。
- 2.
李建军,李建军。植物生长素和细胞分裂素在芽从优势释放中的作用。[J] .中国生物医学工程学报。1967;54(4):136 - 44。
- 3.
张建军,张建军,张建军,李建军,等。拟南芥生长发育过程中生长素对细胞分裂素合成的调控作用。科学通报,2004;31(1):1 - 4。
- 4.
muller D, Waldie T, Miyawaki K, To JPC, Melnyk CW, Kieber JJ, Kakimoto T, Leyser O.生长素介导的顶端优势需要细胞分裂素逃逸而不是释放。植物学报,2015;32(2):874 - 876。
- 5.
Gomez-Roldan V, Fermas S, Brewer PB, Puech-Pages V, Dun EA, pilot JP, Letisse F, Matusova R, Danoun S, Portais JC,等。独角麦内酯对芽分枝的抑制作用。大自然。2008;455:189 - 94。
- 6.
Umehara M, Hanada A, Yoshida S, Akiyama K, Arite T, Takeda-Kamiya N, Magome H, Kamiya Y, Shirasu K, Yoneyama K,等。新萜类植物激素对茎枝分枝的抑制作用。大自然。2008;455:195 - 200。
- 7.
杨建军,李建军,李建军,等。一种新的植物信号分子的合成所需的类胡萝卜素裂解双加氧酶。中国生物医学工程学报,2004;14(2):1232 - 8。
- 8.
Sorefan K, Booker J, Haurogne K, Goussot M, Bainbridge K, Foo E, Chatfield S, Ward S, Beveridge C, Rameau C,等。MAX4和RMS1是拟南芥和豌豆中调控茎枝分枝的同源双加氧酶样基因。生物医学进展,2003;17(1):69 - 74。
- 9.
石川文,前川文,田文杰,王志强,等。水稻分蘖矮化突变体对分蘖芽活性的抑制。植物生理学报。2005;46(1):79 - 86。
- 10.
Arite T, Iwata H, Ohshima K, Maekawa M, Nakajima M, Kojima M, Sakakibara H, Kyozuka J.侏儒f10和RMS1/MAX4/DAD1基因对水稻侧芽生长的影响。植物科学学报,2007;31(1):1 - 9。
- 11.
Alder A, Jamil M, Marzorati M, Bruno M, Vermathen M, Bigler P, Ghisla S, Bouwmeester H, Beyer P, Al-Babili S. β -胡萝卜素生成甾体内酯的途径。科学。2012;335:1348-51。
- 12.
Johnson X, Brcich T, Dun EA, Goussot M, Haurogne K, Beveridge CA, Rameau C. 2006。分支基因在物种间是保守的。控制豌豆新信号的基因受其他远距离信号的协同调节。植物生理学报。2006;42(2):1014 - 1026。
- 13.
斯诺登KC,西姆金AJ,杨森BJ,邓普顿KR,卢卡斯HM,西蒙斯JL, Karunairetnam S, Gleave AP,克拉克DG,克利HJ。1/矮牵牛(Petunia hybrida)类胡萝卜素切割(CAROTENOID CLEAVAGE DIOXYGENASE8)基因的顶端显性降低影响分枝的产生,并在叶片衰老、根生长和花发育中起作用。植物学报。2005;17:746-59。
- 14.
Drummond RSM, Martinez-Sanchez NM, Janssen BJ, Templeton KR, Simons JL, Quinn BD, Karunairetnam S, Snowden KC.矮牵牛杂种类胡萝卜素裂解DIOXYGENASE7参与矮牵牛负、正分支信号的产生。植物生理学报。2009;51(1):1867 - 1877。
- 15.
邓EA,弗格森BJ,贝弗里奇CA。顶端优势与茎枝分枝。意见分歧还是机制分歧?植物生理学报。2006;42(2):812 - 9。
- 16.
茎部分枝的控制:植物信息处理的一个例子。植物学报。2009;32:694-703。
- 17.
Arite T, Umehara M, Ishikawa S, Hanada A, Maekawa M, Yamaguchi S, Kyozuka J. d14,水稻独角戊内酯不敏感突变体分蘖生长加速。植物生理学报。2009;50:1416 - 1424。
- 18.
Hamiaux C, Drummond RSM, Janssen BJ, Ledger SE, Cooney JM, Newcomb RD, Snowden KC. DAD2是一种α / β水解酶,可能参与植物分枝激素独角麦内酯的感知。当代生物学杂志,2012;22:2032-6。
- 19.
Waters MT, Nelson DC, Scaffidi A, Flematti GR, Sun YK, Dixon KW, Smith SM。在拟南芥中,DWARF14蛋白家族的特化赋予了对卡瑞金斯和独角糖内酯的不同反应。发展。2012;139:1285 - 95。
- 20.
拟南芥中的BRANCHED1是腋芽中分支信号的整合者。植物学报。2007;19:458-72。
- 21.
李晓峰,李晓峰,李晓峰,李晓峰,李晓峰,李晓峰,李晓峰,李晓峰,李晓峰,李晓峰,李晓峰。豌豆TCP转录因子PsBRC1作用于独角酯内酯的下游,控制茎分枝。植物生理学报,2012;38(2):557 - 557。
- 22.
邓亚东,陈晓明,陈晓明,等。单穗草内酯和细胞分裂素对芽生长的拮抗作用。植物生理学报,2012;38(2):487 - 498。
- 23.
Finlayson SA。拟南芥TEOSINTE BRANCHED1- like 1调控腋芽的生长,与单子叶TEOSINTE BRANCHED1同源。植物生理学报,2007;48(1):667 - 667。
- 24.
Muhr M, Prufer N, Paulat M, Teichmann T.杨树独角麦内酯生物合成基因敲低对BRANCHED1表达和芽结构的影响。新植物学报,2016;22(2):613 - 26。
- 25.
Cochetel N, msamtsamier E, Merlin I, hsamin C, Pouvreau JB, coutos - thsametnot P, Hernould M, Vivin P, Cookson SJ, Ollat N,等。独角甾内酯在调节嫁接葡萄接穗生长和分枝对氮有效性的响应中的潜在贡献。[J] .中国生物医学工程学报,2018;39(4):591 - 591。
- 26.
任超,刘霞,张震,王勇,段伟,李松,梁震。CRISPR/ cas9介导的霞多丽高效靶向诱变(英文)葡萄l .)。科学通报,2016;6:32 - 289。
- 27.
Nakajima I, Ban Y, Azuma A, Onoue N, Moriguchi T, Yamamoto T, Toki S, Endo M. CRISPR/ cas9介导的葡萄靶向诱变。科学通报,2017;12:e0177966。
- 28.
王欣,杜敏,王东,刘健,李勇,李志,王勇,王旭。CRISPR/ cas9介导的葡萄第一代高效靶向诱变研究。植物学报,2018;16(6):844 - 855。
- 29.
马旭,陈磊,祖强,陈勇,刘永刚。通过PCR产物的直接测序快速解码序列特异性核酸酶诱导的杂合和双等位基因突变。植物学报。2015;8:1285 - 1287。
- 30.
赵超,张震,谢松,司涛,李勇,朱建军。CBF转录因子在拟南芥低温驯化中的作用[J]。植物生理学报,2016;17(1):544 - 559。
- 31.
高燕,朱宁,朱旭,吴明,姜朝忠,Grierson D,罗勇,沈伟,钟生,傅德清,等。果实编码和新的CRISPR/Cas9 CNR和NOR突变体揭示的成熟调控网络的多样性和冗余性园艺学报,2019;6:39。
- 32.
梅原美,韩田,韩美梅,杨春梅,杨春梅,等。(2010)磷缺乏对水稻分蘖芽生长的抑制作用。植物生理学报,2010;51(1):518 - 526。
- 33.
杨欣,陈丽,何军,于伟。敲除水稻类胡萝卜素分解代谢基因不能促进类胡萝卜素积累,但揭示了独角麦内酯生物合成的突变。植物学报,2017;36:1533-45。
- 34.
Vogel JT, Walter MH, Giavalisco P, Lytovchenko A, Kohlen W, Charnikhova T, Simkin AJ, Goulet C, Strack D, Bouwmeester HJ,等。SlCCD7调控番茄独角麦内酯合成、茎枝分枝和菌根诱导的类伪胡萝卜素形成。植物科学学报,2010;31(1):391 - 391。
- 35.
雷燕,卢丽,刘海燕,李生,邢芳,陈丽丽。CRISPR-P:一个用于合成单导RNA的植物crispr系统设计的网络工具。植物学报,2014;7:1494 - 1496。
- 36.
李建军,李建军,李建军,等。糖诱导蛋白激酶(vsk1)对葡萄细胞内己糖转运和糖积累的影响。植物生理学报。2010;25(5):1096 - 1096。
- 37.
毛罗,李建军,李建军,李建军,李建军,李建军,李建军,李建军。葡萄GFLV外壳蛋白基因的高效再生研究。植物科学。1995;112:97-106。
- 38.
Livak KJ, Schmittgen TD。利用实时定量PCR和2−ΔΔCT方法。方法。2001;25:402-8。
致谢
不适用。
资金
宁夏回族自治区重大科技计划项目(批准号:2016BZ06)、国家自然科学基金(批准号:31772266)、中国科学院STS项目(批准号:2016BZ06)资助。KFJ-STS-ZDTP-025)和宁夏回族自治区农业育种项目(批准号:NXNYYZ20150203)。资助者在研究的设计、数据的收集、分析和解释以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
CR和ZL构思和设计了实验。CR, YG, JK进行实验。CR, FL和ZD撰写了手稿。FL, SL和ZL批判性地阅读和修改手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:图S1。
测序结果VvCCD7和VvCCD8从41B细胞中扩增的片段。一个的目标序列VvCCD7基因在41B。b的目标序列VvCCD8基因在41B。靶点在VvCCD7和VvCCD8基因用深蓝色突出显示。
附加文件2:图S2。
两个推测脱靶位点的测序结果VvCCD8迷人的线条。选择其他基因外显子内预测的两个脱靶位点进行脱靶分析。两个VvCCD8基因敲除系为植株1号和植株6号。将含有脱靶位点的扩增片段扩增并克隆到pLB-Simple载体中。每个位点至少使用6个克隆进行Sanger测序。
附加文件3:图S3。
PCR鉴定T-DNA插入的原始凝胶图像CCD8-sgRNA植物。以载体质粒(P1)和转基因细胞(P2)为阳性对照,野生型植物为阴性对照(N)。车道1-6为个体CCD8-sgRNA植物。
附加文件4:表S1。
本研究使用的引物列表。
附加文件5:表S2。
假定脱靶点预测CCD8-sgRNA。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
任超,郭勇,孔杰。et al。基因敲除的VvCCD8葡萄藤上的基因影响着枝条的分枝。BMC Plant Biol20.47(2020)。https://doi.org/10.1186/s12870-020-2263-3
收到了:
接受:
发表:
关键字
- CRISPR / Cas9
- CCD8
- 突变体
- 拍摄分支
- Strigolactone