摘要
背景
铅(Pb)污染是一个普遍存在的环境问题,对生物有害。苦荞(Fagopyrum tataricum)是蓼科植物,生长周期短,生物量丰富,耐铅能力强,是植物修复的理想植物。本研究旨在探讨这种植物对铅胁迫响应的分子基础。
结果
在我们的研究中,超微结构定位分析表明Pb离子主要积聚在叶液泡中。以Pb1 (2000 mg/kg Pb (NO))为样品,对苦荞麦叶片进行RNA深度测序(RNA- seq)3.)2)和Pb2 (10,000 mg/kg Pb (NO3.)2)和对照(CK)。共得到88,977个组合体,125,203,555个碱基。CK与Pb1之间共鉴定出2400个上调和3413个下调差异表达基因,CK与Pb2之间分别鉴定出2948个上调和3834个下调差异表达基因。基因本体论(GO)和途径富集分析表明,这些DEGs主要与“细胞壁”、“结合”、“转运”以及“脂质和能量”代谢有关。随机选取15个候选基因和6个调控基因进行实时荧光定量PCR (qRT-PCR)分析,结果与转录组分析结果一致。在酵母菌株中的异源表达分析Δycf1表明过表达ccch型锌指蛋白14 (ZFP14)增强了对Pb的敏感性2 +金属转运蛋白C2 (MTPC2)、植物螯合素合成酶类家族蛋白(PCSL)、液泡阳离子/质子交换器1a (VCE1a)、天然抗性相关巨噬细胞蛋白3 (Nramp3)和植物螯合素合成酶(PCS) 5个基因增强了突变株对铅的耐受性。
结论
结合我们的发现和之前的研究,我们建立了一个示意图模型,显示了苦荞麦在铅胁迫下的代谢过程。本研究为苦荞耐铅和铅积累的生物学和分子机制的进一步基因组分析提供了重要数据。
背景
铅(Pb)是世界上毒性最大的无机金属污染物之一,是一种持久性环境污染物。铅由许多工业过程产生,随后排放到土壤、水和大气中,可能对生物产生广泛的毒性作用[1,2,3.,4].Pb作为一种非必需离子,对植物的毒害会导致种子萌发抑制、幼苗生长受限、枯萎、作物减产[5].它通过根部渗入植物,并被运送到芽组织[6,7],会对植物形态造成许多毒性影响,包括酶促反应、叶绿素生物合成、膜透性和其他一些代谢过程[5,8,9].因此,植物可作为有效的生物监测器和环境质量评估指标[10,11].同时,植物修复被认为是一种廉价的去除污染土壤中重金属的修复技术[12].
目前,为了了解植物对铅的耐受性和修复机制,研究了许多植物物种,但不同物种对铅的吸收、运输、积累和耐受性不同[13].在这方面,Ferreyroa等人[14使有特点芸苔属植物显著结果表明,低铅浓度下,植物叶绿素含量降低,高铅浓度下,植物细胞受到损伤。此外,Acalypha籼经观察,植物在铅(100-500 mg L)胁迫下会发生生理生化变化−1) [15],但只生长在热带地区,适应范围较窄。在一个研究中,梧桐树在12 g L−1Pb(不3.)2,被认为能很好地适应铅污染[16].然而,它是一种多年生木本植物,需要多年的时间来净化土壤。因此,植物修复受到缺乏Pb超蓄能剂、生物量相对较低、适应能力较差的限制。
苦荞(Fagopyrum tataricum)属蓼科蓼科[17]在一些东亚国家已被广泛种植作为食物和观赏作物[18,19].荞麦广泛适用于低肥力土壤,表现出高生物量积累和短生长周期[20.];此外,荞麦在其茎叶中积累较多的铅。此外,荞麦积累铅不会表现出生长抑制症状[21].以西樵1号、金樵1号和九江3个不同品种荞麦为试验材料,比较了铅对其的影响2 +与其他品种相比,九江的相对细胞质膜通透性和叶绿素含量变化较小[22].据报道苦荞富含类黄酮和酚类物质[23],这些分子可以保护植物免受铅诱导的氧化应激引起的活性自由基的不利影响[24].因此,苦荞可作为铅污染环境修复的潜在蓄能剂。然而,目前还没有发现调节苦荞麦铅胁迫响应的基因和代谢途径,这干扰了我们对苦荞麦铅耐受性机制的理解。
下一代测序(NGS)技术已成为生命科学研究的有力工具,并促进了以前未知基因的快速发现。例如,RNA深度测序(RNA- seq)已用于许多植物环境胁迫响应的分子研究。吴等。[25盐反应转录组Fagopyrum tataricum并鉴定出455个参与盐胁迫反应的deg。这是一种对缺乏基因组数据库的物种数据挖掘的有效方法。关于铅的毒性,Tian等[26的转录组分析路易斯安那州的虹膜并鉴定了许多重要的候选基因和通路,以期发现与铅耐受性和积累相关的机制。在玉米中,Pb胁迫下根系中多个对Pb胁迫有反应的转录因子(TF)家族,包括bZIP、ERF和GARP均上调[27].此外,本研究还发现ABA生物合成途径中的几个基因在根和芽中表达上调Hirschfeldia incana这表明aba介导的信号通路可能参与了该植物对铅的反应[28].此外,RNA-Seq分析梧桐树已鉴定出16,246种与铅接触相关的DEGs,包括抗氧化酶、金属转运蛋白和螯合蛋白[16].这些结果表明,在Pb胁迫下,不同植物的调控网络和防御系统具有复杂而独特的特异性。
虽然苦荞麦在铅耐受性和铅积累方面已有研究[22],如上文所述,其相应的分子机制尚未被破译。例如,负责铅诱导保护的调控基因还没有被确定。铅从土壤向叶片液泡的转运过程涉及多条代谢途径;然而,到目前为止,这些途径在荞麦中都没有被阐明。在本研究中,我们通过比较Pb在不同组织中的超微结构定位,确定了叶片是铅的主要储存组织。然后,我们利用Illumina测序技术获得了铅暴露下苦荞麦叶片的高质量全基因组转录本,并确定了与铅耐受机制有关的关键基因和途径,目的是将这些信息应用于植物修复。
结果
苦荞不同组织中铅的浓度及亚细胞分布
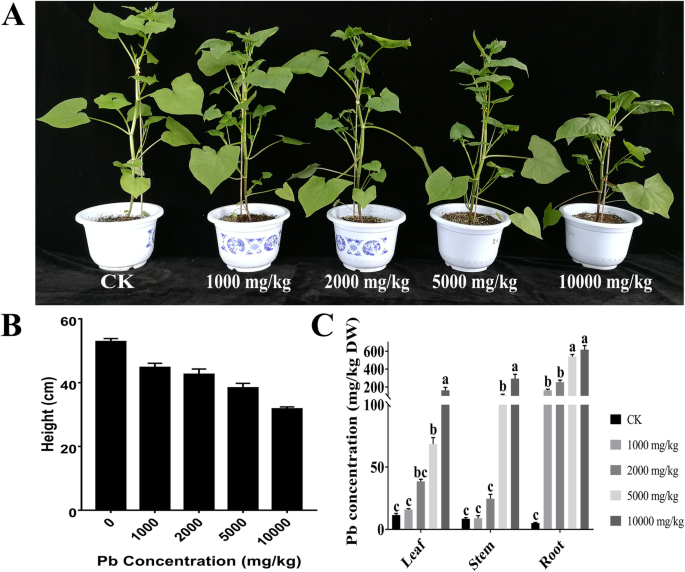
铅暴露达到10,000 mg/kg会降低荞麦植株的高度,但对其没有其他影响(图2)。1a、b);这是在随后的实验中测定的最高浓度。此外,铅暴露未引起MDA含量、GSH含量、可溶性蛋白和SOD活性的变化,表明处理未对叶片生理造成损害(附加文件)1:图S1)。随后分析不同组织中Pb含量(图;1c),当Pb浓度超过5000 mg/kg时,根系中Pb含量逐渐增加。土壤Pb浓度在1000 ~ 10,000 mg/kg范围内,叶片中Pb含量呈递增趋势。
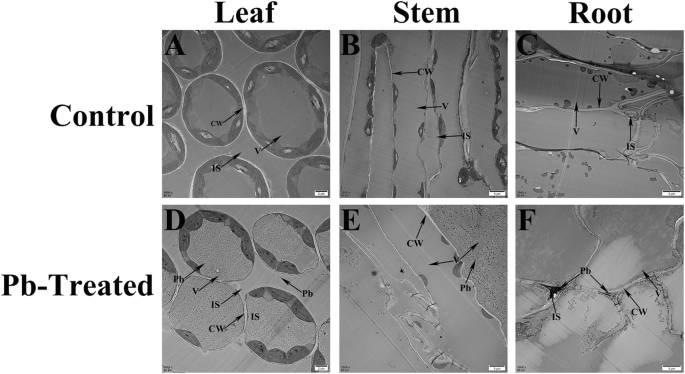
透射电镜(TEM)分析结果显示,Pb离子主要分布在叶细胞的液泡和细胞壁内,细胞间隙的铅离子较少(图2)。2d).在部分干细胞的空泡中观察到一些铅离子(图;2e),而在根中,Pb离子主要沉积在细胞壁和细胞间隙(图。2f).基于这些结果,我们在后续的实验中选择使用树叶。
从头组装和注释
为了鉴定苦荞叶片中铅耐性和铅积累的相关基因,在未处理的2000 mg/kg铅(NO3.)2-处理和10,000 mg/kg Pb (NO3.)2使用Illumina HiSeq 4000仪器进行cDNA文库构建和转录组测序。
从测序结果中获得的RNA-Seq读数概述见表1.对于三组样本,这些clean reads的Q20和GC含量的平均值分别大于96和47%。利用unigene数据库共收集到88,977个unigene, 125,203,555个unigene碱基,长度范围为201-19,818 bp,平均长度为982.34 bp1;额外的文件2:图S2)。39321个unigenes(44.18%)在上述数据库中至少有一个数据库中获得了显著匹配2).在这些unigenes中,27071个(69%)unigenes被功能标注。在比对分布上,18434个unigenes(48.38%)与14个物种相匹配,33080个unigenes(84.14%)与数据库序列的相似性为60 ~ 100%(附加文件)3.:表S1)。
铅胁迫下的DEGs
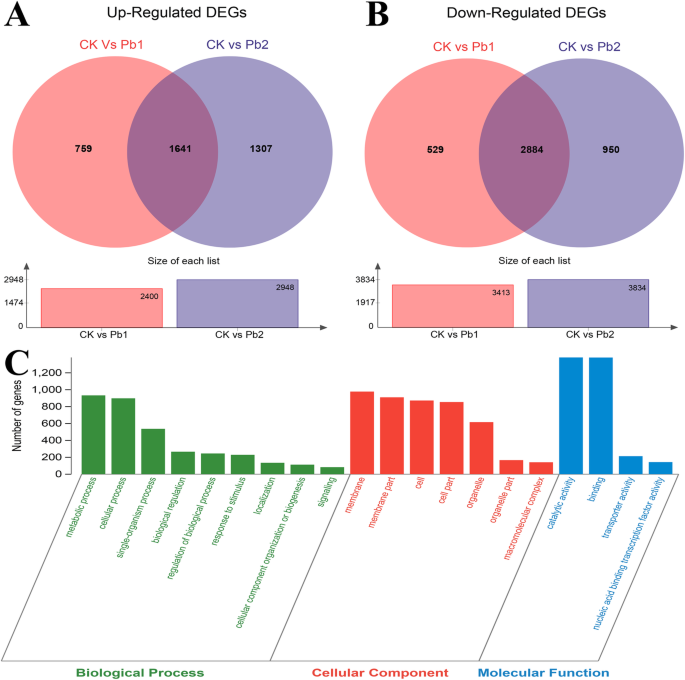
为了鉴定Pb胁迫诱导的unigenes,将三个文库分为两组(CK vs Pb1和CK vs Pb2)和4525个常见的DEGs(附加文件)4:图S3)在这些比较中被识别。我们总共鉴定出1641个上调基因(图;3.a)和2884下调(图;3.b) Pb胁迫下的unigenes。在4525个标记中,有3975个(87.84%)被NR数据库标注。
使用超几何分布将deg分为20个二级GO术语(图2)。3.c).详细地,GO富集分析识别了145个分子功能(MF)术语,244个生物过程(BP)术语和64个细胞成分(CC)术语(附加文件)5:表S2)。对于这些GO术语,显著地超额代表(P< 0.05)的MF类术语包括催化“活性”(GO:0003824)、“结合”(GO:0005488)、“转运体活性”(GO:0005215)、“核酸结合转录因子活性”(GO:0001071)。对于BP术语,代表最多的术语是“代谢过程”(GO:0008152)、“细胞过程”(GO:0009987)、“单生物过程”(GO:0044699)和“生物调节”(GO:0065007)。“膜”(GO:0016020)、“膜部分”(GO:0044425)、“细胞”(GO:0005623)、“细胞部分”(GO:0044464)和“细胞器”(GO:0043226)在CC类别中显著过量。综上所述,铅胁迫下苦荞中鉴定的unigenes主要与催化活性、结合、代谢过程和膜成分有关。
CK vs Pb1和CK vs Pb2的KEGG途径富集分析确定了106个富集途径(附加文件6:表S3),其中17个在PPb胁迫下< 0.053.).响应Pb胁迫的四种最常见途径是“植物激素信号转导”(ko04075, 82)、“植物-病原体相互作用”(ko04626, 56)、“MAPK信号通路-植物”(ko04016, 65)和“苯丙烷生物合成”(ko00940,45)。这些结果表明,铅胁迫于f . tataricum主要影响与能量代谢、脂质代谢、次生代谢产物、非酶抗氧化剂和氧化磷酸化相关的途径。
DEGs的验证和异源表达
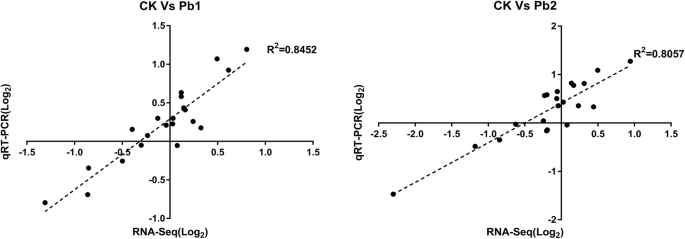
为了证实RNA-Seq数据的准确性,我们选择了21个unigenes,通过qRT-PCR研究它们在叶片中的转录表达。结果表明,RNA-Seq数据与qRT-PCR结果具有良好的相关性(图2)。4),表明RNA-seq数据的可靠性。
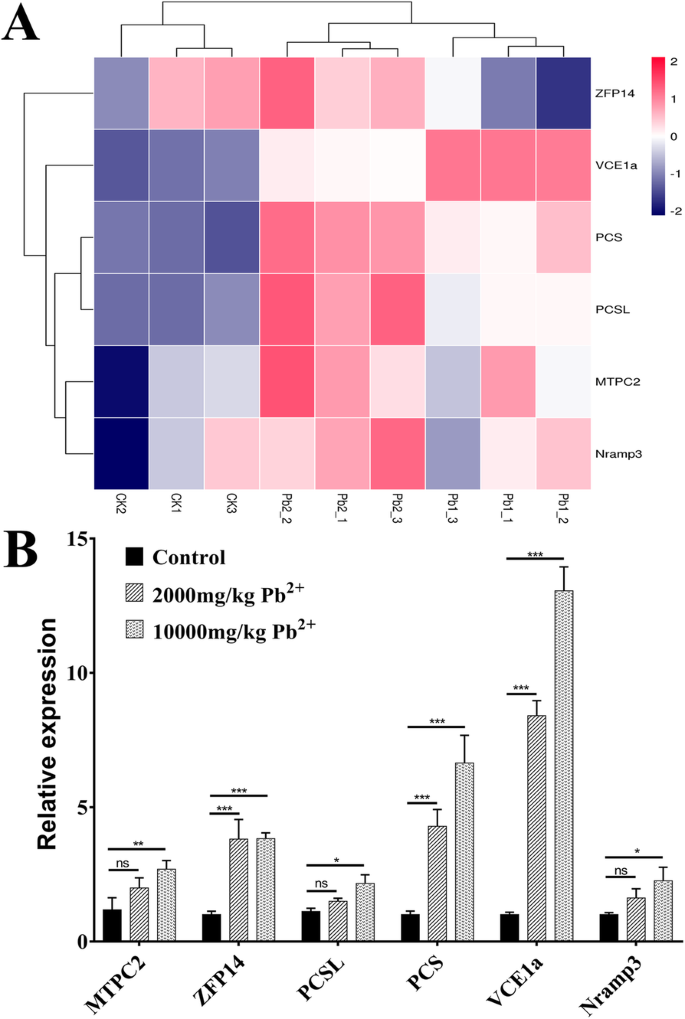
此外,我们还特别分析了6个unigenes (MTPC2,ZFP14,PCSL,VCE1a,Nramp3,个人电脑)在Pb胁迫下受到调控(图;5a).结果,3个上调基因(ZFP14,个人电脑,VCE1a)在两种Pb浓度下均有显著差异表达2 +.的增加ZFP14在两个Pb胁迫样品中表达相同,而在个人电脑而且VCE1a随着Pb的增加,表达量急剧增加2 +浓度。相比之下,MTPC2,PCSL而且Nramp3在2000 mg/kg Pb2 +组与对照组相比,但是P在1万mg/kg Pb中,这些基因的-值均小于0.052 +集团(无花果。5b)。
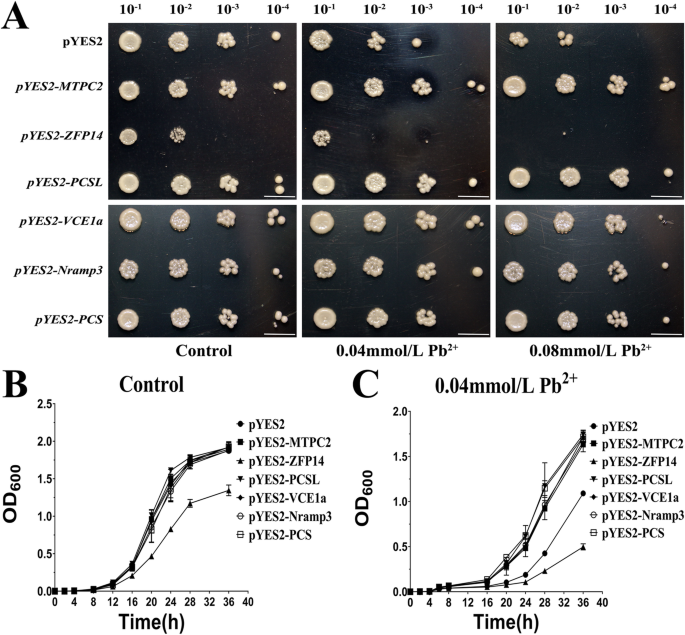
为了确定这6个苦荞基因是否因铅耐受而上调,这些基因在铅敏感酵母菌株中进行了异源表达Δycf1.结果表明FtMTPC2,FtPCSL,FtVCE1a,FtNramp3而且FtPCS显著提高了该菌株对铅的耐受性(图;6).然而,与含有空矢量(pYES2)的应变相比,Δycf1细胞表达FtZFP14对添加0.04和0.08 mmol/L Pb2 +(无花果。6A),后者几乎没有生长。与在琼脂固化培养基上生长的细胞相比,FtZFP14 -在添加0.04 mmol/L Pb的液体培养基中培养2 +48 h后,细胞几乎没有生长(图;6b, c)。
讨论
苦荞与普通荞麦相似,在污染土壤中具有较高的铅积累能力[21,22].通过与前人研究的比较,我们首次证实苦荞可以在高浓度Pb (10,000 mg/kg)的土壤中生长。随后,我们用透射电镜研究了苦荞麦主要在叶片液泡中积累铅。虽然观察到许多铅离子通过根被吸收,并存在于细胞壁和细胞间隙中,但这些离子并没有储存在根细胞中,最终运输到叶液泡中。此外,为了明确苦荞叶片在Pb胁迫下的耐受和积累机制,我们在不同浓度的Pb离子下进行了转录组分析。本研究共生成88,977个unigenes,长度125,203,555 bp,平均长度982.34 bp,平均N50为1730 bp。与之前的苦荞研究相比,我们的研究产生了更长的序列和更深的覆盖范围[29,30.)(表4).综上所述,我们的研究结果不仅对铅毒性有了清晰的生理认识,而且为铅胁迫研究提供了一个有价值的数据库平台。
细胞壁作为细胞的第一道屏障,防止铅进入细胞质[31].细胞壁含有多糖和蛋白质,可作为Pb离子的结合位点[32].当金属离子沉积在细胞壁上时,它们穿过细胞膜进入原生质体的能力受到很大限制,从而使植物细胞的正常代谢得以维持[33].其中,Pb暴露特别富集的细胞组分组含有编码细胞壁(GO: 0005618)和膜部分(GO: 0044425)的基因。此外,与多糖合成相关的基因(GO: 0005976, GO: 0044264, GO: 0033692和GO:0010383)对铅胁迫的响应增加,导致细胞壁大幅增厚。类似的观察结果也报道了铅的毒性洋葱[34].我们还发现许多与细胞器膜和细胞大分子代谢变化相关的基因受到铅暴露的影响(附加文件)6:表S3)。郑等。[35]观察到Pb通过异体和共体途径运输,并通过细胞壁隔离、自噬和液泡区室化作为Pb-磷酸盐进行排毒。此外,当细胞壁上的这些结合位点饱和时,多余的铅离子被转移到细胞质和细胞器中,即液泡和高尔基体[36,37].这些细胞器显示铅离子与酶的直接接触减少,从而防止酶失活并阻止生化反应[38].因此,在Pb胁迫下,细胞壁、细胞膜和细胞器共同发挥保护细胞的作用。
作为对铅暴露的反应,植物通过激活不同的抗氧化酶来增加ROS的产生。由许多环境压力(干旱、盐度、温度、洪水和重金属)引起的活性氧(ROS)过量产生,扰乱了膜蛋白的结构和功能稳定性,并破坏了细胞内稳态[39,40,41].抗氧化系统是保护细胞膜免受铅胁迫下高浓度过氧化氢、超氧阴离子和单线态氧损伤的重要途径[42,43].在这项研究中,我们在苦荞叶中鉴定了19个参与过氧化物酶体(ko04146)的DEGs(附加文件)6:表S3),这与以往研究报道的抗氧化活性增加相一致[44,45].Venkatachalam等人[15研究发现,植物组织中Pb的积累会导致过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)活性的增加。王等。[46]结果表明,Pb可引起氧化损伤,增加超氧化物歧化酶(SOD)、CAT、POD、谷胱甘肽还原酶(GR)和APX活性,增加单脱氢抗坏血酸还原酶(MDA)和非蛋白硫醇水平。
光合作用是一个高度整合和调控的过程,光合作用对环境变化的响应受到Pb [47,48].陈等人。[49]报告说,在水稻中,铅中毒最基本和最明显的症状包括叶片褪绿;发育不良;净光合作用、气孔导度和叶片蒸腾减少;叶绿素(Chl) a、Chl b和类胡萝卜素等光合色素的积累较少。此外,通过维持光合能量的平衡,增加叶绿素含量和叶绿体数量可增强植物对Pb的耐受性[16,26].在我们的研究中,‘光合作用’(ko00195) KEGG途径得到了丰富(附加文件)6:表S3),许多CK vs Pb1和CK vs Pb2比较中常见的deg参与光系统(PS) II、PS I和f型atp酶通路。铅胁迫对植物的主要影响包括对氧进化复合体(OEC)的潜在损伤和PS I和II活性的抑制[50].根据这一观点,根据我们的转录组结果,参与PS I和PS II通路的5个基因被下调,并发生了不同的折叠变化。同样,几乎所有这些DEGs,包括被认为与产氧关系最密切的PSII核心蛋白D1、D2、CP43和CP47,都被下调[51].因此,光合作用受损是通过减少叶绿体中的相关基因来减少氧气产量和防止氧化损伤的一种方式。综上所述,这些结果表明光合作用途径的调节可能是不同植物物种对铅胁迫的共同反应。
加上铅胁迫诱导的多种适应策略,植物能够通过基因调控获得其他解毒和防御机制。一方面,植物对铅暴露具有非酶抗氧化防御机制[52].结果表明,Pb胁迫下苦荞麦叶片中苯丙类生物合成(ko00940)是DEGs富集最显著的产物之一3.和S4)。在这一途径中,苯丙氨酸解铵酶(PAL)是改变类黄酮和木质素生物合成和积累的关键调节酶[53].此外,苯丙类生物合成的分支生化反应,包括类黄酮生物合成(ko00941)和类胡萝卜素生物合成(ko00906),提供了许多重要的酚类化合物(花青素、类胡萝卜素和类黄酮)[54].这些代谢物通过清除H来保护植物免受pb诱导的氧化应激2O2活性自由基[55].另一方面,植物对重金属的初始感知可以触发信号转导,并启动基因表达和适应胁迫的细胞过程。环境压力源通过激素信号和MAP激酶(MAPK)途径传递到靶转录因子(TFs) [56].植物激素是植物在各种耐受性下的信号分子,包括铅胁迫。与重金属有关的激素包括脱落酸(ABA)、生长素、茉莉酸(JA)和水杨酸(SA) [57].在HMs胁迫下,植物激素浓度升高,从而上调MAPKs和GSH代谢基因的表达,刺激GSH的生物合成,GSH参与信号通路和胁迫反应[58].在我们的研究中,大多数DEGs富集在植物激素信号转导、MAPK信号转导和谷胱甘肽代谢的通路中(表S4)。因此,信号从上游的第二信使和激素转导到下游的受体(MAPKs)。MAPK信号通路在这一过程中起着关键作用,并与其他信号分子相互作用,介导植物信号系统之间的串扰,以促进适应和协调植物对各种应激源的反应[59].
此外,根据GO或KEGG分析,一些未显著富集的DEGs可能参与调节铅耐受和铅胁迫下的超积累。Phytochelatins (PCs),由谷胱甘肽(GSH)经phytochelatin synthetase (PCs)合成[60],与各种金属形成巯基键,最终输送到液泡空间[61,62].根据先前的研究结果,天然耐药相关巨噬细胞蛋白(Nramps) [63,64],金属耐受蛋白[65,66]和液泡转运蛋白[67]都是膜转运蛋白,已被证明可以增强植物的耐受性或超积累。为了验证这些基因在苦荞中是否参与了相同的过程,这些基因在酵母中进行了异源表达,结果与上述机制一致(图2)。6).
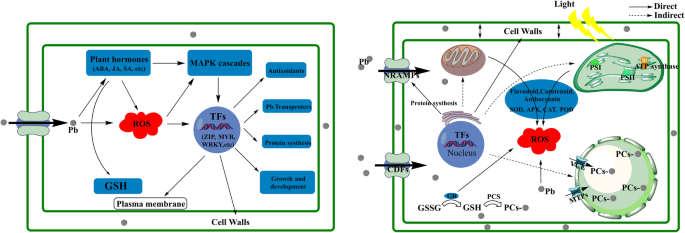
基于目前的研究结果,我们推测在铅胁迫下苦荞麦叶片的多种代谢过程受到影响。如图所示。7时,铅离子从根运输到叶片后,一部分铅离子与细胞壁结合。此外,这些离子绝大多数通过阳离子扩散促进剂(CDFs)、Nramps和其他离子转运体通过铁或水通道运输到细胞质基质[68].一旦铅离子进入植物细胞,植物激素的浓度就会发生变化,从而导致GSH的积累。ROS与植物激素相互作用并参与MAPK级联以激活tf。结果表明,受Pb胁迫影响的基因受到tf的调控,以抵御和减轻Pb暴露。随后,细胞通过各种细胞器中的抗氧化酶(包括APX、CAT、SOD、POD和GR)维持细胞内稳态。然后,Pb离子被GSH、PCs等化合物螯合,通过VCE (YCF的同源物)、MTPs和相关转运体运输到液泡中。这些结果提示苦荞叶片对铅的响应与铅离子的转运和积累有关的代谢过程。
结论
综上所述,我们的研究结果表明,苦荞麦叶片是铅的主要存储组织,并为苦荞麦叶片应对铅胁迫提供了转录组数据。此外,我们还鉴定出374个与苦荞麦叶片早期Pb暴露和Pb处理反应显著相关的deg。根据GO和KEGG通路富集分析,这些DEGs主要与细胞壁、植物激素信号转导、抗氧化系统和光合作用等主要防御机制有关。此外,这些DEGs参与了超积累机制,如tf、金属铁结合蛋白和膜转运蛋白,这在酵母中的异源表达中得到证实。本研究专门探讨了苦荞麦叶片对铅的基本耐受和超积累机制,为进一步研究苦荞麦叶片对铅胁迫响应的分子机制提供了新的信息。
方法
植物材料和生长条件
的Fagopyrum tataricum本研究所用的“九江”品种系来自西北农林科技大学仁济实验室。种子生长条件与Tamura所描述的相似[21],有一些改动。种子在4℃预春季化1周,在45℃去离子水中浸泡2小时,然后播种到40 g PEAT基质中(PINDSTRUP,拉脱维亚;https://www.pindstrup.com/),无重金属污染,每盆4粒(直径30厘米)。这些植物生长在相对湿度为60%、光照12小时、人工昼夜气温为25/15°C的温室中。培养15 d后,荞麦子叶完全展开,分别用0、1000、2000、5000、10000 mg/kg Pb (NO3.)2取决于基质土壤的干重。每组重复10次。根据先前的研究[21],分别在0、2000、10,000 mg/kg Pb (NO3.)2Illumina深度测序(3个生物重复)和qRT-PCR验证(3个生物重复)。我们定义0 mg/kg Pb (NO3.)2处理为对照‘CK’,2000 mg/kg Pb (NO3.)21万mg/kg Pb (NO3.)2Pb2处理。样品立即在液氮中冷冻,并在−80°C保存,直到使用。其余植株在开花前连续栽培和收获,以评估植物材料中Pb的积累。植物材料用去离子水洗涤,在80°C下干燥48 h,称量后磨碎,用浓缩HNO消化3.: HClO4(4:1)放在微波炉里。消化后,用1% HNO稀释至25 mL3.和过滤。随后,使用日立Z-2000原子吸收光谱仪(日立,日本)对样品进行分析。
Pb的透射电镜超微结构定位
这部分引用了maigorzata的方法[69有一些变化。一至两毫米的切片对照和10,000 mg/kg Pb (NO3.)2-处理过的叶、茎和根固定在4%戊二醛(v/v)的0.2 mol/L磷酸钠缓冲液(49 mL 0.2 mol/L Na2HPO4•12 h2O与51 mL NaH2阿宝4•2 h2O共100毫升),pH 6.8, 4°C, 12小时。用0.1 mol/L磷酸盐缓冲液(pH 6.8)在室温下冲洗组织6次(每次10分钟),并在1% (v/w) OsO中固定44℃浸泡2 h,然后在0.1 mol/L磷酸盐缓冲溶液(pH 6.8)中漂洗6次(每次10 min)。样品在室温下使用分级丙酮和乙醇系列(30,50,70,80和90%)脱水,渗透,嵌入LR白色树脂,并使用Leica EM UC7切片机(Leica, Nussloch, Germany)切成超薄切片(~ 90nm)。在铜网格上收集切片,撒上煤粉,最后使用JEOL JEM-1230透射电子显微镜(JEOL, Tokyo, Japan)在80 keV加速电压下观察。
RNA提取,cDNA文库制备及测序
使用Quick RNA分离试剂盒(Huayueyang, Beijing, China)从冷冻叶片组织中提取总RNA,该试剂盒使用无rnase - DNase I去除残留的基因组DNA。RNA数量和质量使用Agilent生物分析仪2100 (Agilent Technologies, Santa Clara, CA, USA)进行评估,RIN值大于7。RNA完整性通过琼脂糖凝胶电泳(1%凝胶加SYBR Green染料)进行评估。为了获得苦荞麦转录组的整体和高质量的概述,我们使用了暴露于三种Pb浓度的生物复制植物叶片组织中的单个rna进行文库构建。
cDNA文库使用TruSeq™RNA样品准备试剂盒(Illumina, USA)按照制造商的说明构建。简单地说,使用Dynabeads oligo (dT)25从总RNA中纯化mRNA (Life Technologies, USA)。随后,用低聚(dT)磁珠从25 μg汇总的总RNA中纯化poly(A) mRNA,并在碎片缓冲液中切割成约300 bp的短片段。用随机六聚体引物将得到的mRNA片段反转录成第一链cDNA,然后合成第二链cDNA。将双链cDNA纯化后连接到Illumina配对端测序适配器上。琼脂糖凝胶电泳后,选择合适的片段(> 200 bp)进行PCR扩增,形成最终的cDNA文库。所得到的cDNA文库在上海马约生物生物危害技术有限公司(中国上海)使用Illumina HiSeq™4000测序系统进行测序。
数据过滤,从头组装和注释
Illumina测序的原始图像数据通过碱基调用转换为原始读取。对原始读取进行过滤,以获得高质量的干净数据,并使用Trinity程序(版本:V2.5.0)进行组装[70]来生成contigs。去除冗余序列,将得到的contigs连接到支架上,得到unigenes。原始数据存入美国国家生物技术信息中心(NCBI)序列读取档案(SRA)(登录号:PRJNA515389)。在功能注释之前,组装的转录本(unigenes)使用Trinity (http://trinityrnaseq.sourceforge.net/analysis/extract_proteins_from_trinity_transcripts.html)来预测开放阅读框(orf)。由于苦荞参考基因组数据库质量较低,所有9个文库均采用Trinity方法组装。将所有unigenes的功能注释与NR蛋白数据库(http://www.ncbi.nlm.nih.gov/)、同源组群(COG)蛋白质数据库(http://www.ncbi.nlm.nih.gov/COG/),以及KEGG数据库(http://www.genome.jp/kegg/)使用BLASTx (E-value) [71].使用Blast2GO程序(版本:2.5.0)分析unigenes的GO注释。通过将unigenes与NCBI非冗余(NR)、COG、GO、String、Swiss-Prot和KEGG数据库中存在的unigenes进行校准,进行功能注释,e值<1e-5(附加文件7:表S4)。然后计算BP、MF和CC类别中与每个GO项相关的unigenes的数量。单基因序列也与COG数据库进行比对,以预测和分类潜在的功能。此外,利用COG和KEGG数据库补充了GO功能特征,确定了unigenes的序列方向。
DEGs和富集分析
使用Bowtie2 (Version: 2.3.4)将所有干净序列的读取结果映射回转录组集合[72],将读计数归一化为transcriptsper million reads (FPKM),通过RSEM计算unigene表达水平(http://deweylab.biostat.wisc.edu/rsem/)(版本:1.2.31)。利用edgeR (http://www.bioconductor.org/packages/2.12/bioc/html/edgeR.htmlFDR < 0.05 and log2|FC| > = 1 (Version: 3.14.0)。GO和KEGG通路富集分析使用GOATOOLS工具(版本:0.6.5)进行超几何分布检验。采用BH (fdr correction with Benjamini/Hochberg)校正法进行校正P值。当校正p值小于0.05时,认为功能簇显著富集。
qRT-PCR验证及表达分析
随机选取21个基因,包括15个DEGs,利用6个pb调控基因进行qRT-PCR进一步验证。总RNA提取和基因组DNA去除如上所述。使用HiScript®1st Strand cDNA Synthesis kit (Vazyme, China)从1 μg RNA中合成第一链cDNA。然后用无核酸酶水将cDNA产物稀释10倍,作为qRT-PCR的模板,使用ChamQ™SYBR Green Master mix (Vazyme,中国)和CFX96实时PCR检测系统(Bio-Rad)进行qRT-PCR。用于qRT-PCR的特异性引物对列在附加文件中8:表S5。对于qRT-PCR验证,引物特异性通过PCR检测(附加文件9:图S4)。所有样本归一化到机电基因(73].基于阈值周期(Ct)计算DEG表达式的折叠变化,其中ΔCt = Ct目标−Ct机电Δ (ΔCt) = ΔCt控制−ΔCt表示条件.
酵母细胞对铅的抗性
的编码序列FtMTPC2,FtZFP14,FtPCSL,FtVCE1a,FtNramp3,FtPCS1从RNA-Seq构建的cDNA文库中扩增cDNA片段,将其亚克隆到pEASY-Blunt Zero (TransGen Biotech, China)中进行测序。正确的编码DNA序列(CDS)片段使用克隆快车II一步克隆试剂盒(Vazyme,中国)克隆到pYES2载体中进行酵母表达。铅和镉敏感酵母菌株的细胞Δycf1(玛塔his3Δ1 leu2Δ0 met15Δ0 ura3Δ0 YCF1::kanMX4)携带空向量(pYES2),pYES2-FtMTPC2,pYES2-FtZFP14,pYES2-FtPCSL,pYES2-FtVCE1a,pYES2-FtNramp3,或pYES2-FtPCS在30°C的培养基中生长。为了分析抗铅性,酵母细胞在SD-Ura(2%葡萄糖)培养基中30℃培养至OD6002.0,然后连续稀释(10−1, 10−2, 10−3, 10−4)带有1× TE缓冲器。将细胞标记在含有Pb的SD-Ura(2%半乳糖)培养基上2 +(0、40、80 μmol/L),在30℃培养箱中培养4 d。将酵母细胞接种于含有0、40 μmol/L Pb的SD-Ura(2%半乳糖)培养基上2 +以1:1000的比例确定生长曲线。
数据分析
所有数值均以三个独立实验的平均值±标准差表示。数据分析采用单向方差分析(ANOVA),随后采用GraphPad Prism 6进行Tukey检验。差异被认为在P< 0.05。
数据和材料的可用性
在本研究过程中产生或分析的所有数据都包含在手稿及其附加文件中。本研究中使用的测序数据集可在生物项目下的NCBI数据库的Sequence Read Archive中获得:PRJNA515389 (https://www.ncbi.nlm.nih.gov/bioproject/PRJNA515389/),并于出版后公开。
缩写
- 原子吸收光谱法:
-
原子吸收分光光度法
- 艾尔:
-
铝
- APX型:
-
抗坏血酸盐过氧化物酶
- 英国石油公司:
-
生物过程
- BZIP:
-
基本区域亮氨酸拉链
- 猫:
-
过氧化氢酶
- 答:
-
蜂窝组件
- 度:
-
差异表达基因
- DMT:
-
二价金属转运体
- 小块土地:
-
Ethylene-responsive因素
- FPKM:
-
每千碱基读出的外显子每百万读出
- GARP:
-
富含谷氨酸的蛋白质
- 走:
-
基因本体论
- 格:
-
谷胱甘肽还原酶
- 谷胱甘肽:
-
谷胱甘肽
- KEGG:
-
京都基因与基因组百科全书
- MDA:
-
Monodehydroascorbate还原酶
- MF:
-
分子功能
- MTPC2:
-
金属转运蛋白C2
- 门店:
-
新一代测序
- NR:
-
无冗余蛋白质数据库
- Nramp3:
-
天然抗性相关巨噬细胞蛋白3
- 描述:
-
Oxygen-evolving复杂
- 子:
-
开放阅读框
- 铅:
-
引领
- 电脑:
-
决定液泡植物螯合肽合成酶
- 电脑:
-
转移
- PCSL:
-
植物螯合蛋白合成酶样家族蛋白
- 圆荚体:
-
过氧化物酶
- PS:
-
光系统
- 存在:
-
实时定量PCR
- RNA-Seq:
-
RNA深度测序
- ROS:
-
活性氧
- RSEM:
-
RNA-Seq期望最大化
- SOD:
-
超氧化物歧化酶
- 透射电镜:
-
透射电子显微镜
- VCE1a:
-
液泡阳离子/质子交换器1a
- YCF1:
-
假设叶绿体开放阅读框1
- ZFP14:
-
ccch型锌指蛋白14
参考文献
Ercal N, grer - orhan H, Aykin-Burns N.有毒金属与氧化应激第一部分:金属诱导氧化损伤的机制。中国医学化学,2001;1(6):529-539.10.2174/1568026013394831。
王晓明,王晓明,王晓明,王晓明,等。铅对植物遗传毒性的影响蚕豆根尖根与金属细胞摄取和初始物种形成的关系。环境科学学报,2011;44(1):78-84。https://doi.org/10.1016/j.ecoenv.2010.08.037.
重金属污染的危害。Br Med Bull. 2003; 68:167-82。https://doi.org/10.1093/bmb/ldg032.
Cecchi M, Dumat C, Alric A, Felix-Faure B, Pradere P, Guiresse M.铅回收厂沉降物对钙形成层的多金属污染。Geoderma。2008;144(2):287 - 98。https://doi.org/10.1016/j.geoderma.2007.11.023.
夏尔玛。植物铅毒性研究。植物学报,2005;17(1):35-52。https://doi.org/10.1590/S1677-04202005000100004.
Tangahu BV, Sheikh Abdullah SR, Basri H, Idris M, Anuar N, Mukhlisin M.植物修复对重金属(As, Pb和Hg)吸收的研究进展。国际化学工程,2011;2011:1687 - 186x。https://doi.org/10.1155/2011/939161.
刘健,马旭,王敏,孙旭。水稻品种间铅积累和转运基因型差异及其与籽粒铅水平的关系。生态毒理学杂志,2013;90:35-40。https://doi.org/10.1016/j.ecoenv.2012.12.007.
Gupta DK, Nicoloso FT, Schetinger MRC, Rossato LV, Pereira LB, Castro GY, Srivastava S, Tripathi RD.水培植物抗氧化防御机制玉米中等铅胁迫下的幼苗。中国生物医学工程学报。2009;29(1):379 - 379。https://doi.org/10.1016/j.jhazmat.2009.06.141.
古普达,黄海峰,杨雪霞,Razafindrabe BHN, Inouhe M.铅的解毒作用景天属植物alfrediiH.与植物螯合素无关,而与谷胱甘肽有关。中国生物医学工程学报。2010;37(1):344 - 344。https://doi.org/10.1016/j.jhazmat.2009.12.052.
Pandey LK, Kumar D, Yadav A, Rai J, gaor JP。作为河流重金属污染生物监测工具的周边硅藻形态异常。生态学报。2014;36:272-9。https://doi.org/10.1016/j.ecolind.2013.08.002.
Alexander P, Alloway B, Dourado A. 6种常见蔬菜Cd、Cu、Pb和Zn积累的基因型变异。环境污染。2006;44(3):736-45。https://doi.org/10.1016/j.envpol.2006.03.001.
李华,胡涛,阿蒙波娥,付娟。两种高羊茅的转录组分析(季)品种对铅胁迫的响应。BMC基因组学杂志,2017;18(1):145。https://doi.org/10.1186/s12864-016-3479-3.
尹杰,曹旭,周强,马丽强。铅,铜和锌的积累在本地植物生长在佛罗里达州的污染地点。环境科学与技术,2006;29(3):344 - 344。https://doi.org/10.1016/j.scitotenv.2006.01.016.
Ferreyroa GV, Lagorio MG, Trinelli MA, Lavado RS, Molina FV。铅对芸苔属植物显著光合器官。生态毒理学杂志,2017;140:123-30。https://doi.org/10.1016/j.ecoenv.2017.02.031.
王志刚,王志刚,王志刚,王志刚。药用植物抗氧化防御机制及其遗传毒性研究Acalypha籼L.在铅压力下。臭氧层。2017;171:544-53。https://doi.org/10.1016/j.chemosphere.2016.12.092.
王玲,杨华,刘荣,范刚。紫花苜蓿产氧及开花的解毒策略及调控梧桐树通过转录组分析,在铅胁迫下。环境科学学报,2015;22(16):12747-58。https://doi.org/10.1007/s11356-015-4563-y.
寻找荞麦的野生祖先。1.new描述Fagopyrum(蓼科)种及其在中国和喜马拉雅山区的分布。Fagopyrum。1998;15(76):18-28。https://doi.org/10.1007/BF02861199.
李A, H淑杓。Fagopyrum tataricum.在:中国植物志;2004.
杨晓明,杨晓明,杨晓明,等。苦荞麦香气成分的鉴定与定量分析(Fagopyrum tataricumGaertn.)和它的一些磨碎馏分。食品科学,2012;77(7): C746-51。https://doi.org/10.1111/j.1750-3841.2012.02778.x.
荞麦:伪谷物和营养食品:ASHS出版社;1996.
田村H,本田M,佐藤T, Kamachi H.普通荞麦Pb超积累与耐受性(Fagopyrum esculentumMoench)。中国植物学报,2005;36(5):359 - 359。https://doi.org/10.1007/s10265-005-0229-z.
刘勇,余乐,陈勇,刘旭,吴磊,黄娟,何素平。不同荞麦品种耐铅性的研究。中国生态学报,2006;25(11):1344-7。https://doi.org/10.1016/s1872 - 2032 (06) 60052 - 8.
王志刚,王志刚,王志刚,王志刚。白三叶草、白三叶草和荞麦药用特性的研究。在:第七届国际科学农业研讨会“Agrosym 2016”,在Jahorina:东萨拉热窝大学农学院;2016.906 - 11页。https://doi.org/10.7251/AGRENG1607133.
Hernández I, Alegre L, Van Breusegem F, Munné-Bosch S.类黄酮作为抗氧化剂在植物中的相关性如何?植物科学进展,2009;14(3):125-32。https://doi.org/10.1016/j.tplants.2008.12.003.
吴强,白鑫,赵伟,向东,万勇,闫娟,邹玲,赵刚。苦荞的组装与分析(Fagopyrum tataricumGaretn)。转录组揭示了盐胁迫反应的关键调控因子。基因。2017;8(10):255。https://doi.org/10.3390/genes8100255.
田松,顾超,刘玲,朱晓霞,赵颖,黄松路易斯安那州的虹膜铅胁迫反应相关基因的根和鉴定。中华分子生物学杂志,2015;16(12):28087-97。https://doi.org/10.3390/ijms161226084.
彭陆张高J, Y, C, H,罗M,李G,沈Y,丁H,张Z,潘G .玉米根转录组的发展动态对重金属铅污染。中国生物工程学报。2015;36(2):357 - 357。https://doi.org/10.1016/j.bbrc.2015.01.101.
Auguy F, Fahr M, Moulin P, El Mzibri M, Smouni A, Filali-Maltouf A, Béna G, Doumas PHirschfeldia incana这是对铅暴露的反应。前沿植物科学,2016;6:1231。https://doi.org/10.3389/fpls.2015.01231.
李强,李志强,李志强,李志强。基于高通量测序技术的发芽苦荞麦转录组分析。生物科技大牛。2016;7:7。
姚红,李超,赵红,赵娟,陈红,步涛,安虎伟,吴强。黑苦荞麦转录组深度测序揭示了不同的类黄酮代谢特征(Fagopyrum tataricumGaretn)。生物工程学报。2017;124:49-60。https://doi.org/10.1016/j.pbiomolbio.2016.11.003.
李志强,李志强,李志强,等。植物对镉胁迫的响应。环境实验学报,1999;41(2):105-30。https://doi.org/10.1016/s0098 - 8472 (98) 00058 - 6.
Allan DL, Jarrell WM。玉米和大豆根细胞壁对质子和铜的吸附。植物科学进展。1989;89(3):823-832.10.2307/4271921。
彭海燕,杨旭娥,田世凯。铜的积累和超微结构分布香splendens.浙江大学理学学士2005;6(5): 311。https://doi.org/10.1631/jzus.2005.B0311.
的异体中的铅洋葱L.根尖超微结构研究。中国植物科学,1998;33(1):1 - 5。https://doi.org/10.1016/s0168 - 9452 (98) 00023 - 5.
郑玲,Peer T, Seybold V, Lütz-Meindl U. Pb诱导的两种胡枝子超微结构改变及亚细胞定位。Environ Exp Bot. 2012;77: 196 - 206。https://doi.org/10.1016/j.envexpbot.2011.11.018.
缅因MA,杜阿尔特MV,苏恩NL。浮游植物对镉的吸收。水资源问题,2001;35(11):2629-34。https://doi.org/10.1016/s0043 - 1354 (00) 00557 - 1.
植物重金属毒性胁迫的管理:生物和生物技术工具。生物技术,2014;32(1):73-86。https://doi.org/10.1016/j.biotechadv.2013.11.011.
罗志斌,何俊,李志强,李志强。植物重金属富集与信号转导:植物修复效率的研究进展。生物技术学报,2016;34(6):1131-48。https://doi.org/10.1016/j.biotechadv.2016.07.003.
杨晓明,李志强,李志强,等。工程植物抗非生物胁迫的研究进展。生物技术。2005;16(2):123-32。https://doi.org/10.1016/j.copbio.2005.02.001.
脱水和低温下的分子响应:两种胁迫信号通路的差异和交叉信号。植物学报,2000;3(3):217-23。https://doi.org/10.1016/s1369 - 5266 (00) 80068 - 0.
杨晓明,李志强,李志强,等。重金属铅对植物毒性的影响。学报学报2012;2012:1 - 10。https://doi.org/10.1155/2012/369572.
李志强,李志强,李志强,等。铅诱导DNA损伤的研究进展蚕豆根尖根细胞:氧化应激的潜在参与。Mutat Res. 2011;726(2): 123-8。https://doi.org/10.1016/j.mrgentox.2011.09.001.
植物中有毒金属的积累、暴露反应和耐受机制。Biochimie。2006;88(11):1707 - 19所示。https://doi.org/10.1016/j.biochi.2006.07.003.
陈志伟,陈志伟,陈志伟,陈志伟。水生植物铅积累潜力的研究眼镜蛇籼都与抗氧化系统有关。中国生物工程学报,2010;29(3):344 - 344。https://doi.org/10.1016/j.biortech.2009.12.031.
古普塔DK, Nicoloso FT, Schetinger MR, Rossato LV,黄HG, Srivastava S,杨XE。铅诱导的反应Pfaffia glomerata这是一种重要的巴西药用植物,在离体培养条件下。中国环境科学。2011;86(3):272-7。https://doi.org/10.1007/s00128-011-0226-y.
王萍,张松,王超,陆杰。Pb对铅生物积累植物氧化应激和抗氧化反应的影响苦草属•.环境科学学报,2012;28(2):344 - 344。https://doi.org/10.1016/j.ecoenv.2011.11.008.
王晓明,王晓明,王晓明。铅对玉米和向日葵光合作用的抑制作用。植物科学。1975;34(4):326-9。https://doi.org/10.1111/j.1399-3054.1975.tb03847.x.
Poskuta JW, Parys E, Romanowska E, Gajdzis-Gujdan H, Wróblewska B:铅对玉米幼苗光合作用、14C分布及蒸腾作用的影响。社会学报,1988,57(1): 149 - 155。https://doi.org/10.5586/asbp.1988.014
陈强,张旭,刘勇,魏军,沈伟,沈志,崔娟。hemin介导的锌、铅、铬毒性缓解与提高光合作用和抗氧化能力有关;水稻幼苗对金属吸收的抑制和氧化应激。植物生长学报。2016;81(2):1-12。https://doi.org/10.1007/s10725-016-0202-y.
Kumar A, Prasad MNV。铅诱导的毒性和叶绿素荧光干扰Talinum triangulare发展水产。Photosynthetica。2015;53(1):66 - 71。https://doi.org/10.1007/s11099-015-0091-8.
Bassi R, Høyer-Hansen G, Barbato R, Giacometti G, Simpson D.光系统II天线系统的叶绿素蛋白。中国生物医学工程学报。1987;26(2):339 - 344。https://doi.org/10.0000/PMID3308877.
Kohli SK, Handa N, Sharma A, Gautam V, Arora S, Bhardwaj R, Alyemeni MN, Wijaya L, Ahmad P. 24-表油菜素内酯和水杨酸联合作用通过调节多种代谢产物减轻铅毒性芸苔属植物junceal .幼苗。原生质。2018;255(1):11-24。https://doi.org/10.1007/s00709-017-1124-x.
戴丽萍,熊志涛,黄勇,李敏梅。镉诱导植物叶片色素、总酚类物质和苯丙氨酸解氨酶活性的变化红萍imbricata.环境毒理。2006;21(5):505-12。https://doi.org/10.1002/tox.20212.
黄酮在植物抗氧化剂中的地位及其功能意义。植物科学进展(英文版);2012;https://doi.org/10.1016/j.plantsci.2012.07.014.
Castañeda-Ovando A, MdL P-H, Páez-Hernández ME, Rodríguez JA, Galán-Vidal CA.花青素化学研究综述。食品化学,2009;113(4):859-71。https://doi.org/10.1016/j.foodchem.2008.09.001.
林玉峰,Aarts MG。植物锌镉胁迫响应的分子机制。细胞生物学与生物工程学报,2012;29(6):366 - 366。https://doi.org/10.1007/s00018-012-1089-z.
闫泽,谭nfy。铅胁迫对小麦幼苗抗氧化酶和应激相关激素的影响Excoecaria agallocha林恩。植物学报。2013;36(2):327 - 329。https://doi.org/10.1007/s11104-012-1467-1.
Agrawal GK, Tamogami S, Iwahashi H, Agrawal VP, Rakwal R.茉莉酸诱导水稻MAP激酶基因(OsBWMK1)在不同生物和非生物胁迫下的瞬时调控。植物化学学报。2003;41(4):355-61。https://doi.org/10.1016/s0981 - 9428 (03) 00030 - 5.
Smékalová V, Doskočilová A, Komis G, Šamaj J:植物非生物胁迫信号通路中次生信使、激素和MAPK模块的串扰。生物技术,2014,32(1):2-11。https://doi.org/10.1016/j.biotechadv.2013.07.009
植物重金属毒性:谷胱甘肽和植物螯合素在植物耐重金属胁迫中的作用综述。中国生物医学工程学报,2010;76(2):167-79。https://doi.org/10.1016/j.sajb.2009.10.007.
Maestri E, Marmiroli M, Visioli G, Marmiroli N:金属耐受性和超积累:性状和环境之间的成本和权衡。环境科学学报,2010,32(1):1 - 13。https://doi.org/10.1016/j.envexpbot.2009.10.011
姜伟,刘东。铅诱导的植物根分生组织细胞的细胞防御系统大蒜中国生物医学工程学报。2010;10(1):1 -8.10.1186/1471-2229-10-40。
Cellier M, Prive G, Belouchi A, Kwan T, Rodrigues V, Chia W, Gros P. Nramp定义了一个膜蛋白家族。中国科学(d辑),2001;26(3):344 - 344。
Tiwari M, Sharma D, Dwivedi S, Singh M, Tripathi RD, Trivedi PK.水稻NRAMP基因在拟南芥中的表达和细胞定位揭示了水稻NRAMP基因OsNRAMP 1参与砷转运和耐砷。植物细胞环境学报。2014;37(1):140-52。https://doi.org/10.1111/pce.12138.
Garrick MD, Dolan KG, Horbinski C, Ghio AJ, Higgins D, Porubcin M, Moore EG, Hainsworth LN, Umbreit JN, Conrad ME。DMT1:多种金属的哺乳动物转运体。BioMetals。2003; 16(1): 41-54。https://doi.org/10.1023/a:1020702213099.
拟南芥金属耐受性蛋白AtMTP3在缺铁和锌过量条件下通过介导茎部锌排斥来维持金属稳态。植物学报,2006;46(5):861-79。https://doi.org/10.1111/j.1365-313X.2006.02746.x.
袁勇,孙艳杰,李永杰,李永杰,杨永耶,黄毅,李勇。转基因植物铅镉的工程耐受性和积累。生物技术学报。2003;21(8):914-9。https://doi.org/10.1038/nbt850.
霍尔JL,威廉姆斯LE。植物中的过渡金属转运体。中国机械工程学报,2003;29(3):344 - 344。https://doi.org/10.1093/jxb/erg303.
的异体中的铅洋葱L.根尖超微结构研究。中国植物科学,1998;33(1):1 - 5。https://doi.org/10.1016/s0168 - 9452 (98) 00023 - 5.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Adiconis X, Fan L, Raychowdhury R, Zeng QD,等。来自RNA-Seq数据的全长转录组组装,没有参考基因组。中国生物工程学报。2011;29(7):644-U130。https://doi.org/10.1038/nbt.1883.
卡马乔C, Coulouris G, Avagyan V, Ma N, Papadopoulos J, Bealer K, Madden TL. BLAST+:结构与应用。生物医学工程学报。2009;10(1):421.10.1186/1471 -2105-10-421。
朗米德B,萨尔茨堡SL。快速间隙读取对齐领结2。Nat Methods. 2012;9(4): 357。https://doi.org/10.1038/nmeth.1923.
Demidenko NV, Logacheva MD, Penin AA。荞麦实时荧光定量PCR内参基因的选择与验证(Fagopyrum esculentum)基于转录组序列数据。公共科学学报,2011;6(5):e19434。https://doi.org/10.1371/journal.pone.0019434.
确认
我们非常感谢中国科学院研究生院生命科学学院柴团耀教授为我们提供pYES2质粒和Δycf1压力。
资金
国家自然科学基金项目(no . 30400282和31171606)和陕西省重点研发计划项目(2017NY-033)支持本研究的收集、分析和处理。这些资金为研究项目提供了资金支持,但不涉及项目设计、数据收集、分析和文稿准备。
作者信息
从属关系
贡献
PC构思了这项研究。PC和LW设计了实验。LW、BZ和YY进行实验。LW和YY对数据进行了分析。PC、QLX和LW撰写了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
不同浓度铅胁迫下苦荞叶片的生理特征。
附加文件2:图S2。
unigenes的序列长度分布。
附加文件3:表S1。
所有unigenes的注释。
附加文件4:图S3。
基于最佳命中的物种和相似度分布。
附加文件5:表S2。
CK与Pb1和CK与Pb2比较中常见的调控基因。
附加文件6:表S3。
GO对DEGs的富集分析。
附加文件7:表S4。
DEGs的KEGG通路富集分析。
附加文件8:表S5。
用于实时定量PCR分析的引物。
附加文件9:图S4。
引物特异性试验用于qPCR验证。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
王,李,郑,乙,袁,杨。et al。转录组分析Fagopyrum tataricum叶片对铅胁迫的反应。BMC植物生物学20.54(2020)。https://doi.org/10.1186/s12870-020-2265-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-2265-1
关键字
- Fagopyrum tataricum
- 导致压力
- 转录组
- 超微结构定位
- 不同的表达