摘要
背景
野豌豆(野豌豆属漂白亚麻纤维卷L.)是一种高蛋白含量和高固氮性的草料谷物豆科植物,与可持续农业系统有关。干旱是制约该作物产量的主要因素。遗传资源的收集对于为育种提供遗传变异性至关重要。通过对干旱相关参数的分析,我们可以识别出紫薇科植物核心植物的耐旱性和敏感性生态类型。
结果
为了了解干旱反应的相关机制,我们分析了耐受性和敏感性材料之间的转录组差异。这些差异表达基因(DEGs)的多态变异(SNPs和SSRs)也被用来分析干旱相关标记的设计.在干旱条件下,两种基因型共有1332个转录本被普遍解除调控。为了了解植物对干旱的适应能力,我们还对不同品种间的生长发育进行了分析。在水和干旱条件下,共有2646个转录本是敏感和耐受生态型之间的DEG,包括参与氧化还原稳态、细胞壁修饰和胁迫响应的重要基因。这些功能和遗传信息的整合将有助于理解普通野豌豆干旱响应的分子机制和抗旱性的适应机制。这些DEGs的多态变异的鉴定也被筛选为干旱相关标记的设计,可用于未来的育种计划策略.
结论
我们的研究首次揭示了普通野豌豆中与耐旱性相关的基因和途径。此外,我们还鉴定了100多个潜在的干旱相关多态性,即snp或SSRs,它们在干旱和耐旱基因型中存在不同。利用这些分子标记进行性状预测,可以通过筛选与植物抗旱能力、适应性或产量相关的作物种质资源,为未来的工程策略开发基因组工具。
背景
干旱给地球上干旱和半干旱地区的作物生产造成巨大损失。粮农组织认为,水资源短缺造成的压力是发展中国家粮食短缺的主要原因,远远超过其他类型的环境威胁,而且相信全球变暖的结果将增加这种现象的频率和影响(http://www.fao.org/).
干旱反应包括大量的形态,生理,生化和分子变化,在整个植物和细胞水平。主要的干旱反应包括相对含水量的减少和膨压的改变,从而激活气孔关闭,减少蒸腾作用并限制光合作用速率。重要的改变也发生在根水平,在根构型和生理受到影响,以调节水分吸收的内稳态,以维持渗透压[1].植物对干旱的反应更相关的方面包括渗透和氧化平衡的维持。干旱促进活性氧(ROS)的积累,克服细胞的抗氧化能力,并诱导抗氧化酶的活性发生变化,以增加对ROS的清除能力[2,3.].这些改变促进细胞氧化还原稳态的剧烈变化,可能刺激蛋白质、脂类和DNA的损伤[4].渗透物的积累在适应水分亏缺方面也起着关键作用[3.].转录因子和蛋白激酶等调控因子在提高植物对干旱和其他非生物胁迫的耐受性方面发挥着重要作用[5].
为了应对干旱,植物已经发展出适应策略来忍受这些胁迫条件。这些改变包括与许多压力相关基因功能相关的生理和生化改变。尽管其中许多反应对大多数植物物种来说是常见的,但一些干旱反应表现出了物种甚至基因型特有的特征[6,7].这一事实增加了理解耐旱机制的多样性和复杂性。
常见的野豌豆(蚕豆)是一种兼用的豆科植物,蛋白质含量高,生物固氮能力强,可作饲料和饲料粮[8],因此在可持续农业系统中具有巨大潜力(www.fao.org).作为覆盖作物,它除了使土壤富氮外,还能阻止其他争夺土壤养分的植物生长,减少除草剂的使用[9,10].动物饲料对植物来源的蛋白质的巨大依赖,以及欧洲联盟和世界其他区域对使用具有环境价值或“绿化”的物种的兴趣,使得使用普通的野豆科植物成为一种具有重大经济意义的农业替代品。西班牙植物遗传资源中心(CRF)隶属于国家农业和食品研究与技术研究所(INIA),保存着国家活跃的植物小麦;拥有800多个品种,包括来自世界各地的本地品种、野生亲缘品种和商业品种。农业形态研究结果可于研究中心网站(http://wwwx.inia.es/coleccionescrf/CaracterizacionCRFeng.asp)和种子储备蛋白质研究中收集到的样本的遗传多样性分析,是第一步,使我们能够分析现有的资料,并建立53个初步核心样本,从而使样本的收集合理化[11,12].
干旱等环境压力严重限制了普通野豌豆的生产;因此,鉴定耐旱基因型是育种的重要目标。基于之前从我们的藏品中选择的具有耐旱性状的材料[13],在这项工作中,我们在灌溉和干旱条件下进行了转录组学分析,以识别耐旱候选基因。
下一代rna -测序(RNA-Seq)测序平台已被用于分析植物非生物胁迫反应的遗传基础,特别是在基因组资源不可用的非模式物种[14].这些工具使我们能够初步探索一些野豆科植物组织中的基因表达[15,16].在这里,从头转录组组装、数据集基因注释和差异基因表达分析使我们不仅能够识别干旱调节基因,而且最相关的是,在耐受和敏感基因型之间表达差异的基因。这些转录本包括与一般应激反应、细胞壁组织、水分剥夺、氧化应激和脱落酸(ABA)反应基因有关的基因,这些基因在耐受和敏感变异中有差异表达。此外,这些研究还使我们了解了植物对水分亏缺的应激反应和耐受机制。
此外,我们的转录组学分析将有助于开发耐旱性预测的基因组工具,因为我们已经识别了DEG基因上的变异,如单核苷酸多态性(SNPs)和简单序列重复(SSRs)。这种功能和遗传信息的整合可以用于未来的战略,以加速育种计划,并在基因库中进一步使用预测基因型和表型分析的发展。
结果
耐旱性状的鉴定
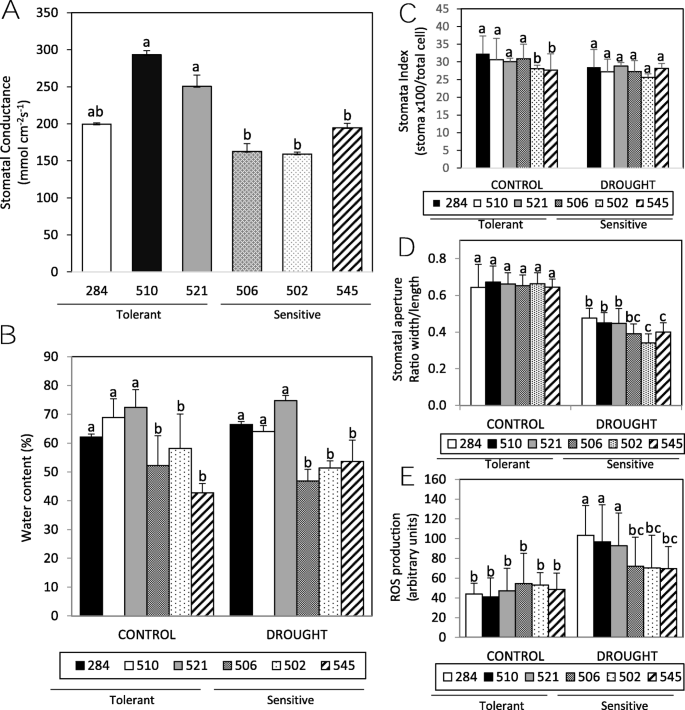
干旱胁迫引起许多分子、生化和生理变化。植物缺水的早期症状之一是干旱胁迫条件下相对含水量的降低[17].气孔导度是与植物对水分亏缺胁迫耐受性直接相关的参数之一。对不同气象条件下的气孔导度测量进行了分析,结果表明284、510和521的气孔导度水平较高,这些品种此前被确定为耐受基因型(图1)。1a)叶片蒸散发的减少是植物更好地适应干旱的重要机制。蒸腾试验是通过测量普通野豆科植物叶片的水分损失来进行的。我们发现,在先前被选为耐旱候选品系的284、510和521中,含水量下降得更快。1b).含水量的降低可能是气孔指数或气孔孔径减小所致。气孔数量、保卫细胞密度和气孔指数分析无统计学差异(图1)。1c).在干旱胁迫下,ABA促进气孔关闭,使蒸腾损失的水分减少到最低[18,19].我们的分析表明,在干旱条件下,气孔普遍关闭,正如预期的那样。虽然基因型之间没有显著差异,但敏感的候选品种506、502和545在干旱条件下比耐受性株系表现出轻微的封闭(图5)。1d).活性氧(Reactive Oxygen Species, ROS)是一种次级信使,通常在对多种刺激的反应中被触发,调节aba诱导的保护细胞关闭[18,19].气孔羧基荧光素染色表明干旱后植物ROS产量普遍增加,尤其是在耐旱候选植物中(图1)。1e).这些数据表明,野豆科植物的抗胁迫能力可能是由于气孔关闭增强介导的蒸腾速率降低和保护细胞ROS生成动态的改变。
气孔导度、蒸腾水分损失和气孔动力学的差异被鉴定为耐旱(284、510和521在所有图的直方图条上均为素色)和干旱敏感(502、506和545在所有图的直方图条上均为装饰纬)。一个。田间测得的气孔导度值。图示为代表性测量(2018年5月;旱作条件;“La Canaleja”马德里),在每个品种的至少6株植株上记录三份。b。离体后3 h,温室植物野豌豆小叶的含水量和蒸腾水分损失。1周龄的野豌豆品种在有水(对照)或无水(干旱)条件下生长3周,然后在3小时干燥称重。相对叶重以初始鲜重(% FW)为基础的百分比表示。三个独立实验;n每人20张。统计差异(方差分析和Tukey HSD检验)只涉及同一时间,以简化。c。气孔指数分析(气孔数complex×100/总表皮细胞数)。不同温室栽培基因型叶片后表皮层(4周龄叶片)的显微细胞分析。d。干旱导致气孔关闭。在对照(白色柱)或干旱(黑色柱)条件下生长的4周龄温室植物叶片表皮表皮上测量气孔孔。三次实验所得的数值(n> 60)。e。通过测量在对照(白色柱)或干旱(黑色柱)条件下生长的4周龄温室植物的保护细胞中的羧酸荧光素二乙酸荧光水平来分析ROS的产生。实验采用三份重复。a e。数值为平均值±标准差。用方差分析和Tukey HSD后验分析,不同字母表示差异显著;p< 0.05
表皮蜡和保护性渗透物(包括脯氨酸和可溶性糖)的水平可能影响抗旱性[3.];然而,我们没有观察到基因型之间在这些成分水平上的显著差异。光合色素在基因型之间也没有表现出严重的差异[4].耐受性基因型在干旱条件下花青素(一种胁迫诱导的色素)的水平较低,这表明这些资源处于较低的胁迫状态。我们观察到一些耐旱材料(284和521)的根系较大,表明根直接参与了紫薇科植物的耐旱性3.:图S1)。这些数据表明,正如预期的那样,野豌豆已经发展出不同的适应策略来应对干旱。
基于我们之前的数据,综合了物候、产量组成部分和收获指数数据与干旱相关参数(SPAD指数、气孔导度[13],我们分别选取506和521基因型作为敏感和耐旱的代表,进行转录组数据分析。
转录组数据和功能注释的从头组装
为了更好地了解非测序物种干旱反应机制的遗传和分子途径诉漂白亚麻纤维卷,我们使用高通量从头RNA测序来评估干旱条件下基因表达的全局变化。此外,为了分析潜在的抗旱适应性机制,我们比较了干旱易感(506)和耐旱(521)基因型之间的转录组差异。通过RNA测序分析,确定了参与干旱反应和抗旱性的候选基因。利用Illumina HiSeq 2500平台对12份混合RNA样本的cDNA文库进行分析。从测序中,总共获得了6.6亿个原始reads。经过质量控制和数据清理处理和从头组装,得到的转录本集(同源性> 90%)聚类为63,878个高质量单基因序列;其中5071个有bb0 1000 nt,平均长度为1015 nt, N50长度为605 nt。illumina测序数据、后续序列组装和长度分布的摘要见表1,附加文件3.:表S1、图S2。
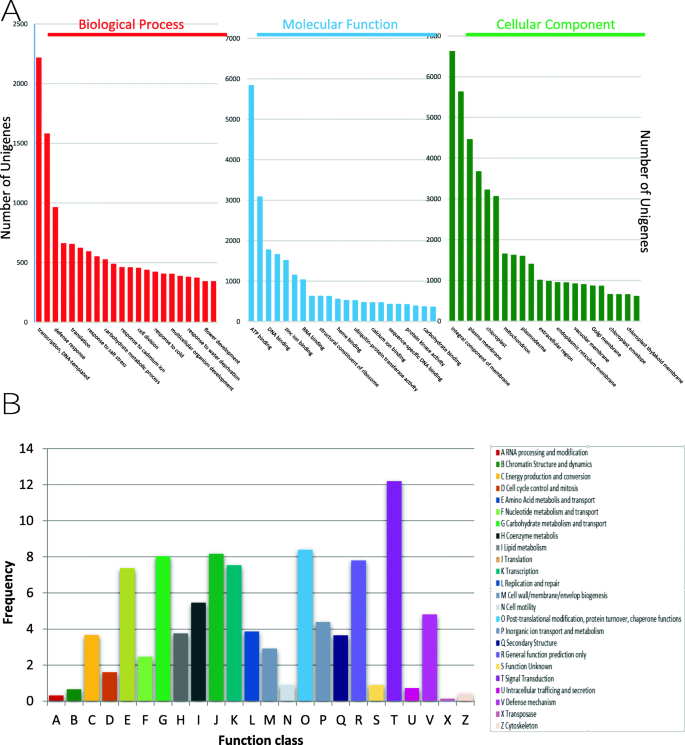
序列组装完成后,对序列数据库(nt NCBI、RnaCentral和Uniprot)进行BLAST (BLASTN和BLASTX)搜索,推断每个单基因的基因功能。然后根据这些公共数据库中序列的相似性对不同的unigenes进行注释。总共有56109个(87.8%)unigenes在至少一个数据库中被成功注释,633个(1.1%)unigenes在三个数据库中都被注释(表2)2).为了对转录组进行功能分类和对假定的野豆科植物基因功能的注释,我们使用了基因本体论(GO)赋值(图1)。2a).共有29691个(46.5%)unigenes被分配到生物过程(BP)、细胞组分(CC)和分子功能(MF)。在CC类中,细胞膜整体组分(6616个unigenes, 10.4%)、细胞核(5627个unigenes, 8.8%)和质膜(4455个unigenes, 7.0%)是最大的GO亚群。MF亚组中最多的是ATP结合(5835个,9.1%)、金属离子结合(3079个,4.8%)和DNA结合(1768个,2.8%)。BP亚组在转录、dna模板化(2215个unigenes, 3.5%)、转录调控(1578个unigenes, 2.5%)和防御反应(960个unigenes, 1.5%)方面表现过高。
对组装的转录本进行同源组(COGs)功能分类,以预测Uniprot数据库中注释的unigenes和基因产物的功能。此外,13641个unigenes被分为24个COG通路(图。2b).过度表达最多的是信号转导(1664个,12.2%)、碳水化合物代谢和转运(1096个,8.0%)和一般功能(1064个,7.8%)。其他分析以Pfam描述和KEGG术语(KO)路径富集方式进行,详见附加文件1:数据集S1。
差异表达基因(DEGs)功能分析
基因量化和差异基因表达基于负二项模型。分别使用HTSeq-count 0.6.1p1和DESeq2方法进行分析[20.].
我们的转录组数据使我们开始了解普通野豌豆干旱反应的遗传机制。为了评估干旱条件下的基因反应,我们分析了4个周龄植物的转录组反应,不同耐受性和敏感性的候选植物在浇水或不浇水的情况下。共2711个基因在水处理和干旱处理植株间差异表达506个,敏感候选加入,(|倍变化|≥2和调整p-value (p-adj) FDR < 0.05),其中上调1220条,下调1491条。在耐受性候选基因中,差异表达基因为521,6097个。干旱处理后上调3383株,下调2214株。在这两种条件下,共有1332个转录本被普遍解除调控(图。3.a).此外,计算不同类别的GO、KEGG (KO)本体、蛋白质家族集合数据库(Pfam)和同源组簇(COG)路径的每个比较的功能富集。正如预期的那样,除脯氨酸、细胞壁和过氧化物相关代谢外,普通的DEG在参与非生物胁迫(包括缺水、氧化应激或脱落酸ABA反应)的生物过程中被富集。细胞成分表现较多的是质膜及其整体成分,胞间连丝,胞外区,胞外和细胞壁,这些成分本质上与干旱胁迫细胞反应有关。在go富集的分子功能之间,我们发现了不同的氧化还原酶和过氧化物酶活性、转录因子和激酶活性(图1)。3.b).其他通路也进行了同样的比较。更多关于GO、KO、Pfam或COG不同途径对GO富集的详细信息及统计学意义见附录2:数据集S2。简单地说,常见的DEG富集于水通道蛋白TIP、过氧化物酶、几丁质酶、漆酶、hsp70、木糖转移酶或脯氨酸脱氢酶的KO通路和Pfam中富亮氨酸重复(LRR)蛋白,蛋白质酪氨酸激酶,铜氧化酶,过氧化物酶,hsp70,纤维素合成酶,扩展蛋白等。当我们分析COG通路(丝氨酸/苏氨酸蛋白激酶、富亮氨酸重复序列(LRR)蛋白、细胞色素P450、铜氧化酶、MIP、水通道蛋白等)时,类似的通路被富集。
为了了解普通野豆科植物对干旱胁迫的适应性反应,我们分析了耐旱和敏感品系间差异调节的基因和通路。在缺水条件下敏感和耐受的候选材料中,共有5478个基因表达差异,在干旱条件下有5999个基因表达差异,在两种条件下均有2646个DEGs表达差异(图4)。3.c).常见的DEGs富集于生物过程GO中,直接参与纤维素和氧脂素生物合成过程以及植物型过敏和防御反应。质膜及其组成成分、胞外区、胞外区和细胞壁是GO细胞成分较多的。富集氧化石墨烯的分子功能是血红素和铁离子结合,氧化还原酶和单加氧酶活性(图。3.d). GO、KO、Pfam和COG通路的详细功能富集见附加文件2:数据集S2。
总的来说,通过对两种不同附加条件下灌溉和干旱条件下基因表达的比较分析,可以确定常见的干旱响应候选基因。此外,在灌溉条件下(差异基础表达)和干旱条件下(差异干旱反应),分析耐受性和敏感性材料之间的差异基因表达,使我们能够识别潜在的负责抗旱性适应机制的基因。
干旱响应候选基因的差异表达:qRT-PCR的验证和表达分析
为了验证微阵列结果的可靠性,我们选择了14个基因(表S2),分析了它们在灌溉和干旱条件下耐受和敏感资源中的表达。VsGAPDH和VsUBC表达稳定,被选为内控基因。定量实时PCR (RT-qPCR)数据与微阵列数据的比较显示统计学相关性(r = 0.83),表明数据一致(附文件3.:图S3)。
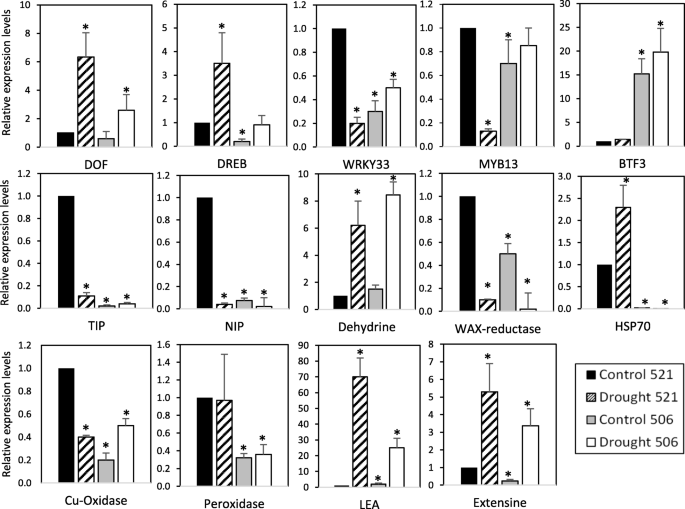
RNA-seq分析表明,许多基因的表达不仅在干旱条件下发生了变化,而且在耐旱和敏感基因型之间也发生了变化。在这些DEGs中,我们选择了14个转录本进行qRT-PCR分析(图。4).我们选取了其他物种中参与非生物胁迫应答的5个转录因子(VsDOF-like, DREB-like, WRKY33-like, Myb13, BTF3-NAC基因)[3.,21].我们还分析了水通道蛋白(NIP和tip型)、ABA响应LEA-5和脱水蛋白的表达,这些已被报道与耐旱性有关[22,23和直接参与氧化还原稳态的蛋白质,如过氧化物酶25和铜氧化酶- l -抗坏血酸氧化酶。我们的分析还包括Extensin-1、伴侣HSP70或蜡生物合成脂肪酸还原酶(FAR),它们在拟南芥中显示受干旱调节[24].
正如预期的那样,在干旱条件下,耐受和敏感的植物中都诱导了同源的TFs DOF、DREB和BTF3的表达。然而,两种材料之间的重要差异被观察到,也在未经处理的植物中。值得注意的是,转录因子WRKY33和myb13在521加入时被抑制,而在506加入时被诱导。脱水酶、HSP70、LEA和Extensin-1同源蛋白在干旱条件下也有诱导作用,但两者有差异。521株水通道蛋白TIP和NIP在干旱处理后被抑制,506株水通道蛋白仍处于低表达水平。过氧化物酶25在506和521植物中表达也有差异,但在干旱条件下没有诱导。最后,cu -氧化酶- l -抗坏血酸氧化酶在敏感亲本中被诱导,在耐受亲本中被抑制,蜡-生物合成- far在干旱条件下被抑制,HSP70在干旱条件下被诱导,但在耐受亲本中表达量较高(图5)。4).这些结果表明干旱的遗传响应存在复杂的网络,并指出不同基因型之间存在复杂的差异调控。
空气结构和根茎结构在干旱的响应中都起着重要作用,表现出不同的分子和生理机制来对抗这种胁迫。为了更详细地研究基因在这些器官中的表达调控,我们分别分析了所选基因在根和地上部分的表达。为了将分析扩展到之前描述的对干旱耐受或敏感的其他基因型,我们还包括并分析了我们工作中描述的这些基因型的基因表达。我们没有观察到耐旱品系521和284、敏感品系502和506之间的DEG水平有显著差异,这表明耐旱品系的基因表达和表型差异之间存在相关性3.:图S4)。然而,在一些基因中已经观察到特定的组织相关表达行为。干旱后LEA的诱导作用在地上部比在根茎部更为明显。水通道蛋白尖在地上部分被抑制,但在根部被诱导。耐旱材料中HSP70的诱导作用在根系中强于在地上部分。Peroxidade25的表达在地上部分保持不变,仅在根中有差异。这些差异的部分原因是这些基因以组织特异性的方式表达,以及基因表达在被分析器官中的不同调控机制的作用。正如预期的那样,一个复杂的场景已经被打开来解释在不同组织和不同耐旱性的材料之间的基因表达差异,这表明对干旱的遗传反应是一个复杂和多方面的网络。
潜在干旱响应基因变异的鉴定:snp和SSRs
RNA-seq已被证明是一种准确、可重复和高通量的方法,用于识别遗传变异,如snp和SSRs,特别是在基因组资源不可用的非模式物种中。该策略非常有用,可以预测与感兴趣性状相关的qtl,并使用标记辅助选择(MAS)策略[25].
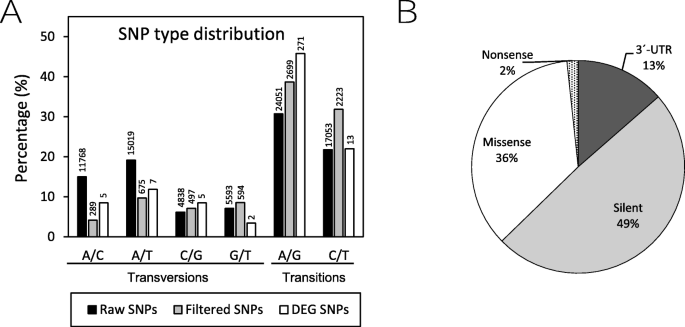
利用HaplotypeCaller挖掘转录组序列中的SNPs标记。在第一种方法中,32,874个unigenes中检测到78,322个SNPs。为了在后续分析中获得高置信度的结果,在每个群体中至少60%的个体的基因型和基因分型中都存在的位点采用了严格的SNP筛选标准,排除了两个群体中较小等位基因频率(MAF) < 0.05的SNP或具有两个以上等位基因的多态位点(可能是人工产物或测序错误)。过滤后得到4230个unigenes中的7246个高质量SNPs。因此,大约6.6%的vetch转录本含有SSR序列。转捩和跃迁频率(图。5A)与在其他植物物种中观察到的相似[26].识别位于cds中的snp对于与具有经济价值的相关农艺性状关联至关重要。为了建立耐旱亲本和干旱敏感亲本之间的差异基因表达与潜在功能标记的存在之间的相关性,我们用高严格的标准分析了DEGs中snp的存在。在36个差异表达的转录本中共发现59个SNPs(67.8%转化/32.2%倒置),差异有统计学意义。在这59个snp中,在3 ' -UTR区域发现了8个变化,在预测开放阅读框中发现了51个变化(29个沉默突变;21个错义突变和1个无意义突变)。具体数据和频率的详细信息见表3.和无花果。5b).编码区非同义snp的百分比与其他真核生物研究中发现的比率相当(见[27])。值得注意的是,这些非同义snp中的一些与非生物胁迫反应、氧化还原和渗透稳态的维持、根系发育光合作用和重要调控蛋白作为转录因子和信号激酶的基因具有潜在同源性(表2)3.).
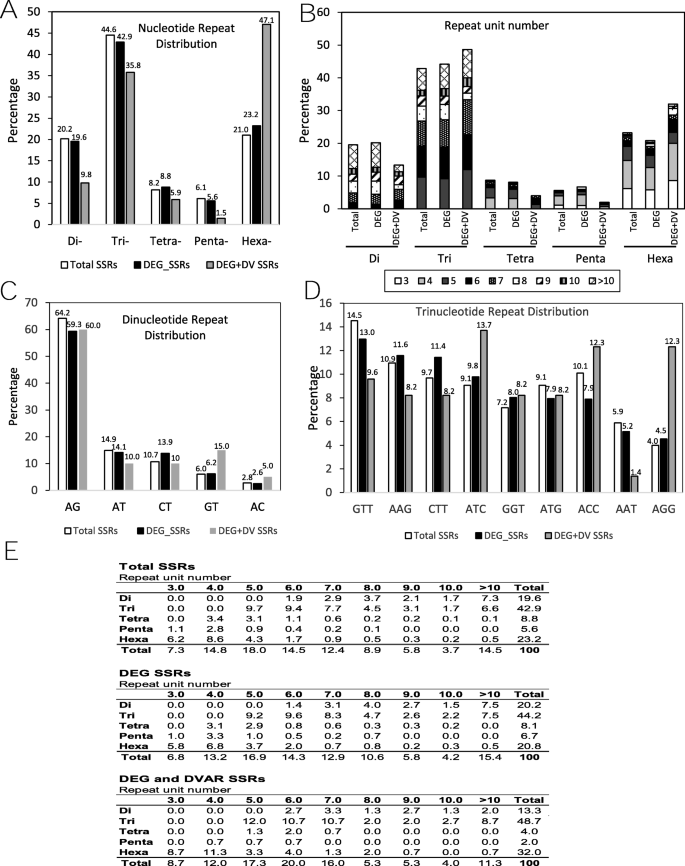
SSRs是一种在MAS、品种鉴定和遗传定位等过程中具有重要应用价值的分子标记。利用HipSTR算法,对2个材料的63,878份基因型转录本进行SSR检索。5642份(8.8%)转录本中共鉴定出6848个SSRs。已识别的SSRs的基序长度从1到6 bp不等。SSR基序数据分析显示,三核苷酸(32.3%)和单核苷酸(24.5%)的重复序列最为丰富。二核苷酸、四核苷酸、五核苷酸和六核苷酸重复序列分别占SSRs总数的14.4、6.1、4.1和18.2%。这些频率,不包括单核苷酸重复,如图所示。6a及b。这些数据与分析其他豆科植物种类所得的数据相似[25,28].分析了最丰富的二核苷酸和三核苷酸动机的频率(图。6c和d)。在总ssr、差异转录本中的ssr (DEG-SSRs)和差异转录本中的ssr (DEG-SSRs)以及不同品种或品种之间的差异(DEG-DV-SSRs;无花果。6c, d).动机和单元数的完整数据分布如图所示。6e。
在52个不同的转录本中(DEG-DV-SSRs)发现了54个SSRs,这些转录本在不同的来源中具有多态变异(DEG-DV-SSRs),并呈现出不同的遗传表达,对它们的比较分析表明,它们存在于编码调控蛋白的转录本中,如信号转转酶或激酶、参与非生物胁迫的tf (WRKY、MAC、myb和bHLH家族成员)、激素反应基因、伴侣基因、以及与光合作用和氧化还原稳态直接相关的蛋白质4).
在干旱条件下耐受和敏感品系中差异表达的基因编码序列中存在的SNPs和SSR标记可以促进标记辅助选择,因为这些标记可能与功能基因相关,具有成本效益,并且易于转移到相关物种进行保护。未来的分析应该描述这些标记在预测干旱等相关性状的未来策略中的潜在价值,或加快寻找耐旱品系的育种计划。
为了验证本研究中识别的SSR/SNPs,设计了10对引物来测试包含假定SNPs的片段的扩增,10对引物来验证SSRs(分别为表S3和表S4)。10个snp中的7个和10个SSR中的7个提供了预期片段大小的单个扩增子(附加文件3.:图S5)。未来的研究可能验证这些分子标记作为抗旱性相关标记的功能。
讨论
全球人口增长和气候变化给作物改良带来多重挑战。在这种情况下,更好地理解干旱反应机制和相关性状对于有效地缓解缺水条件下的作物生长至关重要。以往的研究证实,耐旱性是一种高度复杂的性状,受多种基因控制。在这种情况下,了解植物在分子水平上对干旱胁迫的反应对开发在缺水条件下表现良好的改良基因型至关重要。探索作物遗传资源的生物多样性是鉴定耐旱性材料的重要工具。种质库收集和维护包括当地品种或地方品种、商业栽培品种、杂交品种和相关野生物种的遗传多样性。然而,使用这些收集的主要限制是缺乏性状分析数据,这对于分析它们的遗传多样性、识别潜在的有价值的性状和选择当地的育种或农民直接使用是必不可少的。随着新的基因组方法的发展,基因分型正变得高效和廉价。NGS技术允许进行大规模筛选,以确定环境相关的新基因和遗传途径[29].编码区标记的开发可能使相关农艺重要性状的qtl标记成为可能[30.].尽管基因组资源在生态和经济上具有重要的意义,但它仍然严重缺乏诉漂白亚麻纤维卷这限制了该作物改良的进展和在分子水平上集合的特征。因此,获取高质量的基因组信息对于了解理想农艺性状的分子机制至关重要。此外,更好地整合基因型和表型数据将有助于开发用于预测维科植物性状的基因组工具。此外,了解环境适应的遗传基础,对于气候变化条件下植物遗传资源的合理保护和利用至关重要[31].
在这项工作中,我们开发了两种植物基因型的转录组从头组装和基因注释:耐旱和干旱敏感型及其干旱反应。我们的研究结果不仅有助于理解与干旱相关的分子机制,而且有助于了解与干旱相关的形态学、生理和生化变化。
耐旱品种的气孔导度高于敏感品种。耐受性树种的蒸散发速率较低,活性氧产生较多,尤其是在干旱条件下。这些数据表明,黄豆科植物的耐胁迫能力可能是由于气孔关闭的改变和气孔活性氧生成动力学介导的蒸腾速率降低所致。
详细了解植物分子对环境胁迫的响应,对于培育耐胁迫作物至关重要。两组主要的干旱诱导基因被确定为一般调控基因[32].第一组蛋白质主要涉及抗应激能力,包括抗冻蛋白、渗透生物合成酶、关键水通道蛋白、糖和脯氨酸转运蛋白、解毒酶、伴侣蛋白和胚胎发育晚期丰富蛋白(LEA)。第二组包括调控蛋白,如转录因子、蛋白激酶和磷酸酶以及其他信号分子。转录因子(TF)在干旱信号通路中的基因表达控制中起着至关重要的作用,因为转录因子可以高效、快速地调控多个基因的表达,并可能构成复杂的基因网络[32].这些干旱反应途径大多在拟南芥中有特征。然而,主要的调控机制在其他作物中是保守的。我们的转录组学分析显示了野豆科植物对干旱的保守反应机制。许多与干旱反应有关的信号丝氨酸/苏氨酸激酶、磷酸酶和TF家族成员在干旱条件下也被解除调控。我们还证实了一些基因(DOF, DREB, WRKY33, MYB13和BTF3)的干旱响应是通过组织特异性的方式调节的。最重要的是,这些基因在耐旱材料和敏感材料之间表现出不同的调控作用,表明它们在适应或耐受干旱条件方面发挥着重要作用。类似的行为也被观察到在一些水通道蛋白,脱水和其他LEA蛋白的表达,特别是在根。这些基因的表达在一些物种中受到调控,以应对干旱或ABA [22,23].综上所述,这些结果表明了普通野豌豆对干旱的遗传反应的复杂网络,指出不同基因型之间通过基因表达调控机制的不同作用对组织特异性方式的差异调控。在这篇稿子的准备过程中,在体外聚乙二醇(PEG)处理后的普通野豌豆的转录组学工作已经发表。聚乙二醇处理部分模仿了干旱的效果。虽然这些治疗的实施条件与我们的工作中提出的条件不相比较,但一些基因和激活途径与我们的研究中确定的相似。在这两种分析中,相关氧化石墨烯生物过程类别的转录富集,如“氧化还原酶活性”、“氧化还原过程”、“代谢过程”、“细胞壁修饰”或“碳水化合物代谢过程”[33].
传统的作物选择方法是提高作物的耐旱性和产量,但基于表型分析的抗旱性选择是复杂的,受环境变化的影响很大。我们的功能和遗传信息的整合有助于开发耐旱性预测的基因组工具,使其潜力用于未来的战略,以加速育种计划,并发展预测基因型和表型分析,进一步用于基因库。类似的预测策略已成功应用于其他豆科植物[34,35,36].必须进行进一步的分析,以验证该工作中已识别的多态变异作为干旱预测工具的潜在用途。
结论
本研究有助于了解与干旱胁迫相关的基因和分子机制。此外,我们还鉴定了100多个潜在的干旱相关多态性,即snp或SSRs,它们在干旱和耐旱基因型中存在不同。对这些多型变异的分析,作为性状预测的分子标记,将通过筛选与植物抗旱性、适应性或产量相关的作物种质收集,为未来的工程策略开发基因组工具。此外,根据不同的环境背景,特别是在适应气候变化的背景下,基因库集合的基因组特征将增加它们在农业和育种部门的价值。
方法
植物材料
植物材料的原始来源(野豌豆属漂白亚麻纤维卷本研究使用的是西班牙国家植物遗传资源中心(CRF),隶属于国家农业和食品研究与技术研究所(INIA)。这些材料存放在公开的CRF-INIA种子库中。关于植物材料的正式鉴定、原始来源、护照数据和加入号的所有数据都可以在以下网站获得http://webx.inia.es/web_inventario_nacional/Introduccioneng.asp.我们对该核心收集的普通野豆科植物进行了与干旱响应相关的参数分析,包括叶绿素含量、叶片颜色、覆盖温度、表皮蜡含量、残余呼吸和比重[16].这些数据使我们能够选择对干旱条件反应良好的候选者。经田间筛选,基因型号为284、510、521为耐旱品种,基因型号为502、506、545 (Verdor,商品型)为干旱敏感品种。附件沉积编号为:BGE037817;BGE005449;BGE004375;BGE014897;BGE022207和Verdor。在这项工作中使用的代码之间的对应关系,在CRF收集和在国家库存:284/NC081023-BGE037817;502 / NC010040-BGE005449; 506/NC013296-BGE004375; 510/NC018857-BGE014897; 521/NC043873-BGE022207 and 545-Verdor commercial variety.
田间生长条件及气孔导度测定
在本研究中,普通野豌豆在田间生长仅用于种子扩增和气孔导度测量。马德里“Finca La Canaleja”(602米;40°30 ' 54“N / 03 18°42”W)。该地区的气象条件是年平均降雨量420毫米,日平均气温13.7℃。该地块土壤特征:钙质、壤土、中碱性(pH 8.4)、有机碳(0.6%)、碱饱和(100%)。2016年10月至2017年6月的平均降雨量为203毫米和2018年同期的374.4毫米。在这些分析中,没有收集野生样品,并根据地方、机构、国家和国际立法进行了现场研究。
在2017年4月的上午10时至下午12时,在没有云或风的晴天,50%的植物开花,每接10株,每株在第一片展开的叶子上有5片叶子,并在4周后的2017年5月,50%的植物完全形成荚体时,在田间测量气孔行为。这些测量在2018年4月至5月以同样的方式进行。气孔导度(mmol m−2年代−1)在连续几天内使用稳态叶片孔隙计(SC-1, Decagon-Devices, LabFerrer,西班牙)重复进行。
温室种植条件
对温室条件下生长的植物进行了气孔孔径、气孔指数、活性氧(ROS)测定、失水率测定、转录组学分析以及色素、渗透液和表皮蜡的分析。在温室(22±1°C)光照16 h /暗光8 h条件下,盆栽(直径15 cm)有土栽培。
对于干旱处理,浇水一周的植物,然后在温室中额外生长三周,不需要额外浇水。实验至少重复了四次。
气孔孔径生物测定、气孔指数和活性氧测定
根据Del Pozo和Ramirez-Parra之前的描述,气孔测量方法得到了发展[37].4株温室生长的周龄植物叶片在含50 μM氯化钙的缓冲液中孵育2, 10 mM KCl和10 mM MES/KOH (pH 6.10)缓冲液。为了诱导气孔的打开,叶片的后表皮条状物在光照下孵育3h。在Axioskop2 plus显微镜(蔡司)中拍摄了来自5个不同叶片的至少100个细胞,并使用ImageJ NIH软件进行处理。对于气孔指数和细胞密度的计算,分析了至少500个总细胞。ROS的产生是使用二乙酸荧光素(CFDA)检测的,基本上与Miao等人之前描述的一样。[38].表皮组织在含10 μM CFDA的50 mM Tris-ClH (pH 7.2)缓冲液中孵育10 min。在Axioskop2 + epifluorescence显微镜(Zeiss)中进行检测,并使用Quantity One (BioRad)进行分析。
失水率的测定
根据Del Pozo和Ramirez-Parra [37].对28日龄植株的离体地上部分立即称量(FW,鲜重)。为了估算干燥重量(DesW),植物被放置在实验室条件下(22°C和相对湿度45%),并在指定的时间称重。植物被烤箱干燥(65°C) 2天,以达到恒定的干重(DryW)。叶片WC(含水量)的百分比计算为100 ×(脱水-干燥)/(FW -干燥)。
颜料、渗透剂和表皮蜡的测定
为了测定这些成分,我们使用了温室植物4周的叶子。根据Arnon的描述,在丙酮萃取后分光光度法测定叶绿素含量[38].采用Wade等人的酸化甲醇法从植物中提取花青素。[39].渗透水平的量化如上所述[37].简单地说,总可溶性糖是用蒽酮试剂测定的,正如Yemm和Willis所描述的[40].按照Bates等人描述的方法量化游离脯氨酸水平。[41].如Ebercon等人所述,使用玻璃小瓶测定表皮蜡含量。[42].
用于转录组分析的RNA提取和文库构建
根和地上部分采集自4个不同的4周大的温室植物(如前所述,经过水控制或干旱处理)。试验一式三份。在RNA提取之前,将同等重量的材料汇集在一起。使用Trizol (Invitrogene)和植物RNA提取试剂盒(Omega)提取总RNA。RNA的质量和数量已经在Bioanalyzer 2100和Qubit 3.0中确定。文库制备从10 μg总RNA中分离出Poly(A) + mRNA片段,根据Illumina的建议获得cDNA文库。采用TapeStation 4200高灵敏度法对文库质量进行分析;用实时荧光定量PCR法测定LightCycler 480 (Roche)的文库数量。使用Sistemas genomics icos测序设备(Valencia, Spain)在Illumina HiSeq 2500测序仪(3个流式细胞)中对12个文库进行配对测序(100 × 2)。
转录组测序的数据分析:从头组装和功能注释
使用FASTQC工具检查原始数据的质量[43].使用FastqMcf [44),内部脚本。序列用绿洲组合[45不同的K-mer大小。将来自Oases的最佳组合与Cap3 [46].由最佳N50 [47].
功能注释方面,转录本序列用BLASTN和BLASTX进行注释[48]针对非冗余核苷酸序列(Nt),从国家生物技术信息中心(NCBI),生物系统数据库[49和RnaCentral [50,以及反对Uniprot [51],其截断e值为0.001和内部清除同源性差的序列的脚本。为了进行功能分配,我们使用了以下公开的蛋白质数据库:蛋白质家族(Pfam)、基因本论(GO)、真核原系蛋白质组(KOG)和京都基因与基因组百科(KEGG)。12个文库的测序、转录组组装、基因预测和注释结果合并为一个文库。最后,从不同样本和处理的测序中获得的reads被映射并与使用Tophat2 v2.1.0新创建的从头组装库进行比较[52],用Samtools清理低质量的读取[53]和皮卡德工具(http://picard.sourceforge.net).分别采用HTSeq-count 0.6.1p1和DESeq2方法进行基因量化和差异基因表达[20.].
差异表达分析和功能富集
为了验证不同的生物重复,考虑到使用统计软件R[主成分分析归一化的完整转录组,分析来自不同样本的数据的距离和相关性[54].不同样本间的差异表达研究采用基于python和R的统计软件进行分析。差异表达分析采用DESeq2算法[54],使用负二项分布来确定统计显著性。在本分析中,|Fold Change|≥2和阈值FDR与校正的异构体P-值小于0.05的指定为差异表达。对于DEGs的功能富集分析(GO和KEGG),在获得的blastx结果中应用Uniprot和COG数据进行超几何测试。设定阈值为FDR,校正后的p值< 0.05,判定一个功能类别具有统计学意义。
实时定量PCR分析
根据转录组学分析(4周龄温室植物)提取的RNA样本用于cDNA合成。用高逆转录酶试剂盒(Biotools)进行逆转录。应用生物系统ABI 7300系统和FastStart DNA Master SYBR Green I(罗氏)用于实时定量RT-PCR。甘油醛-3-磷酸脱氢酶的浓度(VsGADPDH)和泛素(VsUBC)的基因水平用于归一化,因为在转录谱和经验对照数据中表达相对稳定。来自两个独立实验的数据进行了三次重复。序列引物见表S2。
新变种的鉴定
为了进行变异分析和snp识别,我们使用了GATK HaplotypeCaller v4.0.2.1,应用了基因组分析工具包(GATK)高通量测序数据中变异发现的最佳实践的默认设置标准。MatrixEQTL用于检验基因型和基因表达之间的相关性,使用线性回归或相加或方差分析基因型效应。
为了从组装的转录本和差异表达的转录本中识别假定的SSRs,我们使用了算法HipSTR,这是一种新的基于单倍型的方法,用于从Illumina测序数据中稳健的基因分型和分期STRs (https://hipstr-tool.github.io/HipSTR)的序列寻找完美的单核苷酸,二核苷酸,三核苷酸,四核苷酸,五核苷酸和六核苷酸基序至少有三个重复。
统计分析
使用Excel外接的Real Statistic包对数据进行统计分析。单因素或双因素方差分析结合Tukey-HSD检验用于检验多个样本之间的差异(p< 0.05)。
数据和材料的可用性
在当前研究期间生成和/或分析的数据集包含在附加表中。
缩写
- 阿坝:
-
脱落酸
- 英国石油公司:
-
生物过程
- 答:
-
蜂窝组件
- CFDA:
-
Carboxifluorescein二乙酸
- 排名:
-
叶绿素
- 齿轮:
-
同源基团的簇
- CRF:
-
植物遗传资源中心
- 度:
-
差异表达基因
- DesW:
-
干体重
- DryW:
-
干重
- GADPDH:
-
GlycerAldehyde-3-Phosphate-DeHydrogenase
- 走:
-
基因本体论
- KEGG:
-
京都基因和基因组百科全书
- KOG:
-
真核生物蛋白质的同源基团
- 李:
-
晚期胚胎发育丰富
- 远程雷达:
-
富亮氨酸重复
- MAS:
-
分子标记辅助选择
- MF:
-
分子功能
- NCBI:
-
国家生物技术信息中心
- 挂钩:
-
聚乙二醇
- 包含了:
-
蛋白家族
- RNA-Seq:
-
RNA-sequencing
- ROS:
-
活性氧种类
- 单核苷酸多态性:
-
单核苷酸多态性
- SSRs:
-
简单序列重复
- 哥伦比亚大学:
-
Ubiquitine
- WCs:
-
水含量
参考文献
- 1.
植物遗传学。找到应对干旱的根源。科学。2008;320(5873):173。
- 2.
Osakabe Y, Osakabe K, Shinozaki K, Tran LS。植物对水分胁迫的响应。植物科学,2014;5:86。
- 3.
Shinozaki K, Yamaguchi-Shinozaki K.与干旱胁迫反应和耐受性有关的基因网络。实验学报2007;58(2):221-7。
- 4.
王晓燕,王晓燕,王晓燕。干旱胁迫下高等植物光合作用和抗氧化代谢的响应。植物生理学报,2004;29(4):369 - 369。
- 5.
陈文杰,朱涛。转录因子在环境应激反应中的作用网络。植物科学进展2004;9(12):591-6。
- 6.
Dani KG, Jamie IM, Prentice IC, Atwell BJ。植物物种特异性光呼吸速率、耐旱性和异戊二烯排放速率。植物信号行为学报2015;10(3):e990830。
- 7.
Sofo A, Dichio B, Xiloyannis C, Masia A.橄榄树叶片和根部脂氧合酶活性和脯氨酸积累对干旱胁迫的响应植物化学学报。2004;121(1):58-65。
- 8.
黄艳芳,高晓林,南志斌,张志祥。野豌豆的潜在价值(野豌豆属漂白亚麻纤维卷L.)作为动物饲料:综述。中国生物医学杂志2017;101(5):807-23。
- 9.
Abdin OA, Zhou X, Cloutier M, Coulman MA, Faris MA, Smith DL:短季玉米覆盖作物和行间作除草(玉米中国农学杂志,2004,12(5):563 - 566。
- 10.
马蒂奇R,内格尔S,柯比G. http://keys.lucidcentral.org/keys/v3/pastures/Html/Common_vetch.htm。2008.
- 11.
De la Rosa L, Marcos T, González J. Análisis De la varibilidad genética en poblaciones locales De veza (),马尔卡多雷斯的中间人morfológicos y bioquímicos。园艺学报2008;51:75-6。
- 12.
De la Rosa L, González JM。西班牙地下紫薇科植物种子蛋白质的遗传多样性(野豌豆属漂白亚麻纤维卷l .无性系种群。amphicarpaDorthes Asch。& Graebn)。作物学报2010;57:565-73。
- 13.
De Andrés E, Zambrana E, Cadorniga C, Martín D, Marcos T, De la Rosa L, Tenorio JL: Estudio De caracteres De sistencia a la sequía en la colección activa De野豌豆属漂白亚麻纤维卷L del CRF-INIAacas de la Asociación Española de leguminosa2008年,3:124 - 125。
- 14.
新一代测序平台在植物基因组学和遗传变异发现中的应用。动物育种,2010;25(4):553-70。
- 15.
董锐,董东,罗东,周强,柴晓,张杰,谢伟,刘伟,董燕,王燕,等。转录组分析发现豆荚腹缝线中涉及候选豆荚破碎相关基因(野豌豆属漂白亚麻纤维卷l .)。植物科学进展2017;8:649。
- 16.
刘铮,马琳,南智,王赟。比较转录谱分析为研究植物的左右花的进化和发育提供了新的思路野豌豆属漂白亚麻纤维卷(Papilionoideae)。科学通报,2013;8(2):e57338。
- 17.
Valentovic P, Luxov M, Kolarovic L, Gasparikovs O.渗透胁迫对两个玉米品种相容性溶质含量、膜稳定性和水分关系的影响。植物土壤环境,2006;52:186-91。
- 18.
哈伯德KE,西村N,仁美K,盖佐夫ED,施罗德JI。早期脱落酸信号转导机制:新发现的成分和新出现的问题。基因学报2010;24(16):1695-708。
- 19.
Cutler SR, Rodriguez PL, Finkelstein RR, Abrams SR.脱落酸:核心信号网络的出现。植物学报2010;61:651-79。
- 20.
Anders S, Pyl PT, Huber W. HTSeq——一个用于处理高通量测序数据的Python框架。生物信息学,2014,31(2):166 - 9。
- 21.
干旱响应的转录调控:一个曲折的转录因子网络。植物科学进展2015;6:895。
- 22.
魏鑫,金鑫,Ndayambaza B,闵鑫,张铮,王赟,刘伟。干旱胁迫下普通野豌豆水通道蛋白基因家族的转录组全特征及功能鉴定。DNA细胞生物学2019;https://doi.org/10.1089/dna.2018.4562.
- 23.
赵萍,刘萍,袁刚,贾静,李旭,祁东,陈松,马婷,刘刚,程磊。全球绵羊草基因表达变化研究对干旱胁迫响应的新认识(羊草).植物科学进展2016;7:954。
- 24.
Des Marais DL, McKay JK, Richards JH, Sen S, Wayne T, Juenger TE。拟南芥不同品种对土壤干燥响应的生理基因组学研究。植物学报,2012;24(3):893-914。
- 25.
考尔S, Kimber RB, Cogan NO, Materne M,福斯特JW,保罗JG。蚕豆SNP的发现和高密度遗传定位(蚕豆根尖L.)可以鉴定抗蛇形菌枯萎病的qtl。植物科学,2014;217-218:47-55。
- 26.
杜燕,罗松,李旭,杨杰,崔涛,李伟,余琳,冯辉,陈勇,穆杰,等。拟南芥碳离子束辐照诱导的取代和小插入缺失的鉴定。植物科学进展2017;8:1851。
- 27.
吴建军,曾锐。群体变异的分子基础:从snp到sap。中国生物医学工程学报(英文版)2012;
- 28.
考尔S, Pembleton LW, Cogan NO, Savin KW, Leonforte T, paul J, Materne M, Forster JW。对豌豆和蚕豆的转录组测序,以发现和验证SSR遗传标记。BMC基因组学,2012;13:104。
- 29.
Rokas A, Abbot P.利用基因组学进行进化洞察。生态学报2009;24(4):192-200。
- 30.
科拉德BCY,麦基尔DJ。标记辅助选择:21世纪植物精密育种的途径。Philos transr Soc. 2008; 363:557-72。
- 31.
王晓燕,王晓燕,王晓燕,等。生态基因组学的研究进展。中国生物医学工程学报,2013;14(11):807-20。
- 32.
王晓燕,王晓燕。干旱和寒冷胁迫下植物基因表达的调控网络。植物生物学杂志,2003;6(5):410-7。
- 33.
朱颖,刘强,徐伟,张军,王旭,聂刚,姚亮,王红,林晨。普通紫薇植物抗旱性相关基因的重新组装与发现。国际分子科学杂志2019;20(2):328。
- 34.
Annicchiarico P, Nazzicari N, Li X, Wei Y, Pecetti L, Brummer EC。不同参考群体苜蓿生物量产量基因组选择的准确性。BMC基因组学。2015;16:1020。
- 35.
Annicchiarico P, Nazzicari N, Pecetti L, Romani M, Ferrari B, Wei Y, Brummer EC:基于gbs的极端干旱条件下豌豆籽粒产量的基因组选择。植物基因组2017,10(2)。
- 36.
Tayeh N, Klein A, Le Paslier MC, Jacquin F, Houtin H, Rond C, chbert - martinello M, Magnin-Robert JB, Marget P, Aubert G,等。豌豆基因组预测:标记密度、训练群体大小和组成对预测精度的影响。植物科学进展2015;6:941。
- 37.
Del Pozo JC, Ramirez-Parra E.破译植物抗旱性的分子基础拟南芥同源四倍体。植物细胞环境学报,2014;37(12):2722-37。
- 38.
亚迪。分离叶绿体中的铜酶。多酚氧化酶在甜菜属.植物物理学报1949;24(1):1 - 15。
- 39.
Wade HK, Sohal AK, Jenkins GI。拟南芥ICX1是调控类黄酮生物合成基因的多个途径的负调控子。植物生理学报,2003;32(2):347 - 347。
- 40.
Yemm EW, Willis AJ。用蒽酮法测定植物提取物中碳水化合物含量。生物化学与工程学报,2003;27(3):369 - 369。
- 41.
贝茨LS,沃尔德兰RP,蒂尔ID。水胁迫研究中游离脯氨酸的快速测定。植物土壤。1973;39(1):4。
- 42.
高粱叶片表皮蜡含量的快速比色法研究。作物科学1977;17:179-80。
- 43.
FastQC:用于高通量序列数据的质量控制工具。可在以下网址下载:http://www.bioinformatics.babraham.ac.uk/projects/fastqc.2010.
- 44.
E.排序实用程序的比较。开放生物信息学杂志,2013;7:1-8。
- 45.
Schulz MH, Zerbino DR, Vingron M, Birney E. Oases:跨越表达水平动态范围的健壮的新生RNA-seq组装。生物信息学。2012;28(8):1086 - 92。
- 46.
黄旭,马丹。CAP3: DNA序列组装程序。基因组学报1999;9(9):868-77。
- 47.
Miller JR, Koren S, Sutton G.下一代测序数据汇编算法。基因组学。2010;95(6):315 - 27所示。
- 48.
Altschul SF, Madden TL, Schaffer AA,张杰,张Z, Miller W, Lipman DJ。gap BLAST和PSI-BLAST:新一代蛋白质数据库搜索程序。核酸学报,1997;25(17):3389-402。
- 49.
葛尔利,马彻勒-鲍尔,葛尔RC,韩林,何俊,何胜,刘超,史伟,布莱恩特。NCBI生物系统数据库。核酸Res. 2009;38(数据库问题):D492-6。
- 50.
RNAcentral-Consortium。一个国际性的ncRNA序列数据库。核酸学报2014;43(数据库issue): D123-9。
- 51.
UniProt:蛋白质信息中心。中国生物医学工程学报,2015,43:D204-D212。
- 52.
Trapnell C, Pachter L, Salzberg SL. TopHat:发现RNA-Seq的剪接连接。生物信息学,2009,25(9):1105 - 11所示。
- 53.
Li H, Handsaker B, Wysoker A, Fennell T, Ruan J, Homer N, Marth G, Abecasis G, Durbin R.序列对齐/地图格式和SAMtools。生物信息学。2009;25(16):2078 - 9。
- 54.
Stacklies W, Redestig H, Scholz M, Walther D, Selbig J. pcmethods—为不完整数据提供PCA方法的生物导体包。生物信息学。2007;23(9):1164 - 7。
确认
我们感谢G. Marco-Puche(西班牙Sistemas genomics icos)在从头测序的生物信息学组装和处理方面的帮助。
资金
实验研究的设计、Illumina测序、数据分析和稿件撰写得到了Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria, INIA[批准号AT2016-009]和西班牙政府MICIU [RTI2018-094037-R-I00]的支持。这些资助机构在研究的设计、收集、分析和解释数据以及撰写手稿方面没有发挥作用。
作者信息
从属关系
贡献
ERP、LDR和EZ构思了最初的研究计划;ERP、LDR和EZ进行了实验并对数据进行了分析。ERP和LDR起草了手稿。EZ对手稿进行了批判性的修改。所有作者阅读并批准了该手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:数据集S1。
Excel表格诉漂白亚麻纤维卷装配unigenes的Uniprot注释和功能分类赋值,以及GO、KEGG、Pfam和GOG术语。https://drive.google.com/open?id=153IX8pv-CxL6G4SDoKjP17WQ26FMeY9x
附加文件2数据集S2。
Excel表格包含不同实验条件下的DEG信息(干旱与对照,两种条件下的耐受与敏感变量)和功能富集分类的统计分析:GO, KEGG, Pfam和GOG术语。https://drive.google.com/open?id=1WnnFJTsmCVBGFvevDgQCOki7z0dz1e8l
附加文件3图S1。
对被鉴定为耐旱性(284、510和521在所有图表的直方图条上均为素色)和干旱敏感(502、506和545在所有图表的直方图条上均为装饰纬线)的作物的表皮蜡含量、根系和空气质量、渗透液水平和色素含量进行评估。一个。温室植物4周龄叶片的表皮蜡含量。B。4周龄温室栽培品种气部和根部重量。c - d。在对照条件和干旱处理条件下测定4周龄温室植物的可溶性糖(下图)和游离脯氨酸(上图)含量(3个试验;n= 10株/株)。E-F。色素含量:4周龄温室植物在对照或干旱处理下花青素含量(E)或叶绿素a和b含量(F)(3个试验;n= 20株/株)。a e。数值为平均值±标准差。用方差分析和Tukey HSD后验分析,不同字母表示差异显著。P< 0.05。图S2。通过转录组测序等tigs的大小分布。对低质量读进行修剪后的序列读的长度分布。图S3:从正常和干旱条件下耐旱敏感植物(4周龄温室栽培)的RT-qPCR数据和微阵列数据中选取15个基因的对数比(Fold change)散点图回归方程和相关系数r如图所示。图S4。不同野豆科植物抗旱基因的组织特异性基因表达。一个。以GADPH为标准基因进行耐受性和敏感性归一化,通过实时RT-PCR分析确定干旱响应和/或耐旱性候选基因的表达水平野豌豆属4周龄温室植物在干旱或浇水条件下的空中部分干旱植物(对照)。值为至少三次测定的平均值(±标准差)。B。与A中相同的测定方法,但在植物的根部。星号表示差异p< 0.05(学生测试)为对照耐受性植物。图S5。引物的设计用于扩增含有本工作中鉴定的一些snp (A)或SSRs(B)的PCR片段,使用6个相关的野豌豆资源。放大子大小为箭头所示。表S1。统计摘要诉漂白亚麻纤维卷转录组测序和组装数据。表S2。用于实时PCR定量分析的基因特异性引物。表S3。用于snp验证的基因特异性引物。表S4。用于SSRs验证的基因特异性引物。
权利与权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于本文
引用本文
De la Rosa, L., Zambrana, E. & Ramirez-Parra, E.普通野豌豆耐旱性的分子基础:设计新的分子育种工具。植物生物学20.71(2020)。https://doi.org/10.1186/s12870-020-2267-z
收到了:
接受:
发表:
关键字
- 野豌豆(野豌豆属漂白亚麻纤维卷l .)
- 干旱响应
- 遗传变异
- 分子育种
- 基因表达