摘要
背景
去除基叶被广泛应用,以增加葡萄簇的阳光曝晒,控制浆果腐烂和提高品质。研究其对葡萄果实中挥发性化合物的影响主要是在地中海或海洋气候地区进行的。目前还不确定在大陆性气候下种植葡萄浆果是否能达到类似的效率。本研究旨在分析干热气候地区阳光照射下葡萄果实挥发性化合物产量和转录组的变异,并提出与变异相关的关键基因。
结果
以天山北麓为研究区,采用辣椒玉米苗期基底叶去除、véraison (LR-V)叶片去除、véraison (LM-V)叶片移动和véraison (LR-V)半叶去除4种簇状日照暴露策略。不同的聚类暴露处理导致成熟葡萄果实中类甲异戊二烯和单萜的浓度下降。这两个β-胡萝卜素和叶黄素是甲异戊二烯类生物合成的底物。k -均值聚类分析显示,一些基因参与生物合成,如VviTPS55,VviTPS60,VviTPS66,VviCCD4a而且VviCCD4b在暴露的浆果中至少在一个测试阶段表现出较低的表达水平。两种具有水果属性的c6衍生酯己酸乙酯和乙酸己酯被明显还原。相比之下,在LR-V和lm - v处理的葡萄浆果中,主要C6醇化合物水平升高,这对应于表达上调VviLOXA,VviLOXO而且VviADH1在oxylipin通路中。暴露浆果和对照浆果中大部分差异表达基因富集于“胁迫反应”过程,这种转录组差异随着浆果成熟而积累。此外,LR-V处理显著上调了葡萄果实光合相关基因的表达,而LM-V处理则没有。
结论
在干热气候下的葡萄栽培中,集群阳光照射与在温带地中海或海洋气候地区获得的不同,导致了不同的挥发性靶向转录组和代谢反应。因此,应采取改良冠层管理来改善葡萄果实的香气。
背景
阳光是植物生长发育最重要的非生物因子之一。它可以转化为化学能,然后通过光合作用用于合成有机化合物;光照条件的改变会对葡萄果实的生长和化学成分产生显著影响[1].一些冠层管理措施,如叶片去除、集群间伐、葡萄培养和叶片移动,被广泛用于优化冠层小气候,允许不同的阳光照射,控制浆果产量,提高葡萄浆果和葡萄酒质量[2].在这些葡萄栽培实践中,最常见的是集群地带的叶片去除(也称为基基叶片去除),主要是因为它能够促进阳光照射和气流,以及减少叶片覆盖和疾病发病率[3.,4].研究还发现,人工去叶对葡萄和葡萄酒中的酚类和挥发性化合物有积极作用[5,6].
落叶一般在阳光充足、热量积累和雨量充足的凉爽地区进行[7].它通常是选择性地或完全地剥去束区周围的叶子,这种做法传统上是在结果后的某个时间实施,通常是在véraison [6,8].面对全球变暖以及葡萄浆果成熟对气候变化的敏感性,应调整在日照和热量适宜地区实施的葡萄栽培管理,以适应气候变暖[9].在一些日照强、干旱的地区,如西北葡萄酒产区,青果期葡萄去叶偶尔会导致葡萄浆果晒伤,甚至导致茎木化、褐化,导致葡萄浆果因营养缺乏而停止生长。此外,由于该地区气候干燥炎热,葡萄果实成熟进程总是加快。10,11].成熟期缩短还会导致酚类化合物缺乏,特别是花青素和酚类共色素(如杨梅素、槲皮素、儿茶素、表儿茶素)对气候条件的变化很敏感,会损害葡萄酒的颜色强度和稳定性[12].因此,在干热气候条件下,有必要调整葡萄丛日照时间。我们之前的研究表明,在véraison条件下,将葡萄簇暴露在阳光下直到收获,去除叶片或移动叶片可以显著提高黄酮类-3-醇的积累,并降低生长在中国西北部新疆天山北麓地区的葡萄浆果中花青素的浓度[5].本研究的目的是分析在干热气候地区暴露的葡萄果实中挥发性化合物代谢组和转录组的变化。
葡萄衍生的挥发性化合物在评估葡萄和葡萄酒的质量中起着最重要的作用。先前的研究已经报道了pre-véraison的基叶去除对单萜和类降异戊二烯积累的影响,这有助于麝香葡萄品种的香气和宜人的气味[8,13,14].此外,基叶去除会引起其他挥发性化合物的变化,如甲氧基吡嗪[4,15]、硫醇[16]和rotundone [17],在葡萄浆果中赋予植物、柑橘和黑胡椒的香气。事实上,阳光照射的时间和强度对葡萄浆果中产生的挥发性化合物有明显的影响。Kwasniewski等人观察到[14],仅在浆果结果(PBS)后33天开始的簇光照显著增加了总1,1,6-三甲基-1,2-二氢萘(TDN)和葡萄螺烷的浓度,而PBS后68天的叶片去除则降低了β-damascenone一代。此外,当所有基叶都被移除,使葡萄簇完全暴露在阳光下时,浆果会积累得更多β-大马酮和一些束缚型萜[6].与去除基叶方法相比,根尖脱叶方法暴露在簇状阳光下对葡萄酒挥发性化合物的影响最小,但会降低葡萄酒的酒精含量[3.].有限数量的研究处理了在葡萄果实发育早期通过去除叶片暴露在阳光下的葡萄浆果中挥发性C6/C9化合物的变化[6,18,19];然而,在véraison或成熟阶段叶片去除的影响尚不清楚。C6醛类和醇类可以产生典型的“绿色”气味,也称为“绿叶挥发物”(GLVs)。这些化合物是由植物组织的破坏或植物遭受生物或非生物胁迫后诱导产生的[20.].C9醛,特别是(E)-2-壬烯醛和(E,Z) 2,6壬二烯醛,有助于植物中的黄瓜风味[21].以前的研究也没有涉及葡萄浆果中挥发性苯衍生化合物的变化,这是由叶片去除引起的。这种化合物可赋予葡萄浆果及其相应的葡萄酒以花香和果香。22,23].了解葡萄挥发性特征的变化有助于全面评估在日照强烈和降雨少的地区,叶片去除如何有助于葡萄香气质量的改善策略。
去除叶片可能会消除果实从邻近叶片获得的潜在同化碳补充,而从簇周围移动叶片不仅可以保留光合器官,还可以增加簇的阳光照射。véraison去叶显著促进总花青素的积累,并上调相关基因的表达[24],但这种性能对挥发性化合物生产的影响尚不清楚。此外,先前的转录组学研究仅关注葡萄浆果生长早期簇日照的影响(E-L 29) [8],而葡萄浆果在véraison或成熟阶段对叶片移除或叶片移动的转录组反应尚不清楚。
在本研究中,采用4种聚类光照策略,包括辣椒玉米大小阶段的叶片去除(LR-PS)、véraison阶段的叶片去除(LR-V)、véraison阶段的半叶片去除(HLR-V)和véraison阶段的叶片移动(LM-V)。通过对挥发性代谢组和转录组数据的联合分析,阐明了这些集群阳光照射操作对葡萄浆果挥发性化合物产生的效率,以及潜在的机制。
结果
光照对丛丛区小气候和浆果理化指标的影响
与美国俄勒冈州等温带海洋气候地区不同[5,6],我们实验葡萄园的特点是干热沙漠气候,总日照时间2550-3500 h,降水量90-100毫米,葡萄生长季节(4 - 9月)蒸发量近1000毫米[5].不同的天气条件表明,相似的集群日照处理对葡萄浆果的化学成分和浓度有不同的影响。我们之前已经描述了团簇区周围小气候的变化,总可溶性固形物(TSS,o葡萄果实在日晒后的酸碱度(Brix)和可滴定酸度(TA) [5].在véraison左右,通过叶片去除(LR)、半叶去除(HLR)和叶片移动(LM),浆果集群周围的日温度略有升高(附加文件)1:图S1)。此外,这些阳光照射处理还使e - l35至e - l36期间的1天平均小时温度从10:00至19:00提高了约1.5°C。暴露群的日空气温度范围为15.9°C至32.7°C,而对照组的日空气温度范围为15.9°C至30.9°C。相应地,在发育过程中,改变暴露在阳光下显著增加了浆果簇周围的光合有效辐射(PAR)和太阳辐射(SR),并导致相对湿度(RH)的降低(附加文件)1:图S1)。与对照组不同,LR-PS和HLR-V处理降低了总可溶性固形物(TSS)约0.73和1.70o成熟期葡萄果实中TSS含量分别为白垩度,而LM-V和LR-V处理几乎不影响果实TSS含量。葡萄浆果中的可滴定酸(TA)含量也不受各种阳光照射处理的影响(附加文件)2:表S1)。
在阳光照射下挥发性化合物的变化
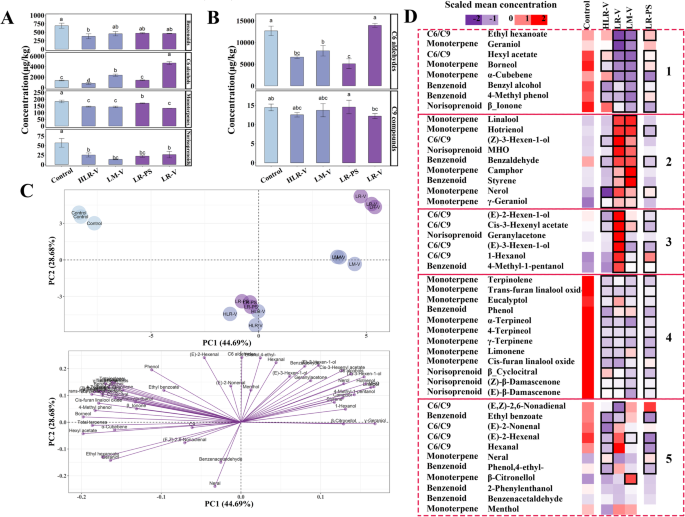
分别测定了游离和糖苷结合的挥发性化合物。我们发现大部分C6醇、苯类、甲异戊二烯类和单萜均以两种形式存在,但C6醛和C9化合物仅以自由形式存在。为了说明簇阳光照射对挥发性化合物积累的影响,我们决定总结每种化合物的自由和糖苷结合形式的浓度,结果如图所示。1.结果表明,与对照相比,只有HLR-V处理降低了挥发性苯的浓度,而其他阳光照射处理对挥发性苯没有统计学上的显著影响。在véraison进行的LM-V和LR-V处理均显著提高了C6醇的浓度,而HLR-V产生相反的影响(图2)。1a).还注意到,所有阳光照射处理都降低了成熟葡萄浆果中总类甲异戊二烯和总单萜的浓度(图。1a).除LR-V外,其他三种暴露处理均强烈抑制了C6醛的积累,如己醛和(E)-2-己烯醛,而成熟葡萄浆果中的C9化合物在任何测试的阳光照射处理中都没有改变(图。1b)。
采用主成分分析(PCA)对4个处理和对照组(3个生物重复)的挥发性化合物进行分析;目的是提供不同簇阳光照射对挥发性化合物的影响的概述(图。1c).第一(PC1)和第二(PC2)主成分占总方差的73.37%,其中PC1和PC2分别解释44.69和28.68%。PC1阴性得分高的对照组可以与PC1阳性得分高的LM-V和LR-V治疗明显分开。HLR-V和LR-PS处理均集中在PC2的负半轴和PC1的零轴附近,通过PC2与对照组区分。这些结果表明,对照组、LM-V/LR-V组和HLR-V/LR-PS组的挥发性化合物分布差异较大。然而,HLR-V和LR-PS亚群之间并没有明显的区别,这表明它们可能具有相似的成熟浆果挥发性特征。此外,两种全聚类暴露处理在véraison日照下也存在一定差异:LR-V处理位于PC2的正轴上,得分较高,LM-V处理接近PC2的零轴。相应的负载图反映了单个挥发性化合物的相对重要性(图2)。1c),热图聚类分析说明了各化合物的变化(图。1d).各挥发性化合物浓度如表S2所示。发现一些单萜类化合物(如芳樟醇、赤三烯醇、槟榔醇和槟榔醇)γ-香叶醇)和苯(苯甲醛和苯乙烯),以及6-甲基-5-庚烯-2-酮(MHO)和(Z)-3-己烯-1-醇集中在右上象限,这些成分在LR-V和lm - v处理的浆果中以相对较高的浓度存在,如图2的聚类所示。1d.相比之下,大部分单萜类化合物和去异戊二烯类化合物位于左上象限,与对照组的位置相对应,这表明这些化合物的含量高于阳光照射处理组(图1和图4的簇。1d).特别是簇1中所示的化合物,如己酸乙酯、香叶醇、乙酸己酯和β-ionone,显著低于对照组。此外,我们还观察到LR-V处理对聚类3中化合物的积累有积极影响(例如(E) 2-hexen-1-ol, (E)-3-己烯-1-醇和1-己醇),这导致lr - v处理的浆果中总C6醇浓度较高(图。1a).值得注意的是,在暴露的葡萄浆果中,簇5中的化合物浓度有所增加或减少(图。1d).因此很难解释这些成分的变化是否与簇暴露于光有关。
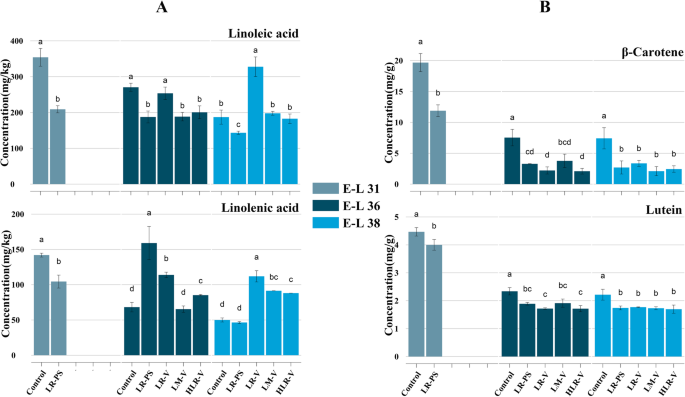
在成熟浆果中检测了两种类型的挥发性前体。通过脂氧合酶(LOX)-过氧化氢裂解酶(HPL)途径,亚油酸可裂解生成己醛、己醇及其衍生物,而亚麻酸可转化为己醛、己烯醇及其衍生物[25].在这项研究中,在E-L 38(成熟收获期),通过LR-V处理,亚油酸的浓度显著提高,在E-L 36和E-L 38阶段,亚麻酸的浓度显著提高(图2)。2a),这与LR-V处理后大多数C6化合物的显著增加相一致(见图3簇)。1D和己烷在簇5中)。β-胡萝卜素和叶黄素是葡萄浆果中两种重要的类胡萝卜素,可通过ccd裂解生成norisoprenoids。研究发现,在E-L 31、E-L 36和E-L 38阶段,两种前体的浓度在所有阳光照射的葡萄浆果中都有所降低。2b).结合去甲异戊二烯类药物浓度下降(图。1A),可以推断聚类暴露在阳光下会导致甲异戊二烯类生物合成的整体下调。
LR-V和LM-V处理的转录重编程
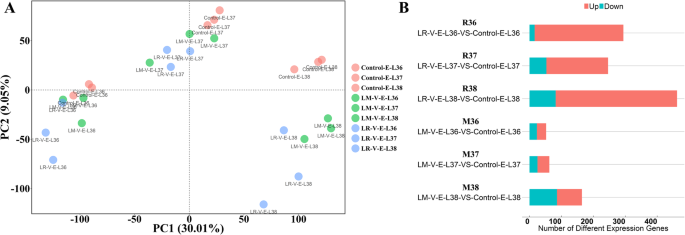
基于上述结果,LR-V和LM-V处理被证明显著改变了挥发性化合物的特征,以及本研究中检测到的一些挥发性前体的水平。为了解释véraison上由于集束阳光照射导致的挥发性化合物的变化,从转录组的角度,我们对成熟期E-L 36、E-L 37和E-L 38阶段的LR-V、LM-V和对照葡萄浆果进行了rna测序。总共有28940个基因被注释,然后根据它们的表达水平进行PCA分析。在E-L 36期,对照组与LV-R组和LM-R组无法明显区分(图2)。3.A),这表明在这些阶段基因表达谱的差异是有限的。然而,随着浆果的成熟,转录组差异逐渐增大。通过PC2可以将LM-V-E-L 38和LR-V-E-L 38处理与对照- e - l 38区分开来(图2)。3.a).这表明LM-V或LR-V处理对葡萄浆果的转录组具有累积效应。结果也通过比较差异表达基因(DEGs)的数量来证明。分别从E-L 36(缩写为R36和M36)、E-L 37(缩写为R37和M37)和E-L 38(缩写为R38和M38)的LR-V-vs-Control和LM-V-vs-Control 6个比较集中选择deg。在与LR-V-vs-Control相关的3组DEG (E-L 36, E-L 37和E-L 38)中,R38比较产生的DEG最多。同样,在三个发育阶段,与LM-V-vs-Control相对应的三组中,M38也有最多的deg(图3)。3.b).此外,在3个发育阶段(M36、M37和M38), LR-V-vs-Control组(R36、R37和R38)的deg含量均高于LM-V-vs-Control组。这可能是因为LR-V处理除了改善阳光照射外,还导致葡萄簇周围营养器官的损失。因此,葡萄浆果必须经历多次变化以适应新的生长条件。
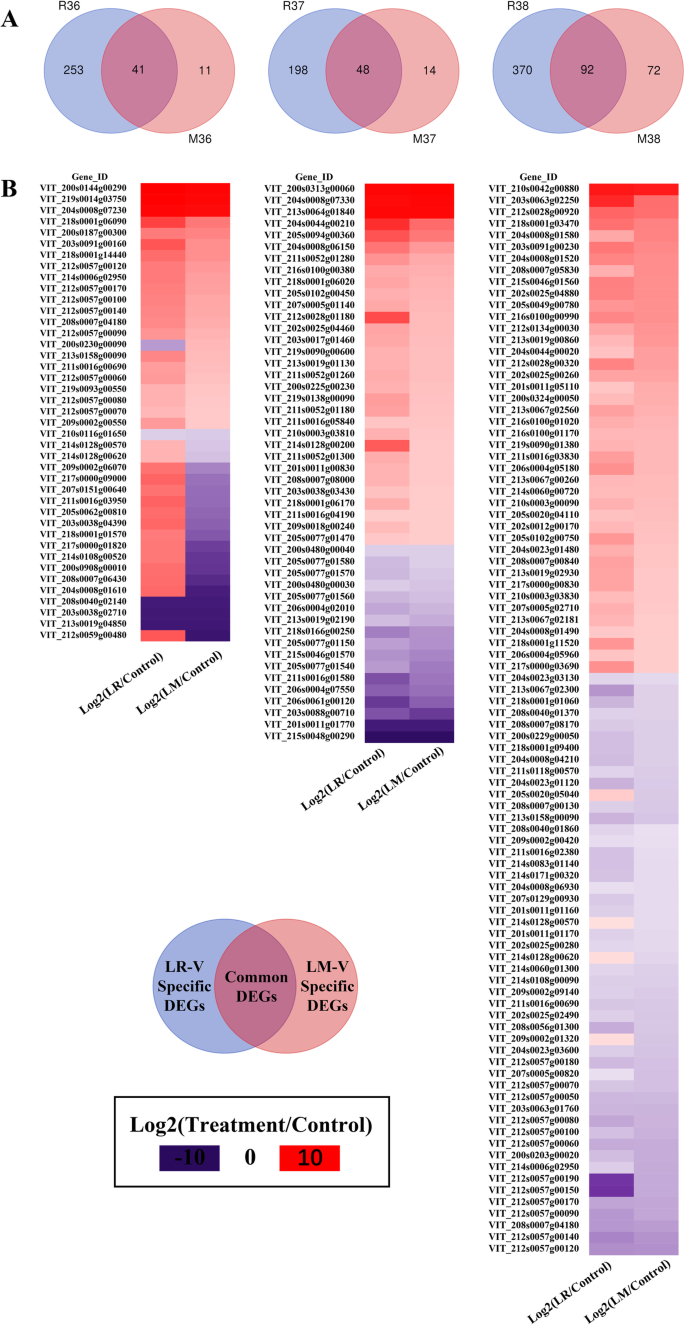
使用热图构建维恩图,以识别和探索在同一发育阶段LR-V-vs-Control和LM-V-vs-Control比较的共同和特定的deg。如图所示。4a,在e - l36、e - l37和e - l38位点上,常见的deg分别为41、48和92个,表明这些常见的deg与葡萄果实对阳光的响应密切相关。然而,在R36、R37和R38中有253、198和370个特异性表达基因,而在M36、M37和M38中有11、14和72个特异性表达基因。数字4b表明,大多数常见的DEGs在去叶(LR)和移叶(LM)处理中有相似的上调或下调表达模式。它们的功能注释进一步表明,大多数常见的DEGs参与葡萄浆果的成熟和胁迫反应(附加文件)4:表S3)。例如,4个编码木葡聚糖内转葡萄糖化酶/水解酶的基因(VIT_211s0052g01280、VIT_211s0052g01260、VIT_211s0052g01180和VIT_211s0052g01300)在e - l37位点均上调。此外,有5个致病相关基因(VIT_205s0077g01580、VIT_205s0077g01570、VIT_205s0077g01560、VIT_205s0077g01540、VIT_203s0088g00710)在e - l37位点大量下调。在e - l38期,编码小热应激蛋白(sHSPs)和二苯乙烯合成酶(STS)的基因也普遍上调。众所周知,sHSPs一直与植物的非生物胁迫耐受性有关[26的提高VviSTS表达可促进底物利用p-香豆酰辅酶a和丙二酰辅酶a [27]并增加二苯乙烯的生成。相当多的证据支持,二苯乙烯在植物受到生物和非生物刺激时可大量诱导[28,29].因此,我们认为这些编码sHSPs和STS的基因的上调可能是葡萄浆果对日照增加的反应的结果。然而,在m - v和LR-V浆果中,与e - l36生物和非生物刺激相关的一些常见的基因表达下调,例如编码胚胎发生晚期丰富蛋白(VIT_203s0038g04390、VIT_209s0002g06070和VIT_200s0908g00010)、小热休克蛋白(VIT_218s0001g01570和VIT_204s0008g01610)和发芽样蛋白(VIT_214s0128g00570和VIT_214s0128g00620)的基因。以前的报道指出,胚胎发生后期丰富蛋白(LEAP)通常与一些植物的耐盐和耐干旱胁迫有关[30.,31],而发芽连接蛋白(GLP)对生物和非生物胁迫都有反应[32].同时,我们还观察到,在e - l36位点,有16个基因对LR-V和LM-V的反应相反,其中大部分基因在LR-V处理下表达上调,在LM-V处理下表达下调(图2)。4b). 16个DEGs中,除编码假设蛋白的4个基因(VIT_212s0059g00480、VIT_200s0230g00090、vit_205s0128g00620和VIT_205s0062g00810)外,其余均为胁迫相关蛋白,如胚胎发育后期丰富蛋白(VIT_203s0038g04390、VIT_209s0002g06070和VIT_200s0908g00010)、HSP20家族蛋白(VIT_218s0001g01570和VIT_204s0008g01610)和脱水反应蛋白rd22 (VIT_211s0016g03950)。与对照组相比,这些胁迫反应蛋白以及编码苹果酸合成酶(VIT_217s0000g01820)和非特异性脂质转移蛋白(VIT_214s0108g00520)的基因在e - l36位点均在LR-V处理下表达上调,而在LM-V处理下表达下调。
为了了解与Venn图中特定的DEGs相关的代谢(图2)。4a),然后进行KEGG通路富集分析。LR-V处理特异性的deg在固碳途径高度富集,且主要为光合作用相关蛋白(附加文件)5:表S4)。有趣的是,这些光合相关基因在LR-V处理的葡萄浆果中显著上调,特别是在e - l38期(图2)。5),虽然葡萄浆果对光合作用并不重要。也许葡萄浆果转录组的重新编程是对周围缺乏光合器官(即功能叶片)的一种反应,但这种变异的生物学效应仍有待证明。与LR-V特异性的deg数量相比,LM-V处理特异性的deg数量更少(见图。4a). llm - v特异性的DEGs主要富集在与酚类化合物(如二苯乙烯类化合物,二芳基庚烷类化合物和姜辣素,黄酮和黄酮醇,黄酮)的合成和植物-病原体相互作用相关的途径(附加文件)6:表S5)。
为了进一步比较两种聚类日照处理对葡萄莓转录组的影响,我们还鉴定了LM-V和LR-V之间的差异基因。在E-L 36、E-L 37和E-L 38阶段,总共有144、111和284个deg(附加文件)7:表S6)。我们注意到,在每个阶段,与LM-V相比,LR-V约90%的这些DEGs上调,这表明,与叶片移动相比,叶片去除引起的阳光照射可能导致复杂的葡萄浆果转录反应。在所有三个采样阶段,LR-V和LM-V共上调了72个基因,包括编码一个MADS-box转录因子、一个tip3 - 2样水通道蛋白、两个HSP20家族蛋白、一个苹果酸合成酶和多个胁迫相关蛋白的基因。
聚束光照下挥发性化合物生物合成相关基因表达谱的变化
特别评估了在véraison的簇阳光照射下挥发性化合物生物合成相关基因表达谱的变化,目的是解释挥发性化合物的变化(图。1).单萜生物合成通过两条独立但紧密连接的途径:质体2-甲基- d -赤四醇-4-磷酸磷酸(MEP)和细胞质甲戊酸(MVA)途径[33].为了更好地说明主要负责本研究中挥发性化合物积累的基因,在接下来的分析中省略了一些低表达水平(RPKM≤1)的基因。研究发现,在LM-V和lr - v处理的葡萄浆果中,MVA和MEP通路中的基因没有显著改变(附加文件)1:图S2)。的表达式VviDXS,注释为VviDXS1(VIT_205s0020g02130),在转录水平上没有显著改变;该基因已被确定为单萜烯浓度的关键数量性状位点[34,35].萜类合成酶(Terpenoid synthase, TPS)家族由四个子家族组成VviTPS-a, VviTPS-b, VviTPS-e和VviTPS-g,其中TPS-b和TPS-g亚家族均为单萜合酶,TPS-a亚家族负责倍半萜的合成[36].大多数编码TPSs的基因由于表达丰度很低(RPKM < 1)而被排除在本次分析之外,仅有14个VviTPSsRPKM≥1,(附加文件1:图S2)。其中只有一个TPS-b家族基因VviTPS35(VIT_212s0134g00030)在e - l38期均被LM-V和LR-V显著上调,而5个TPS-g家族基因在e - l38期均无显著上调或波动。在葡萄浆果中,大量的单萜作为非挥发性糖苷存在。这些糖苷是由单萜糖基转移酶(GT)作用形成的,其中三种已被功能表征[13,37].在本研究中,编码GT7、GT14和GT15的基因没有受到LM-V和LR-V处理的显著影响。
来自MEP途径的香叶酰香叶酰二磷酸作为植烯合成的底物,由植烯合成酶(PSY)催化。然后,植烯被转化为一系列类胡萝卜素,这些类胡萝卜素可以通过类胡萝卜素裂解双加氧酶(CCDs)进一步裂解成类降异戊二烯,或通过一系列酶分解成脱落酸、独脚金内酯和其他产物[38].众所周知VviCCD4a而且VviCCD4b主要负责在葡萄浆果发育过程中类胡萝卜素裂解为类诺异戊二烯[39].在本研究中,VviCCD4a而且VviCCD4b在光照浆果中,LR-V和LM-V处理的表达均有所下调,但差异无统计学意义。相比之下,VviNCED3,与内源性ABA的生物合成密切相关[38],在e - l36期,光照浆果中表达明显上调。
C6醛、C6醇和挥发性C9化合物都是通过脂氧合酶-过氧化氢酶(LOX - HPL)途径合成的,其中脂氧合酶(LOX)、过氧化氢酶(HPL)和乙醇脱氢酶(ADH)是关键酶[40,41,42].总共有八个VviLOX,一个VviHPL,六VviADH在目前的RNA测序分析中被鉴定(附加文件1:图S3)。作为假定的13个lox之一,VviLOXA(VIT_206s0004g01510)含量最高,主要在葡萄浆果发育过程中表达[40].然而,在本研究中,LM-V和LR-V处理并没有显著改变该基因的表达。ADH负责醛向醇的转化,之前的一项研究发现,ADH的表达VviADHADH酶活性的2个平行点[41].然而,目前,VviADH2(VIT_204s0044g01110)在lr - v处理的浆果在e - l38期下调,但不对应于C6醇的增加。相反,VviADH1基因在阳光照射葡萄果实中表达量高于对照,特别是在e - l38期,表明该基因的表达可能与LM-V处理和lr - v处理的葡萄果实中C6醇的增加密切相关。另一个分支途径涉及茉莉酸(JA)的生物合成,它与HPL驱动的C6化合物合成途径共享13-氢过氧亚油酸(或亚麻酸)底物。本研究发现,在茉莉酸生物合成途径中编码12-oxo-phytodienoic acid reductase (OPDA)的6个基因在LM-V和LR-V处理下表达上调VviOPDA(VIT_218s0041g02060)。据报道,OPDAs是由生物和非生物胁迫诱导的,并伴有半乳糖酯化的形成拟南芥[43].由于缺乏JA浓度数据,我们无法确定这种JA合成是否在阳光照射下被激活。然而,我们得出结论VviOPDA(VIT_218s0041g02060)在阳光照射浆果的转录水平上被强烈诱导。
大部分挥发性苯类化合物是由苯丙氨酸和苯丙氨酸生成的反式-cinamate,如附加文件1:图S4在酪氨酸/多巴脱羧酶1 (TYDC)和伯胺氧化酶(PAO)的催化下,苯丙氨酸可直接合成苯乙醛和苯乙醇。在这项研究中,一VviTAT(VIT_219s0014g02190)和一个VviPAL(VIT_200s2849g00010)在E-L 38期被LM-V上调(附加文件1:图S4)。此外,Vvi4HPPD经LR-V处理后上调。这些基因可能与苯类化合物和类黄酮的产生有关,因为它们具有共同的底物苯丙氨酸。
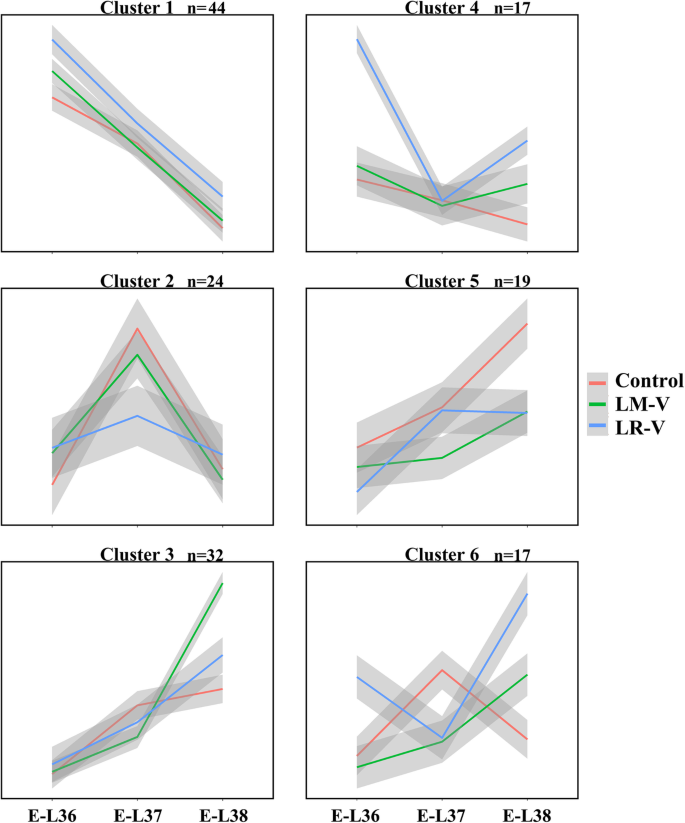
如上所述,挥发性化合物受到了很大的影响,但与其生物合成相关的大多数基因并没有因阳光照射处理而发生显著变化。似乎DEG分析并不能完全解释相应代谢产物的差异。为了了解阳光照射处理是否对靶向挥发性化合物生物合成相关基因的表达有协同作用,我们对挥发性化合物生物合成相关基因的时间序列进行了k-means聚类分析,以研究基因的表达模式。使用R包“factoextra”确定最优聚类数量,生成6个聚类(图。6).聚类1的定义是转录本积累从e - l36减少到e - l38。第1簇基因在lr - v处理的e - l36葡萄果中表达量较高,主要包括2VviADH年代,3VviLOX年代,4VviOPDA年代,4VviPAL年代,3VviNCEDs以及萜类和类胡萝卜素代谢的一些上游基因,这些基因与C6醇的增加相对应(表1).相比之下,对照组在簇2 (E-L 37)和簇5中分别有24和19个基因表现出更高的转录丰度,其中单萜类和去异戊二烯类生物合成的关键基因如VviTPS55,VviTPS60,VviTPS66,VviCCD4a,VviCCD4b被包括在内。聚类3中的32个基因在lm - v处理的e - l38浆果中表达量较高,包括VviTPS-a,VviTPS-b,VviTPS-e,以及茉莉酸甲酯生物合成相关基因。此外,在第4和第6簇的e - l36和e - l38位点,有34个基因在lr - v处理后的葡萄果实中表达较高。我们找到了另外两个VviADHS和2VviLOX这也会导致暴露在外的浆果中含有更高水平的C6醇。
鉴定与挥发性化合物积累相关的WGCNA基因
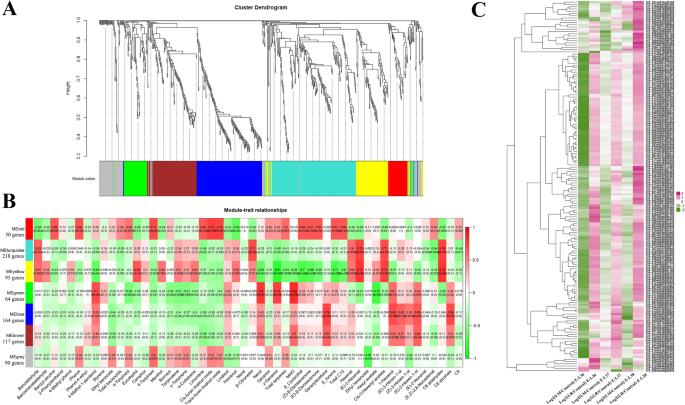
为了确定可能与挥发性化合物积累相关的基因,我们进行了加权基因共表达网络分析(WGCNA)。共选取了798个治疗组和对照组差异表达的基因用于WGCNA。这些deg被分为7个模块,其中基因表达谱在样本中高度相关(附加文件)8:表S7)。计算模块特征基因,即模块基因表达值的第一个主成分,然后用于将共识模块与各种特征关联起来。在形成的7个模块中,有些模块与检测到的挥发性化合物的浓度高度相关,它们用7种颜色表示(图2)。7a).其对应的模块-性状关系表明,蓝色模块中的164个基因与C6醇的积累高度相关(图)。7b).根据基因表达谱,在LR-V葡萄果实中,该模块的所有基因均上调(图。7c),这可能解释了为什么LR-V处理的成熟浆果的C6醇浓度高于对照。虽然LM-V处理也增加了C6醇总量,但蓝色模块中的基因在e - l36阶段下调,大多数基因在e - l37和e - l38阶段在对照中表达水平相似。这些结果表明,基因表达模式与C6醇产量之间的不一致可能是由单个C6醇化合物对LM-V处理的不同反应引起的。例如,(Z)-3-己烯-1-醇浓度在LM-V处理中增加,而(E)-3-己烯-1-醇下降和(E)-2-己烯-1-醇不受阳光照射处理的影响(图。1d).为了进一步阐明蓝色模块基因的功能,我们进行了KEGG富集分析。结果表明,在所有发育阶段和e - l38期,一个编码苹果酸合成酶的基因(VIT_217s0000g01820)在LM-V处理的浆果中表达上调,这与C6醇的积累高度同步。有趣的是,苹果酸合成酶可以催化(S)-苹果酸生成乙酰辅酶a,乙酰辅酶a是脂肪酸生物合成的重要底物[44].然而,日光照射下的葡萄浆果是否存在这种远程调控仍不确定,还需要更多的实验证据。此外,在LR-V和LM-V处理中,编码3-oxoacyl-(酰基载体蛋白)还原酶的基因(VIT_214s0128g00340)表达上调,属于脂肪酸生物合成途径。因此,该基因的上调也有助于提高葡萄果实中的C6醇含量。蓝色模块中包含转录因子编码基因,如TGA家族(VIT_207s0031g02670和VIT_208s0007g06160)、bHLH (VIT_215s0021g02690)、ABI3 (VIT_207s0005g05400)、AP2/ERF (VIT_218s0001g13320和VIT_211s0016g00670)、MADS-box (VIT_218s0001g09540)。到目前为止,定义参与调控C6醇合成的转录因子的证据有限。其机制尚不清楚,需要进一步研究。
被分类到其他六个模块的基因与我们所研究的挥发性化合物的产生没有密切或潜在的联系。这可能是由于阳光照射组和对照组浆果之间的代谢物存在微小差异,以及这六个模块中deg的数量有限。
讨论
这项研究得出了与以往研究不同的结果。结果发现,主要化合物为甲异戊二烯类化合物和单萜化合物β在LR-V和lm - v处理的葡萄浆果中,-胡萝卜素和叶黄素都减少了,一些参与类去异戊二烯生物合成的关键基因下调。相比之下,先前的研究表明,在pre-véraison的集束阳光照射可以改善葡萄浆果中norisoprenoids或单萜烯的积累[6,8],提升类胡萝卜素池[8].得出的结论是,日照增加与束缚型萜类化合物以及主要的去异戊二烯类β-大马士革酮之间存在正相关[6].Young等人认为,类胡萝卜素对改善阳光的反应增加可能导致类去异戊二烯的相应增加[8].此外,他们预测,由于单萜烯和类胡萝卜素都具有抗氧化作用,并有助于光保护,暴露的浆果中较高浓度的单萜烯可能归因于其在发育后期补偿去甲异丙二烯类水平下降的作用[8].
结果的不一致可能与实验葡萄园的温度较高,降雨量较少有关。以往的研究大多在属于温带海洋气候或地中海气候的葡萄酒产区进行,葡萄浆果生长季节温和、阳光充足。在目前葡萄种植的气候条件下,通过去除叶片暴露在阳光下,除了阳光辐射增加外,没有引起集群区温度的可检测变化。因此,暴露的浆果中norisoprenoids含量较高,主要是由于光诱导的类胡萝卜素合成[8].相比之下,我们的实验处理是在天山北麓的葡萄园进行的。该地区属于典型的中温带干旱沙漠气候,年平均气温6-8℃,日温差超过20℃,年日照时数超过2550 h,蒸发超过降雨近10倍。2012年葡萄浆果生长季(4 - 9月),生长季平均气温(GST)为21.4℃,总热时间为2218.1生长度日(GDD, Base 10℃)。在这样的干热环境下,葡萄集群暴露在阳光照射下,容易提高葡萄集群的太阳辐射和白天温度。在这项研究中,相对于对照组,暴露的簇带的日温度升高了,从10:00到19:00的平均小时温度升高了约2°C(附加文件1:图S1B)。这种改变的小气候可能不适合类胡萝卜素及其裂解产物(类诺异戊二烯)在葡萄浆果发育过程中的积累。正如Lecourieux和他的同事所报告的那样,高温导致类胡萝卜素浓度下降,主要是因为大多数与类胡萝卜素代谢相关的基因被下调了[45].他们的发现与我们的结果一致,如图所示。6,并部分解释了我们目前的结果。虽然我们的调查也揭示了一些单萜类成分的水平,如芳樟醇,hortrienol,槟榔醇,和γ-香叶醇,在LR-V和lm - v处理的浆果中得到改善,这些单萜占总浓度的比例很小(附加文件3.:表S2)。
与norisoprenoids相反,在LR-V和lm - v处理的浆果中,C6醇(主要是(Z)-3-己烯-1-醇)显著增加,这与(Z)-3-己烯-1-醇的表达上调有关VviLOXA,VviLOXO而且VviADH1在oxylipin通路中。值得一提的是,根据WGCNA分析,两个与脂肪酸生物合成相关的转录本,编码苹果酸合成酶(VIT_217s0000g01820)和3-氧酰-(酰基载体蛋白)还原酶(VIT_214s0128g00340)的基因与C6醇的积累高度相关。前期研究表明,早期叶片去除对C6化合物的浓度没有显著影响[6,19],这与我们的结果一致(图;1a).本研究首次研究了véraison条件下叶片去除和叶片移动对C6醇生物合成的影响,结果表明叶片去除的时机对挥发性化合物的积累有重要影响。此外,一些研究将C6化合物与浆果成熟度联系起来,表明C6化合物随着成熟度的增加而减少[46,47].然而,我们观察到LR-V或lm - v处理的浆果成熟度与对照没有差异,但LR-PS处理的浆果成熟度低于对照。结果表明,去除叶片或移动叶片对C6化合物积累的影响主要随处理时间的变化而变化。
本研究证实,簇状阳光照射会改变葡萄浆果中挥发性化合物的分布,这种影响与区域气候条件密切相关,其他研究人员已经证实了这一点,尽管不是在挥发性化合物方面[48].作者还观察到,随着浆果的成熟,LR-V或LM-V与对照组之间转录组的差异被放大。3.b).此外,大部分差异表达基因富集于“应激反应”过程。这一结果与Pastore等人的实验一致。[49他的结论是,这些差异表达的压力相关基因反映了葡萄浆果对阳光照射的反应。此外,据我们所知,我们的研究是第一次评估LR-V和LM-V日光照射处理之间转录组的变化。令人惊讶的是,尽管葡萄浆果不是重要的光合器官,但它们之间的DEGs几乎富集于光光合作用或光保护相关过程。这可能是由于阳光照射的改善,营养器官的去除,或两者兼而有之。
综上所述,在干热气候地区,葡萄集群暴露在阳光下,上调了许多与应激反应相关的基因,以防止暴露的葡萄浆果受到伤害。此外,随着浆果的成熟,对暴露的转录组反应变得更强。相比之下,针对挥发性化合物生物合成的转录组略有改变。葡萄果实中重要的类去异戊二烯和单萜类成分减少。因此,在炎热干燥或沙漠气候地区,采用遮阳棚或遮阳网进行适度的阳光调节管理是改善葡萄和葡萄酒香气的较好选择。
结论
与温带海洋气候葡萄栽培的叶片去除相比,温带大陆性气候葡萄浆果对不同日照处理的响应不同。这些效应在单萜烯和去异戊二烯类化合物的调控和生物合成中尤其明显。在新疆地区干热季节,去叶或移叶加剧了浆果丛的日照和日间温度,导致主要单萜、类降异戊二烯和c6衍生酯类物质水平降低。转录组分析表明,光照处理LR-V和LM-V均诱导了胁迫相关基因的表达,而LR-V也显著上调了光合作用相关基因的表达。这些结果将帮助葡萄栽培家和酿酒师更好地了解葡萄浆果对阳光照射处理的反应,调整他们的种植策略,并帮助选择阳光照射的时间,以满足他们喜欢的葡萄酒风格。此外,本研究的结果将为各农业地区应对全球变暖的机制提供信息。
方法
植物材料及处理
在一个商业葡萄园中进行了各种日光照射处理诉酿酒用葡萄赤霞珠产区位于中国新疆玛纳斯县(44°17ˊN, 86°12ˊE)。该地区为碱性土壤,pH值8.0,属干热沙漠气候,年降水量约100毫米,蒸发量接近1000毫米,年日照2550-3500小时。通过形态鉴定和简单序列重复(SSR)分析验证了该品种的真实性[5].结果与赤霞珠的数据相匹配葡萄属国际品种目录(VIVC,http://www.vivc.de/).自根葡萄种植于2000年,株间2.5 m × 1 m,南北向排列。所有的藤蔓都被训练成一个改良的垂直射击定位(M-VSP)网格系统,该系统具有每线性米保留15个节点的刺修剪警戒线。在实验期间,营养和病虫害管理均按照上文所述的当地行业标准实施[50].HOBO气象站数据记录仪对束带温度、光合有效辐射(PAR)、太阳辐射(SR)和相对湿度(RH)进行监测,该记录仪配备有光合有效辐射(PAR)传感器(型号S-LIA-M003, Onset Computer Corporation, Bourne, MA, USA)、太阳辐射(SR)传感器(型号S-LIB-M003, Onset Computer Corporation, Bourne, MA, USA)和温度/RH智能传感器(型号S-THB-M002, Onset Computer Corporation, Bourne, USA)。
葡萄果实发育物候阶段采用改良的Eichhorn-Lorenz (E-L)体系[51].按文献所述进行集束日光照射处理[5].具体来说,当浆果达到辣椒玉米大小时,通过从有簇的嫩枝上剥离第一个到六个基叶来进行叶片去除(E-L 29;治疗LR-PS)或访问véraison (E-L 35;处理LR-V)。半叶切除包括从véraison处的每枝上以簇状去除第1、3和5个基叶(处理HLR-V)。叶片移动处理在véraison进行(处理LM-V),用尼龙拉链扎小心地将一到六片基叶移动到不同的位置,使群集完全暴露在阳光下。以未经处理的葡萄藤为对照。对照组和处理组葡萄树均采用完全随机试验设计,3个生物重复,每个重复15株葡萄树。我们确认葡萄园的主人允许我们进行这项研究。该手稿的主人名叫吴晨,是该手稿的作者之一。 No protected species were sampled. The grape berries were sampled at the E-L 31, E-L 36, E-L 37, and E-L 38 developmental stages, respectively. For each biological replicate, approximately 600 berries were randomly separated from at least 100 clusters within the 15 vines. Berries were sampled in the morning (8–10 AM) from the bunch facet exposed to the both east and west sides. Following this, the berries were washed with distilled water, and then 100 berries were used to determine the physical-chemical indicators. The remaining fruit were frozen in liquid nitrogen immediately and transported to the laboratory on dry-ice for the analyses of volatile precursors and volatile compounds and for RNA sequencing.
叶黄素和的测定β-胡萝卜素
两种类胡萝卜素,叶黄素和β-胡萝卜素,按照已发表的方法进行了一些修改[52].商业叶黄素标准品(95.9%,Chromadex, Inc.)溶解于氯仿和β-胡萝卜素(95%,Sigma-Aldrich, Inc.)在氯仿/己烷(1:9)。将预先加入0.1% (w/v) 2,6 -二叔丁基-4-甲基苯酚(BHT)的原液分成1 ml的等份,装入琥珀色的HPLC小瓶中。小瓶中的溶液在氮气流下干燥。使用前将两个标准品重新溶解在含有0.1% (w/v) BHT的乙酸乙酯/甲醇(1:4)中。除去种子的25个浆果在液氮中研磨成粉末。提取类胡萝卜素时,将250 mg粉末与500 μL Millipore水、500 μL乙醚/己烷(1:1)和10 μL内标(β-载波-胡萝卜素-8-al 200 ng/μL)混合。将混合物旋转30分钟,然后以12000 rpm离心2分钟。收集上层有机相。重复这些步骤,将有机上清液池化,然后在氮气下干燥。在HPLC分析之前,将干燥的类胡萝卜素提取物溶解在含有0.1% BHT (w/v)的200 μL乙酸乙酯-甲醇溶液(1:4 v/v)中。 The resulting solution was filtered through a nylon syringe-driven filter. It should be noted that the whole extraction procedure was carried out away from strong light and on ice to avoid photo isomerization of the extracted materials. Two independent extraction procedures were performed for each biological replicates.
类胡萝卜素化合物在YMC30色谱柱(YMC Europe, Schermbeck,德国)上分离,该色谱柱固定在装有紫外可见光电二极管阵列探测器的安捷伦1100系列上(安捷伦科技公司,美国加利福尼亚州圣克拉拉)。流动相为含3% H的溶剂A2O (Millipore净化系统,Millipore, Bellerica, MA, USA)在含0.05 M醋酸铵的甲醇中,溶剂B为100%甲基叔丁基醚(MTBE)。流速设置为1 mL/min。提取液按如下顺序洗脱:20% B等量洗脱20 min,从20% B到50% B线性梯度洗脱4 min;在50% B处等量上升4 min,然后在2 min内线性上升至68% B;在每次注射前,柱在初始条件下平衡10 min。叶黄素,β-胡萝卜素定量评价采用基于标准曲线的外标法。
亚油酸和亚麻酸的测定
25个去籽葡萄浆果在液氮中研磨成粉末,并立即冻干,直到水分含量低于5%。不饱和脂肪酸(UFAs)是从冻干粉中提取的,根据以前的报告进行了一些修改[53].取1克冻干粉加入25 ml正己烷萃取溶剂中,超声处理30 min,离心。在加入溶剂和离心后提取两次残渣。上清液经30°C真空旋转蒸发浓缩至小于1 mL。然后,用5 mL 1% H甲基化上清中的UFAs2所以4/甲醇(w/v)溶液在65°C下2小时。脂肪酸甲酯(FAMEs)通过加入3ml己烷和3ml蒸馏水从两相混合物中提取。此提取步骤重复三次,将正己烷相结合并在温和的氮气流下浓缩至最终体积为1ml。FAMEs的测定使用与挥发性化合物分析相同的气相色谱仪和质谱系统。甲基壬醛酸(0.4 mg/mL)为FAME测定的内标。注入1微升萃取液(无分裂模式),GC-MS条件参照我们之前的报告[54].亚油酸和亚麻酸的定量估计基于先前发表的方法,以其甲酯为标准[53].
挥发性化合物的测定
将50个去籽葡萄浆果与1克聚氯乙烯聚吡咯烷酮(PVPP)混合,在液氮中研磨成粉末。为了提取挥发性化合物,取50 g粉末在4℃下浸渍3 h,然后在8000 rpm下离心10 min,收集清晰的上清液。采用顶空固相微萃取法(HS-SPME)测定上清液中自由形态挥发性化合物[55].剩余的材料用于提取糖苷结合的前体。Cleanert PEP-SEP药筒(150 mg/6 mL;Bonna-Agela Technologies, USA)依次用10 mL甲醇和10 mL水进行预处理,然后加入2 mL清上清。用2 mL水和5 mL二氯甲烷清洗墨盒,有效去除糖、自由形态挥发性化合物和极性化合物。然后,用20ml甲醇洗脱糖苷结合的挥发性前体。蒸发得到的甲醇提取物,并将残留物重新溶解在10 mL柠檬酸磷酸盐缓冲溶液(0.2 M, pH = 5.0)中。结合型挥发性前体用100 μL AR2000 (Rapidase, 100 g/L)在37℃培养箱中酶解16 h,用HS-SPME提取释放的挥发性物质。
采用Agilent 6890气相色谱- Agilent 5975C质谱联用对挥发性化合物进行分析。这些化合物在HP-INNOWAX毛细管柱(60 m × 0.25 mm × 0.25 μm, J&W Scientific, Folsom, CA)上分离,并根据先前报道的方法进行检测[55].在保留时间和质谱的基础上,与现有的外部标准品进行了定性鉴定。通过比较NIST11数据库中挥发性化合物的保留指数和质谱,初步鉴定了无参考标准的挥发性化合物。这些挥发性化合物是根据我们之前发表的方法定量评估的[56]使用200 g/L葡萄糖和7 g/L酒石酸在pH值3.3的合成基质。将外部标准品溶解在合成基质中,共15层。采用与葡萄莓挥发物相同的方法对合成基质中的挥发物标准物进行分析。具有可用标准物的挥发物根据其参考标准曲线进行定量,而没有可用标准物的挥发物则使用具有相同官能团和/或相似碳原子数的标准物曲线进行定量。
RNA测序和数据挖掘
共构建了27个RNA-seq文库,包括LR-V、LM-V和对照组,分别在E-L 36、E-L 37和E-L 38发育阶段有3个生物重复。为了最大限度地提高葡萄浆果样本的代表性,在将果实研磨成粉末之前,每个生物副本中大约有50个浆果的种子被人工去除。大约500毫克粉末用于总RNA提取。RNA提取遵循制造商的植物RNA分离试剂盒(Sigma RT-250,圣路易斯,密苏里州,美国)的协议。使用量子比特2.0荧光RNA检测试剂盒(Invitrogen Inc.)估计得到的总RNA的质量和数量。安捷伦2100生物分析仪(安捷伦,圣克拉拉,CA,美国)。RNA测序使用Illumina HiseqTM2000 (Illumina Inc., San Diego, CA, USA)进行,产生100 bp的单端reads,最终产生总共3.96亿个清洁reads。然后使用TopHat将这些干净的reads映射到葡萄参考基因组,并与V2.1版本进行比较(http://genomes.cribi.unipd.it/grape/).各自RNA-seq文库的基因组和基因定位率均超过80%,表明测序质量足以进行进一步的数据挖掘。通过计算目标Reads Per Kilobases Per Million Reads (RPKM)值对基因表达量进行归一化,以消除基因长度变异的影响。采用R包(NOISeq)对差异表达基因(DEGs)进行鉴定,根据差异概率(分歧概率≥0.8)和log2Ratio绝对值(|log2Ratio|≥1)判断差异表达基因的显著性。此外,从京都基因和基因组百科全书(KEGG)、基因本论(GO)和NCBI非冗余蛋白序列(Nr)数据库中获取的信息被注释到所有基因中,用于功能和通路富集分析。Venn图和热图分别使用R包“VennDiagram”和“ComplexHeatmap”进行可视化。
统计分析
数据以三次重复试验的均数±标准差表示。采用单因素方差分析(ANOVA)比较R包“agricolae”在0.05显著水平下邓肯多极差检验下的均数差异。利用R包NOISeq的功能筛选差异表达基因(DEGs)。主成分分析(PCA)使用R包stats中的“prcomp”函数进行。使用R包“ComplexHeatmap”、“factoextra”和“WGCNA”分别进行层次聚类分析、K-means聚类分析和加权相关网络分析(WGCNA)。本研究使用开源R统计计算环境(3.3.3)对所有数据进行分析。生长度日数(GDD,以10°C为基数)计算时间为4月1日至9月30日,其公式为:GDD = n (Td-10°C),其中n为浆果生长季节日数,Td为日平均气温。
数据和材料的可用性
转录组数据可在NCBI基因表达综合库(http://www.ncbi.nlm.nih.gov/geo/),注册编号为GSE121146。支持本文结果的数据集包含在本文及其附加文件中。
缩写
- 4 hppd:
-
4-hydroxyphenylpyruvate加双氧酶
- 阳极氧化铝:
-
Abscisic-aldehyde氧化酶
- ACAT:
-
乙酰辅酶a酰基转移酶
- ACCAT:
-
乙酰辅酶a C-acetyltransferase
- ACX:
-
酰coa氧化酶
- 抗利尿激素:
-
乙醇脱氢酶
- AOC:
-
烯氧化物环化酶
- 代谢:
-
烯氧化物合酶
- BCH:
-
β-胡萝卜素3-hydroxylase
- CAAT:
-
叶绿体天门冬氨酸转氨酶
- CCD:
-
类胡萝卜素裂解双加氧酶
- 聊天:
-
Z-3-hexen-1-ol乙酰转移酶
- CMK:
-
4-diphosphocytidyl-2-C-methyl-D-erythritol激酶
- CRTISO:
-
Prolycopene异构酶
- 度:
-
差异表达基因
- DXR:
-
1-deoxy-D-xylulose-5-phosphate reductoisomerase
- dx:
-
1-deoxy-D-xylulose-5-phosphate合酶
- FPPS:
-
法尼基二磷酸合成酶
- GGPPS:
-
香叶酰香叶酰二磷酸合成酶
- gpp:
-
香叶酰二磷酸合成酶
- GT:
-
糖基转移酶
- HDR:
-
4-羟基-3-甲基-2-乙酰二磷酸还原酶
- HDS:
-
E-4-hydroxy-3-methylbut-2-enyl-diphosphate合酶
- HLR-V:
-
半叶去除véraison
- HMGCR:
-
Hydroxymethylglutaryl-CoA还原酶
- HMGCS:
-
Hydroxymethylglutaryl-CoA合酶
- HPA:
-
Histidinol-phosphate转氨酶
- HPL:
-
氢过氧化物裂解酶
- IPPI:
-
Isopentenyl-diphosphate Delta-isomerase
- JOMT:
-
Jasmonate O-methyltransferase
- LBCY:
-
番茄红素beta-cyclase
- LECY:
-
番茄红素epsilon-cyclase
- LM-V:
-
叶子移动véraison
- 液态氧:
-
脂氧合酶
- LR-PS:
-
去掉叶子,然后浆果变成辣椒玉米大小
- LR-V:
-
去叶网址:véraison
- LUT1:
-
胡萝卜素epsilon-monooxygenase
- LUT5:
-
beta-ring羟化酶
- 未经中华人民共和国交通部:
-
2- c -甲基- d -赤藓糖醇4-磷酸胞基转移酶
- MDS:
-
2- c -甲基- d -赤藓糖醇2,4-环二磷酸合酶
- 议员:
-
2-methyl-D-erythritol-4-phosphate磷酸
- MEP2:
-
乙醛酶体脂肪酸-氧化多功能蛋白MFP-a
- 姆欧:
-
6-methyl-5-hepten-2-one
- 可:
-
甲羟戊酸激酶
- MMIF:
-
巨噬细胞迁移抑制因子同源物
- MVA:
-
甲羟戊酸
- nc:
-
9-cis-epoxycarotenoid加双氧酶
- NSY:
-
Neoxanthin合酶
- OPCL1:
-
CoA连接酶1
- OPDA:
-
12-氧植二烯酸还原酶
- 朋友:
-
苯丙氨酸ammonia-lyase
- PAO:
-
伯胺氧化酶
- 票面价值:
-
光合作用的有效辐射
- 主成分分析:
-
主成分分析
- PDS:
-
15-cis-phytoene desaturase
- 两家公司:
-
Phosphomevalonate激酶
- PPMD:
-
Diphosphomevalonate脱羧酶
- 小组:
-
八氢番茄红素合成酶
- RH:
-
相对湿度
- SR:
-
太阳辐射
- 助教:
-
可滴定酸度
- 答:
-
酪氨酸转氨酶
- TPS:
-
类萜合成酶
- TSS:
-
总可溶性固形物
- TYDC:
-
酪氨酸/多巴脱羧酶1样
- VDE:
-
黄质de-epoxidase
- WGCNA:
-
加权基因共表达网络分析
- XDH:
-
黄氧素脱氢酶
- ZDS:
-
Zeta-carotene desaturase
- 齐柏林飞艇:
-
玉米黄质环氧酶
- ZISO:
-
Zeta-carotene异构酶
参考文献
- 1.
Bergqvist J, Dokoozlian N, Ebisuda N.阳光照射和温度对加利福尼亚州中部圣华金河谷赤霞珠和歌海娜浆果生长和成分的影响。李文杰,王文杰,2001;32(1):1 - 7。
- 2.
Jackson DI, Lombard PB。影响葡萄成分和葡萄酒质量的环境和管理实践综述。中国科学(d辑). 1993;44(4):409-30。
- 3.
张鹏,吴霞,刘丹,冯恩特斯S, Howell K.根尖和基部落叶对山药冠层结构和生化成分的影响葡萄简历。设拉子葡萄和葡萄酒。前沿化学2017;5:48。
- 4.
Mosetti D, Herrera JC, Sabbatini P, Green A, Alberti G, Peterlunger E, Lisjak K, Castellarin SD。浆果结果后叶片去除对‘长相思’果实成分和串腐的影响。葡萄。2016;55(2):57 - 64。
- 5.
孙仁志,程刚,李强,何永年,王勇,兰永波,李世勇,朱永荣,宋文峰,张旭,等。赤霞珠葡萄酚类化合物在光诱导下的变化(葡萄l .)涉及广泛的转录组重编程的生物合成酶,转录因子,和植物激素调节。中国植物科学,2017;8:547。
- 6.
冯华,袁峰,钱春春。去簇区叶片对黑比诺葡萄化学成分和挥发性成分的影响。食品化学,2015;173:414-23。
- 7.
Frioni T, Zhuang S, Palliotti A, Sivilotti P, Falchi R, Sabbatini P.在凉爽气候下,葡萄种植的叶片去除和簇薄效率受到环境条件的高度调节。J Enol vitticult . 2017; 68:325-35。
- 8.
Young PR, eyehe - bickong HA, du Plessis K, Alexandersson E, Jacobson DA, Coetzee Z, Deloire A, Vivier MA。葡萄对改变的小气候的可塑性:长相思调节特定的代谢物以应对增加的浆果暴露。中国生物医学工程学报,2016;17(3):339 - 344。
- 9.
Hannah L, Roehrdanz PR, Ikegami M, Shepard AV, Shaw MR, Tabor G, Zhi L, Marquet PA, Hijmans RJ。气候变化、葡萄酒和环境保护。中国科学(d辑:自然科学),2013;
- 10.
郑波,李跃,张永青,张志刚,张志刚。红葡萄中添加鞣花酸对赤霞珠葡萄酒酚类成分和色度品质的影响。中国食品科学,2017;41(4):e13080。
- 11.
杨晓明,杨晓明,杨晓明。夜间温度升高对葡萄果实花青素合成的影响。科学通报,2005;30(3):319-30。
- 12.
花青素的色素沉着及其在红酒颜色中的作用:一个重要的回顾。李文杰,李文杰。2001;32(2):67-87。
- 13.
张娥,柴峰,张宏,李松,梁志,范鹏。日光排斥对葡萄外果皮和中果皮单萜合成和积累的影响。食品化学,2017;237:379-89。
- 14.
Kwasniewski MT, Vanden Heuvel JE, Pan BS, Sacks GL.葡萄发育过程中簇光环境操作时机对雷酒C-13 Norisoprenoid和类胡萝卜素浓度的影响。农业食品化学。2010;58(11):6841-9。
- 15.
Sivilotti P, Herrera JC, Lisjak K, Basa Cesnik H, Sabbatini P, Peterlunger E, Castellarin SD。开花前后叶片去除对“梅洛”花青素、单宁和甲氧基吡嗪浓度的影响(葡萄l)葡萄和葡萄酒。农业食品化学学报,2016;64(22):4487-96。
- 16.
Sivilotti P, Falchi R, Herrera JC, Skvarc B, Butinar L, Sternad Lemut M, Bubola M, Sabbatini P, Lisjak K, Vanzo A.早季叶片去除和气候条件对长苏维翁葡萄香气前体的联合影响。农业化学学报,2017;65(38):8426-34。
- 17.
李志刚,李志刚,李志刚。果实区叶片去除对黑叶螟黄酮浓度的影响。中国科学院学报(自然科学版),2017;29(4):344 - 344。
- 18.
埃尔南德斯-奥尔特P,康瑟罗B,斯特兰J,拉索B,卡乔J,费雷拉V.葡萄栽培方法对葡萄香气前体的影响及其与葡萄酒香气的关系。中国食品农业科学,2015;95(4):688-701。
- 19.
Alessandrini M, Battista F, Panighel A, Flamini R, Tomasi D.花前叶片去除对赛美蓉葡萄香气组成和葡萄酒感官特征的影响。中国食品农业科学,2018;98(5):1674-84。
- 20.
绿叶挥发物:过氧化氢酶途径的氧化脂素代谢。植物学报。2006;9(3):274-80。
- 21.
butter RG, Turnbaugh JG, Ling LC。挥发物对大米香气的贡献。农业食品化学,1988;36(5):1006-9。
- 22.
罗宾逊AL,老板PK,所罗门PS,特伦戈夫RD,海曼H,埃贝勒SE。葡萄和葡萄酒香气的来源。第1部分。化学成分和葡萄栽培的影响。王晓明,王晓明。2014;30(1):1 - 24。
- 23.
González-Barreiro C, Rial-Otero R, Cancho-Grande B, Simal-Gándara J.葡萄中的葡萄酒香气化合物:综述。《食品科学》2015;55(2):202-18。
- 24.
马图斯·JT,罗耀拉R,维嘉A, Peña-Neira A,博杜E,阿斯-约翰逊P,阿尔卡尔德JA。变种后阳光照射诱导myb介导的莓皮花青素和黄酮醇合成的转录调控葡萄.中国机械工程学报,2009;30(3):344 - 344。
- 25.
Kalua CM, Boss PK.赤霞珠葡萄发育过程中挥发性化合物的演化(葡萄l .)。农业食品化学。2009;57(9):3818-30。
- 26.
王伟,王晓明,王晓明,王晓明。植物热休克蛋白和分子伴侣蛋白在非生物胁迫响应中的作用。植物科学进展,2004;9(5):244-52。
- 27.
紫外光对葡萄科植物叶片二苯乙烯合酶、苯丙氨酸解氨酶和肉桂酸4-羟化酶的坐标诱导。足底。1981;151(1):52。
- 28.
张志刚,张志刚,张志刚,等。二苯乙烯类化合物在植物代谢中的作用。植物科学进展,2009;37(3):344 - 344。
- 29.
Degu A, ayennew B, Cramer GR, Fait A.葡萄浆果对光、温度、氧化应激、脱落酸和茉莉酸的多酚响应表现出特定的发育依赖性代谢弹性。食品化学,2016;212:828-36。
- 30.
Dalal M, Tayal D, Chinnusamy V, Bansal KC.甘蓝型油菜非生物胁迫和aba诱导的第4族LEA在耐盐耐旱中起关键作用。中国生物医学工程学报。2009;39(2):457 - 457。
- 31.
赵萍,刘峰,马敏,龚娟,王强,贾鹏,郑刚,刘慧。AtLEA3-3的过表达增强了拟南芥的渗透胁迫耐受性和ABA敏感性。Mol biology, 2011;45(5):785。
- 32.
邓维尔JM,吉宾斯JG,马哈茂德T,萨克兰纳克维SM。萌发蛋白和类萌发蛋白:进化、结构和功能。植物科学,2008;27(5):342-75。
- 33.
Vranová E, Coman D, Gruissem W. MVA和MEP途径对类异戊二烯合成的网络分析。植物科学进展。2013;29(1):366 - 366。
- 34.
Duchêne E, Butterlin G, Claudel P, Dumas V, Jaegli N, Merdinoglu D.葡萄藤(葡萄L.)脱氧-d-木质素合成酶基因与萜醇含量的主要数量性状位点共位。应用理论,2009;118(3):541-52。
- 35.
Battilana J, Costantini L, Emanuelli F, Sevini F, Segala C, Moser S, Velasco R, Versini G, Grando MS. 1-脱氧-d-木酮糖5-磷酸合成酶基因与影响葡萄单萜含量的主要QTL共定位应用理论,2009;118(4):653-69。
- 36.
Martin DM, Aubourg S, Schouwey MB, Daviet L, Schalk M, Toub O, Lund ST, Bohlmann J.葡萄功能注释、基因组组织和系统发育(葡萄)基于基因组组装、FLcDNA克隆和酶分析的萜烯合成酶基因家族。植物学报。2010;10(1):226。
- 37.
Bönisch F, Frotscher J, Stanitzek S, Rühl E, Wüst M, Bitz O, Schwab W. A UDP-glucose:Monoterpenol Glucosyltransferase增加了葡萄代谢组的化学多样性。中国生物医学工程学报,2014;29(2):344 - 344。
- 38.
Young PR, Lashbrooke JG, Alexandersson E, Jacobson D, Moser C, Velasco R, Vivier MA。类胡萝卜素代谢途径的基因和酶葡萄中国生物医学工程杂志,2012;13(1):243。
- 39.
Lashbrooke JG, Young PR, Dockrall SJ, Vasanth K, Vivier MA。功能特征的三个成员葡萄L.类胡萝卜素裂解双加氧酶基因家族。中国生物医学工程学报。2013;13(1):156。
- 40.
白杨A,白J, Jordan B, Winefield C.脂氧合酶基因家族的鉴定葡萄以及长相思葡萄浆果中表达的两种13-脂氧合酶的生化特性。植物学报。2010;37(8):767-84。
- 41.
Tesnière C, Verriès C.乙醇脱氢酶cdna的分子克隆与表达葡萄L.在浆果发育期间。植物科学进展,2000;37(1):1 - 7。
- 42.
朱伯强,徐晓强,吴彦文,段昌全,潘庆华。葡萄果实中两个过氧化氢酶基因的分离与鉴定。Mol生物学杂志2012;39(7):7443-55。
- 43.
尼尔森AK,法尔伯格P, Ellerström M,安德森MX。在拟南芥中,氧植二烯酸(OPDA)是由组织破坏后酯化成半乳糖的脂肪酸形成的。中国科学(d辑),2012;
- 44.
斯威特曼C, Deluc LG, Cramer GR, Ford CM, Soole KL.葡萄莓和其他发育中的水果中苹果酸代谢的调控。植物化学。2009;70(11):1329 - 44。
- 45.
Lecourieux F, Kappel C, Pieri P, Charon J, Pillet J, Hilbert G, Renaud C, Gomès E, Delrot S, Lecourieux D.局部热处理对赤霞珠葡萄浆果发育的生化和转录组效应的解剖。中国植物科学,2017;8:547。
- 46.
孟德斯-科斯塔贝尔MP,威尔金森KL,巴斯蒂安SEP,等。冬季降水对冬小麦产量构成及果实绿色香气的影响葡萄l .简历。加州的梅洛葡萄酒。德国葡萄酒R. 2014;20(1): 100-10。
- 47.
宋杰,谢莉,王华,等。亏亏灌溉和高岭土颗粒膜对梅洛葡萄成分及挥发性化合物的影响(葡萄l .)。食品化学,2012;34(2):841-50。
- 48.
Frioni T, Zhuang S, Palliotti A, Sivilotti P, Falchi R, Sabbatini P.在凉爽气候下,葡萄种植的叶片去除和簇薄效率受到环境条件的高度调节。中国科学院学报(自然科学版),2017;29(4):344 - 344。
- 49.
Pastore C, Zenoni S, Fasoli M, Pezzotti M, Tornielli GB, Filippetti I.选择性落叶对葡萄植株生长、果实转录成熟程序和类黄酮代谢的影响。中国生物医学工程学报。2013;13(1):30。
- 50.
程刚,何永宁,岳天祥,王杰,张志伟。气候条件和土壤特性对赤霞珠浆果生长和花青素分布的影响。分子。2014;19(9):13683。
- 51.
狭谷BG。葡萄藤的生长阶段:采用一种识别葡萄藤生长阶段的系统。中国葡萄酒业,2005;1(2):104-10。
- 52.
杨晓明,张晓明,张晓明,等。葡萄果实成熟过程中类胡萝卜素和叶绿素的提取及定量方法的优化(葡萄简历。梅洛)。农业食品化学,2010;58(11):6578-86。
- 53.
Santos LP, Morais DR, Souza NE, Cottica SM, Boroski M, Visentainer JV。不同部位的酚类化合物和脂肪酸葡萄属狐狸而且诉酿酒用葡萄葡萄。食品科学,2011;44(5):1414-8。
- 54.
徐晓强,程刚,段丽丽,姜瑞,潘庆华,段春青,王杰。不同培养体系对赤霞珠葡萄及天山北坡葡萄酒脂肪酸及其衍生挥发物的影响。食品化学。2015;181:198-206。
- 55.
兰永斌,钱鑫,杨志军,向晓峰,杨文祥,刘涛,朱伯强,潘庆华,段昌强。在中国东北“北冰红”葡萄过熟期间,在零下温度下挥发性特征的显著变化。食品化学,2016;212:172-82。
- 56.
徐晓强,刘波,朱保强,兰永波,高勇,王东,Reeves MJ,段昌强。在中国两个不同地区种植的赤霞珠葡萄挥发性特征的差异及其对天气条件的反应。中国生物医学工程学报,2015;
确认
衷心感谢新疆中信国安酒业有限公司对实验场地和葡萄取样的支持。
资金
国家自然科学基金(31471834)、中国农业科学研究系统(car -29)和新疆省“十三五”科技重大专项(2017A01001-3)资助。资助者在实验设计、数据分析、发表决定或手稿准备中没有任何作用。
作者信息
从属关系
贡献
LH对挥发性化合物、RNA-seq数据进行了分析,并起草了手稿。实验由JW、CQD和QHP设计。采用WC、XQX、GC和BL进行田间试验,YW、WKC和RZS对结果进行统计分析和可视化。QHP、JW、CQD和WC提供了资金支持,QHP对手稿进行了修改。所有作者都对最终稿做出了贡献并通过了。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:
图S1。2012年8月5日果丛区发果期日平均气温(A)和小时平均气温(B)。右图数据为左图中蓝色竖线所示当日。光照和对照葡萄果实发育过程中束带的光合有效辐射(C)、太阳辐射(D)和相对湿度(E)。浅红色背景代表e - l35至e - l36阶段。HLR-V,半叶去除véraison;LM-V,叶片移动véraison;LR-V,去叶véraison。图S2。萜类和类胡萝卜素代谢相关基因通路分析。紫色和红色框表示下调和上调基因,框的颜色表示表达折叠变化的强度(log2)。粗体边距的方框表示处理组和对照组之间表达基因的差异。图S3。亚麻酸代谢相关基因通路分析。紫色和红色框表示下调和上调基因,框的颜色表示表达折叠变化的强度(log2)。粗体边距的方框表示处理组和对照组之间表达基因的差异。图S4。苯丙氨酸代谢相关基因通路分析。紫色和红色框表示下调和上调基因,框的颜色表示表达折叠变化的强度(log2)。粗体边距的方框表示处理组和对照组之间表达基因的差异。
附加文件2:
表S1。葡萄果实发育过程中可溶性固形物总量和可滴定酸度。
附加文件3:
表S2。浓度(μg/kg,均值±SD,n= 6)在收获的葡萄浆果中检测到挥发性化合物。
附加文件4:
表S3。LM-V和LR-V之间共有差异表达基因。
附加文件5:
表S4。LR-V特异性诱导差异表达基因KEGG富集分析。
附加文件6:
表S5。LM-V特异性诱导差异表达基因KEGG富集分析。
附加文件7:
表S6。LM-V和LR-V的差异表达基因。突出显示的基因是在三个测试阶段都出现的常见的deg。
附加文件8:
表S7。每个WGCNA模块中的基因。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
He, L., Xu, XQ。,王,Y。et al。干热气候下葡萄果实挥发性化合物代谢组和转录组的调控BMC植物生物学20.59(2020)。https://doi.org/10.1186/s12870-020-2268-y
收到了:
接受:
发表:
关键字
- 叶切除
- 叶移动
- 半叶去除
- 挥发性资料
- 葡萄浆果