摘要
背景
地球植物具有特殊的储存器官——球茎、块茎、球茎或根茎,这些器官使它们能够在不变化的时期存活,并为发芽、有性繁殖和营养繁殖提供能量支持。地生植物的球茎和开花是内外因素综合作用的结果,特别是温度和光周期的综合作用。许多地球植物被广泛应用于农业,但其开花和鳞茎的调控机制仍不清楚。
结果
通过形态生理学和转录组的比较分析以及基因表达的定量验证,揭示了大蒜这种典型球茎植物对春化反应的分子调控。鳞茎长时间的暗冷暴露是开花和鳞茎形成的主要信号,其与单株遗传组成的相互作用决定了生长阶段的表型表达。光周期信号不参与初期的核和代谢过程,但可能在后期的发育、花茎伸长和球茎形成中起作用。4℃春化12周,11月种植,12 - 1月短光期开花,花期早,球茎早。相比之下,未春化的植物没有发生分生组织转变。春化和非春化鳞茎的比较发现约14000个差异表达基因。
结论
低温刺激了大蒜分子机制的大量级联,多种开花途径共同作用,有利于分生组织的转变,每年的生命周期和可活繁殖结果。的circadian clock appears to play a central role in the transition of the meristem from vegetative to reproductive stage in bulbous plant, serving as integrator of the low-temperature signals and the expression of the genes associated with vernalization, photoperiod and meristem transition. The reserved photoperiodic pathway is integrated at an upstream point, possibly by the same receptors. Therefore, in bulb, low temperatures stimulate cascades of developmental mechanisms, and several genetic flowering pathways intermix to achieve successful sexual and vegetative reproduction.
背景
多年生植物根据季节变化精心安排开花时间,以确保和最大化繁殖成功。开花是由内部和环境因素诱导、启动和促进的,如生理年龄、赤霉素合成、光周期和/或温度。两种或两种以上这些因子的联合作用形成了一个控制开花时间和开花质量的综合调控网络[4,89].
尽管物种之间和物种内部有很大的遗传差异[9,10,18,29],温带植物之间有很大的生理相似性,因为它们中的许多植物都依赖于春化作用来诱导花。寒冷时间的积累调节着水分状况、激素平衡、呼吸和碳水化合物调动的基本变化[39],从而增加植物对翌年春季日照长度变化的接受能力[4].
在植物的历史上,对低温的依赖进化了好几次,随之而来的是许多调节机制的参与[4,10,40,74].例如,拟南芥保持植物性FRIGIDA(星期五)上调花抑制因子开花位点c (flc),这反过来又降低了花的整合因子英国《金融时报》,FD,SOC1.冷诱导下调方法,从而使花整合子的表达得以实现,从而使分生组织从营养状态过渡到生殖状态[44,60,79,80].另一种调节机制在单子科谷物中很常见英国《金融时报》同族体春化3 (vrn3)被抑制了VRN2.在冷诱导之后,VRN1压制VRN2的表达式,从而支持的表达式VRN3以及随后分生组织的转变[74].在洋葱中,英国《金融时报》类基因控制球茎和开花的开始[45].光周期短,高AcFT4表达通过抑制抑制球泡的形成AcFT1。随着时间的延长,这种基因型特异性抑制作用逐渐减弱,随后诱导光周期下调AcFT4,进而表现为促球AcFT1.另一方面,贮藏和/或田间的低温促进了AcFT2这意味着在春夏开花。春化作用对上调英国《金融时报》类序列(LiFTL)也被报道百合longiflorum[47,49].在郁金香,TgFT2被认为是致花原,而TgFT1而且TgFT3可能具有灯泡特有的功能[47].
与春化作用不同,光周期通路的分子机制在早期就已经进化,并且在植物中得到了很好的保存[4,91].它涉及到光感受器之间的稳定/不稳定的平衡,随之而来的是通过表达君士坦斯(有限公司),由双方共同监管, gigantea (gi)昼夜节律[84,91].
在许多植物物种中,开花诱导和启动需要春化和光周期的连续和联合作用。因此,春化效应的“记忆”是由表观遗传机制维持的[8,86].在拟南芥,这些染色质修饰抑制花抑制因子方法[16,86,而在谷物中,它们上调了花的激活因子VRN1[67,90].一般认为,对于单子和双子,英国《金融时报》S同源体是各种途径的主要遗传花整合器[74].
地生植物是指具有地下储存器官的植物,如球茎、块茎、球茎或根茎。在极端气候环境下,贮藏器官帮助植物在不变化的时期存活,并为发芽、有性繁殖和营养繁殖提供能量支持。它们的生命周期由复杂的环境依赖性的一年生序列组成,开花和球茎的诱导和开始受到周围条件的严格控制[34].许多地生植物在农业中被广泛应用,对其生理特性已有深入的了解,但其分子调控的主要机制尚不清楚[35].
典型球茎类地生植物大蒜的年发育周期(大蒜L.),能很好地适应其产地中亚常见的环境变化[36].因此,球茎和开花都受温度和光周期的共同影响[38,58,71,72,82,94].在抽苔基因型中,低温诱导分生组织从营养状态向生殖状态转变,进而导致花序分化、花葶伸长和腋芽生长。初夏,气温升高,白昼变长,开花开始,成熟的复合鳞茎进入休眠。
种前冷处理和/或冬季温度显著影响大蒜生长植株的发育调节和表型表达、鳞茎和鳞茎质量以及繁殖发育[7].春化期的延长大大加快了植物的营养生长、分生组织的早期转变和鳞茎的形成,因此只产生少量的腋芽(瓣),从而形成小鳞茎和花序[5,7,26,76,95].
人们普遍认为,光周期是控制洋葱和大蒜茎长和鳞茎生长的主要环境因素[38,70].然而,我们最近的研究结果表明,大蒜在4°C下种植前储存12周会导致光周期无关的分生组织转变早在冬至12 - 1月,白昼最短的时候[7].本研究旨在确定一个开花大蒜基因型对低温响应的调控分子机制。此外,通过比较春化时间长和春化时间短的植物与未春化植物的基因表达,我们获得了球茎冷藏诱导开花的分子证据。
结果
Morpho-physiological分析
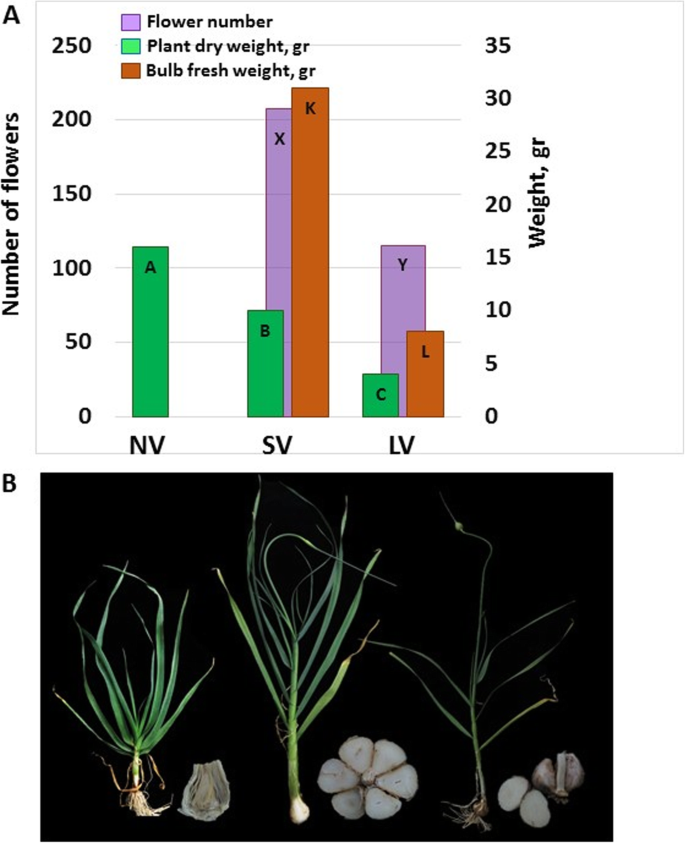
由非春化(NV)鳞茎产生的植株在整个生长过程中保持着营养习性并不断产生新叶,在6月可达20片新叶[7].在这些植物中,顶端分生组织没有向花起始转变,顶端优势性没有减弱,侧面分生组织没有分化成叶或瓣。地上部分干重达到17 g,而短春化(SV)和长春化(LV)栽培的植株分别为11-12和3-4 g(图4)。1一个)。
相比之下,由春化鳞茎培育的植物在种植数周后失去了顶端优势,发育出生殖器官和丁香,并产生休眠鳞茎(图。1b).在SV后培养的植株中,种植前春化短不足以诱导分生组织转变,但在3月底,即种植后140天(DAP),顶端优势减弱,可见生殖分生组织。这些植物在5月开花前产生17-19片叶子,185 DAP,每个花序发育约160朵花。在收获时,230dap,鳞茎有6-7瓣,平均鳞茎重量为30克。1).
在LV植株中,分生组织的转变早在1月~ 50dap时就已经可见,在7-8片叶子发育之后(图5)。1).花序开100-120朵花,鳞茎仅有2-3瓣。鳞茎成熟发生在200dap,平均鳞茎重量为8克(图。1).因此,在漫长的春化过程中积累的冷单元足以在无性系#87中开始开花和球茎。
全球转录组分析
从丁香顶端分生组织中提取的RNA样本用于种植前转录组的构建。高通量并行RNA-Seq文库可用于构建cDNA文库,双端阅读量为100 bp,达到3600万~ 4200万。高质量的修剪和过滤结果是3300 - 3900万次清洁读取。与可育大蒜数据(NCBI生物项目PRJNA243415;[37)这些reads使用Trinity软件进行组装,得到了112,388个三位一体“基因”,平均长度为1.178 bp, N50为1812 bp。大约90%的干净读取被映射到答:一种转录组目录。
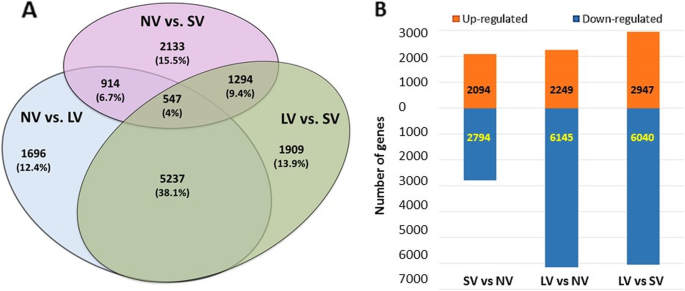
对处理之间的比较表明,检测到的约14000个差异表达基因(DEGs)中只有4%在所有比较中存在。LV/NV和LV/SV的共同deg数量最多(38%)(图1)。2a).长时间冷暴露导致上调和下调基因的转录活性差异最大。此外,在所有的比较中,下调基因的数量明显高于上调基因的数量(图1)。2b)。
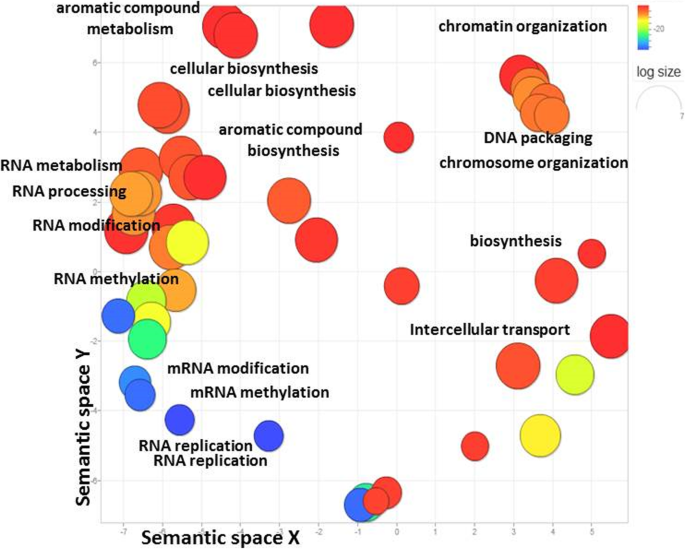
对所有比较中共有的547个deg(占总数的4%)进行功能性GO分析(图5)。2a)揭示了三个主要的活性域——RNA甲基化、染色质组织和芳香化合物的生物合成(图。3.).这些代谢过程在大蒜休眠结束、发芽和受春化影响的分生组织识别过程中起着一般的发育作用。
使用GO算法,我们分析了上调和下调基因的生物过程函数,在所有的比较中(图5)。4).对于SV/NV的比较,氧化GO富集显示与激素运输、对温度刺激的响应和类黄酮代谢相关的结构域的过度代表(图。4a, c),而染色质组织,DNA包装,基因表达调控,代谢过程和生物合成下调(图。4b, d)。LV/NV比较显示了与光合作用、碳固定、对生物刺激和细胞分裂素的响应、质体组织和光反应相关的强过代表域(图)。4a, c)。相比之下,左瓣中参与细胞分解代谢、防御反应和RNA代谢的功能域明显下调(图1)。4b, d)。最后,LV/SV比较分析显示2947个基因上调(图5)。2a),与生物合成、染色质组织、DNA修饰和甲基化、碳水化合物代谢、光合作用和对光的响应,以及与光周期作用、光合作用、对外界刺激的响应和生长素流入相关的生物过程丰富(图)。4a, c).细胞成分组织过度表达,而编码对温度刺激和RNA甲基化反应的基因被下调(图。4b)。
功能分析的数据挖掘
我们的研究结果表明,植物生长性能的差异与分生组织转变相关基因的表达有关。为了验证这一假设,我们在DEGs列表中进行了数据挖掘,使用关键词:开花、分生组织过渡、光周期、昼夜节律和春化(vernalization)在数据库中搜索基因注释。进一步,我们分析了特定基因家族或更高复杂性基因的文献数据,如:英国《金融时报》为了比较大蒜与模式植物和非模式植物的分生组织鉴定途径。
因此,我们编制了一份与分生组织身份确定相关的74个deg列表5:表S2)。
基因共表达网络(GCNs)
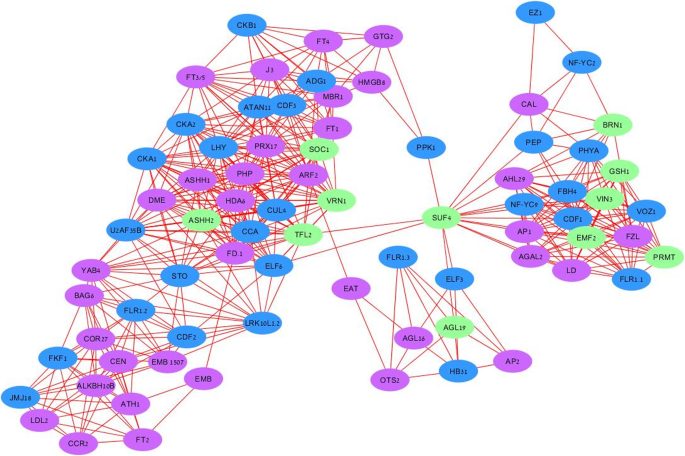
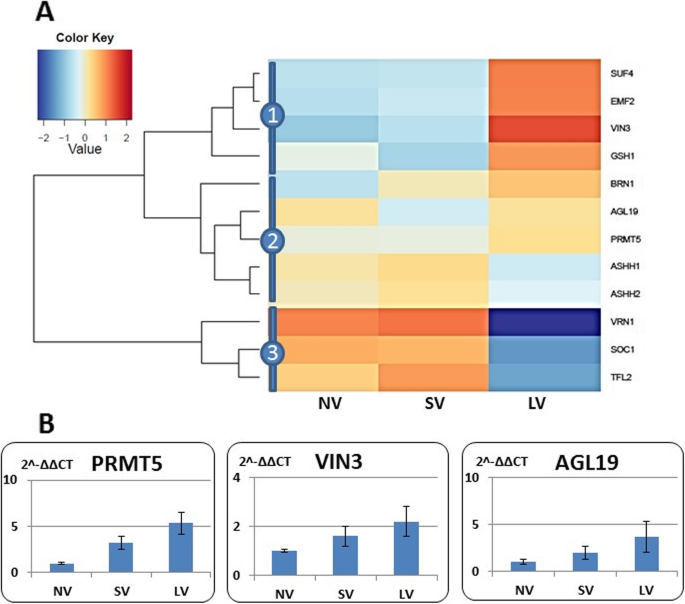
基因共表达网络被构建为多个表达数据集的集成,通过连接跨处理的表达模式相似的基因来揭示根尖分生组织中阳性和阴性基因连接的具体生物学背景。在GCN阳性表达中,至少发现了三个主要模块,并且在春化和光周期通路相关基因之间以及注释为分生组织转变相关基因之间发现了共表达(图1)。5).春化相关基因(绿色标记)存在于所有三个模块中,并与标记光周期反应的基因(蓝色标记)和分生组织识别基因(紫色标记)密切相关。一般来说,与光接收、光周期反应和昼夜节律时钟相关的基因5表S2)代表阳性GCN的主要部分,并与分生组织过渡网络相结合。大蒜的同义物4型冷抑菌(suf4),与拟南芥激活方法表达在阳性GCN的中心位置。因此,它似乎在整合开花相关通路中起着保守的作用。5).
大蒜春化(绿色)、光周期(蓝色)通路和分生组织转化(紫色)相关基因的共表达阳性。使用网络绘图软件Cytoscape分析三种春化处理的数据[81].Pearson相关值大于0.9
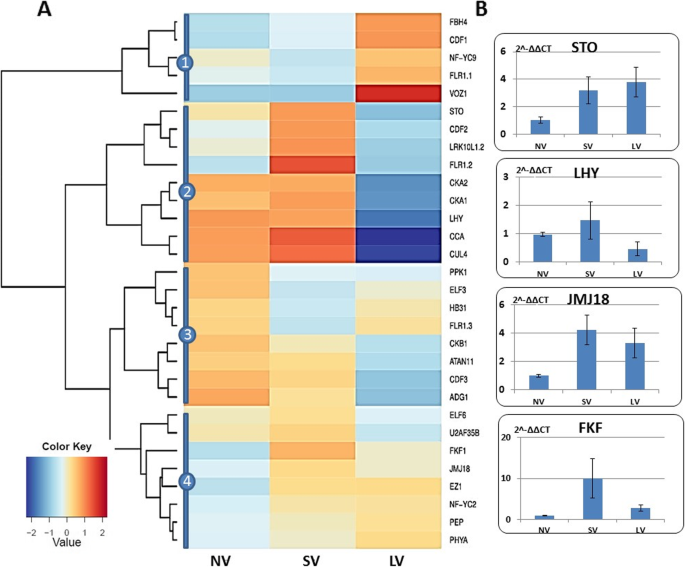
我们的分析还揭示了三点FLOR1(FLR1)同源,与分生组织转变的长光周期通路有关。FLR1在每个主要模块中都存在序列略有不同的同源物,这表明它们可能通过选择性剪接参与开花。耐盐性(停止)与光周期反应和开花过渡密切相关的基因是另一个感兴趣的基因。它位于最大的GCN模块的中心,连接两个子模块。
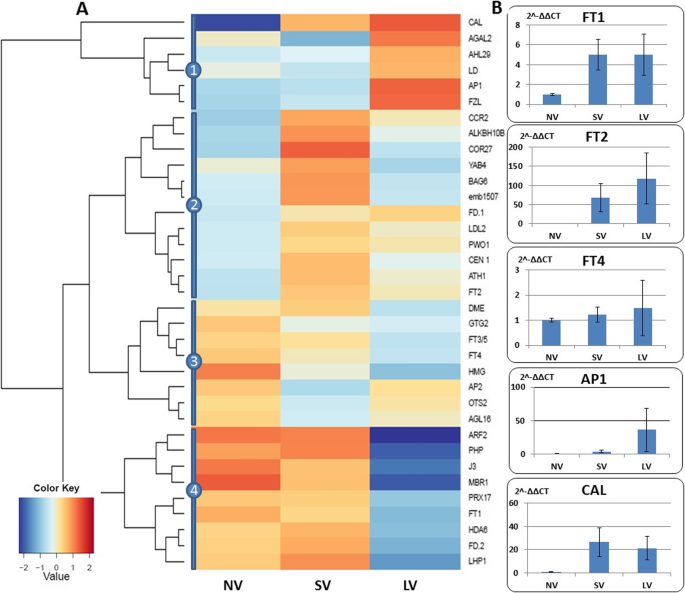
的英国《金融时报》基因家族(Ft1, ft2, ft4,而且FT3/5)位于这个网络的中心,但它们之间没有直接连接。FT2与分生组织转化基因共表达Ccr2, emb, cor27,而FT1而且FT4与参与光周期反应的基因共表达(Cka1 cka2 lhy,而且ADG1).
阴性GCN中,一种春化相关基因AGAMOUS-like 19(AGL19)与光周期和分生组织识别基因呈负相关(附加文件3.:图S3)。
“开花”基因的差异表达
为了选择与开花有关的候选基因的差异表达,我们结合了74个感兴趣基因的硅分析结果(附加文件5:表S2),对15个推测基因进行qRT-PCR分析,并对其参与不同开花途径进行标注。
表达与春化相关的基因聚集在三个大组中(图。6的同义词:包含…同义词的SUF4 VIN3,而且EMF2,在NV和SV组织中表达较低,而在LV植物中表达较强。第二组由LV中轻微上调的基因组成,第三组包含VRN1,SOC1, TFL2它们在NV和SV植物中的过度表达很明显,但在LV植物中表达下调。qRT-PCR分析本组3个基因的表达,PRMT5 VIN3,而且AGL19在春化鳞茎中表现出一致的过度表现(图。6b)。
在硅片分析中,与光周期通路相关的基因产生了四个差异表达簇(图。7a).一类包括在LV植物中过度表达的基因,具有极高的过表达VOZ1它以参与长日光周期、冷驯化和开花的正调控而闻名。另一组由上调的基因组成FLR1.2,而LV导致这些基因下调。同一簇还包括一组昼夜节律基因(Cka1, cka2, lhy, cca, cul4)在NV和SV处理后均有过表达,在长时间春化后则下调。其他两个簇在不同处理间表达差异适中。有些在长时间春化后会轻微下调(例如,Ckb1, atan11, cdf3, adg1)(图。7a). 4个特异性基因的qRT-PCR表达分析Sto, lhy, jmj18,而且FKF,它们的过表达主要表现在SV和国标而且JMJ18对左心室也有类似的反应。7b)。
春化处理对光周期通路相关基因表达的影响。一个对30个注释基因进行硅胶分析(附加文件4:表S1),分为四个类;表达式值(FPKM;复制的平均值)进行log2转换。b4个基因的相对表达,经qRT-PCR验证
在贮藏处理结束的当天,对根尖分生组织的显微镜检查清楚地显示了植物的外观,无论处理如何[数据未显示]。然而,转录组分析表明,许多基因的高表达,注释为活跃的分生组织身份。热图由至少四组不同的基因组成。8a).大多数与分生组织由营养状态向生殖状态转变相关的DEGs在LV后下调,但是Agal2, ahl29, ld而且手段在一组中,LV治疗后患者比例过高。另一簇由NV和LV植物中下调的基因组成,而SV导致了相当大的上调。第三个聚类代表NV的轻微上调,而第四个聚类包含NV和SV鳞茎的过度表达基因(Arf2, mbr1, j3, ft1, fd2)在长时间冷藏后显著下调(图5。8a).需要注意的是,RT-qPCR方法与RNAseq结果相比具有更高的方差,因此这两种方法得到的表达结果可能存在差异。qRT-PCR检测FT1而且FT4表达量与硅片结果并不一致,但相对表达量与硅片结果一致卡尔而且AP1证实了计算的趋势(图。8b)。
春化处理对分生组织相关基因表达的影响。一个对34个注释基因进行硅胶分析(附加文件4:表S1),按表达模式分为四类;表达式值(FPKM;复制的平均值)进行log2转换。bqRT-PCR验证了4个分生组织同源基因的相对表达
昼夜节律基因的KEGG分析
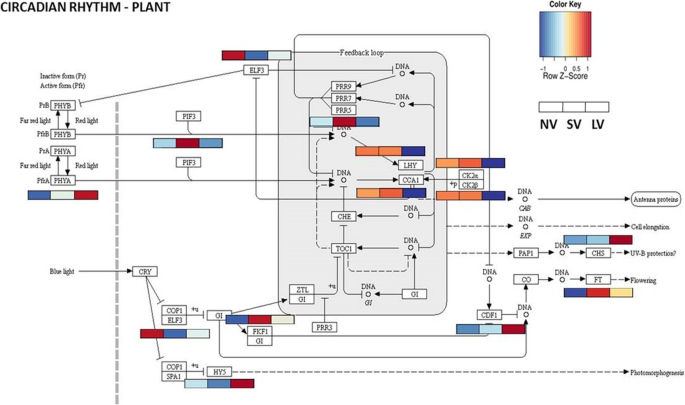
内源昼夜节律振荡器为植物提供日常变化的信息,从而控制许多发育过程。利用KEGG算法对昼夜节律(ko04712)中涉及的特定DEGs进行分析,发现昼夜节律中至少有一半基因的表达受温度的影响(图1)。9).因此,尽管存储中完全黑暗,早晨组件后期拉长的下胚轴(LHY),生物钟相关1 (cca1)NV和SV结束时表达较高,LV治疗结束时表达较低。
开花促进基因黄酮结合KELCH重复F-box1 (FKF1)和英国《金融时报》与NV和LV处理相比,SV过表达。的表达光敏色素b (phyb)不受治疗的显著影响,而光敏色素相互作用因子3在LV植株中表现明显。
讨论
长春化作用激活了大蒜的分生组织转化
许多地球植物物种,包括葱科作物,在冬季寒冷气候中进化,需要春化才能成功完成其年度发育和开花[34,39].在洋葱和大蒜中,光周期也被认为是从活跃生长时期过渡到休眠时期的重要环境线索[58,70].我们的数据支持本·迈克尔等人的发现。7仅春化过程就能满足顶端分生组织转变的需要——这是大蒜开花和鳞茎生长的第一步,也是必不可少的一步。本研究研究了冷处理对分生组织向活性生长和开花的遗传相互作用的影响。
我们的研究结果显示,低温是触发分生组织转变的主要环境线索。1),而光周期可能只在植物发育的后期发挥调节作用[38].需要注意的是,在洋葱中,低温促进开花,长光周期诱导球茎生长[70].然而,在大蒜中,低温满足了这两个过程的要求[7].因此,分子对分生组织转变和植物进一步发育的控制可能存在差异答:cepa而且答:一种.
大蒜分生组织转移与表观遗传学有关
转录组分析显示,在与种植前贮藏条件相关的顶端分生组织中,表观遗传和染色质基础的过程发生了显著的改变。3.).人们普遍认为甲基化在适应环境压力和植物的“冬季记忆”中起着核心作用[28,42].我们的研究显示,在春化和非春化鳞茎的所有比较中,甲基化活性均显著,这些途径应进一步研究。
在黑暗中春化会触发光反应和光周期相关基因
分生组织的转录变化编码了两个重要代谢途径的主要改变:(1)休眠释放和活跃生长的开始,(2)分生组织从营养状态过渡到生殖状态,从而结束顶端优势和腋芽的生长。以往的生理学和分子研究表明,温度调节的休眠释放与激素运输、碳、肽和类黄酮的代谢有关[59,63,66,93].我们现在提供的证据表明,对于同样的生理变化,在转录水平上,许多基因参与了细胞分裂、分化和生长(图。2b和3.).大蒜分生组织通过大量细胞成分和代谢过程的强烈重组来响应春化(图1)。4).在暗储存的春化分生组织中,我们发现了大量与光反应和光合作用相关的氧化石墨烯术语。因此,我们得出结论,标记为“光合作用活性”的基因在这里基本上是由低温调节的。在常绿果园草中也得到了类似的结果,春化和光周期基因在分生组织转变过程中参与并共同表达[20.].Leeggangers等人[46]报道说,在夏季高温诱导花的过程中,休眠的郁金香球茎的光形态建成、光周期、对光刺激的响应和昼夜节律等氧化石墨烯术语被上调。他们解释说,地上干燥的叶子可能会接收光或光周期信号。这些线索随后被传递到分生组织,从而产生花诱导效应。然而,在我们的实验中,球茎在黑暗中储存之前,叶片和根系都被移除,因此光周期基因的诱导不太可能。因此,我们认为上述基因的上调完全是冷依赖性的。
分生组织转化过程中的基因共表达
在植物中,分生组织从营养状态到生殖状态的转变是由一个多方面的遗传网络编码的,包括光周期、赤霉素、春化和自主信号模块[2,21,61,84].接收光周期信号可提供有关季节变化的可靠信息,因此保存良好[83],而春化需求及其基因组成在不同物种之间差异很大。后一种变异源于这样一个事实:为了更好地适应当地的气候周期,在一些植物类群中,冬季记忆的获取是独立进化的[10].因此,在春化感知上存在较大差异拟南芥及其相关种(十字花科;[60)、谷类(禾本科;[74]),蔷薇科[41等。我们采用了大蒜转录组目录[37在一项与大量基因和途径的比较研究中。这些开花基因的分析揭示了基因共表达网络中的几个模块(图1)。5).虽然注释为春化基因的大蒜转录本在这个网络中只占很小的部分,但它们位于中心位置。春化基因与许多与光反应相关的基因以及与花期光周期控制相关的基因共同表达(图。5).因此,我们认为春化的分子级联在一定程度上包含了编码光周期通路的基因。后者与的同义拟南芥国标(主要作用于对光和光周期的反应,[50]),LHY(昼夜节律和光周期,[22]),FKF1(调节生物钟依赖的花期过渡;[88]),VOZ1(促进光敏色素B (phyB)下游开花,[96])和CKA1而且CKA2(昼夜节律,光形态发生,[55])。
处理对春化和光周期基因差异表达的影响是明显的(图。8).这些基因在LV植株中大量下调(图5)。6而且7),从而表明,在分子水平上,LV处理结束时,已经发生了向生殖阶段的过渡。事实上,分生组织身份基因的差异表达支持了这一假设。8).
开花信号积分器,如拟南芥TFL1,在分生组织转化过程中作为光周期编码基因和温度编码基因之间的枢纽发挥重要作用[85].在草莓,FvTFL1整合光周期和温度信号抑制开花[73].在大蒜中,基因共表达分析指出了一些在开花过程中可能起关键作用的基因。因此,SUF4三个模块之间的联系与许多开花基因积极共表达(图。5),而春化相关基因AGL19与光周期和分生组织身份基因呈负相关,似乎对这些基因有相当大的抑制作用(附加文件3.:图S3)。因此,SUF4而且AGL19可能在大蒜(和其他地球植物)中作为花的整合者,但需要进一步的研究来确定它们在花启动中的实际作用。
花发育的开始拟南芥是由两者之间的相互作用控制的吗多叶(长叶),无瓣1(长叶1)还有它的比喻花椰菜(CAL)[24].我们已经证明了大蒜的同源物LFY(gaLFY)是花转变、花序和花分化的关键基因[77].我们目前的研究结果显示只有微弱的表达卡尔而且AP1在春化后有明显的上调(图5)。9).因此,我们提出后一种基因相互作用gaLFY在大蒜的花转变过程中。
英国《金融时报》基因参与分生组织的转变
除了重要和保守的作用英国《金融时报》作为“成花原”,这个家族的其他基因在许多植物物种中作为一系列功能的“主”调节者。在地球植物中,它们也参与球茎/块茎生长[1,45与春化、光周期和热反应有关[47,65].大蒜是6英国《金融时报》同源物已被鉴定[37),包括AsFT2,是洋葱' florigen '的同系物,其表达与大蒜的开花启动密切相关[45,76].
洋葱的开花和鳞茎,成簇洋葱(答:fistulosum)和许多其他地球植物在生理和分子水平上都是两个竞争过程[11,17,45,70].我们目前的研究结果表明,与洋葱相似,在大蒜低温影响下调AsFT4和上调AsFT2.的差异英国《金融时报》短日和长日洋葱品种之间的表达已经显示出来[56,57].由于大蒜在白昼较短的情况下也可以种植,英国《金融时报》该物种的基因可以以不同的方式表达和发挥功能,进一步研究该家族在大蒜不同基因型中的功能特性将有助于了解其在植物区系发生和鳞茎发育中的作用。
生物钟在温度和分生组织转化之间起着整合器的作用
植物生物钟,一种基于细胞自我维持振荡的内源性计时系统[62],可根据光周期和温度进行调整,因此可作为两种主要环境线索的整合点[13,23].事实上,我们的数据显示,与内部时钟周期相关的基因的强烈表达,例如,Cka1/2, lhy, elf3, pif3在春化大蒜(图。9),正如先前在栗子和其他植物物种中所证实的那样[23,30.].在百合中也证实了昼夜节律在低温诱导的花区发生中的作用。52,果园草(Dactylis glomerata;[20.)、萝卜(萝卜;[53,64)、大白菜(芸苔属学报;[33]),以及在树木的芽休眠破裂时[51,68].
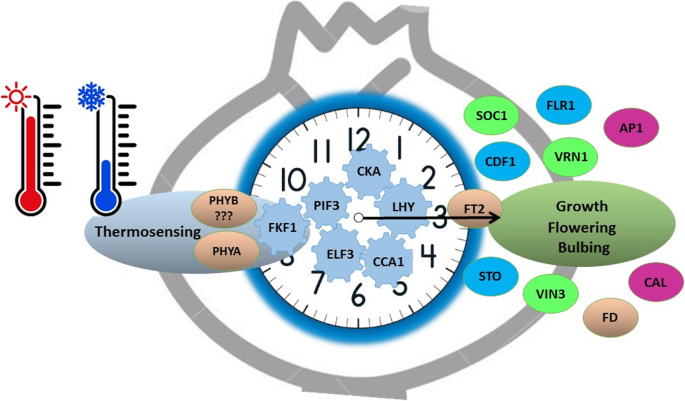
我们认为,在阴冷贮藏球茎的过程中,生物钟整合了低温信号,从而诱导春化、光周期和分生组织转变相关基因的表达(图1)。10).事实上,最近的报告证明了这一点光敏色素B(、),昼夜节律的主要光传感器,起着体温传感器的作用[32,48,69),而花期早(ELF3)传输热信息[19].类似地,在大蒜中,同义物、可作为温度传感器,通过接口传输温度信息到生物钟光敏色素相互作用因子(论坛s) (78].此外,寒冷诱导了至少14个昼夜节律时钟基因的差异表达,这些基因与光周期通路的核心紧密相连。, lhy, cca1, fkf1, cdf1,而且PRRs;[22)(图9).我们得出结论,大蒜春化的分子控制在上游点整合到保留的光周期通路中,可能是由相同的受体。
结论
鳞茎长时间的暗冷暴露是开花和鳞茎形成的主要信号,其与单株遗传组成的相互作用决定了生长阶段的表型表达。低温刺激大蒜中分子机制的大串联,包括光周期通路在内的多种开花机制通过昼夜节律共同作用,促进分生组织的转变、一年生周期和可活繁殖结果。
方法
植物材料、贮藏处理和生长条件
开花硬颈蒜87号,2004年从一个分离的幼苗种群中选择,然后在以色列博卡尼中心的农业研究组织(ARO)进行无性系繁殖,用于我们的实验(附加文件)1:图S1)。植物于2015-2016年在以色列雷霍沃特(纬度31.9°N)耶路撒冷希伯来大学Robert H. Smith农业、食品与环境学院的实验农场种植。
2015年7 - 8月,新鲜收获的球茎在环境条件下(22-35°C)储存在一个有屋顶的开放式棚内。该实验旨在确保所有鳞茎在同一时间种植,以避免季节变化.8月将健康、完整、大小一致的鳞茎置于4℃温度控制的暗室中12周(LV,长春化),10月放置4周(SV,短春化)。对照灯泡(无春化)保存在原始棚内,环境温度在20 - 30°C之间。2015年11月11日,当所有冷处理结束后,从健康完整鳞茎中取出大小一致的丁香进行RNA提取,并将同样完整的丁香种植在土壤中,在30%阴影的屏蔽室内,采用三次随机区组设计,每复制30瓣,以50株/米的速度种植2密度。室内空气温度记录和整个生长时期的光周期在附加文件中提出2:图S2。整个过程都采用了标准的农业做法,但对于每一种处理,施肥[" Shefer "液体肥料(N:P:K = 59:35:94 g L-1), Dshanim,以色列]在2016年5 - 6月,当地上部分枯萎时停止,球茎在成熟时选择性收割。每复制20株完整生长的植物(60株/处理)用于物候学和形态学研究。在完全开花时,花蕾和花从花托上分离,每处理10个花序。收获后,将叶片和花茎从球茎中分离出来,测量鲜重和干重。采收3周后记录养护鳞茎的重量和结构。利用JMP软件对植物发育数据进行单因素方差分析(ANOVA),采用Tukey-Kramer检验[31].
组织取样用于RNA/DNA分析和提取程序
当储存处理结束后,取三个生物复制的尖芽取样,并立即浸入液氮中,然后在- 80°C保存。使用CTAB协议提取总RNA [14],并使用安捷伦2100生物分析仪评估提取物质量。在接下来的研究中,只使用RNA积分值最小为7的提取物。
转录组的组装
文库准备和测序由以色列Technion生命科学与工程基因组中心完成。利用Illumina Hiseq 2500和Trueseq协议,制备了6个含100个核苷酸的对端RNA-seq文库。使用FASTX工具包(http://hannonlab.cshl.edu/fastx_toolkit/index.html,版本0.0.13.2)如下:
- (1)
使用fastq_quality_trimmer校正质量分数< 30的读端核苷酸;
- (2)
使用fastq_quality_filter,如果其中任何一个碱基对小于70%且质量评分≤30,则丢弃读对。
在加工和清洗之后,总共大约2.3亿个清洗过的成对端读被从头组装,使用Trinity软件(Trinityrnaseq version v2.3.2, [25])与默认参数Trimmomatic选项。
得到的数据根据先前发表的可育大蒜转录组目录编译[37].新的转录组目录目前共包含112,388个三位一基因,平均长度为1.178 bp, N50为1812 bp。数据已作为生物项目PRJNA566287保存在NCBI序列读取档案(SRA)数据库中。
丰度估计与差分表达式分析
使用Bowtie2比对器将每个文库中清洗过的reads与新组装的转录组进行比对[43].丰度估计使用三位一体协议计算[27]和期望最大化方法(RSEM)。归一化表达通过TMM (M值的修剪平均值)归一化和FPKM(每千碱基转录本每百万映射读取的片段)计算。
每对样本的比较和序列计数数据的差异表达分析在R环境中使用Bioconductor edgeR包进行[75].差异表达被定义为大于转录表达的两倍差异值,且错误发现校正的统计学显著性低于0.05。使用聚类分析检查处理之间至少有一个成对比较的差异表达转录本。基于两次复制的均值,对转录本和样本进行分层聚类,使用R脚本提取聚类。
功能注释
将组装好的转录组用于NCBI非冗余(nr)蛋白数据库的搜索,使用DIAMOND软件[12].使用BLASTX工具在Swiss-Prot数据库中识别同源序列[3.)E-value阈值为10−5.结果导出至Blast2GO 4.0版本[15为基因本体论(GO)赋值。KAAS工具(KEGG自动注释服务器;http://www.genome.jp/tools/kaas/)用于KEGG矫形学和KEGG路径分配。使用Blast2GO进行基因本体富集分析[15基于费雪精确测试的软件[92]用多次测试纠正错误发现率(FDR;[6])。阈值设置为修正后的FDRP-value小于0.05。ReviGO web服务器用于在基于语义相似性的散点图中可视化GO术语(http://revigo.irb.hr;[87])。
基于Pearson相关(使用R脚本)构建基因共表达网络(GCN)。使用Cytoscape 3.3.0绘制网络([81];http://www.cytoscape.org).
实时定量PCR验证
根据推测的花诱导和分生组织转化功能,选取了15个基因进行表达验证。对用于文库构建和转录组分析的RNA样本进行进一步分析。从三个样本/储存处理中获得的总RNA中各取两微克RNA样本,用于使用高容量逆转录试剂盒(应用生物系统公司,福斯特市,CA)合成cDNA。引物使用primer3.0 web-tool设计(附加文件4:表S1)。扩增子身份通过Sanger测序(生命科学核心设施,Weizmann Institute of Science, Israel)进行验证。
使用Fluidigm®系统验证基因表达。cDNA样本和非模板对照(NTC)由以色列魏茨曼科学研究所生物服务部进行分析。使用48.48 Dynamic Array™IFCs、BioMark™HD系统(Fluidigm, South San Francisco, CA)和GE Fast PCR + Melt v2协议(https://www.fluidigm.com/documents).采用Fluidigm Real-time PCR软件进行数据分析。大蒜中肌动蛋白(AY821677)和微管蛋白(AY148156)的同源基因作为内参基因,用于数据归一化和计算研究样本中mRNA的相对量。所有序列都保存在大蒜转录组目录(NCBI生物项目PRJNA566287)中。用∆∆CT法量化表达[54,并以对数尺度表示(2——ΔΔCT).
数据和材料的可用性
当前研究过程中生成的数据集被提交到NCBI存储库,生物项目PRJNA566287。
缩写
- 衣冠楚楚的:
-
种植后几天
- LV:
-
长春化
- 公司:
-
没有春化
- SV:
-
短的春化
参考文献
Abelenda JA, Cruz-Oró E, Franco-Zorrilla JM, Prat S. Potato StCONSTANS-like1通过直接激活FT-like StSP5G抑制子抑制存储器官的形成。生物学杂志2016;26:872-81。
一年生和多年生植物开花的比较分析。中国生物医学杂志2010;91:323-48。
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ。基本的本地对齐搜索工具。中华分子生物学杂志1990;215:403-10。
Andrés F, Coupland G.开花对季节线索反应的遗传基础。2012; 13:627-39。
班达拉女士,克里格K,斯林卡德AE,塔尼诺KK。春播大蒜的种前冷冻要求。植物科学与技术,2000;30(2):447 - 447。
控制错误发现率:多重测试的一种实用而强大的方法。中国生物医学工程学报,1995;
Ben Michael T, Shemesh-Mayer E, Kimhi S, Gershberg C, Forer I, de Ávila VT, Rabinowitch HD, Kamenetsky-Goldstein R.植前低温对抽茎大蒜植株构型和开花的时空影响。科学通报。2018;242:69-75。
环境感知与表观遗传记忆:通过FLC的机制洞察。植物学报,2015;43(3):447 - 447。
微调时间:自然变异告知机制基础的开关开花在拟南芥.J Exp Bot. 2017; 8:5439-52。
Bouché F,伍兹DP,阿马西诺RM。植物王国的冬天记忆:不同的开花路径。植物物理学报,2017;73:27-35。
布儒斯特莱托。洋葱和其他蔬菜葱。第二版。沃林福德:CABI;2008.
布芬克B,谢C,胡森DH。使用DIAMOND快速和灵敏的蛋白质校准。Nat Methods. 2015; 12:59-60。
Casal JJ, Qüesta JI。光和温度信号:多任务受体和转录整合子。新植绿醇2018;217:1029-34。
张志强,张志强,张志强,等。一种简便高效的松木RNA分离方法。植物生物学报1993;1:113-6。
Conesa A, Götz S, García-Gómez JM, Terol J, Talón M, Robles M. Blast2GO:功能基因组学研究中注释、可视化和分析的通用工具。生物信息学。2005;21:3674-6。
丹尼斯ES,孔雀WJ。开花的表观遗传调控。植物生物学,2007;10:520-7。
董颖,程铮,孟H,刘辉,吴成,汗阿。品种、播期和大田移栽部位对大葱抽茎的影响(葱属植物fistulosuml .)。BMC Plant Biol 2013;13:154。https://doi.org/10.1186/1471-2229-13-154.
Duncan S, Holm S, Questa J, Irwin J, Grant A, Dean C.春季化时间的季节性变化是对极端冬季的适应。eLife。2015; 4: e06620。https://doi.org/10.7554/eLife.06620.
张志华,张志华,张志华,等。晚复合体在拟南芥中协调环境和内源信号。植物学报。2017;3:17 7087。https://doi.org/10.1038/nplants.2017.87.
冯刚,黄亮,李俊,王俊,徐亮,潘磊,赵鑫,王鑫,黄涛,张旭。综合转录组分析揭示了果园草春化和花芽发育过程中不同的调控程序(Dactylis glomeratal .)。BMC植物生物学。2017。https://doi.org/10.1186/s12870-017-1170-8.
福纳拉,de Montaigu A, Coupland G. SnapShot:拟南芥开花的控制。细胞。2010;141:550。
藤原山,田田A,吉田R,等。拟南芥生理时钟蛋白LHY和CCA1通过调控SVP蛋白积累控制开花。植物细胞,2008;20:2960-71。
Gil KE, Park CM。植物生物钟的热适应与可塑性。新植物学报2019;221:1215-29。
Goslin K, Zheng B, Serrano-Mislata,等。在花起始过程中,叶状体和瓣状体之间的转录因子相互作用。植物物理学报2017;174:1097-109。
王晓燕,王晓燕,王晓燕,等。没有参考基因组的RNA-Seq数据的全长转录组组装。生物工程学报2011;29:644-52。
Guevara-Figueroa T, López-Hernández L, Lopez MG, Hurtado MD, Vázquez-Barrios ME, Guevara-Olvera L, González RG, Rivera-Pastrana DM, Torres-Robles H, Mercado-Silva EM.低温条件下处理大蒜“种子”瓣可以改变植物生长、糖、果聚糖含量和蔗糖果糖转移酶(1-SST)表达。科学通报2015;189:150-8。
王晓燕,王晓燕,王晓燕,等。利用三位一平台从RNA-seq中重新构建转录本序列进行参考生成和分析。Nat protocol . 2013; 8:1494-512。
何艳,李卓。植物表观遗传环境记忆的建立、维持和重编程。2018; 34:856-66。
开花位点C的教训:保守的染色质开关支持发育时间和适应。植物物理学报2015;168:1237-45
Ibañez C, Ramos A, Acebo P, Contreras A, Casado R, Allona I, Aragoncillo C.栗冷反应中生物钟基因表达的整体改变。PLoS One, 2008。https://doi.org/10.1371/journal.pone.0003567.
JMP 13 Pro。Cary, NC: SAS Institute Inc. 2016。
郑志华,Domijan M, Klose C,等。光敏色素作为热传感器在拟南芥.科学。2016;354:886-9。
郑文威,李阿,文JS,金YS,赵夏。大白菜春化花期相关基因及调控花期网络的全基因组鉴定。植物生物技术代表2018;12:47 - 63。
地球植物的生物多样性:植物地理、形态和生存策略。在:卡梅涅茨基R,大久保H,编辑。观赏植物:从基础科学到可持续生产。博卡拉顿:CRC出版社,泰勒和弗朗西斯集团;2012.57 - 76页。
Kamenetsky R, Zaccai M, Flaishman MA。Florogenesis。在:卡梅涅茨基R,大久保H,编辑。观赏植物:从基础科学到可持续生产。博卡拉顿:CRC出版社,泰勒和弗朗西斯集团;2012.p . 197 - 232。
大蒜:植物学和园艺。见:园艺评论-西港后纽约,第33卷;2007.p . 123 - 72。
Kamenetsky R, Faigenboim A, Shemesh-Mayer E,等。可育大蒜基因表达的综合转录组目录和器官特异性分析(大蒜l .)。BMC基因组学,2015。https://doi.org/10.1186/s12864-015-1212-2.
Kamenetsky R, London Shafir I, Zemah H, Barzilay A, Rabinowitch HD。大蒜生长与区系发生的环境调控。现代社会科学,2004;29(1):44 - 51。
温度在地球植物生长和开花中的作用。植物。2013;2:699 - 711。
Kim DH, Doyle MR, Sung S, Amasino RM。春化:植物的冬天和开花的时间。Annu Rev Cell Dev Bi. 2009;25:27 - 99。
黑仓T,米米达N,巴特伊NH, Hytönen T.蔷薇科植物季节性开花的调控。J Exp Bot 2013; 64:4131-41。
Lämke J, Bäurle I.植物在环境胁迫适应和胁迫记忆中的表观遗传和染色质机制。基因组生物学。2017。https://doi.org/10.1186/s13059-017-1263-6.
Langmead B, Trapnell C, Pop M, Salzberg SL.人类基因组短DNA序列的超快和高效记忆对齐。基因组生物学,2009。https://doi.org/10.1186/gb-2009-10-3-r25.
Lee H, Suh SS, Park E, Cho E, Ahn JH, Kim SG, Lee JS, Kwon YM, Lee i。agamouss - like 20 MADS结构域蛋白整合了拟南芥中的花诱导途径。Gen Dev. 2000; 14:2366-76。
Lee R, Baldwin S, Kenel F, McCallum J, Macknight R.开花基因位点T控制洋葱鳞茎形成和开花。2013年。https://doi.org/10.1038/ncomms3884.
Leeggangers HA, Nijveen H, Bigas JN, Hilhorst HW, Immink RG。温度依赖性花诱导的分子调控郁金香.植物物理学报2017;173:1904-19。
Leeggangers HA, Rosilio-Brami T, Bigas-Nadal J, Rubin N,等。郁金香而且百合longiflorumPEBP基因及其在花期控制中的假设作用。植物细胞物理学报2018;59:90-106。
Legris M, Klose C, Burgie ES, Rojas CC, Neme M, Hiltbrunner A, Wigge PA, Schäfer E, Vierstra RD, Casal JJ。光敏色素B集成了光和温度信号拟南芥.科学。2016;354:897 - 900。
李伟,刘旭,陆勇。东方百合春化反应的关键候选基因的转录组比较。BMC基因组学,2016。https://doi.org/10.1186/s12864-016-2955-0.
李芳,孙娟,王东,白s, Clarke AK, Holm M. B-box家族基因STO (BBX24)拟南芥通过不同途径调节花期。PLoS One, 2014。https://doi.org/10.1371/journal.pone.0087544.
刘刚,李伟,郑鹏,徐涛,陈磊,刘丹,Hussain S,滕燕。‘苏里’梨的转录组学分析(Pyrus pyrifolia通过RNA-Seq对白梨组)的芽进行休眠。BMC基因组学,2012。https://doi.org/10.1186/1471-2164-13-700.
刘旭,王强,顾健,Lü Y.东方杂交百合Sorbonne春化:生理代谢活性的变化及分子机制。Mol Biol rep 2014; 41:6619-34。
刘超,王松,徐伟,刘旭。萝卜全基因组转录组分析(萝卜L.)的春化反应。PLoS One, 2017。https://doi.org/10.1371/journal.pone.0177594.
Livak KJ, Schmittgen TD。使用实时定量PCR和2−ΔΔCT方法分析相关基因表达数据。方法。2001;25:402-8。
吕世祥,刘红,Knowles SM,李娟,马琳,Tobin EM,林晨酪蛋白激酶2拟南芥生物钟中的α亚基。植物物理学报,2011;157:1537-45。
Lyngkhoi F, Khar A, Mangal M, Gaikwad AB, Thirunavukkarasu N.短日洋葱鳞茎与开花位点T (FT)基因的表达分析及相关性(英文)洋葱l .)。印度J Genet Pl Br 2019; 79:77-81。
Manoharan RK, Suk J, Han H, Vijayakumar H, Subramani B, Thamilarasan SK, Park JI, Nou IS。葱属开花位点T同源物的分子和功能特征cepa.分子。2016;21:217。https://doi.org/10.3390/molecules21020217.
张志强,张志强,张志强,等。长光周期对大蒜生殖和鳞茎发育的影响(大蒜l .)基因型。环境科学学报2011;71:166-73。
Maurya JP, Bhalerao RP。光周期和温度对树木生长停止和休眠的调控:分子视角。Ann Bot. 2017; 120:351-60。
Michaels SD, Amasino RM。开花基因座C活性的缺失消除了FRIGIDA的晚开花表型和自主通路突变,但对春化反应性无效。植物细胞,2001;13:935-41。
花期的控制:相互作用途径作为多样性的基础。植物细胞,2002;14:111-30。
监测植物中单个细胞的昼夜节律。植物学报2018;131:15-21。
Née G,向勇,Soppe WJ。休眠的解除,唤醒了种子的发芽。植物生物学杂志2017;35:8-14。
聂松,李超,徐磊,王艳,黄东,Muleke EM,孙鑫,谢艳,刘磊。萝卜新生转录组分析(萝卜L.)和与抽苔和开花有关的关键基因的鉴定。BMC基因组学,2016。https://doi.org/10.1186/s12864-016-2633-2.
Noy Porat T, Cohen D, Mathew D, Eshel A, Kamenetsky R, Flaishman MA。热启动:花转化过程中水仙FT和lfy样基因的差异表达。J Exp Bot 2013; 64:3273-84。
主要观赏植物的植物学和园艺学研究。在:卡梅涅茨基R,大久保H,编辑。观赏植物:从基础科学到可持续生产。博卡拉顿:CRC出版社,泰勒和弗朗西斯集团;2012.p . 77 - 117。
Oliver SN, Finnegan EJ, Dennis ES, Peacock WJ, Trevaskis B.谷物春化诱导开花与春化1基因组蛋白甲基化变化相关。科学通报2009;106:8386-91。
植物的温度感知和信号转导。植物学报2008;179:615-28。
邱颖,李敏,Jean R, Moore CM,陈敏。拟南芥光敏色素B通过转录激活子HEMERA感知白天温度。2019年。https://doi.org/10.1038/s41467-018-08059-z.
Rabinowitch高清。开花生理学。在:Rabinowitch HD, Brewster JL编辑。洋葱及相关作物,第1卷。博卡拉顿:CRC出版社;1990.113 - 34页。
马建平,陈建平,陈建平。贮藏温度对蒜瓣萌发和发育的影响(大蒜l .)。Sci Hort. 1988; 7:25-38。
环境操纵对大蒜鳞茎生长的影响。植物学报2001;555:181-8。https://doi.org/10.17660/ActaHortic.2001.555.27.
Rantanen M, Kurokura T, Jiang P, Mouhu K, Hytönen T.草莓TERMINAL FLOWER 1同源物整合光周期和温度信号抑制开花。植物学报(英文版)2015;
Ream TS, Woods DP, Amasino RM。不同植物类群春化的分子基础。冷泉港定量生物学杂志2012;7:105-15冷泉港实验室出版社。
罗宾逊医学博士,麦卡锡DJ,史密斯GK。edgeR:用于数字基因表达数据的差异表达分析的生物导体包。生物信息学。2010;26:139-40。
Rohkin-Shalom S, Gillett D, Zemach H, Kimhi S, Forer I, Zutahy Y, Tam Y, Teper-Bamnolker P, Kamenetsky R, Eshel D.贮藏温度通过茎尖分生组织终止控制大蒜球茎形成的时间。足底。2015;242:951 - 62。
Rotem N, David-Schwartz R, Peretz Y, Sela I, Rabinowitch HD, Flaishman M, Kamenetsky R.大蒜花发育:gaLFY表达的起伏。足底。2011;233:1063 - 72。
Sakamoto T, Kimura S.植物温度传感器。传感器。2018。https://doi.org/10.3390/s18124365.
Samach A, Onouchi H, Gold SE, Ditta GS, Schwarz-Sommer Z, Yanofsky MF, Coupland G. CONSTANS靶基因在拟南芥生殖发育中的独特作用。科学。2000;288:1613-6。
Searle I, He Y, Turck F, Vincent C, Fornara F, Kröber S, Amasino RA, Coupland G.转录因子FLC通过抑制拟南芥分生组织能力和系统信号通路,使开花响应春化。基因开发2006;20:898-912。
Shannon P, Markiel A, Ozier O, Baliga NS, Wang JT, Ramage D, Amin N, Schwikowski B, Ideker T. Cytoscape:生物分子相互作用网络集成模型的软件环境。Genome Res. 2003; 13:2498-504。
舍梅什-梅尔E、本-迈克尔T、罗特姆N、拉比诺维奇HD、多隆-费根博伊姆A、科斯马拉A、佩利科夫斯基D、谢尔曼A、卡梅内茨基r大蒜l)育性:转录组和蛋白质组分析提供了对花和花粉发育的深入了解。植物科学进展,2015。https://doi.org/10.3389/fpls.2015.00271.
拟南芥的生物钟和光周期开花:CONSTANS是信号整合的中枢。植物物理学报2017;173:5-15。
宋永华,沈俊杰,金月-舒尔茨,Imaizumi T.叶片光周期开花时间测量机制。植物生物学杂志2015;66:441-64。
Strasser B, Alvarez MJ, Califano A, Cerdán PD。ELF3和TFL1在环境温度调节开花时间方面的互补作用。植物学报2009;58:629-40。
Sung S, Amasino RM。春化和表观遗传学:植物如何记住冬天。植物生物学,2004。https://doi.org/10.1016/j.pbi.2003.11.010.
Supek F, bonjak M, Škunca N, Šmuc T. REVIGO总结和可视化了基因本体术语的长列表。PLoS One, 2011。https://doi.org/10.1371/journal.pone.0021800.
Takato I, Kay SA。开花的光周期控制:不仅仅是巧合。植物科学进展2006;11:550-8。
张国强,张国强。植物开花与不开花:微rna在植物开花过程中的作用。植物学报2015;8:359-77。
特雷瓦斯基斯B,亨明MN,丹尼斯ES,孔雀WJ。谷物春化诱导开花的分子基础。植物学报2007;12:352-7。
Turck F, Fornara F, Coupland G.成花原的调控与鉴定:开花位点T移动到中心阶段。植物学报2008;59:573-94。
厄普顿GJ。费雪精确判别法。中华科学杂志1992;155:395-402。
王艳,赵红,王艳,于松,郑莹,陈卓。比较生理和代谢组学分析揭示了郁金香对贮藏温度的自然响应。足底。2019;249:1379 - 90。
吴超,王敏,程铮,孟h。大蒜的响应(大蒜L.)抽苔和球茎对温度和光周期处理的影响。生物生物学公开赛。2016;5:507-18。
吴超,王敏,董颖,程铮,孟h。大蒜的生长、抽苔及产量(大蒜L.)对丁香冷却处理的反应。科学通报2015;194:43-52。
拟南芥维管植物ONE-ZINC finger - 1和VOZ2抑制开花位点C分支成员控制开花时间生物技术与生物化学。2014;78:1850-5。
确认
不适用。
资金
本研究部分由Classeed有限公司资助。资助机构没有参与研究的设计、数据的收集、分析和解释,也没有参与撰写手稿。
作者信息
从属关系
贡献
TEBM、RKG、ESM、HDR进行实验设计、数据分析解读、撰写稿件。AF进行了生物信息学分析和数据解释。IF、CG和HS协助实验工作和数据解释。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:图S1。
实验设计流程图,包括种植前处理、形态生理研究、转录组分析和87号大蒜候选基因的验证。
附加文件2:图S2。
2015年10月至2016年9月,以色列雷霍沃特的日长和平均日温度。
附加文件3:图S3。
大蒜春化(绿色)、光周期(蓝色)通路和分生组织转化(紫色)相关基因的共表达为阴性。使用网络绘图软件Cytoscape分析三种春化处理的数据[80].Pearson相关值大于0.9。
附加文件4:表S1。
用于qRT-PCR验证的引物列表。大蒜中actin (AY821677)、微管蛋白(AY148156)和NADH (TRINITY_DN98625_c0_g3)的同源基因作为内参基因,用于数据归一化和计算研究样本中mRNA的相对量。
附加文件5:表S2。
根据UniProt数据库和文献调查,列出与分生组织转化、光周期通路和春化相关的74个基因及其相关GO术语和简短描述。
权利与权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于本文
引用本文
本·迈克尔,t.e.,费根博伊姆,A.,谢梅什-梅尔,E.。et al。黑暗相声:球茎春化通过昼夜节律和光周期途径激活分生组织转变。植物生物学20.77(2020)。https://doi.org/10.1186/s12870-020-2269-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-2269-x
关键字
- 大蒜
- 灯泡
- 开花
- 生殖分生组织
- 低的温度