- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
玉米茎秆强度的遗传定位和基因组选择gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba196gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
玉米是最重要的主食作物之一,在世界各地广泛种植。茎秆倒伏会造成玉米产量的巨大损失。然而,皮透度计(RPR)被公认为评价茎秆强度的可靠测量方法,已被证明是提高茎秆抗倒伏能力的有效方法。连锁作图是研究目标性状遗传结构的一种公认的方法。此外,利用全基因组标记的基因组选择(GS)提高了遗传复杂性状的选择效率。本研究利用两个重组自交系(RIL)群体对RPR的遗传基础进行了分析,并对其在7个生长阶段进行了评价。gydF4y2Ba
结果gydF4y2Ba
测定茎秆强度的最佳阶段是吐丝期和吐丝后阶段。在每个RIL群体中共鉴定出66个和45个QTL。根据玉米基因注释数据库预测了几个潜在的候选基因,这些基因与细胞壁组分的生物合成密切相关。此外,基因本体(GO)富集和京都基因与基因组百科(KEGG)通路分析进一步表明,与细胞壁形成相关的基因参与了RPR的测定。此外,基因组选择的多变量模型相对于单变量模型和将rpr相关位点作为固定效应的模型有效地提高了预测精度。gydF4y2Ba
结论gydF4y2Ba
RPR的遗传结构是高度复杂的。多个小效应QTL共同参与控制RPR的表型变异。多个阶段鉴定的多效QTL可能含有可靠的基因,可用于开发提高茎秆强度选择效率的功能标记。基因组选择技术在RPR育种中的应用有望加快育种进程,提高茎秆强度和抗倒伏性。gydF4y2Ba
背景gydF4y2Ba
茎秆倒伏会严重影响光合作用和物质运输,每年导致全球玉米产量减少5%至20% [gydF4y2Ba1gydF4y2Ba].遗传、自然条件、田间管理、病虫害等多种因素可导致植株稳定性差和茎秆倒伏[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].强壮的茎秆可以减少倒伏的发生,因为茎秆机械强度与茎秆倒伏负相关[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].因此,茎秆强度可用于评价茎秆抗倒伏性。已经开发了几种测量茎秆强度的方法,包括茎秆弯曲强度、茎秆破碎强度和果皮穿透仪强度(RPR) [gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].与其他方法相比,RPR操作简单高效,不需要破坏秸秆结构,不影响植株生长,具有明显的优势[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].因此,研究多个成长阶段的RPR可以被视为确定最佳测量周期的可行策略。此外,RPR在前期研究中也与茎秆抗倒伏性显著正相关[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].此外,对RPR进行了有目的的选择,并已证明能够同时提高茎秆质量和抗倒伏性[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].gydF4y2Ba
在RPR的遗传结构方面,已有研究利用关联和连锁作图来识别数量性状位点(QTL),目的是开发功能标记进行标记辅助选择(marker-assisted selection, MAS)以提高茎秆强度。具体来说,是多个FgydF4y2Ba2:3gydF4y2Ba利用SSR标记对群体进行基因分型,分析了RPR的遗传基础,比较了表型选择与MAS的效率。共检测到35个与RPR相对应的QTL,这清楚地表明茎秆强度的复杂性[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].此外,当QTL来自同一群体而非不同群体时,对于高RPR的MAS已被证明比表型选择更有效[gydF4y2Ba23gydF4y2Ba].此外,构建了多个重组自交系(RIL)和双单倍体(DH)群体来探索rpr相关位点,并利用单核苷酸多态性(SNP)标记建立了高质量的连锁图。这些研究预测的潜在候选基因与木质素和纤维素的生物合成直接或间接相关,说明细胞壁成分可能参与了RPR的确定和形成[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].另一方面,在玉米嵌套关联映射面板与自然群体的全基因组关联研究(GWAS)中发现了一系列与RPR相关的显著关联位点,进一步表明了RPR的遗传复杂性[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].尽管如此,茎秆强度的基因组选择(GS)很少有报道,并且在以前的研究中获得的预测精度不理想[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].为了在实际育种项目中预测GS策略中的茎秆强度,需要提高预测能力。gydF4y2Ba
在本研究中,我们着重分析了RPR的遗传结构,并为植物育种家提高茎秆抗倒伏的选择效率提供了一些有用的建议。本研究的数据集包含两个RIL群体7个阶段评估的表型数据和从SNP阵列获得的基因型数据,用于识别rpr相关位点并进行基因组选择。我们的目标是:(1)确定茎秆强度的最佳测量阶段;(2)分析RPR的遗传结构;(3)预测与RPR相关的潜在候选基因和生物学途径;(4)采用多模型进行基因组选择,提高育种效率,为实际育种方案寻求一些可取的措施。gydF4y2Ba
结果gydF4y2Ba
RPR的表型变异和阶段间的复杂关系gydF4y2Ba
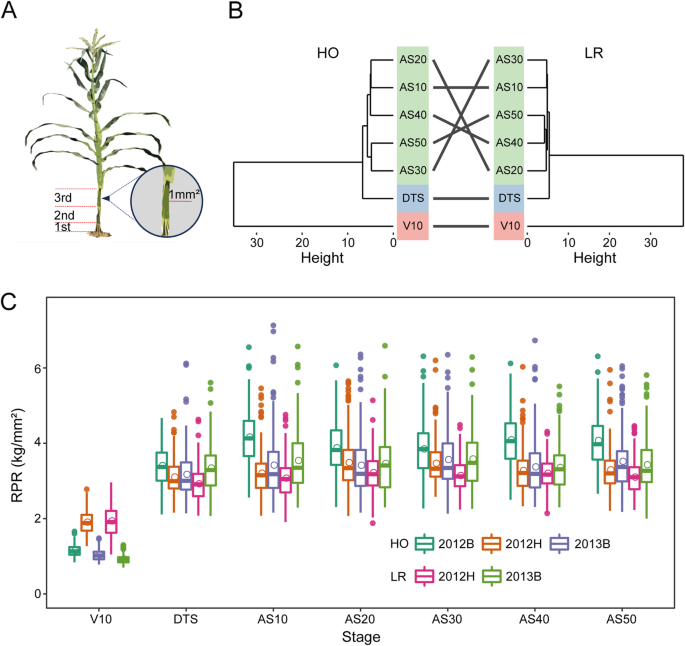
根据之前的研究和我们小组的研究结果[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba],选择第三个离地茎秆节间进行RPR,以评估茎秆强度(图;gydF4y2Ba1gydF4y2Baa).在多个阶段、环境和RIL群体中评估的RPR值均呈正态分布,每个阶段最小值与最大值之间的差异为1.90- 3.33倍(附加文件)gydF4y2Ba1gydF4y2Ba:图S1)。V10与其他各生育期的表型相关系数均低于DTS与吐丝后各生育期的表型相关系数,且显著低于gydF4y2BargydF4y2BapgydF4y2Ba丝后各阶段之间(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。对两个RIL群体中RPR的表型变异进行了表型聚类分析(图2)。gydF4y2Ba1gydF4y2Bab). 7个阶段的RPR值分为3组,其中AS10、AS20、AS30、AS40和AS50为最大聚类,属于繁殖生长期。V10期和DTS期分别分为另外两组(图。gydF4y2Ba1gydF4y2Bab).另一方面,利用不同环境下不同阶段的数据绘制各RIL种群的RPR箱线图。更准确地说,在每个环境中,RPR从V10阶段增加到AS50阶段,然后从DTS阶段到后续阶段略有增强(图5)。gydF4y2Ba1gydF4y2Bac).此外,在其他环境下,2012H V10阶段RPR显著高于V10阶段。此外,在2012B的两个RIL群体中,从DTS期到AS50期评估的RPR均大于其他环境(图2)。gydF4y2Ba1gydF4y2Bac).进行方差分析,估计广义遗传力。的gydF4y2BaHgydF4y2Ba2gydF4y2Ba各群体V10期的RPR相对于其他阶段最低。广义遗传率因期而异,除V10期外,所有期均大于67.0%(附加文件)gydF4y2Ba1gydF4y2Ba:表S1)。gydF4y2Ba
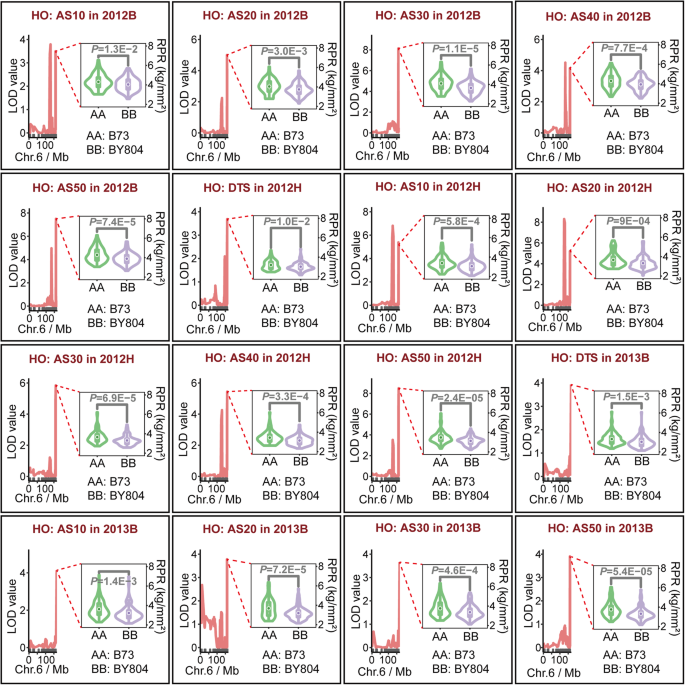
在每个RIL群体中表皮穿透计抗性的广泛表型变异。gydF4y2Ba一个gydF4y2BaRPR测量图。探头截面积为1mmgydF4y2Ba2gydF4y2Ba.gydF4y2BabgydF4y2BaRPR的分级聚类在每个RIL群体中分为7个阶段进行评估。高度定义为集群之间的欧氏距离。gydF4y2BacgydF4y2Ba在多个环境中测量了七个阶段的RPR表型变异。HO:高油群体(B73 × BY804);LR:抗倒伏群体(郑58 × HD568);RPR:皮透电阻;V10:第十叶期;DTS:天至丝;AS10:丝绸后10天;AS20:丝绸后20天;AF30:丝后30天;AS40:丝后40天; AS50: 50 days after silking; 2012B: Beijing in 2012; 2012H: Hainan in 2012; 2013B: Beijing in 2013
高密度联动图的构建与质量gydF4y2Ba
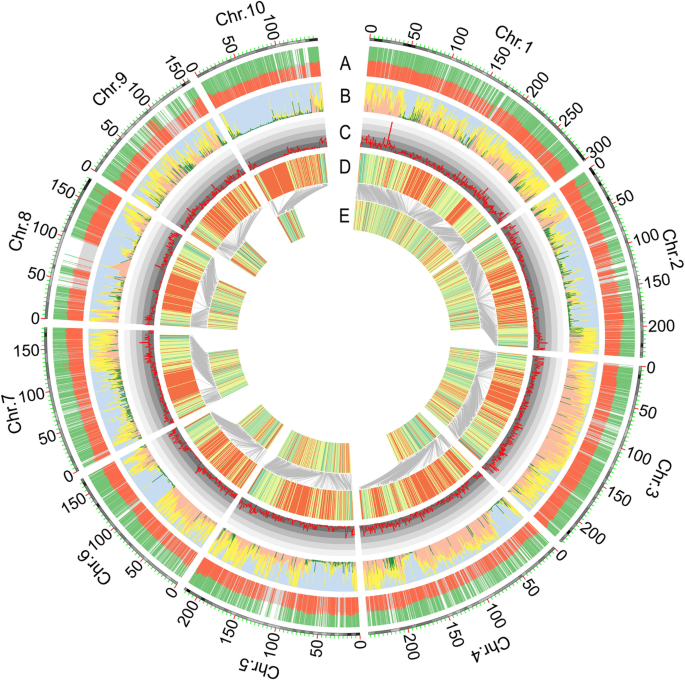
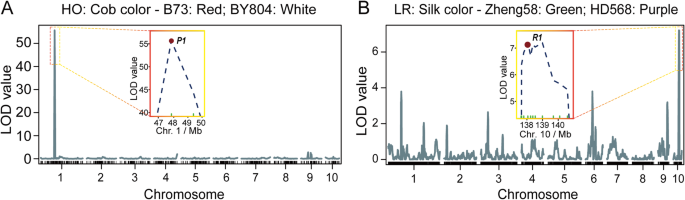
在对基因型数据进行质量控制后,总共保留了15167个SNPs,然后总共有11691个SNPs通过了卡方检验,在LR群体中显著性水平超过0.05(图2)。gydF4y2Ba2gydF4y2Ba).采用滑动窗口方法分配bin标记,利用2121个重组bin构建遗传图谱。bin标记的平均物理长度为971 Kb,最小长度为5.1 Kb,最大长度为54.4 Mb(附加文件gydF4y2Ba1gydF4y2Ba:表S2)。长度大于10mb的bin标记有19个,共有15个bin位于10条染色体的着丝点或着丝点周围区域(附加文件)gydF4y2Ba1gydF4y2Ba:表S3)。另外4个物理长度较长的重组仓lmk0203、lmk0979、lmk1002和lmk1453位于SNP覆盖率较低的区域,因为这些区域的大多数SNP被卡方检验不合格(图。gydF4y2Ba2gydF4y2Ba,附加文件gydF4y2Ba1gydF4y2Ba:表S3)。HO群体基因型数据分析中,共保留756个SNPs,无分离畸变(卡方检验,gydF4y2BaPgydF4y2Ba> 0.05),然后利用这些标记构建遗传图谱并进行进一步分析。利用R包构建HO和LR居群的连锁图谱。每个RIL群体的图谱长度分别为1642.2 cM和1519.5 cM。此外,HO和LR群体相邻标记之间的平均遗传长度分别为2.2和0.7 cM,相当于物理长度约为2.6和0.97 Mb(附加文件)gydF4y2Ba1gydF4y2Ba:表S4)。为了评价连锁图谱的质量,我们绘制了比较标记顺序的图,这表明物理图谱和遗传图谱之间存在良好的共线性(图2)。gydF4y2Ba2gydF4y2Ba,附加文件gydF4y2Ba1gydF4y2Ba:图S2)。此外,还对HO群体的穗轴颜色和LR群体的蚕丝颜色进行了QTL定位,以评估各群体的遗传图谱的威力和准确性。穗轴和蚕丝颜色的QTL称为gydF4y2BapC1gydF4y2Ba而且gydF4y2BapS10gydF4y2Ba分别在1号染色体的47.8 Mb和10号染色体的138.1 Mb处检测到的LOD值最高,分别为55.7和7.2。gydF4y2Ba3.gydF4y2Ba).为gydF4y2BapC1gydF4y2Ba,一个克隆基因,gydF4y2BaP1gydF4y2Ba(gydF4y2Ba果皮color1gydF4y2Ba),可调节果仁果皮、穗轴颖片、流苏颖片和花丝等花器官中的红色类黄酮素和酞酚[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba],存在于该QTL中。一个经典基因,gydF4y2BaR1gydF4y2Ba,位于QTL中gydF4y2BapS1gydF4y2Ba调控组织中花青素色素沉着的蛋白0与果仁果皮和丝的颜色相关[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].gydF4y2Ba
LR(郑58 × HD568)群体基因型数据的分布及分析过程带鳞片的最外层代表玉米的10条染色体。gydF4y2Ba一个gydF4y2BaRIL群体中各多态性SNP的分布比例。红色表示郑58基因型的个体比例;绿色表示来自HD568基因型的个体比例;灰色颜色为0.5的参考线。gydF4y2BabgydF4y2Ba10条染色体内每个SNP卡方值的分布。绿色表示不合格标记gydF4y2BaPgydF4y2Ba值小于0.05。gydF4y2BacgydF4y2Ba基于卡方检验(1.0 Mb窗口大小)的合格snp的密度。不同颜色的刻度表示单位窗口大小内的标记数量,从内到外的数字为0到50,间隔为10。gydF4y2BadgydF4y2Babin标记在每条染色体上的物理分布。gydF4y2BaegydF4y2Ba链接图中bin标记的分布。灰色线表示物理图和遗传图之间共享的bin标记顺序的比较gydF4y2Ba
各RIL群体RPR的QTL定位gydF4y2Ba
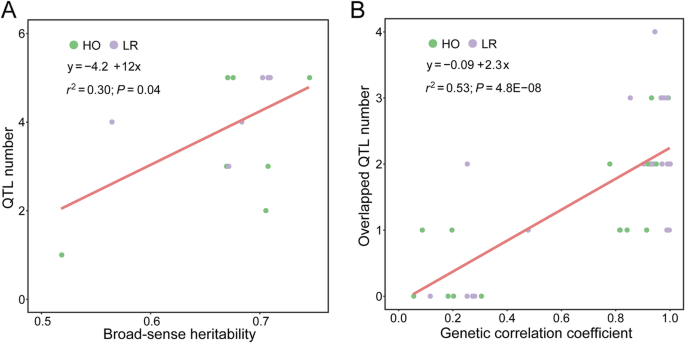
利用R包中的高质量遗传图谱,在每个环境中分7个阶段对RPR进行QTL定位gydF4y2BaR / qtlgydF4y2Ba版本1.44-9 [gydF4y2Ba35gydF4y2Ba].在HO群体中共检测到66个RPR QTL,其中26个、20个和20个QTL分别在3种环境中检测到。这些QTL的置信区间物理长度为0.83 ~ 29.11 Mb,平均长度为6.54 Mb。各QTL解释的RPR表型方差在1.95 ~ 13.61%之间,平均占RPR变异的7.01%。每个QTL的遗传效应估计范围为−0.24至0.29(附加文件gydF4y2Ba1gydF4y2Ba:表S5)。此外,当遗传效应为负时,BY804衍生的等位基因降低了RPR的茎秆强度。另一方面,当QTL的遗传效应为阳性时,来自B73的等位基因可改善RPR。共有9个QTL可以单独解释RPR中超过10%的表型方差,其中4个QTL在AS30阶段被检测到(附加文件)gydF4y2Ba1gydF4y2Ba:表S5)。此外,在2013B共鉴定出3个置信区间重叠且遗传效应较高的QTL,表明该QTL可将RPR从0.25提高到0.29 kg/mmgydF4y2Ba2gydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba:表S5)。在两种环境中共鉴定出45个QTL,其中23个QTL和22个QTL。每个QTL的置信区间为0.70 ~ 64.49 Mb,平均长度为8.37 Mb;其中38个物理长度小于14.0 Mb(附加文件gydF4y2Ba1gydF4y2Ba:表S6)。各QTL对RPR的表型方差在1.85 ~ 14.06%之间,平均占RPR变异的6.31%。此外,每个QTL的遗传效应计算范围为−0.19至0.26(附加文件gydF4y2Ba1gydF4y2Ba:表S6)。此外,如果遗传效应值为正,这些等位基因可以从HD568中衍生出来,提高RPR的茎秆强度。然而,当QTL的遗传效应为负时,等位基因可能对RPR产生负影响(附加文件)gydF4y2Ba1gydF4y2Ba:表S6)。有3个与RPR相关的QTL可以单独解释10%以上的表型方差,其中2个QTL在AS10阶段被鉴定(附加文件)gydF4y2Ba1gydF4y2Ba:表S6)。利用BLUE值分析各群体QTL数量与广义遗传力的关系,进行QTL定位。随着各阶段RPR广义遗传力估计在各环境中的增加,QTL数量也随之增加。gydF4y2Ba4gydF4y2Baa).另一方面,随着阶段间遗传相关系数的增加,两个阶段重叠QTL的数量也随之增加(图2)。gydF4y2Ba4gydF4y2Bab).最后,通过整合两个群体中111个RPR QTL的重叠基因组区,共检测到18个多效QTL (pQTL),这些QTL位于染色体1 ~ 9上gydF4y2Ba1gydF4y2Ba).其中,pQTL6-2位于6号染色体上,物理长度为8.56 Mb,置信区间包含16个在3种环境中HO群体中鉴定的QTL。该pQTL解释的表型方差在RPR变异的3.57 ~ 13.31%之间,平均为7.81%。此外,遗传效应的估计范围为−0.09至−0.24,平均效应为−0.19(表2)gydF4y2Ba1gydF4y2Ba,无花果。gydF4y2Ba5gydF4y2Ba,附加文件gydF4y2Ba1gydF4y2Ba:表S5)。此外,pQTL8的物理长度为22.42 Mb,包括9个位于第8染色体上的QTL,其中8个QTL来自LR群体,另一个QTL在HO群体中检测到遗传效应较低(表2)gydF4y2Ba1gydF4y2Ba,附加文件gydF4y2Ba1gydF4y2Ba:图S3,附加文件gydF4y2Ba1gydF4y2Ba:表S5, S6)。gydF4y2Ba
候选基因GO富集及KEGG通路分析gydF4y2Ba
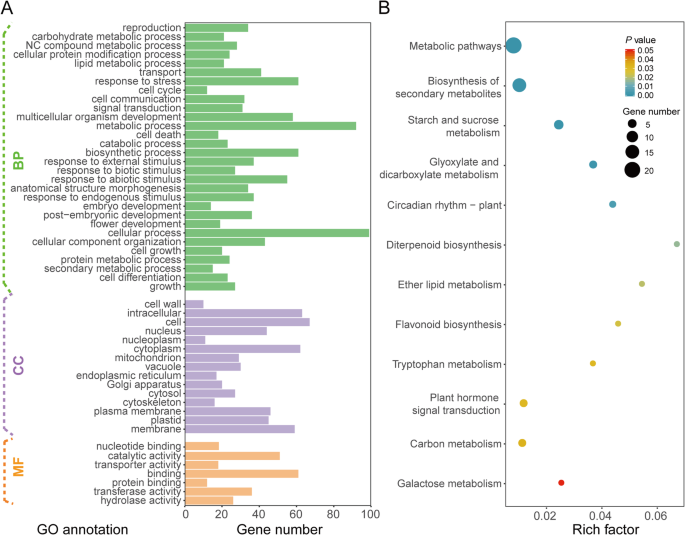
根据玉米基因标注数据库(MaizeGDB),筛选出106个预测候选基因,并标注出与这些QTL置信区间相对应的物理区域。此外,这些候选基因是根据注释数据库中描述的经典基因列表确定的,预测基因的生物学功能描述通常与物质运输和细胞生长有关(附加文件gydF4y2Ba1gydF4y2Ba:表S7)。对候选基因进行GO分析,富集项目主要包括与代谢、生物合成、应激反应和物质运输相关的生物过程。此外,与基因相关的细胞成分包括质膜、高尔基体、内质网和细胞壁(图2)。gydF4y2Ba6gydF4y2Baa).对预测基因进行KEGG分析,共鉴定出12条通路(图。gydF4y2Ba6gydF4y2Bab).这些途径包括次生代谢产物的生物合成、淀粉和蔗糖代谢、植物激素信号转导、半乳糖代谢等,这些途径可能与细胞壁的形成有关,有助于RPR的形成。gydF4y2Ba
利用考虑固定效应或多元效应的模型改进RPR的基因组选择gydF4y2Ba
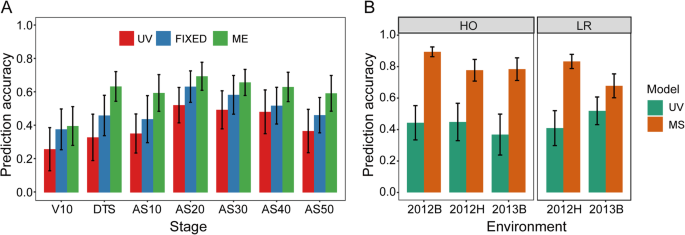
使用UV模型对HO群体的预测精度在0.06 ~ 0.52之间,使用2012年h的表型数据估计最小值。的gydF4y2BargydF4y2Ba国会议员gydF4y2Ba三种环境中V10阶段的估计值均低于其他阶段(图2)。gydF4y2Ba7gydF4y2Baa,附加文件gydF4y2Ba1gydF4y2Ba:表S8)。至于UV模型在LR种群中的表现,gydF4y2BargydF4y2Ba国会议员gydF4y2Ba在不同环境的不同阶段从0.38更改为0.58(附加文件gydF4y2Ba1gydF4y2Ba:表S8)。然而,改善gydF4y2BargydF4y2Ba国会议员gydF4y2Ba在GBLUP模型中将不同环境下各阶段检测到的QTL视为固定效应时,相对于UV模型的估计,可以达到。的最大差gydF4y2BargydF4y2Ba国会议员gydF4y2Ba2012年h内V10阶段UV模型与FIXED模型的差值为0.21。一般而言,gydF4y2BargydF4y2Ba国会议员gydF4y2Ba基于FIXED模型的数值高于基于UV模型的数值。的变化gydF4y2BargydF4y2Ba国会议员gydF4y2Ba在HO人群中,FIXED模型的估计值为0.26 ~ 0.63,LR人群中为0.41 ~ 0.61(图2)。gydF4y2Ba7gydF4y2Baa,附加文件gydF4y2Ba1gydF4y2Ba:表S8)。与FIXED模型相比,ME模型可以进一步提高预测精度,其中前两种环境下RPR的表型数据被用于构建多元模型中的辅助变量。的改进gydF4y2BargydF4y2Ba国会议员gydF4y2BaFIXED和ME模型之间的差异在每个阶段的范围为0.02 ~ 0.17。gydF4y2Ba7gydF4y2Baa).此外,FIXED模型和ME模型估计的剩余方差比例低于UV模型,每个阶段的剩余方差在0.43 ~ 0.71之间。然而,FIXED模型评估的剩余方差的比例总体上高于ME模型(附加文件gydF4y2Ba1gydF4y2Ba:表S9)。此外,MS模型将前六个阶段的RPR值作为辅助变量进行交叉验证,以预测第七阶段的RPR。的gydF4y2BargydF4y2Ba国会议员gydF4y2Ba在两个RIL群体中,相对于UV模型估计的值显著增加(图2)。gydF4y2Ba7gydF4y2Bab).此外,在MS模型中辅助变量对应的方差分量比例很高,可以解释大部分的表型方差(附加文件gydF4y2Ba1gydF4y2Ba:表S10)。gydF4y2Ba
模型间预测精度比较。gydF4y2Ba一个gydF4y2BaUV、FIXED和ME模型对HO人群预测能力的比较。gydF4y2BabgydF4y2Ba两种RIL群体中UV和MS模型预测能力的比较。UV:单变量模型,即通用GBLUP模型;FIXED:考虑rpr相关QTL作为固定效应的GBLUP模型;ME:多变量GBLUP模型,使用在其他环境中评估的表型数据作为辅助变量;MS:多变量GBLUP模型,使用其他阶段评估的表型数据作为辅助变量;HO:高油群体(B73 × BY804);LR:抗倒伏群体(郑58 × HD568);RPR:皮透电阻;V10:第十叶期;DTS:天至丝; AS10: 10 days after silking; AS20: 20 days after silking; AF30: 30 days after silking; AS40: 40 days after silking; AS50: 50 days after silking; 2012B: Beijing in 2012; 2012H: Hainan in 2012; 2013B: Beijing in 2013; the 5-fold cross-validation scheme was implemented in this case
讨论gydF4y2Ba
茎秆强度是玉米重要的农艺性状,它与茎秆倒伏和产量有关。而RPR作为一项重要的测量指标,可以有效、准确地评价茎秆强度,以提高育种系的抗倒伏性。因此,基于关联和连锁作图检测到的功能分子标记,对RPR进行遗传解剖,可为选择茎秆强度高的候选品系提供有力的辅助[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].此外,利用基因组选择还可以加速育种后期无表型的复杂性状的选育过程[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].本研究充分利用基因组信息对RPR进行了更好的基因组预测。gydF4y2Ba
2012B的茎秆强度相对于其他环境较高,可能是由于该环境的种植密度较低,说明较高的种植密度可能会降低RPR,这与之前的研究一致[gydF4y2Ba6gydF4y2Ba].根据ANOVA结果,RPR具有较高的广义遗传力,这也得到了前人研究的支持[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba],说明遗传效应在RPR表型方差中所占比例最大,以目标系为亲本构建育种群体,筛选茎秆强度高的品种,可以在早期世代实现更好的RPR选择。然而,RPR是一种复杂的数量性状,由多个基因控制,影响较小,这在以往的研究中已经讨论过[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].对于RPR相关的有利等位基因金字塔,群体循环选择育种方案可能更有效[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].总之,将早代选育与群体改良相结合,可提高选育高茎秆强度选育系的育种效率。但各RIL群体在V10期的广义遗传力较低,这可能是由于V10期为营养生长期,营养物质和干质量在此阶段大幅增加[gydF4y2Ba40gydF4y2Ba].由于节间的快速生长,单株的茎秆强度较弱,这可能受到营养缺乏、高温和干旱的影响[gydF4y2Ba41gydF4y2Ba].本研究的方差分析结果表明,在V10阶段,非遗传效应占RPR表型方差的较高比例。表型聚类和相关分析结果显示,V10阶段与其他阶段单独分离,且与其他阶段相关系数较低,进一步说明各阶段RPR可能受不同遗传因素控制,后6个阶段可能具有相似的遗传基础。然而,吐丝后的DTS与其他阶段不属于同一亚群,这可能是由于后阶段属于籽粒灌浆至成熟的籽粒发育阶段。另一方面,各RIL群体的分布箱线图显示,除V10期外,各期间RPR值差异较小。此外,这些阶段的广义遗传力相对于V10阶段较高。因此,在吐丝期或吐丝后阶段测量的RPR可用于评估茎秆强度,这一点在之前的几项研究中得到了直接证据,这些研究都是在吐丝期或开花后几周进行的[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].最后,本研究中茎秆强度较高的自交系可以作为新种质进行未来的候选杂交。gydF4y2Ba
利用基于Kosambi定位函数的R包构建各RIL群体的遗传图谱。经典和克隆基因,包括gydF4y2BaP1gydF4y2Ba[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba),gydF4y2BaR1gydF4y2Ba[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba],表明所构建的连锁图谱具有较高的质量和准确性,为后续的QTL定位分析提供了依据。RPR的广义遗传力因期而异,且与各期QTL检测数量呈正相关。这表明,如果目标性状具有较高的广义遗传力,则可以鉴定出更多的QTL,从而更好地分析复杂性状的遗传基础。另一方面,当两个阶段的遗传相关系数越来越大时,在不同阶段之间可以获得更多重叠和共同的RPR QTL。一般来说,性状之间的遗传相关性越高,QTL就越常见,这可能是由于这些性状由相似或连锁的基因控制,或具有共同的代谢途径[gydF4y2Ba43gydF4y2Ba].各实验群体中QTL的检测位置和数量在不同阶段、不同环境下普遍存在差异。研究表明,RPR可能存在不同的遗传机制,基因表达可能具有时空特异性,并在植物发育过程中的特定时间被激活。此外,各检测QTL所解释的表型方差均低于15%,与其他研究结果一致[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba19gydF4y2Ba],表明RPR由多个影响较小的等位基因控制,缺乏该性状的主要QTL。然而,有18个基因组区域重叠的多效QTL在多个阶段被鉴定出来。特别是,pQTL6-1在HO群体中在不同环境的不同阶段被重复检测到16次。此外,多效QTL pQTL8在不同阶段和环境中共被鉴定9次,其中LR群体中鉴定8次,HO群体中鉴定1次。这一现象表明,与RPR相关的某些等位基因在玉米发育过程中的各个阶段稳定表达,并在整个生育期有助于茎秆强度的形成。从另一个角度来看,本研究检测到的几个QTL,包括gydF4y2BaqAhb1-2gydF4y2Ba,gydF4y2BaqAhg2gydF4y2Ba,gydF4y2BaqAhe2gydF4y2Ba,gydF4y2BaqBhe2-1gydF4y2Ba,gydF4y2BaqBhc3gydF4y2Ba,并与之前的研究一致,在这些研究中,差异人群和基因型数据被用于进行关联或连锁映射,以探索RPR的遗传结构[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba],这进一步支持了前文提到的与RPR相关的一些QTL在不同的实验群体中稳定表达。这些基因组中的位点可以作为候选基因组区域,有可能用于精细定位和识别功能基因,从而剖析RPR的遗传机制。此外,根据本研究和以往研究的结果,确定了RPR QTL作图在实验种群间存在比较明显的差异[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].对这种差异的合理解释如下:首先,RPR被认为是一个复杂的数量性状,具有复杂的遗传机制。可能存在上位效应,即一个QTL可以与本实验群体中的一个QTL相互作用,也可以与其他遗传背景中的另一个位点相互作用,从而使该QTL在不同群体中产生不同的遗传效应;第二种解释是目标性状相关的QTL可以在该区域分离重组后合法检测到。换句话说,如果一个实验群体的双亲在一个QTL上有相同的等位基因,则相关的QTL无法被识别;第三种解释是许多具有轻微遗传效应的QTL不会被重复检测到,因为它们可能缺乏足够的统计能力来进行QTL定位[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].因此,需要进一步研究将RPR分解为几个直接成分或子因子,以便更有效地分析遗传基础,探索茎秆强度的候选基因,为标记辅助育种提供建议。gydF4y2Ba
连锁作图作为一种探索目标性状遗传结构的有效方法,在分子遗传学研究中被广泛应用于QTL的鉴定和功能基因的探索。鉴定出的QTL可用于分子标记的开发,以辅助实际育种和加速选择过程。本研究在MaizeGDB数据库中发现了几个与RPR相对应的主要候选基因。pQTL6-2中有一个模型号为GRMZM2G031200的候选基因位于6号染色体上,物理位置为164.69 Mb。这个基因的同源物gydF4y2Ba拟南芥gydF4y2Ba编码调控转录因子,即次级壁相关NAC结构域蛋白1 (SND1),它是次级壁正常生物合成所必需的,是激活这一发育程序的关键转录开关。SND1与其他转录因子结合构成转录网络,调控影响纤维次生壁生物合成的下游靶点[gydF4y2Ba45gydF4y2Ba].此外,在pQTL6-1基因组区检测到2个候选基因,由7个rpr相关QTL组成,模型id为GRMZM2G027723和GRMZM2G135108,与细胞壁组分的形成有关。第一个基因是gydF4y2BaZmCesA-2gydF4y2Ba,是生产纤维素所必需的,并参与初级细胞壁生物合成[gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba].另一个基因,也就是gydF4y2BaZmPox3gydF4y2Ba,是木质素生物合成过程中的关键基因,参与单木质素聚合,对细胞壁消化率有积极影响[gydF4y2Ba48gydF4y2Ba].此外,一个位于pQTL4-2的候选基因,gydF4y2BaZmFBL41gydF4y2Ba具有抗叶枯病和叶鞘枯病的生物学功能,并间接影响木质素的积累。该基因编码一种F-box蛋白(ZmFBL41),该蛋白与ZmCAD蛋白相互作用,敲除该基因对ZmCAD降解有负面影响,从而促进木质素生物合成,限制病变扩展[gydF4y2Ba49gydF4y2Ba].这些描述表明,与细胞壁组分对应的候选基因可能调控和决定RPR的形成。另一方面,一些研究报道了细胞壁组分的QTL定位结果[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba],其中一些QTL与本研究确定的QTL有重叠的置信区间。在HO群体中检测到的pQTL6-2,其基因组区域与前人研究中鉴定的木质素、酸性洗涤纤维(ADF)、中性洗涤纤维(NDF)、酸性洗涤木质素/NDF、体外干物质消化率(IVDMD)相关QTL的物理位置一致[gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].根据相关研究结果,pQTL4-2与IVDMD和木质素相关的其他基因座有一个物理区域重叠[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba51gydF4y2Ba], pQTL8的区间与IVDMD相关的QTL一致,且与木质素含量呈负相关[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba52gydF4y2Ba].因此,这一证据表明,某些QTL具有多效性,可以同时控制RPR和细胞壁成分的含量,这可能表明RPR与细胞壁成分密切相关,如纤维素、半纤维素和木质素,这与以往的研究结果一致[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].此外,GO和KEGG分析的结果为上述情景提供了进一步的支持,因为本研究确定了与窖组分和细胞壁形成相关的富集项目和代谢途径。因此,与RPR相关的候选基因可能参与了细胞壁组分的调控,对RPR的改善具有重要作用。gydF4y2Ba
与传统的标记辅助选择相比,基因组选择已被认为是选择复杂性状的有效方法[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba].在本研究中,使用UV模型进行交叉验证时,各阶段和种群估计的预测精度存在明显差异,这可能是由于不同情况下广义遗传力估计不同所致。这一现象与前人的研究相一致,说明广义遗传力是影响预测精度评价的重要因素[gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba].通过连锁映射识别出的功能位点信息可作为GS模型中的固定效应,以提高模型的预测能力,本研究和以往研究均采用了这种方法[gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba,gydF4y2Ba65gydF4y2Ba].然而,当固定效应模型使用解释表型方差比例低于10%的QTL时,预测精度有所提高,这与之前的研究一致[gydF4y2Ba66gydF4y2Ba].这说明与目标性状相关的QTL具有潜在的提高预测精度的能力,应在模型中发挥重要作用。本研究应用多元模型进行GS时,预测精度有了显著提高。前人研究表明,在GS模型中使用相关特征作为辅助变量可以有效提高预测精度,且明显优于单变量模型[gydF4y2Ba67gydF4y2Ba,gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba,gydF4y2Ba70gydF4y2Ba,gydF4y2Ba71gydF4y2Ba].固定模型和多元模型预测精度的提高主要是由于这些模型比单变量模型捕获了更高比例的遗传方差,如本研究和以往研究所示[gydF4y2Ba67gydF4y2Ba,gydF4y2Ba72gydF4y2Ba].另一种解释可能是多元模型可能通过在模型中使用辅助协变量来捕捉加性和非加性相互作用效应[gydF4y2Ba73gydF4y2Ba].总之,可以将遗传解剖信息或附加辅助变量整合到改进的模型中,以提高产量、RPR和其他抗性相关性状等复杂农艺性状的选择效率。在此基础上,为gs辅助育种提供了一些建议,以提高选择效率,进一步提高育种周期的遗传增益。对于具有复杂遗传结构的目标性状,第一点是基于克隆基因或验证QTL开发的功能标记信息可以应用到修改的模型中,提高标记效应估计的精度;第二点是利用遗传相关性状的信息可以获得更高的目标性状预测精度,即在统计模型中使用其他性状作为辅助变量;通过育种实验积累的历史数据可以捕捉环境与基因型之间的相互作用效应,从而提高GS模型的预测能力。这些要点可以在实际的gs辅助育种方案中更好地选择性能优良的候选品系。gydF4y2Ba
结论gydF4y2Ba
玉米茎秆倒伏严重影响植株稳定性和产量。茎秆强度是现代玉米育种中重要的农艺性状,对提高玉米抗倒伏性具有重要作用,茎秆强度高有利于减少倒伏,提高玉米产量。在本研究中,利用在三种环境中评估的表型值和来自两个RIL群体的SNP阵列识别的基因型数据进行遗传解剖和基因组选择,以进行皮肤穿透仪抗性。RPR具有较高的遗传复杂性,且各阶段差异较大。在吐丝期和吐丝后各阶段进行RPR研究,可获得较高的广义遗传力;选择这些阶段可以更好地评估候选品系的RPR。QTL定位结果表明,RPR作为一个数量性状,受多个基因控制,影响较小。然而,在不同的环境下,多个QTL热点被识别出来,这可能用于开发功能标记,以实施MAS育种选育。候选基因的注释基于MaizeGDB数据库,这些候选基因通常参与细胞壁组分的调控和形成。此外,采用各种考虑固定效应或辅助变量的模型进行交叉验证,预测精度较单变量模型有显著提高。 Finally, the illustration of linkage mapping and genomic selection can provide pertinent suggestions for improving stalk strength and further enhancing lodging-resistance in maize breeding.
方法gydF4y2Ba
植物材料gydF4y2Ba
本实验使用两个RIL群体进行。第一个来源于B73和BY804的杂交,由188个RILs组成。B73是由爱荷华州硬茎合成种群发展而来的著名精英品系。BY804是由北京高油群体选育的高粒油自交系。该RIL群体来源于中国农业大学。以优良自交系郑58和HD568为亲本的抗倒伏玉米杂交种获得215个RIL群体。郑58是一个著名的自交系,是广泛种植的玉米杂交种郑单958的亲本。以茎秆强度高为标准,有意选择HD568。最后,为了简单起见,这两个RIL群体被简称为HO(高油)和LR(抗倒伏)。gydF4y2Ba
现场试验和表型gydF4y2Ba
试验采用随机不完全区组设计,每年进行两次重复。HO群体试验主要于2012年夏季在北京进行,所有株系单行播种,种植密度为49,500株/公顷。在2012年冬季和2013年夏季分别对海南省和北京市的RIL种群进行了评价。每一行为单行地,种植密度为6万株/公顷。用电子皮透度仪(aos - sl04,爱沃世科技股份有限公司)在地上第三茎节间平侧中间测定了10叶期(V10)、吐丝前(DTS)、吐丝后10 ~ 50天(AS10、AS20、AS30、AS40、AS50) 7个阶段的RPR。公司,中国河北)。本试验随机选取2 ~ 5株植物进行RPR测量,每一株系的RPR由10个测量值的平均值确定。gydF4y2Ba
表型数据分析gydF4y2Ba
方差分析、广义遗传力及最佳线性无偏估计。gydF4y2Ba
方差分析(ANOVA)采用gydF4y2Ba自动阀gydF4y2BaR包stats版本3.6.0 (R Core Team, 2019)中的函数。线性模型如下:gydF4y2Ba
在哪里gydF4y2BaygydF4y2BaijkgydF4y2Ba为目标性状的表型值,μ为总均值,gydF4y2BaggydF4y2Ba我gydF4y2Ba是遗传的影响吗gydF4y2Ba我gydF4y2BathgydF4y2Ba基因型,gydF4y2BaegydF4y2BajgydF4y2Ba是对环境的影响吗gydF4y2BajgydF4y2BathgydF4y2Ba环境中,gydF4y2Ba通用电气gydF4y2BaijgydF4y2Ba是相互作用的效果吗gydF4y2Ba我gydF4y2BathgydF4y2Ba基因型和gydF4y2BajgydF4y2BathgydF4y2Ba环境中,gydF4y2BargydF4y2BajkgydF4y2Ba效果如何gydF4y2BakgydF4y2BathgydF4y2Ba复制,gydF4y2BaεgydF4y2BaijkgydF4y2Ba是残差。广义遗传力按公式估计:gydF4y2Ba
在哪里gydF4y2Ba\({\sigma}_{\ mathm {g}}^2 \)gydF4y2Ba,gydF4y2Ba\({\sigma}_{ge}^2 \)gydF4y2Ba,gydF4y2Ba\({\sigma}_{\varepsilon}^2 \)gydF4y2Ba基因型、基因型的方差分量分别受环境相互作用和随机误差影响,且gydF4y2BargydF4y2Ba而且gydF4y2BaegydF4y2Ba分别是复制数和环境数。此外,R包gydF4y2Balme4gydF4y2Ba版本1.1-21使用以下混合线性模型(MLM)对遗传效应进行最佳无偏线性估计(BLUE) [gydF4y2Ba74gydF4y2Ba,gydF4y2Ba75gydF4y2Ba]:gydF4y2Ba
所有组成部分都是基于Liu等人(2019)[gydF4y2Ba76gydF4y2Ba].联合使用2012年冬季和2013年夏季测定的RPR表型值进行方差分析,估算BLUE值。利用BLUE值进行QTL映射,检测两者之间的关系gydF4y2BaHgydF4y2Ba2gydF4y2BaQTL数。gydF4y2Ba
RPR各阶段的层次聚类构建gydF4y2Ba
为了构建两个RIL群体中RPR的层次聚类,首先将每个阶段的BLUE值按照以下公式标准化为零均值和单位方差:gydF4y2Ba
在哪里gydF4y2BaYgydF4y2BaijgydF4y2Ba是变换后的值,gydF4y2BaXgydF4y2BaijgydF4y2Ba是BLUE值的gydF4y2Ba我gydF4y2BathgydF4y2Ba基因型gydF4y2BajgydF4y2BathgydF4y2Ba阶段,mean()定义为平均值,sd()为标准差。在此基础上,利用各阶段RPR的变换值计算各阶段对之间的欧氏距离gydF4y2Ba经销gydF4y2BaR包stats 3.6.0版本中的函数。公式如下[gydF4y2Ba43gydF4y2Ba]:gydF4y2Ba
在哪里gydF4y2BaDgydF4y2BaABgydF4y2Ba为阶段A与阶段B之间的欧氏距离值;gydF4y2BaYgydF4y2BaiAgydF4y2Ba而且gydF4y2BaYgydF4y2BaiBgydF4y2Ba的变换值是gydF4y2Ba我gydF4y2BathgydF4y2Ba基因型分别为A期和B期;n为两个RIL群体的个体数目。的gydF4y2BahclustgydF4y2Ba基于7个阶段所有对的距离值,利用函数构建了层次聚类树。gydF4y2Ba
表型和遗传相关性gydF4y2Ba
表型相关性(gydF4y2BargydF4y2BapgydF4y2Ba)是对一对目标性状的个体表型值之间的关联的测量。遗传相关性(gydF4y2BargydF4y2BaggydF4y2Ba)是一个遗传学参数,可用于评估两个性状之间遗传变异的关联程度。相关系数由以下公式估算[gydF4y2Ba77gydF4y2Ba,gydF4y2Ba78gydF4y2Ba,gydF4y2Ba79gydF4y2Ba]:gydF4y2Ba
在浸gydF4y2BapgydF4y2Ba()和covgydF4y2BaggydF4y2Ba()分别为性状间的表型和遗传协方差,和gydF4y2BaVgydF4y2BapgydF4y2Ba而且gydF4y2BaVgydF4y2BaggydF4y2Ba分别为目标性状的表型方差和遗传方差。表型和遗传相关分析使用gydF4y2Ba天哪gydF4y2BaR包中的功能gydF4y2Ba统计数据gydF4y2Ba3.6.0版本(R Core Team, 2019)和gydF4y2BaasremlgydF4y2BaR包中的功能gydF4y2BaASRemlgydF4y2Ba3.0版本[gydF4y2Ba80gydF4y2Ba),分别。利用各环境下评价的RPR表型数据估计表型相关系数。但采用2012年冬季和2013年夏季测定的RPR值进行遗传相关性分析。gydF4y2Ba
基因型数据分析gydF4y2Ba
基因分型和质量控制gydF4y2Ba
对于HO群体,所有自交系都使用Illumina MaizeSNP50 BeadChip的子集MaizeSNP3K阵列进行基因分型[gydF4y2Ba81gydF4y2Ba].缺失率大于0.20、小等位基因频率(MAFs)小于0.05的标记被剔除。然而,玉米55k SNP阵列[gydF4y2Ba82gydF4y2Ba]用于对LR群体中的所有RILs进行基因分型。LR群体基因型数据的质量控制过程基于Liu et al. (2019) [gydF4y2Ba76gydF4y2Ba].此外,对每个群体中的所有snp进行卡方检验,以筛选出分离畸变的标记(gydF4y2BaPgydF4y2Ba< 0.05)。gydF4y2Ba
bin图的构建和QTL定位gydF4y2Ba
用滑动窗口方法检测Bin标记,并对其进行比对,该方法用于识别变异调用错误和评估来自亲本的SNP等位基因的比例。bin map构造的详细方法如Liu et al. (2019) [gydF4y2Ba76gydF4y2Ba],该研究基于多项研究[gydF4y2Ba83gydF4y2Ba,gydF4y2Ba84gydF4y2Ba].利用Kosambi定位函数构建了两个RIL居群的遗传图谱gydF4y2BamstmapgydF4y2BaR包中的功能gydF4y2BaASMapgydF4y2Ba版本1.0-4 [gydF4y2Ba85gydF4y2Ba].RPR相关的QTL采用复合区间映射法进行检测gydF4y2BacimgydF4y2BaR包中的功能gydF4y2BaR / qtlgydF4y2Ba版本1.44-9 [gydF4y2Ba35gydF4y2Ba].根据多项研究分析确定了概率对数阈值(LOD)、每个QTL的置信区间和多效QTL [gydF4y2Ba76gydF4y2Ba,gydF4y2Ba83gydF4y2Ba].此外,从玉米遗传和基因组数据库(MaizeGDB,gydF4y2Bahttps://www.maizegdb.org/gydF4y2Ba).由于HO群体中保留的合格标记较少,这些snp被直接用于构建连锁图并进行进一步分析,而不检测bin标记。然而,这些bin标记可以被检查并用于LR种群的后续分析。gydF4y2Ba
GO富集及KEGG通路分析gydF4y2Ba
基因本体(GO)富集分析采用AgriGO 2.0版本(gydF4y2Bahttp://systemsbiology.cau.edu.cn/agriGOv2/gydF4y2Ba的显著水平上,采用Fisher统计检验方法和Yekutieli多重检验调整方法gydF4y2BaPgydF4y2Ba< 0.05 [gydF4y2Ba86gydF4y2Ba].此外,利用GOSlimViewer (gydF4y2Bahttps://agbase.arizona.edu/cgi-bin/tools/goslimviewer_select.plgydF4y2Ba)的AgBase [gydF4y2Ba87gydF4y2Ba].对于京都基因与基因组百科全书(KEGG)的路径注释,KOBAS 3.0版(gydF4y2Bahttp://kobas.cbi.pku.edu.cn/index.phpgydF4y2Ba),采用Fisher统计方法和Benjamini and Yekutieli FDR(错误发现率)修正法(gydF4y2BaPgydF4y2Ba< 0.05)。提取重要的GO项和KEGG项绘制图。gydF4y2Ba
基因选择gydF4y2Ba
采用5倍交叉验证方案(100个重复)评估每个模型的性能并计算预测精度(gydF4y2BargydF4y2Ba国会议员gydF4y2Ba),即基因组估计育种值(GEBVs)与表型值的相关系数。使用三个模型进行交叉验证,这些模型是从基因组最佳线性无偏预测(GBLUP)模型发展而来的。单变量模型(UV)本质上是GBLUP模型的一般形式,混合模型如下[gydF4y2Ba88gydF4y2Ba,gydF4y2Ba89gydF4y2Ba]:gydF4y2Ba
在哪里gydF4y2BaygydF4y2Ba是一个向量(gydF4y2BangydF4y2Ba× 1)表型值,1gydF4y2BangydF4y2Ba是一个向量(gydF4y2BangydF4y2Ba× 1), μ为总体均值,gydF4y2BaugydF4y2Ba随机效应服从正态分布吗gydF4y2BaNgydF4y2Ba(0,gydF4y2BaGgydF4y2Ba\({\sigma}_u^2 \)gydF4y2Ba),gydF4y2Ba\({\sigma}_u^2 \)gydF4y2Ba是遗传方差,gydF4y2BaGgydF4y2Ba为VanRaden(2008)计算的所有基因型之间的基因组关系矩阵[gydF4y2Ba88gydF4y2Ba),gydF4y2BaεgydF4y2Ba是一个向量(gydF4y2BangydF4y2Ba× 1)具有正态分布的随机项gydF4y2BaNgydF4y2Ba(0,gydF4y2Ba我gydF4y2Ba\({\sigma}_{\varepsilon}^2 \)gydF4y2Ba),gydF4y2Ba我gydF4y2Ba是单位矩阵。此外,gydF4y2BangydF4y2Ba是个体的数量。对于包含固定效应(fixed)的GBLUP模型,公式可以描述为[gydF4y2Ba76gydF4y2Ba]:gydF4y2Ba
在哪里gydF4y2BaβgydF4y2Ba是向量(gydF4y2BangydF4y2Ba× 1)固定效应,gydF4y2BaXgydF4y2Ba是(gydF4y2BangydF4y2Ba×gydF4y2BapgydF4y2Ba)设计矩阵,其他参数与上述描述一致。选取每个目标性状中QTL LOD值达到峰值的标记构建QTLgydF4y2BaXgydF4y2Ba设计矩阵,gydF4y2BapgydF4y2Ba表示目标标记的数量。然而,gydF4y2BaGgydF4y2Ba矩阵由包含的设计矩阵计算gydF4y2Ba米gydF4y2Ba-gydF4y2BapgydF4y2Ba标记,gydF4y2Ba米gydF4y2Ba为每个RIL群体中所有标记物的数量。最后,由单变量模型建立多元模型,模型如下[gydF4y2Ba67gydF4y2Ba]:gydF4y2Ba
在哪里gydF4y2BaygydF4y2Ba是一个向量(gydF4y2BangydF4y2Ba× 1)的目标变量,gydF4y2BavgydF4y2Ba辅助变量的随机效应是正态分布吗gydF4y2BaNgydF4y2Ba(0,gydF4y2BaGgydF4y2BavgydF4y2Ba\({\sigma}_v^2 \)gydF4y2Ba),gydF4y2Ba\({\sigma}_v^2 \)gydF4y2Ba的方差分量是gydF4y2BavgydF4y2Ba,其他参数与上述描述相同。的gydF4y2BaGgydF4y2BavgydF4y2Ba为多元关系矩阵,计算公式如下:gydF4y2BaGgydF4y2BavgydF4y2Ba= ngydF4y2Ba米gydF4y2BavgydF4y2Ba米gydF4y2BavgydF4y2Ba' /跟踪(gydF4y2Ba米gydF4y2BavgydF4y2Ba米gydF4y2BavgydF4y2Ba”),gydF4y2Ba米gydF4y2BavgydF4y2Ba= (gydF4y2BaygydF4y2Ba1gydF4y2Ba,gydF4y2BaygydF4y2Ba2gydF4y2Ba、……gydF4y2BaygydF4y2Ba我gydF4y2Ba、……gydF4y2BaygydF4y2Bat - 1gydF4y2Ba),gydF4y2BaygydF4y2Ba我gydF4y2Ba是一个缩放向量(gydF4y2BangydF4y2Ba× 1)的表型值gydF4y2Ba我gydF4y2BathgydF4y2Ba标准化为零均值和单位方差的环境或阶段,gydF4y2BatgydF4y2Ba是所有变量的个数,trace表示所有对角线元素的和。将t-1环境或阶段的表型数据作为模型的辅助变量。如果辅助变量来自多个环境,则多元模型可以缩写为ME。对于从多个阶段推导出来的辅助变量,用MS表示。这些模型是使用R包进行拟合的gydF4y2BaBGLRgydF4y2Ba1.0.8版本[gydF4y2Ba90gydF4y2Ba],吉布斯采样器的迭代次数设置为10,000次,前5000个样本被丢弃。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持结果的数据可以在附加文件中找到gydF4y2Ba1gydF4y2Ba在当前研究中使用和/或分析的任何其他数据集均可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- 方差分析:gydF4y2Ba
-
方差分析gydF4y2Ba
- AS10 ~ AS50:gydF4y2Ba
-
丝后10 ~ 50天gydF4y2Ba
- 蓝色:gydF4y2Ba
-
最佳线性无偏估计gydF4y2Ba
- DTS:gydF4y2Ba
-
丝绸的日子gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- g:gydF4y2Ba
-
基因选择gydF4y2Ba
- GWAS:gydF4y2Ba
-
全基因组关联研究gydF4y2Ba
- 何:gydF4y2Ba
-
很高的gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因和基因组百科全书gydF4y2Ba
- LOD:gydF4y2Ba
-
概率的对数gydF4y2Ba
- LR:gydF4y2Ba
-
耐倒伏性gydF4y2Ba
- 加:gydF4y2Ba
-
小等位基因频率gydF4y2Ba
- MAS:gydF4y2Ba
-
分子标记辅助选择gydF4y2Ba
- QTL:gydF4y2Ba
-
数量性状位点gydF4y2Ba
- 瑞来斯:gydF4y2Ba
-
重组自交系gydF4y2Ba
- 弹性分组环:gydF4y2Ba
-
表皮穿透计电阻gydF4y2Ba
- SNP:gydF4y2Ba
-
单核苷酸多态性gydF4y2Ba
- 苏维埃社会主义共和国:gydF4y2Ba
-
简单序列重复gydF4y2Ba
- V10:gydF4y2Ba
-
Tenth-leaf阶段gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
范文杰,李志强,李志强,等。玉米茎秆强度的数量性状分析。作物科学2003;43:13-22。gydF4y2Ba
- 2.gydF4y2Ba
杨晓明,杨晓明,杨晓明。玉米锚固力学研究进展,gydF4y2Ba玉米gydF4y2Ba.中国科学(d辑),2001;gydF4y2Ba
- 3.gydF4y2Ba
Esechie HA, Rodriguez V, Al-Asmi H.沙漠气候下本地和外来玉米品种茎秆倒伏成分的比较。Eur J Agron, 2004; 21:21-30。gydF4y2Ba
- 4.gydF4y2Ba
马东,谢瑞,刘霞,牛霞,侯鹏,王凯,等。20世纪50年代以来中国玉米品种与倒伏有关的茎秆特征作物科学2014;54:2805-14。gydF4y2Ba
- 5.gydF4y2Ba
米姆农协。玉米茎螟虫抗性寄主植物的选育。热带昆虫学报1985;6:369-77。gydF4y2Ba
- 6.gydF4y2Ba
赵薛J, Y,郭台铭L, Z,姚明M,张w .植物密度高的玉米如何影响基底节间发展和力量的形成。作物科学2016;56:3295-306。gydF4y2Ba
- 7.gydF4y2Ba
柯贝尔TR, Darrah LL, Zuber MS.秸秆抗压强度循环选择对玉米农艺性状和可溶性固形物的影响。作物科学,1984;24:473-8。gydF4y2Ba
- 8.gydF4y2Ba
达德利JW。两个玉米居群抗皮穿刺性的选择。作物科学1994;34:1458-60。gydF4y2Ba
- 9.gydF4y2Ba
贾佩东,张志强,张志强,张志强。单穗和双穗选择对玉米茎秆强度及其他性状的影响。作物科学2000;40:605-11。gydF4y2Ba
- 10.gydF4y2Ba
Kamran M,崔伟,Ahmad I,孟X,张欣,苏伟,等。生长调节剂多效唑对玉米茎秆机械强度、木质素积累的影响及其与抗倒伏性的关系。植物生长规律,2018;84:317-32。gydF4y2Ba
- 11.gydF4y2Ba
康明生,丁克克,张勇,马嘉瑞。玉米抗皮刺穿性的配合力研究。作物科学1999;39:368-71。gydF4y2Ba
- 12.gydF4y2Ba
苟玲,黄娟,张斌,李涛,孙锐,赵敏。群体密度对玉米茎秆抗倒伏机制及农艺特性的影响。作物学报。2007;10:1688-95。gydF4y2Ba
- 13.gydF4y2Ba
汤普森DL。用碾压强度和外皮厚度测定玉米茎秆强度。作物科学,1963;3:323-9。gydF4y2Ba
- 14.gydF4y2Ba
西贝尔EM, Darrah LL, Zuber MS.用于测量玉米茎秆强度的两种表皮穿透仪的比较。Maydica。1992;37:111-4。gydF4y2Ba
- 15.gydF4y2Ba
Martin SA, Darrah LL, Hibbard BE。玉米表皮穿透计抗性的发散选择及其对欧洲玉米螟损害和茎秆性状的影响。作物科学2004;44:711-7。gydF4y2Ba
- 16.gydF4y2Ba
胡华,刘伟,付忠,李文杰,王华,等。玉米重组自交系群体茎秆弯曲强度的QTL定位。应用理论,2013;126:2257-66。gydF4y2Ba
- 17.gydF4y2Ba
一种测量玉米茎秆强度的新技术。作物科学1961;1:378-80。gydF4y2Ba
- 18.gydF4y2Ba
马Q-H。咖啡酸3- o -甲基转移酶在两种不同抗倒伏基因型小麦中的表达。中国机械工程学报,2009;30(2):344 - 344。gydF4y2Ba
- 19.gydF4y2Ba
胡红,孟Y,王红,刘红,陈松。高油玉米群体抗皮透度的数量性状位点鉴定及密切相关茎秆性状的确定。理论应用,2012;124:1439-47。gydF4y2Ba
- 20.gydF4y2Ba
李凯,闫娟,李娟,杨霞。两个玉米重组自交系群体抗逆性的遗传结构。BMC植物生物学。2014;14:152。gydF4y2Ba
- 21.gydF4y2Ba
Flint-Garcia SA, McMullen MD, Darrah LL。玉米茎秆强度与穗高的遗传关系。作物科学2003;43:23-31。gydF4y2Ba
- 22.gydF4y2Ba
郭台铭L,黄J,太阳R,丁Z,赵董Z, m .玉米茎渗透强度的变化特征与不同density-tolerance品种。中国农业科学,2010;26:156-62。gydF4y2Ba
- 23.gydF4y2Ba
Flint-Garcia SA, Darrah LL, McMullen MD, Hibbard BE。玉米茎秆强度和第二代欧洲玉米螟抗性的表型与标记辅助选择。应用理论,2003;107:1331-6。gydF4y2Ba
- 24.gydF4y2Ba
Butrón A,马尔瓦尔RA,瑞维拉P,索恩加斯P, Ordás A,盖革HH。玉米抗逆性的遗传及其与抗粉螟虫侵袭的关系。植物育种。2002;121:378-82。gydF4y2Ba
- 25.gydF4y2Ba
Albrecht B, Dudley JW。玉米适应×外来群体杂交茎秆品质和产量的发散选择。作物科学,1987;27:48 - 94。gydF4y2Ba
- 26.gydF4y2Ba
孟杨,李娟,刘娟,胡红,李伟,刘伟,等。玉米DH及其对应单倍体群体茎秆性状倍性效应及遗传结构探索。BMC植物生物学2016;16:50。gydF4y2Ba
- 27.gydF4y2Ba
张勇,梁涛,陈明,张勇,王涛,林华,等。利用IBM Syn10 DH群体在三种环境下对玉米茎秆倒伏相关性状的遗传解剖(gydF4y2Ba玉米gydF4y2Bal .)。Mol Gen Genomics, 2019; 294:1277-88。gydF4y2Ba
- 28.gydF4y2Ba
Peiffer JA, Flint-Garcia SA, Leon ND, McMullen MD, Kaeppler SM, Buckler ES。玉米茎秆强度的遗传结构。科学通报。2013;8:e67066。gydF4y2Ba
- 29.gydF4y2Ba
张勇,刘鹏,张旭,郑强,陈明,葛峰,等。多位点全基因组关联研究揭示玉米茎秆抗倒伏相关性状的遗传结构。植物科学,2018;9:611。gydF4y2Ba
- 30.gydF4y2Ba
冯刚,刘震,吴勇,李勇,黄超。玉米品种抗倒伏性与茎刺拔强度相关性的初步研究。玉米科学,2010;18:19-23。gydF4y2Ba
- 31.gydF4y2Ba
格罗特沃尔德E,阿瑟玛P,彼得森tgydF4y2Ba交流gydF4y2Ba插入玉米gydF4y2BaPgydF4y2Ba基因。Mol Gen Genet, 1991; 230:329-31。gydF4y2Ba
- 32.gydF4y2Ba
张飞,Peterson T.玉米的比较gydF4y2Ba果皮color1gydF4y2Ba等位基因显示副同源基因重组和一个器官特异性增强子区域。《植物科学》2005;17(4):344 - 344。gydF4y2Ba
- 33.gydF4y2Ba
Scanlon MJ, Stinard PS, James MG, Myers AM, Robertson DS。63个影响玉米籽粒发育的突变体的遗传分析。遗传学。1994;136:281 - 94。gydF4y2Ba
- 34.gydF4y2Ba
沃克埃尔。的参数化gydF4y2Bar1gydF4y2Ba玉米位点与胞嘧啶甲基化增加有关。遗传学。1998;148:1973 - 81。gydF4y2Ba
- 35.gydF4y2Ba
Arends D, Prins P, Jansen RC, Broman KW. R/QTL:高通量多QTL映射。生物信息学。2010;26:2990-2。gydF4y2Ba
- 36.gydF4y2Ba
莫维森THE,海耶斯BJ,戈达德ME。利用全基因组密集标记图预测总遗传价值。遗传学。2001;157:1819-29。gydF4y2Ba
- 37.gydF4y2Ba
刘文杰,杨晓明,Pérez-Rodríguez P,崔文杰,Montesinos-López O, Jarquín D.植物基因组选择的研究进展。植物科学进展,2017;22:961-75。gydF4y2Ba
- 38.gydF4y2Ba
张志刚,张志刚。基因组选择:植物改良中的全基因组预测。植物科学进展(英文版);gydF4y2Ba
- 39.gydF4y2Ba
Jonas E, de Koning D-J。基因组选择在植物育种中有前途吗?生物技术,2013;31:497-504。gydF4y2Ba
- 40.gydF4y2Ba
休谟DJ,坎贝尔DK。玉米秸秆可溶性固形物的积累和转运。植物科学学报,2001;26(2):366 - 366。gydF4y2Ba
- 41.gydF4y2Ba
Hanway JJ。玉米的生长阶段(gydF4y2Ba玉米gydF4y2Bal .)。Agron J. 1963;55:48 - 92。gydF4y2Ba
- 42.gydF4y2Ba
赵薛J,郭台铭L, Z, Y,张w .叶切除对光合有效辐射分布的影响玉米树冠和茎的力量。中国农业科学学报,2017;16(3):344 - 344。gydF4y2Ba
- 43.gydF4y2Ba
潘强,徐勇,李凯,彭勇,詹伟,李伟,等。10个玉米重组自交系群体植株结构的遗传基础。中国生物医学工程学报,2017;gydF4y2Ba
- 44.gydF4y2Ba
导演WD。QTL分析:功率、精密度和准确度。进:帕特森,编辑。复杂性状的分子解剖。博卡拉顿:CRC出版社;1998.p . 145 - 62。gydF4y2Ba
- 45.gydF4y2Ba
钟睿,李超,周杰,McCarthy RL,叶志华。拟南芥二级细胞壁生物合成调控中的一系列转录因子。《植物科学》2008;20:2763-82。gydF4y2Ba
- 46.gydF4y2Ba
Persson S, Paredez A, Carroll A, Palsdottir H, Doblin M, Poindexter P,等。在原代细胞壁纤维素合成酶复合物中有三种独特成分的遗传学证据gydF4y2Ba拟南芥gydF4y2Ba.自然科学进展,2007;26(4):366 - 366。gydF4y2Ba
- 47.gydF4y2Ba
Holland N, Holland D, Helentjaris T, Dhugga KS, Xoconostle-Cazares B, Delmer DP。植物纤维素合成酶(gydF4y2Ba中国极限运动协会gydF4y2Ba)基因家族。植物学报。2000;123:1313-24。gydF4y2Ba
- 48.gydF4y2Ba
Guillet-Claude C, Birolleau-Touchard C, Manicacci D, Rogowsky PM, Rigau J, Murigneux A,等。核苷酸的多样性gydF4y2BaZmPox3gydF4y2Ba玉米过氧化物酶基因:外显子2中MITE插入与饲料玉米消化率变化的关系。BMC Genet 2004;5:19。gydF4y2Ba
- 49.gydF4y2Ba
李宁,林斌,王辉,李霞,杨峰,丁霞,等。自然变异gydF4y2BaZmFBL41gydF4y2Ba使玉米具有抗叶枯病和叶鞘枯病的能力。Nat Genet, 2019; 51:1540-8。gydF4y2Ba
- 50.gydF4y2Ba
王强,李凯,胡霞,史华,刘震,吴勇,等。B73×By804玉米重组自交系茎秆细胞壁组分和消化率的遗传分析和QTL定位。2019年作物j;gydF4y2Bahttps://doi.org/10.1016/j.cj.2019.06.009gydF4y2Ba.gydF4y2Ba
- 51.gydF4y2Ba
王慧,李凯,胡霞,刘忠,吴勇,黄超。玉米成熟茎秆牧草品质全基因组关联分析。BMC植物生物学,2016;16:1-12。gydF4y2Ba
- 52.gydF4y2Ba
Barrière Y, Méchin V, Lefevre B, Maltese S.玉米RIL子代农艺性状和细胞壁性状的qtl《理论与实践》,2012;gydF4y2Ba
- 53.gydF4y2Ba
Courtial A, Jourda C, Arribat S, Huguet S, Reymond M, Grima-Pettenati J,等。4种不同木质素含量和细胞壁降解性玉米ril和1个亲本细胞壁相关基因的比较表达。Maydica。2012;57:56 - 74。gydF4y2Ba
- 54.gydF4y2Ba
Courtial A, Méchin V, Reymond M, Grima-Pettenati J, Barrière Y. F288 × F271早期玉米RIL子代细胞壁降解性和组成的几个qtl之间的共定位,提出了生物燃料容量可能的潜在决定因素和育种目标的性质问题。生物能源决议2014;7:142-56。gydF4y2Ba
- 55.gydF4y2Ba
李凯,王辉,胡霞,刘智,吴勇,黄超。全基因组关联研究揭示了玉米茎秆细胞壁组分的遗传基础。PLoS One. 2016;11:e0158906。gydF4y2Ba
- 56.gydF4y2Ba
李国强,李国强。利用基因组选择加速作物遗传收益。理论应用,2019;132:669-86。gydF4y2Ba
- 57.gydF4y2Ba
曹s,袁毅,马蒂内斯,苏亚雷斯,马德华,等。在水分处理下,玉米双单倍体群体的籽粒产量和生理性状的基因组选择优于标记辅助选择。植物科学,2018;9:366。gydF4y2Ba
- 58.gydF4y2Ba
张安,王华,Beyene Y, Semagn K,刘勇,曹松,等。性状遗传力、训练群体规模和标记密度对22个双亲热带玉米居群基因组预测精度估计的影响植物科学,2017;8:1916。gydF4y2Ba
- 59.gydF4y2Ba
库姆斯E,贝尔纳多R.不同性状全基因组选择的准确性与恒定的群体规模,遗传力和标记数。植物基因组学报。2013;6:1-7。gydF4y2Ba
- 60.gydF4y2Ba
刘旭,王辉,王辉,郭忠,徐旭,刘杰,等。玉米基因组选择影响因素的实证研究。2018; 6:341-52。gydF4y2Ba
- 61.gydF4y2Ba
赫夫纳EL, Jannink J-L, Sorrells ME。在小麦育种计划中使用多科预测模型的基因组选择准确性。植物基因组。2011;4:65-75。gydF4y2Ba
- 62.gydF4y2Ba
贝尔纳多R.全基因组选择,当主要基因是已知的。作物科学2014;54:68-75。gydF4y2Ba
- 63.gydF4y2Ba
Boeven PHG, Longin CFH, Leiser WL, Kollers S, Ebmeyer E, Würschum T.杂交小麦雄花性状的遗传结构。理论应用,2016;129:2343-57。gydF4y2Ba
- 64.gydF4y2Ba
张志刚,张志刚,张志刚,张志刚,等。包含从头GWAS的全基因组预测模型是热带水稻改良的有力新工具。遗传。2016;116:395 - 408。gydF4y2Ba
- 65.gydF4y2Ba
Sarinelli JM, Murphy JP, Tyagi P, Holland JB, Johnson JW, Mergoum M,等。训练群体选择和使用固定效应来优化美国冬小麦历史面板的基因组预测。理论应用,2019;132:1247-61。gydF4y2Ba
- 66.gydF4y2Ba
阿鲁达MP,李普卡AE,布朗PJ,磷ill AM, Thurber C,布朗- guedira G,等。小麦抗赤霉病基因选择与标记辅助选择的比较(gydF4y2Ba小麦gydF4y2Bal .)。Mol Breed. 2016;36:84。gydF4y2Ba
- 67.gydF4y2Ba
王旭,李林,杨震,郑旭,于生,徐超,等。基于北卡罗来纳配种设计的单变量和多变量GBLUP模型预测水稻杂交性能2。遗传。2017;118:302-10。gydF4y2Ba
- 68.gydF4y2Ba
Calus MP, Veerkamp RF。不同方法多性状基因组选择的准确性。《世界末日》2011;43:26。gydF4y2Ba
- 69.gydF4y2Ba
贾勇,Jannink J-L。多性状基因组选择方法提高了遗传价值预测的准确性。遗传学。2012;192:1513-22。gydF4y2Ba
- 70.gydF4y2Ba
郭刚,赵峰,王勇,张勇,杜玲,苏刚。单性状和多性状基因组预测模型的比较。BMC Genet 2014;15:30。gydF4y2Ba
- 71.gydF4y2Ba
恩格尔n, Corbet NJ, Allen JM, Laing AR, Fordyce G, McGowan MR,等。热带适应牛牛青春期年龄的多元基因组预测。中国动物科学,2019;gydF4y2Ba
- 72.gydF4y2Ba
李海梅,杨晓明,杨晓明,等。基于多变量全基因组回归模型的植物遗传异质性分析。Schön遗传学。2015;201:323-37。gydF4y2Ba
- 73.gydF4y2Ba
Okeke UG, Akdemir D, Rabbi I, Kulakow P, Jannink J-L。非洲木薯单变量和多变量基因组预测模型的准确性。《世界末日》2017;49:88。gydF4y2Ba
- 74.gydF4y2Ba
杨杰,梅兹穆克,鲍姆加腾,巴克尔,柯,McMullen MD,等。有害等位基因的不完全显性是造成玉米性状变异和杂种优势的重要原因。PLoS Genet, 2017;13:e1007019。gydF4y2Ba
- 75.gydF4y2Ba
Bates D, Mächler M, Bolker B, Walker S.用lme4拟合线性混合效应模型。中国统计杂志,2015;gydF4y2Ba
- 76.gydF4y2Ba
刘旭,王辉,胡旭,李凯,刘智,吴勇,等。利用数量性状位点和非加性效应改善玉米基因组选择的经验证据。植物科学学报2019;10:1129。gydF4y2Ba
- 77.gydF4y2Ba
表型、遗传和环境相关性。生物识别技术。1961;17:474 - 80。gydF4y2Ba
- 78.gydF4y2Ba
希尔工作组。遗传相关性。入:Maloy S, Hughes K,编辑。布伦纳的遗传学百科全书。第二版。圣地亚哥:学术出版社;2013.237 - 9页。gydF4y2Ba
- 79.gydF4y2Ba
榛子LN。构建选择指标的遗传基础。遗传学。1943;28:476 - 90。gydF4y2Ba
- 80.gydF4y2Ba
Butler DG, Cullis BR, Gilmour AR, Thompson R. ASReml-R参考手册(第3版). Brisb State Qld Dep Prim Ind Fish. 2009。gydF4y2Ba
- 81.gydF4y2Ba
Ganal MW, Durstewitz G, Polley A, Bérard A, Buckler ES, Charcosset A,等。一种大玉米(gydF4y2Ba玉米gydF4y2Bal .)SNP基因分型阵列:开发和种质分型,并与B73参考基因组进行遗传定位比较。科学通报。2011;6:e28334。gydF4y2Ba
- 82.gydF4y2Ba
徐超,任勇,简勇,郭震,张勇,谢超,等。用于分子育种的玉米55k SNP基因阵列的开发。Mol Breed. 2017;37:20。gydF4y2Ba
- 83.gydF4y2Ba
周震,张超,周勇,郝震,王震,曾晓,等。基于重组自交系的超高密度仓图玉米植株结构的遗传解剖。BMC Genomics. 2016;17:178。gydF4y2Ba
- 84.gydF4y2Ba
黄霞,冯强,钱倩,赵强,王玲,王安,等。全基因组重测序高通量基因分型。Genome Res. 2009; 19:1068-76。gydF4y2Ba
- 85.gydF4y2Ba
Taylor J, Butler D. R包ASMap:高效的遗传连锁图谱构建与诊断。中国统计杂志,2017;49:1 - 28。gydF4y2Ba
- 86.gydF4y2Ba
田涛,刘勇,闫红,尤强,易鑫,杜智,等。agriGO v2.0:农业社区GO分析工具包,2017年更新。核酸研究,2017;45:122-9。gydF4y2Ba
- 87.gydF4y2Ba
McCarthy FM, Wang N, Magee GB, Nanduri B, Lawrence ML, Camon EB,等。AgBase:农业功能基因组资源。BMC Genomics, 2006;7:229。gydF4y2Ba
- 88.gydF4y2Ba
VanRaden点。计算基因组预测的有效方法。中国乳制品科学,2008;gydF4y2Ba
- 89.gydF4y2Ba
玉米单交性能的最佳线性无偏预测。作物科学1996;36:50-6。gydF4y2Ba
- 90.gydF4y2Ba
Pérez P, de los Campos G.全基因组回归和预测与BGLR统计包。遗传学。2014;198:483 - 95。gydF4y2Ba
致谢gydF4y2Ba
作者感谢匿名审稿人对改进手稿的宝贵意见和建议,感谢中国农业科学院作物科学研究所周文斌博士的技术援助,感谢学生和助手在表型方面的帮助,感谢中国农业大学杨x和李j .实验室在人口发展方面的帮助。感谢Y. Zhou的合理建议。gydF4y2Ba
资金gydF4y2Ba
国家重点研发计划(No. 2017YFD0101201)、中国农业科学院农业科技创新计划(No. 2017YFD0101201)、国家基础研究计划(973计划)(No. 2014CB138200)资助。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
CH和HW构思并设计了实验,并监督了研究项目。表型和基因型数据由XL进行研究,并在XH、KL、ZL和YW的协助下完成。数据分析采用XL。然后,XH, KL, ZL和YW提出了一些有价值和有用的建议。本文由XL和HW撰写,并得到CH的支持。所有作者都讨论了结果并对最终手稿做出了贡献。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
两个RIL群体在不同环境下不同阶段皮肤穿透计抗性的方差(ANOVA)和广义遗传力分析。gydF4y2Ba表S2。gydF4y2Ba陆虎种群(郑58 × HD568) bin图摘要。gydF4y2Ba表S3。gydF4y2BaLR群体中长度大于10.0 Mb的垃圾箱(Zheng58 × HD568)gydF4y2Ba表S4。gydF4y2Ba来自两个RIL群体的高密度遗传图谱概述。gydF4y2Ba表S5。gydF4y2Ba高油群体皮透度测定抗性的QTL (B73 × BY804)。gydF4y2Ba表S6。gydF4y2Ba抗倒伏群体抗逆性的QTL(郑58 × HD568)。gydF4y2Ba表S7。gydF4y2Ba候选基因注释。gydF4y2Ba表S8。gydF4y2Ba模型之间预测精度的比较。gydF4y2Ba表S9。gydF4y2BaUV、FIXED和ME模型估计的方差分量比例。gydF4y2Ba表S10。gydF4y2BaUV和MS模型估计的方差分量比例。gydF4y2Ba图S1。gydF4y2Ba在两个RIL群体中,每个环境中所有阶段对之间的表皮穿透计抗性的表型相关性。(A) ~ (C) 2012年北京、2012年海南、2013年北京高油人口(B73 × BY804)。(D) ~ (E) 2012年海南和2013年北京市抗住宿人群(Zheng58 × HD568)。V10:第十叶期;DTS:天至丝;AS10:丝绸后10天;AS20:丝绸后20天;AF30:丝后30天;AS40:丝后40天;AS50:丝织后50天。gydF4y2Ba图S2。gydF4y2Ba高油群体(B73 × BY804)物理图谱与bin标记构建的遗传图谱比较。x轴为玉米参考基因组中基于物理位置的仓的线性顺序,y轴为连锁图中基于遗传距离的仓的顺序;LG:联动集团;空空的。:chromosome.图S3。gydF4y2BapQTL8在各种情况下被识别的说明。小提琴图表示来自每个亲本的基因型之间的差异;HO:高油群体(B73 × BY804);LR:抗倒伏群体(郑58 × HD568);RPR:皮透电阻;V10:第十叶期;DTS:天至丝;AS10:丝绸后10天;AS20:丝绸后20天;AF30:丝后30天; AS40: 40 days after silking; AS50: 50 days after silking; 2012H: Hainan in 2012; 2013B: Beijing in 2013.
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
刘,X,胡,X,李,K。gydF4y2Baet al。gydF4y2Ba玉米茎秆强度的遗传定位和基因组选择。gydF4y2BaBMC植物生物学gydF4y2Ba20.gydF4y2Ba196(2020)。https://doi.org/10.1186/s12870-020-2270-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-2270-4gydF4y2Ba
关键字gydF4y2Ba
- 茎强度gydF4y2Ba
- 表皮穿透计电阻gydF4y2Ba
- 数量性状位点gydF4y2Ba
- 基因选择gydF4y2Ba
- 玉米gydF4y2Ba