摘要
背景
叶片颜色是一个重要的农艺性状,对作物产量有很大的影响。分离叶片颜色突变体可为研究叶绿素(Chl)生物合成和代谢调控提供有价值的材料。
结果
在本研究中,我们从“花冠”小白菜品种中分离出一个稳定遗传的黄叶突变体,并将其命名为pylm.该突变体发芽后叶片呈黄色。其黄化表型在整个生长期是非致死的,稳定的。生长乏力,下胚轴明显拉长。遗传分析揭示了两个隐性核基因,命名为py1而且py2,是造成黄化表型的原因。扩增分离RNA测序(BSR-Seq)显示py1而且py2分别位于染色体A09和A07上。该基因为孟德尔单因子3:4基于3:1表型分离比的群体。的py1定位在34个基因基因组的258.3 kb区间。差异表达基因BraA09004189是在py1映射区域和调节血红素分解代谢。的单核苷酸多态性(SNPBraA09004189发生在pylm。1520年F的一个候选基因特异性SNP标记3:4黄色人种和py1.为py2, 1860年隐性纯合子F3:4对个体进行调查和定位py2到4.4 kb的间隔。在这个区域的五个基因中,BraA07001774被预测为候选人py2。它编码了胚胎缺陷1187和一种与叶绿素缺乏和下胚轴伸长有关的磷酸转移酶。一个SNPBraA07001774发生在pylm。它导致一个氨基酸从Asp突变到Asn。根据定量实时聚合酶链反应(qRT-PCR),BraA07001774在pylm。
结论
我们的研究发现了一个Chl缺乏突变体pylm小白菜。两个隐性核基因命名py1而且py2对黄化有显著影响。调控黄化的候选基因被鉴定为BraA09004189而且BraA07001774,分别。这些发现将有助于阐明叶绿素代谢和控制小白菜黄化的基因相互作用的分子机制。
RNA- seq RNA测序
RPKM每千碱基每百万映射读取数
SNP单核苷酸多态性
背景
光合色素叶绿素(Chl)在蓝藻和高等植物的叶绿体中普遍存在。Chl将阳光的能量转化为生物可利用的化学能,从而推动碳水化合物的生物合成[1].Chl是影响作物干物质积累和产量的叶片颜色的重要成分。一般来说,叶子呈现绿色是因为Chl占主导地位,并在其中发挥重要作用。当Chl含量发生变化时,植物叶片颜色突变表型包括叶绿素、绿色、白化、黄绿色和保持绿色[2].叶片颜色突变体是通过抑制调节Chl生物合成和叶绿体发育的基因而产生的。这些基因的下调直接或间接影响Chl的合成和降解,产生叶片颜色突变[3.,4,5].因此,叶片颜色突变体可能非常适合于阐明光合作用、Chl生物合成、叶绿体发育的机制,以及与这些过程相关的基因的表达和调控[6,7,8,9].叶色突变体在拟南芥[10],大米[11,12],小麦[13],芸苔属植物显著[14],芸苔属植物oleracea[15],大麦[16羽衣甘蓝[17]、烟草[18],大豆[19],棉花[20.]和黄瓜[5,21].通过叶片颜色突变体对Chl生物合成和叶绿体发育的遗传学、生理学和分子机制进行了大量研究。
在遗传分析方面的一些研究将叶片颜色突变遗传分为核和细胞质两类。大多数叶片颜色突变是隐性遗传的,由单个核基因赋予[21,22,23,24].涉及两个隐性基因的叶片颜色突变是罕见的。此外,其遗传性质复杂,对其进行遗传分析和基因定位较为困难。Wu等人鉴定了浅色突变体ws1在烟草并确定这种表型是由隐性核基因控制的ws1a而且ws1b由不同BC本地化1F2组到链接组5和链接组24,[18].BnChd1-1而且BnChd1-2是造成浅绿色叶片突变表型的原因吗芸苔属植物显著.精细映射BnChd1-1是用BC3.F1人口。候选基因预测提示BnChd1-1编码类囊体腔内烟酰胺腺嘌呤二核苷酸磷酸(NADPH)复合物的一个亚单位[25].硬粒小麦chl缺乏突变体表型[26),芸苔属植物juncea[27]也是由两个隐性基因控制的。细胞质突变体与核突变体相比不常见。然而,据报道,它们对烟草有影响[28],大麦[29),而芸苔属植物定[30.].
在植物中,Chl生物合成包括15个酶促步骤,受至少27个基因调控[31].Chl生物合成基因的失活突变通常会导致Chl缺乏突变体[11,22,32,33].控制Chl降解代谢的基因突变通常产生保持绿色的突变体,即使在衰老过程中也保持其绿色叶片表型[24,34,35].Chl和血红素生物合成是四吡咯形成的两种类型,并具有从5-氨基乙酰丙烯酸(ALA)到原卟啉IX (Proto IX)的共同代谢途径[36].血红素是呼吸作用和光合作用所必需的。相反,过多的血红素积累会抑制谷氨酰- trna还原酶活性和ALA合成,降低四吡咯生物合成速率,并影响Chl生物合成[37].从异常血红素代谢引起的叶片颜色突变被鉴定为拟南芥[38],大米[39,40,41],豌豆[42]和玉米[43].
在先前的研究中,我们开发了一种小白菜(芸苔属植物拉伯l . ssp。对)黄叶突变体(pylm)从“花冠”小白菜品种中分离小孢子培养而来。该菌株为双单倍体(DH),具有稳定的黄叶表型[44].本研究中,我们对pylm使用散装分离RNA测序(BSR-Seq)和连锁分析来绘制相应的基因。然后,预测与突变表型相关的候选基因。从这项工作中获得的信息可能有助于促进黄化基因的克隆和阐明基因相互作用的分子机制。
结果
突变体的表型特征pylm
野生型CK-51和pylm均来自“花冠”小白菜品种的离体小孢子培养。然而,后者在发芽时显示出黄叶,这种表型在其整个生命周期中都是稳定的(图2)。1).该突变体表型细长,生长乏力。然而,它的黄色叶子是不致命的。此外,相对于CK-51,pylm在苗期显示出细长的下胚轴(图。1c)抽苔期提早开花(图;1b)。
突变体的遗传分析pylm
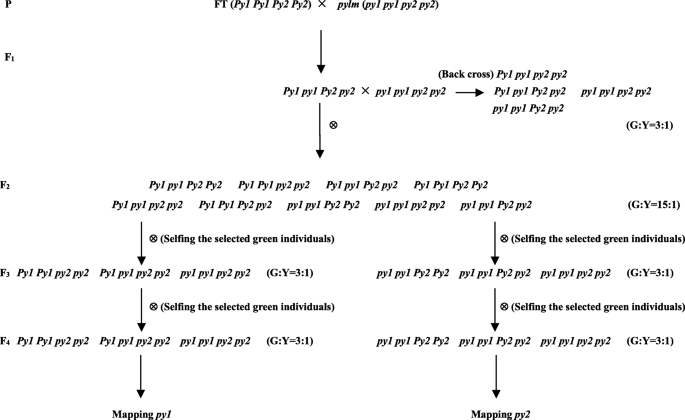
F1和F2种群是由两者的杂交构成的pylm和大白菜DH系' FT '(附加文件)1:图S1)。F1互惠杂交的个体具有与‘FT’相同的绿叶表型。因此,黄化表型的遗传在pylm是细胞核的而不是细胞质的。黄叶和绿叶表型的分离统计数据2人口符合预期的孟德尔比15:1 (χ2<χ20.05= 3.84)。因此,Chl缺乏性状是由两个隐性核基因控制的。BC1从F .1分别回交与pylm和“英尺”。BC绿色和黄色叶片表型的分离统计数据1F1从F1与pylm符合预期的孟德尔比为3:1 (χ2<χ20.05= 3.84)。这一发现证实了突变性状是由两个隐性核基因所赋予的。他们被指定为py1而且py2.两种基因均不能单独诱导黄叶表型。表中列出了各代的表型数据1.
种族隔离的py1而且py2
根据遗传分析pylm, chl减少表型受隐性核基因控制py1而且py2.因此,F2和公元前1F1不能用种群来分别绘制这些基因。分离py1从py2F2可随机选择具有绿色叶片的个体进行自花授粉,以产生F2:3后代。才F2:3统计分离比为3:1(绿色:黄色)的植物可能是自花授粉产生F3:4后代。理论上,F3:4家庭应该显示预期的孟德尔分离比为3:1。其中一些可以映射py1而其他人可以绘制地图py2(无花果。2).
20个绿色个体来自F2随机选择自花授粉产生F2:3.二十美元2:3研究了家系、表型分离。有三个不同的群体。11个居群无黄色植株,5个居群以15:1分离,4个居群以3:1分离3.:表S1)。这些结果证实了F .的理论分离比“全部绿色:(绿色:黄色= 3:1):(绿色:黄色= 15:1)= 7:4:4”2:3.
四个F中的一个2:3以3:1为分家,每科选8株绿叶植物自花授粉,生产出F3:4.表型分离显示20个F3:4家庭(第1-20个)以3:1的比例隔离,而其他12个家庭(第21-32个)没有黄色个体。因此,F2:3基因型应该是Py1 Py1 py2 py2/py1 py1 Py2 Py2而且Py1 Py1 py2 py2/py1 py1 Py2 Py2,分别(附加文件3.:表S2)。表型分离的F3:4各家庭符合“(绿色:黄色= 3:1):所有绿色= 2:1”的理论隔离比。因此,F3:4家族(编号1-20)可以用来绘制py1和/或py2位点。
BSR-Seq分析
从g池和y池中分别产生了47,526,126和49,119,466个原始读取(150-bp)。经过质量评估和数据过滤,97%的读对(g池为46,456,174对,y池为47,581,728对)仍然存在。对象映射干净的读取芸苔属植物参考基因组Hisat v. 2.0.14。其中,> 66%在两个池中都是唯一映射的。
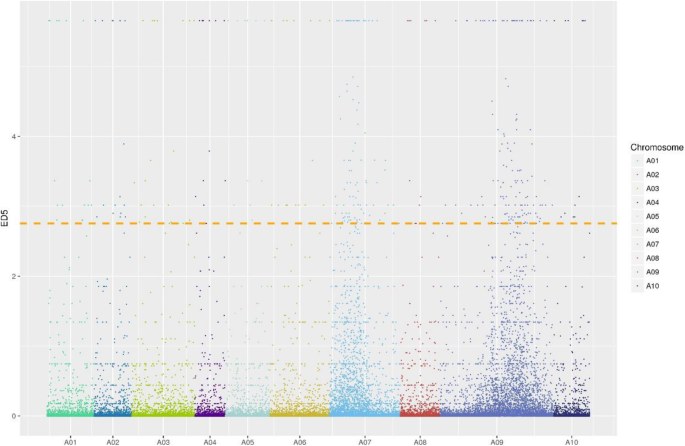
相对于参考基因组,G-pool和Y-pool分别检测到154,863和157,022个SNPs。筛选ED的差异SNP位点5根据ED的前1%计算得到412个目标差异SNP位点5阈值。在染色体A07和A09上观察到两个不同的峰。3.).这一发现与突变性状由两个隐性核基因控制的假设是一致的。由此推测,黄化基因位于A07和A09染色体的5个染色体区域内(表2)2).
鉴别差异表达基因
采用RPKM法检测基因表达水平。设置RPKM≥0.1,共检测到55250个基因。这些被分为六个RPKM分布区间(附加文件3.:表S3)。根据约束(|log . 0), G-pool和Y-pool之间有181个deg2折叠变化|≥1,FDR≤0.05)。当g库与y库进行比较时,90个基因上调,其他基因下调(附加文件)2:图S2)。deg显示在附加文件中3.:表S4。
精细映射py1
在A09染色体上的3个预测染色体区域周围建立了96个SSR标记。它们被用来检测基因的多态性pylm和“英尺”。经筛选,37个SSR标记在亲本间表现出多态性。他们被用来测试来自1号F的12个绿色和黄色的个体3:4家庭。SSRzk5和SSRzk12位于A09染色体的23811435 - 27563122位点附近,并与A09染色体上的染色体有连锁关系py1在另一边。
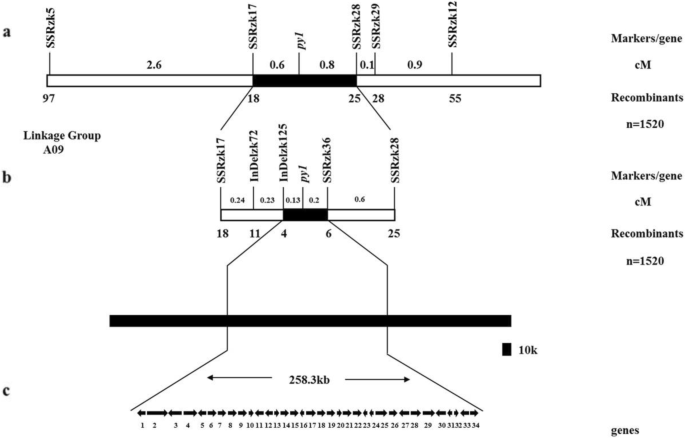
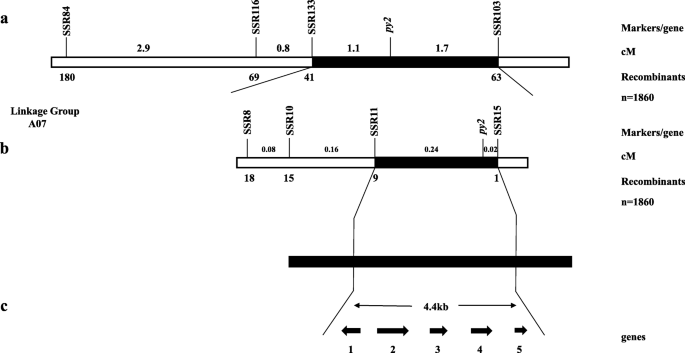
1号F共有1520只黄色个体3:4家庭被选为py1人口的映射。一项关联分析揭示了py1分别位于SSRzk5和SSRzk12之间,估计遗传距离分别为3.2 cM和1.8 cM。4a).识别与之紧密相连的分子标记py1缩小py1在SSRzk5和SSRzk12之间建立了新的SSR和Indel标记。多态性标记SSRzk17、SSRzk28、SSRzk29、SSRzk36、Indelzk72和Indelzk125被链接py1(附加文件3.:表S5)。SSRzk17、Indelzk72和Indelzk125位于的一侧py1为SSRzk5,而SSRzk28、SSRzk29和SSRzk36位于另一侧py1SSRzk12。的py1分别在Indelzk125和SSRzk36的0.13 cM和0.2 cM处进行了定位(图2)。4因此,b)。py1被映射在最紧密链接标记之间的258.3 kb区域(图。4c)。
遗传和物理py1图谱和候选基因分析。一个:用1520构建了染色体A09的连锁图谱pylm来自1号F3:4家庭。的py1初步定位在SSRzk17和SSRzk28之间;b:精细映射py1.的py1局限于Indelzk125和SSRzk36之间的区域。标记和之间的重组数py1基因图谱如下所示。连杆图上方的映射距离以厘摩根(cM)为单位;c:候选人py1区域和注释的基因芸苔属植物数据库。的py1基因座范围缩小到258.3 kb,包含34个预测基因。数字1-34是候选基因。箭头表示基因表达的方向。34个基因的详细信息在附加文件中3.表S6
候选人py1分析
在Indelzk125和SSRzk36之间的258.3 kb区域的目标DNA序列芸苔属植物数据库。基因组序列分析显示,候选区域包含34个基因(图2)。4c、附加文件3.:表S6)。仅公开了差异基因表达分析BraA09004189在py1映射区域。BraA09004189是血红素加氧酶(HO1),参与血红素分解代谢。在早期的研究中报道了缺陷HOs诱导的黄叶表型突变体[40,41].BraA09004189被预测为最有可能的候选人py1基因。
为了证实这一假设,我们设计了两对引物进行测序BraA09004189在pylm和“CK-51”(附加文件3.:表S7)。亲本间的BraA序列无差异,而亲本间的BraB序列无差异pylm出现一个SNP(图;5).基于的位置BraA09004189研究人员设计了一个SNP标记,从1号F中筛选出1520个黄色个体3:4家庭。整个映射个体的条带与之共分离py1.
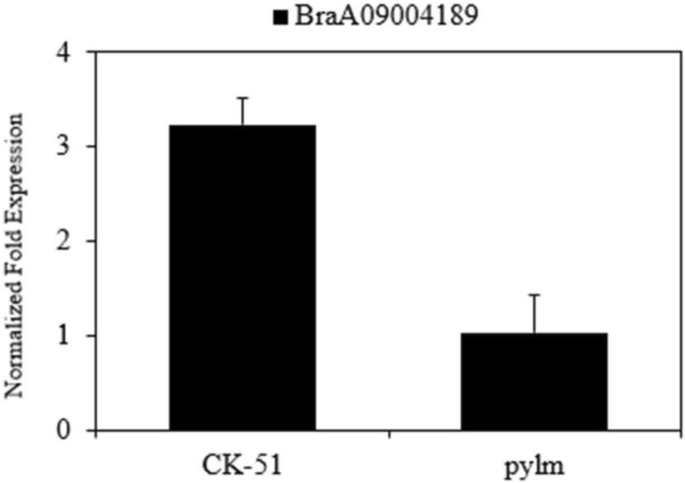
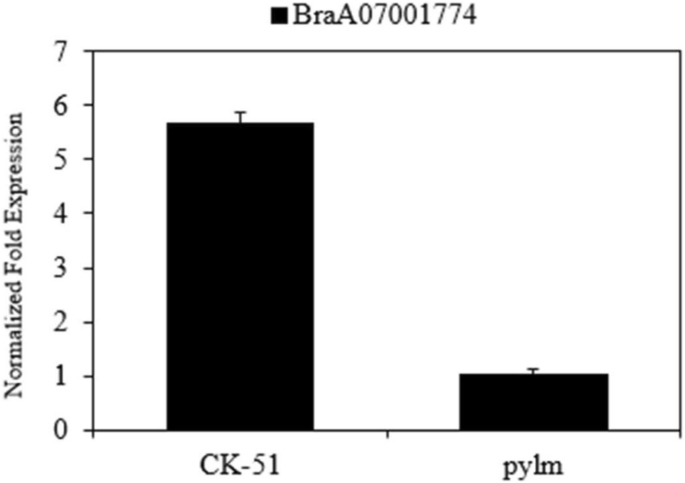
采用qRT-PCR检测BraA09004189表达pylm和“CK-51”。根据差异基因表达分析,结果表明BraA09004189在‘CK-51’中表达量明显高于在‘CK-51’中pylm(无花果。6).这一发现进一步支持了BraA09004189候选人是py1.
精细映射py2
考虑到构建的种群大小,我们筛选了2-5号F3:4使用与SSRzk5和SSRzk12相关的相同研究策略的家庭py1.黄化基因py1在二楼,四楼和五楼3:4家庭。从理论上讲,3楼3:4家庭可以用来建立py2轨迹。
在A07染色体的两个预测区域周围开发了48个SSR标记,以检测两者之间的多态性pylm和“英尺”。经筛选,有11个SSR标记在亲本间出现多态性。他们被用来测试3楼12个绿色和12个黄色的个体3:4家庭。SSR84和SSR103位于A07染色体的11,166,810- 15,034483区域附近,并与py2在另一侧(图。7一个;额外的文件3.:表S8)。
3楼有1860只黄种人3:4家庭被选为py2人口的映射。的py2分别位于SSR11和SSR15之间,估计遗传距离分别为0.24 cM和0.02 cM。7b).缩小py2作图间隔并鉴定与之紧密相连的分子标记py2,在SSR11和SSR15之间出现了新的SNP标记。只有多态性标记SNP11与之相关py2.以重组个体为基础py2区间缩小至14,851,951-14,896,902,包含5个基因。7c)。
候选人py2分析
5个候选基因的注释数据py2目标区域由芸苔属植物数据库(附加文件)3.:表S9)。引物被设计来覆盖每个基因的cDNA并预测候选基因(附加文件)3.:表S10)。两者之间没有区别pylm和CK-51BraA07001775,BraA07001776,或BraA07001777.经PCR扩增后BraA07001773序列无序,序列比较在连续重复中不一致。第一个外显子在父母之间存在SNP变异BraA07001774(无花果。8).它引起野生型的Asp (GAT)突变为Asn (AAT)pylm(无花果。9).因此,BraA07001774被认为是最可能的候选基因py2.
BraA07001774是一个胚胎缺陷1187(emb 1187)和磷酸转移酶。白化突变体(pds1,pds2)显型拟南芥可能是由emb 71[45].为拟南芥在发育过程中,下胚轴伸长,种子有角果状缺陷2世代突变苗[46].我们提出突变表型是由基因突变决定的BraA07001774.为了验证我们的预测,BraA07001774表达pylm用qRT-PCR法分析CK-51。BraA07001774被大幅下调了pylm(无花果。10).因此,它可能是候选基因py2.
讨论
树叶颜色的变异在自然界中很普遍。叶片颜色突变的主要类型为Chl缺乏。矮小、生长迟缓、光合能力减弱、产量低和死亡与该缺陷有关[25,47,48].在这里,我们鉴定出小白菜黄叶突变体pylm从分离的小孢子培养。与之前报道的Chl缺陷突变体不同,pylm苗期下胚轴明显延长,抽苔期开花早。黄化表型pylm在整个生长期是非致死的且稳定的。Chl缺乏pylm由两个隐性基因控制。这些特征表明pylm对于揭示受基因相互作用调控的Chl生物合成机制具有较高的研究价值。
基于图谱的克隆是一种有效的基因分离策略。广泛用于植物基因功能分析[49,50,51].然而,这取决于目标基因的精确定位。对于大多数叶色突变体,这些性状是隐性遗传的,由单个核基因控制。F2种群被本能地用于绘制目标基因[5,41,48].对于两个隐性核基因所赋予的性状,F2种群也可用于初步制图。构建高级回交和其他群体是将等位基因对彼此分离并单独映射的一种有效方法。隐性白茎(ws)基因座烟草和Chl缺乏症(Bnchd1)基因座芸苔属植物显著成功地使用构造的BC1F2和公元前3.F1人口,分别[18,25].在本研究中,遗传分析显示,隐性核基因指定为py1而且py2对黄化性状负责。我们成功地隔离了py1从py2构建了小白菜Chl缺失性状的遗传模型。20 F3:4构建表型分离比为3:1的家系。各种F3:4家庭被成功地用来绘制py1而且py2单独位点。与使用高级回交群体绘制隐性核基因对相比,创建和使用F2:3或F3:4避免了亲本不完全阉割所造成的选择错误和遗传分析的干扰芸苔属植物拉伯.
BSR-Seq有效地结合了体分离分析(BSA)和RNA测序(RNA- seq)各自的优势,用于快速基因定位[52,53,54,55].BSR-Seq在mRNA水平上靶向。它从分离的群体中选择表型相反的个体,构建两个RNA混合池,在转录水平上寻找snp。转录组数据定位目标基因并检测潜在相关的deg [56].BSR-Seq已被广泛应用于绘制与单一目标性状相关的因果基因[24,57,58].两个独立遗传的性状也可能被BSR-Seq定位。Tan等人利用BSR-Seq技术在A05染色体和A02染色体上定位了控制雄性不育的基因[59].这里是突变体pylm以大白菜DH ' FT '系为亲本构建F2分离人口。野生型和突变型个体表型差异显著。因此,可以准确方便地为BSR-Seq创建极端混合池。释放芸苔属植物拉伯基因组数据增强了这些群体在BSR-Seq应用中的可靠性。与黄叶表型相关的5个候选区域pylm分别位于染色体A07和A09上。根据候选区域的位置开发分子标记。黄化基因py1而且py2分别用不同的F3:4家庭。这一发现证实了BSR-Seq定位两个隐性核基因的可行性。他们还表明,BSR-Seq简化了传统作图方法中的分子标记开发和筛选,并大大提高了它们的效率。
在初步研究的基础上,在靶区附近开发了新的分子标记py1BSR-Seq映射。的py1在A09染色体上标记Indelzk125和SSRzk36之间进行定位,定位区间为258.3 kb,包含34个预测基因。没有新的多态SSR或Indel标记来限制定位间隔。BSR-Seq测定的基因表达模式仅揭示了一个差异表达基因(BraA09004189)在py1映射区域。引用的基因注释芸苔属植物数据库显示BraA09004189编码血红素加氧酶-1 (HO1)。该酶在光敏色素发色团代谢、光响应机制、不定根形成和氧化损伤缓解中起着至关重要的作用[60,61,62,63].HO1通过将血红素转化为BV-IXα来稳定和维持血红素含量[64].Chl和血红素生物合成作为四吡啶生物合成的分支,具有从ALA到Proto IX的共同代谢途径。血红素代谢异常导致的血红素过度积累导致Chl生物合成的反馈抑制[36].因此,HO1活性的降低可能影响Chl的生物合成。的hy1突变体的拟南芥和2 .黄绿色叶子由于HO1突变导致游离血红素抑制,水稻突变体呈现chl降低表型[40,60].HO1缺陷强烈影响水稻类囊体发育[41].Davis等人发现突变体的下胚轴表型异常延长拟南芥幼苗可能与HO1缺陷有关[60].因此,py1可编码HO,其突变可影响Chl的生物合成和叶片颜色。在本研究中,qRT-PCR证实了这一点BraA09004189在pylm。这一发现与BSR-Seq的结果一致。苏格兰民族党BraA09004189被检测到pylm和“CK-51”。1520年F的一个候选基因特异性SNP标记3:4黄色人种和py1.因此,BraA09004189对应于黄叶位点py1在pylm.
人们已经知道,某些Chl缺乏性状是由两个隐性核基因控制的。然而,缺乏适当的定位群体或可靠的分子标记。因此,它们要么是没有明确位置的近似映射[18,26]或者只有一对可以本地化[25].在以往的研究中,候选基因的同时精细定位或准确预测进展甚微。这里,我们使用了相同的映射策略py1为实现精细映射py2.连锁分析揭示了py2在A07染色体SSR11和SSR15之间进行了定位。链接到的SNP11标记将映射间隔缩小到4.4 kbpy2。5个基因的序列分析py2定位间隔仅显示BraA07001774表达有显著差异pylm和“CK-51”。为pylm,BraA07001774在第一个外显子上有SNP错义突变,因此野生型有Asp残基,而pylm有一个Asn。qRT-PCR结果显示BraA07001774突变体相对于野生型是否下调了.基因注释芸苔属植物数据库显示BraA09004189编码emb 1187还有一个磷酸转移酶。在拟南芥,循证基因对种子发育至关重要[65].循证基因编码各种蛋白质。其中30%活跃在质体中[66].大多数循证突变导致白化病或黄化的种子和胚胎,这是叶绿体生物发生和功能突变的次要影响[67].白化突变体(pds1,pds2)和下胚轴伸长表型拟南芥可能与突变有关循证基因(45,46].因此,BraA07001774候选基因是py2。
结论
我们报告了一个Chl缺乏突变体的鉴定pylm在小白菜中。黄化性状由两个隐性核基因控制py1而且py2.我们成功地隔离了py1从py2通过构造F3:4并对两个黄化基因进行了精细的定位和预测。调控黄化的候选基因被鉴定为BraA09004189而且BraA07001774,分别。这些发现可能有助于阐明该性状由两个隐性核基因控制的分子机制。在未来的研究中,我们将进行功能验证,以明确这些候选基因的功能。通过这种方式,可以更好地理解基因相互作用的分子机制。
方法
植物材料与测绘种群发展
DH线pylm以日本武藏野种子公司引进的“花冠”小白菜品种为材料,经小孢子分离培养获得。该品系叶片呈黄色,下胚轴细长[44].父母用于隔离人口发展与pylm在本研究中,由沈阳绿星大白菜研究所(中国沈阳)筛选的来自大白菜品种“福田50”的DH系FT,其叶片呈褶皱状[68].的pylm与FT相互交叉,就形成了F1F2,和BC1一代又一代。20 F2具有绿色叶片的个体自花授粉产生F2:3后代。八个绿色的F2:3每组从相应群体中随机选取个体,进行自花授粉,得到F3:4人群。性状分离的基因用于连锁分析和基因定位。所有植物都是在中国沈阳农业大学的温室里种植的。
BSR-Seq检测变异
在三叶期分别收集了100个极端叶色表型个体2并汇总用于RNA提取。使用TRIzol试剂(Invitrogen, USA)提取每个样品的总RNA。RNA浓度和完整性用Agilent 2100生物分析仪(Agilent Technologies, USA)进行分析。极端混合池绿叶(G-pool)和黄叶(Y-pool)是通过混合等量的每种RNA样本来构建的。RNA- seq文库制剂根据制造商的协议(NEBNext®Ultra™RNA文库Prep Kit for Illumina®)构建。测序使用GENEWIZ苏州生物科技有限公司生产的Illumina HiSeq 2500测序仪。
用FastQC (v. 0.10.1)评估RNA-Seq原始reads的质量。使用Cutadapt (v. 1.9.1)从原始读取中删除包含N和< 70的适配器序列和低质量读取。5 '或3 '端低质量碱基被过滤掉。平均质量< 20的用4-bp滑动窗口法进行修剪。干净的数据对齐到芸苔属植物数据库(http://brassicadb.org/brad/)与Hisat v. 2.0.14 [69].利用SAM Tools (v. 0.1.18)中的Mpileup模块获得两个池之间的候选单核苷酸多态性(SNPs),筛选深度覆盖> 3×的SNP位点,用于突变型和野生型池中的差异SNP分析。计算了差异SNP位点的欧氏距离(ED)。每个差异SNP位点的ED提高到5次方,即ED5,以消除背景噪音[70].所有的艾德5与ED5根据SNP位点的分布,筛选出前1%的SNP位点,并将其映射到特定的染色体区域。根据ED的分布预测与目标性状相关的染色体区域5染色体上的差异SNP位点。
差异基因表达分析
为了检测库之间的差异表达基因(DEGs),使用Htseq (v. 0.6.1)进行基因表达水平分析。计算每千碱基每百万映射读取数(RPKM) [71].使用预先设定的阈值(|log . log)筛选deg2折变|≥1,错误发现率(FDR)≤0.05)。
DNA分离,聚合酶链反应(PCR),连锁分析
一种改进的十六烷基三甲基溴化铵(CTAB)方法[72],从亲本和F3:4表型分离比为3:1的群体。多态性分析引物在Primer Premier (v. 5.0)中设计。按照Wang等人的说明进行PCR扩增。[24].PCR产物在5% (w/v)变性聚丙烯酰胺凝胶上分离,银染色检测。采用Join map v. 4.0构建遗传连锁图谱[73]使用分离数据。根据Kosambi的映射函数计算地图距离并以厘米(cM)为单位报告[74].
候选基因预测和实时定量PCR (qRT-PCR)验证
利用目标基因的染色体定位,对所有邻近基因进行标记芸苔属植物数据库(http://brassicadb.org/brad/).根据基因注释预测候选基因。PCR引物设计为跨越突变体之间的整个假定基因长度pylm野生型CK-51。对照系CK-51具有绿色叶片表型,以相同的方式获得pylm同一时期的突变体[44].候选基因按照Huang等人的方法克隆。[75].序列由GENEWIZ生物科技有限公司(中国苏州)确定,并与DNAMAN软件进行比对。
的叶子pylm如前所述,收集' CK-51 '进行总RNA提取。在确认其浓度和完整性后,用FastQuant RT Kit (Tiangen, China)反转录RNA。qRT-PCR采用Bio-Rad IQ5实时PCR系统(Bio-Rad Laboratories, USA)和SYBR Green PCR Master Mix (Tiangen, China)。所有反应进行3个生物重复。每个样品进行两次独立的技术重复,以确认数据的准确性。候选基因引物BraA09004189(F: 5“-GCTTCCACTTCGCTTTTTCCT-3”;R: 5 ' - tctttttctgcttctcttgatgctg -3 ')和BraA07001774(F: 5“-GGATACGACTGTGATTACACCTTCTAC-3”;采用R: 5 ' -CCGACTCCACTTCACCAACG-3 ')进行qRT-PCR分析。的肌动蛋白基因(F: 5 ' -CGAAACAACTTACAACTCCA-3 ';R: 5 ' -CTCTTTGCTCATACGGTCA-3 ')作为内源性对照。qRT-PCR反应条件和程序参考Huang等文献[76].相对表达量由2−ΔΔCt方法(77].Bio-Rad IQ5(美国Bio-Rad实验室)对数据进行了分析。
数据和材料的可用性
在当前研究中分析的数据集可在芸苔属植物数据库(http://brassicadb.org/brad/).所有使用和/或分析的数据均可根据要求提供。
缩写
- “金融时报”:
-
福田50
- 阿拉巴马州:
-
5-Aminolevulinic酸
- BSA:
-
体偏析分析
- BSR-Seq:
-
散装分离RNA测序
- 排名:
-
叶绿素
- cM:
-
厘摩
- CTAB:
-
Cetyltrimethylammonium溴化
- 度:
-
差异表达基因
- DH:
-
双单倍体
- 艾德:
-
欧氏距离
- 循证:
-
胚胎缺陷
- 罗斯福:
-
错误发现率
- HO1:
-
血红素oxygenase-1
- NADPH:
-
烟酰胺腺嘌呤二核苷酸磷酸
- 聚合酶链反应:
-
聚合酶链反应
- 第九原型:
-
原卟啉IX
- pylm:
-
小白菜(芸苔属植物拉伯l . ssp。对)黄叶突变体
- 存在:
-
实时定量PCR
- RNA-Seq:
-
RNA序列
- RPKM:
-
每千碱基每百万映射读取数
- SNP:
-
单核苷酸多态性
参考文献
- 1.
Fromme P, Melkozernov A, Jordan P, Krauss N.光系统的结构和功能I:与可溶性电子载体和外部天线系统的相互作用。中国生物医学工程学报,2003;36(1):1 - 4。
- 2.
仓田N, Miyoshi K, Nonomura KI, Yamazaki Y, Ito Y.水稻突变体及其与器官发育、形态发生和生理性状相关的基因植物细胞物理学报,2005;46(1):48-62。
- 3.
舒尔特NP,索厄斯RJH,布鲁特内尔TP,克鲁格RW。玉米高叶绿素荧光60突变是由一种交流编码叶绿体核糖体小亚单位蛋白17的基因被破坏。植物学报,2000;21(4):317-27。
- 4.
Motohashi K, Koyama F, Nakanishi Y, Ueoka-Nakanishi H, Hisabori T.叶绿体亲环蛋白是硫氧还蛋白硫醇调控肽基脯氨酸的靶蛋白顺反异构酶的活动。中国生物医学工程学报,2003;29(3):342 - 344。
- 5.
宋明,魏强,王娟,付伟,秦霞,陆霞,程峰,杨凯,张磊,余旭,李娟,陈娟,娄强CsVYL通过调控黄瓜叶绿体发育,使叶片呈现绿色。前沿植物科学,2018;9:432-43。
- 6.
李志强,李志强,李志强。叶绿体生物发生的遗传学和基因组学研究:以玉米为模型系统。植物科学进展,2004;9(6):293-301。
- 7.
Kusaba M, Ito H, Morita R, Iida S, Sato Y, Fujimoto M, Kawasaki S, Tanaka R, Hirochika H, Nishimura M, Tanaka A.水稻NON-YELLOW COLORING1参与叶片衰老过程中的光收获复合体II和颗粒降解。植物学报。2007;19(4):1362-75。
- 8.
方WY,郑is,金dw,林忠,池诚,黄sm,金文伟,孙ys,郑j, Shiina T,朴jd。的作用拟南芥CHL27蛋白用于光合作用、叶绿体发育和基因表达谱。植物生理学报。2008;49(9):1350-63。
- 9.
陈鹏,胡辉,张勇,王震,董刚,崔勇,钱强,任东,郭伯林。水稻一个新突变体的遗传分析与精细定位,白色和病变似叶1.植物生长学报,2018;85(3):425-35。
- 10.
贾伟。Dörmannn Peter, Peto CA, lutes J, Benning C, Chory J.半乳糖脂缺乏与叶绿体发育异常拟南芥MGD合成酶1突变体。自然科学进展,2000;29(3):344 - 344。
- 11.
张宏,李俊,刘俊华,刘sc,赵帅,高海杰,徐海生,白忠忠。大米Chlorina-1而且Chlorina-9编码mg-螯合酶的ChlD和ChlI亚基,mg-螯合酶是叶绿素合成和叶绿体发育的关键酶。植物分子生物学杂志,2006;32(3):325-37。
- 12.
Moon S, Giglione C, Lee DY, An S, Jeong DH, Meinnel T, An G.水稻肽脱甲酰基酶PDF1B在叶绿体发育中的关键作用。植物生理学报。2008;49(10):1536-46。
- 13.
惠忠,田凤霞,王国坤,王广平,王伟。抗氧化防御系统参与小麦突变体延缓衰老tasg1.植物细胞学报,2012;31(6):1073-84。
- 14.
朱玲,曾鑫,陈勇,杨震,齐玲,蒲勇,易斌,文杰,马超,沈娟,涂军,付涛。叶绿素缺乏突变体的遗传特征及精细定位(BnaC.ygl)芸苔属植物显著.Mol Breed. 2014;34(2): 603-14。
- 15.
刘小鹏,杨超,韩丰青,方志智,杨丽敏,庄敏,吕海辉,刘玉敏,李志生,张元元。黄绿叶基因的遗传及精细定位(ygl-1)在卷心菜里(芸苔属植物oleraceavar。性的l .)。Mol Breed. 2016;36(6): 82-9。
- 16.
缪淑娟,陈建平,陈志伟,陈志伟,等。大麦基因突变的研究进展fch2编码叶绿素a加氧酶。中国生物医学工程学报,2012;
- 17.
周松,胡忠,朱明,张斌,邓龙,潘勇,陈刚。羽衣甘蓝白鸽温敏突变体的生物化学和分子分析。植物生理学报,2013;26(3):344 - 344。
- 18.
吴强,吴霞,张霞,姜春,肖斌,张勇,王勇,刘刚,四倍体普通烟草白茎两个基因的定位(烟草l .)。Mol Breed. 2014;34(3): 1065-74。
- 19.
李方C, C,李W,王Z,周Z,沈Y,吴,吴Y,李G,香港洛杉矶,刘C,杰克逊SA,田Z共同进化的D1而且D2调节大豆叶绿素降解。植物学报(自然科学版);2014;37(5):344 - 344。
- 20.
宋敏,杨震,樊胜,朱辉,庞超,田敏,余松。陆地棉一个绿色突变体的细胞学和遗传分析(陆地棉l .)。Euphytica。2012;187(2):235 - 45。
- 21.
高敏,胡林,李勇,翁勇。黄瓜叶绿素缺乏金叶突变是由单核苷酸取代引起的CsChlI为镁螯合酶I亚基。应用理论与实践,2016;29(10):379 - 379。
- 22.
王鹏,高杰,万春,张峰,徐忠,黄霞,孙霞,邓霞。二乙烯基叶绿素(ide)一个可转化为单乙烯基叶绿素(ide)一个通过水稻中的二乙烯基还原酶。中国生物医学工程学报。2010;29(3):344 - 344。
- 23.
Ansari MJ, Al-Ghamdi A, Kumar R, Usmani S, AL-Attal Y, Nuru A, Mohamed AA, Singh K, Dhaliwal HS。一个叶绿素缺乏突变体的鉴定和基因定位clm1的小麦属植物monococcum中国生物医学工程学报,2012;29(3):344 - 344。
- 24.
王宁,刘震,张勇,李超,冯慧。一株保持绿色基因的鉴定与精细定位(Brnye1)在小白菜里(芸苔属植物定l . ssp。对).理论与应用,2018;31(3):673-84。
- 25.
赵华,余林,怀志,王霞,丁刚,陈松,李鹏,徐峰BnChd1-1,一个参与叶绿素生物合成的位点芸苔属植物显著.植物物理学报,2014;36(4):859-70。
- 26.
李楠,贾娟,夏春,刘霞,孔霞。硬粒小麦叶绿素缺乏突变基因的鉴定与定位。育种科学,2013;63(2):169-75。
- 27.
田勇,黄强,刘宏,王娟,安瑞,刘霞,胡伟。叶绿素缺乏突变体的遗传研究L638-y在芸苔属植物junceaL.和叶绿素缺乏基因分子标记gr1一起.西北农林科技大学(自然科学与教育)。2012;40(12): 90-6。
- 28.
李文杰,李志强,李志强,等。过氧酶体乙醇酸氧化酶基因在黄白区有差异表达DP1烟草杂色突变体。中国生物医学工程学报,2000;30(1):326 - 326。
- 29.
Colombo N, Emanuel C, Lainez V, Maldonado S, Prina AR, Börner T.大麦质体突变体这有点难度以细胞年龄依赖的方式影响细胞核和叶绿体管家基因的表达。基因工程学报。2008;279(4):403-14。
- 30.
唐霞,王艳,张艳,黄松,刘志,费东,冯慧。大白菜叶绿体RPS4错义突变与叶绿素缺乏相关(芸苔属植物定ssp。学报).中国生物医学工程学报,2018;18(1):130-40。
- 31.
田田,田中荣,田中平。叶绿素合成的乙烯还原酶基因的鉴定拟南芥以及对原绿球藻物种进化的影响。植物学报。2005;17(1):233-40。
- 32.
李国强,李国强,李国强。一个拟南芥porB porC缺乏光依赖性NADPH:原叶绿素氧化还原酶B和C的双突变体是高度叶绿素缺乏和发育受阻的。植物学报,2003;35(2):141-53。
- 33.
盛震,吕勇,李伟,罗锐,魏旭,谢玲,焦刚,邵刚,王杰,唐松,胡鹏。黄叶1编码镁-原卟啉IX单甲基酯环化酶,参与水稻叶绿素生物合成(栽培稻l .)。PLoS ONE。2017; 12 (5): e0177989。
- 34.
刘雪生,赵帅,张宏,白昌昌,李超,李俊,刘志华,李宝文,高海杰,徐海生,白忠忠。与功能相关的数量性状位点保持绿色SNU-SG1在大米。生物化学学报。2007;24(1):83-94。
- 35.
Morita R, Sato Y, Masuda Y, Nishimura M, Kusaba M.非黄色色素3 (α / β水解酶折叠家族蛋白)的缺陷导致水稻叶片衰老过程中保持绿色表型。植物学报,2009;29(6):344 - 344。
- 36.
韦勒JL, Terry MJ, Rameau C, Reid JB, Kendrick RE.光敏色素缺乏pcd1豌豆突变体不能将血红素转化为胆绿素IXα。植物学报。1996;8(1):55-67。
- 37.
杨晓明,陈晓明,陈晓明,等。光敏色素缺乏对叶绿素合成的影响钻进而且yellow-green-2番茄的突变体。植物科学进展。1999;19(1):1 - 5。
- 38.
谢玉军,徐德克,崔文涛,沈文文。突变的拟南芥HY1通过损害类胡萝卜素和类黄酮的生物合成和降低抗氧化防御而引起UV-C过敏。中国科学(d辑:自然科学),2012;
- 39.
徐松,王磊,张斌,韩斌,谢勇,杨娟,钟伟,陈辉,王锐,王楠,崔伟,沈伟。水稻RNAi敲除的研究SE5基因通过下调抗氧化防御功能对除草剂甲基紫精敏感。植物分子生物学杂志,2012;30(2):319 - 319。
- 40.
陈宏,程志,马霞,吴红,刘颖,周凯,陈艳,马伟,毕杰,张欣,郭霞,王娟,雷超,吴峰,林青,刘艳,刘玲,姜丽黄绿色LEAF2阻碍水稻叶绿素生物合成。植物细胞学报,2013;32(12):1855-67。
- 41.
李强,朱飞,高旭,孙勇,李松,陶勇,罗春,刘辉。幼叶褪绿编码间质定位血红素加氧酶2,这是水稻正常四吡咯生物合成所必需的。足底。2014;240(4):701 - 12所示。
- 42.
林利PJ, Landsberger M, Kohchi T, Cooper JB, Terry MJ。血红素加氧酶缺乏症的分子基础pcd1豌豆突变体。中国农业科学学报,2006;29(12):344 - 344。
- 43.
石东,郑鑫,李林,林伟,谢伟,杨军,陈松,金伟。玉米叶绿素缺乏的研究进展细长mesocotyl2突变是由血红素加氧酶缺陷和延迟颗粒堆叠引起的。PLoS One. 2013;8(11):e80107。
- 44.
张凯,刘志,单霞,李春,唐霞,池明,冯慧。白菜生理特性及叶绿素生物合成(芸苔属植物拉伯, L. ssp。对)黄叶突变体,pylm.植物物理学报,2017;39(1):22-32。
- 45.
刘志刚,刘志刚。的遗传图谱拟南芥与胚胎基因突变。植物学报,1995;7(2):341-50。
- 46.
巴顿DA,弗兰兹曼LH,梅克DW。绘制胚胎发育所必需的基因拟南芥.Mol Gen Genet, 1991;227(3): 337-47。
- 47.
郑克红,刘春华,郑玉玉,郑玉玉,郑玉玉,李志强,李志强。水稻叶绿素亏缺突变体T-DNA基因捕获系统的研究。植物生理学报。2003;44(5):463-72。
- 48.
吴震,张鑫,何斌,刁亮,盛松,王静,郭鑫,苏楠,王玲,姜玲,王超,翟海华,万杰。叶绿素合成中叶绿素酯化受损的叶绿素缺乏水稻突变体。植物科学进展。2007;45(1):29-40。
- 49.
詹德G,诺里斯SR,罗斯利SD,布什DF,莱文IM,最后RL。后基因组时代基于拟南芥图谱的克隆。植物科学进展。2002;29(2):344 - 344。
- 50.
桑晓春,方路力,Vanichpakorn Y,凌玉华,杜鹏,赵芬芬,杨志林,何海辉。叶色突变体的生理特征及分子定位wyv1在大米中(栽培稻l .)。基因基因组学。2010;32(2):123-8。
- 51.
谢坤,吴松,李震,周勇,张东,董志,安祥,朱涛,张松,刘松,李娟,万霞玉米可能有雄性不育(ZmMs33)基因,编码甘油-3-磷酸酰基转移酶。理论与应用,2018;31(6):1363-78。
- 52.
Trick M, Adamski NM, Mugford SG, Jiang CC, Febrer M, Uauy C.将新一代测序数据中的SNP发现与散装分离分析(BSA)结合起来,对多倍体小麦的基因进行精细定位。植物学报。2012;12(1):14-30。
- 53.
李YP,曹Y,金的高分辨率连锁图Rfd1,是萝卜细胞质雄性不育的育性恢复位点(萝卜L.)由膨胀分离分析和RNA-Seq相结合产生。应用理论与实践。2014;29(10):344 - 344。
- 54.
陆华,林涛,Klein J,王松,齐军,周强,孙军,张震,翁勇,黄松。QTL-seq鉴定了一个早花QTL开花位点T在黄瓜。应用理论与实践。2014;27(7):1491-9。
- 55.
Ramirez-Gonzalez RH, Segovia V, Bird N, Fenwick P, Holdgate S, Berry S, Jack P, Caccamo M, Uauy C. RNA-seq批量分离分析可用于六倍体小麦育种的高分辨率遗传标记的鉴定。中国生物技术学报,2015;26(5):529 - 529。
- 56.
Schneeberger K, Weigel D.新测序技术使遗传学快速发展。植物科学进展,2011;16(5):282-8。
- 57.
Nestler J, Liu S, Wen TJ, Paschold A, Marcon C, Tang HM, Li D, Li L, Meeley RB, Sakai H, Bruce W, Schnable PS, Hochholdinger F. Roothairless5在玉米中发挥作用(玉米L.)根毛起始和伸长编码一种单株特异的NADPH氧化酶。植物学报(自然科学版);2014;29(5):344 - 344。
- 58.
唐慧敏,刘s, Hill-Skinner S,吴伟,Reed D,叶ct, Nettleton D, Schnable PS.玉米布朗midrib2(bm2)基因编码一种亚甲基四氢叶酸还原酶,有助于木质素的积累。植物学报,2014;26(3):344 - 344。
- 59.
谭超,刘震,黄松,冯慧。雄性不育突变体基因的定位英尺分在芸苔属植物拉伯l . ssp。学报通过BSR-Seq结合全基因组重测序。应用理论与实践。2019;32(2):355-70。
- 60.
Davis SJ, Kurepa J, Vierstra RD拟南芥HY1光敏色素-发色团生物合成所需的基因座,编码与血红素加氧酶相关的蛋白质。自然科学进展,1999;26(6):649 - 649。
- 61.
黄志刚,王志刚,黄志刚。血红素加氧酶的结构与机制研究。化学学报。2000;51(1):359-407。
- 62.
光敏色素光感信号网络。中国生物医学工程学报,2002;3(2):85-93。
- 63.
Emborg TJ, Walker JM, Noh B, Vierstra RD.多种血红素加氧酶家族成员有助于光敏色素的生物合成拟南芥.植物学报。2006;40(3):856-68。
- 64.
Terry MJ, Maines MD, Lagarias JC。大鼠肝胆绿素还原酶对光敏色素和藻胆蛋白发色团前体的失活。中国生物医学工程学报,1993;26(3):344 - 344。
- 65.
Despres B, Delseny M, Devic M.的部分互补胚胎缺陷突变:阐明基因功能的一般策略。植物学报,2001;27(2):149-59。
- 66.
沈勇,李C, McCarty DR, Meeley R, Tan BC。胚胎defective12编码质体起始因子3,对玉米胚胎发生至关重要。植物学报,2013;26(5):344 - 344。
- 67.
李震,汤玛士。PEI1一种胚胎特异性锌指蛋白基因,用于心脏期胚胎形成拟南芥.植物学报。1998;10(3):383-98。
- 68.
黄松,刘震,李东,姚瑞,孟Q,冯慧60离体小孢子培养物的co射线诱变。植物育种,2014;133:480-8。
- 69.
Kim D, Langmead B, Salzberg SL. HISAT:低内存需求的快速拼接对齐器。光子学报。2015;12(4):357-62。
- 70.
苏安,宋伟,邢娟,赵艳,张荣,李超,段明,罗明,石忠,赵娟。玉米s型细胞质雄性不育育性不稳定相关基因的扩增分离RNA-Seq鉴定。公共科学学报,2016;11(9):e0163489。
- 71.
Mortazavi A, Williams BA, McCue K, Schaeffer L, Wold B.用RNA-Seq绘制和量化哺乳动物转录组。光子学报。2008;5(7):621-8。
- 72.
默里MG,汤普森WF。高分子量植物DNA的快速分离。中国生物医学工程学报,1980;8(19):4321-6。
- 73.
Van Ooijen J. Joinmap 4.0软件用于计算实验群体的遗传连锁图。瓦赫宁根:Kyazma BV;2006.
- 74.
Kosambi DD.从重组值估计地图距离。安优生学。1944;12(1):175 - 5。
- 75.
黄松,刘震,姚睿,李东,张涛,李霞,侯玲,王勇,唐霞,冯华,一个花瓣退化突变体候选基因预测,pdm,一颗大白菜(芸苔属植物定ssp。采用精细作图和转录组分析。Mol Breed. 2016;36(3): 26-35。
- 76.
黄松,刘震,姚瑞,李东,冯华。花瓣变性突变体的转录组比较分析pdm在大白菜里(北京芸苔属)使用RNA-Seq。中国生物医学工程学报,2015;29(5):344 - 344。
- 77.
Livak KJ, Schmittgen TD。相关基因表达数据的分析采用实时定量PCR和2−ΔΔCt方法。方法。2001;25(4):402 - 8。
确认
作者感谢Editage的英文编辑和GENEWIZ的测序。
资金
本研究由国家自然科学基金项目(No. 31672144)资助。资金在研究的设计和数据的收集、分析和解释中发挥了作用。
作者信息
从属关系
贡献
KZ和FH构想了这项研究并设计了实验。KZ, YM, XS和NW进行实验并收集数据。KZ和WL分析了数据并起草了手稿。所有作者都阅读并批准了最终的手稿。
作者的信息
KZ,讲师,中国山西省大同市山西大同大学生命科学学院。YM和NW是中国辽宁省沈阳市沈阳农业大学园艺学院的研究生。王力,讲师,山西大同大学碳材料科学研究所,山西省大同市,中华人民共和国。XS,中华人民共和国山西省大同市山西大同大学生命科学学院实验室技术员。HF,中华人民共和国辽宁省沈阳市沈阳农业大学园艺学院教授。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
表型pylm小白菜中的突变体(左)和大白菜中的DH系FT(右)。比例尺:40mm
附加文件2:图S2。
G-pool和Y-pool之间的差异(|log . log)2折叠变化|≥1,FDR≤0.05)
附加文件3:表S1。
F2:3人口和他们的F2杂交' FT ' ×的基因型pylm。表S2。F3:4人口和他们的F2:3杂交' FT ' ×的基因型pylm。表S3。通过BSR-Seq在G-pool和Y-pool中鉴定的55250个基因的RPKM区间分布。表S4。Y-pool和G-pool中deg的基因鉴定和表达数据。表S5。引物序列为SSR与Indel标记紧密相连py1.表S6。预测A09染色体基因定位区域内的候选基因。表S7。引物的序列,用于克隆的全长和CDS序列BraA09004189。表S8。引物序列与SSR标记紧密相连py2。表S9。预测A07染色体基因定位区域内的候选基因。表S10。引物序列用于克隆候选基因的全长序列py2
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
张,K, Mu, Y, Li, W。et al。两个隐性黄化基因的鉴定(py1,py2)在小白菜里(芸苔属植物拉伯l . ssp。对).BMC植物生物学20.68(2020)。https://doi.org/10.1186/s12870-020-2271-3
收到了:
接受:
发表:
关键字
- 芸苔属植物拉伯,
- BSR-Seq,
- 黄化突变体,
- 基因映射