摘要
背景
大豆原产于东亚的温带地区。西非国家大豆产量低的部分原因可能是大豆对热带环境适应不足。适应需要了解主要成熟基因的等位基因组合的影响(E1,E2,E3)和系统架构。长少年特征(J)影响大豆的开花时间,短至每天12小时,这是热带纬度的特征。大豆植株结构包括由基因控制的确定或不确定的茎表型dt₁基因。了解这些遗传成分对植物发育和适应的影响是优化物候和提高热带环境下大豆产量潜力的关键。
结果
从5个重组自交系群体中获得了不同目标基因组合的大豆品系。这些大豆品系在多种环境下进行了田间试验,并在加纳北部各地对开花天数(DTF)、成熟天数(DTM)和株高进行了表征,并确定了每个品系的等位基因组合,以将基因型与表型联系起来。结果显示,DTF和DTM在基因型上存在显著差异,并可以对这些基因的不同变异等位基因进行比较。的突变等位基因J和E1对DTF和DTM有显著影响,这些基因的等位基因对DTF有相互作用,而对DTM没有相互作用。的dt₁基因对株高有显著影响,但对DTF和DTM无显著影响。
结论
本研究确定了加纳短日照热带环境中大豆基因的主要和次要作用等位基因,这些等位基因可以组合控制DTF、DTM和株高。这些表型有助于适应低纬度环境,可以在大豆育种计划中通过有针对性地选择所需的等位基因组合来优化。这些性状的遗传控制知识将加强分子育种,以生产出适合热带环境的最佳大豆品种。
背景
整个非洲对大豆的需求正在增加,既是作为牲畜饲料,也是作为改善营养不良的蛋白质来源。1,2],但是撒哈拉以南非洲的大豆产量低于其潜力[1,3.,4,5,6,7]。重要的是要确保西非热带大豆的遗传背景适应于补偿环境影响,如贫瘠的土壤或难以或昂贵控制的疾病。了解诸如开花天数和成熟天数等农艺性状背后的遗传机制,将使大豆育种者能够优化他们释放的品种,以保护产量潜力,因为光周期响应是影响大豆适应热带环境的最重要性状[8]。
大约5000年前,大豆在中国北方大约北纬35°的地方被驯化。9,10]。该纬度在生长季节昼长> 13 h。大豆是一种日照短、光周期敏感的植物,日照短可诱导开花[11,12,13,14]。当大豆在12小时或更短的日照时间内生长时,它在出芽时立即收到开始开花的提示,因此很难适应低于20°的纬度[15,16,17,18,19]。这种提早开花导致植株矮小,过早成熟,导致产量下降[20.]。
在温带气候中,控制生长和成熟的基因是已知的。E1, E2,和E3成熟基因功能时延迟开花,隐性时促进提前开花[21,22,23,24,25,26,27,28,29,30.,31]。株高受顶茎生长决定的影响,影响结荚产量和产量[j]。32]。不确定植物在开花后继续主茎生长和结节,而确定植物在开花后不久就终止主茎生长。成熟基因和结构基因都影响植株高度[32]。决定植物结构的主要基因是dt₁,四个独立的dt₁基因的错义等位基因产生决定性的植物结构[22,33,34]。
发现利用不同的等位基因可将大豆产量扩大到~ 20°E基因,虽然它不允许生产到达亚热带纬度低于20°[35,36]。在从秘鲁引进的植物(PI) 159925中发现了一种被命名为长幼体性状的性状,它确实允许在短日照环境中延长营养生长[16,18]。这种表型在巴西再次被观察到,通过栽培品种paran
PI 159925长幼期性状的遗传机制是最近才发现的[39,40]。一个控制pi159925长幼期性状的单基因被确定为该性状的主要基因拟南芥开花基因同源ELF3Glyma.04G050200 Wm82.a2。v1 [39,40],其中包含一个核苷酸缺失,导致第4外显子发生移码突变j - 1[39];然而,在该基因的编码序列中未发现致病多态性ELF3在Paranagoiana的基因基因图谱数据已经证明了这一点E6也位于第4号染色体上,可能紧密相连,也可能在ELF3源自Paranagoiana [41],所以这里这个等位基因被称为jx。此外,长幼性状可能受多个基因的影响ELF3,这些还有待确认[36,38]。的相互作用E1而人们才刚刚开始了解幼年时期的长特征[39]。
由于最近的克隆ELF3关于长幼体性状与长幼体性状之间的相互作用的认识还存在空白E成熟基因,尤指在短光周期环境中的成熟基因。此外,最近介绍了西非的分子育种,本研究的结果使分子工具的利用能够在育种方面取得重大进展。这项研究的目的是了解的影响E西非环境中长幼体性状的开花日和成熟日的成熟基因和等位基因。为此,创建了5个重组自交系(RIL)群体,对成熟基因和感兴趣的等位基因进行分离:E1/e1-as,E2/e2,E3/e3,j - 1和jx长幼性状的不同来源的等位基因J,dt₁/ dt₁。然后将这些品系在加纳北部~ 9°N纬度种植2年,并对开花、成熟和株高进行天数评估。
结果
重组自交系(RILs)的开发和基因型鉴定,以测试热带环境中开花、成熟和植物结构的等位基因组合
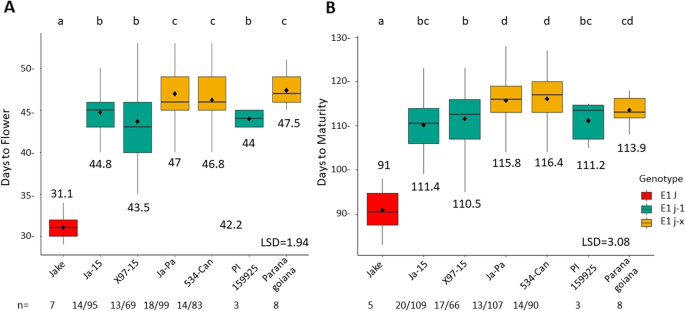
最大限度地提高大豆产量潜力需要优化适应目标环境中的植物发育。利用7个具有大豆主要成熟基因、终止茎的植物结构基因和长幼性状等位基因的亲本,开发了5个RIL群体,以确定这些等位基因组合对加纳北部热带田间环境中物候和农艺表型的影响(表1)1和表2、附加文件1).F2在哥斯达黎加的一个商业冬季苗圃的热带田野环境中,对Jake-15、Jake-Pa和X97-15种群的植株进行了长幼体性状的评价o表现出长幼体特征的Jake-15和Jake-Pa植株约有25%被选择进代。大豆的克隆J4号染色体上的长幼体性状基因使分子标记测定法得以发展j - 1源自PI 159925。jx此外,研究人员还利用分子标记法对来自Paranagoiana (PI 628880)的基因区进行了追踪,该基因区包含了该基因的最后一个内含子和外显子ELF3基因。所有表型均选择长幼代F2Jake-15和Jake-Pa群体中存在纯合子j - 1或jx等位基因。
F2X97-15群体中的植物具有更广泛的植物发育表型,因此在没有选择长幼体性状的情况下,就像其他群体一样。五个种群中有四个使用了一种变体j等位基因,但加纳品种“Jenguma”的长幼性状的遗传机制尚不清楚(表2)1).我们为每个未被选中的人群设定了100个ril。然而,由于各种因素,包括热带环境中的人口发展,能够为实验生产足够种子的ril数量大幅减少(表1)2).所有的ril均以其基因型为特征ELF3(J / J - 1/jx),E1(E1 / e1-as),E2(E2 / E2),E3(E3 / E3),dt₁(dt₁/dt₁R166W /dt₁与亲本基因型相关的P113L基因(附加文件)2).
5个RIL群体的花龄(DTF)和成熟期(DTM)
对5个RIL群体在低纬度大田环境下的大豆物候特征(DTF和DTM)进行了评价。在加纳北部(北纬9°)的5个地点种植了2年的ril、亲本系和对照,并测定了开花和成熟的天数。
通过方差分析分析所有RIL种群和环境中的所有实验品系的DTF、DTM和产量(附加文件)3.).DTF和DTM的统计分析验证了试验的准确性;然而,产量数据的变异系数太高,不能被认为是有用的(CV = 92%)。由于基因型、环境和基因型*环境效应,各性状存在显著差异3.),但在本研究中使用的个体基因型分析中,没有观察到基因型与环境的相互作用,因此没有进一步探讨这种相互作用(数据未显示)。
除X97-Jen种群外,DTF和DTM所有种群的ril直方图都显示出开花和成熟较晚的倾向,更类似于长幼亲本,而不是传统的幼亲本4).虽然没有比传统亲本更早开花或成熟,但与长幼亲本相比,存在较晚开花和成熟的海侵隔离。
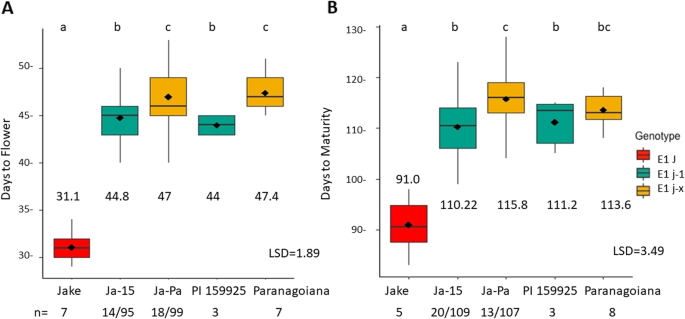
在Jake背景下,长幼性状的两个变异体表现出不同的DTF和DTM
了解基因多态性的不同影响ELF3在花龄和成熟期,对RIL群体Ja-15和Ja-Pa的不同突变等位基因进行了评价ELF3(J-1或j-x);这些ril具有固定的功能等位基因E1, E2,和E3被固定下来dt₁(表2).采用Fisher’s LSD (p= 0.05)。1).与ril相比j - 1与此同时,传统的双亲杰克花早了14天左右。亲本Paranagoiana和RILs都是从Paranagoiana衍生出来的jx与PI 159925相比,该等位基因在开花日数上表现出显著差异j - 1~ 2天等位基因(图2)1a).传统亲本Jake比含有该基因的Jake-15 ril提前19天成熟j - 1等位基因和rilj - 1等位基因比ril提前5天成熟jx来自Paranagoiana的等位基因。然而,亲本PI 159925和Paranagoiana在成熟期没有表现出同样的差异(图2)。1b)。
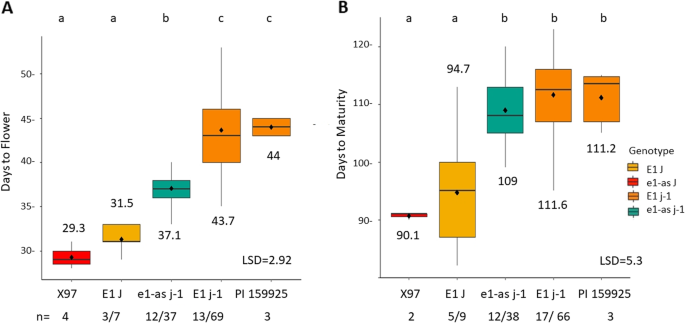
主成熟基因的错义等位基因E1, e1-as,影响DTF,但不影响DTM
测试等位基因组合的影响e1-as,E1,传统的少年ELF3(J)和PI 159925长幼体性状(j - 1),我们利用了X97-15 RIL人群(表1)2).比较DTF和DTM各基因型组合的均值(图2)。2).没有印度武装分子在场e1-as_J这个群体的基因型。将父X97与e1-as_ J基因型为RIL系E1_ J两基因型间DTF差异无统计学意义。当比较e1-as具有长少年特征(e1-as_j-1)E1在传统的青少年背景下(E1_J)时,DTF差异为5.6j - 1是礼物。最后,有6.6 DTF的差异E1与e1-as这与PI 159925亲本的结果相似(图2)。2有趣的是,这些差异在成熟期没有被观察到。唯一显著的差异是在基因型组之间,传统的和长期的幼鱼,不管E1状态,与时相差~ 14天j - 1存在(图2)2b)。
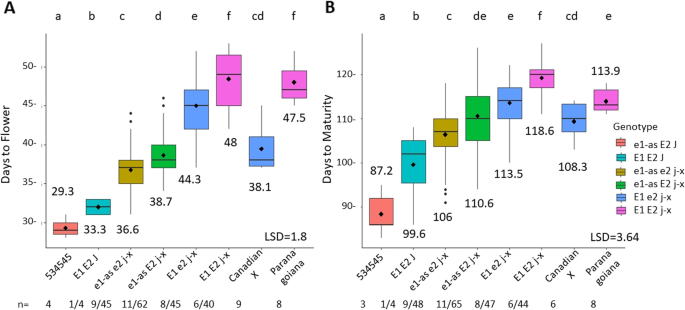
E2影响534-Can人群的DTF和DTM
为了理解E2在热带环境中影响开花和成熟的时间,一个种群被创造出来E1/ E1 -as, E2/ E2, J/ J -x。长幼体供体亲本为Can X (E1_e2_j-x),常规亲本为食品级大豆534545 (e1-as_E2_J).我们根据基因型对DTF和DTM数据进行了分类,并对来自群体的基因型进行了多均值比较检验。534-Can ril有5种不同的基因型(图2)。3.).1个常规基因型组E1_E2_J33天开花最早。随着延迟开花等位基因的添加,各基因型组的DTF均呈逐步增加趋势,且各RIL基因型组间差异显著。Can X的父节点(E1_ e2_ j-x)的意思与the相似e1-as_ jx而长长的幼年供体Paranagoiana的开花时间与凤尾花相似E1_E2_j-x基因型(无花果。3.a).随着延迟开花等位基因的添加,DTM显著增加。DTM在各基因型组间差异均有统计学意义(p < 0.05)e1-as_E2_j-x和E1_e2_j-x。Can X的父节点(E1_e2_j-x)有类似的成熟e1-as_ jx又是基因型组。长长的幼年供体Paranagoiana (E1_E2_j-x)有类似的成熟E1_e2_ jx基因型组。RIL基因型E1_ E2_ j-x与Paranagoiana相比,DTM长约5(图2)。3.b)。
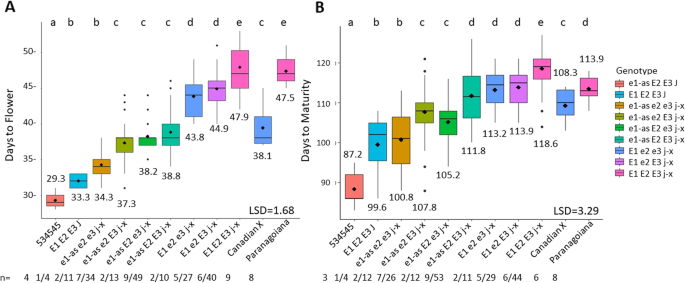
E2和E3对延迟开花和成熟有附加效应E1公元534年的背景
剖析…的影响E3与E1, E2,和J等位基因组合,我们比较了534-Can中8个不同基因型组的平均值(图2)。4).有四个显著不同的平均DTF组,显示的影响E3在不同的基因型组中并不一致。的E3等位基因状态分裂e1-as_ e2_j-x基因型组为早期DTF平均值e3ril和较晚的DTF平均为E3ril大约3天。这类似于e1-as_E2_e3 jx和e1-as_E2_E3_j-x虽然后两组在添加功能性等位基因后确实表现出延迟开花,但差异不显著。下一个显著差异发生在添加E1在e2 jx背景,虽然存在E3或e3对DTF没有显著影响。最后,当所有E等位基因在ajx背景,观察到最晚开花,这也类似于长幼供体Paranagoiana(图2)。4a).在DTM中e3ril与E3其他基因型相同的两例ril在发病前7天的DTM有显著差异e3对于这两个e1-as_e2_jx和e1-as_E2_jx。在另一种情况下,观察到的DTM无显著差异e3与E3在组中E1_e2_j-x(无花果。4b)。
的影响j - 1和jx不同遗传背景下长幼性状的等位基因
为了证实在j - 1和jx等位基因在不同的遗传背景下是一致的,我们将DTF和DTM与固定功能时的等位基因进行了比较E1,但在其他方面不同的基因背景。对四个RIL群体:Jake-15、X97-15、Jake-Pa和534-Can进行了多均值比较检验E1和J用各品系的基因型进行群体内分组。两个种群,Jake-15和X97-15,正在进行隔离j - 1来自PI 159925的长幼崽性状等位基因。也有两个种群在隔离jx来自Paranagoiana的长幼年等位基因:Jake-Pa和534-Can。对DTF和DTM进行了比较E1_ j - 1和E1_j-x RILs与几个父线(图2)。5).E1_ j - 1X97-15群体的DTF与相同基因型的Jake-15群体和长幼亲本PI 159925的DTF差异不显著。杰克-帕和534-Can rilE1_ jxDTF基因型差异不显著,但两者均有差异E1_ jx基因型组显著晚于E1_ j - 1分类至少2天(图2)5一个)。
在DTM中,Jake-15和X97-15线带E1_ j - 1与亲本PI 159925之间DTM差异不显著,但显著晚于常规亲本~ 20 d。杰克爸爸和534-CanE1_ jx成熟期差异不显著,但比亲本黑穗鱼晚成熟2 d,比亲本黑穗鱼晚成熟2 dE1_ j - 14-5天(图2)5b)。
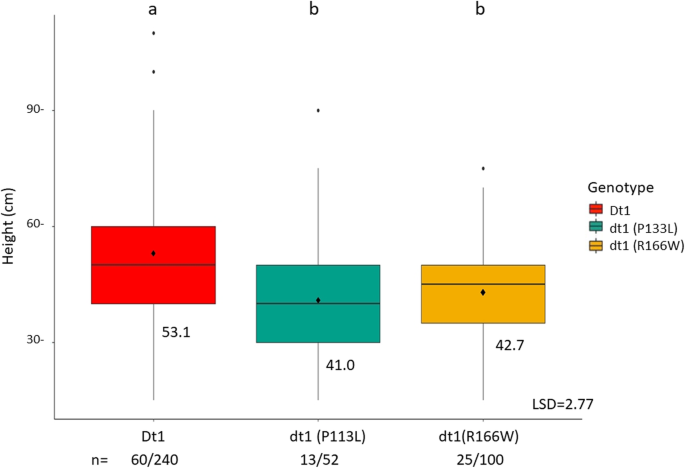
的dt₁在热带环境中,基因对株高影响不大,但对DTM影响不大
以确定是否等位基因的dt₁基因对热带环境有影响,2017年所有种群的植物高度都被记录下来。平均数比较是基于dt₁等位基因与人群无关。当不确定时,高度差大于10 cmdt₁与确定系相比,等位基因的存在与基因的表达无关dt₁等位基因存在(图2)6).进行均值比较以确定是否dt₁/ dt₁对DTM有影响,但当系长幼时差异不显著(数据未显示)。
讨论
大豆生产正在向世界赤道地区扩展,使小农能够获得这种经济上重要的作物。5,42]。对发展中国家来说,大豆是一种非常宝贵的作物,因为它具有弹性:农民可以选择将其种子出售给牲畜饲料市场,也可以直接食用大豆,以从其高蛋白和高热量中获益。1]。然而,大豆要被接受还需要克服许多障碍,如获得优质种子和盈利能力[43]。这两个挑战都可以通过熟练的育种实践来解决,努力在低纬度环境中实现最大产量。在这种具有挑战性的环境中培育大豆的一个方面是了解控制DTF和DTM的遗传机制,因为大豆是一种光周期敏感植物,不适应赤道附近典型的12 h天,导致产量低[20.]。我们的研究结果可以帮助促进进一步的研究和开发工作,以培育正确适应季节长度的品种,以确保当地农民拥有最佳的适应品种。这项研究还允许采用新的育种技术,利用分子标记来确定西非的成熟度。
我们的研究旨在了解的作用和相互作用E通过在西非低纬度地区对来自五个不同种群的ril进行实地测试,这些种群正在分离出我们感兴趣的基因的不同等位基因组合。最重要的是,我们发现长幼期性状的添加至少延迟开花13天,延迟成熟19天,证明长幼期性状是适应热带环境的关键特征[37(图。1).我们发现在杰克的背景下,两个不同的等位基因ELF3:j - 1和jx具有显著不同的DTF和DTM(图2)。1),jx开花较晚的。此外,我们确定E1和e1-as影响DTF但不影响DTMj - 1背景(图。2).这些结果表明,通过选择长幼代等位基因可以控制大豆季长,通过选择长幼代等位基因可以调节营养生殖比e1-as或E1。我们的结果与其他研究一致,表明E1或E1 -由于等位基因影响着长幼背景中不同的开花时间[39]。我们认为,在过去的研究中,观察到长幼性状的分离比为1:15,第二个基因最有可能E1[36,38]。
RILs人口为534人jx开花和成熟的时间呈逐步增加的趋势E添加等位基因。534-Can基因的功能等位基因在开花和成熟过程中显著延迟E2或E3出现(图2)。3.-4).这与j - 1等位基因在成熟时不表现出显著差异,即使等位基因为E1对比鲜明(图2)2).进一步的人口发展和测试将需要做,以了解是否其他等位基因E基因能够影响植物的成熟程度j - 1背景。我们的结果指出了DTF和DTM的层次效应,其中j>E1>E2>E3在低纬度环境中。
本研究中使用的系是来自五个不同种群的ril,它们在不同的遗传背景下询问成熟基因的影响。为了确保这些结果可以转化为有用的育种信息,在不同的遗传背景下研究了相同的等位基因组合(图2)。5).我们研究了两种基因型的结果:E1_j-1和E1_j-x在两个不同的背景下。为E1_j-1Ja-15群体有14个系,X97-15群体有13个系。为E1_j-x来自Ja-Pa群体18个,来自534-Can群体14个。无论遗传背景如何,结果都保持一致,在不同背景的相似基因型中没有观察到显着差异,但在不同背景的基因型之间也存在相同的显着差异E1_j-1和E1_j-x在不同的背景。这表明成熟基因E1和J对西非的育种工作至关重要,如果在其他遗传背景中使用,可以预期类似的结果。
同样重要的是要注意,对不适应的品种也有自然选择。具有该基因型的ril数量非常少e1-as_J或E1_J在哥斯达黎加的人口增长和加纳的试验中,它们都存活下来,产生了足够的种子,供后代使用。豆荚破碎对产量也是毁灭性的,而控制大部分破碎表型的基因,Pdh1[44],存在于以PI 159925为亲本的群体中。虽然从2016年到2017年,所有人群的测试风险指数都有所下降,但PI为159925的两个人群的风险指数为159925Pdh1种族隔离对ril的影响最大。基因的功能等位基因似乎存在自然选择E基因和基于存活的株系数量的长幼体性状(附加文件4).延迟开花和延迟成熟的自然选择在534-Can群体中尤为明显,其中许多ril都是用ril进行测试的E1_E2_E3_j-x基因型。
包括叠古马在内的大多数非洲品种的长幼期遗传机制尚不清楚J此外,品种还产生了新的潜在候选基因ELF3[45]。有一种繁殖的可能性j等位基因的ELF3可以通过优化季节长度和营养与生殖阶段的比例来提高产量,尽管这需要在田间环境中进行评估。我们的研究表明,可以通过E1a中选择的等位基因j - 1背景,并可能添加更精细的调节DTF和DTM与E2和E3等位基因jx背景。这些知识和这些等位基因应该在西非育种计划中实施,因为在某些热带环境中需要这样做,并对可能的产量效益进行测试。
综上所述,可以通过选择长幼等位基因来控制热带大豆的成熟时间,也可以通过选择长幼等位基因来控制DTFE1或e1-as,也可能E2和E3在某些背景下。正如之前的研究中提到的,仍然存在影响长幼期性状成熟表型的背景效应[18]。这项研究将使大豆育种者能够通过有意识地操纵季节长度和营养繁殖比来评估对产量的影响。
结论
在这里,我们提出了在加纳北部进行的两个等位基因的低纬度野外分析ELF3长少年特征;j - 1和jx与…的功能或非功能等位基因结合E1,E2,E3。我们已经证明,DTF和DTM在不同的等位基因组合中存在显著差异,包括jx延迟DTF和DTM比j - 1。等位基因的E1影响DTF但不影响DTMj - 1背景。等位基因的E1和E2a中DTF和DTM的影响jx背景,E3也可能有轻微的影响。等位基因的dt₁影响植株高度,但不影响植株成熟度。需要做进一步的研究来了解这些等位基因组合如何影响低纬度环境下的产量。
方法
植物材料
选取7个大豆亲本建立实验群体(表2)1).本研究创建了5个重组自交系(RIL)群体,每个群体有一个传统的幼亲本(J)和一个长幼亲本(j)(表2).采用了三种常规父母。杰克是美国密苏里大学发布的一种高产MG - V确定品种[46]。X97 - 0101(本文中简称X97)是不确定MG III Williams 82的不含凝集素、不含胰蛋白酶抑制剂的等基因实验衍生物,由伊利诺伊大学(University of Illinois)开发[47]。534545是一种不确定的MG III食品级大豆品种,因其蛋白质和蔗糖含量高而被密苏里大豆销售委员会使用[48]。利用了四个长幼父母。pi159925是一种来自秘鲁的确定植物引种系,从伊利诺伊州香槟-厄巴纳的大豆种质收集中获得。https://www.ars-grin.gov/核计划组/ index . html)。这是第一个具有长幼体性状的系,并指定了等位基因j - 1[18,39]。PI 159925是本研究中利用的唯一具有粉碎易感等位基因的亲本Pdh1[49,50]。Paranagoiana (PI 628880)是从巴西释放的确定品种paran
RIL种群和田间试验设计
大豆种群(表12)源自2013年夏季(Jake-15和Jake-Pa)或2014年(X97-Jen和534-Can X)或2014年1月在哥斯达黎加Upala(10.8979°N, 85.0155°W) (X97-15)在密苏里州哥伦比亚附近的南方农场研究中心(South Farm Research Center)杂交的品种。F1对Jake-15、Jake-Pa和X97-15群体的种子进行种植和自花授粉,得到F22014年夏天在旧金山播种。F1对X97-Jen群体的种子进行自花授粉,得到F22015年2月在哥斯达黎加的乌帕拉播种。F1对534-Can X群体的种子进行自花授粉,产生F2在2015年1月获得种子,然后推进另一代生产F3.2015年5月全部在哥斯达黎加的乌帕拉
Jake-15, Jake-Pa和x97 - 15f2从2014年12月到2015年4月,在哥斯达黎加的Upala种植种群进行植物发育表型分析。每系每种群单行种植100粒种子,播种后81 d,单株F2对植物发育阶段进行评价。有92°F2在Jake-15和Jake-Pa种群中,每个种群中都有植物2在x97 - 15f的工厂2人口。在Jake-15和Jake-Pa群体中,分别标记了21株和20株具有长幼期特征(开花延迟比例为1:3)的植株,在FTA卡片上收集叶片样本进行基因分型,并对F -15和Jake-Pa群体的单株穗粒进行了基因分型2:3每个长幼植株的种子都是在植株成熟后产生的。所有的x97 - 15f2种群植物为单株脱粒。
2015年5月,对重组自交系(RIL)进行了单粒遗传的群体发育研究4:6在哥斯达黎加的乌帕拉开始使用未选择的F2:3种子(X97-15群体),未选F3.种子(534-Can X种群)和单个F3.从每一株所选的长幼枝F2:3Jake-15和Jake-Pa种群的植物。对于X97-Jen人群,ril为F3:5因为可用的起始材料是F22015年5月在哥斯达黎加的乌帕拉播种。尽管每个未选择的RIL群体都有100个RIL,但由于成熟度不合适、种子破碎或散装阶段的其他问题,许多品系在推进过程中丢失或不能产生足够的种子(2016年4月/ 5月在哥斯达黎加Upala)。F4:6瑞来斯(F3:5所有种群的X97- Jen种子于2016年春季运往加纳的Tamale(附加文件)1).
2016年和2017年在加纳北部的5个地区进行了产量试验。研究区为萨凡纳农业研究所研究区(Nyankpala SARI [nyys, 9.403°N,-1.008°W]、Yendi SARI [YeS, 9.495°N,0.128°W]和Wa SARI [WaS, 9.799°N, - 2.499°W])或当地农民的农田(Nyankpala farmer [NyF, 9.396°N,-1.019°W]和Yendi farmer [YeF, 9.412°N,-0.102°W])。种植日期由连续季节性降雨的开始和田间条件/可用性决定。2016年大豆播种时间为7月9日和11日,7月13日,7月15日,7月16日,7月20日。2016年,由于大豆猝死综合征的破坏,未收集YeF成熟度和产量数据。试验设计为以本地品种叠叠菊为单试验线,随机完全区组设计为2个重复,其中一排叠叠菊的两侧以本地检查(叠叠菊)为边界。2016年,屏蔽是由人口完成的。按照国际种植协会的建议,每行种植间隔75厘米(www.iita.org).地块长约300厘米(10英尺),上面有一条约122厘米(4英尺)的小巷。粒状接种剂被使用,并在种子播种和覆盖之前直接应用于开放的休假。没有使用化肥来代表当地农民的做法,并复制农民的农艺和产量结果。2016年,每个地块种植了120颗种子,以弥补预测的发芽率低。在播种后和出苗前喷洒草甘膦。出苗后手动除草。出苗记录时,每行超过100株的地块减薄至100株。当2+株在地块中心开花时确定开花日期(R1),以消除对地块末端单株的环境影响。当95%的豆荚干燥时,地块被认为成熟(R8) [51]。每个地块随机个体从地面到顶端分生组织的高度在收获前立即测量。收割是手工完成的,用Almaco单束脱粒机机械脱粒。种子用筛子和手工采摘清洗干净,然后称重计算产量。种子产量以每10英尺行克数计算。YeS和NyF生产的种子质量最高,并于2017年储存在4°C的冷室中种植。
2017年的现场和实验设计与2016年相同,但有一些例外。如果在2017年产生的种子不足以在5个地点种植,或者在2016年表现出分离表型,则将从2017年的田间试验中淘汰。以PI 159925为亲本的种群由于破碎而遭受产量损失。PI 159925包含Pdh1[44易破碎的等位基因。X97-15种群在加纳经历了严重的种子损失,由于其他42个品系的种子产量不足,在加纳进行多地点田间试验的种群规模从2016年的47 RIL减少到2017年的5 RIL。在Jake-15项目中,由于种子产量低,2017年20个品种中只有9个进行了测试。2017年,YeF于7月8日播种,YeS于7月10日播种,NyF于7月11日播种,NyF于7月18日播种(8月2日补种),WaS于7月21日播种。
每块地播种200颗种子,以弥补预测的低发芽率。2017年,由于洪水破坏导致应急能力差,纽约没有收集到任何数据。
加纳北部7月的日长为12.4小时,12月的日长为11.4小时。www.timeanddate.com).
基因分型
DNA提取
最初的基因分型是在2016年在加纳从R1的三叶厂(Whatman, Clifton, NJ)的FTA卡上的压叶机完成的,然后运到密苏里州的哥伦比亚,如[52]。缺失的数据于2017年在密苏里州哥伦比亚再次进行了基因分型7从加纳运来的种子使用DNeasy Plant Mini Kit (Qiagen, Valencia, CA)从2 - 5颗种子中提取DNA,并按照[23]。
E基因分型分析
E1和E2基因分型试验按[23]。E3基因分型试验按[22]。
Dt1基因分型分析
dt₁/ dt₁R166W
所描述的所有SimpleProbe检测方法的开发方法与[50]。建立了简单探针熔化曲线法测定腺嘌呤与胸腺嘧啶的比值dt₁R166W来自野生型的错义等位基因dt₁(Glyma.19G194300 Wm82.a2.v1)。引物Dt1in31f (5 ' - catgagagagatcactgac -3 ')和Dt1endr1 (5 ' - GCAAAACCAGCAGCTACTT-3 ')扩增292 bp的区域,其中包括位于45,183,701 in位置的T/ a SNP大豆Wm82.a2。v1基因组。SimpleProbe寡核苷酸(5 ' - Fluorescein-SPC-TGCACAGAGGGAAACGGCT-Phosphate - 3 ')使用LightCycler Probe Design软件(Roche Applied Science, Indianapolis, IN)设计并退火到传感链。PCR反应为20 μl,包括DNA模板、0.5 μM反向引物Dt1endr1、0.2 μM正向引物Dt1in31f、0.2 μM SimpleProbe、缓冲液(40 mM Tricine- KOH [pH 8.0]、16 mM MgCl)23.75 μg ml−1BSA), 5% DMSO, 200 μM dNTPs和0.2倍钛Taq聚合酶(BD Biosciences, Palo Alto, CA)。PCR反应在LightCycler 480实时PCR仪(Roche Applied Science, Indianapolis, IN)上进行。反应在95℃下变性3 min,然后在每个循环中在95℃下变性20 s,引物在60℃下退火20 s,产物在72℃下拉长20 s,共45个循环。扩增完成后,在50 ~ 70℃范围内绘制熔化曲线。的dt₁R166W突变等位基因在57℃时达到峰值dt₁野生型在63℃时达到峰值。杂合的dt₁/ dt₁样品产生了两个峰。
dt₁/ dt₁P113L
用于检测P113L错义dt₁等位基因,在引进a的基础上建立了一种裂解扩增多态性序列测定方法HindIII限制性内切酶位点在P113Ldt₁45,183,859 (G/A)位等位基因大豆Wm82.a2。V1基因组[53]。用DNA模板和Dt1in31f和Dt1endr1引物(如上所述)在0.5 μM下,用缓冲液(40 mM Tricine- KOH [pH 8.0], 16 mM MgCl)在20 μl反应中扩增292bp的PCR产物23.75 μg ml−1BSA), 5% DMSO, 200 μM dNTPs和0.2倍钛Taq聚合酶(BD Biosciences, Palo Alto, CA)。反应在95℃下变性3 min,然后在每个循环中在95℃下变性20 s,引物在60℃下退火20 s,产物在72℃下拉长20 s,共45个循环。扩增完成后,每个样品取5 μl,在FlashGel系统(Lonza, Basel, Switzerland)上检查产物形成。在每个样品的剩余15 μl上,加入含有1.5 μl New England BioLabs (NEB, Ipswich, MA)缓冲液2、1.5 μl NEB的酶混合物(15 μl)HindIII(3万单位),ddH 12 μl20.反应在37°C下孵育过夜,产物在FlashGel系统上分离。的dt₁基因型产生215 bp的条带dt₁P113L基因型产生215 bp和77 bp的条带,杂合样品产生292、215和77 bp的条带。
ELF3基因分型分析
j - 1:在PI 159925中发现胞嘧啶缺失(C-del)
为检测PI 159925版本的长幼子性状C-delELF3 (Glyma.04G050200, Wm82.a2.v1),建立了SimpleProbe检测方法。引物Cdelfor (5 ' - tgttctgcagagaatgcggt -3 ')和Cdelr (5 ' - CCTCCTCCACAACCAGTTCC-3 ')产生一个254 bp的PCR产物,其中包含位于4,077,102位的C/−SNP (Lu et al. 2017)。SimpleProbe寡核苷酸(5 ' -Fluorescein-SPC-GACGGTAGCCACCTTTCAAAATGCA-Phosphate-3 ')使用LightCycler Probe Design软件(Roche Applied Science, Indianapolis, IN)在传感链上设计。PCR结果与dt₁/ dt₁R166W除了熔化曲线在50 ~ 75°C范围内。C-del突变体等位基因在61°C时达到峰值ELF3野生型在68°C时达到峰值。杂合样品产生这两个峰。
jx: Paranagoiana的未知突变
控制Paranagoiana长幼鱼性状的确切多态性尚不清楚,但它被认为与ELF3[41]。测序的ELF3来自Paranagoiana的DNA也没有产生任何多态性,除了我们难以扩增和测序内含子3和外显子4之间的连接。来区分巴拉戈亚纳jx我们开发了一种基于凝胶的PCR检测方法ELF3另一条染色体上的控制区确保PCR成功。引物喜欢。(5 ' - CGAGTATTGTGCAATTTTCTTGATCC-3 ')和Cdelr:(5 ' - CCTCCTCCACAACCAGTTCC-3 ')扩增了一个652 bp的区域,包括内含子3到外显子4的连接。对照引物组lx1f (5 ' - ACCGACATCTTAGCGTGCTT-3 ')和lx1r (5 ' - aaaaaggttgtctctattatgccat -3 ')扩增了13号染色体(Glyma.13G347600)上一个129 bp的脂肪加氧酶基因区域。
PCR反应为20 μl,包括DNA模板(该实验不适用于叶压榨的DNA), 0.5 μMELF3反向引物Cdelr, 0.5 μMELF3正向引物ljkf,对照引物:0.25 μM lx1f和0.25 μM lx1r,缓冲液(40 mM Tricine- KOH [pH 8.0], 16 mM MgCl)23.75 μg ml−1BSA), 5% DMSO, 200 μM dNTPs和0.2倍钛Taq聚合酶(BD Biosciences, Palo Alto, CA)。PCR反应在热循环仪上进行,在95°C下变性3 min,然后在95°C下变性20 s,引物在60°C下退火20 s,产物在72°C下延长60 s,共45个循环。扩增完成后,PCR产物在1.5%琼脂糖凝胶上运行,其中含有稀释1:10 000的SYBR Safe DNA凝胶染色剂,在(145 V)下运行20分钟。用蓝光透光器观察产品。只有对lx1引物产生129 bp产物的品系被分配为基因型J。如果上面的波段存在,例如在J对照时,认为线路是常规的,如果不存在652 bp波段,则认为是常规的jx。
统计分析
2016年,Nyankpala田平均每周记录3次花日,Yendi田平均每周记录1次,Wa田平均每周记录1次。2017年开花天数和成熟天数:2016年和2017年在Nyankpala田每周记录两次,在Yendi田每周记录两次,在Wa田每周记录一次。采用SAS软件9.4版的PROC GLM程序对收集到的所有数据进行方差分析(SAS Institute, 2012)。Windows的SAS 9.4系统。SAS研究所,加里,北卡罗来纳州)。未使用佤邦的开花天数数据。
利用模型方程name + environment + rep (environment) + name*environment (Additional file)对所有品系的开花天数、成熟天数和产量数据进行方差分析3.).环境被定义为站点年或换句话说location_year。有9个环境记录了数据。
将具有相同基因型的品系数据分组,采用方差分析方法进行基因型+环境+ rep(环境)和基因型*环境的分析。每个基因型组的异常值只有在验证它们是由于记录错误后才被删除。来自基因型数据不完整(至少一个基因缺失或杂合)的系的数据从分析中省略。根据这些标准对数据进行清理后,使用SAS软件9.4生成Fisher最小显著差异(lsd),其中p= 0.05。箱线图是使用R版本3.6.0中的ggplot2包构建的[54]。
数据和材料的可用性
在当前研究中使用和/或分析的数据集可根据通讯作者的合理要求提供。
缩写
- DTF:
-
花开的日子
- DTM:
-
到期日
- 迷幻药:
-
最小显著差异
- PI:
-
引进的植物
- 瑞来斯:
-
重组自交系
参考文献
- 1.
Masuda T, Goldsmith PD。世界大豆生产:收获面积、产量和长期预测。食品与农业管理,2009;12(4):143-62。
- 2.
王福荣,陈志强,陈志强,陈志强,等。模型预测大豆将主导整个非洲的作物生产。植物学报,2019,42(1):373-85。
- 3.
阿贝特,奥尔a .热带豆科植物的研究与开发:迈向以知识为基础的战略。[J] .中国农业科学,1981;10:1-12。
- 4.
戈德史密斯PD。大豆生产、销售和利用经济学。大豆化学、生产、加工与利用;2008.117 - 50页。
- 5.
Abate T, Alene AD, Bergvinson D, Shiferaw B, Silim S, Orr A,等。非洲和南亚的热带谷物豆类:知识和机遇:国际半干旱热带作物研究所;2012.
- 6.
Alene A, Coulibaly O, Abdoulaye T.世界豇豆和大豆经济:事实、趋势和展望。国际热带农业研究所:利隆圭;2012.
- 7.
IITA。大豆2014[引2014 12-10]。可以从:http://www.iita.org/soybean。
- 8.
Bandillo NB, Anderson JE, Kantar MB, Stupar RM, Specht JE, Graef GL,等。大豆局部适应的遗传基础剖析。科学通报,2017;7(1):1 - 7。
- 9.
论大豆的驯化。经济学报。1970;24(4):408-21。
- 10.
Carter TE, Nelson RL, Sneller CH,崔忠。大豆遗传多样性。大豆:改良、生产和使用。2004 (soybeimprovement): 303-416。
- 11.
加纳WW,阿拉德HA。昼夜相对长短等环境因素对植物生长繁殖的影响。气象,1920;48(7):415。
- 12.
Whigham DK, Minor HC。农艺性状与环境胁迫。纽约:大豆生理学、农学与利用学术出版社;1978.p . 77 - 112。
- 13.
Destro D, Carpentieri-Pipolo V. Afonso de S. Kiihl R, Alves de Almeida L.大豆长幼期的光周期和遗传控制研究进展。作物品种学报,2001;1(1):72-92。
- 14.
田志强,王志强,王志强,等。大豆开花光周期响应的遗传和分子基础。品种科学,2012;61(5):531-43。
- 15.
Hartwig EE, Edwards CJ。形态特征对大豆种子产量的影响。杨建军。2007;32(1):1 - 4。
- 16.
Hartwig EE, Kiihl RA。短日照条件下大豆延迟开花性状的鉴定与利用。农田作物研究。1979;2:145-51。
- 17.
Kiihl R. In: Garcia A,编辑。长幼体性状在大豆品种选育中的应用。布宜诺斯艾利斯:世界会议Investigación en Soja;1989.
- 18.
Ray JD, Hinson K, Mankono EB, Malo MF。大豆长幼期性状的遗传控制。作物科学,1995;35(5):1001 - 6。
- 19.
Cober ER, Tanner JW, Voldeng HD。大豆光周期敏感位点对光质量的响应是不同的。作物科学。1996;36:606-10。
- 20.
辛克莱TR, Hinson K.大豆开花对长幼期性状的响应。作物科学,1992;32(5):1242-8。
- 21.
张丽,Kyei-Boagen S,张军,张敏,Freeland T, Watson C Jr.美国大豆成熟群体最适适应带的改良。作物管理。2007;6:1。
- 22.
Langewisch T,张宏,Vincent R, Joshi T, Xu D, Bilyeu K.大豆成熟基因主要单倍型的snp分析。科学通报,2014;9(4):e94150。
- 23.
Langewisch T, Lenis J,蒋国良,王东,Pantalone V, Bilyeu K.大豆成熟群体分子模型的建立与应用。植物学报,2017;17(1):91。
- 24.
伯纳德RL。决定大豆开花和成熟时间的两个主要基因。作物科学。1971;11:24 - 4。
- 25.
夏忠,Watanabe S, Yamada T, Tsubokura Y, Nakashima H,翟辉,等。定位克隆和鉴定揭示了大豆成熟位点的分子基础E1它调节光周期开花。中国科学:自然科学版,2012;39(3):391 - 391。
- 26.
Cober ER, Voldeng HD。一个新的大豆成熟与光敏基因座E1和T。作物科学。2001;41:698-701。
- 27.
夏志平,刘建平,刘建平,刘建平,等。利用残杂合子系的图谱克隆策略表明GIGANTEA基因与大豆成熟和开花有关。遗传学。2011;188(2):395 - 407。
- 28.
黄豆开花对荧光日长的遗传响应。[J]中国生物医学工程学报,2011;13(4):391 - 391。
- 29.
李建军,李建军,李建军,等。长日照不敏感的遗传分析。大豆遗传学报,1980;7:26-9。
- 30.
刘建军,刘建军,刘建军,刘建军,等。大豆成熟位点相关基因的图谱克隆E3。遗传学。2009;182(4):1251 - 62。
- 31.
徐敏,徐志,刘波,孔峰,Tsubokura Y, Watanabe S,等。4个成熟基因的遗传变异影响大豆的光周期不敏感和phya调控的花后反应。植物生理学杂志,2013;13(1):91。
- 32.
伯纳德RL。影响大豆茎终止的两个基因。作物科学。1972;12:235-9。
- 33.
田忠,王旭,李锐,李勇,Specht JE, Nelson RL,等。大豆生长习性的人工选择。中国科学:自然科学版,2010;37(5):563 - 568。
- 34.
刘波,刘志强,孔峰,金泽A,夏志,等。大豆茎生长习性基因dt₁是拟南芥TERMINAL FLOWER1的同源植物。植物生理学报,2010;32(1):391 - 391。
- 35.
黄豆对矿质元素吸收的双列分析[j]。美林]。理论与应用,1995;90(5):707-13。
- 36.
Carpentieri-Pipolo V. Alves de Almeida L . Afonso de S. Kiihl R.短日照条件下大豆长幼期遗传。中华生物医学杂志。2002;25(4):463 - 469。
- 37.
Bonato ER, Vello NA。E6,一个控制大豆早花早熟的显性基因。中华生物医学杂志,1999;22(2):229-32。
- 38.
可贝尔。极短光周期下长幼大豆开花响应。作物科学,2011,51(1):140-5。
- 39.
卢生,赵旭,胡勇,刘生,南辉,李旭,等。大豆J位点的自然变异提高了对热带的适应性,提高了产量。物理学报,2017;49(5):773-9。
- 40.
岳勇,刘宁,姜波,李敏,王辉,姜志,等。编码GmELF3的J基因的单核苷酸缺失使其具有较长的青春期,并与热带大豆的适应性有关。植物学报,2017;10(4):656-8。
- 41.
李欣,方超,徐敏,张飞,卢生,南辉,等。大豆成熟基因E6数量性状位点定位。作物科学,2017,57(5):2547-54。
- 42.
大豆生产制约因素的评估:以加纳北部地区为例。发展与可持续农业,2011;6(2):199-214。
- 43.
Dogbe W, Etwire PM, Martey E, Etwire JC, Baba II, Siise A.大豆生产经济学:来自加纳北部Saboba和Chereponi地区的证据。农业科学学报,2013;5(12):38。
- 44.
Funatsuki H, Suzuki M, Hirose A, Inaba H, Yamada T, Hajika M,等。大豆抗碎性促进全球传播的分子基础。中国科学:自然科学版,2014;31(5):17797-802。
- 45.
方超,陈磊,南辉,孔磊,李勇,张宏,等。基于多遗传群体和基因分型测序的大豆长幼期性状一致新qtl快速鉴定动物学报,2019;39(6):80。
- 46.
香农J, Wrather J, Sleper D,罗宾斯R,阮H,阿南德s。植物学报,2007;1(1):29-30。
- 47.
Palacios M, Easter R, Soltwedel K, Parsons CM, Douglas M, Hymowitz T,等。大豆品种及加工对雏鸡和仔猪生长性能的影响。动物学报,2004;32(4):1108 - 1108。
- 48.
Bilyeu KD, Wiebold WJ。棉子糖合酶2 (RS2)基因不同等位基因大豆种子碳水化合物谱的环境稳定性农业食品化学学报,2016;64(5):1071-8。
- 49.
Funatsuki H, Ishimoto M, Tsuji H, Kawaguchi K, Hajika M, Fujino K.大豆荚果破碎QTL的简单序列重复标记。植物育种,2006;125(2):195-7。
- 50.
Miranda C, Culp C, Škrabišová M, Joshi T, Belzile F, Grant DM,等。Pdh1的分子检测工具可以通过减少豆荚破碎造成的产量损失来提高大豆育种效率。动物学报,2019;39(2):27。
- 51.
Fehr WR, Caviness CE。大豆发育阶段;1977.
- 52.
张建军,张建军,张建军,等。基于遗传标记的亚麻酸表型选择研究。作物科学,2006;46(2):747-50。
- 53.
刘刚,赵磊,Averitt BJ,刘勇,张斌,常荣,等。中国大豆品种GmTfl1等位基因的地理分布作物学报;2015;3(5):371-8。
- 54.
韦翰H. ggplot2:优雅的图形数据分析:斯普林格;2016.https://cran.r-project.org/web/packages/ggplot2/citation.html。
致谢
作者感谢Brian Diers博士在引导新的研究环境方面的帮助。我们也感谢克里斯蒂·科尔为种群发展的杂交尝试提供的帮助。如果没有Kerry Clark博士的帮助和建议,加纳的实地研究几乎是不可能的。还要感谢哥斯达黎加种子公司,他们监督了我们近2年的人口增长。最后,感谢位于加纳尼扬帕拉的萨凡纳农业研究所主办并促进了研究的顺利完成。
资金
这项研究得到了美国农业部/农业研究所的支持,用于种群发展和基因分型分析;来自美国国际开发署“大豆价值链研究养活未来创新实验室”的拨款支持了人口的发展,普渡大学博洛格研究生研究补助金为加纳的研究活动提供了资金,密苏里大学为加纳的研究活动提供了博士生津贴支持和资金。
作者信息
从属关系
贡献
KB, AS,和CM构思和设计实验。CM, ND, KB进行实验。CM、KB、AS和EC分析结果。CM和KB撰写了稿件,所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1。
重组自交系群体发育。本研究中使用的所有5个RIL群体的植物逐代计划。
附加文件2
所有人群的RILS数据。ril的数据包括群体名称、实验名称、2年平均DTF和DTM、基因型E1,E2,E3,dt₁,J。
附加文件3。
所有RILS的DTF, DTM和产量的方差分析表。对感兴趣的农艺性状进行三方差分析。
附加文件4
5个RIL群体农艺性状直方图。ril的数量在y轴上,天数在x轴上。每个群体的父母数据用箭头表示,父母名字的第一个字母在右边。a: Jake-15日到花b: Jake-Pa日到花c: Jake-15日到成熟d: Jake-Pa日到成熟a-d:两个种群均因长幼体性状而被选择。e: X97-15的开花天数f: X97-Jen的开花天数g: X97-15的成熟天数h: X97-Jen的成熟天数e-h:两个群体的分离时间为E1 / e1-as不同的等位基因J / J。i: 534-Can的开花天数j: 534-Can的成熟天数i-j:这个群体被隔离到E1/ E1 -as E2/ E2 E3 E3或J / J x。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
Miranda, C., Scaboo, A., Cober, E.。et al。大豆成熟基因等位基因对开花时间、成熟度和热带环境适应性的影响及其相互作用。BMC Plant Biol20.65(2020)。https://doi.org/10.1186/s12870-020-2276-y
收到了:
接受:
发表:
关键字
- 大豆
- 长幼期特征
- 非洲
- 较低的纬度
- 成熟
- 热带环境
- 茎顶生长
- 加纳