- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
苹果的较高生长(GydF4y2Ba马鲁斯GydF4y2Ba×GydF4y2Ba家庭GydF4y2Ba果实皮层在早期发育过程中由资源密集的代谢支持GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba20.GydF4y2Ba文章编号:GydF4y2Ba75.GydF4y2Ba(GydF4y2Ba2020GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
苹果果实的主要肉质组织在空间上可分为皮层和髓。这些组织在发育过程中表现出不同的生长。这种差异生长的关键特征,以及支持这种差异生长的碳汇代谢程序,以前还没有被研究过。我们假设这些果实组织之间的差异生长是由不同的库代谢程序支持的,特别是在早期发育过程中。测量代谢相关基因的生长、代谢物浓度和转录丰度,以确定不同的生长特征及其潜在的代谢程序。GydF4y2Ba
结果GydF4y2Ba
在果实发育早期,皮层的生长速度比髓高5倍,表明在这一时期形成了生长差异。此外,当通过去除水池增加资源可用性时,皮质生长优先增强。在果实发育的早期,这些组织之间的代谢程序的最大差异是明显的。在发育早期,通过增加进口碳(C)资源,山梨醇和蔗糖,以及氮(N)资源,天冬酰胺的分解代谢,促进了高级皮层的生长。它还与初级C代谢增强和C以苹果酸和奎宁酸的形式储存有关。这一时期的髓内代谢程序包括有限的C和N分配给生长,但更多的分配给储存,并促进蔗糖-蔗糖循环。GydF4y2Ba
结论GydF4y2Ba
这些数据在一起表明果皮组织在早期果实开发期间显示了资源密集型代谢程序。这提供了C骨干,蛋白质,能量和渗透物,以支持其较高的增长。GydF4y2Ba
背景GydF4y2Ba
水果在形态上和解剖学上,但在所有情况下都是由多种组织类型的不同起源构成。苹果果实有两个主要肉质组织:皮质和佩斯(图。GydF4y2Ba1GydF4y2Baa).人们提出了两种假说,即花托和阑尾,来解释这些组织的起源[GydF4y2Ba1GydF4y2Ba].花托假说认为,果的肉质组织是轴向起源,从花梗和花托延伸出来。阑尾假说认为,构成成熟果实最大部分的皮层来自于附属组织,很可能来自于萼片、花瓣和花药融合的基部[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba].此外,髓构成了围绕在种子室周围的果实内部区域,被认为包含来自子房的真正果实(图。GydF4y2Ba1GydF4y2Ba) (GydF4y2Ba1GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba].苹果果实生长和开发包括多个阶段,类似于在其他水果中观察到的番茄(GydF4y2Ba茄属植物lycopersicumGydF4y2Ba)[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba].在施肥和种子套装后的果实套装中发生果实生长和发育的启动发生,完全绽放后不久。苹果的果实生长是expolinear [GydF4y2Ba6.GydF4y2Ba].早期的果实生长包括密集的细胞生产(通过细胞分裂在群体中产生新的细胞)[GydF4y2Ba7.GydF4y2Ba],并在盛开(DAFB)后延伸到〜8天〜30天[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].随后是半果实生长,是线性的,并且通过广泛的电池扩张实现大小的最大增加的尺寸增加超过1000倍[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba].这段时间可能延伸到120-180达布。在发展的最后阶段,水果经历了涉及果实颜色的变化,含糊不清,坚定,淀粉含量的变化,可溶性糖的增加,降低酸度和酸度下降的变化成熟GydF4y2Ba11GydF4y2Ba那GydF4y2Ba12GydF4y2Ba].通过细胞扩张的持续增长可以在此期间发生[GydF4y2Ba13GydF4y2Ba].皮质和髓组织显示增长的差异:虽然它们与盛开的花大小与花尺寸相似,因此皮质构成了成熟度的70%,表明该组织的优先增长[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba14GydF4y2Ba].虽然~ 50 DAFB在组织大小上的差异是明显的,但这些组织在发育过程中形成差异生长的时间尚未确定[GydF4y2Ba8.GydF4y2Ba].尚未调查促进优先皮质增长的机制。GydF4y2Ba
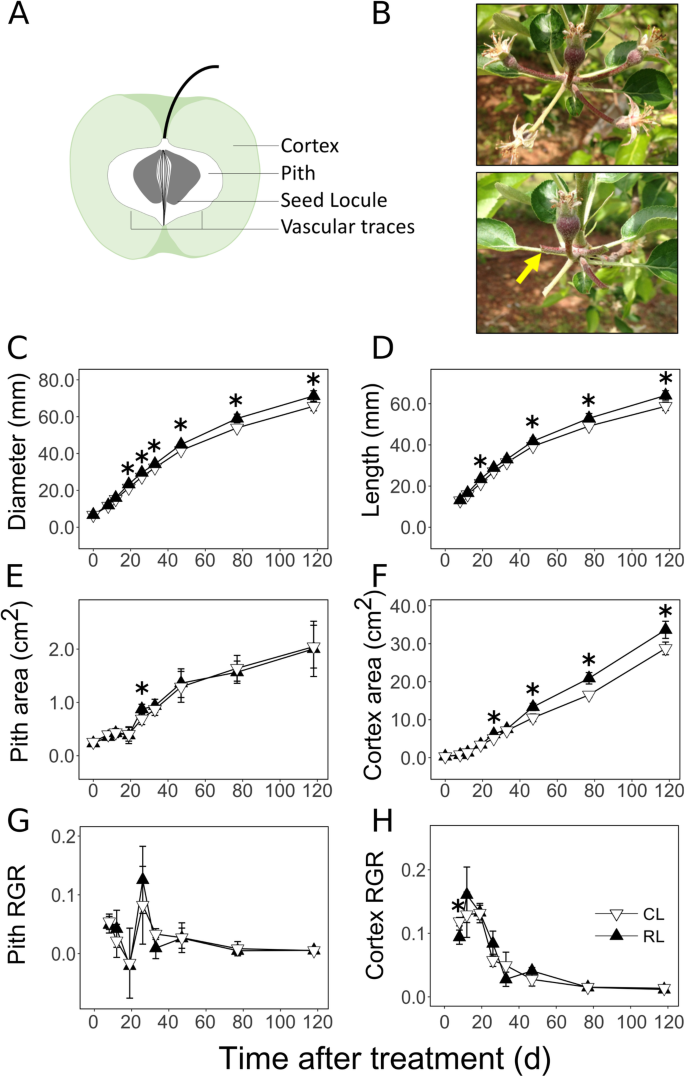
苹果果实生长的时空格局。苹果果实纵切面的图解,显示皮层、髓、种子室和维管痕迹(GydF4y2Ba一种GydF4y2Ba).苹果果簇在人工摘除果梗之前(上)和之后(下),按照“减少果量”处理(GydF4y2BaB.GydF4y2Ba).箭头表示水果切除点。果实负荷量在开花后11 d降低。水果直径(GydF4y2BaCGydF4y2Ba), 长度 (GydF4y2BaD.GydF4y2Ba)及髓质纵截面积(GydF4y2BaE.GydF4y2Ba)和皮质(GydF4y2BaFGydF4y2Ba)的表现与果实减量处理后的时间有关。结果显示了果实发育过程中髓和皮层组织的相对生长率(RGR)以及对果实负荷量减少的响应(GydF4y2BaGGydF4y2Ba-GydF4y2BaHGydF4y2Ba).均值±道。(GydF4y2BaNGydF4y2Ba = 4) are displayed here. Asterisk indicates significant difference between the control (CL) and reduced fruit load (RL) treatments at α = 0.05
果实新陈代谢支持果实生长。许多肉质果实显示有限的光合容量,主要是异养的[GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba].因此,果实代谢依赖于碳(C),氮(N)和其他资源的进口。碳导入通常是许多植物中的蔗糖(Suc)[GydF4y2Ba16GydF4y2Ba,但主要是苹果和其他几种蔷薇科水果中的山梨糖醇[GydF4y2Ba17GydF4y2Ba].通过调动储存的储量和新的采收来满足水果氮需求[GydF4y2Ba18GydF4y2Ba].果实生长所需的结构和非结构组分通过果实代谢来源于这些进口资源。作为两个水槽组织,皮质和髓,接收来自相同来源的输入,差异代谢活动可能支持优惠的皮质生长。此前尚未研究这种空间不同的代谢的特征。GydF4y2Ba
在多个果实中识别了时间上动态的代谢程序[GydF4y2Ba19GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba那GydF4y2Ba21GydF4y2Ba那GydF4y2Ba22GydF4y2Ba].这些研究突出了特定阶段的代谢特征,并且代谢与发育过渡重合的关键转变。然而,在早期发展内的颞代代谢计划高分辨率,缺乏往往涉及密集细胞生产的时期。例如,在番茄和桃子如果实中(GydF4y2Ba碧桃GydF4y2Ba),对促进水果发育的代谢程序进行了研究[GydF4y2Ba16GydF4y2Ba那GydF4y2Ba21GydF4y2Ba那GydF4y2Ba23GydF4y2Ba那GydF4y2Ba24GydF4y2Ba,细胞产生介导的早期生长的周期并没有被集中评估。类似地,苹果的果实代谢产物含量只在早期发育的1-2个阶段进行了分析[GydF4y2Ba25GydF4y2Ba那GydF4y2Ba26GydF4y2Ba].水果在发育早期的代谢过程需要有特异性,这是由于其介导生长的特征过程——快速的细胞生产,这需要大量的细胞壁材料、细胞膜和细胞内容物的合成以及相关的能量消耗。由于在发育早期的细胞生产建立了一个细胞群,这些细胞群随后可以通过液泡作用相对便宜地膨胀,在这一时期建立的生长差异可能会在果实发育的其余部分被放大。例如,在发育早期减少果实负荷通过增加细胞产量来促进果实生长,这种生长优势在发育的其余阶段继续存在[GydF4y2Ba27GydF4y2Ba那GydF4y2Ba28GydF4y2Ba].同样,如果皮质代谢程序在早期发展期间有利于佩斯的优先增长,那么这可能在其余的水果发育过程中被扩增。GydF4y2Ba
在这里,我们假设皮层和髓生长的空间差异是通过不同的sink代谢活动在早期发育中建立的。为了解决这一问题,我们在果实发育的多个阶段对皮层和髓组织进行了分析,特别是在发育早期的高分辨率分析。此外,通过去除水槽改变了果实负荷,并评估了这些组织的不同生长和代谢反应。通过测定主要糖、糖醇、有机酸、氨基酸和淀粉的浓度来表征其主要代谢特征。此外,测定了与上述代谢物代谢相关的多个基因的转录丰度。GydF4y2Ba
结果GydF4y2Ba
水果皮层的优惠增长GydF4y2Ba
通过11 dafb进行的果实负荷减少处理提高了果实生长[(图。GydF4y2Ba1GydF4y2BaB-D;处理后11 dafb = 0 d(DAT)]。果实减少的果实(RL)处理均显示较大直径(9.4%;GydF4y2BaP.GydF4y2Ba < 0.01) by 19 DAT, which continued until 118 DAT. Similarly, fruit length was higher in RL fruit at 19 DAT (9.7%;P.GydF4y2Ba < 0.01) and then from 47 to 118 DAT. Pith and cortex tissues displayed differential growth during fruit development (Figs.1GydF4y2Ba情况)。在0 DAT时,RL果实的皮质区大于髓区,但在0 DAT时,RL果实皮质区大于髓区。GydF4y2BaP.GydF4y2Ba= 0.01)。从8 DAT开始,两种处理的皮质区均高于髓区。RL果实在0 ~ 26 d时,髓面积增加了3.8倍,在26 ~ 118 d时,髓面积增加了2.3倍。在相应时期,皮层面积分别增加了19.4倍和5.4倍。GydF4y2Ba1GydF4y2Bae和f)。在水果发育过程中,髓中的相对生长速率(RGR)通常低(图。GydF4y2Ba1GydF4y2BaG)。在早期发展期间,Cortex RGR很高,从26日下降(图。GydF4y2Ba1GydF4y2BaH)。皮质RGR在早期开发期间高达6倍的高达6倍。响应果实载荷减少,早期阶段优先增强皮质生长。RL水果中的皮质区域高于CL果实26日(23%;GydF4y2BaP.GydF4y2Ba= 0.01),然后从47到118 DAT (GydF4y2BaP.GydF4y2Ba< 0.05)。8 DAT时,CL果实皮层RGR增加了1.25倍(GydF4y2BaP.GydF4y2Ba= 0.01)。果实负荷量的减少对髓区面积的影响不显著,但在26 DAT时(26%;GydF4y2BaP.GydF4y2Ba= 0.04)。GydF4y2Ba
在早期发育过程中,皮质和髓间的代谢差异最为明显GydF4y2Ba
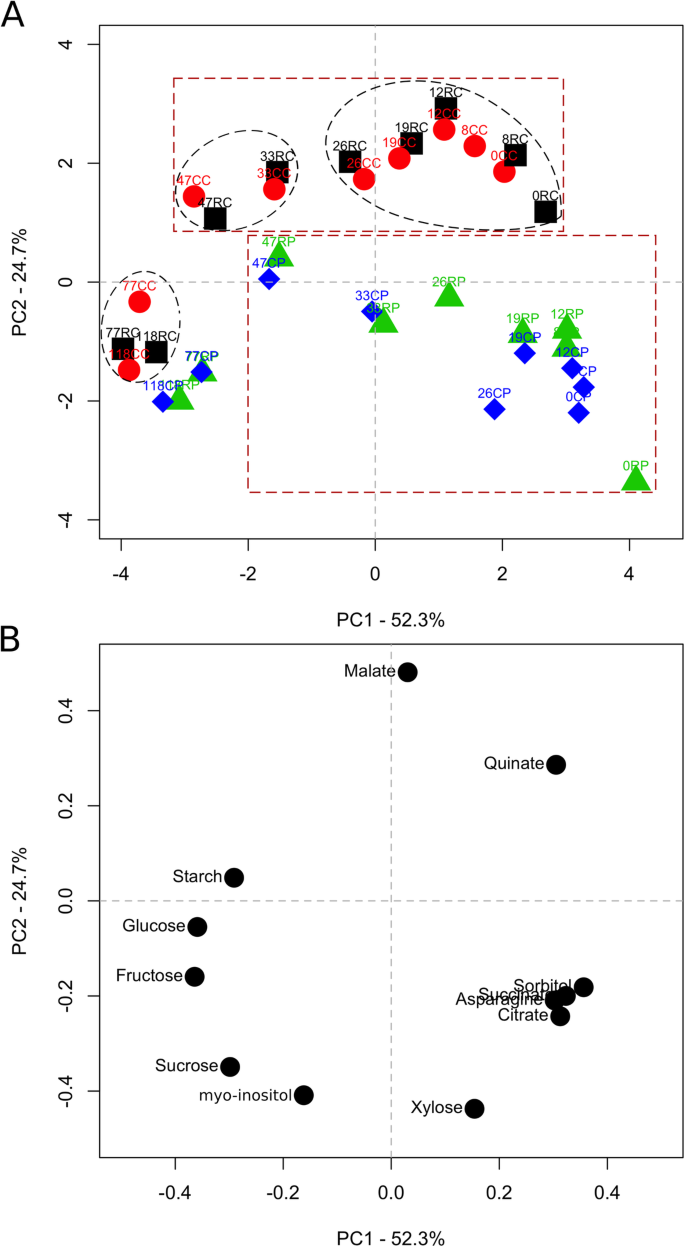
代谢产物浓度数据采用主成分分析(PCA)进行分析。这些数据中约77%的方差由两个主成分解释,PC1(52.3%)和PC2 (24.7%);无花果。GydF4y2Ba2GydF4y2Ba一种)。大多数变异与代谢物浓度中的时间模式相关,因为果实发育的九个阶段沿PC1显然分离。在皮质中,水果发育的早期阶段(0-26 DAT)明显与PC1中的中期(33和47个DAT)和晚期(77和118个DAT)阶段分开。在髓中也是类似的模式。因此,基于PCA,定义了三个阶段的水果开发:早期水果开发(EFD; 0-26 DAT);中水果开发(MFD; 26-47 DAT);和晚水果开发(LFD; 47-118 DAT)。分析加载图(图。GydF4y2Ba2GydF4y2Bab)表明,果糖(Fru)、葡萄糖(Glc)和Sor对PC1的变异贡献最大,因此影响了代谢物浓度的时间变化模式。皮质和髓组织沿PC2明显分离。这些数据沿PC2的空间分离在EFD期间最为明显,在后期逐渐减弱。负荷图分析显示,苹果酸对PC2的影响最大,对代谢物数据空间分离的影响最大。GydF4y2Ba
主要成分分析(PCA)揭示了苹果果实代谢的空间和时间特征。果实开发期间的果实代谢物浓度数据,跨越不同的组织类型和响应果实负荷减少进行PCA。第一和第二主成分解释了77%的数据变化,并在此显示(GydF4y2Ba一种GydF4y2Ba).具有虚线边缘的椭圆形显示基于皮质水果代谢的时间变化分离三个集群。带有虚线边缘的方形盒显示基于水果代谢的空间变化分离两个簇。果实负荷减少处理在盛开后11天进行。符号上方的数字表示治疗后的天数。数字旁边的字母表示治疗和水果组织类型。CC:控制水果载荷 - 皮质(圆圈);CP:控制水果载荷 - 绒毛(钻石);RC:减少水果载荷 - 皮质(方形);RP:减少水果载荷 - 髓(三角形)。 The loadings plot for principal components 1 and 2 (PC1 and PC2) are displayed (B.GydF4y2Ba).代谢物的名称在相应的符号旁边呈现GydF4y2Ba
导入的C在EFD期间在皮质和Pith中差异分解代谢GydF4y2Ba
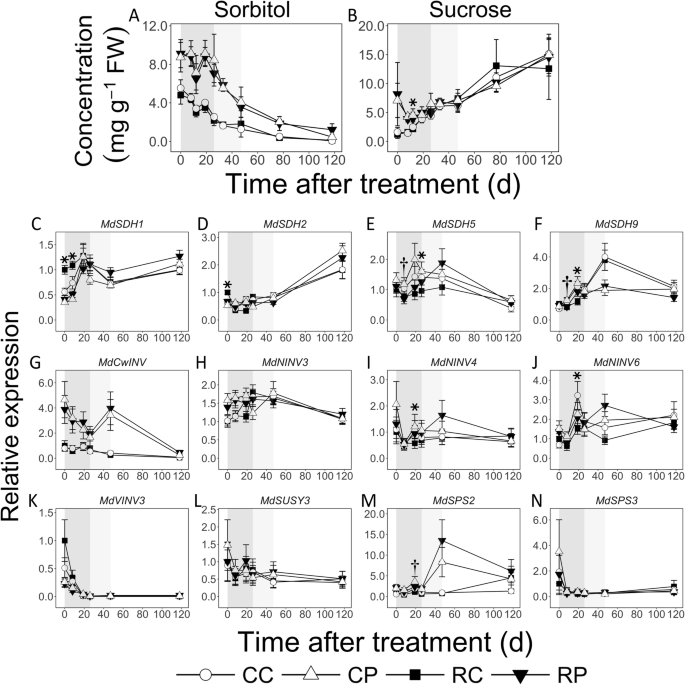
在EFD期间,Sor浓度在皮质中下降了2.2倍,但在髓中没有变化(图2)。GydF4y2Ba3.GydF4y2Ba一种)。它在佩斯中大多高于皮质高达3.3倍(例如,DAT;GydF4y2BaP.GydF4y2Ba< 0.05)。在MFD期间,它在髓和CL果实皮层中减少了2倍。在大脑皮层,在LFD期间,它进一步下降了25倍。在EFD期间,蔗糖浓度没有显著变化(图。GydF4y2Ba3.GydF4y2Bab).然而,髓内的细胞凋亡率高于皮层:在8 DAT时高达3倍(GydF4y2BaP.GydF4y2Ba<0.05),和19 dat的1.2倍(Cl水果;GydF4y2BaP.GydF4y2Ba= 0.01)。此外,12dat时,皮层中的Suc浓度随着果实负荷的减少而降低了13% (GydF4y2BaP.GydF4y2Ba= 0.04)。在MFD期间,两种组织中的SUC浓度相似,并且保持不变。在LFD期间,它在髓中增加> 2倍,Cl果皮。GydF4y2Ba
山梨糖醇的浓度(GydF4y2Ba一种GydF4y2Ba)和蔗糖(GydF4y2BaB.GydF4y2Ba)和代谢相关基因的转录丰度(GydF4y2BaCGydF4y2Ba-GydF4y2BaNGydF4y2Ba)在苹果果皮层和髓组织响应果实负荷减少。方法 (GydF4y2BaNGydF4y2Ba = 4) and S.D. of the mean (for metabolite concentrations) or S.E of the mean (for transcript abundance) are displayed. Transcript abundance was measured using quantitative RT-PCR. CC: Control fruit load-Cortex; CP: Control fruit load-Pith; RC: Reduced fruit load-Cortex; RP: Reduced fruit load-Pith.SDH.GydF4y2Ba:GydF4y2Ba山梨糖醇脱氢酶GydF4y2Ba;GydF4y2BaCwINVGydF4y2Ba:GydF4y2Ba细胞壁转化酶GydF4y2Ba;GydF4y2Ba九GydF4y2Ba:GydF4y2Ba中性转化酶GydF4y2Ba;GydF4y2BaVINVGydF4y2Ba:GydF4y2Ba真空转化酶GydF4y2Ba;GydF4y2Ba苏珊GydF4y2Ba:GydF4y2Ba蔗糖合酶GydF4y2Ba;GydF4y2BaSPS.GydF4y2Ba:GydF4y2Ba蔗糖磷酸合酶。GydF4y2Ba转录本丰度数据归一化至至少两个内参基因:GydF4y2Ba施GydF4y2Ba和GydF4y2BaGAPDH.GydF4y2Ba(GydF4y2Ba甘油醛3磷酸脱氢酶GydF4y2Ba).相对表达数据参考在RC处理后在0d中的平均表达式呈现。星号和匕首符号分别表示皮质和髓中的控制和降低的水果载物处理之间的显着差异(α= 0.05)。盛开后11天进行治疗。阴影盒在后台标记早期(深灰色),中间(浅灰色)和晚期(白色)水果开发GydF4y2Ba
我们测定了4个编码山梨糖醇脱氢酶(SDH)的基因的转录丰度,这些基因参与了Sor分解代谢到Fru的过程。GydF4y2Ba3.GydF4y2BaC-F)。GydF4y2BaMDSDH1.GydF4y2Ba和GydF4y2BaMDSDH9.GydF4y2Ba在EFD期间,转录本丰度增加了2倍(RL果实皮层除外)。GydF4y2BaMDSDH1.GydF4y2Ba在EFD的早期部分在EFD的早期部分至少2倍(0和8 DAT的RL果实中,转录物丰度较高;GydF4y2BaP.GydF4y2Ba< 0.05)。GydF4y2BaMDSDH2.GydF4y2Ba和GydF4y2BaMDSDH5GydF4y2Ba转录水平在EFD和MFD期间没有显著改变。在最晚完成日期,GydF4y2BaMDSDH2.GydF4y2Ba转录物丰度分别增加了皮质和髓中的2-和3倍。GydF4y2BaMDSDH5GydF4y2Ba在8个DAT中,Pith的转录物丰度为1.7倍,而那个GydF4y2BaMDSDH9.GydF4y2Ba响应水果载荷减少,在19日时,皮质较低1.8倍(GydF4y2BaP.GydF4y2Ba = 0.02 and 0.01, respectively).
测定了编码Suc代谢相关酶的基因的转录丰度(图。GydF4y2Ba3.GydF4y2Bag-n)。成绩单丰富GydF4y2BaMdCwINVGydF4y2Ba[编码一种将Suc分解为Fru和Glc的外质转化酶]在髓部EFD时>下降了2倍,但在皮层中没有变化。GydF4y2BaMdCwINVGydF4y2Ba髓中的转录物丰度始终高于皮质高达5倍(例如,在RL果实中的8个DAT;GydF4y2BaP.GydF4y2Ba= 0.01)。在MFD期间,佩蒂尔比皮质高达16倍(RL水果; 47 DAT;GydF4y2BaP.GydF4y2Ba= 0.01)。三GydF4y2Ba九GydF4y2Ba编码中性转化酶的基因,转录性丰度GydF4y2Bamdninv3.GydF4y2Ba在佩斯的佩斯中较高,在EFD的初始阶段期间比皮质在皮质中升高1.5倍(CL果实0 dat;GydF4y2BaP.GydF4y2Ba= 0.01)。成绩单丰富GydF4y2Bamdninv4.GydF4y2Ba和GydF4y2Bamdninv6.GydF4y2Ba响应于19 dat在皮质中减少果实载荷减少的基因减少了2倍(GydF4y2BaP.GydF4y2Ba< 0.05)。真空转化酶基因,GydF4y2Bamdvinv3.GydF4y2Ba,在EFD期间显示更高的转录性丰度,此后仍然低低。对蔗糖合成酶进行基因的转录累积(GydF4y2BaMDSUSY3GydF4y2Ba),参与FRU和UDP-GLC的Suc分解代谢,在本研究中没有改变。在分析蔗糖磷酸合酶(SPS)的两个基因中,分析,GydF4y2BaMDSPS2.GydF4y2Ba在佩斯中显示较高的高度,而不是在efd的多个阶段的皮质组织中达到3倍(例如,Cl果实0 dat; rl果实26 dat;GydF4y2BaP.GydF4y2Ba < 0.05), and by up to 18-fold during MFD (Eg. RL fruit, 47 DAT,P.GydF4y2Ba= 0.001)。果实负荷量的减少使其在髓内的转录本积累量减少了1.5倍(GydF4y2BaP.GydF4y2Ba= 0.02)。GydF4y2Ba
Cortex在EFD期间显示进口N的增强分解代谢GydF4y2Ba
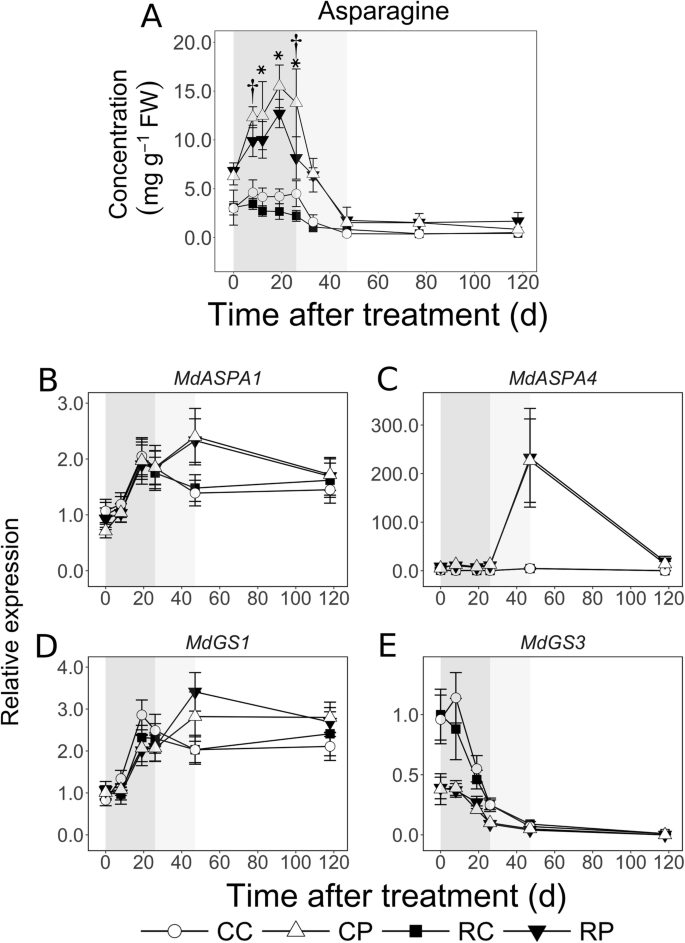
天冬酰胺(Asn)在皮质的浓度在EFD没有改变(图。GydF4y2Ba4.GydF4y2Ba一种)。在MFD期间拒绝,在LFD期间未被干预。在髓中,在EFD期间增加到2倍,达到峰值水平,达到19个DAT,在MFD期间急剧下降至9倍,并且在LFD期间保持不变。荔枝中的天冬酰胺浓度高达5倍,而不是皮质通过EFD。在MFD和LFD期间,在CL果实中佩斯高达4倍,但不在RL水果中较高。在EFD期间,响应于果实负荷减少的EFD减少:在8和26日的PITH(分别为20和41%;GydF4y2BaP.GydF4y2Ba< 0.05),在12、19和26 DAT时皮质区(分别为35、37和51%;GydF4y2BaP.GydF4y2Ba< 0.05)。GydF4y2Ba
苹果果实组织中天冬酰胺(Asn)浓度和Asn代谢相关基因转录丰度的时空模式对果实负荷减少的响应。果实负荷量在开花后11 d降低。气相色谱法测定天冬酰胺浓度,RT-PCR法测定转录本丰度。平均值及标准差(GydF4y2BaNGydF4y2Ba= 4)显示代谢物数据。转录丰度数据显示平均值和平均值的S.E. (GydF4y2BaNGydF4y2Ba= 4)。CC:控制水果负荷-皮层;CP:控制果实重量;RC:减少水果负荷皮层;RP:减少水果的重量。GydF4y2BaASPAGydF4y2Ba:GydF4y2Ba天冬酰胺酶GydF4y2Ba;GydF4y2BaGSGydF4y2Ba:GydF4y2Ba谷氨酰胺合成酶GydF4y2Ba.在RC中,所有转录本丰度数据均与治疗后0 d的平均表达有关。苹果GydF4y2Ba施GydF4y2Ba和GydF4y2BaGAPDH.GydF4y2Ba(GydF4y2Ba甘油醛3磷酸脱氢酶GydF4y2Ba)基因用于转录本丰度数据的标准化。星号和匕首号标记表明,对照和减果处理在皮层和髓中分别有显著差异(α = 0.05)。阴影区域表示早期(深灰色)、中期(浅灰色)和晚期(白色)GydF4y2Ba
成绩单丰富GydF4y2Bamdaspa1.GydF4y2Ba,编码参与Asn转化物与天冬氨酸和铵的天冬酰胺酶的基因编码,在两种组织中高达2倍的EFD期间增加(图。GydF4y2Ba4.GydF4y2Bab)。在47日,GydF4y2Bamdaspa1.GydF4y2BaPith中的转录性丰度> 1.5倍高于皮质(GydF4y2BaP.GydF4y2Ba= 0.02)。GydF4y2Bamdaspa4.GydF4y2Ba在两种组织中EFD期间转录物丰度低,但在佩蒂中比在皮质中高达44倍(CL水果,8个DAT;GydF4y2BaP.GydF4y2Ba < 0.01; Fig.4.GydF4y2BaC)。在MFD伴随的MFD伴随于ASN浓度的急剧下降时,其丰度在髓中急剧增加至多22倍。在47日,GydF4y2Bamdaspa4.GydF4y2Ba髓内转录产物丰度比皮层高51倍(RL果实;GydF4y2BaP.GydF4y2Ba= 0.01)。GydF4y2Bamdgs1.GydF4y2Ba(涉及同化铵的谷氨酰胺合成酶的编码)转录性丰度模式类似于GydF4y2Bamdaspa1.GydF4y2Ba,在EFD期间增加> 2倍(达到19个DAT),并且在两种组织中的其余果实发育过程中保持不变(图。GydF4y2Ba4.GydF4y2Bad)。GydF4y2BaMDGS3.GydF4y2Ba在EFD期间显示出更高的成绩丰富,并在其余的水果发育中减少。在大多数EFD期间,它在皮质中的丰度比在Pith中高出2.5倍(图。GydF4y2Ba4.GydF4y2Bae;GydF4y2BaP.GydF4y2Ba< 0.05)。GydF4y2Ba
Cortex和Pith在EFD期间显示差分初级C代谢GydF4y2Ba
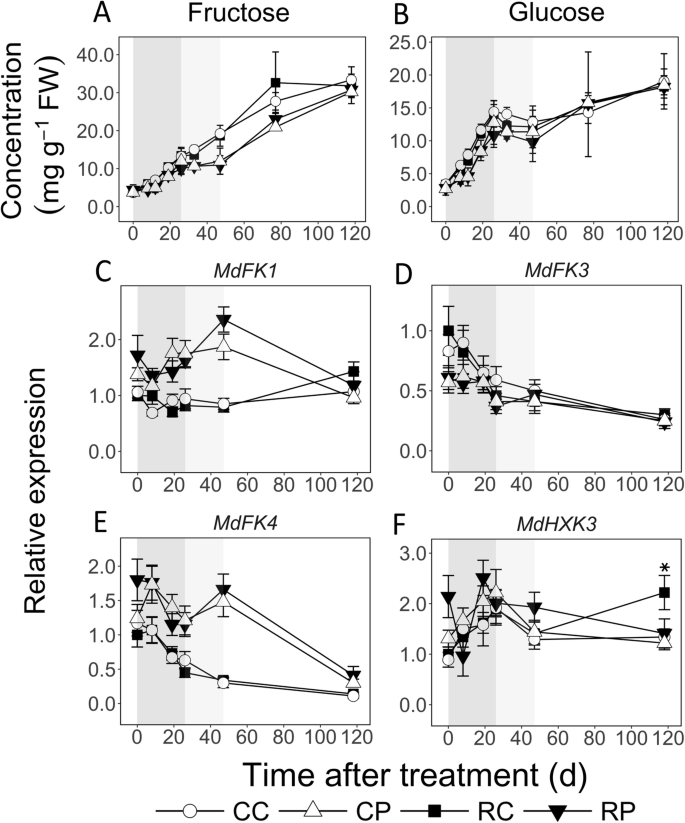
在EFD期间,两种组织中的果糖浓度增加到3.6倍(图。GydF4y2Ba5.GydF4y2Baa).在8、12和19 DAT时,RL和CL果实的皮层均高于髓部,在19 DAT时高达1.4倍(GydF4y2BaP.GydF4y2Ba< 0.05)。在MFD(CL水果)期间皮质持续增加,但在佩斯中保持不变。皮质中比佩斯在皮质上高出1.7倍。在两个组织中的LFD期间它会增加。类似地,在EFD期间GLC浓度增加超过4倍,皮层比PITH(8,12和19 DAT)更高,高达1.7倍(GydF4y2BaP.GydF4y2Ba < 0.05; Fig.5.GydF4y2Bab)。在MFD期间,它在任何一种组织中都没有改变,然后在LFD期间增加到1.8倍(除了RL水果之外)。特征丰富的三个GydF4y2BaFK.GydF4y2Ba分析基因,分析了将FRU磷酸化催化至果糖-6-磷酸酯(F6P)的果蛋白酶,编码(图。GydF4y2Ba5.GydF4y2BaC-E)。在皮质,GydF4y2BaMDFK3.GydF4y2Ba和GydF4y2BaMDFK4.GydF4y2Ba在EFD期间,转录物丰度高于后续阶段。成绩单丰富GydF4y2Bamdfk1.GydF4y2Ba和GydF4y2BaMDFK4.GydF4y2Ba在佩斯中比在大多数EFD和MFD高达3倍的情况下比皮质更大。GydF4y2BaMDFK3.GydF4y2Ba在0(R1)和8个DAT(CL)的皮层中,转录物丰度在皮层中高(高达1.5倍)。成绩单丰富GydF4y2BaMdHXK3,GydF4y2Ba将Glc磷酸化为Glc-6-磷酸(G6P)的己糖激酶的编码基因GydF4y2Ba那GydF4y2Ba在皮质中的EFD期间增加到2倍,此后未改变(图。GydF4y2Ba5.GydF4y2BaF)。这些基因的转录物丰度大多不受果实载荷减少的影响。GydF4y2Ba
果糖浓度(GydF4y2Ba一种GydF4y2Ba)和葡萄糖(GydF4y2BaB.GydF4y2Ba)和对其新陈代谢相关基因的转录性丰富(GydF4y2BaCGydF4y2Ba-GydF4y2BaFGydF4y2Ba)在苹果果组织中,响应果实负荷减少。盛开后11天进行治疗。使用定量RT-PCR分析测量转录物丰度。意思和s.d.提出了代谢物浓度数据(GydF4y2BaNGydF4y2Ba= 4)。平均值和s.e的平均值(GydF4y2BaNGydF4y2Ba = 4) of transcript abundance are displayed. CC: Control fruit load-Cortex; CP: Control fruit load-Pith; RC: Reduced fruit load-Cortex; RP: Reduced fruit load-Pith.FK.GydF4y2Ba:GydF4y2BaFructokinase.GydF4y2Ba;GydF4y2BaHXKGydF4y2Ba:GydF4y2Ba六酮酶GydF4y2Ba.在RC中,转录本丰度与处理后0 d的平均表达量有关。这些数据被归一化为GydF4y2Ba施GydF4y2Ba和GydF4y2BaGAPDH.GydF4y2Ba(GydF4y2Ba甘油醛3磷酸脱氢酶GydF4y2Ba).星号和匕首号标记表明,对照和减果处理在皮层和髓中分别有显著差异(α = 0.05)。背景阴影区域表示早期(深灰色)、中期(浅灰色)和晚期(白色)果实发育期GydF4y2Ba
迈诺GydF4y2Ba在EFD期间,皮层-肌醇(Ino)浓度增加了3倍,但髓内没有变化(图3)。GydF4y2Ba6.GydF4y2Ba一种)。在佩斯中比在大多数efd efd达3倍,特别是在rl水果中(GydF4y2BaP.GydF4y2Ba< 0.05)。在MFD期间,在CL水果中没有显着改变,但仍然保持较高(2倍;GydF4y2BaP.GydF4y2Ba< 0.05)。在LFD期间,它在CL果皮中增加了2倍,但在髓中和RL果皮中没有显着显着。果实载荷减少导致皮质中的43%在8个DAT中降低INO浓度(GydF4y2BaP.GydF4y2Ba= 0.01)。在大多数果实发育过程中没有改变木糖(XEL)浓度(图。GydF4y2Ba6.GydF4y2Bab)。在EFD的部分期间,佩斯的浓度较高:在Cl果实中的8个DAT,在RL水果中的12个DAT,并在两者中进行了19个(GydF4y2BaP.GydF4y2Ba< 0.05)。在47个DAT(1.2折;GydF4y2BaP.GydF4y2Ba= 0.01)。GydF4y2Ba
枸橼酸浓度在EFD期间呈下降趋势,髓部的枸橼酸浓度为皮质部的2倍。GydF4y2BaP.GydF4y2Ba = 0.01), 12 DAT in RL fruit (P.GydF4y2Ba = 0.03) and 19 DAT in both (P.GydF4y2Ba < 0.05; Fig.6.GydF4y2BaC)。在其余的水果开发期间没有改变。在皮质中,由于8 dat和77 DAT,柠檬酸盐浓度增加约34%和50%(GydF4y2BaP.GydF4y2Ba< 0.05)。在EFD期间通常没有改变琥珀酸浓度,在MFD期间在皮质(CL果实)中下降,并且在LFD期间没有改变(图。GydF4y2Ba6.GydF4y2Bad)。在EFD期间,其在PITH中的浓度倾向于高于皮质,特别是在RL果实中高达3.3倍(例如,12个DAT;GydF4y2BaP.GydF4y2Ba= 0.02)。果实载荷减少导致皮质中的51%更高的琥珀酸盐浓度在77 DAT(GydF4y2BaP.GydF4y2Ba= 0.01)。GydF4y2Ba
Cortex和Pith在EFD期间显示差分C存储GydF4y2Ba
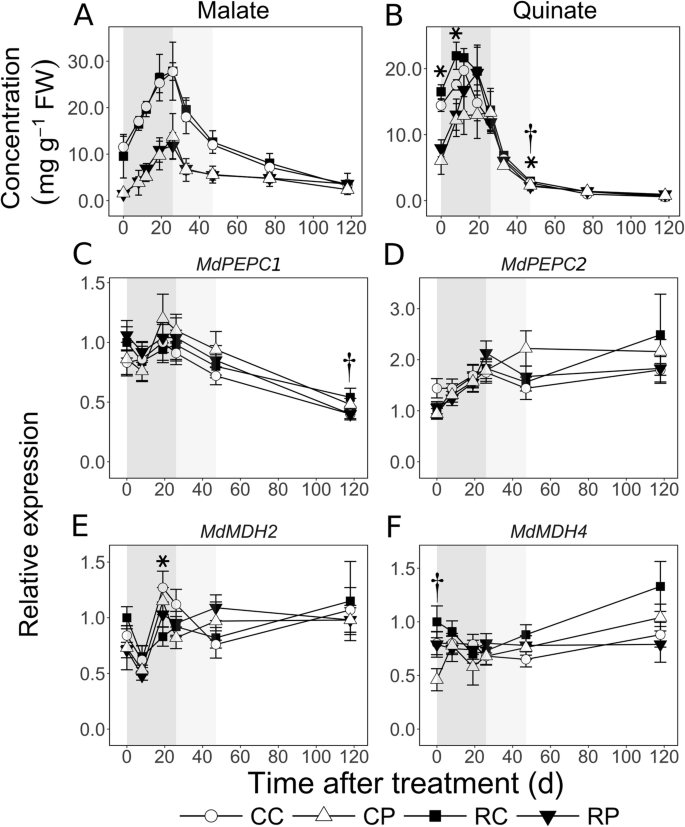
苹果酸和quininate是EFD中主要的贮藏形式。在EFD过程中,皮层苹果酸浓度稳定增加近3倍,髓内苹果酸浓度稳定增加8倍以上(图4)。GydF4y2Ba7.GydF4y2Baa).然而,在0 DAT时,皮质区则高出7倍(GydF4y2BaP.GydF4y2Ba< 0.05),其余时间持续升高> 2倍。在MFD期间,>在两个组织中逐渐下降50%,但在皮质仍保持>高2倍。在LFD期间,它在皮质中继续下降,在118 DAT时在两个组织中达到相似的水平。成绩单丰富GydF4y2BaMdPEPC1,GydF4y2Ba磷基因被认为编码磷的基因GydF4y2Baenol.GydF4y2Ba丙酮酸(PEP)羧化酶参与由PEP和HCO合成草酰乙酸(OAA)GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba,但在EFD期间变化不大,随后下降约50%(图1)。GydF4y2Ba7.GydF4y2BaC)。GydF4y2BaMdPEPC2GydF4y2Ba转录本丰度在EFD期间增加了2倍(除了在CL果实皮层),之后没有显著变化(图2)。GydF4y2Ba7.GydF4y2Bad).成绩单丰富GydF4y2BaMdMDH2GydF4y2Ba苹果酸脱氢酶是一种编码苹果酸脱氢酶的基因,可将OAA转化为苹果酸。GydF4y2Ba7.GydF4y2Bae)。果实负荷减少在19 dat的皮层中瞬时降低1.5倍(GydF4y2BaP.GydF4y2Ba= 0.02)。成绩单丰富GydF4y2BaMdMDH4GydF4y2Ba在EFD和MFD中没有改变,但在LFD中略有增加(图4)。GydF4y2Ba7.GydF4y2Baf).在0 DAT时,CL果实的髓部含量增加了1.7倍(GydF4y2BaP.GydF4y2Ba= 0.04)。成绩单丰富GydF4y2Ba铝活性苹果酸盐转运蛋白GydF4y2Ba(GydF4y2Bamdalmt9.GydF4y2Ba),参与水果苹果醛累积[GydF4y2Ba29GydF4y2Ba]除了在CL果皮中的EFD期间增加外,在水果开发期间没有显着改变(附加文件GydF4y2Ba1GydF4y2Ba).0 DAT时,CL果实的髓部比皮层部高4.3倍(GydF4y2BaP.GydF4y2Ba = 0.007). Fruit load reduction transiently reduced its expression by 1.7-fold only in the cortex at 26 DAT (P.GydF4y2Ba= 0.03)。GydF4y2Ba
主要有机酸、苹果酸(GydF4y2Ba一种GydF4y2Ba)和Quint(GydF4y2BaB.GydF4y2Ba)和转录物丰富的苹果酸代谢相关基因(GydF4y2BaCGydF4y2Ba-GydF4y2BaFGydF4y2Ba)在苹果果实中响应果实负荷减少。使用气相色谱法测定代谢物浓度,并且使用定量RT-PCR测量转录物丰度。CC:控制水果负荷-皮层;CP:控制果实重量;RC:减少水果负荷皮层;RP:减少水果的重量。果实负荷量在开花后11 d降低。平均值及标准差(GydF4y2BaNGydF4y2Ba = 4) are presented for metabolite data. The mean and S.E. of the mean (NGydF4y2Ba= 4)显示的副本丰度。星号和匕首号标记表明,对照和减果处理在皮层和髓中分别有显著差异(α = 0.05)。GydF4y2BaPepc.GydF4y2Ba:GydF4y2Ba磷丙酮酸羧化酶GydF4y2Ba;GydF4y2BaMDH.GydF4y2Ba:GydF4y2Ba苹果酸脱氢酶GydF4y2Ba.所有的表达数据都是参照RC处理后0 d的平均表达。目的基因的转录本丰度归一化到苹果GydF4y2Ba施GydF4y2Ba和GydF4y2BaGAPDH.GydF4y2Ba(GydF4y2Ba甘油醛3磷酸脱氢酶GydF4y2Ba)基因。背景中的阴影区域表现出早期(深灰色),中间(浅灰色)和晚水果开发(白色)时期GydF4y2Ba
在0到12个DAT之间的皮质(R1水果)中Quinate浓度增加了1.4倍,然后下降(图。GydF4y2Ba7.GydF4y2Bab).髓部在0 ~ 19 DAT之间增加了2.4倍以上。在0 ~ 12 DAT之间,皮质区比髓区高达2倍(GydF4y2BaP.GydF4y2Ba< 0.05),但19 DAT相似。它的浓度在MFD期间迅速下降,并在之后保持低水平。在CL果实中,其浓度略为(1.2倍;GydF4y2BaP.GydF4y2Ba = 0.01) lower in the pith than in the cortex at 33 DAT and then higher at 77 and 118 DAT (> 1.3-fold;P.GydF4y2Ba< 0.05)。果实负载量降低导致0和8 DAT时皮质中quininate浓度升高约14%和25% (GydF4y2BaP.GydF4y2Ba分别为< 0.01)。在33 DAT时,它还导致皮质和髓中的浓度分别增加了10和14% (GydF4y2BaP.GydF4y2Ba< 0.05)。GydF4y2Ba
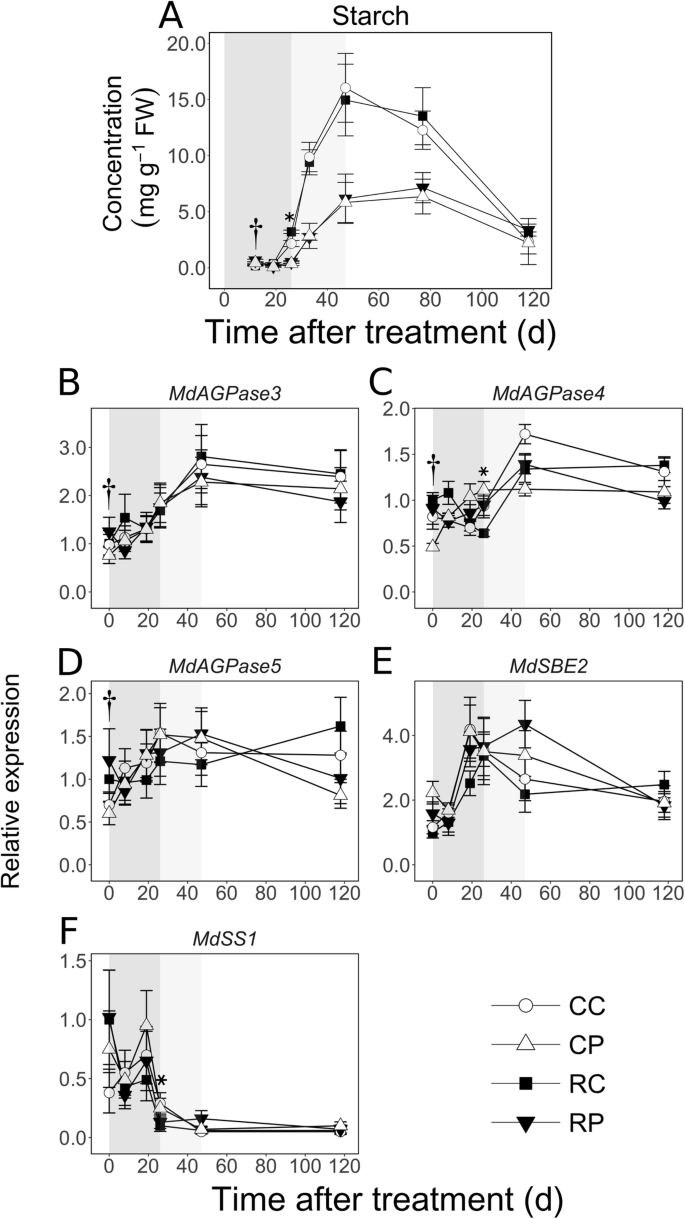
由于有限的组织可用性,淀粉浓度不能在0和8日定量。它的浓度低(<0.7mg gGydF4y2Ba- 1GydF4y2Ba),在12和19 DAT(图。GydF4y2Ba8.GydF4y2Baa),但在12 DAT时,髓部高出3.5倍(GydF4y2BaP.GydF4y2Ba< 0.05)。果实负荷降低导致佩斯中的淀粉浓度较高1.4倍,12 dat(GydF4y2BaP.GydF4y2Ba = 0.02), and in the cortex by 1.5-fold at 26 DAT (P.GydF4y2Ba< 0.001)。淀粉浓度在MFD期间显著增加:皮质增加了4- 7倍,髓中增加了16倍。然而,在这一时期,髓内的脂肪含量仍然比皮层低2- 3倍。在LFD期间,两种组织中均有下降,主要是在77到118 DAT之间。GydF4y2Ba
苹果果组织中淀粉代谢相关基因的淀粉浓度及淀粉代谢相关基因的时空模式,响应于果实载荷减少。果实负荷量在开花后11 d降低。意思和s.d.显示淀粉浓度数据。平均值和s.e.意思(GydF4y2BaNGydF4y2Ba= 4)显示的副本丰度。CC:控制水果负荷-皮层;CP:控制果实重量;RC:减少水果负荷皮层;RP:减少水果的重量。GydF4y2BaAGPase.GydF4y2Ba:GydF4y2BaADP葡萄糖焦磷酸化酶GydF4y2Ba;GydF4y2Basbe.GydF4y2Ba:GydF4y2Ba淀粉分支酶GydF4y2Ba;GydF4y2BaSS.GydF4y2Ba:GydF4y2Ba淀粉合成酶GydF4y2Ba.星号和匕首号标记表明,对照和减果处理在皮层和髓中分别有显著差异(α = 0.05)。所有的表达数据都是参照治疗后0 d的均值。基因的转录本丰度归一化为苹果的丰度GydF4y2Ba施GydF4y2Ba和GydF4y2BaGAPDH.GydF4y2Ba(GydF4y2Ba甘油醛3磷酸脱氢酶GydF4y2Ba)基因。阴影区域表示早期(深灰色)、中期(浅灰色)和晚期(白色)GydF4y2Ba
三种adp -葡萄糖焦磷酸化酶编码基因的转录本丰度(GydF4y2Bamdagpase3.GydF4y2Ba那GydF4y2Bamdagpase4.GydF4y2Ba和GydF4y2Bamdagpase5.GydF4y2Ba)测定催化来自GLC-1-磷酸(G1P)的ADP-GLC合成的酶(图。GydF4y2Ba8.GydF4y2Ba罪犯)。GydF4y2Bamdagpase3.GydF4y2Ba转录性丰度在19和47 dat之间增加到2倍(除了RL果实髓外)。GydF4y2Bamdagpase4.GydF4y2Ba在MFD期间,皮层的转录本丰度增加了> 2倍,而CL果实皮层的转录本丰度比髓内的转录本丰度高1.5倍(GydF4y2BaP.GydF4y2Ba= 0.02)。GydF4y2Bamdagpase5.GydF4y2Ba果实发育过程中转录本丰度没有明显改变。编码淀粉分支酶的基因的转录本丰度GydF4y2BaMDSBE2.GydF4y2Ba,在EFD,在皮质和RL果粒中分别增加,分别超过3倍和2倍(图。GydF4y2Ba8.GydF4y2Bae).髓部在0 DAT时最高可达1.9倍(GydF4y2BaP.GydF4y2Ba< 0.05)。记录的积累GydF4y2BaMDSS1,GydF4y2Ba一个编码淀粉合酶的基因,在EFD期间较高,在19 - 26 DAT期间下降(除了在CL果实皮层),此后保持低水平(图2)。GydF4y2Ba8.GydF4y2Baf).水果负荷量降低65%GydF4y2BaMdSS1GydF4y2Ba在26 dat的皮层中的转录物丰度(GydF4y2BaP.GydF4y2Ba= 0.01)。GydF4y2Ba
讨论GydF4y2Ba
果实皮层在生长发育期间表现出优先生长GydF4y2Ba
在EFD期间,生长的空间差异明显确立(图。GydF4y2Ba1GydF4y2Ba).EFD时皮层的生长是髓的5倍。EFD期间大部分皮层生长与细胞快速生成有关[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba那GydF4y2Ba28GydF4y2Ba].因此,通过更大的细胞生成可能比佩斯的细胞产生更高的皮质增长。此外,果实负荷降低主要在皮质中增强生长,并且通过EFD的末端显而易见(图。GydF4y2Ba1GydF4y2Ba).果实负荷降低通过增加细胞生产来增强早期果实生长[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba那GydF4y2Ba28GydF4y2Ba].因此,由于移除沉积而将额外的资源转向果实[GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba主要分配给增强细胞产生,允许更大的皮质生长。这些数据的共同表明通过增强的细胞产生,在EFD期间建立皮质作为主要沉积组织。GydF4y2Ba
差异皮质库活性支持其在EFD期间的优先生长GydF4y2Ba
EFD期间的果实代谢明显可分离以后的阶段(图。GydF4y2Ba2GydF4y2Ba),表明细胞生产介导的生长需要特定的代谢程序。类似地,EFD从桃子的后期发展阶段代谢可分离[GydF4y2Ba21GydF4y2Ba].在EFD期间注意到在代谢物浓度之间的皮质和髓组织之间的最大分歧(图。GydF4y2Ba2GydF4y2Ba),表明在此期间通过差异水池代谢活动促进了它们的差异增长。下面讨论了EFD期间这种差分水槽代谢的关键特征。GydF4y2Ba
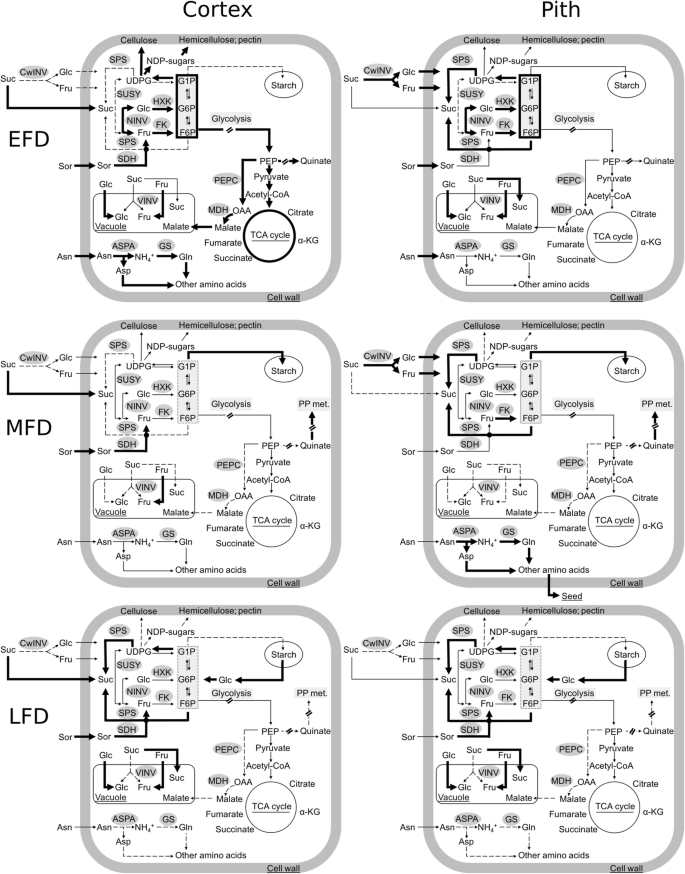
较高的皮质增长与进口C资源的更高分解代谢有关,可能提供支持密集细胞生产所需的C骨干和能量(图。GydF4y2Ba9.GydF4y2Ba).在EFD期间其浓度超过2倍,其浓度在该组织中浓度下降超过2倍,浓度高,皮质增殖与更高的SOR分解代谢有关,并且比绒毛膜低2倍(图。GydF4y2Ba3.GydF4y2Ba).山梨糖醇代谢主要由SDH介导,SDH在EFD期间表现出较高的活性,有助于果实库强度的增强[GydF4y2Ba32.GydF4y2Ba那GydF4y2Ba33.GydF4y2Ba那GydF4y2Ba34.GydF4y2Ba].成绩单丰富GydF4y2BaMDSDH1.GydF4y2Ba和GydF4y2BaMDSDH9.GydF4y2Ba在EFD期间在皮质中增加了互联网的模式,以互惠浓度下降,和GydF4y2BaMDSDH1.GydF4y2Ba皮质层的丰度高于髓层,表明它们的基因产物参与了髓层的新陈代谢。GydF4y2BaMDSDH1.GydF4y2Ba和GydF4y2BaMDSDH9.GydF4y2Ba在EFD的晚期阶段的髓中也增加了转录物丰度,其中Sor浓度基本上没有改变。潜在的,翻译后修饰调节SDH活动[GydF4y2Ba35.GydF4y2Ba在这个时期的佩斯中。在EFD的初始阶段期间皮质蔗糖浓度也较低,并且响应于果实负荷还原而瞬时下降。这些数据表明,Suc分解代谢也支持Cell-生产介导生长的高C.相比之下,EFD期间髓中较低的生长与进口C的大量分配有关。山梨糖醇浓度较高,暗示更大的储存。有证据表明,髓细胞中的成功循环活动更高。成绩单丰富GydF4y2BaMdCwINVGydF4y2Ba在EFD期间,髓部的含量增加了5倍。GydF4y2Ba3.GydF4y2Bag),表明将Suc-ermived c的更大的妊娠增塑料和差异进入髓细胞:作为GLC和FRU(图。GydF4y2Ba9.GydF4y2Ba).成绩单丰富GydF4y2Bamdfk1.GydF4y2Ba那GydF4y2BaMDFK4.GydF4y2Ba和GydF4y2BaMDSPS2.GydF4y2Ba在EFD期间与高达3倍的相当较高,并且始终如一的SUC浓度高达3倍(图。GydF4y2Ba3.GydF4y2Ba和GydF4y2Ba5.GydF4y2Ba),建议提高环己烷转化为成功。此外,在EFD(12个DAT)的一部分中,在PITH中注意到作为淀粉作为淀粉的更大的C储存。这些数据在一起表明EFD期间的PITH代谢程序促进了更大比例的进口C到储存的分配(图。GydF4y2Ba9.GydF4y2Ba).GydF4y2Ba
苹果果实的时空代谢。利用不同发育阶段果实皮层和髓组织的代谢产物和转录本丰度数据,建立了具有代表性的果实细胞代谢模型。细胞边界外的空间表示为质外体空间(包括细胞壁)。EFD:果实早期发育;MFD:果实中期发育;LFD:果实发育晚期。CwINV:细胞壁转化酶;NINV:中性转化酶;VINV:液泡转化酶;SDH:山梨糖醇脱氢酶; SUSY: sucrose synthase; SPS: sucrose phosphate synthase; FK: fructokinase; HXK: hexokinase; ASPA: asparaginase; GS: glutamine synthetase; MDH: malate dehydrogenase; PEPC: phosphoenol.GydF4y2Ba丙酮酸羧化酶。PP代谢表明苯丙代谢途径。代谢物命名:Sor:山梨醇;往下:蔗糖;Fru:果糖;相关:葡萄糖;F6P: fructose-6-phosphate;G6P: glucose-6-phosphate;G1P: glucose-1-phosphate;UDPG:尿苷diphosphate-glucose; NDP-sugars: nucleoside diphosphate-sugars; PEP: phosphoenol.GydF4y2Ba丙酮酸;OAA:草丙酸;Asn:天冬酰胺;gln:谷氨酰胺;asp;天冬氨酸;α-kg:α-酮戊二酸。大胆箭头表示较高的助焊剂;窄箭头表示媒体通量和虚线表示减少通量GydF4y2Ba
在EFD过程中,皮层和髓组织中不同的库活动也涉及不同的氮代谢。苹果中一次输入N源的浓度,Asn [GydF4y2Ba36.GydF4y2Ba那GydF4y2Ba37.GydF4y2Ba],在皮层的>是髓的3倍,并且在果实负荷减少的反应中进一步下降(图。GydF4y2Ba4.GydF4y2Ba).细胞生产介导的生长需要高N个输入[GydF4y2Ba38.GydF4y2Ba],特别是对于蛋白质合成。始终如一地,增加N供应增强了细胞产生和果实生长[GydF4y2Ba39.GydF4y2Ba].在皮层中EFD期间的N要求更高,并且响应果实负荷减少,可以通过密集的ASN分解代谢来满足。与此符合的,转录性丰富GydF4y2Bamdaspa1.GydF4y2Ba和GydF4y2Bamdgs1.GydF4y2Ba以协调的方式增加。更远,GydF4y2BaMDGS3.GydF4y2Ba>的转录本丰度在皮层中特别高2倍,表明该组织的下游N代谢也增强。这些数据表明,在EFD期间,输入氮在皮层的代谢升高,以支持早期生长的强烈需求,而输入氮在髓内积累(图2)。GydF4y2Ba9.GydF4y2Ba).GydF4y2Ba
皮层中不同的库代谢活动也涉及初级C代谢的提高,以满足EFD期间细胞生产介导的生长的结构和能量需求。苹果果实细胞中的果糖来源于Sor和Suc的分解代谢。随后可在液泡中积累或被FK磷酸化为F6P进行下游代谢。在皮层中,多行证据表明EFD过程中较高比例的Fru被分配到下游代谢。尽管在皮质中有较高的Sor分解代谢,但Fru积累在该组织中并不比髓中高成比例。在大脑皮层,转录丰富的两个GydF4y2BaFK.GydF4y2Ba在EFD的初始阶段期间基因较高,并在后续阶段下降(图。GydF4y2Ba5.GydF4y2Ba),表明EFD期间的果糖酶活性更高,与之前的报告一致[GydF4y2Ba40GydF4y2Ba那GydF4y2Ba41.GydF4y2Ba那GydF4y2Ba42.GydF4y2Ba].果糖-6-磷酸酯可以通过SPS活性促成SUC合成[GydF4y2Ba43.GydF4y2Ba].然而,由于在EFD初始阶段,皮层的Suc浓度相对低于髓内,较高比例的F6P可能通过己糖-磷酸盐池分配到替代代谢(F6P, G1P和G6P)。葡萄糖通过己糖激酶磷酸化为G6P后,也有助于己糖磷酸池[GydF4y2Ba43.GydF4y2Ba].始终如一地,成绩单丰富GydF4y2BaMdHXK3GydF4y2Ba在EFD过程中,大脑皮层中Glc向G6P的大量转化。同样,番茄果实发育的细胞分裂阶段与与己糖磷酸化相关的酶活性较高有关[GydF4y2Ba44.GydF4y2Ba].己酮磷酸盐具有多个粘性,主要是分配给呼吸。在皮质中EFD期间,柠檬酸盐和琥珀酸盐的浓度较低,在这种组织中表明糖酵解和TCA的程度较高,并且在此期间与先前报告的高呼吸速率一致[GydF4y2Ba15GydF4y2Ba那GydF4y2Ba26GydF4y2Ba].己糖磷酸也可以通过生成核苷酸糖分配到细胞壁合成中[GydF4y2Ba45.GydF4y2Ba].由于细胞生产介导的介导的成果在皮质中较高,因此可以将较高比例的己糖 - 磷酸池分配给该组织中的新细胞壁合成(图。GydF4y2Ba9.GydF4y2Ba).己糖 - 磷酸盐还可以分配给INO的合成,其有助于细胞结构部件合成,作为合成细胞壁(果胶)和膜组分的前体[GydF4y2Ba46.GydF4y2Ba].在皮质中肌醇浓度较低3倍,并且在果实负荷降低下进一步降低(图。GydF4y2Ba6.GydF4y2Ba),一致,与INO的更大分配朝向支持与增强细胞产生相关的结构组分合成。这些数据在一起表明EFD期间的原发性C代谢程度较高支持快速细胞生产介导的皮质生长的结构和能量需求(图。GydF4y2Ba9.GydF4y2Ba).GydF4y2Ba
EFD期间的高呼吸作用导致CO增加GydF4y2Ba2GydF4y2Ba释放可以重新固定(作为HCOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba),通过PEP最终生成苹果酸盐,苹果酸盐作为C储备储存在液泡中[GydF4y2Ba47.GydF4y2Ba].持续地,更高的生长(和相关的呼吸作用)[GydF4y2Ba26GydF4y2Ba])在EFD期间,在皮质中可以允许释放的C重新固定,导致该组织中较高的雄性浓度(图。GydF4y2Ba9.GydF4y2Ba).PEP以及红细胞-4-磷酸盐(E4P),还用作合成脱卤素的基材,Qualita和Shikimate的前体[GydF4y2Ba48.GydF4y2Ba].在EFD期间Quinate浓度增加,皮质较高,并响应果实负荷减少而增强(图。GydF4y2Ba7.GydF4y2Ba)通过PEP表示实质性的C分配Quinate。PEP还用作丙酮酸合成的基材,其允许C进入TCA循环。在皮质中,通过PEP更高的苹果醛和Quinate合成可以反映一种代谢程序,允许微调C分配给呼吸以满足生长的动态能量需求,因为在EFD期间,C存储在以后的阶段达到能量和C骨架需求。,并促进随后的细胞膨胀(作为渗透物)。GydF4y2Ba
差异代谢继续在MFD和LFDGydF4y2Ba
MFD期间的生长主要由临床后细胞扩张介导的[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba那GydF4y2Ba28GydF4y2Ba]并且可能通过液泡中的代谢物积累促进。在此期间显而易见的果实组织的差异代谢活动在很大程度上与C储存有关(图。GydF4y2Ba9.GydF4y2Ba).MFD的特征是在皮质中发生的淀粉浓度的快速增加而不是髓中的速率(图。GydF4y2Ba8.GydF4y2Ba).由于其较大的水槽尺寸,这可能会通过较高的C分区来支持。细胞生产,主要资源汇,在MFD和生长之前停止并在主要细胞扩张后大部分介导[GydF4y2Ba10GydF4y2Ba那GydF4y2Ba28GydF4y2Ba那GydF4y2Ba49.GydF4y2Ba].因此,可以从多重代谢途径重新分配到淀粉生物合成的多种代谢途径(图。GydF4y2Ba9.GydF4y2Ba)[GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba50.GydF4y2Ba].淀粉浓度的增加与苹果酸和奎宁酸浓度的急剧下降同时发生,这表明C在贮藏过程中被重新分配为有机酸。在两种组织中,在EFD期间观察到的Glc浓度的增加在MFD开始时停止,其组织含量在此期间的增长速度低于EFD期间(附加文件)GydF4y2Ba3.GydF4y2Ba).类似地,先前报道了淀粉累积期间GLC浓度的临时降低[GydF4y2Ba50.GydF4y2Ba].这些数据与从GLC积聚到淀粉合成的C的转移一致。在Cortex中,FRU主要分配给与以前的报告一致的存储[GydF4y2Ba51.GydF4y2Ba由于SOR浓度略微下降,而FRU浓度继续以相关的方式增加(附加文件GydF4y2Ba2GydF4y2Ba).然而,在髓内,即使Sor浓度下降2倍以上,Fru浓度也没有增加,而且质外体的Suc分解代谢较高(转录丰度)GydF4y2BaCwINVGydF4y2Ba髓部>高10倍;无花果。GydF4y2Ba3.GydF4y2Ba).此外,转录性丰富GydF4y2Bamdfk1.GydF4y2Ba和GydF4y2BaMDFK4.GydF4y2Ba髓中较高(图。GydF4y2Ba5.GydF4y2Ba),建议增强F6P合成。还,GydF4y2BaMDSPS2.GydF4y2Ba在粘合剂中的转录物丰度超过18倍(图。GydF4y2Ba3.GydF4y2Ba)提示增强的Suc再合成。但是,作为Suc浓度和内容(附加文件GydF4y2Ba3.GydF4y2Ba)没有按比例增加,很可能将新合成的Suc迅速转向佩斯中的淀粉合成,可能通过Susy和UDP-Glc焦磷酸化酶活性[GydF4y2Ba30.GydF4y2Ba].GydF4y2Ba
MFD期间,髓内进口氮分解代谢增加。天冬酰胺在髓内的浓度急剧下降的速度大于在皮质内(图。GydF4y2Ba4.GydF4y2Ba).这与陡峭的增加有关GydF4y2Bamdaspa4.GydF4y2Ba转录物丰富,相对较高的丰富GydF4y2Bamdaspa1.GydF4y2Ba和GydF4y2Bamdgs1.GydF4y2Ba成绩单,表明髓中转录调节的ASN分解酵母和随后的N代谢。潜在地,这为氨基酸提供了支持邻近种子发育的N要求(图。GydF4y2Ba9.GydF4y2Ba).GydF4y2Ba
虽然在LFD中差异的碳汇活动仍然很明显,但它们明显不如早期阶段突出。LFD与有丝分裂后细胞扩张介导的生长相关[GydF4y2Ba10GydF4y2Ba那GydF4y2Ba49.GydF4y2Ba和成熟。在LFD期间继续积累FRU,GLC和Suc允许在此期间维持持续细胞扩增介导的生长所需的真空渗透物。果糖浓度持续增加,由Sor Catabolism支持的支持可能由增加介导GydF4y2BaMDSDH2.GydF4y2Ba转录物丰富,在皮质(CL果实)中较高。在LFD期间,淀粉浓度显着降低,特别是在皮质中。这可能有助于恢复GLC和SUC浓度的增加,部分符合呼吸中异性的代谢要求[GydF4y2Ba30.GydF4y2Ba].GydF4y2Ba
结论GydF4y2Ba
两个主要的苹果果肉组织皮层和髓的差异生长主要是在EFD期间建立的,并由它们的差异库代谢活动支持。较高的进口C和N资源的分解代谢,较高的初级C代谢和较高的C作为有机酸的储存是不同皮层代谢活动的标志。总的来说,这些特征提供了C脊骨、蛋白质、能量和渗透物质,这些都是在EFD期间细胞产生和皮层形成所必需的,皮层作为主要的碳汇,这种生长优势在果实发育的其余部分都将继续存在。EFD期间髓内生长受库限,其代谢活动主要涉及C和N分配到存储,并促进了sucsuc循环。了解这些截然不同的代谢特征有助于优化器官的生长。此外,诸如运输结构(包括血管组织)的发展等物理特征可能在这些组织之间存在差异[GydF4y2Ba52.GydF4y2Ba].这些特征也可能导致生长差异,需要进一步研究。这些邻近肉质组织的差异生长为探索果实生长、代谢及其相互依赖的分子调控提供了一个极好的模型系统。GydF4y2Ba
方法GydF4y2Ba
植物材料GydF4y2Ba
在这项研究中,在佐治亚大学的M.7a Rootstock的M.7a Rootstock,Ga大学,Ga,Ga大学,乔治亚州山区研究中心的苹果树,“金色美味冰沙”的成熟苹果树。这些树木于2001年种植,并被研究人员确定。在研究人员的区域商业生产实践之后,树木被维持。2015年,四棵树被随机选择并进行水果载荷减少处理(RL),而另外四棵树未经处理并用作对照(CL)。每棵树作为一个实验单元。对于RL治疗,通过在使用剪刀下方将花梗〜1cm切除,在果实簇中手动除去果实组中的中央(王)果实的所有水果(图。GydF4y2Ba1GydF4y2Bab).前期研究表明,这一阶段的果实去除通过刺激细胞产生来促进果实生长[GydF4y2Ba10GydF4y2Ba那GydF4y2Ba28GydF4y2Ba].因此,在试验开始时,CL处理的果实负荷量可能是RL处理的5倍。然而,由于苹果生理落果的几个周期开始于10-15 DAFB左右,这一比例随果实发育而变化。此前对该基因型在相同发育阶段和位置进行的果实摘除研究结果表明,在收获时,CL和RL处理的果实负荷量相差约3倍[GydF4y2Ba28GydF4y2Ba].该基因型的果实通常在140-150℃下达到收获成熟度[GydF4y2Ba28GydF4y2Ba那GydF4y2Ba53.GydF4y2Ba].本研究未使用化学稀释剂,以避免影响果实生长。分别在0 (11 DAFB)、8、12、19、26、33、47、77和118 DAT(附加文件)对每棵树10个标记的王果进行了果实直径和长度的测量GydF4y2Ba4.GydF4y2Ba).在每个阶段,每棵树的四个王果实被采样,纵向切成两半。在CRAF III(铬酸:醋酸:福尔马林)固定剂中固定一半,用于不同的分析,另一半用于确定代谢物和转录物丰富。对于后一种使用,使用活组织检查冲头(1-10mm)分离髓和皮质组织,立即在液氮中冷冻,并储存在-80℃。在果实开发的所有阶段期间,这两种组织都均匀地取样,以避免潜在的区域效应。GydF4y2Ba
髓中的测量和皮质生长GydF4y2Ba
通过平板扫描仪(V600,爱普生)获得水果纵向剖面图像。ImageJ(美国国立卫生研究院)用于勾勒和测量室室、核(以萼片和花瓣的血管轨迹标记)和果实总断面面积(图。GydF4y2Ba1GydF4y2Ba一种)。核心区域从水果的面积减去以获得皮质区域。从核心的区域中减去区域区域以获得PITH区域。组织RGR由面积测量确定为:GydF4y2Ba[ln(aGydF4y2Ba2GydF4y2Ba) - Ln (AGydF4y2Ba1GydF4y2Ba)] / [TGydF4y2Ba2GydF4y2Ba- T.GydF4y2Ba1GydF4y2Ba]GydF4y2Ba,在那里GydF4y2Ba一种GydF4y2Ba2GydF4y2Ba和GydF4y2Ba一种GydF4y2Ba1GydF4y2Ba是两个连续时间点的区域,GydF4y2BaT.GydF4y2Ba2GydF4y2Ba和GydF4y2BaT.GydF4y2Ba1GydF4y2Ba, 分别。GydF4y2Ba
使用气相色谱(GC)的代谢物测量GydF4y2Ba
提取代谢物并根据[GydF4y2Ba54.GydF4y2Ba]有一些修改。水果组织在液氮中研磨。在1.2ml 80%甲醇含有苯基β-D-葡糖苷的1.2ml 80%甲醇作为内标中,提取约50-100mg的地组。离心40分钟以14,000分 GGydF4y2Ba和4℃,将100μl上清液转移至2mL GC小瓶中的300μL玻璃插入物。在氮气流下蒸发溶剂。首先通过将25μL羟胺加热至50℃加热至50℃,然后通过加入50μl的BSTFA(双(三甲基甲硅烷基)三氟乙酰胺(双(三甲基甲硅烷基)三氟乙酰胺)转化为其三甲基甲硅烷基(TMS)衍生物转化为其肟衍生物。加热至50℃30分钟。注入一个μL该混合物并在气相色谱仪(GC-2014; Shimadzu,Japan)上配备了HP-5毛细管柱(Agilent Technologies Inc.,USA)和火焰离子化探测器。氦用作载气。烘箱温度程序是:150℃,4℃/ min斜坡为190℃,0.5分钟,1.5°C / min斜坡至210°C,0.5分钟,0.5分钟,10分钟 °C/min ramp to 260 °C, 10 min at 260 °C. Standard solutions were prepared for all metabolites, and derivatized as described above. Standard curves were generated and used for metabolite quantification. Metabolites analyzed using GC in this study were: Sor, Suc, Glc, Fru, Xyl, Ino, malate, quinate, citrate, succinate, and Asn.
淀粉量化GydF4y2Ba
淀粉浓度被确定为mg glc当量gGydF4y2Ba- 1GydF4y2Ba新鲜重量后[GydF4y2Ba55.GydF4y2Ba].用80%乙醇在80℃下提取3次,提取时间为10 min,提取量约为50-100 mg。在pH 4.8和55°C条件下,用35单位淀粉糖苷酶将颗粒保留并消化36 h。用己糖激酶和葡萄糖-6-磷酸脱氢酶(G6P)测定葡萄糖浓度。在340 nm波长下用分光光度法检测Glc转化为6-磷酸葡萄糖酸酯过程中生成的NADH。用Glc标准曲线测定其当量。GydF4y2Ba
RNA提取,cDNA合成和QPCRGydF4y2Ba
使用先前描述的CTAB提取缓冲液方法提取总RNA [GydF4y2Ba56.GydF4y2Ba].用1 μg总RNA合成cDNA。采用ImProm II逆转录酶(Promega, USA)进行逆转录,体积为20 μL。将cDNA稀释6倍后,用稀释后的cDNA 1 μL进行定量RT-PCR,方法参照上述方法[GydF4y2Ba28GydF4y2Ba]除了使用Poctup Sybr Green Master Mix(Thermofisher,USA)除外。使用Stratagene MX3005P(Agilent Technologies,USA)定量实时PCR仪器。在PCR扩增结束时进行熔融曲线分析以确定引物特异性。包括无模板的控制反应。两种参考基因用于靶基因表达的标准化,GydF4y2Bamdactin.GydF4y2Ba和GydF4y2BaMDGAPDH.GydF4y2Ba.在的情况下GydF4y2BaMDSDH1.GydF4y2Ba那GydF4y2BaMDSDH2.GydF4y2Ba那GydF4y2Bamdninv3.GydF4y2Ba和GydF4y2BaMDSUSY3GydF4y2Ba,另一种参考基因,GydF4y2Bamdcacs.GydF4y2Ba,被使用了。分析基因的选择是基于[GydF4y2Ba40GydF4y2Ba]以及基于RNA-SEQ数据的基因家族内的最高丰度(Jing等,GydF4y2Ba在筹备GydF4y2Ba).QRT-PCR的基因列表和QRT-PCR的引物序列在附加文件中呈现GydF4y2Ba5.GydF4y2Ba.使用LinregPCR测定QPCR反应的效率[GydF4y2Ba57.GydF4y2Ba].通过效率校正确定相对量(RQ)值,并使用参考基因的RQ的几何平均值归一化以产生归一化RQS(NRQ)。在日志之后对NRQ值进行数据分析GydF4y2Ba2GydF4y2Ba转换。标准误差的确定如[GydF4y2Ba58.GydF4y2Ba].所有基因的表达都表现为0 DAT时RL果实皮层中靶基因的平均转录丰度的倍数变化。只讨论了转录本丰度差异有统计学意义和>差异1.5倍。GydF4y2Ba
统计分析GydF4y2Ba
使用RStudio (Version 1.0.143)和Inkscape (Version 0.92.3)进行统计分析和图表准备。采用方差分析(ANOVA;α = 0.05),然后采用Tukey诚实显著性差异(HSD;α= 0.05)。这些数据在CL和RL之间进行了比较GydF4y2Ba学生的t检验GydF4y2Ba(α= 0.05)在每个阶段。在使用配对的阶段和水果载荷处理中比较皮质和佩斯区域GydF4y2BaT-Tests.GydF4y2Ba(α= 0.05)。在给定的阶段和使用配对的果实载荷处理中分析组织之间的代谢物浓度和转录物丰度差异GydF4y2BatGydF4y2Ba(α= 0.05),在给定阶段和组织类型的Cl和R1处理之间使用GydF4y2Ba学生的t检验GydF4y2Ba(α= 0.05)。用方差分析(α = 0.05)和Tukey的HSD (α = 0.05)分析了在水果负荷处理和组织类型中上述数据的时间变化。这些数据的统计意义见附加文件GydF4y2Ba6.GydF4y2Ba.利用9个阶段、2个组织类型和2个果实负荷处理的代谢产物浓度数据进行主成分分析(PCA)。这些数据被用来确定代谢物浓度变化的主要决定因素GydF4y2BaPrComp.GydF4y2Ba在RStudio函数。前两个主要组件解释了大部分的变化和它们的加载图是使用RStudio中的plot函数显示的。GydF4y2Ba
数据和材料的可用性GydF4y2Ba
在本研究中使用的数据集可从通讯作者在合理的要求。GydF4y2Ba
缩写GydF4y2Ba
- 答:GydF4y2Ba
-
控制水果载荷 - 皮质GydF4y2Ba
- CL:GydF4y2Ba
-
控制水果负载GydF4y2Ba
- CP:GydF4y2Ba
-
控制水果载荷 - PithGydF4y2Ba
- DAFB:GydF4y2Ba
-
盛开后的几天GydF4y2Ba
- DAT:GydF4y2Ba
-
治疗后的日子GydF4y2Ba
- EFD:GydF4y2Ba
-
水果早期发育GydF4y2Ba
- F6P:GydF4y2Ba
-
果糖-6-磷酸盐GydF4y2Ba
- FRU:GydF4y2Ba
-
果糖GydF4y2Ba
- G1P:GydF4y2Ba
-
葡萄糖-1-磷酸盐GydF4y2Ba
- G6P:GydF4y2Ba
-
葡萄糖-6-磷酸盐GydF4y2Ba
- glc:GydF4y2Ba
-
葡萄糖GydF4y2Ba
- ino:GydF4y2Ba
-
肌醇GydF4y2Ba
- 最晚完成日期:GydF4y2Ba
-
水果发展后期GydF4y2Ba
- 维护功能配置:GydF4y2Ba
-
水果发展中期GydF4y2Ba
- RC:GydF4y2Ba
-
减少水果载荷 - 皮质GydF4y2Ba
- RL:GydF4y2Ba
-
降低果实荷载GydF4y2Ba
- 总机:GydF4y2Ba
-
降低水果载荷 - 佩斯GydF4y2Ba
- SOR:GydF4y2Ba
-
山梨糖醇GydF4y2Ba
- 往下:GydF4y2Ba
-
蔗糖GydF4y2Ba
- XYL:GydF4y2Ba
-
木糖GydF4y2Ba
参考文献GydF4y2Ba
- 1.GydF4y2Ba
Pratt C. Apple花和水果:形态和解剖学。Hort Rev. 1988; 10:273-308。GydF4y2Ba
- 2.GydF4y2Ba
姚杰,徐J,Cornille A,Tomes S,Karunairetnam S,Luo Z,Bassett H,Whitworth C,Rees-George J,Ranatunga C,Snirc A,Crhurst R,De Silva N,Warren B,Deng C,Kumar S,Chagnéd,公共汽车VGM,Volz RK,Rikkerink Eha,Gardiner Se,Giraud T,MacDiarmid R,Gleave AP。在苹果驯化前出现的microRNA等位基因可能是果实尺寸进化。植物J. 2015; 84:417-27。GydF4y2Ba
- 3.GydF4y2Ba
Macdaniels LH。苹果和其他乐者水果的形态。纽约(康奈尔大学)。Agri Exp Sta。1940; 230:3-30。GydF4y2Ba
- 4。GydF4y2Ba
麦金塔苹果果实外皮细胞的研究。机器人Gaz。1968;129:173 - 83。GydF4y2Ba
- 5。GydF4y2Ba
Gillaspy G,Ben-David H,Gruissem W.水果:发展观点。植物细胞。1993年; 5:1439-51。GydF4y2Ba
- 6。GydF4y2Ba
引用本文:王志强,王志强,王志强。苹果果实生长模式的指数模型。中国林业科学。1995;70:389-94。GydF4y2Ba
- 7。GydF4y2Ba
根分生组织中细胞分裂率的稳定性。植物学报。2000;43:545-54。GydF4y2Ba
- 8。GydF4y2Ba
贝恩资本(Bain JM),罗伯逊注册会计师(Robertson RN)。苹果果实生长的生理学一、细胞大小、细胞数量与果实发育。澳洲科学文献1951;4:75-91。GydF4y2Ba
- 9。GydF4y2Ba
Malladi A,Johnson LK。细胞周期基因的表达谱揭示COLPEL发育,水果集和苹果果实生长期间细胞生产的关键促进剂(GydF4y2Ba马吕斯×释放有GydF4y2BaBorkh)。J Exp Bot. 2011; 62:205-19。GydF4y2Ba
- 10.GydF4y2Ba
Dash M,Malladi A.该GydF4y2BaAINTEGUMENTAGydF4y2Ba基因,GydF4y2BaMDANT1GydF4y2Ba和GydF4y2BaMDANT2.GydF4y2Ba,与苹果果生长期间的细胞产生调节有关(GydF4y2Ba马鲁斯GydF4y2Ba×GydF4y2Ba家庭GydF4y2BaBorkh)。BMC植物BIOL。2012; 12:98。GydF4y2Ba
- 11.GydF4y2Ba
Johnston JW,Gunaseelan K,Pidakala P,Wang M,Schaffer RJ。苹果中早期和晚期成熟事件的协调是通过对乙烯的差异敏感性调节。J Exp Bot。2009; 60:2689-99。GydF4y2Ba
- 12.GydF4y2Ba
Costa F,Alba R,Schouten H,Soglio V,GianfrancesChi L,Syrra S,Musacchi S,Sansavini S,Costa G,Fei Z,Giovannoni J.使用同源和异源基因表达分析工具在苹果果实成熟过程中表征转录动力学和成熟。BMC植物BIOL。2010; 10:229。GydF4y2Ba
- 13。GydF4y2Ba
Lakso AN, Goffinet MC.《苹果果实发育的研究进展》。正确的做法:实现苹果的可持续种植。剑桥:Burleigh Dodds科学出版社;2017.104 - 33页。GydF4y2Ba
- 14。GydF4y2Ba
tukey hb,年轻的jo。苹果果实的总体形态和组织学。BOT GAZ。1942; 104:3-25。GydF4y2Ba
- 15。GydF4y2Ba
Blanke Mm,Lenz F.水果光合作用。植物细胞环境。1989; 12:31-46。GydF4y2Ba
- 16。GydF4y2Ba
番茄果实发育的代谢调控。J Exp Bot. 2006; 57:1883-97。GydF4y2Ba
- 17。GydF4y2Ba
Bieleski RL。Apple Phloem山梨糖醇的积累和易位。Aust J Biol Sci。1969年; 22:611-20。GydF4y2Ba
- 18。GydF4y2Ba
陈志强,王志强,王志强。苹果树氮素代谢、转运和循环利用的研究进展。如果短启1982;4:204-46。GydF4y2Ba
- 19。GydF4y2Ba
Carrari F,Baxter C,Usadel B,Urbanczyk-Wochniak E,Zano Mi,Nunes-Nesi A,Nikiforova V,Centero D,Ratzka A,Pauly M,SweetLove LJ,Fernie AR。代谢产物和转录水平的综合分析显示了番茄果实开发利用的代谢变化,并突出了代谢网络行为的监管方面。植物理性。2006; 142:1380-96。GydF4y2Ba
- 20。GydF4y2Ba
Fait A,Hanhineva K,Beleggia R,Dai N,Rogachev I,Nikiforova VJ,Fernie AR,Aharoni A.在草莓果实开发期间重新配置了瘦果和容器代谢网络。植物理性。2008; 148:730-50。GydF4y2Ba
- 21。GydF4y2Ba
Lombardo VA,Osorio S,Borsani J,Lauxmann Ma,Bustamante Ca,Budde Co,Andreo Cs,Lara MV,Fernie Ar,Drincovich MF。在桃子果实开发期间的代谢分析和成熟揭示了支撑每个发育阶段的代谢网络。植物理性。2011; 157:1696-710。GydF4y2Ba
- 22。GydF4y2Ba
Dai Zw,Léonc,feil r,Lunn Je,Delrot S,Gomèse。代谢剖面揭示了葡萄浆果中原发性碳水化合物代谢的协调开关(GydF4y2Bavitis ViniferaGydF4y2BaL.),非中小学肉质果实。J Exp Bot。2013; 64:1345-55。GydF4y2Ba
- 23。GydF4y2Ba
Mounet F,Lemaire-Chamley M,Maucourt M等。果实发展过程中番茄肉和种子的定量代谢谱:ANN和PCA的互补分析。代谢组学。2007; 3:273-88。GydF4y2Ba
- 24。GydF4y2Ba
Mounet f,moing a,garcia v等。早期发展果组织的基因和代谢物调节网络分析突出了新的候选基因来控制番茄果组合和发育。植物理性。2009; 149:1505-28。GydF4y2Ba
- 25。GydF4y2Ba
张YZ,李鹏,程L.“蜂窝苹果肉”中碳水化合物,有机酸,氨基酸和酚类化合物的发育变化。食品化学。2010; 123:1013-8。GydF4y2Ba
- 26。GydF4y2Ba
bashir WF, Mbong F, Hertog ML, Geeraerd AH, Van den Ende W, Nicolaï BM。动态标记揭示了苹果果实发育过程中中枢代谢中碳重新分配的时间变化。植物学报2017;8:1785。GydF4y2Ba
- 27。GydF4y2Ba
Berüter J.苹果果实发育过程中糖的积累及其相关酶活性的变化。acta botanica yunshan(云南植物研究),1985;GydF4y2Ba
- 28。GydF4y2Ba
Dash M,Johnson LK,Malladi A.通过提高碳水化合物可用性,改变细胞生成相关基因的表达,增加细胞生产,降低果实载荷的减少影响苹果的早期果实生长。J Amer SoC Hort SCI。2013; 138:253-62。GydF4y2Ba
- 29.GydF4y2Ba
白y,Dougherty L,Li M,Fazio G,Cheng L,徐K. MA基因座中的两个铝活化苹果醛转运蛋白样基因之一的自然突变与苹果中的低果酸有关。Mol Genet Genoomics。2012; 287:663-78。GydF4y2Ba
- 30。GydF4y2Ba
FeusiMesBerüterJ。Girdling对碳水化合物分配在生长苹果果实中的影响。J植物理性。1997年; 151:277-85。GydF4y2Ba
- 31.GydF4y2Ba
王志强,王志强,王志强,等。苹果叶片、韧皮部分泌物和果实非结构性碳水化合物的日变化。植物学报2001;28:131-9。GydF4y2Ba
- 32.GydF4y2Ba
山梨醇相关酶和转化酶在苹果组织糖代谢季节变化中的作用。J Amer Soc Hort Sci. 1986; 111:134-7。GydF4y2Ba
- 33.GydF4y2Ba
Archbold DD。碳水化合物可用性改变山梨醇脱氢酶的苹果果实活性。physiol植物。1999; 105:391-5。GydF4y2Ba
- 34.GydF4y2Ba
Nosarszewski M,Clatement Am,Downie Ab,Archbold DD。山梨醇脱氢酶在苹果果实套装中的表达和活性及早期发展。physiol植物。2004; 121:391-8。GydF4y2Ba
- 35.GydF4y2Ba
吴B-H,Li S-H,NoSarzewski M,Archbold DD。山梨醇脱氢酶基因表达和苹果中的酶活性:芽发育期间的组织特异性和对砧木活力和生长操纵的反应。J Amer SoC Hort SCI。2010; 135:379-87。GydF4y2Ba
- 36.GydF4y2Ba
Tromp J, Ovaa JC。苹果贮藏氮的韧皮部转运。杂志。1971;25:407-13。GydF4y2Ba
- 37.GydF4y2Ba
Malaguti D,Millard P,Wendler R,Hepburn A,Tagliavini M.苹果Xylem中的氨基酸易位(GydF4y2Ba马吕斯×释放有GydF4y2BaBorkh。)春天的树木是氮的反弹和根吸收。J Exp Bot。2001; 52:1665-71。GydF4y2Ba
- 38。GydF4y2Ba
汉森P.在“金色美味”苹果中产生的成分和水果发育,受到氮气供应时序的影响。科学座位。1980; 12:243-57。GydF4y2Ba
- 39。GydF4y2Ba
夏国平,程立龙,王志强,王志刚。氮素供应对‘Gala’苹果树源库平衡和果实大小的影响。J Amer Soc Hort Sci. 2009; 134:126-33。GydF4y2Ba
- 40.GydF4y2Ba
李米,冯福,程立。苹果果实发展中糖代谢和积累中涉及的基因的表达模式。Plos一个。2012; 7:E33055。GydF4y2Ba
- 41.GydF4y2Ba
李敏,李丹,冯飞,张舒,马飞,程磊。蛋白质组学分析揭示苹果果实发育和糖酸积累的动态调控。J Exp Bot. 2016; 67:5145-57。GydF4y2Ba
- 42。GydF4y2Ba
李敏,李鹏,马芳,程磊。转基因苹果果实中山梨醇合成量的变化及其对糖代谢的影响。如果短杂志2018;5:60。GydF4y2Ba
- 43。GydF4y2Ba
Granot D,Kelly G,Stein O,David-Schwartz R.己酮酶和果蛋白酶在糖对植物生理学和发育影响中的实质作用。J Exp Bot。2013; 65:809-19。GydF4y2Ba
- 44。GydF4y2Ba
Biais B, Benard C, Beauvoit B, Colombie S, Prodhome D, Menard G, Bernillin S, Gehl B, Gauitier H, Ballias P, Mazat J-P, Sweetlove L, Genard M, Gibon Y. Remarkable reproducibility of enzyme activity profiles in tomato fruits grown under contrasting environments provides a roadmap for studies of fruit metabolism. Plant Physiol. 2014;104:1204–21.
- 45。GydF4y2Ba
Verbančič J, Lunn JE, Stitt M, Persson S.碳供应与细胞壁合成的调控。摩尔。2018;11:75 - 94。GydF4y2Ba
- 46。GydF4y2Ba
Loewus Fa,Murthy PPN。GydF4y2Ba迈诺GydF4y2Ba-肌醇在植物中的代谢植物科学。2000;150:1-19。GydF4y2Ba
- 47。GydF4y2Ba
Blanke Mm,Hucklesby DP,诺顿BA。苹果果果实光合磷丙酮酸羧基羧化酶的分布及生理意义。J植物理性。1987年; 129:319-25。GydF4y2Ba
- 48。GydF4y2Ba
水果中有机酸的代谢、功能和含量。如果短启46:371 2018;430年。GydF4y2Ba
- 49。GydF4y2Ba
Malladi A.和P. M. Hirst。增加“晚会”苹果的自发突变体的果实大小(GydF4y2Ba马吕斯×释放有GydF4y2Ba细胞产生的改变和细胞大小的增加促进了细胞的生长。中国生物医学工程学报。2010;41:3003 - 13。GydF4y2Ba
- 50。GydF4y2Ba
Berüter J.苹果生长果实碳水化合物分配与水分关系的变化。植物生理学报1989;135:583-7。GydF4y2Ba
- 51。GydF4y2Ba
BerüterJ,Feusi Mes,Ruedi P.山梨醇和蔗糖分区在生长的苹果果实中。植物理性。1997年; 151:229-76。GydF4y2Ba
- 52。GydF4y2Ba
Herremans E,Verboven P. Hertogml,Cantre D,Van Dael M,De Schryver T,Van Hoorebeke L,Nicolai BM。苹果运输结构的空间发展(GydF4y2Ba马鲁斯GydF4y2Ba×GydF4y2Ba家庭GydF4y2Baborkh。)水果。正面。植物SCI。2015; 6:679。GydF4y2Ba
- 53。GydF4y2Ba
沃灵顿IJ,Fulton Ta,Halligan EA,De Silva HN。苹果果实生长和成熟受早期温度的影响。J Amer SoC Hort SCI。1999年; 124:468-77。GydF4y2Ba
- 54。GydF4y2Ba
小查普曼,霍瓦特RJ。毛细管GLC和GLC/MS测定水果和甘薯提取物中非挥发性酸和糖的含量。《农业食品化学》1989;37:947-50。GydF4y2Ba
- 55.GydF4y2Ba
植物组织中淀粉的定量分析。Nat Prot。2006;1:1342。GydF4y2Ba
- 56.GydF4y2Ba
一种高效的RNA分离方法和内参基因的鉴定,用于蓝莓基因表达的标准化。植物细胞代表2011;30:2167-76。GydF4y2Ba
- 57.GydF4y2Ba
Ruijter JM,Ramakers C,Hoogaars WMH,Karlen Y,Bakker O,Van Den Hoff MJB,Moorman AFM。扩增效率:在定量PCR数据分析中连接基线和偏差。Nucl酸res。2009; 37:E45。GydF4y2Ba
- 58.GydF4y2Ba
Rieu I,Powers SJ。实时定量RT-PCR:设计,计算和统计数据。植物细胞。2009; 21:1031-3。GydF4y2Ba
致谢GydF4y2Ba
我们承认通过佐治亚大学园艺厅的博士研究助理探博助理的支持。我们感谢John Doyle寻求实验设置和数据收集。我们感谢山区研究和教育中心的员工,以获得树木维护。GydF4y2Ba
资金GydF4y2Ba
SJ通过佐治亚大学园艺部门的研究助理资助。该工作部分由Hatch项目(项目编号:GEO00784 /登录号:1010225)部分支持美国农业部,国家粮食和农业研究所。资金来源没有参与设计的实验,数据收集,分析或解释。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
SJ和我想象的这项研究。SJ收集并分析了数据。SJ和我解释了数据,并准备了稿件。所有作者阅读并认可的终稿。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
提交人声明他们没有竞争利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意事项GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
额外的文件1。GydF4y2Ba
几空记录的成绩单GydF4y2Ba铝活化苹果酸转运体9GydF4y2Ba(GydF4y2Bamdalmt9.GydF4y2Ba)在苹果果实中,响应果实负荷减少,使用定量RT-PCR测量。CC:控制水果负荷-皮层;CP:控制果实重量;RC:减少水果负荷皮层;RP:减少水果的重量。果实负荷减少处理在盛开后11天进行。平均值和s.e.意思(GydF4y2BaNGydF4y2Ba= 4)显示。星号表示皮质中的控制和降低的水果载物处理之间的显着差异(α= 0.05)。转录性丰度数据参考在RC处理后在0d中的平均表达式呈现。转录物丰富被标准化为苹果GydF4y2BaGAPDH.GydF4y2Ba(GydF4y2Ba甘油醛3磷酸脱氢酶GydF4y2Ba基因。背景中的阴影区域表现出早期(深灰色),中间(浅灰色)和晚果开发(白色)时期。GydF4y2Ba
附加文件2。GydF4y2Ba
不同果实代谢物中的相关矩阵。进行Pearson相关性分析以确定本研究分析的所有代谢产物中的关系。这里使用果实代谢物浓度数据。相关性被呈现为彩色键控相关系数(数字)和热图。正相关性在蓝色和负相关中指示为红色。颜色的强度表示两个代谢物之间的关系的大小。GydF4y2Ba
附加文件3.GydF4y2Ba
苹果果实组织代谢产物含量对果实负荷量减少的时空响应果实代谢物浓度与皮质和髓的归一化组织面积相乘,得到组织代谢物含量的估计。组织面积被用来代替组织重量。平均值及平均值的标准误差(GydF4y2BaNGydF4y2Ba= 4)显示。CC:控制水果负荷-皮层;CP:控制果实重量;RC:减少水果负荷皮层;RP:减少水果的重量。星号和匕首符号表示对照和减果处理在皮层和髓中分别有显著差异(α = 0.05)。阴影区域表示早期(深灰色)、中期(浅灰色)和晚期(白色)。GydF4y2Ba
附加文件4。GydF4y2Ba
“金香冰沙”的果实发育阶段。展示了本研究中所使用的果实发育阶段。图示的果实纵向切片,用CRAF III固定片固定。使用平板扫描仪获取图像,并用ImageJ进行处理。条形表示1cm。DAT:治疗后的天数。果实负荷量在开花后11 d (0 DAT)降低。GydF4y2Ba
附加文件5。GydF4y2Ba
定量RT-PCR分析中使用的苹果基因和序列的列表。GydF4y2Ba
额外的文件6。GydF4y2Ba
果实生长,果实发育过程中的果实生长,代谢物浓度和转录物丰富数据的统计学意义,在皮质和髓组织中,以及响应果实负荷减少。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
(1)苹果的高生长率(GydF4y2Ba马鲁斯GydF4y2Ba×GydF4y2Ba家庭GydF4y2BaBorkh。)早期发展中资源密集型新陈代谢支持水果皮质。GydF4y2BaBMC植物BIOL.GydF4y2Ba20,GydF4y2Ba75(2020)。https://doi.org/10.1186/s12870-020-2280-2GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-020-2280-2GydF4y2Ba
关键词GydF4y2Ba
- 碳代谢GydF4y2Ba
- 细胞生产GydF4y2Ba
- 果实生长发育GydF4y2Ba
- 水果减负荷GydF4y2Ba
- 代谢分析GydF4y2Ba
- 氮代谢GydF4y2Ba
- 沉没活动GydF4y2Ba