摘要
背景
干旱胁迫是影响油菜籽生长的主要非生物因子(芸苔属植物显著l .)的生产力。尽管之前的研究表明长链非编码rna (long non-coding RNAs, lncRNAs)在干旱胁迫响应中发挥着关键作用,但目前仍缺乏一种全基因组识别和表征lncRNAs对干旱胁迫响应的方案,特别是在干旱胁迫下显著。为了进一步了解反应的分子机制显著对于干旱胁迫,我们比较了Q2(耐旱基因型)和秦优8(干旱敏感基因型)在苗期对干旱胁迫和补水处理的转录组变化。
结果
在Q2中共检测到5546个下调mrna和6997个上调mrna,而在Qinyou8中分别检测到7824个和10251个;在Q2中检测到369个下调的lncrna, 108个上调的lncrna,而在Qinyou8中分别检测到449个和257个。LncRNA-mRNA相互作用网络分析表明,Q2的共表达网络由145个网络节点和5175个连接组成,而秦右8的共表达网络由305个网络节点和22327个连接组成。我们进一步鉴定出34个转录因子(tf)对应Q2中126个差异表达的lncrna, 45个tf对应Qinyou8中359个差异表达的lncrna。lncrna差异表达分析表明,在两种基因型中,与lncrna共表达的上调和下调mrna参与不同的代谢途径,参与不同的调控机制。值得注意的是,一些lncRNAs与BnaC07g44670D共表达,与植物激素信号转导有关。此外,一些与XLOC_052298、XLOC_094954和XLOC_012868共定位的mrna主要被归类为信号传输和防御/应激反应。
结论
本研究结果增加了我们对油菜lncrna在干旱胁迫和复浇水下的表达特性的认识,为进一步研究lncrna在干旱胁迫和复浇水下的功能和作用机制提供参考。
背景
干旱是限制作物产量和生存的重要因素之一。由于持续的全球气候变化,越来越多的研究集中在了解作物如何抵抗干旱胁迫并提高其抗性水平的机制[1,2,3.,4,5,6,7,8]。植物感知干旱信号并产生第二信使物质,如Ca2 +、磷脂酰肌醇及活性氧[9,10],同时引起细胞内钙离子浓度的增加,启动了蛋白质磷酸化途径的级联网络。最后,靶蛋白直接参与细胞保护,或通过tf (MYC/MYB、ABF、CBF/DREB、bZIP等)调控一系列与胁迫相关的特异性基因的表达,从而保护细胞,提高植物的逆境抗性[11,12,13]。尽管现代分子生物学的快速发展逐渐揭示了植物抗旱性的分子机制,但开发抗旱植物以应对干旱胁迫仍然是未来的实质性挑战。
长链非编码RNA (Long non-coding RNA, lncRNA)是一种长度超过200个核苷酸,没有或有限的蛋白质编码能力的RNA转录物[14,15,16]。越来越多的证据表明,lncRNAs以RNA的形式对基因表达水平发挥调控作用,包括表观遗传调控、转录调控和转录后调控[17,18,19,20.,21,22,23,24,25]。随着新一代测序技术和生物信息学方法的优势,许多lncrna已在模型植物中被发现,如拟南芥(26,27,28,29],小麦[30.],玉米[31,32,33]和米[34],表明lncRNAs在植物发育和胁迫响应的各种生物学过程中发挥着重要作用。最近的研究证实lncrna对非生物胁迫有反应[31,35,36],包括干旱胁迫。例如,在玉米中分析了664个干旱响应的lncrna [31]。在干旱胁迫下,已鉴定出2542个lncRNA候选基因杨树trichocarpa,其中504个品种对干旱有反应[37]。在拟南芥, 1832个lncrna在干旱、寒冷、高盐和/或ABA (ABA)处理2 h和/或10 h后发生变化[29]。在玉米中,有664个转录本被证实为干旱响应的lncRNAs,其中8个被证实为miRNAs的前体[31]。在水稻中,pre-miRNA表达谱分析表明miR171f参与水稻根系发育和生长的进程,以及对干旱胁迫的响应[38]。在棉花中,长介入/基因间非编码rna (lincRNAs) XLOC 063105和XLOC 115463通过调控邻近基因参与干旱胁迫响应[39]。此外,谷子中有19个lncRNA(17个lincrna和2个天然反义转录物(NATs))对聚乙二醇-6000 (PEG)诱导的干旱胁迫有反应,其中只有一个与高粱的lncRNA具有同向性[40]。Qin等人(2017)确定了一种拟南芥lncRNA,干旱诱导的lncRNA (DRIR),响应干旱和盐胁迫。干旱和盐胁迫以及ABA处理均可显著激活DRIR [41]。此外,在木薯中鉴定出318个lncrna,这些lncrna对寒冷和/或干旱胁迫有反应,并与激素信号转导、次生代谢产物的生物合成和蔗糖代谢途径有关[42]。此外,在应激反应中,许多参与基因表达调控的lncrna已被鉴定和表征芸苔属植物(43,44,45,46]。在大白菜里(油菜。对),共鉴定出4594个推测的lncrna响应热应激,其中25个与10个热响应基因共表达[47]。在芸苔属植物拉伯L.研究发现,549个lncrna在低温处理后表达显著改变,短期低温处理诱导天然反义转录物(NATs)BrFLC和BrMAF已鉴定出与春化有关的基因[48]。Summanwar等人(2019)从易感和耐药的根中鉴定出530个差异表达的lncrna芸苔属植物显著行。从A08染色体上鉴定出24个差异表达的lncrna,据报道,该染色体对不同的病毒具有抗性p . brassicae病变型(49]。在芸苔属植物juncea, 1614个差异表达的lncrna响应高温和干旱胁迫,部分lncrna与参与非生物胁迫响应的tf共表达[50]。
油菜籽(芸苔属植物显著L.)是世界上重要的油籽作物[51]。它易受干旱影响,严重影响油菜籽的生产[52,53,54]。尽管已经在不同的植物物种中发现了许多lncrna,这表明lncrna在响应非生物胁迫中发挥了重要作用,但lncrna对干旱胁迫和复水处理反应的全基因组鉴定和表征仍然缺乏,特别是在植物中显著。为了进一步了解反应的分子机制显著我们比较了Q2(耐旱基因型)和Qinyou8(干旱敏感基因型)在幼苗期对干旱胁迫和补水处理的转录组变化,并鉴定了参与干旱胁迫和补水处理的lncrna。本研究采用基于共表达的方法,根据lncRNA共表达蛋白编码基因的功能预测lncRNA的功能[55]。因此,构建lncRNA-mRNA共表达网络进行通路富集分析。此外,通过分析植物激素信号转导的lncRNA-mRNA共表达网络,进一步探讨差异表达的lncrna在干旱胁迫和复水胁迫下的潜在作用。
结果
干旱胁迫(DS)和复水处理(RW)油菜幼苗表型
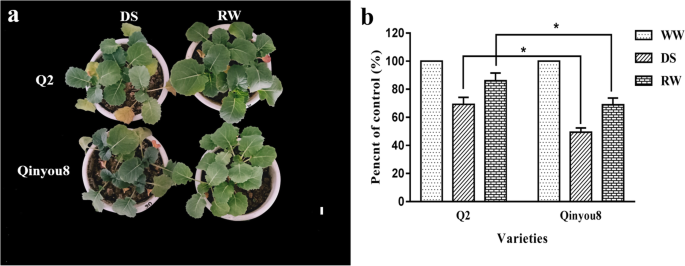
油菜幼苗在DS和RW处理下的反应不同(图2)。1).DS处理下Q2鲜重达到WW的70.43%,显著高于秦优8号。RW下Q2鲜重达到WW的82.76%,显著高于秦优8号。由此可见,补水后Q2的恢复能力优于秦油8。
在干旱胁迫和再浇水条件下lncRNAs和mrna的差异表达
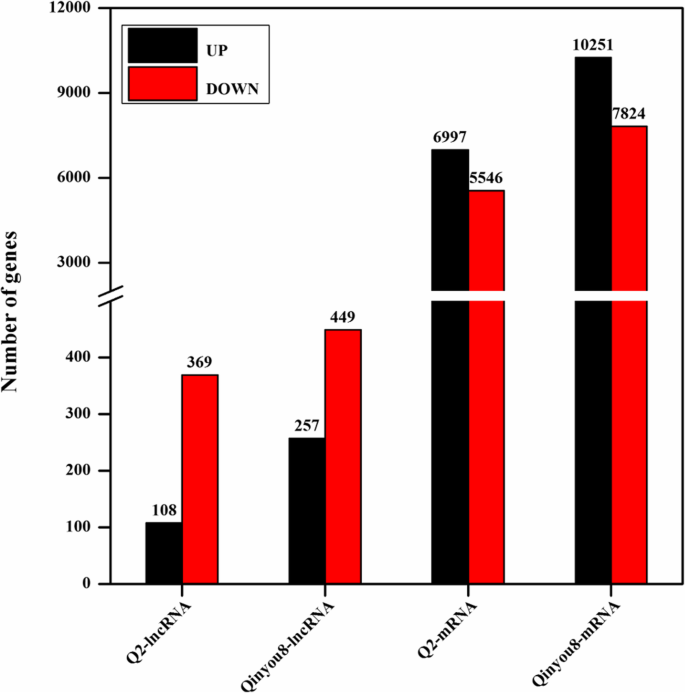
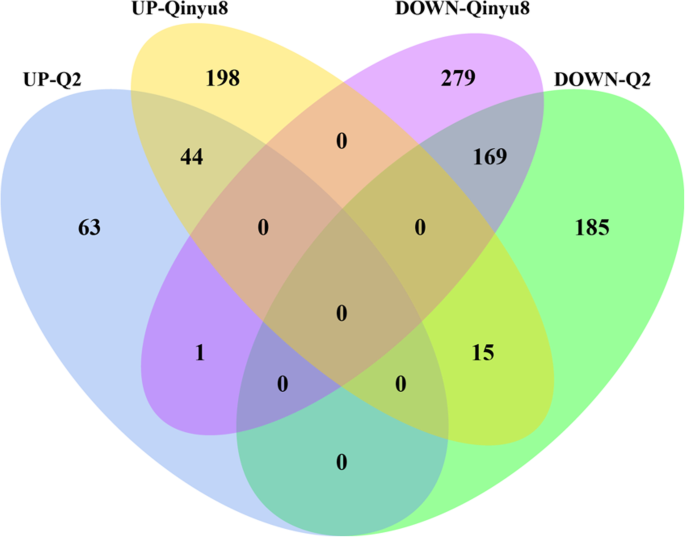
在这项研究中,从12个样本(两个处理,两个测试材料,三个生物重复)中提取RNA,并在进行RNA测序之前测试其质量(附加文件)1).我们通过从RNA-seq数据中去除低质量的读取来获得干净的读取。从清洁数据计算QC和GC含量,以评估测序数据的质量(附加文件)2).干净的数据集被映射到芸苔属植物显著l .基因组。所有结果表明RNA-seq数据是非常可靠的。所有转录本的表达水平,包括lncRNAs和mRNAs,采用FPKM进行鉴定,系统估计,差异转录本分析采用cuffdiff,阈值为问值< 0.05。与干旱胁迫下lncrna的表达相比,再浇水后Q2中差异表达477个lncrna(下调369个,上调108个),秦油8中差异表达706个lncrna(下调449个,上调257个)(图。2).此外,在Q2和Qinyou8中分别有12,543个mrna(下调5546个,上调6997个)和18,075个mrna(下调7824个,上调10,251个)差异表达(图。2).
中存在的验证
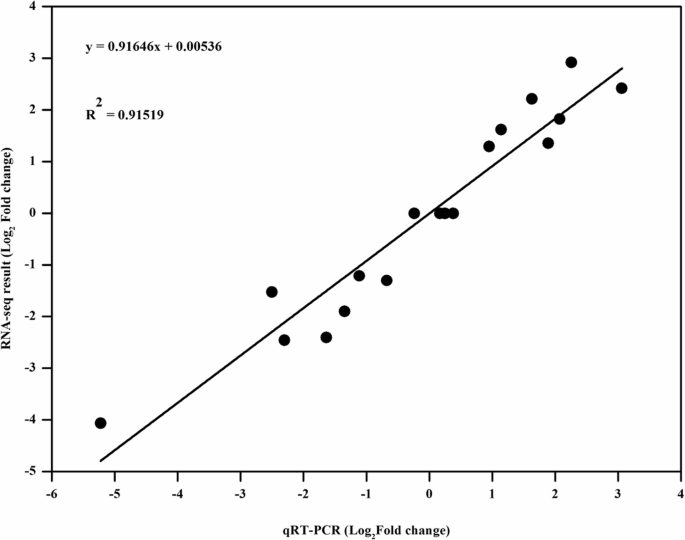
为了验证RNA-seq的表达数据,我们选择了9个在两种基因型中差异表达的lncrna进行实时RT-PCR分析。计算lncrna表达水平的pearson相关系数(决定系数)的平方。如图所示。3.,用RNA-seq检测lncRNA表达水平显著(R2= 0.91519,斜率= 0.91646)与qRT-PCR分析结果相关。例如,XLOC_012868的相对表达量在Q2中升高,而在Qinyou8中降低,这与RNA-seq结果一致(附加文件3.).实时PCR结果验证了转录组测序得到的表达模式,表明基于RNA-seq数据的lncrna表达谱是可靠的。
基于lncRNA-mRNA共表达网络的差异表达lncrna功能
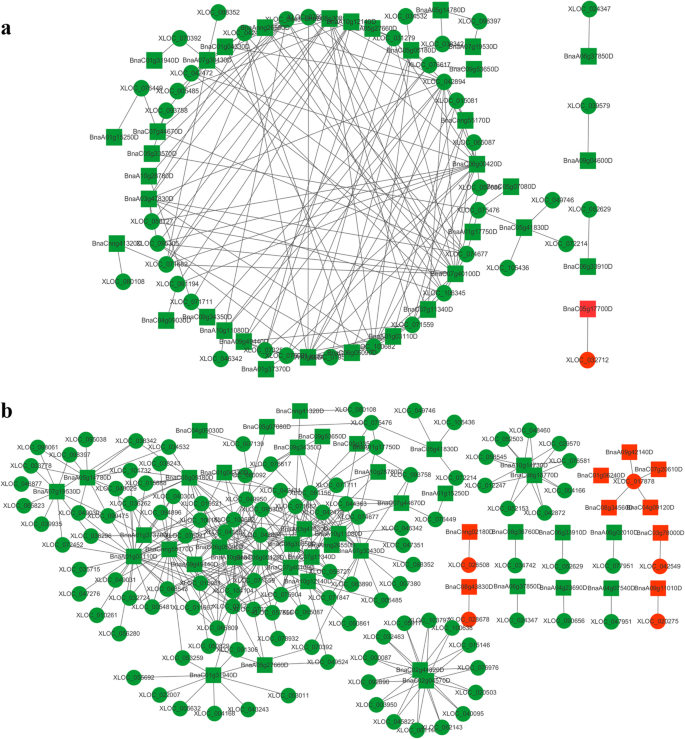
为了进一步描述差异表达的lncrna的作用,我们使用lncRNA-mRNA关系对构建交互网络。共表达网络分析表明,Q2的共表达网络由145个网络节点和5175个连接组成,而Qinyou8的共表达网络由305个网络节点和22327个连接组成。在Q2中,共有5175对lncRNA-mRNA对,其中分别包括1481个mrna和145个lncrna(附加文件)4).同样,Qinyou8中有22,327对lncRNA-mRNA,其中分别包括3200个mrna和305个lncrna(附加文件4).在两种基因型中,表达趋势相同的lncRNA-mRNA对明显多于表达趋势相反的lncRNA-mRNA对。在Q2和Qinyou8中分别有6对和4对相反的趋势,这表明候选lncrna在干旱和复水过程中起作用(附加文件)5).研究表明,一个lncRNA可以调控多个蛋白质编码基因,反之亦然[56,57,58]。通过Q2的共表达网络,我们知道1个mRNA可能与1 ~ 18个lncRNA相关,1个lncRNA可能与1 ~ 375个mRNA相关。此外,Qinyou8的共表达网络显示1个mRNA可能与1 ~ 43个lncRNA相关,1个lncRNA可能与1 ~ 375个mRNA相关。XLOC_071559分别是两种基因型网络中最大的节点。
研究表明lncRNA可以间接影响mRNA的表达,也可以直接与mRNA结合,从而影响翻译[59,60,61],剪羊毛[62,63],以及mRNA的降解[64]。目前lncRNA与mRNA相互作用的机制尚不清楚。为了揭示差异lncRNAs在干旱胁迫和再浇水条件下的潜在功能,我们分析了差异lncRNAs靶基因的基因本体(Gene Ontology, GO)术语。本分析旨在确定差异表达lncRNAs的靶基因所关联的主要分子功能、生物过程和细胞成分。
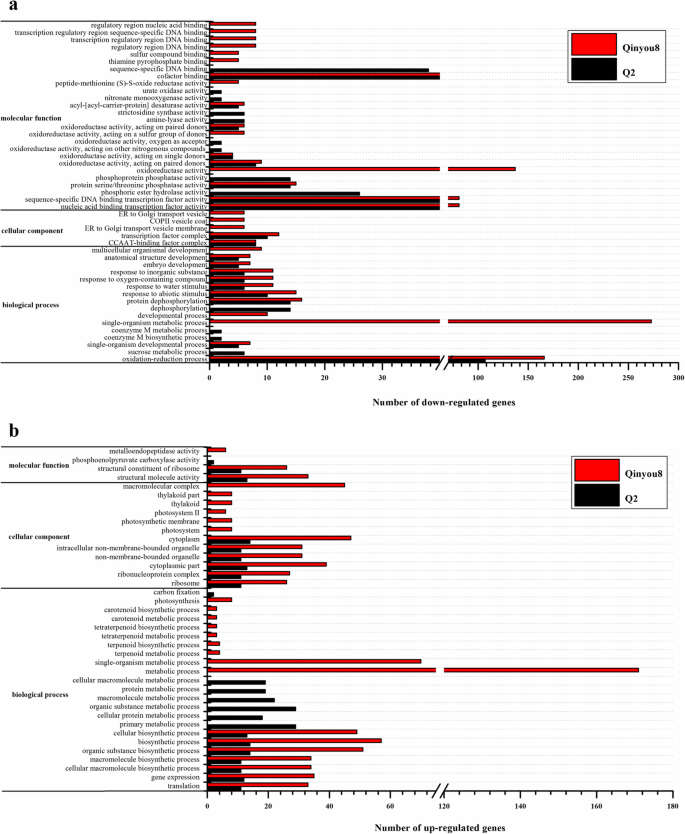
在Q2和Qinyou8中,与差异表达的lncrna共表达的下调mrna分别被分配到32个和34个显著项(图2)。4a).对于Q2中与差异表达的lncrna共表达的下调mrna,生物过程中最显著的GO术语为氧化还原过程(GO:0055114)、蛋白质去磷酸化(GO: 0006470)、去磷酸化(GO:0016311)、对非生物刺激的反应(GO:0009628)、对水刺激的反应(GO:0009415)和蔗糖代谢过程(GO:0005985)。就分子功能而言,核酸结合转录因子活性(GO:0001071)、序列特异性DNA结合转录因子活性(GO:0003700)、辅因子结合(GO:0048037)、序列特异性DNA结合(GO:0043565)、磷酸酯水解酶活性(GO:0042578)、蛋白质丝氨酸/苏氨酸磷酸酶活性(GO:0004722)和磷酸蛋白磷酸酶活性(GO:0004721)是重要的显著富集的GO项。转录因子复合物(GO:0005667)和ccaat结合因子复合物(GO:0016602)是细胞成分中最重要的显著术语。在Qinyou8中,对于与差异表达lncrna共表达的下调mrna,生物过程的重要GO术语为单生物代谢过程(GO:0044710)、氧化还原过程(GO:0055114)、蛋白质去磷酸化(GO:0006470)、对非生物刺激的反应(GO:0009628)、对水刺激的反应(GO:0009415)和蛋白质丝氨酸/苏氨酸磷酸酶活性(GO:0004722)。在分子功能方面,氧化还原酶活性(GO: 0016491)、核酸结合转录因子活性(GO:0001071)和序列特异性DNA结合转录因子活性(GO:0003700)三个GO项均表现出显著富集。在细胞成分方面,转录因子复合物(GO:0005667)和ccaat结合因子复合物(GO:0016602)是富集最显著的GO术语。
在Q2和Qinyou8中,与差异表达的lncrna共表达的上调mrna分别被分配到23个和31个显著的GO项(图。4b).在Q2中表达上调的mrna与差异表达的lncRNAs共表达的生物过程类别中,富集GO术语最多的是初级代谢过程(GO:0044238),其次是有机物代谢过程(GO:0071704)、大分子代谢过程(GO: 0043170)、蛋白质代谢过程(GO:0019538)、细胞大分子代谢过程(GO: 0044260)和细胞蛋白质代谢过程(GO:0044267)。在分子功能中,结构分子活性(GO:0005198)和核糖体结构成分(GO:0003735)是Q2中最占优势的基团。在细胞成分类别中,有意义的术语为细胞质(GO:0005737)、细胞质部分(GO:0044444)、核糖体(GO:0005840)、核糖核蛋白复合物(GO:0030529)和翻译(GO:0006412)。此外,在Qinyou8中,上调mrna与差异表达lncrna共表达的GO术语,如代谢过程(GO:0008152)、单生物代谢过程(GO:0044710)、生物合成过程(GO:0009058)、有机物生物合成过程(GO:1901576)、细胞生物合成过程(GO:0044249)、基因表达(GO:0010467)、翻译(GO:0006412)、光合作用(GO:0015979),在生物过程类别中,氧化石墨烯富集最为显著。在分子功能方面,结构分子活性(GO:0005198)和核糖体结构成分(GO:0003735)是亲油8号的优势基团。在细胞组分类别中,以细胞质(GO:0005737)、大分子复合物(GO:0032991)、细胞质部分(GO:0044444)、非膜界细胞器(GO:0043228)、核糖核蛋白复合物(GO:0030529)、核糖体(GO:0005840)、光系统II (GO: 0009523)为优势组。这些结果表明,胁迫响应型lncRNAs可能调控干旱胁迫和再浇水过程中参与信号转导、能量合成、分子代谢、转录和翻译等生物学过程的基因。
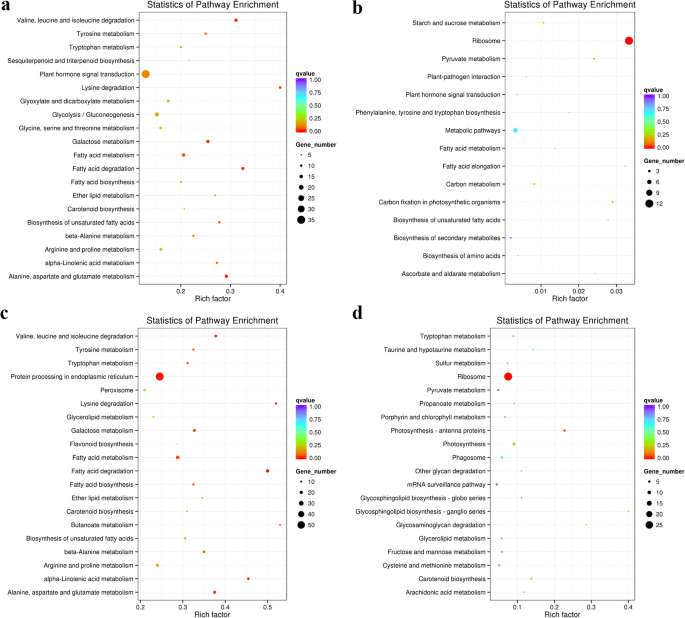
我们还分析了KEGG中共表达的mrna与差异表达的lncrna的统计富集情况。通过途径富集分析,分别在Q2和Qinyou8中发现了18个和18个显著的KEGG通路(p< 0.05)。KEGG分析显示,有19条通路与Q2中表达差异的lncRNAs共表达的下调mrna显著相关(图2)。5A),包括植物激素信号转导(ko04075)、糖酵解/糖异生(ko00010)、脂肪酸代谢(ko01212)、缬氨酸、亮氨酸和异亮氨酸降解(ko00280)、丙氨酸、天门冬氨酸和谷氨酸代谢(ko00250)以及精氨酸和脯氨酸代谢(ko00330)。此外,有3个已确定的通路与Q2中上调表达的mrna与差异表达的lncrna共表达显著相关(图2)。5B),包括核糖体(ko03008)、光合生物中的碳固定(ko00710)和丙酮酸代谢(ko00620)。在Qinyou8中,鉴定出17条通路与下调表达的lncrna共表达的lncrna显著相关,7条通路与上调表达的lncrna共表达的lncrna显著相关。在内质网蛋白加工(ko04141)、脂肪酸代谢(ko01212)、脂肪酸降解(ko00071)、丙氨酸、天门冬氨酸和谷氨酸代谢(ko00250)、半乳糖代谢(ko00052)以及精氨酸和脯氨酸代谢(ko00330)中,与秦油8号lncRNAs共表达的下调mrna显著富集(图)。5c),而与Qinyou8的lncRNAs共表达上调最多的mrna参与核糖体(ko03010)、光合作用(ko00195)和光合作用-天线蛋白(ko00196)(图。5d)。
干旱胁迫和复水条件下tf的鉴定
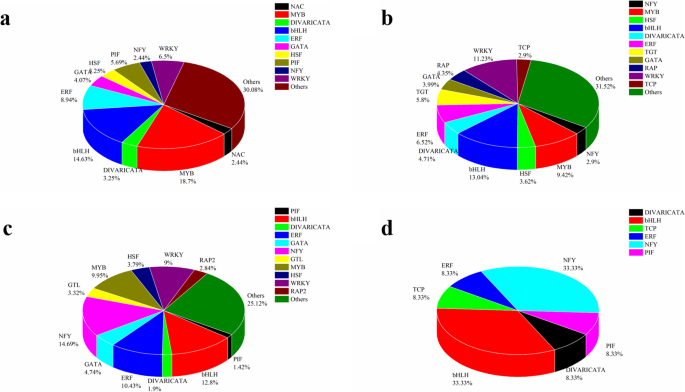
在干旱胁迫下,tf可作为干旱胁迫的调控因子,与相关基因启动子区域的顺式作用元件结合,调控下游基因的表达[65]。在我们的研究中,我们发现Q2中有334个差异表达基因,秦右8中有487个差异表达基因;的TF数据库进行比较拟南芥211个tf在两种基因型中共表达,12个tf在两种基因型中相反表达。此外,在Q2特异性表达的123个tf被分为38组;其中10个TF家族占这些组的69.92%,包括MYB(23个TF)、基本螺旋-环-螺旋(bHLH)(18个TF)、ERF(11个TF)、WRKY(8个TF)、PIF(7个TF)、GATA(5个TF)、DIVARICATA(4个TF)、HSF(4个TF)、NAC(3个TF)和NFY(3个TF)(图。6a).此外,Qinyou8特异性表达276个TF,分为56个TF群,其中11个TF家族占276个TF群的68.48%;其中包括MYB(26个tf),基本螺旋-环-螺旋(bHLH)(36个tf), ERF(18个tf), WRKY(31个tf), GATA(16个tf), DIVARICATA(13个tf), HSF(10个tf), RAP(11个tf), TCP(12个tf), NFY(8个tf)和TGT(8个tf)(图。6b). 39组tf以两种基因型共表达,包括NFY(31个tf)、bHLH(27个tf)、WRKY(19个tf)、MYB(21个tf)、ERF(22个tf)、GATA(10个tf)。6c).另外,6组在两种基因型之间反向表达(共表达tf);包括bHLH(4个tf), NFY(4个tf), DIVARICATA(1个tf), ERF(1个tf), PIF(1个tf)和TCP(1个tf)。6d).我们还分析了差异表达的lncrna与转录因子之间的关系。获得tf的序列信息,用于与lncrna共表达分析。在Q2中,属于20个TF家族的57个TF被发现与57个差异表达的lncrna共表达(附加文件)6),而在Qinyou8中发现了属于24个TF家族的94个TF与172个差异表达的lncrna共表达(附加文件)6).
讨论
最近的一些研究表明lncRNAs在干旱胁迫响应中发挥着重要作用[31,39,41,66]。据此,我们构建了lncRNA和mRNA文库,并对参与干旱胁迫和复水的lncRNA进行了标注、鉴定和验证。
干旱胁迫和复水条件下两种不同基因型差异mrna和lncrna的表达
在我们的研究中,我们系统地识别和分析显著mRNAs和lncRNAs,对干旱胁迫和再水化有反应。在两种不同基因型的对照组中,Q2中分别检测到5546个下调mrna和6997个上调mrna,而Qinyou8中分别检测到7824个和10251个;在Q2中检测到369个下调的lncrna, 108个上调的lncrna,而在Qinyou8中分别检测到449个和257个。有趣的是,我们发现两种基因型中均有229个lncRNA(下调169个,上调44个),其中1个lncRNA XLOC_012868在耐旱基因型中上调,在干旱敏感基因型中下调;相反,15个lncrna在耐旱基因型中下调,在干旱敏感基因型中上调(图2)。7).由此可知,这两种基因型在干旱胁迫和复水条件下的反应不同。在Qinyou8中,差异表达的mrna和lncRNAs数量明显高于Q2。
剪接改变是lncRNA转录物在许多生理过程中影响基因表达的机制之一[67,68,69]。在Q2中,从469个lncRNA基因中鉴定出477个lncRNA转录本,其中8个lncRNA编码基因被交替剪接。同样,在Qinyou8中,从688个lncRNA基因中鉴定出706个lncRNA转录本,其中18个lncRNA编码基因被交替剪接(附加文件7).这些交替剪接的lncRNA编码基因可能参与了干旱和再浇水过程。选择9个鉴定出的lncrna进行qRT-PCR验证,结果与测序结果一致。
差异表达的lncrna在GO和KEGG通路中特异性富集
随着新一代测序技术的进步,许多研究表明lncRNAs以RNA的形式对基因表达水平发挥调控作用,包括表观遗传调控、转录调控和转录后调控[19]。已知序列特异性DNA结合转录因子活性[42,70],对刺激的反应[71],对非生物刺激的反应[70],生物合成过程[70],核糖体的结构成分[58],光合作用[72]和氧化还原酶活性[72],由一些lncrna调控,已被报道响应非生物胁迫,这些GO项在本研究中被确定。为了确定两种基因型之间的相似性和差异性,比较了显著富集的GO项。在我们的研究中,在干旱胁迫和复浇水条件下,秦优8的GO项比Q2更显著,说明两个基因型对干旱胁迫和复浇水的响应存在差异。我们发现Q2中磷酸化蛋白磷酸酶活性、蛋白质代谢过程和序列特异性DNA结合显著且特殊地富集,而秦油8中单生物代谢过程、光合作用和氧化还原酶活性显著且特殊地富集。此外,lncrna已被认为是响应干旱胁迫途径的强大调节因子,包括核糖体、光合作用[73],以及植物激素信号转导[42,74]。核糖体途径在两种基因型中同时显著,且差异lncRNA靶基因在该途径中上调。值得注意的是,植物激素信号转导通路在Q2中显著而特殊地富集,共有36个mrna与41个lncrna共表达被分配到植物激素信号转导中。此外,许多下调mrna与内质网中参与蛋白质加工的lncrna共表达,上调mrna与光合作用的lncrna共表达在沁优8中显著且特别富集。共有7个和5个与lncrna共表达的mrna分别被分配到光合作用和光合天线蛋白中。参与光合作用的基因普遍因干旱而下调[75,76]。与DS处理相比,RW处理下秦优8号的光合作用(ko00195)和光合天线蛋白(ko00196)通路显著富集,说明短期干旱胁迫对Q2的光合作用没有造成显著损伤,但对秦优8号有一定损伤。在秦优8号中,参与光合作用的基因(ko00195)和光合天线蛋白(ko00196)上调,恢复正常的光合作用,从而恢复生长。这些结果表明,lncrna可以通过调控基因网络在许多响应干旱胁迫和复水的生物过程中发挥作用,且与lncrna共表达的上调和下调mrna参与不同的代谢途径,参与不同的调控机制。综上所述,我们的结果表明,两种不同的基因型执行不同的机制来调节干旱胁迫和复水处理的反应。
利用lncRNA-mRNA共表达网络分析植物信号转导
对共表达网络的调控可能是lncrna应对应激的可能机制[18,31]。虽然发现大量的lncrna与许多生物学过程相关,但通过lncRNA-mRNA共表达分析,筛选出了有限数量的lncrna参与植物激素信号转导。在Q2中,植物激素信号转导共表达网络包含157个匹配的lncRNA-mRNA对,其中41个lncrna和36个mrna(图2)。8a和附加文件8).秦右8的植物激素信号转导共表达网络由120个lncrna和51个mrna组成,其中352对匹配的lncRNA-mRNA(图2)。8b和附加文件8).参与植物激素信号转导的lncRNAs在两种基因型中与靶基因表达方向一致,证明lncRNAs的表达促进了靶基因的功能。在这一途径中,两种基因型中差异表达的lncRNAs的靶基因均参与生长素、细胞分裂素、赤霉素和脱落酸信号通路。乙烯和水杨酸信号通路相关的部分差异lncrna的靶基因在Q2中特异性表达,而BR和茉莉酸两种信号通路相关的差异lncrna的靶基因在沁油8中特异性表达。在这些信号通路中,与ABA信号通路相关的mrna(与差异表达的lncRNAs共表达)多于其他植物激素信号通路,这与以往研究认为ABA是植物应对干旱胁迫的预警信号一致[77,78]。
生长素(IAA)作为一种植物激素,对植物的信号传递、运输、生长和发育至关重要[79]。生长素结合运输抑制反应1/生长素信号F-BOX蛋白(TIR1/AFBs)和生长素/吲哚-3-乙酸(Aux/IAA)蛋白。当IAA水平较低时,Aux/IAA蛋白与生长素反应因子(ARF)形成异二聚体抑制基因转录。相反,Aux/IAA蛋白被降解,导致ARF转录调控和生长素反应基因表达的降低[80]。目前IAA早期反应基因主要包括生长素/吲哚-3-乙酸(Aux/IAA)、Gretchen Hagen 3 (GH3)和Small AUXIN - up RNAs (SAUR),这些都是生长素诱导的原始表达基因[81]。其中Aux/IAA蛋白在IAA信号转导通路中起着非常重要的作用,在信号转导通路中起转录抑制因子的作用[82]。GH3基因编码一种生长素结合酶,该酶作为生长素的反馈调节器,通过降低有益的生长素水平[83]。在Q2中,IAA信号转导共表达网络包含21对匹配的lncRNA- mRNA对,包括16个lncRNA和3个mRNA。在Qinyou8中,IAA信号转导共表达网络包含56对匹配的lncRNA- mRNA对,其中包括46个lncRNA和12个mRNA。干旱胁迫和复水调节了基因的表达辅助/ IAA(Q2中有1个差异表达mRNA与lncrna共表达,Qinyou8中有6个差异表达mRNA与lncrna共表达)GH3(Q2中有1个差异表达mRNA与lncRNAs共表达,Qinyou8中有3个差异表达mRNA与lncRNAs共表达)两种基因型中的基因。Q2下调XLOC_042431, XLOC_071559, XLOC_095305, XLOC_100682, XLOC_019521和XLOC_042894,针对下调的BnaC06g05090D(编码辅助/ IAA),可能积极参与调控IAA信号转导通路。此外,下调XLOC_098397、XLOC_034532和XLOC_038342,靶向下调BnaA05g14780D(编码GH3),促进有益生长素的水平。提示这些lncrna在Q2中表达下调导致IAA信号增强,可能通过细胞增大加速营养生长。在Qinyou8中,上调了XLOC_017878、XLOC_042549和XLOC_028678,靶向上调了BnaC01g06240D、BnaC03g78000D和BnaC08g43830D(编码辅助/ IAA),分别。另外,上调XLOC_017878,靶向上调BnaA09g42140D和BnaC08g34560D(编码GH3).这些lncrna在Qinyou8中的表达上调导致IAA信号减弱,可能会抑制营养生长。
细胞分裂素(Cytokinin, CK)在植物的多种生理功能中发挥重要作用,如促进细胞分裂、诱导芽层形成和促进其生长[79]。细胞分裂素信号是基于双组分信号系统(TCS),主要由拟南芥组氨酸激酶,拟南芥组氨酸磷转移蛋白(AHPs)和拟南芥响应调节器(ARRs)。首先,细胞分裂素受体与细胞分裂素结合,然后与自磷酸化产物结合。随后,它通过跨膜转运将磷酸基转移到细胞质的磷酸转移酶上;磷酸化后的AHPs进入细胞核,将磷酸基转移到响应调控因子上,从而诱导基因表达,调控植物生长发育[84]。b型反应调控因子(B-ARR)是细胞分裂素信号的正向调控因子,a型反应调控因子(a - arr)是下游信号,是细胞分裂素信号的负向调控因子,同时抑制B-ARR的信号传递[85]。在Q2中,CK信号转导共表达网络包含7对匹配的lncRNA-mRNA对,其中7对lncrna, 3对mrna。BnaA01g17750D参与编码下调B-ARR基因被下调的XLOC_075476和XLOC_074677靶向,说明下调的XLOC_075476和XLOC_074677可能减弱CK信号,从而抑制Q2幼苗的生长。在Qinyou8中,IAA信号转导共表达网络包含27个匹配的lncRNA- mRNA对,其中包括25个lncRNA和5个mRNA。下调的BnaC06g18770D参与编码A-ARR基因被9个下调的lncrna靶向。提示沁优8号的9个下调lncrna可能增强CK信号,有利于油菜幼苗生长。
赤霉素(Gibberellin, GA)在植物生长发育的各个阶段都发挥着重要作用,参与调控植物生长发育的各种生理过程。最显著的效果之一是促进节间伸长,从而促进植物生长[86]。赤霉素不敏感侏儒(GID1受体是一种可溶性蛋白质,定位于细胞质和细胞核。GID1蛋白可特异性与活性GA结合,进一步与DELLA蛋白结合形成GID1-GA-DELLA [87]。GID1-GA-DELLA通过介导DELLA蛋白降解或抑制其活性,将DELLA蛋白从GA反应系统中解抑制,进而激活GA反应基因[88]。当GA水平较低时,GID1不与GA结合,使DELLA蛋白与赤霉素反应基因结合并抑制其活性,从而抑制植物生长。当GA处于高水平时,GID1可以感知GA信号,形成GID1-GA-DELLA降解DELLA蛋白,抑制DELLA对GA信号的抑制[89]。在Q2中,GA信号转导共表达网络包含8对匹配的lncRNA-mRNA对,包括8个lncrna和4个mrna。在Qinyou8中,GA信号转导共表达网络包含31对匹配的lncRNA-mRNA对,其中包括30个lncrna和4个mrna。两种mrna (BnaA07g19530D和BnaCnng55170D)与lncrna共表达,在两种基因型中都下调,并对干旱胁迫和再浇水有反应,被注释到GID1。下调GID1基因阻止了与GA和DELLA蛋白复合物的形成,导致DELLA蛋白与赤霉素反应基因结合,从而抑制了幼苗的生长。
ABA作为植物感知胁迫的信号分子[90],在防止植物失水、调节气孔开放、维持细胞通透性平衡等方面发挥重要作用[90]。ABA结合其受体PYR/PYL/RCAR (pyrabactin resistant/PYR-like/regulatory component of ABA),抑制PP2C (protein phosphatases type-2C)的活性,从而导致下游SnRK2(蔗糖非发酵1相关亚家族2 kinase)的自磷酸化和下游ABF转录因子的磷酸化,调控胁迫相关基因的表达[91,92]。BnaC07g44670D与ABF (AT4G34000)基因同源拟南芥,已被报道为ABA信号通路的重要基因[93]。在Q2中,ABA信号转导共表达网络包含119对匹配的lncRNA-mRNA对,其中37个lncrna, 24个mrna。在Qinyou8中,ABA信号转导共表达网络包含207对匹配的lncRNA-mRNA对,其中包括73个lncrna和25个mrna。在我们的研究中,我们发现与BnaC07g44670D共表达的lncrna在两种基因型之间存在差异。与BnaC07g44670D共表达的XLOC_074677、XLOC_093758、XLOC_044363和XLOC_076449在两种基因型中均下调表达。XLOC_081156与BnaC07g44670D共表达,仅在Qinyou8中表达下调。这些结果表明,lncrna可能参与了“植物激素信号转导”,并在两种基因型中受到不同的调控。干旱胁迫下ABF的上调可引发气孔关闭和种子休眠[94]。ABA信号减弱,可能缓解ABA对油菜幼苗生长的抑制作用。
转录因子在干旱胁迫和复水条件下发挥作用
转录因子已被证实在调节植物干旱胁迫中起着至关重要的作用[89,95,96]。此前,MYB [97,98], bHLH [99,One hundred.], wrky [101], erf [102], nfy [103], gata [104], pif [105,106], aba诱导的bhlh型转录因子(aib) [107], HSF [108], bZIP [109]被认为对非生物压力有反应。在本研究中,这些tf在干旱胁迫和再浇水条件下被诱导表达。
有研究表明,MYB参与了ABA诱导的非生物胁迫响应,参与调控干旱胁迫响应的蜡合成途径[110],并通过促进气孔关闭和减少叶片失水来提高植物的抗旱性[111,112]。目前,关于bHLH tf在植物干旱胁迫响应中的可能作用的研究主要集中在气孔发育、毛状体发育、根毛发育以及ABA敏感性[99]。bhlh型转录因子AtAIB依赖ABA信号转导途径参与抗旱性响应拟南芥(113]。发现过表达OsbHLH148在水稻中诱导上调OsDREB,OsJAZ而其他相关基因参与了应激反应,并参与了茉莉酸信号通路,表明OsbHLH148干旱胁迫下调控茉莉酸信号通路相关基因的表达[114]。在Q2和Qinyou8中表达最多的转录因子分别是MYB和bHLH。这可能是两种基因型对干旱胁迫和复水反应的调控方式不同的重要原因之一。核因子Y (NF-Y)由三个不同的亚基(NF-YA, NF-YB和NF-YC)组成。我们发现拟南芥在干旱胁迫下,NFYA5转录体以ABA依赖的方式强烈诱导,在干旱胁迫下,NFYA5在水稻中过表达拟南芥通过控制气孔孔径来抵抗干旱胁迫,从而减少叶片失水[115]。在本研究中,NFY分别在两种基因型中共表达的tf中所占比例最大。综上所述,两种基因型对干旱胁迫和复浇水的响应方式不同,这有利于理解响应干旱胁迫的分子调控机制,加强我们对干旱调控网络的认识。
LncRNA HID1 (HIDDEN TREASURE 1)通过调节PIF3(光敏色素相互作用因子3)的表达,被证明是种子光形态发生的重要参与者[116]。在大白菜里(油菜。对),部分tf受到lncrna对热应激反应的顺式调控[47]。在水分胁迫和恢复过程中,189个tf对应163个差异表达的lncrnac . songorica,有一个bZIP基因被预测为lncRNA的靶基因(MSTRG.17203.1) [72]。这些研究表明lncrna与tf之间存在调控关系。共有20个和24个不同家族的57个和94个tf分别与两种基因型的lncrna共表达。虽然秦优8共表达的TF和TF家族数量高于Q2,但其发生模式具有可比性。与HSF、NF-YA、ERF、bHLH、MYB、GATA和bZIP家族相关的tf在第二季度中大量出现。同样,HSF、NF-YA、ERF、bHLH、MYB、WRKY和bZIP TF家族在秦油8号中富集。在Q2特异性表达的tf中,预测一个PAT1基因(BnaC07g49170D)为XLOC_096112靶基因,预测一个TGA3 (BnaC05g17700D)为XLOC_032712靶基因。在Qinyou8中,一个bHLH69基因(BnaC01g07430D)被预测为10个lncrna的靶基因。在我们的研究中,我们还发现一个bZIP基因(BnaA09g03330D)被预测为Q2中7个lncrna的靶基因,两个bZIP基因(BnaA09g03330D和BnaA09g19470D)被预测为Qinyou8中35个lncrna的靶基因。这一结果表明,lncrna的调控可能在干旱胁迫响应中起着至关重要的作用。 This would be the next step to explore.
其他lncrna参与干旱胁迫和再浇水
其他一些候选的功能性和调控lncrna已被检测出响应干旱胁迫和再浇水。我们发现XLOC_052298和XLOC_094954在耐受基因型中表达下调,在敏感基因型中表达上调,XLOC_012868在耐受基因型中表达上调,在敏感基因型中表达下调。我们注意到一些与3个lncrna同时定位的mrna主要分为两类,即信号传输和防御/应激反应。
干旱信号可以通过膜受体活性的变化来感知。此时,细胞外信号转化为细胞内信号,可导致Ca等第二信使的产生2 +,糖,ROS和IP3.输送系统[117],触发磷酸化/去磷酸化反应并传递信息,从而激活特定的转录因子。转录因子与相应的顺式作用元件结合后,调控干旱胁迫响应基因的表达[118]。丝氨酸/苏氨酸蛋白磷酸酶是催化蛋白质去磷酸化的主要酶之一[119]。已有研究表明丝氨酸/苏氨酸蛋白磷酸酶与植物脱落酸诱导的抗逆转信号转导调控有关[120,121]。BES1/BZR1转录因子作为BR信号的核心成分,被BR信号激活,与生长发育相关基因启动子的E-box (CANNTG)或BRRE元件(CGTGT/CG)结合,调控靶基因的表达[122,123,124]。BRs是一种重要的植物激素,通过改善植物渗透调节和影响抗氧化酶活性来提高植物的抗旱性[125,126]。在干旱胁迫下,海藻糖等可溶性糖的积累具有稳定蛋白质和细胞膜的作用,有利于调节植物渗透压与细胞外的平衡[127,128]。赤霉素(GA)活性降低,蒸腾作用减少的植物受叶片干燥的影响较小,从而保持较高的能力和回收率[129]。在本研究中,与XLOC_052298共定位的BnaC02g25020D、BnaC02g25150D和BnaC02g25200D分别与-海藻糖-磷酸合成酶、过氧化物酶和BES1/BZR1同源蛋白相关。BnaC09g24140D与XLOC_094954共定位,与丝氨酸/苏氨酸蛋白磷酸酶相关。与XLOC_012868共定位的BnaA03g47140D和BnaA03g47400D分别与超氧化物歧化酶、赤霉素氧化酶相关。与XLOC_012868共定位的BnaA03g47370D和BnaA03g47380D与bHLH相关。因此,我们认为这些lncRNAs可能与干旱胁迫和再浇水有关。然而,我们对这些失调lncrna在干旱响应中的潜在功能的了解仍然有限。因此,值得进一步研究。
非常重要。
结论
本研究在Q2中检测到5546个下调mrna,在Qinyou8中检测到6997个上调mrna,而在Qinyou8中分别检测到7824个和10251个;在Q2中检测到369个下调的lncrna, 108个上调的lncrna,而在Qinyou8中分别检测到449个和257个。此外,构建lncrna与mrna之间的相互作用网络,并基于lncRNA-mRNA相互作用网络研究lncrna的功能。本研究发现,在干旱胁迫和再浇水条件下,在第二季,KEGG通路“植物激素信号转导”中,有4个lncRNAs对ABA信号通路有显著的注解。8个mrna与3个lncrna共定位,主要分为干旱胁迫和再浇水下的信号转运和防御/应激反应。同时,在干旱胁迫和复水处理下,秦优8号的光合相关基因普遍上调。综上所述,上述结果表明干旱胁迫和复浇水影响了部分lncRNAs的表达,lncRNAs与mrna之间的相互调节可能引发了干旱胁迫和复浇水的反应。虽然这些发现为lncrna在干旱胁迫和再浇水反应中的潜在作用提供了新的信息,但还需要进一步的研究来阐明显著失调的lncrna的分子机制。共表达网络表明lncRNAs和mRNAs的相互调节参与了干旱胁迫和再浇水的响应。
方法
植物材料、生长条件和处理
两种对比菜籽的种子(芸苔属植物显著L.)基因型、Q2(耐旱型)和秦优8(干旱敏感型)均来自中国农业科学院武汉油料作物研究所。通过分析水分胁迫下叶片的光合速率、叶绿素含量、类胡萝卜素含量、丙二醛含量和抗氧化活性,筛选出这两种对比型油菜基因型[130,131]。干旱胁迫下,Q2叶片净光合速率、相对含水量(RWC)、叶绿素含量、类胡萝卜素含量和叶片抗氧化活性均高于秦优8 [130,131,132,133]。
实验于2017年6月在25°C的温室中进行,光周期为光照16 h,暗8 h,湿度为83%。种子和土壤在花盆中的详细制备方法见Xiong等。132]。在进行干旱胁迫前,所有花盆均每日浇水至75% FC 18 d(三叶期)。试验处理条件如下:(1)对18 d生的植株进行水分亏缺处理,不浇水8 d(设为干旱胁迫,DS);(2) 18日龄植株缺水,7天不浇水至35% FC [133],然后复水1天至75% FC(设置为复水,RW)。实验采用完全随机设计,重复3次。处理8 d后,从每个重复中各处理5个个体(共12个样本)分别采集第3叶,分别快速保存于N液中2。
生理参数测定
以WW、DS和RW处理下各重复均匀的幼苗为试验材料,测定鲜重。
RNA提取,文库构建,Illumina测序
RNA的提取和纯度参照Hu等。[94]。每个样品取3 μg RNA生成cDNA文库并进行测序。通过PCR富集构建cDNA文库,在HiSeq X Ten上测序,测序reads长度为PE125。12个基因表达文库分别命名为DSQ2-1、DSQ2-2、DSQ2-3、RWQ2-1、RWQ2-2、RWQ2-3、DSQinyou8-1、DSQinyou8-2、DSQinyou8-3、RWQingyou8-1、RWQinyou8-2、RWQinyu8-3。文库的制备和深度测序由诺沃金生物信息技术合作公司(北京,中国)完成。在质量控制过程后获得的所有干净读取都保存在NCBI Sequence Read Archive中,ID为PRJNA574049,用于数据分析,如下节所示。
映射到参考基因组
参考基因组和基因模型注释文件可从基因组网站(http://brassicadb.org/brad/datasets/pub/Genomes/直接)。使用bowtie v2.0.6建立参考基因组索引,使用TopHat v2.0.9将成对的末端清洁reads与参考基因组对齐
基因表达水平的量化
Cuffdiff用于计算每个样本中lncrna和编码基因的FPKMs(每千碱基外显子每百万个映射片段的片段数)[134]。值是根据片段的长度和映射到这个片段的读取计数来计算的。基因fpkm由每个基因组转录本的fpkm之和计算。
微分表达式分析
Cuffdiff提供了统计例程,用于使用基于负二项分布的模型确定数字转录本或基因表达数据中的差异表达[134]。采用FPKM法测定各基因的表达强度[134],通过平均3个重复的表达数据进行计算。通过Cufflinks软件确认样品间差异表达的lncRNAs和mrna,阈值q值≤0.05,|log2(FPKM)比值|≥1。计算问值根据Trapnell等人。[134]。分别进行RWQ2/DSQ2和RWQinyou8/DSQinyou8处理。
lncRNA-mRNA共表达网络的构建
构建LncRNA-mRNA共表达网络,根据基因和lncrna特异性表达的归一化信号强度,识别蛋白编码基因与lncrna之间的相互作用[135]。我们根据Wang et al.(2018)构建了lncRNA-mRNA共表达网络[136]。首先,获得差异表达的lncrna和mrna的表达值。其次,从匹配的mRNA和lncRNA表达谱数据中,使用Pearson相关系数(PCC)评估差异表达的lncRNA和mRNA之间的相关性。lncRNA-mRNA对|PCC值≥0.95|和p< 0.05作为共调控的lncRNA-mRNA对。随后构建网络,网络节点为lncrna或mRNAs。总的来说,lncRNA-mRNA共表达网络最初是基于每个比较中的共表达lncRNA-mRNA对(RWQ2/DSQ2, RWQinyou8/DSQinyou8)构建的。最终,为了直观地显示lncrna和靶蛋白编码rna之间的关系,使用Cytoscape软件(3.7.1)构建了交互网络,这是一个用于可视化复杂网络的开源软件平台http://cytoscape.org/).
差异表达lncrna的靶基因功能分类
利用GOseq R包对与差异表达的lncrna共表达的靶基因进行基因本体(GO)富集分析,并校正基因长度偏倚。GO术语p值< 0.05为差异表达基因显著富集。我们使用KOBAS软件检测KEGG通路中与差异表达的lncrna共表达的靶基因的统计富集程度。最丰富的KEGG是根据更正的顺序p价值。一个纠正p值< 0.05为差异具有统计学意义。
存在分析
RNA样本经RNase-free DNase处理后,使用RevertAid First Strand cDNA Synthesis Kit (Fermentas, USA)生成cDNA。实时PCR在ABI 700平台上使用SYBR Green PCR Master Mix系统(Takara Co. Ltd, Japan)进行。每孔10 μl的反应体积中含有0.5 ng cDNA, 2.5 μl的正、反引物各含1.2 μM的混合物,5 μl的主混合物。PCR扩增程序为:95°C起始周期30 s;94℃变性30 s,引物60℃退火30 s, 72℃延伸1 min;最后,在72°C下再延长10分钟。随机选取的lncrna引物序列见附加文件9。每个PCR反应独立重复3次,取每个lncRNA的表达强度为平均值。
数据和材料的可用性
在当前研究中分析的数据集可在NCBI (SRA登录:PRJNA574049)存储库中的序列读取存档(SRA)中获得,https://www.ncbi.nlm.nih.gov/sra/PRJNA574049
缩写
- A-ARR:
-
a型响应调节器
- 阿坝:
-
脱落酸
- 沛富:
-
脱落结合因子
- 向来关注:
-
拟南芥组氨酸激酶
- 层次分析法:
-
拟南芥组氨酸磷转移蛋白
- 爱尔兰联合银行:
-
aba诱导的bhlh型转录因子
- 东盟地区论坛:
-
生长素反应因子
- 加勒比海盗:
-
拟南芥反应调节剂
- 辅助/ IAA:
-
生长素/吲哚-3-乙酸
- B-ARR:
-
b型响应调节器
- BES1 / BZR1:
-
bri1-乙基甲烷磺酸盐抑制剂1 /耐油菜杂唑1
- bHLH:
-
基本helix-loop-helix
- bZIP:
-
基本亮氨酸拉链域
- CBF /含有DREB:
-
C-repeat结合因子/脱水反应元件结合转录因子
- DRIR:
-
干旱诱导的lncRNA
- DS:
-
干旱胁迫
- 小块土地:
-
乙烯响应元件结合因子
- 舰队指挥官:
-
田间持水量
- FPKM:
-
每千碱基的片段数
- 遗传算法:
-
赤霉素酸
- GH3:
-
格雷琴hagen3
- GID1:
-
赤霉素不敏感侏儒1
- 走:
-
基因本体论
- HID1:
-
隐藏宝藏1
- HSF:
-
热休克因子
- 国际宇航科学院:
-
Indole-3-acetic酸
- IP3:
-
肌醇1,4,5 -三磷酸
- KEGG:
-
京都基因和基因组百科全书
- LncRNAs:
-
长非编码rna
- MYB:
-
成髓细胞瘤
- MYC:
-
Myelocytomatosis
- PCC:
-
皮尔逊相关系数
- PIF3:
-
光敏色素相互作用因子3
- PP2C:
-
2c型蛋白磷酸酶
- PYR /所有/ RCAR:
-
抗Pyrabactin /类pyr / ABA的调节成分
- 存在:
-
实时定量PCR
- RNA-seq:
-
RNA序列
- ROS:
-
活性氧
- RW:
-
Re-watering
- RWC:
-
相对含水量
- 阿富汗二月:
-
小生长素上升rna
- SnRK2:
-
蔗糖非发酵1相关亚家族2激酶
- 塔塔:
-
双组分信号系统
- TFs:
-
转录因子
- TIR1 /空军基地:
-
运输抑制反应1 /生长素信号f-box蛋白
- WW:
-
有实力的
参考文献
- 1.
王伟,王晓明,王晓明。植物对干旱、盐度和极端温度的响应:植物抗逆性基因工程研究进展。足底。2003;218(1):1 - 14。https://doi.org/10.1007/s00425-003-1105-5。
- 2.
Breshears DD, Cobb NS, Rich PM, Price KP, Allen CD, Balice RG等。区域植被死亡对全球变化型干旱的响应。中国科学院学报(自然科学版),2005;26(4):344 - 344。https://doi.org/10.1073/pnas.0505734102。
- 3.
Coumou D, Robinson A.受月度极端高温影响的全球陆地面积的历史和未来增加。环境科学与技术,2013;23(3):34018-23。https://doi.org/10.1088/1748-9326/8/3/034018。
- 4.
李文杰,李志强,李志强。气候变化对植物分子胁迫响应的影响。植物科学进展,2010;15(12):664-74。https://doi.org/10.1016/j.tplants.2010.08.002。
- 5.
Dai A.在观测和模型中,全球变暖导致干旱增加。张国昌。2013;3(1):52-8。https://doi.org/10.1038/nclimate1633。
- 6.
方玉军,熊丽珍。干旱响应的一般机制及其在植物抗旱性改良中的应用。中国生物医学工程学报,2015;29(4):344 - 344。https://doi.org/10.1007/s00018-014-1767-0。
- 7.
Rabara RC, Tripathi P, Reese RN, Rushton DL, Alexander D, Timko MP,等。烟草干旱胁迫响应揭示了茄科作物改良的新靶点。BMC Genomics. 2015;16:484。https://doi.org/10.1186/s12864-015-1575-4。
- 8.
Fracasso A, Trindade LM, Amaducci S.通过RNA-Seq揭示两种不同WUE基因型高粱的抗旱策略。BMC植物生物学2016;16:115。https://doi.org/10.1186/s12870-016-0800-x。
- 9.
熊林,舒梅克,朱建科。寒冷、干旱和盐胁迫下的细胞信号。《植物科学》2002;14(增刊):165-83。https://doi.org/10.1105/tpc.000596。
- 10.
黄桂琴,马世林,白丽萍,张玲,马宏,贾鹏,等。植物在寒冷、盐和干旱胁迫下的信号转导。Mol生物学杂志2012;39(2):969-87。https://doi.org/10.1007/s11033-011-0823-1。
- 11.
杨晓明,李志强,李志强,等。工程植物抗非生物胁迫的研究进展。生物技术。2005;16(2):123-32。https://doi.org/10.1016/j.copbio.2005.02.001。
- 12.
Mittler R, Finka A, Goloubinoff P.植物是如何感知热量的?生物化学学报,2012;37(3):118-25。https://doi.org/10.1016/j.tibs.2011.11.007。
- 13.
王志刚,王志刚,王志刚。植物干旱胁迫的研究进展。农业可持续发展,2009;29(1):185-212。https://doi.org/10.1051/agro:2008021。
- 14.
Mercer TR, Dinger ME, Mattick JS。长非编码rna:对功能的洞察。《中国日报》,2009;10:155-9。https://doi.org/10.1038/nrg2521。
- 15.
王晓燕,王晓燕,王晓燕,等。分子生物学:RNA鉴别。大自然。2012;482:310-1。https://doi.org/10.1038/482310a。
- 16.
孔俊泰,古龙丽D,李俊杰。长非编码rna:过去,现在和未来。遗传学。2013;193(3):651 - 69。https://doi.org/10.1534/genetics.112.146704。
- 17.
孙卡尔R,钦努沙米V,朱军,朱建科。小rna在植物非生物胁迫反应和营养剥夺中扮演重要角色。植物科学进展,2007;12(7):301-9。https://doi.org/10.1016/j.tplants.2007.05.001。
- 18.
Ben Amor B, Wirth S, Merchan F, Laporte P, D 'Aubenton-Carafa Y, Hirsch J,等。新型长链非蛋白质编码rna参与拟南芥分化和应激反应。基因组学报,2009;19(1):57-69。https://doi.org/10.1101/gr.080275.108。
- 19.
Caley D, Pink R, Trujillano D, Carter D. Long非编码rna,染色质和发育。ScientificWorldJournal。2010; 10:90 - 102。https://doi.org/10.1100/tsw.2010.7。
- 20.
吴俊华,吴鸿辉。lincrna加入多能性联盟。中国科学,2010;42(12):1035-6。https://doi.org/10.1038/ng1210-1035。
- 21.
Nagano T, Fraser P. No-nonsense功能的长非编码rna。细胞。2011;145(2):178 - 81。https://doi.org/10.1016/j.cell.2011.03.014。
- 22.
丁俊,卢强,欧阳阳,毛华,张鹏,姚杰,等。一种长链非编码RNA调节光周期敏感雄性不育,这是杂交水稻的基本组成部分。中国科学:自然科学(英文版),2012;29(3):344 - 344。https://doi.org/10.1073/pnas.1121374109。
- 23.
金ed, Sung S. Long非编码RNA:揭示基因调控网络的隐藏层。植物科学进展,2012;17(1):16-21。https://doi.org/10.1016/j.tplants.2011.10.008。
- 24.
莫兰V, Perera R, Khalil A.哺乳动物长链非编码rna的新兴功能和机制范式。中国生物医学工程学报,2012;40(14):6391-400。https://doi.org/10.1093/nar/gks296。
- 25.
Kornienko AE, Guenzl PM, Barlow DP, Pauler FM。通过长链非编码RNA转录的基因调控。中国生物医学工程杂志,2013;11(1):59。https://doi.org/10.1186/1741-7007-11-59。
- 26.
狄晨,袁建平,吴勇,李荣荣,林海霞,胡林,等。胁迫响应型lncrna的特征拟南芥通过整合表达、表观遗传和结构特征。植物学报,2014;30(5):848-61。https://doi.org/10.1111/tpj.12679。
- 27.
朱庆华,王文敏,王文敏,王文敏,朱庆华,王文敏。长链非编码rna对尖孢镰刀菌侵染的响应拟南芥。植物学报。2014;21(2):574-84。https://doi.org/10.1111/nph.12537。
- 28.
吴娟,冈田T,福岛T, Tsudzuki T, Sugiura M, Yukawa Y.一种新型的低氧胁迫响应长链非编码RNA转录酶III拟南芥。RNA生物学,2012;9(3):302-13。https://doi.org/10.4161/rna.19101。
- 29.
刘娟,荣昌,徐娟,王辉,邓松,Bernad L,等。全基因组分析揭示了长基因间非编码rna的调控拟南芥。植物科学进展。2012;24(11):433 - 45。https://doi.org/10.1105/tpc.112.102855。
- 30.
赵霞,刘霞,郭超,顾娟,肖凯。小麦microrna的鉴定与鉴定(小麦l)在缺磷条件下。植物生物化学学报。2013;22(1):113-23。https://doi.org/10.1007/s13562-012-0117-2。
- 31.
张伟,韩志新,郭清良,刘勇,郑玉霞,吴福龙,等。玉米长链非编码rna对干旱胁迫响应的鉴定。PLoS One. 2014;9(6):e98958。https://doi.org/10.1371/journal.pone.0098958。
- 32.
李玲,刘志刚,王秀珍,刘志刚,等。玉米长链非编码rna的全基因组发现和表征。中国生物医学工程学报。2014;15(2):R40。https://doi.org/10.1186/gb-2014-15-2-r40。
- 33.
吕勇,梁志科,葛敏,齐卫文,张泰峰,林峰,等。玉米氮响应基因间和内含子长非编码rna的全基因组鉴定和功能预测(玉米l .)。BMC基因组学杂志,2016;17(1):350。https://doi.org/10.1186/s12864-016-2650-1。
- 34.
张玉春,廖建勇,李志颖,余勇,张建平,李庆峰,等。全基因组筛选和功能分析发现了大量参与水稻有性生殖的长链非编码rna。中国生物医学工程学报。2014;15(12):512。https://doi.org/10.1186/s13059-014-0512-1。
- 35.
辛敏,王勇,姚勇,宋楠,胡震,秦东,等。利用微阵列分析和SBS测序鉴定小麦长链非蛋白编码rna对白粉病感染和热胁迫的响应。植物学报。2011;11(1):61。https://doi.org/10.1186/1471-2229-11-61。
- 36.
张永春,陈永强。长链非编码rna:植物发育中的新调控因子。生物化学学报。2013;36(2):111-4。https://doi.org/10.1016/j.bbrc.2013.05.086。
- 37.
帅鹏,梁东,唐松,张震,叶春春,苏勇,等。新型干旱响应lincRNAs的全基因组鉴定和功能预测杨树trichocarpa。中国生物医学工程学报,2014;26(3):344 - 344。https://doi.org/10.1093/jxb/eru256。
- 38.
郑培杰,郑洪华,郑德华,何淑娟,金娟。水稻干旱响应非编码rna及其靶基因的转录组分析。BMC Genomics. 2016;17(1):563。https://doi.org/10.1186/s12864-016-2997-3。
- 39.
吕小科,陈小强,穆敏,王俊杰,王小刚,王德龙,等。棉花长链非编码rna的全基因组分析及其对干旱胁迫的响应(陆地棉l .)。PLoS One. 2016;11(6):e0156723。https://doi.org/10.1371/journal.pone.0156723。
- 40.
齐霞,谢世杰,刘玉文,易峰,于俊杰。谷子对模拟干旱胁迫响应的基因和非编码rna的全基因组注释。中国生物医学工程学报,2013;29(4):457 - 457。https://doi.org/10.1007/s11103-013-0104-6。
- 41.
秦涛,赵海燕,崔鹏,Albesher N,熊丽敏。细胞核定位的长链非编码RNA增强了干旱和盐胁迫的耐受性。中国生物医学工程学报,2017;29(3):344 - 344。https://doi.org/10.1104/pp.17.00574。
- 42.
李世祥,于旭,雷宁,程志华,赵普军,何玉凯,等。木薯低温和/或干旱响应lncRNAs的全基因组鉴定和功能预测科学通报2017;7:45981。https://doi.org/10.1038/srep45981。
- 43.
李荣荣,夏玉生,李荣荣,白海红,Siddique KHM,郭鹏鹏。非编码rna在植物胁迫反应调控中的作用芸苔属植物作物。基因组学》2019。https://doi.org/10.1016/j.ygeno.2019.08.011。
- 44.
宋晓明,刘广峰,黄宗忠,段伟科,谭华伟,等。通过RNA-Seq分析,揭示了非抽头大白菜中基因的温度表达模式及其与lncrna的共表达。BMC Genomics. 2016;17:297。https://doi.org/10.1186/s12864-016-2625-2。
- 45.
张建峰,魏立军,姜军,Mason AS,李海军,等。全基因组鉴定,lncrna和mirna之间的假定功能和相互作用芸苔属植物物种。科学通报2018;8(1):4960。https://doi.org/10.1038/s41598-018-23334-1。
- 46.
Joshi RK, Megha S, Basu U, Rahman MH, Kav NNV。长链非编码rna的全基因组鉴定和功能预测菌核病sclerotiorum感染芸苔属植物显著。PLoS One. 2016;11(7):e0158784。https://doi.org/10.1371/journal.pone.0158784。
- 47.
王阿华,胡建辉,高晓波,陈光良,王广斌,林芳芳,等。长链非编码rna的全基因组分析揭示了大白菜耐热性的调控作用(油菜。对).科学通报2019;9:5002。https://doi.org/10.1038/s41598-019-41428-2。
- 48.
谢烨DJ,西田N,高田S,板桥E,高桥S,阿克特A,等。长非编码rna芸苔属植物拉伯L在春化之后。科学通报2019;9:9302。https://doi.org/10.1038/s41598-019-45650-w。
- 49.
张志强,张志强,张志强,等。油菜孢浆菌感染敏感和耐药的lncrna鉴定芸苔属植物显著携带抗性的品系从芜菁甘蓝中渗入。分子植物-微生物相互作用。2019;32(10):1360-77。
- 50.
Bhatia G, Singh A, Verma D, Sharma S, Singh K.在高温和干旱胁迫下lncRNAs调控作用的全基因组研究芸苔属植物juncea(印度芥菜)。Environ Exp Bot. 2020;171:103922。https://doi.org/10.1016/j.envexpbot.2019.103922。
- 51.
Miller CN, Harper AL, Trick M, Wellner N, Werner P, Waldron KW,等。解剖植物抗倒伏的复杂调控芸苔属植物显著。Mol Breed. 2018;38(3): 1-18。https://doi.org/10.1007/s11032-018-0781-6。
- 52.
Khalili M, Aboughadareh AP, Naghavi MR, Javad S.春季油菜的响应(芸苔属植物显著l)与水分亏缺胁迫相关的基因型。《农业科学》2012;4:1579-86。
- 53.
Müller T, Lentzsch P, Müller MEH。油菜籽叶片碳水化合物动态(芸苔属植物显著)干旱。中国农学通报,2012;32(3):344 - 344。https://doi.org/10.1111/j.1439-037x.2011.00502.x。
- 54.
张娟,Mason AS,吴娟,刘松,张晓超,罗涛,等。油菜耐水胁迫候选基因的鉴定(芸苔属植物显著).前沿植物科学,2015;6:1058。https://doi.org/10.3389/fpls.2015.01058。
- 55.
廖强,刘国忠,袁晓霞,康世林,苗荣,肖华,等。在编码-非编码基因共表达网络中长非编码RNA功能的大规模预测。中国生物医学工程学报,2011;39(9):3864-78。https://doi.org/10.1093/nar/gkq1348。
- 56.
Wilusz JE, Sunwoo H, Spector DL。长非编码RNA: RNA世界的功能惊喜。基因开发,2009;23(13):1494-504。https://doi.org/10.1101/gad.1800909。
- 57.
徐娟,张峰,高超,马晓峰,彭小林,孔德胜,等。视神经脊髓炎患者lncRNA和mRNA表达谱的芯片分析中国神经生物学杂志,2017;54(3):2201-8。https://doi.org/10.1007/s12035-016-9754-0。
- 58.
王TZ,刘M,赵毫克,陈RJ张WH。参与渗透胁迫和盐胁迫的长链非编码rna的鉴定和特征Medicago truncatula使用全基因组高通量测序。中国生物医学工程学报。2015;https://doi.org/10.1186/s12870-015-0530-5。
- 59.
马法希,莫达瑞西,卡里尔,伍德,BG,摩根,等。一种非编码RNA的表达在阿尔茨海默病中升高,并驱动β-分泌酶的快速前馈调节。医学杂志,2008;14:723-30。https://doi.org/10.1038/nm1784。
- 60.
张志刚,张志刚,张志刚,张志刚。反义RNA稳定化诱导转录基因沉默的研究进展酿酒酵母。细胞。2007;131(4):706 - 17所示。https://doi.org/10.1016/j.cell.2007.09.014。
- 61.
李文杰,李文杰,李文杰,李文杰。酵母GAL基因簇中ncRNA对组蛋白修饰和mRNA诱导的影响。生物化学学报。2008;32(5):685-95。https://doi.org/10.1016/j.molcel.2008.09.027。
- 62.
洪涛,王玉玲,林文明,Koegel AK, Kotake Y, Grant GD,等。细胞周期启动子内非编码rna的广泛和协调转录。王志刚。2011;43(7):621-9。https://doi.org/10.1038/ng.848。
- 63.
崔pathi V, Ellis JD,沈震,宋迪,潘强,瓦特,等。核保留的非编码RNA MALAT1通过调节SR剪接因子磷酸化来调节选择性剪接。生物化学学报。2010;39(6):925-38。https://doi.org/10.1016/j.molcel.2010.08.011。
- 64.
龚cg, Maquat LE。LncRNAs通过Alu元素与3 ' UTRs双工,激活stau1介导的mRNA衰变。大自然。2011;470(7333):284 - 8。https://doi.org/10.1038/nature09701。
- 65.
杨晓明,李志刚,杨晓明。AP2/ERF家族转录因子在植物非生物胁迫响应中的作用。生物化学学报,2011;1819(2):86-96。https://doi.org/10.1016/j.bbagrm.2011.08.004。
- 66.
Muthusamy M, Uma S, Suthanthiram B, Saraswathi M.抗旱易感香蕉叶片转录组中新型干旱胁迫响应长非编码rna的全基因组筛选(穆萨利用Illumina高通量测序技术对spp)栽培品种进行测序。植物学报,2015;9(5):279-86。https://doi.org/10.1007/s11816-015-0363-6。
- 67.
Marquardt S, Raitskin O, Wu Z,刘丰强,孙庆伟,Dean C.反义转录本拼接的功能后果COOLAIR在方法转录。中国生物医学工程学报,2014;54(1):156-65。https://doi.org/10.1016/j.molcel.2014.03.026。
- 68.
巴豆F, Ariel F, Simpson CG, Romero-Barrios N, Laporte P, Balzergue S,等。长链非编码RNA调节可选剪接调控因子拟南芥。科学通报。2014;30:166-76。https://doi.org/10.1016/j.devcel.2014.06.017。
- 69.
陈琳,史立林,蒋乃芬,汉扎达,瓦桑GM,朱春林,等。水稻对镉胁迫反应早期影响根系发育的长非编码rna的全基因组分析BMC基因组学。2018;19(1):460。https://doi.org/10.1186/s12864-018-4807-6。
- 70.
Huanca-Mamani W, Arias-Carrasco R, Cárdenas-Ninasivincha S, Rojas-Herrera M, Sepúlveda-Hermosilla G, Caris-Maldonado JC,等。在来自阿塔卡马沙漠的超干旱lluteño玉米中响应盐和硼胁迫的长非编码rna。基因(巴塞尔)。2018; 9(3): 170。https://doi.org/10.3390/genes9030170。
- 71.
陈建华,权美美,张德强。新型长链非编码rna的全基因组鉴定Populus tomentosa张力木、对生木和正常木木质部RNA-seq分析。足底。2014;241(1):125 - 43。https://doi.org/10.1007/s00425-014-2168-1。
- 72.
闫强,吴峰,闫志忠,李俊,马婷婷,张玉峰,等。差异共表达网络长非编码rna和mrnaCleistogenes songorica在水压力下和恢复期间。BMC植物生物学,2019;19(1):23。https://doi.org/10.1186/s12870-018-1626-5。
- 73.
王建新,林杰,阚建林,王辉,李小刚,杨秋生,等。新型干旱响应lncrna的全基因组鉴定和功能预测Pyrus betulifolia。基因(巴塞尔)。2018; 9(6): 311。https://doi.org/10.3390/genes9060311。
- 74.
张超,唐国军,彭旭,孙福林,刘士德,奚玉军。柳枝稷的长非编码rna (黍virgatumL.)在多重脱水应力下。中国生物医学工程学报,2018;18(1):79。https://doi.org/10.1186/s12870-018-1288-3。
- 75.
李志强,李志强,李志强,等。AtGenExpress全球应力表达数据集:UV-B光、干旱和冷胁迫响应的协议、评估和模型数据分析。植物学报,2007;20(2):347 - 353。https://doi.org/10.1111/j.1365-313X.2007.03052.x。
- 76.
袁松,刘文杰,张恩华,王明柏,梁宏海,林海辉。水分胁迫对大麦叶片主要PSII基因表达及蛋白质代谢的影响中国生物医学工程学报。2005;29(4):344 - 344。https://doi.org/10.1111/j.1399-3054.2005.00577.x。
- 77.
杨晓明,杨晓明。水分胁迫响应的基因表达与信号转导。植物科学进展。1997;21(2):327 - 324。https://doi.org/10.1104/pp.115.2.327。
- 78.
Schachtman DP, Goodger JQD。干旱下化学根梢信号。植物科学进展,2008;13(6):281-7。https://doi.org/10.1016/j.tplants.2008.04.003。
- 79.
Teale WD, Paponov IA, Palme K.生长素在作用:信号,运输和植物生长发育的控制。中国生物医学工程学报。2006;7(11):847-59。https://doi.org/10.1038/nrm2020。
- 80.
植物发育过程中的生长素代谢与稳态。发展。2013;140(5):943 - 50。https://doi.org/10.1242/dev.086363。
- 81.
黄志刚,李志刚,李志刚。生长素诱导的早期核蛋白基因编码。中国科学(d辑:自然科学),2001;26(1):1 - 6。https://doi.org/10.1073/pnas.91.1.326。
- 82.
王晓军,王晓军,王晓军。AUX/IAA蛋白是活性抑制因子,其稳定性和活性受生长素的调控。植物细胞学报,2001;13(12):2809-22。https://doi.org/10.1105/tpc.010289。
- 83.
Staswick PE, Serban B, Rowe M, Tiryaki I, Maldonado MT, Maldonado MC, Suza W.将氨基酸偶联到吲哚-3-乙酸的拟南芥酶家族的特征。植物学报。2005;17(2):616-27。https://doi.org/10.1105/tpc.104.026690。
- 84.
黄海燕,徐志军,Müller B.细胞分裂素信号通路。植物学报,2012;https://doi.org/10.1146/annurev-arplant-042811-105503。
- 85.
Müller B.一般信号特异性反应:细胞分裂素和环境依赖性细胞反应。应用物理学报,2011;36(10):373 - 388。https://doi.org/10.1093/jxb/erq420。
- 86.
赤霉素的生物合成及其对植物发育的调控。植物生物学(Stuttg)。2006; 8(3): 281 - 90。https://doi.org/10.1055/s-2006-923882。
- 87.
张志林,张志林,张志林,张志林,张志林,张志林,张志林,等。早期赤霉素信号转导中DELLA直接靶点的全球分析拟南芥。植物学报。2007;19(10):3037-57。https://doi.org/10.1105/tpc.107.054999。
- 88.
Fleet CM, Sun TP。DELLAcate平衡:赤霉素在植物形态发生中的作用。植物学报,2005;8(1):77-85。https://doi.org/10.1016/J.PBI.2004.11.015。
- 89.
朱镕基JK。盐和干旱胁迫在植物中的信号转导。植物科学进展。2002;29(1):344 - 344。https://doi.org/10.1146/annurev.arplant.53.091401.143329。
- 90.
张欣,竹宫A,木下T,岛崎K.一氧化氮通过脱落酸信号通路抑制Vicia保护细胞的蓝光特异性气孔开放。植物生理学报。2007;48(5):715-23。https://doi.org/10.1093/pcp/pcm039。
- 91.
卡特勒SR,罗德里格斯PL,芬克尔斯坦RR,艾布拉姆斯SR.脱落酸:核心信号网络的出现。植物科学进展。2010;36(1):651-79。https://doi.org/10.1146/annurev-arplant-042809-112122。
- 92.
Ben-Ari G.经济作物ABA信号转导机制:以拟南芥为例。植物细胞学报,2012;31(8):1357-69。https://doi.org/10.1007/s00299-012-1292-2。
- 93.
王鹏,杨春林,陈宏,宋正大,张旭,王金杰。植物抗旱性的转录组基础芸苔属植物显著L.科学通报2017;7:40532。https://doi.org/10.1038/srep40532。
- 94.
胡海辉,熊丽珍。基因工程和抗旱作物育种。植物科学进展。2014;29(5):715 - 41。https://doi.org/10.1146/annurev-arplant-050213-040000。
- 95.
干旱胁迫响应与耐受性相关的基因网络。中国机械工程学报,2007;32(2):379 - 379。https://doi.org/10.1093/jxb/erl164。
- 96.
张学军,刘晓霞,张东峰,唐海军,孙bc,等。通过对干旱条件下玉米自交系基因表达的全基因组鉴定,揭示了转录因子在抗旱性中的重要意义。公共科学学报,2017;12(7):e0179477。https://doi.org/10.1371/journal.pone.0179477。
- 97.
申东杰,文世杰,韩s,金bg, Park SR, Lee SK,等。的表达StMYB1R-1一种新的马铃薯单myb样结构域转录因子,提高了马铃薯的耐旱性。中国生物医学工程学报,2011;29(1):344 - 344。https://doi.org/10.1104/pp.110.163634。
- 98.
毕海辉,Luang S,李勇,Bazanova N, Morran S,宋志华,等。参与调控角质层生物合成的小麦干旱响应MYB转录因子的鉴定和鉴定。中国科学(d辑),2016;29(3):344 - 344。https://doi.org/10.1093/jxb/erw298。
- 99.
王晓明,王志强,王志强,王志强,等。植物转录因子在干旱适应中的作用。植物科学进展(英文版);https://doi.org/10.1016/j.plantsci.2014.02.010。
- One hundred.
董勇,王晓鹏,韩旭,唐松,刘松,夏晓丽,尹伟林。一个新的bHLH转录因子PebHLH35从胡杨通过调节气孔发育、光合作用和生长,使植物具有耐旱性拟南芥。生物化学学报。2014;42(1):453-8。https://doi.org/10.1016/j.bbrc.2014.05.139。
- 101.
Okay S, Derelli E, Unver T.面包小麦WRKY转录因子在干旱胁迫下的转录组范围鉴定。中国生物医学工程学报。2014;29(5):344 - 344。https://doi.org/10.1007/s00438-014-0849-x。
- 102.
Trujillo LE, Sotolongo M, Menéndez C, Ochogavía ME, Coll Y, Hernández I,等。SodERF3是一种新型的甘蔗乙烯反应因子(ERF),在烟草植株中过表达时,可以增强耐盐性和耐旱性。植物物理学报。2008;49(4):512-25。https://doi.org/10.1093/pcp/pcn025。
- 103.
郭志勇,阮宏杰,徐东,阮海涛。大豆全基因组表达分析NF-Y基因揭示了发育和干旱响应的潜在功能。中国生物医学工程学报,2015;29(3):344 - 344。https://doi.org/10.1007/s00438-014-0978-2。
- 104.
李文杰,李志强,李志强,等。非生物胁迫对水稻GATA转录因子选择性剪接形式调控的影响。植物科学,2017;8:1944。https://doi.org/10.3389/fpls.2017.01944。
- 105.
高原,姜伟,戴勇,肖宁,张长青,李华,等。玉米光敏色素相互作用因子3提高了水稻的耐旱性和耐盐性。中国生物医学工程学报,2015;29(4):344 - 344。https://doi.org/10.1007/s11103-015-0288-z。
- 106.
工藤M, Kidokoro S,吉田T, Mizoi J, Todaka D, Fernie AR,等。DREB和PIF转录因子的双过表达提高了转基因植物的抗旱性和细胞伸长。植物学报,2017;15(4):458-71。https://doi.org/10.1111/pbi.12644。
- 107.
刘长青,张小科,张凯,安华,胡克宁,文杰,等。甘蓝型油菜根系和叶片转录谱对干旱胁迫响应的比较分析。中华分子化学杂志,2015;16(8):18752-77。https://doi.org/10.3390/ijms160818752。
- 108.
郭敏,刘建辉,马霞,罗晓东,龚志华,陆明明。植物热胁迫转录因子(HSFs)的结构、调控及其对非生物胁迫的响应。前沿植物科学,2016;7:114。https://doi.org/10.3389/fpls.2016.00114。
- 109.
康灿,翟华,何淑珍,赵宁,刘成昌。一种新的甘薯bZIP转录因子基因IbbZIP1,在转基因中涉及耐盐和耐旱拟南芥。植物细胞学报,2019;38(11):1373-82。https://doi.org/10.1007/s00299-019-02441-x。
- 110.
崔fq, Brosché M, Lehtonen MT, Amiryousefi A,徐ej, Punkkinen M,等。解剖脱落酸信号通路参与角质层形成。植物学报。2016;9(6):926-38。https://doi.org/10.1016/j.molp.2016.04.001。
- 111.
梁YK, Dubos C, Dodd IC, Holroyd GH, Hetherington AM, Campbell MM。在MYB61,一种R2R3-MYB转录因子,控制气孔孔径拟南芥。中国生物学报,2005;15(13):1201-6。https://doi.org/10.1016/j.cub.2005.06.041。
- 112.
郑春,徐宗杰,韩文文,具玉杰,金忠,宋思,等。过度的AtMYB44增强气孔闭合,赋予转基因拟南芥抗非生物胁迫能力。植物科学进展。2008;26(2):344 - 344。https://doi.org/10.1104/pp.107.110981。
- 113.
李红梅,孙建强,徐玉霞,姜海林,吴晓宇,李春春。bhlh型转录因子AtAIB正向调控ABA在植物体内的反应拟南芥。植物分子生物学杂志,2007;26(5):655 - 655。https://doi.org/10.1007/s11103-007-9230-3。
- 114.
徐宗杰,朱杰,金兆杰,金玉凯,南波赫,宋思,等。OsbHLH148是一种基本的螺旋-环-螺旋蛋白,与茉莉酸盐信号通路中的OsJAZ蛋白相互作用,导致水稻的耐旱性。植物学报,2011;26(6):457 - 457。https://doi.org/10.1111/j.1365-313X.2010.04477.x。
- 115.
李文霞,乌野勇,朱建华,何新军,吴建民,饭田凯,等。的拟南芥NFYA5转录因子通过转录和转录后调控促进抗旱性。植物科学进展。2008;20(8):2238-51。https://doi.org/10.1105/tpc.108.059444。
- 116.
王永强,范晓东,林峰,何gm, Terzaghi W,朱德明,邓晓伟。拟南芥非编码RNA介导红光对光形态建成的控制。中国科学(d辑),2014,26(3):357 - 357。https://doi.org/10.1073/pnas.1409457111。
- 117.
Osakabe Y, Arinaga N,梅泽T, Katsura S,长町K,田中H,等。钾转运蛋白控制的渗透胁迫响应与植物生长拟南芥。植物学报。2013;25(2):609-24。https://doi.org/10.1105/tpc.112.105700。
- 118.
秦努沙米V,舒梅克K,朱建科。植物非生物胁迫信号传递中串扰和特异性的分子遗传学研究。中国机械工程学报,2004;29(3):344 - 344。https://doi.org/10.1093/jxb/erh005。
- 119.
Broz AK, Thelen JJ, Muszynski MG, Miernyk JA, Randall DD.玉米中新的2c型蛋白磷酸酶ZMPP2。中国机械工程学报,2001;26(3):344 - 344。https://doi.org/10.1093/jexbot/52.361.1739。
- 120.
Vranová E, Langebartels C, Van Montagu M, Inzé D, Van Camp W.氧化应激、热休克和干旱对烟草蛋白磷酸酶2C表达的影响。中国生物医学工程学报,2000;29(3):344 - 344。https://doi.org/10.1093/jexbot/51.351.1763。
- 121.
Meskiene I, Baudouin E, Schweighofer A, liwoz A, Jonak C, Rodriguez PL,等。应激诱导蛋白磷酸酶2C是丝裂原活化蛋白激酶的负调控因子。中国生物医学工程学报,2003;29(4):344 - 344。https://doi.org/10.1074/jbcM300878200。
- 122.
吴娥,朱建勇,王志智。BZR1和PIF4的相互作用整合了油菜素类固醇和环境反应。细胞生物学杂志,2012;14(8):802-9。https://doi.org/10.1038/ncb2545。
- 123.
乔少林,孙淑云,王玲,吴志华,李彩霞,李小明,等。RLA1/SMOS1转录因子与OsBZR1共同调节油菜素内酯信号通路和水稻结构。植物学报。2017;29(2):292-309。https://doi.org/10.1105/tpc.16.00611。
- 124.
叶海霞,李林,郭海辉,尹永华。MYBL2是gsk3样激酶BIN2的底物,在油菜素类固醇信号通路中作为BES1的辅抑制因子拟南芥。中国科学(d辑:自然科学)2012;29(4):344 - 344。https://doi.org/10.1073/pnas.1205232109。
- 125.
袁广峰,贾广昌,李震,孙波,张丽萍,刘楠,王庆明。油菜素内酯对水分胁迫下番茄抗旱性和脱落酸浓度的影响。Sci Hortic(阿姆斯特丹)。2010年,126(2):103 - 8。https://doi.org/10.1016/j.scienta.2010.06.014。
- 126.
王晓霞,高永刚,王启军,陈敏,叶小玲,李德明,等。2,4-表油菜素内酯对干旱胁迫对桃抗氧化酶和自噬的影响(李属persicael .)树叶。植物物理与生物化学。2019;135:30-40。https://doi.org/10.1016/j.plaphy.2018.11.026。
- 127.
王志强,王志强,王志强,等。海藻糖代谢的研究进展。植物科学进展,1999;4(8):315-9。https://doi.org/10.1016/s1360 - 1385 (99) 01446 - 6。
- 128.
Garg AK, Kim JK, Owens TG, Ranwala AP, Choi YD, Kochian LV, Wu RJ。海藻糖在水稻植株中的积累使水稻对不同的非生物胁迫具有较高的耐受性。中国科学(d辑),2002;29(2):389 - 397。https://doi.org/10.1073/pnas.252637799。
- 129.
Nir I, Moshelion M, Weiss D.转基因番茄赤霉素甲基转移酶1抑制赤霉素活性,降低全株蒸腾作用,提高抗旱性。植物细胞环境学报。2014;37(1):113-23。https://doi.org/10.1111/pce.12135。
- 130.
小q。干旱胁迫下油菜干旱相关基因表达分析(芸苔属植物显著l .)中国农业科学院油料作物研究所硕士论文,武汉,中国,2011。
- 131.
油菜品种耐旱性评价(芸苔属植物显著L.)和外源性GA3的作用。中国农业科学院油料作物研究所硕士论文,武汉,中国,2010。
- 132.
熊建林,戴丽丽,马宁,张春林。转录组和生理分析表明,AM1作为一种aba模拟配体提高了水稻的抗旱性芸苔属植物显著。植物生长学报,2018;85(1):73-90。https://doi.org/10.1007/s10725-018-0374-8。
- 133.
李娟,张春林,李建军,张春林。AM1是油菜抗旱性的潜在ABA替代品。植物物理学报,2016;38(7):183。https://doi.org/10.1007/s11738-016-2190-y。
- 134.
特拉内尔C, Williams BA, Pertea G, Mortazavi A, Kwan G, van Baren MJ,等。RNA-Seq转录本的组装和定量揭示了细胞分化过程中未注释的转录本和异构体转换。生物技术学报。2010;28(5):511-5。https://doi.org/10.1038/nbt.1621。
- 135.
Pujana MA, Han JDJ, Starita LM, Stevens KN, Tewari M, Ahn JS, Rennert G,等。网络建模将乳腺癌易感性和中心体功能障碍联系起来。植物学报。2007;39(11):1338-49。https://doi.org/10.1038/ng.2007.2。
- 136.
王仁仁,邹杰,孟金龙,王俊杰。新合成的全基因组lncRNA和mRNA表达的综合分析芸苔属植物六倍体。生态环境学报,2018;8(12):6034-52。https://doi.org/10.1002/ece3.4152。
致谢
作者要感谢博士。龙卫华,农业部棉花与油菜籽重点实验室(南京)/江苏省农业科学院经济作物研究所,中国江苏,对全文提出重要建议,并对图片进行了装饰。
资金
本工作得到国家油菜产业技术体系项目(CARS-13)的支持。资助者在研究设计、数据收集和分析、发表决定或手稿准备中没有任何作用。
作者信息
从属关系
贡献
XT分析了序列并撰写了手稿。XT和SL进行实验。CZ和LH构思、设计实验。所有作者都阅读并批准了手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
谭,X,李,S,胡,L。et al。两种油菜长链非编码rna (lncRNAs)的全基因组分析(芸苔属植物显著l)干旱胁迫和复水条件下的基因型。BMC植物生物学20.81(2020)。https://doi.org/10.1186/s12870-020-2286-9
收到了:
接受:
发表:
关键字
- RNA-seq
- 补液治疗
- 信使核糖核酸
- GO和通路分析
- Co-expression网络