- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 出版:GydF4y2Ba
拟南芥叶片在长时间升温和热激下的生理、转录和代谢反应差异GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba20.GydF4y2Ba, 文章编号:GydF4y2Ba86GydF4y2Ba(GydF4y2Ba2020GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
由于全球气候变暖的温度升高,无论是突然热波(热休克)或延长变暖的形式,对植物的生长和发育都有深刻的影响。然而,植物如何差异地响应这两种形式的升高的温度在很大程度上是未知的。因此,我们已经对拟南芥叶片的多级响应进行了全面的比较,以热休克和延长变暖。GydF4y2Ba
结果GydF4y2Ba
植物通过降低气孔导度来应对延长的增温,通过增加蒸腾作用来应对热激。在碳代谢中,长时间的升温增强了糖酵解途径,抑制了三羧酸(TCA)循环,热休克显著限制了丙酮酸向乙酰辅酶a的转化GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba)和抗氧化酶活性均有所提高,但热激诱导率较高。有趣的是,在热休克条件下,A1类热休克因子(HSFA1s)和脱水反应元件结合蛋白(DREBs)的转录因子表达上调,而随着升温时间的延长,其他非生物胁迫反应途径,特别是碱性亮氨酸拉链因子(bZIPs)的表达上调。GydF4y2Ba
结论GydF4y2Ba
我们的发现表明GydF4y2Ba拟南芥GydF4y2Ba在热冲击和长时间变暖的作用下,植物表现出不同的反应模式,并采用明显不同的反应策略来应对这两种类型的热胁迫。GydF4y2Ba
背景GydF4y2Ba
由于气候变暖,植物由于其固定的生活方式,需要发展一套反应来适应不断上升的温度。以往对高温处理的研究可归纳为短期强热(也称热休克)和长期增温两大类。传统上,对于热休克处理,植物在很短的时间内(从几分钟到几小时)遭受比最佳阈值高得多的温度(例如比环境温度高10-15°C) [GydF4y2Ba1GydF4y2Ba].另一方面,延长变暖通常是通过将植物暴露在适度升高的温度(例如比其最佳温度范围高出2-5°C)中数天、数周,甚至整个生长季节来模拟的[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba].GydF4y2Ba
以往对长期变暖的研究主要集中在物候、繁殖生产力、生长发育和生物量积累等方面[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba],在社区,人口和物种水平上,物种从草地变为树木[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba,而其他一些则研究了细胞、生理和代谢组反应[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba].然而,对长期变暖的反应的综合分析却很少。GydF4y2Ba
而植物对热激反应的生理和分子机制则得到了广泛的研究。一般来说,热休克降低光合作用和呼吸活动,降低生产力[GydF4y2Ba9.GydF4y2Ba].由于活性氧(ROS)的产生,导致大量细胞成分受到破坏,高温引起光合装置中类囊体膜的结构和功能变化[GydF4y2Ba11GydF4y2Ba].在热休克反应中,植物加速热休克蛋白(HSPs)的产生,并积累响应性代谢物[GydF4y2Ba12GydF4y2Ba]在热休克相关信号通路中,已发现主转录调节因子HSFA1和其他几种转录因子的作用[GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba].然而,我们对这种长期变暖反应的调节机制知之甚少。特别是,尽管在自然界中这两种情况都经常发生,但目前还没有研究集中在长期变暖和热休克之间的植物反应的系统比较。GydF4y2Ba
叶片是直接感知环境温度变化的主要营养器官,可对环境温度变化表达表型可塑性反应[GydF4y2Ba15GydF4y2Ba].此外,作为植物生长发育的基础,叶片光合作用和蒸腾作用易受温度变化的影响[GydF4y2Ba9.GydF4y2Ba].因此,高温对叶片影响的实验将为更好地了解植物对热胁迫的反应提供依据。因此,我们比较了其生理、转录组和代谢组反应GydF4y2Ba拟南芥GydF4y2Ba并将这些结果解释在它们对光合作用和呼吸作用以及潜在的转录调控的背景下。GydF4y2Ba
结果GydF4y2Ba
生理生化变化GydF4y2Ba
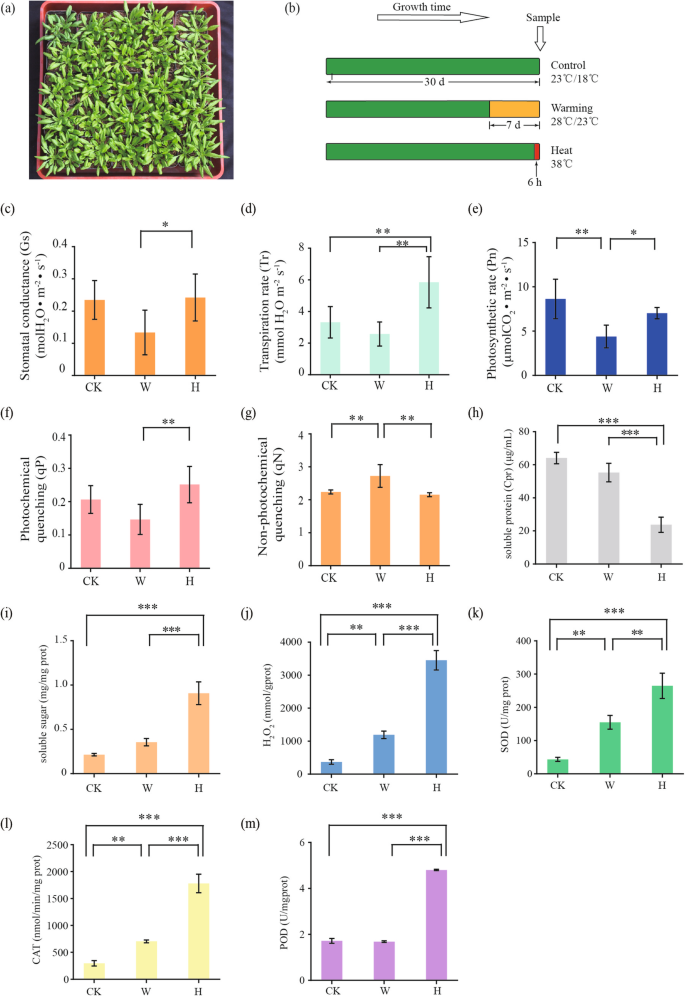
拟南芥GydF4y2Ba植物在对照(CK)、长期升温(PW)和热休克(HS)处理下生长,并在莲座丛生长阶段采集叶片样本(图。GydF4y2Ba1GydF4y2Baa, b)。GydF4y2Ba1GydF4y2Bac)。然而,在热激下,蒸腾速率显著增加(图。GydF4y2Ba1GydF4y2Bad).与对照和热激相比,长期增温降低了光合速率(图。GydF4y2Ba1GydF4y2Ba同样,变暖时间的延长对qP和qN的影响更为显著,通过降低qP和提高qN(图4)。GydF4y2Ba1GydF4y2Baf, g)。然而,qP和qN在对照和热休克之间没有显著差异(图。GydF4y2Ba1GydF4y2Baf, g)。GydF4y2Ba
的生理特点GydF4y2Ba答:芥GydF4y2Ba在不同升高的温度处理下。GydF4y2Ba一种GydF4y2Ba典型的GydF4y2Ba答:芥GydF4y2Ba播种后30天植株处于莲座生长期。GydF4y2BaB.GydF4y2Ba对照(CK)的时间表,延长升温(PW)和热休克(HS)处理,显示出相对延长的温热(橙色)7天,短期热冲击(红色)6小时。GydF4y2BaCGydF4y2Ba气孔导度(GydF4y2BaD.GydF4y2Ba蒸腾速率,(GydF4y2BaE.GydF4y2Ba)光合速率,(GydF4y2BaFGydF4y2Ba)光化学猝灭(qP),以及(GydF4y2BaGGydF4y2Ba)非光化学猝灭(qN)用LI-6400测定GydF4y2BaXTGydF4y2Ba便携式光合式系统。GydF4y2BaHGydF4y2Ba可溶性蛋白质,(GydF4y2Ba一世GydF4y2Ba)可溶性糖,(GydF4y2BajGydF4y2Ba)过氧化氢的活性(GydF4y2BaK.GydF4y2Ba)过氧化氢酶(CAT)(GydF4y2BaL.GydF4y2Ba超氧化物歧化酶(SOD)及GydF4y2BamGydF4y2Ba)在升高的温度处理结束时确定叶中的过氧化物酶(POD)。CK:控制;PW:长期变暖;海关:热休克。误差栏代表平均值±s.d.(c) - (g),GydF4y2BaN.GydF4y2Ba = 8, (H-M.GydF4y2Ba),GydF4y2BaN.GydF4y2Ba = 3, */**/***:P.GydF4y2Ba < 0.05/0.01/0.001, respectively
与对照和长时间升温相比,热休克时可溶性蛋白水平显著降低(图2)。GydF4y2Ba1GydF4y2Bah)。另一方面,热休克产生的可溶性糖和过氧化氢的增加明显大于长期变暖(图。GydF4y2Ba1GydF4y2Ba热休克组超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性显著高于长时间升温组(图2)。GydF4y2Ba1GydF4y2Bak、 l,m)。GydF4y2Ba
代谢物的变化GydF4y2Ba
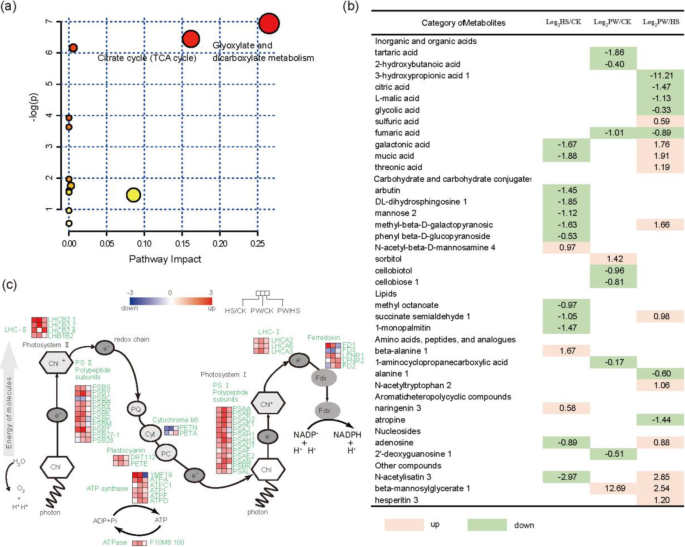
使用GC-MS,我们确定了181个代谢物,在长时间的加热和热休克下显着影响。使用主成分分析(PCA)和正交投影与判别分析(OPLS-DA)的潜在结构,我们在实验组之间分离了这些代谢物(附加文件GydF4y2Ba1GydF4y2Ba:图S1a-d),并将范围缩小到34种不同的代谢物(VIP > 1和GydF4y2BaP.GydF4y2Ba< 0.05)。代谢组视图图显示,富集途径(GydF4y2BaP.GydF4y2Ba< 0.05)的变化与柠檬酸循环、乙醛酸盐和二羧酸盐代谢有关(图。GydF4y2Ba2GydF4y2Baa) 。GydF4y2Ba
植物光合作用相关基因的代谢组学分析及表达变化GydF4y2Ba答:芥GydF4y2Ba在不同升高的温度处理下。GydF4y2Ba一种GydF4y2Ba在长期受热和热休克的植物中鉴定的常见代谢物的代谢组视图;不同颜色深度的圆代表GydF4y2BaP.GydF4y2Ba- 途径富集分析。GydF4y2BaB.GydF4y2Ba热休克(HS)、长时间变暖(PW)、长时间变暖(PW)、长时间变暖(PW)与热休克(HS)相比影响显著的代谢产物列表(GydF4y2BaP.GydF4y2Ba-value≤0.05),按功能类别进行组织,并相应累积fold-changes。这些数字表示折叠变化。红色遮阳为上调,绿色遮阳为下调GydF4y2Ba.CGydF4y2Ba光合作用的光和暗反应路径图,上面有彩色编码的方格,表示DEGs。红色方块:上调基因;蓝色方块:下调基因。左栏:热休克vs控制;中间栏:长期变暖vs控制;右栏:长期变暖vs热休克。CK:控制;PW:长期变暖;海关:热休克。LHC I/II:光收集复合体I/II; PS I/II: photosystem I/II; PQ: plastoquinone; Cyt: cytochrome b6f complex; PC: plastocyanin; Chl: chlorophyll; Fdx: ferredoxin
图中列出了3个处理间积累的主要代谢物。GydF4y2Ba2GydF4y2BaB从整体代谢物情景来看,热休克与对照和长期升温与对照之间没有共同的代谢物,这表明这两种类型的热应激导致代谢物变化趋势完全不同。例如,山梨醇在长期变暖中显著增加,而在热休克中则没有发现。一些碳水化合物结合物(如DL-二氢鞘氨醇、甘露糖、甲基-β-D-半乳糖基吡喃和苯基-β-D-吡喃葡萄糖苷)在热休克时减少(与对照组相比),而在长期升温时没有变化(与对照组相比)。此外,许多参与TCA循环中间产物的代谢物,如富马酸、L-苹果酸和柠檬酸,在长期升温(PW vs HS)中显著减少(图。GydF4y2Ba2GydF4y2Bab)。GydF4y2Ba
与光合作用相关的差异表达基因(DEGs)GydF4y2Ba
我们从叶片中生成了RNA-Seq数据,并分别从CK(102,596,706)、延长变暖(77,761,052)和热休克(80,456,340)处理的3个生物重复中获得了清晰的reads(补充文件)GydF4y2Ba4.GydF4y2Ba:表S1)。我们进一步进行了差异表达分析(附加文件GydF4y2Ba2GydF4y2Ba:图S2A)。基于Kegg(基因和基因组的Kyoto百科全书)富集分析,核糖体,光合作用,天线蛋白和柠檬酸盐循环中涉及的基因均较长升温和热休克(附加文件GydF4y2Ba2GydF4y2Ba:图S2B,C,红色箭头)。另一方面,与热休克相比,卟啉和叶绿素代谢的途径和不饱和脂肪酸的生物合成显着富集(额外的档案)GydF4y2Ba2GydF4y2Ba:图S2D,红色箭头)。基于GO(基因本体论)浓缩分析,热冲击导致富集对刺激的响应的基因,对应力,细胞组分和膜的反应(附加文件GydF4y2Ba3.GydF4y2Ba:图S3a,箭头),而热冲击导致与反应非生物刺激,叶绿体,塑性,细胞质,细胞内部分,光合作用和光反应相关的基因富集(额外的文件)GydF4y2Ba3.GydF4y2Ba:图S3B,箭头)。在两个升高的温度处理(延长变暖VS热休克)之间,富含刺激,应激,叶绿体,塑性,细胞质和细胞质部分的响应相关的基因(额外的档案GydF4y2Ba3.GydF4y2Ba:图S3c,箭头)。GydF4y2Ba
根据KEGG和GO富集结果,我们进一步研究了与光合电子传递系统相关的DEGs。我们鉴定了4个与光收获复合体II (LHC II)相关的DEGs, 3个编码光收获复合体I (LHC I)的DEGs, 11个与PS II相关的DEGs和13个与PS I相关的DEGs(图)。GydF4y2Ba2GydF4y2Bac).在长时间的变暖和热休克中,大多数基因均上调(除GydF4y2BaPSBCGydF4y2Ba,编码PS II的CP43亚基)。GydF4y2BaLHCB2.2GydF4y2Ba和GydF4y2BaLHCB2.4GydF4y2Ba(编码光收获复合体II),GydF4y2BaPSB28GydF4y2Ba(与PS II相关),和GydF4y2BaPSAH2GydF4y2Ba和GydF4y2BaPSANGydF4y2Ba(与PS I相关),与热休克相比(PW vs HS),在长期变暖中上调了2倍以上(图1)。GydF4y2Ba2GydF4y2Bac).此外,ATP合酶(GydF4y2BaATPC1GydF4y2Ba和GydF4y2BaATPDGydF4y2Ba光合电子传递系统中的)在长期变暖和热激作用下也上调GydF4y2BaYMF19GydF4y2Ba抑制(图。GydF4y2Ba2GydF4y2BaC)。GydF4y2Ba
呼吸代谢GydF4y2Ba
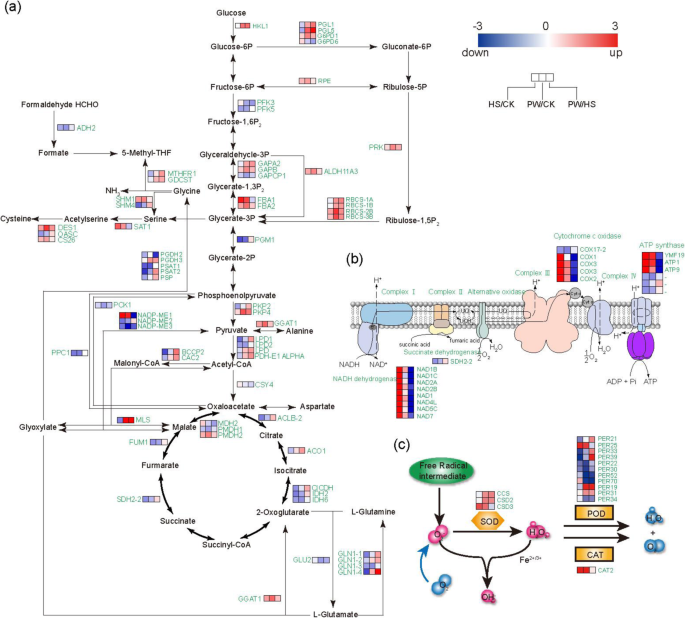
与热休克相比,在长时间的升温中,调节乙醛酸盐和二羧酸盐代谢的DEGs表达水平显著增加。例如,表达水平高出40倍GydF4y2Ba美国职业足球大联盟GydF4y2Ba(编码苹果酸合酶),高出8倍以上GydF4y2BaRBCS-1AGydF4y2Ba那GydF4y2BaRBCS-1BGydF4y2Ba那GydF4y2BaRBCS-2BGydF4y2Ba和GydF4y2BaRBCS-3BGydF4y2Ba(编码核酮糖二磷酸羧化酶),高3倍GydF4y2BaHKL1GydF4y2Ba(编码己糖激酶样1)。GydF4y2Ba3.GydF4y2Baa) 。GydF4y2Ba
通过检测deg的表达水平和代谢产物丰度之间的关系,我们确定了那些受到两种高温处理显著影响的途径。已知的主要途径包括糖酵解、丙酮酸代谢、乙醛酸和二羧酸代谢和三羧酸循环,如图所示。GydF4y2Ba3.GydF4y2Baa.与CK相比,编码二氢脂酰脱氢酶的丙酮酸基因代谢(GydF4y2BaLPD1.GydF4y2Ba那GydF4y2BaLPD2.GydF4y2Ba)在热休克中下调,表明热应激限制丙酮酸向乙酰辅酶a的转化。然而,GydF4y2BaLPD1, LPDGydF4y2Ba和GydF4y2BaPDH-E1αGydF4y2Ba在长时间变暖和热冲击中上调,表明在长时间变暖和热冲击之间的转换模式不同。GydF4y2Ba
在TCA循环途径中,编码苹果酸脱氢酶(GydF4y2BaPMDH1GydF4y2Ba)、富马酸水合酶(GydF4y2BaFUM1GydF4y2Ba),ATP-柠檬酸合酶β链蛋白(GydF4y2BaACLB-2GydF4y2Ba)、异柠檬酸脱氢酶(GydF4y2BaIDH2GydF4y2Ba那GydF4y2BaIDH6GydF4y2Ba)和琥珀酸脱氢酶(GydF4y2BaSDH2-2GydF4y2Ba)在长时间的温暖和热休克中均下调。这与代谢组学的结果是一致的,其中柠檬酸和延胡索酸的含量在长时间的升温比热休克中降低(图。GydF4y2Ba2GydF4y2Bab,无花果。GydF4y2Ba3.GydF4y2Baa) 。苹果酸含量的降低也与GydF4y2BaPMDH1GydF4y2Ba在长时间变暖和热休克(图。GydF4y2Ba2GydF4y2Bab,无花果。GydF4y2Ba3.GydF4y2Baa) 。GydF4y2Ba
此外,编码ATP合酶、细胞色素c氧化酶和NADH脱氢酶的与氧化磷酸化相关的DEGs在HS中上调。例如ATP合酶蛋白(GydF4y2BaYMF19GydF4y2Ba),细胞色素c氧化酶亚单位(GydF4y2BaCOX1.GydF4y2Ba那GydF4y2BaCOX2.GydF4y2Ba那GydF4y2BaCOX3.GydF4y2Ba)和NADH脱氢酶(GydF4y2BaNAD1B NAD1CGydF4y2Ba) (无花果。GydF4y2Ba3.GydF4y2Bab)。然而,大多数这些基因在延长温度VS热休克时显着下调,表明热休克增强了比延长变暖更高的氧化磷酸化。GydF4y2Ba
抗氧化系统GydF4y2Ba
在SOD催化的反应中,有三个基因(GydF4y2BaCCS.GydF4y2Ba那GydF4y2BaCSD2GydF4y2Ba那GydF4y2BaCSD3GydF4y2Ba)在长期变暖中均上调。然而,只有GydF4y2BaCSD3GydF4y2Ba在热休克中高表达。的表达水平GydF4y2BaCCS.GydF4y2Ba和GydF4y2BaCSD2GydF4y2Ba与热休克相比,长时间变暖的存活率高出2.5倍。GydF4y2Ba3.GydF4y2BaC)。GydF4y2Ba
在CAT-catalyzed反应,GydF4y2BaCAT2GydF4y2Ba(过氧化氢酶2)在热休克和长期变暖中均有较高的表达。GydF4y2Ba3.GydF4y2Bac).此外,与对照相比,在热激或增温延长条件下,编码pod的大部分基因均表达下调,但除pod基因外,其余基因均表达下调GydF4y2BaPER25GydF4y2Ba(过氧化物酶25)在热休克中有较高的表达。GydF4y2Ba3.GydF4y2BaC)。GydF4y2Ba
热休克蛋白、转录因子和热应激诱导基因GydF4y2Ba
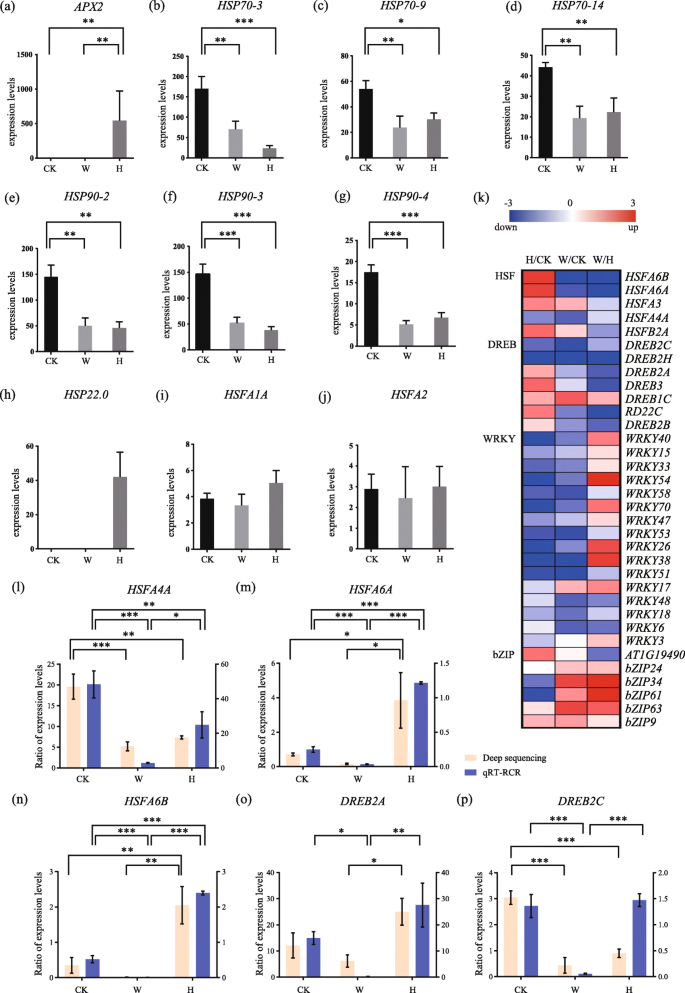
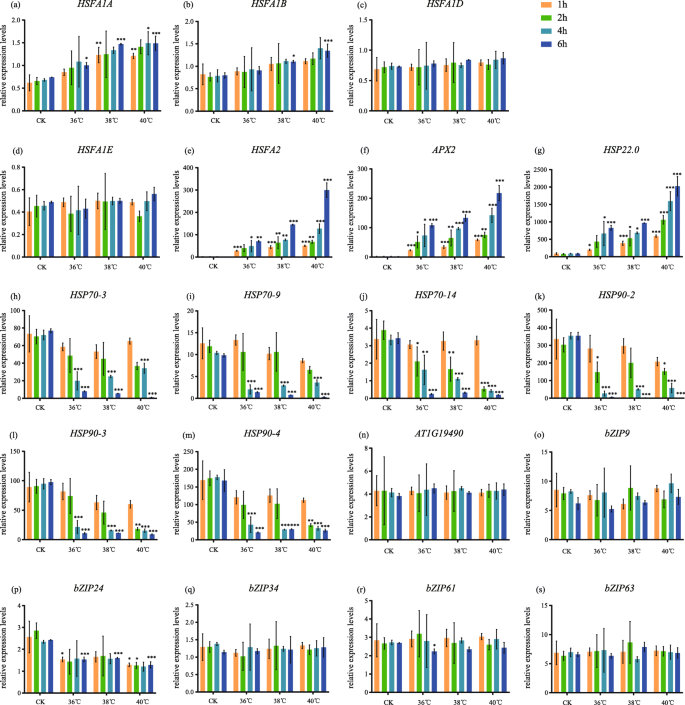
热休克反应网络由热休克蛋白激活,从而启动热应激相关转录因子和基因。抗坏血酸过氧化物酶2 (GydF4y2BaAPX2GydF4y2Ba)参与催化H.GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba- 在植物中抗坏血酸的依赖性氧化。我们发现了GydF4y2BaAPX2GydF4y2Ba仅在热休克中显著上调,但在长期变暖中未检测到其表达(图。GydF4y2Ba4.GydF4y2Baa).此外,表达水平GydF4y2BaHSP70-3GydF4y2Ba那GydF4y2BaHSP70-9GydF4y2Ba那GydF4y2BaHSP70-14GydF4y2Ba那GydF4y2BaHSP90-2GydF4y2Ba那GydF4y2BaHSP90-3GydF4y2Ba和GydF4y2BaHSP90-4GydF4y2Ba在延长的变暖和热休克和表达中,延长升温和表达都显着降低GydF4y2BaHSP70-3GydF4y2Ba与长期变暖相比,热休克组的细胞数量进一步减少(图2)。GydF4y2Ba4.GydF4y2Bab-g)。然而,GydF4y2BaHSP22.0.GydF4y2Ba表达仅在热冲击中检测,但不延长变暖(图。GydF4y2Ba4.GydF4y2BaH)。GydF4y2Ba
不同高温处理下的热休克蛋白和转录因子分析。的表达水平(GydF4y2Ba一种GydF4y2Ba抗坏血酸过氧化物酶2 (GydF4y2BaAPX2GydF4y2Ba),(GydF4y2BaB.GydF4y2Ba)热休克蛋白70-3 (GydF4y2BaHSP70-3GydF4y2Ba),(GydF4y2BaCGydF4y2Ba)GydF4y2BaHSP70-9GydF4y2Ba, (GydF4y2BaD.GydF4y2Ba)GydF4y2BaHSP70-14GydF4y2Ba, (GydF4y2BaE.GydF4y2Ba)GydF4y2BaHSP90-2GydF4y2Ba, (GydF4y2BaFGydF4y2Ba)GydF4y2BaHSP90-3GydF4y2Ba, (GydF4y2BaGGydF4y2Ba)GydF4y2BaHSP90-4GydF4y2Ba, (GydF4y2BaHGydF4y2Ba)GydF4y2BaHSP22.0.GydF4y2Ba, (GydF4y2Ba一世GydF4y2Ba)热冲击系数A 1A(GydF4y2BaHSFA1A.GydF4y2Ba), 和GydF4y2Ba(j)GydF4y2BaHSFA2GydF4y2Ba.每个条表示平均值±SD;GydF4y2BaN.GydF4y2Ba= 3。GydF4y2BaK.GydF4y2Ba34个差异表达的转录因子在控制、延长温激和热激处理下的热图,分为4大类。红色矩形表示表达上调,蓝色矩形表示表达下调。GydF4y2BaL-P.GydF4y2Ba几种选定转录因子的表达水平:(GydF4y2BaL.GydF4y2Ba)GydF4y2BaHSFA4AGydF4y2Ba, (GydF4y2BamGydF4y2Ba)GydF4y2BaHSFA6AGydF4y2Ba, (GydF4y2BaN.GydF4y2Ba)GydF4y2BaHSFA6BGydF4y2Ba, (GydF4y2BaO.GydF4y2Ba)GydF4y2BaDREB2AGydF4y2Ba, (GydF4y2BaP.GydF4y2Ba)GydF4y2BaDREB2CGydF4y2Ba采用定量RT-PCR分析。粉色条:深度测序结果;蓝色条:qRT-PCR结果。每个条表示平均值±SD;GydF4y2BaN.GydF4y2Ba= 3。CK:控制;PW:长期变暖;海关:热休克GydF4y2Ba
通过更进一步,我们测量了转录因子的表达水平,包括GydF4y2BahsfGydF4y2Ba那GydF4y2Ba德布斯GydF4y2Ba那GydF4y2BaWRKYsGydF4y2Ba和GydF4y2BabZIPsGydF4y2Ba.表达水平GydF4y2BaHSFA1A.GydF4y2Ba而在热休克时则略有上调(图。GydF4y2Ba4.GydF4y2BaI),但两组间无显著性差异GydF4y2BaHSFA2GydF4y2Ba在CK中表达,延长温、热休克(图。GydF4y2Ba4.GydF4y2Baj)。有趣的是,四个GydF4y2BahsfGydF4y2Ba,包括GydF4y2BaHSFA6B,HSFA6A,HSFA3GydF4y2Ba和GydF4y2BaHSFB2A.GydF4y2Ba是明显上调的,GydF4y2BaDREB2AGydF4y2Ba和GydF4y2BaDREB3.GydF4y2Ba在热休克中也强烈上调(图。GydF4y2Ba4.GydF4y2Bak)。不同的是,表达式GydF4y2BaDREB2AGydF4y2Ba和GydF4y2BaDREB3.GydF4y2Ba在延长变暖的延长变暖中减少,并且将毛腕转录因子的大多数基因下调至更大程度的热冲击程度,而不是延长升温的程度(图。GydF4y2Ba4.GydF4y2Ba特别是,5个编码bZIP9的基因在长期变暖中显著上调,而只有一个(bZIP9)在热休克中显著上调(图2)。GydF4y2Ba4.GydF4y2Bak).表示GydF4y2BaHSFA4AGydF4y2Ba那GydF4y2BaHSFA6AGydF4y2Ba那GydF4y2BaHSFA6BGydF4y2Ba和GydF4y2BaDREB2AGydF4y2Ba通过qRT PCR(实时逆转录PCR)检测到的结果与转录组数据中观察到的结果相似(图。GydF4y2Ba4.GydF4y2Bal-o),DREB2C除外(图。GydF4y2Ba4.GydF4y2Bap) 。GydF4y2Ba
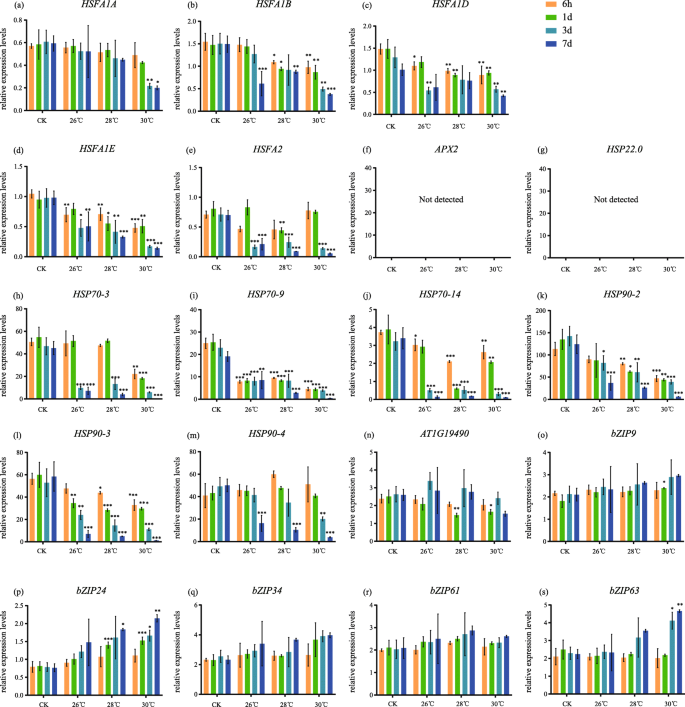
我们进一步进行了一系列qRT PCR,以验证HSFAs和HSP70/90在不同温度和不同持续时间下的表达模式(图。GydF4y2Ba5.GydF4y2Baa - m,无花果。GydF4y2Ba6.GydF4y2Baa - m,附加文件GydF4y2Ba5.GydF4y2Ba:表S2)。结果表明,在所有的热处理过程中GydF4y2BaHSFA1A.GydF4y2Ba那GydF4y2BaHSFA1B.GydF4y2Ba那GydF4y2BaHSFA2GydF4y2Ba那GydF4y2BaAPX2GydF4y2Ba和GydF4y2BaHSP22.0.GydF4y2Ba随着治疗时间的延长而显著上调(图。GydF4y2Ba5.GydF4y2BaA b e f g),除了这个GydF4y2BaHSFA1D.GydF4y2Ba和GydF4y2BaHSFA1E.GydF4y2Ba变化不大(图。GydF4y2Ba5.GydF4y2Bac, d)。然而,不像热处理,所有GydF4y2BaHSFA1S.GydF4y2Ba和GydF4y2BaHSFA2GydF4y2Ba在所有增温处理中,随处理时间的增加而降低(图2)。GydF4y2Ba6.GydF4y2Baa-e)一会儿GydF4y2BaAPX2GydF4y2Ba和GydF4y2BaHSP22.0.GydF4y2Ba未检出(图。GydF4y2Ba6 f, gGydF4y2Ba),表明在长期变暖的情况下,它们在很大程度上受到抑制。此外,GydF4y2BaHSP70/90sGydF4y2Ba均随处理时间的增加而降低(图2)。GydF4y2Ba5h-M.GydF4y2Ba, 无花果。GydF4y2Ba6.GydF4y2Ba氯)。其中,在热休克下,GydF4y2BaHSPS.GydF4y2Ba那GydF4y2BaHSP70-3GydF4y2Ba那GydF4y2BaHSP70-9GydF4y2Ba那GydF4y2BaHSP70-14GydF4y2Ba那GydF4y2BaHSP90-2GydF4y2Ba那GydF4y2BaHSP90-3GydF4y2Ba和GydF4y2BaHSP90-4GydF4y2Ba,表现出与hsfa1相比的逆转录表达水平。GydF4y2Ba
qRT-PCR检测不同温度和持续时间的热休克。GydF4y2Ba一种GydF4y2BaHSFA1A.GydF4y2Ba, (GydF4y2BaB.GydF4y2Ba)GydF4y2BaHSFA1B.GydF4y2Ba, (GydF4y2BaCGydF4y2Ba)GydF4y2BaHSFA1D.GydF4y2Ba, (GydF4y2BaD.GydF4y2Ba)GydF4y2BaHSFA1E.GydF4y2Ba, (GydF4y2BaE.GydF4y2Ba)GydF4y2BaHSFA2GydF4y2Ba, (GydF4y2BaFGydF4y2Ba)GydF4y2BaAPX2GydF4y2Ba, (GydF4y2BaGGydF4y2Ba)GydF4y2BaHSP22.0.GydF4y2Ba, (GydF4y2BaHGydF4y2Ba)GydF4y2BaHSP70-3GydF4y2Ba, (GydF4y2Ba一世GydF4y2Ba)GydF4y2BaHSP70-9GydF4y2Ba, (GydF4y2BajGydF4y2Ba)GydF4y2BaHSP70-14GydF4y2Ba, (GydF4y2BaK.GydF4y2Ba)GydF4y2BaHSP90-2GydF4y2Ba, (GydF4y2BaL.GydF4y2Ba)GydF4y2BaHSP90-3GydF4y2Ba, (GydF4y2BamGydF4y2Ba)GydF4y2BaHSP90-4GydF4y2Ba, (GydF4y2BaN.GydF4y2Ba)GydF4y2BaAT1G19490GydF4y2Ba, (GydF4y2BaO.GydF4y2Ba)GydF4y2BabZIP9GydF4y2Ba, (GydF4y2BaP.GydF4y2Ba)GydF4y2BabZIP24GydF4y2Ba, (GydF4y2Ba问:GydF4y2Ba)GydF4y2BabZIP34GydF4y2Ba, (GydF4y2BaR.GydF4y2Ba)GydF4y2BabZIP61GydF4y2Ba, (GydF4y2BaS.GydF4y2Ba)GydF4y2BabZIP63GydF4y2Ba.橙色棒:结果1小时,绿棒:2小时的结果,蓝色条:结果4小时,深蓝色条:结果6小时。每个条表示平均值±SD;GydF4y2BaN.GydF4y2Ba= 3GydF4y2Ba
不同温度和持续升温时间的qRT PCR。GydF4y2Ba一种GydF4y2BaHSFA1A.GydF4y2Ba, (GydF4y2BaB.GydF4y2Ba)GydF4y2BaHSFA1B.GydF4y2Ba, (GydF4y2BaCGydF4y2Ba)GydF4y2BaHSFA1D.GydF4y2Ba, (GydF4y2BaD.GydF4y2Ba)GydF4y2BaHSFA1E.GydF4y2Ba, (GydF4y2BaE.GydF4y2Ba)GydF4y2BaHSFA2GydF4y2Ba, (GydF4y2BaFGydF4y2Ba)GydF4y2BaAPX2GydF4y2Ba, (GydF4y2BaGGydF4y2Ba)GydF4y2BaHSP22.0.GydF4y2Ba, (GydF4y2BaHGydF4y2Ba)GydF4y2BaHSP70-3GydF4y2Ba, (GydF4y2Ba一世GydF4y2Ba)GydF4y2BaHSP70-9GydF4y2Ba, (GydF4y2BajGydF4y2Ba)GydF4y2BaHSP70-14GydF4y2Ba, (GydF4y2BaK.GydF4y2Ba)GydF4y2BaHSP90-2GydF4y2Ba, (GydF4y2BaL.GydF4y2Ba)GydF4y2BaHSP90-3GydF4y2Ba, (GydF4y2BamGydF4y2Ba)GydF4y2BaHSP90-4GydF4y2Ba, (GydF4y2BaN.GydF4y2Ba)GydF4y2BaAT1G19490GydF4y2Ba, (GydF4y2BaO.GydF4y2Ba)GydF4y2BabZIP9GydF4y2Ba, (GydF4y2BaP.GydF4y2Ba)GydF4y2BabZIP24GydF4y2Ba, (GydF4y2Ba问:GydF4y2Ba)GydF4y2BabZIP34GydF4y2Ba, (GydF4y2BaR.GydF4y2Ba)GydF4y2BabZIP61GydF4y2Ba, (GydF4y2BaS.GydF4y2Ba)GydF4y2BabZIP63GydF4y2Ba.橙色条:6小时的结果,绿色条:1d的结果,蓝色条:3d的结果,深蓝色条:7d的结果。每个条表示平均值±SD;GydF4y2BaN.GydF4y2Ba= 3GydF4y2Ba
大多数Bzips在第7天长时间变暖时上调,例如GydF4y2BabZIP9GydF4y2Ba那GydF4y2BabZIP24GydF4y2Ba那GydF4y2BabZIP34GydF4y2Ba和GydF4y2BabZIP63GydF4y2Ba(无花果。GydF4y2Ba6.GydF4y2Bao, p, q, s)。GydF4y2Ba5.GydF4y2BaO, p, q, s),但下调者除外GydF4y2BabZIP24GydF4y2Ba(无花果。GydF4y2Ba5.GydF4y2Bap),表明bzip在长时间变暖过程中是活跃的,这与它们在热休克反应中的表达完全不同。GydF4y2Ba
讨论GydF4y2Ba
通过系统比较生理,转录和代谢反应GydF4y2Ba拟南芥GydF4y2Ba本研究揭示了两种热胁迫的不同响应模式,包括光合作用、呼吸作用、活性氧清除和胁迫信号通路。GydF4y2Ba
通过测定气孔导度,测定了长时间升温和热激条件下的气体交换量。结果表明,随着增温处理时间的延长,气孔导度显著降低,CO含量显著降低GydF4y2Ba2GydF4y2Ba同化也显着抑制。然而,在热休克下,它们在很大程度上保持不变,导致高蒸腾速率。气孔调节是一种高温耐受性的重要保护机制,因为它对于防止防止至关重要。通常,在中度至重度应力下,由于降低的培养基电导和气孔闭合,光合速率会降低[GydF4y2Ba12GydF4y2Ba].因此,我们的研究结果表明了两种不同的反应机制。在热冲击下,由于植物经历温度的突然上升,它们可能会增加蒸腾速率,以允许由于蒸发而产生的冷却效果。不同的是,在温度升高不致命的长期变暖条件下,植物关闭气孔以防止水分过度流失。GydF4y2Ba
我们进一步研究了光合作用在长时间增温和热激下的响应,发现在长时间增温下光化学猝灭降低而非光化学猝灭增加,而与LHCII和光合电子传递系统(包括PSII和PSI)相关的基因如GydF4y2BaLHCB2.2GydF4y2Ba那GydF4y2BaLHCB2.4GydF4y2Ba那GydF4y2BaPSB28GydF4y2Ba那GydF4y2BaPSAH2GydF4y2Ba那GydF4y2BaPSANGydF4y2Ba是差异。以往的研究已经确认了一些psii相关的蛋白质亚基和光合电子传递系统的辅助因子对高温的响应。GydF4y2BaPSB28-1GydF4y2Ba在高温下在PSII修复中发挥重要作用[GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba].LHCII作为PSII的主要成分,具有光能分布和光保护的功能,Lhcb1和Lhcb2是移动三聚体LHCII的主要成分[GydF4y2Ba18GydF4y2Ba].结合这些研究,我们预测,延长温暖条件下的增强的光反应和光保护。类似地,大多数与光收集复合物和光合电子传输系统相关的基因也被热休克上调,表明短期高温也可能诱导光保护。GydF4y2Ba
呼吸作用通常涉及糖酵解、TCA循环、线粒体电子传递链(miETC)和氧化磷酸化等途径。升高的温度会通过破坏细胞呼吸的平衡而引起植物细胞的损伤[GydF4y2Ba1GydF4y2Ba].我们的数据显示糖酵解途径相关基因,包括GydF4y2BaHKL1GydF4y2Ba那GydF4y2BaGAPA2GydF4y2Ba那GydF4y2BaGAPBGydF4y2Ba那GydF4y2BaFBA1GydF4y2Ba那GydF4y2BaFBA2GydF4y2Ba和GydF4y2BaPKP4GydF4y2Ba,随着延长的加热治疗,上调。同时,与TCA周期相关的基因,如GydF4y2BaFUM1GydF4y2Ba那GydF4y2BaPMDH1GydF4y2Ba和GydF4y2BaACLB-2GydF4y2Ba代谢组学结果证实TCA循环活性降低。这些结果表明,某些特定的TCA循环中间体在长期的增温条件下被高度消耗。相反,在热休克下,一些糖酵解途径相关的基因,如GydF4y2BaPKP2GydF4y2Ba那GydF4y2BaLPD1.GydF4y2Ba和GydF4y2BaLPD2.GydF4y2Ba而与呼吸电子传递和氧化磷酸化途径相关的基因,如GydF4y2BaNAD1BGydF4y2Ba那GydF4y2BaNAD1CGydF4y2Ba那GydF4y2BaCOX1.GydF4y2Ba那GydF4y2BaCOX2.GydF4y2Ba,GydF4y2BaCOX3.GydF4y2Ba,表明热应激抑制糖酵解和TCA循环途径,增强电子传递。GydF4y2Ba
可溶性碳水化合物和氨基酸(如脯氨酸)是植物中与热胁迫相关的重要初级代谢物,由糖酵解和三羧酸循环的中间代谢物合成。可溶性糖的积累与细胞的渗透稳态和膜的稳定有关,它可以保护光合机构免受热损伤,维持光合能力[GydF4y2Ba19GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba].在这项研究中,在延长的升温和热休克中,可溶性糖显着增加。与长时间变暖相比,热冲击导致明显高度浓度的可溶性糖。此外,糖醇和碳水化合物缀合物积累的糖醇的模式响应于两种治疗均有很大差异。例如,山梨糖醇仅在延长升温但不在热冲击之下累积,而在热冲击下,不乳酸,甘露糖,甲基β-D-吡喃糖苷和苯基 - β-D-吡喃葡萄糖苷显着降低。由于渗透物质是通过光合同化的或呼吸中间产物生产的,因此需要ATP和NADPH作为减少电力提供者,其主要由呼吸产生。我们的研究结果表明,通过糖醇分解的中间产物,可以生产在长期加热和热冲击期间保持渗透平衡所需的分子。GydF4y2Ba
在非生物胁迫下,植物通常会积累ROS。同时,植物有快速的抗氧化系统,包括非酶抗氧化剂,如抗坏血酸(ASC)和谷胱甘肽(GSH),以及抗氧化酶,如SOD, POD和CAT负责清除和清除ROS。然而,在应激条件下,一旦ROS的生成和清除之间的平衡被破坏,ROS就开始积累[GydF4y2Ba21GydF4y2Ba那GydF4y2Ba22GydF4y2Ba].这里我们发现H的浓度GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba,SOD和CAT活性及其相关基因,包括GydF4y2BaCSD3GydF4y2Ba和GydF4y2BaCAT2GydF4y2Ba,均增强,说明两种处理均能诱导活性氧清除酶活性,解毒活性氧。然而,HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba在快速的热休克中增加得更快。此外,热激处理下POD活性高于长期增温处理,POD合成相关基因含量也高于高温处理GydF4y2BaPER25GydF4y2Ba热激作用下,ROS的表达显著上调,表明在热激作用下,ROS的产生和清除系统之间的平衡被破坏。随着变暖时间的延长,ROS水平虽然高于对照水平,但仍然相对较低。事实上,一些证据表明,在中等压力下,清除系统可以保持低ROS水平,ROS作为信号分子激活适应反应和程序性细胞死亡。例如,在中度胁迫下,ROS在从叶绿体到细胞核的细胞内信号传递中发挥关键作用,控制植物的发育过程[GydF4y2Ba23GydF4y2Ba].因此,我们推测,ROS可能作为信号分子调节应激反应通路的激活,而不会导致光合系统的不可逆失活,也不会对PSII造成严重损害。然而,详细的机制有待进一步调查。GydF4y2Ba
在对即将到来的损伤条件的预期中,植物可以激活基因并积累参与细胞防御热损伤的热休克蛋白。HSPs包括HSP100、HSP90、HSP70、HSP60和小HSPs,通过使多种因热应激而变性的蛋白质复性,在调节蛋白质质量方面发挥着重要作用。反过来,这些HSPs由转录因子网络(tf)精确控制,包括HSFs、dreb、wrky和bzip [GydF4y2Ba24GydF4y2Ba].最近的综述阐明了热应激中涉及的复杂转录和翻译后调控网络[GydF4y2Ba13GydF4y2Ba那GydF4y2Ba25GydF4y2Ba].HSFS是信号转导链的末端组分,其响应于热应激响应于热应激的激活,这在热能响应中尤为重要[GydF4y2Ba13GydF4y2Ba].在本研究中,通过RNA-seq转录组分析检测到33个TF家族,包括HSFs、DREBs、wrky和bzip响应热应激。其中,hsfa1和DREBs途径中的转录因子,如GydF4y2BaHSFA1A.GydF4y2Ba那GydF4y2BaHSFA6AGydF4y2Ba那GydF4y2BaHSFA6BGydF4y2Ba和GydF4y2BaDREB2AGydF4y2Ba在热休克治疗中上调。在GydF4y2Ba拟南芥GydF4y2Ba研究表明,hsfa1在热应激反应中发挥核心作用。许多重要的热应激反应转录因子,如DREB2A、HSFA2、HSFA7a和HSFBs已经被预测直接受HSFA1s调控[GydF4y2Ba26GydF4y2Ba].因此,我们的数据表明,hsfa1和dreb在热休克反应中起着关键作用。HSP70和HSP90分别通过抑制HSFA1的反式激活活性和细胞核定位来抑制其活性。在热休克时,HSFA1s从HSP70中分离并解除抑制[GydF4y2Ba13GydF4y2Ba].同样,我们的qRT-PCR结果显示GydF4y2BaHSP70/90sGydF4y2Ba是明显下调的吗GydF4y2BaHSFA1S.GydF4y2Ba在热休克中上调。这些结果进一步证实HSFA1从HSP70 / 90的抑制中活跃,HSFA1s由HSP70 / 90负调节。但是,在长期的温暖处理中,虽然是GydF4y2BaHSP70/90sGydF4y2Ba表达水平较低GydF4y2BaHSFA1S.GydF4y2Ba被下调,表明HSFA1s并没有充当中央调节因子,以应对长时间的变暖。GydF4y2Ba
bZIP-TFs是植物内质网胁迫传感器,调节包括脱落酸(ABA)和胁迫信号在内的许多过程,并促进胁迫耐受[GydF4y2Ba27GydF4y2Ba]在我们的研究中,有趣的是指出,随着温度的延长,HSFA1非依赖性途径中的转录因子,如GydF4y2BabZIP9GydF4y2Ba那GydF4y2BabZIP24GydF4y2Ba那GydF4y2BabZIP34GydF4y2Ba和GydF4y2BabZIP63GydF4y2Ba上调。此外,我们的大规模QRT-PCR结果还验证了这些Bzip家族成员,如GydF4y2BabZIP24GydF4y2Ba和GydF4y2BabZIP34GydF4y2Ba,在所有延长温度处理(如第7天)中均上调,而在热休克中均未上调。这些结果表明,长时间的升温和热休克可能会诱导完全不同的热耐受或热适应的热反应途径。GydF4y2Ba
此外,早期暴露于温和的温度胁迫可以增强对热胁迫的耐热性,胁迫启动可能发生在基因转录水平,如GydF4y2BaHSFA2GydF4y2Ba表达式取决于所表示的GydF4y2BaHSFA1GydF4y2Ba亚型(GydF4y2Ba28GydF4y2Ba那GydF4y2Ba29GydF4y2Ba].此外,GydF4y2BaHSP22.0.GydF4y2Ba和GydF4y2BaAPX2GydF4y2Ba与热应激相关的启动可以在热记忆中保持高水平数天[GydF4y2Ba28GydF4y2Ba].这里,我们找到了GydF4y2BaHSFA2GydF4y2Ba那GydF4y2BaHSP22.0.GydF4y2Ba和GydF4y2BaAPX2GydF4y2Ba仅在热休克条件下上调,而在长时间变暖条件下则没有上调,这表明长时间的变暖处理条件(比控制条件高5°C)可能不足以使植物随后在GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2Ba
结论GydF4y2Ba
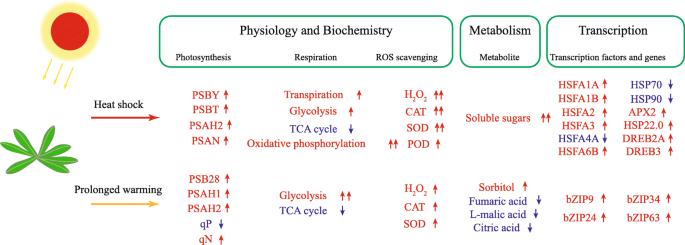
我们的研究提供了生理、转录和代谢反应的详细信息GydF4y2Ba拟南芥GydF4y2Ba到长时间的变暖与热休克(如图所示)。GydF4y2Ba7.GydF4y2Ba).这些多层次的结果的基础上,我们得出这样的结论:植物应对迅速发生热休克主要通过增加蒸腾速率、光合和呼吸电子传递,生产活性氧、抗氧化酶的感应,和HSFA1热应激反应通路的激活。另一方面,植物对气候变暖的响应主要通过气孔导度降低、光合电子传递速率增加、TCA循环受到抑制以及bZIPs激活一个hsfa1无关的响应途径。GydF4y2Ba
方法GydF4y2Ba
植物材料和生长条件GydF4y2Ba
野生型(WT)种子GydF4y2Ba拟南芥GydF4y2Ba哥伦比亚生态型(Col-0)最初是从诺丁汉获得的GydF4y2Ba拟南芥GydF4y2Ba在过去的10年里,在23/18°C(白天/晚上)的生长室中,通过种子繁殖,在我们的实验室中生长了30多代。种子分层在4°C 2天,然后播种盆(650×650×750毫米)充满了蛭石的混合物和泥炭(1:1,v / v),并放置在增长钱伯斯(rxz - 300 b, NingboDongnan仪器有限公司,中国)在23°C(16小时)/ 18°C(8小时)(白天/晚上),一天光强度350μ摩尔·mGydF4y2Ba−2GydF4y2Ba·年代GydF4y2Ba−1GydF4y2Ba相对湿度(RH)保持在80%/90%(白天/晚上)。在真叶出苗后,将幼苗稀释至每盆2或3株,每3株随机重新排列一次 抵消腔室内位置效应的天数(图。GydF4y2Ba1GydF4y2Baa).每周用1/2 Murashige and Skoog溶液或去离子水交替浇水一次。为了消除不同生长室之间可能存在的差异,在植物生长和处理过程中,将每个处理的植株在不同生长室(≥3个)中不规则地交换和迁移。此外,虽然生长室的灵敏度在±0.5°C范围内,但每个生长室都放置了两个温度计,以检查设定温度的准确性。GydF4y2Ba
控制GydF4y2Ba
昼/夜温度设为23/18°C作为对照温度(CK),根据已发表的使用Col-0生态型的研究[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba].播种后30天在植物中取样(在莲座生长阶段)(图。GydF4y2Ba1GydF4y2Bab)。GydF4y2Ba
长时间变暖待遇GydF4y2Ba
在本世纪末,全球平均气温可能会温暖1.5-4°C [GydF4y2Ba31GydF4y2Ba].因此,我们将增温温度设定在CK以上5°C,在播后23 d对植株进行28/23°C(昼/夜)处理7 d,作为延长增温处理。加温处理后,对叶片进行取样分析(图。GydF4y2Ba1GydF4y2Bab)。GydF4y2Ba
热休克治疗GydF4y2Ba
由于37-42°C(44-45°C为致死温度)已被广泛使用GydF4y2Ba拟南芥GydF4y2Ba在热应激研究中,我们设定了38 摄氏6度 h作为热冲击处理的光周期白天部分(图。GydF4y2Ba1GydF4y2Bab)。GydF4y2Ba
因此,3种温度条件下的叶片取样均在播后30 d(3.90生长期)进行。在这个阶段,植株的莲座生长接近完成,叶片充分展开[GydF4y2Ba32GydF4y2Ba].所有叶片样品都立即在液氮中迅速冷冻。同一批次的取样材料用于转录组、代谢组、生理生化分析。GydF4y2Ba
RNA提取,RNA测序和数据分析GydF4y2Ba
分别从对照、长时间增温和热激处理的叶片中分离总RNA,每个生物重复3个,用于RNA提取和测序。所有总RNA样本使用Mini BEST Plant RNA Extraction Kit (TaKaRa,中国大连)提取,并使用基因组DNA擦剂(TaKaRa,中国大连)处理,以减少或消除任何DNA污染。基于illumina的RNA测序在Hiseq™4000平台上进行。在删除包含适配器的读、包含ploy-N的读和低质量的读之后,过滤的读被映射到GydF4y2Ba答:芥GydF4y2Ba基因组(TAIR 10)使用TopHat2。然后根据基因长度计算每个基因的每千碱基转录物每百万次映射读取(RPKM)的读取数,并将读取数映射到该基因。使用DESeq R包(1.18.0)对样本进行差异表达分析。阈值为| logGydF4y2Ba2GydF4y2Ba(fold change)|≥1并调整GydF4y2BaP.GydF4y2Ba- 应用value <0.05以评估转录水平差异的重要性。在加入号GSE118298下,序列数据已沉积在NCBI基因表达式Omnibus(Geo)数据库中。GydF4y2Ba
代谢分析GydF4y2Ba
体积为0.48ml甲醇 - 水(3:1,v / v)和24μladonitol(DH中1mg / ml股)GydF4y2Ba2GydF4y2Bao)在2mL Eppendorf管中加入0.06g各样品,作为内标,然后在50Hz的球磨机中均匀化4分钟,然后在两次上超声处理5分钟(冰水中孵育)。在4℃下以13000×g离心15分钟后,将350μl上清液转移到新鲜的2mL GC / MS玻璃小瓶中。用真空浓缩器干燥样品后,向每个样品中加入80μl甲氧氧胺盐酸甲氧胺(吡啶中20mg / ml)并在80℃下孵育30分钟。然后,加入100μl的BSTFA级(1%TMC,V / V),将混合物在70℃下温育1.5小时,并混合孔,用于GC - 飞行时间(TOF)-MS分析。GydF4y2Ba
使用Agilent 7890气相色谱仪和Pegasus HT飞行时间质谱(Agilent Technologies, Santa Clara, CA, USA)进行GC-TOF-MS分析。在本次代谢组学研究中,每个处理重复至少6个生物学重复。GydF4y2Ba
利用LECO Corporation的Chroma TOF 4.3X软件和LECO- fiehn Rtx5数据库进行原始峰提取、数据基线滤波、基线定标、峰对、反褶积分析、峰识别和峰面积积分。采用保留时间指数(RI)法进行峰鉴定,RI耐受性为5000。GydF4y2Ba
光合能力测定GydF4y2Ba
使用便携式光合系统(Li-6400xt)在成熟的叶子上测量主要的光合参数来量化COGydF4y2Ba2GydF4y2Ba在饱和光和水有效性条件下的吸收。在三个不同处理下,所有样品都在生长室中对完整植株进行了测量。在所有测量过程中,高流速(400ml·min)GydF4y2Ba−1GydF4y2Ba),以保持COGydF4y2Ba2GydF4y2Ba浓度范围:370 ~ 390 μmol·molGydF4y2Ba−1GydF4y2Ba.叶室的温度与处理温度保持一致,所有的测量都在生长室的日照第8 - 9小时进行。光强为1000 μmol量子mGydF4y2Ba−2GydF4y2Ba·年代GydF4y2Ba−1GydF4y2Ba的饱和光合光子通量密度GydF4y2Ba拟南芥GydF4y2Ba.从8种不同植物的8片叶子中测量,以提供每个处理的生物复制。将叶片插入叶室后,所有数据均在稳态下采集。GydF4y2Ba
HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba水平分析GydF4y2Ba
将新鲜切割的叶样品(0.1g)在冰浴中均质化,含有0.9ml的50mmol·LGydF4y2Ba−1GydF4y2BaP.HO.S.P.H一种te buffer (PH7.8) and centrifuged at 10,000×g for 10 min at 4 °C. The H2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba用商业试剂盒(BCA assay,南京建城生物工程研究所,中国南京)比色法测定上清液中的浓度。使用3 - 5片叶片为每个样品提供足够数量的叶片组织(每个处理3次生物重复)。GydF4y2Ba
生理指示器测量GydF4y2Ba
用蒽酮比色法测定上清液中可溶性糖浓度,考马斯亮蓝法测定上清液中可溶性蛋白浓度[GydF4y2Ba33GydF4y2Ba].鲜切叶片样品(0.1 g)用1 mL蒸馏水冰浴均质,置于95℃水浴10分钟。冷却后25℃8000×g离心10 min,用蒸馏水稀释至10 mL。每个重复使用3 - 5片叶片来提供足够数量的叶片组织(每个处理3个生物重复)。GydF4y2Ba
上清液清除超氧自由基的能力采用商用试剂盒(BCA assay,南京建城生物工程研究所,中国南京)测定。用商品试剂盒(Suzhou Comin Bioengineering, Suzhou, China)测定SOD、CAT和POD三种酶的活性。每个重复使用3 - 5片叶片来提供足够数量的叶片组织(每个处理3个生物重复)。GydF4y2Ba
实时逆转录PCR (qRT-PCR)分析GydF4y2Ba
我们进行了QRT-PCR以验证转录组的结果。此外,为了验证编码重要功能的一些所选基因的表达模式,例如转录因子,我们在不同的持续时间内进行了一系列QRT-PCRS。对于热休克,我们包括36℃,38℃和40°C的治疗,并在处理后在1小时,2小时,3小时和6小时取样叶子。对于延长的变暖,我们在26℃,28℃和30℃下包括治疗,并在治疗后6小时,1d,3d和7d取样叶子。将所有叶样样品立即在液氮中冷冻。GydF4y2Ba
每个RNA样本(包含大约1 μg总RNA)用gDNA橡皮(TaKaRa,大连,中国)按照制造商的说明处理,以消除任何污染的gDNA。按照制造商的协议,将处理过的RNA溶液(10 μL)与PrimeScript™逆转录酶试剂试剂盒(带有gDNA擦除器(Perfect Real Time)) (TaKaRa,大连,中国)进行逆转录酶反应。利用Primer 5.0设计基因特异性引物。GydF4y2BaActin2GydF4y2BamRNA作为内参基因。根据生产商的方案,使用Bio-Rad CFX96™Real-Time系统(Bio-Rad,美国)和SYBR Premix Ex Taq™Kit (Perfect Real Time) (TaKaRa,日本)进行定量RT-PCR。qRT-PCR条件为:94℃变性30 s, 94℃变性5 s, 56℃变性30 s, 72℃变性10 s, 40个循环。用2GydF4y2Ba-GydF4y2Ba△GydF4y2Ba△GydF4y2BaCT.GydF4y2Ba比较阈值循环(CT)方法。所有反应在三种生物学复制中进行,并用Bio-Rad CFX管理器V1.6.541.1028软件测定CT值的结果。GydF4y2Ba
统计分析GydF4y2Ba
本研究采用单因素方差分析,然后采用Tukey事后检验,显著性水平为0.05 (GydF4y2BaP.GydF4y2Ba< 0.05) (SPSS 18.0 software for Windows) (SPSS, Chicago, IL, USA) [GydF4y2Ba34GydF4y2Ba].GydF4y2Ba
数据和材料的可用性GydF4y2Ba
在加入号GSE118298下,测序数据可在NCBI基因表达式OMNIBUS(GEO)数据库中使用。支持本文结果的数据集包含在文章和其他文件中。GydF4y2Ba
缩写GydF4y2Ba
- 阿巴:GydF4y2Ba
-
脱落酸GydF4y2Ba
- ACLB:GydF4y2Ba
-
atp -柠檬酸合酶-链GydF4y2Ba
- APX2:GydF4y2Ba
-
抗坏血酸盐过氧化物酶2GydF4y2Ba
- ASC:GydF4y2Ba
-
抗坏血酸盐GydF4y2Ba
- bZIP:GydF4y2Ba
-
基本亮氨酸拉链GydF4y2Ba
- 猫:GydF4y2Ba
-
过氧化氢酶GydF4y2Ba
- CAT2:GydF4y2Ba
-
过氧化氢酶2.GydF4y2Ba
- CCS技术:GydF4y2Ba
-
超氧化物歧化酶的铜伴侣GydF4y2Ba
- chl:GydF4y2Ba
-
叶绿素GydF4y2Ba
- CK:GydF4y2Ba
-
控制GydF4y2Ba
- 考克斯1:GydF4y2Ba
-
细胞色素C氧化酶亚基1GydF4y2Ba
- CSD:GydF4y2Ba
-
超氧化物歧化酶GydF4y2Ba
- 中青旅:GydF4y2Ba
-
细胞色素b6f复合体GydF4y2Ba
- 度:GydF4y2Ba
-
差异表达基因GydF4y2Ba
- 羧酸:GydF4y2Ba
-
脱水反应元件结合蛋白GydF4y2Ba
- FBA1/2:GydF4y2Ba
-
Fructose-bisphosphate醛缩酶1/2GydF4y2Ba
- FDX:GydF4y2Ba
-
FerredoxinGydF4y2Ba
- fum1:GydF4y2Ba
-
富马酸水合酶GydF4y2Ba
- GAPA2:GydF4y2Ba
-
甘油醛3-磷酸脱氢酶A亚基2GydF4y2Ba
- GAPB:GydF4y2Ba
-
甘油醛-3-磷酸脱氢酶B亚基GydF4y2Ba
- 地理:GydF4y2Ba
-
基因表达综合GydF4y2Ba
- 走:GydF4y2Ba
-
基因本体论GydF4y2Ba
- 谷胱甘肽:GydF4y2Ba
-
谷胱甘肽GydF4y2Ba
- HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba:GydF4y2Ba
-
过氧化氢GydF4y2Ba
- HKL 1:GydF4y2Ba
-
六酮酶样1GydF4y2Ba
- HS:GydF4y2Ba
-
热休克GydF4y2Ba
- HSF:GydF4y2Ba
-
热休克因子GydF4y2Ba
- HSFA1:GydF4y2Ba
-
A1级热震动因子GydF4y2Ba
- 热休克:GydF4y2Ba
-
热休克蛋白GydF4y2Ba
- IDH:GydF4y2Ba
-
异柠檬酸脱氢酶GydF4y2Ba
- KEGG:GydF4y2Ba
-
京都基因和基因组百科全书GydF4y2Ba
- LHC I / II:GydF4y2Ba
-
聚光复杂I / IIGydF4y2Ba
- LPD:GydF4y2Ba
-
Dihydrolipoyl脱氢酶GydF4y2Ba
- miETC:GydF4y2Ba
-
线粒体电子传递链GydF4y2Ba
- MLS:GydF4y2Ba
-
苹果酸合成酶GydF4y2Ba
- NAD1B/C:GydF4y2Ba
-
NADH脱氢酶GydF4y2Ba
- NADH:GydF4y2Ba
-
烟酰胺腺嘌呤二核苷酸GydF4y2Ba
- OPLS-DA:GydF4y2Ba
-
用判别分析对潜在结构进行正交投影GydF4y2Ba
- PC:GydF4y2Ba
-
质体蓝素GydF4y2Ba
- PCA:GydF4y2Ba
-
主要成分分析GydF4y2Ba
- PER25:GydF4y2Ba
-
过氧化物酶25.GydF4y2Ba
- PKP4:GydF4y2Ba
-
质体丙酮酸激酶4GydF4y2Ba
- PMDH1:GydF4y2Ba
-
蛋白苹果酸脱氢酶GydF4y2Ba
- 圆荚体:GydF4y2Ba
-
过氧化物酶GydF4y2Ba
- PQ:GydF4y2Ba
-
质体醌GydF4y2Ba
- PS I / II:GydF4y2Ba
-
光系统I / IIGydF4y2Ba
- PW:GydF4y2Ba
-
长时间变暖GydF4y2Ba
- 问题:GydF4y2Ba
-
Non-photochemical淬火GydF4y2Ba
- 表示为:GydF4y2Ba
-
光化学猝灭GydF4y2Ba
- 存在:GydF4y2Ba
-
实时反转录PCRGydF4y2Ba
- 红细胞:GydF4y2Ba
-
核糖糖二磷酸羧化酶GydF4y2Ba
- 活性氧:GydF4y2Ba
-
活性氧物种GydF4y2Ba
- SDH:GydF4y2Ba
-
琥珀酸脱氢酶GydF4y2Ba
- 扫描电镜:GydF4y2Ba
-
扫描电子显微镜GydF4y2Ba
- 草皮:GydF4y2Ba
-
超氧化物歧化酶GydF4y2Ba
- 柠檬酸:GydF4y2Ba
-
三羧酸GydF4y2Ba
- TFS:GydF4y2Ba
-
转录因素GydF4y2Ba
- Wrkys:GydF4y2Ba
-
衣衫转录因素GydF4y2Ba
- YMF19:GydF4y2Ba
-
ATP合酶蛋白YMF19GydF4y2Ba
参考GydF4y2Ba
- 1.GydF4y2Ba
Wahid A,Gelani S,Ashraf M,愚人衣Mr。植物中的耐热性:概述。Environ Exp Bot。2007; 61:199-223。GydF4y2Bahttps://doi.org/10.1016/j.envexpbot.2007.05.011GydF4y2Ba.GydF4y2Ba
- 2.GydF4y2Ba
Wolkovich Em,Cook Bi,Allen JM,Crimmins TM,Betancourt JL,Travers SE等。温暖实验削弱植物危害气候变化的植物鉴定。自然。2012; 485:494-7。GydF4y2Bahttps://doi.org/10.1038/nature11014GydF4y2Ba.GydF4y2Ba
- 3.GydF4y2Ba
斯普林盖特地方检察官,科弗PX。植物对高温的响应:对模拟气候变暖的物候敏感性和适应性响应的实地研究。中国科学(d辑:地球科学)GydF4y2Bahttps://doi.org/10.1111/gcb.12430GydF4y2Ba.GydF4y2Ba
- 4.GydF4y2Ba
HEDHLY A,Hormaza Ji,Herroero M.全球变暖和性植物繁殖。趋势植物SCI。2009; 14:30-6。GydF4y2Bahttps://doi.org/10.1016/j.tplants.2008.11.001GydF4y2Ba.GydF4y2Ba
- 5.GydF4y2Ba
Ainsworth Ea,Ort Dr。我们如何在温暖的世界中改善作物生产?植物理性。2010; 154:526-30。GydF4y2Bahttps://doi.org/10.1104/pp.110.161349GydF4y2Ba.GydF4y2Ba
- 6.GydF4y2Ba
林丹,夏军,万胜。气候变暖与陆地植物生物量积累的meta分析。新植醇。2010;188:187 - 98。GydF4y2Bahttps://doi.org/10.1111/j.1469-8137.2010.03347.xGydF4y2Ba.GydF4y2Ba
- 7.GydF4y2Ba
陈建平。气候变化对植物群落和生态系统的影响。中国科学(d辑:地球科学)2010;GydF4y2Bahttps://doi.org/10.1098/rstb.2010.0021GydF4y2Ba.GydF4y2Ba
- 8.GydF4y2Ba
金波,李伟,景伟,姜克忠,杨伟,江XX,倪春英,王玉玲,滕乃杰。试验增温对水稻叶片功能性状、结构和生物化学的影响GydF4y2Ba拟南芥GydF4y2Ba《BMC植物生物学》2011;11:35。GydF4y2Bahttps://doi.org/10.1186/1471-2229-11-35GydF4y2Ba.GydF4y2Ba
- 9.GydF4y2Ba
Way DA,Yamori W.光合作用的热适应:关于调整我们的定义和解释呼吸热适应的重要性。Photosynth Res.2014;119:89–100。GydF4y2Bahttps://doi.org/10.1007/s11120-013-9873-7GydF4y2Ba.GydF4y2Ba
- 10.GydF4y2Ba
Glaubitz U, Li X, Schaedel S, Erban A, Sulpice R, Kopka J, Hincha DK, Zuther E.对夜间温度升高的水稻转录组和代谢组反应的综合分析确定了敏感性和耐受性相关的特征。植物学报。2017;40:121-37。GydF4y2Bahttps://doi.org/10.1111/pce.12850GydF4y2Ba.GydF4y2Ba
- 11.GydF4y2Ba
Pospíšil P.光系统II对光和温度胁迫的反应产生活性氧。植物学报2016;7:1950。GydF4y2Bahttps://doi.org/10.3389/fpls.2016.01950GydF4y2Ba.GydF4y2Ba
- 12.GydF4y2Ba
Bita Ce,Gerats T.植物耐受性耐高温的耐受性:科学基础知识和生产热胁迫耐受作物。前植物SCI。2013; 4:273。GydF4y2Bahttps://doi.org/10.3389/fpls.2013.00273GydF4y2Ba.GydF4y2Ba
- 13.GydF4y2Ba
植物热胁迫反应的转录调控网络。植物学报。2017;22:53-65。GydF4y2Bahttps://doi.org/10.1016/j.tplants.2016.08.015GydF4y2Ba.GydF4y2Ba
- 14.GydF4y2Ba
牛燕,向阳。生物膜在植物高温胁迫响应中的作用研究进展。植物科学学报2018;GydF4y2Bahttps://doi.org/10.3389/fpls.2018.00915GydF4y2Ba.GydF4y2Ba
- 15.GydF4y2Ba
(1)表型可塑性与生长温度:对种间变异的理解。J Exp Bot. 2006; 57:267-81。GydF4y2Bahttps://doi.org/10.1093/jxb/erj029GydF4y2Ba.GydF4y2Ba
- 16.GydF4y2Ba
Ashraf M, Harris PJC。压力环境下的光合作用:概述。Photosynthetica。2013;51:163 - 90。GydF4y2Bahttps://doi.org/10.1007/s11099-013-0021-6GydF4y2Ba.GydF4y2Ba
- 17.GydF4y2Ba
Sakata S, Mizusawa N, Kubotakawai H, Sakurai I, Wada H. Psb28参与高温下光系统II的恢复GydF4y2BaSyneChocystis.GydF4y2Basp。PCC 6803. Biochim Biophys Acta。2013; 1827:50-9。GydF4y2Bahttps://doi.org/10.1016/j.babio.2012.10.004GydF4y2Ba.GydF4y2Ba
- 18.GydF4y2Ba
关键词:热胁迫,光合作用,分子响应Photosynth杂志2008;98:541-50。GydF4y2Bahttps://doi.org/10.1007/s11120-008-9331-0GydF4y2Ba.GydF4y2Ba
- 19.GydF4y2Ba
Patrick JW,BIRCH RG。植物中糖和简单糖衍生物的代谢工程。植物Biotechnol J. 2013; 11:142-56。GydF4y2Bahttps://doi.org/10.1111/pbi.12002GydF4y2Ba.GydF4y2Ba
- 20GydF4y2Ba
王志强,王志强,王志强,等。植物光合作用后碳向糖醇的分配及其对植物生长的影响。植物化学。2017;144:243-52。GydF4y2Bahttps://doi.org/10.1016/j.phytochem.2017.09.019GydF4y2Ba.GydF4y2Ba
- 21GydF4y2Ba
Lismont C,Nordgren M,Van Veldhoven PP,Fransen M.氧化还原在线粒体和过氧化血之间的相互作用。前电池驱动BIOL。2015; 3:35。GydF4y2Bahttps://doi.org/10.3389/fcell.2015.00035GydF4y2Ba.GydF4y2Ba
- 22GydF4y2Ba
引用本文:王志强,王志强,王志强,等。光合作用叶绿体中氧化还原和活性氧依赖信号通路的研究进展。植物杂志。2016;171:1541-50。GydF4y2Bahttps://doi.org/10.1104/pp.16.00375GydF4y2Ba.GydF4y2Ba
- 23GydF4y2Ba
太阳艾兹,郭FQ。叶绿体逆行调节植物中热应激反应的调节。前植物SCI。2016; 7:398。GydF4y2Bahttps://doi.org/10.3389/fpls.2016.00398GydF4y2Ba.GydF4y2Ba
- 24.GydF4y2Ba
王志强,王志强,王志强,等。耐高温转基因植物的研究进展。植物科学。2013;205 - 206:38 47岁。GydF4y2Bahttps://doi.org/10.1016/j.plantsci.2013.01.005GydF4y2Ba.GydF4y2Ba
- 25.GydF4y2Ba
赵军,何强,陈刚,王磊,金波。非编码rna在植物热胁迫响应中的调控作用。植物科学学报2016;7:1213。GydF4y2Bahttps://doi.org/10.3389/fpls.2016.01213GydF4y2Ba.GydF4y2Ba
- 26.GydF4y2Ba
Yoshida T, Ohama N, Nakajima J, Kidokoro S, Mizoi J, Nakashima K,等。GydF4y2Ba拟南芥GydF4y2BaHSFA1转录因子用作热冲击响应基因表达中的主要阳性调节因子。Mol Gen Genomics。2011; 286:321-32。GydF4y2Bahttps://doi.org/10.1007/s00438-011-0647-7GydF4y2Ba.GydF4y2Ba
- 27.GydF4y2Ba
陈志强,邓玉华,王志强。植物内质网应力传感器的研究进展。植物学报。2014;5:59。GydF4y2Bahttps://doi.org/10.3389/fpls.2014.00059GydF4y2Ba.GydF4y2Ba
- 28.GydF4y2Ba
Bäurle I.植物热适应:对热胁迫的启动反应。F1000research。2016; 5:694。GydF4y2Bahttps://doi.org/10.12688/f1000research.7526.1GydF4y2Ba.GydF4y2Ba
- 29.GydF4y2Ba
Lämke J, Brzezinka K, Altmann S, Bäurle i。EMBO j . 2016; 35:162 - 75。GydF4y2Bahttps://doi.org/10.15252/embj.201592593GydF4y2Ba.GydF4y2Ba
- 30.GydF4y2Ba
王志强,王志强,王志强,等GydF4y2Ba拟南芥GydF4y2Ba通过提高生长温度开花。公共科学图书馆麝猫。2006;2:e106。GydF4y2Bahttps://doi.org/10.1371/journal.pgen.0020106GydF4y2Ba.GydF4y2Ba
- 31.GydF4y2Ba
王志强,王志强,王志强,等。气候模式的评估。见:Stocker TF, Qin D, Plattner G-K, Tignor M, Allen SK, Boschung J, Nauels A, Xia Y, Bex V, Midgley PM,编辑。气候变化。2013:自然科学基础。第一工作组对政府间气候变化专门委员会第五次评估报告(第5卷)的贡献。剑桥:剑桥大学出版社;2013.p . 741 - 866。GydF4y2Ba
- 32.GydF4y2Ba
Boyes DC, Zayed AM, Ascenzi R, Mccaskill AJ, Hoffman NE, Davis KR, Görlach J.生长阶段表型分析GydF4y2Ba拟南芥GydF4y2Ba:植物高通量功能基因组学模型。植物细胞。2001;13:1499 - 510。GydF4y2Bahttps://doi.org/10.1105/tpc.13.7.1499GydF4y2Ba.GydF4y2Ba
- 33.GydF4y2Ba
任树华,马凯,卢振华,陈光,崔建平,王磊,滕宁,金波。玉米热胁迫反应的转录组学和代谢组学分析GydF4y2BaPopulus tomentosaGydF4y2Ba卡车。森林。2019; 10:383。GydF4y2Bahttps://doi.org/10.3390/F10050383GydF4y2Ba.GydF4y2Ba
- 34.GydF4y2Ba
Allen P,Bennett K,J.Pasw统计到SPSS,一个实用指南:18.0版。墨尔本:康复学习媒体;2010年。GydF4y2Ba
确认GydF4y2Ba
我们感谢Novogene Company(北京)帮助转录组测序和Biotree Bio-Technology(Shanghai)帮助代谢组学数据分析。我们感谢LX Huang-Fu博士为衡量光合容量的帮助。JY Chu复制了稿件。GydF4y2Ba
资金GydF4y2Ba
这项工作得到了中国国家重点研究和发展方案(2016年FD0600105)的资助,授予NJT和香港研究助理理事会计划(AOE / M-403/16)颁发给HML。该资助者在研究和收集,分析和数据的设计方面没有作用,以及编写稿件。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
LW, KBM, HML和BJ设计了研究。KBM、ZGL和SXR进行了试验并对结果进行了分析。LW, KBM, BJ和HML撰写了手稿。HRJ、JWC、GC和NJT参与了结果分析和资料解释。HML对手稿进行了严格的修改。所有作者都已阅读并批准了最终稿。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
附加信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:图S1。GydF4y2Ba
代谢组学分析的主成分分析(PCA)和基于判别分析的潜在结构正交投影(OPLS-DA)。GydF4y2Ba(一)GydF4y2BaPCA分数绘图。GydF4y2Ba(b) - (d)GydF4y2BaOPLS-DA分数:GydF4y2Ba(b)GydF4y2Ba控制(CK)VS热冲击(HS);GydF4y2Ba(c)GydF4y2Ba对照(CK)与长期变暖(PW);GydF4y2Ba(d)GydF4y2Ba延长变暖(PW) vs热休克(HS)。黑圈:控制;红方:长暖;蓝色三角形:热冲击。每次处理包含6个生物重复。GydF4y2Ba
附加文件2:图S2。GydF4y2Ba
基因表达比较。GydF4y2Ba(一)GydF4y2Ba差异表达基因(DEGs)数量的维恩图。重叠组中的数字显示了在两到三组成对比较中差异表达的基因数量。GydF4y2Ba(b) - (d)GydF4y2Ba京都基因和基因组百科全书(KEGG)途径富集的二甲基异位基因。GydF4y2Ba(b)GydF4y2Ba对照(CK) vs热休克(HS);GydF4y2Ba(c)GydF4y2Ba对照(CK)与长期变暖(PW);GydF4y2Ba(d)GydF4y2Ba延长变暖(PW) vs热休克(HS)。点的大小与相关基因的数量成比例。当q值接近0时,圆点的颜色更接近红色。当q < 0.05时,这些基因被认为在统计学上显著过度代表,即富集。(b)和(c)中的红色箭头表示参与核糖体、天线蛋白、光合作用和柠檬酸循环的deg富集途径;(d)中的红色箭头表示最重要的富集途径。GydF4y2Ba
附加文件3:图S3。GydF4y2Ba
基因本体学(GO)富集DEGS。(a)热冲击(HS)VS控制(CK);(b)延长变暖(PW)VS控制(CK);(c)延长变暖(PW)VS热冲击(HS)绿棒代表响应外部刺激而参与生物过程的基因,橙色条代表参与细胞组分结构的那些。GydF4y2Ba
附加文件4:表S1GydF4y2Ba
.Illumina深度测序样品读稿摘要GydF4y2Ba
附加文件5:表S2。GydF4y2Ba
利用qRT-PCR技术对紫花苜蓿叶片进行定量pcrGydF4y2BaA. Thaliana。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
王磊,马建军。陆,ZG。GydF4y2Ba等等。GydF4y2Ba长期升温和热休克下拟南芥叶片的差异生理、转录组学和代谢组学反应。GydF4y2BaBMC植物杂志GydF4y2Ba20,GydF4y2Ba86(2020)。https://doi.org/10.1186/s12870-020-2292-0.GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-020-2292-0.GydF4y2Ba
关键词GydF4y2Ba
- 拟南芥GydF4y2Ba
- 气候变暖GydF4y2Ba
- 热应力GydF4y2Ba
- 组学GydF4y2Ba
- 光合作用GydF4y2Ba
- 呼吸GydF4y2Ba
- 转录因素GydF4y2Ba