- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
Nerylneryl二磷酸是serrulatane,viscidane和西松烷型二萜的前体gydF4y2BaEremophila.gydF4y2Ba物种gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba91gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
Eremophila.gydF4y2BaR.Br。(玄参科)是一个多样化的植物属,其物种分布在半干旱和干旱的澳大利亚。它是一个重要的生态属,对许多传统上使用多种物种作为药物来源的土著澳大利亚人来说也具有文化意义。结构上不同寻常的二萜,特别是serrulatane和内脏甾类,在许多物种的化学特征中占有显著地位,最近的研究表明,这些化合物是报道的大部分生物活性的来源。我们研究了三种植物中二萜的生物合成:gydF4y2BaEremophila最亮的星gydF4y2Ba,gydF4y2BaEremophila drummondiigydF4y2Ba和gydF4y2BaEremophila denticulata.gydF4y2Ba亚普。gydF4y2BatrisulcatagydF4y2Ba.gydF4y2Ba
结果gydF4y2Ba
在所有研究中,物种用二萜酸层本地化到叶片表面并与腺体胎儿的发生相关。生成富集的转录组数据库并为候选萜烯合成酶(TPS)产生。鉴定了四种具有二萜生物合成活性的TPS:gydF4y2Ba埃尔gydF4y2BaTPS31和gydF4y2Ba埃尔gydF4y2BaTPS3来自gydF4y2BaE. lucida.gydF4y2Ba被发现生产(3gydF4y2BaZgydF4y2Ba,7gydF4y2BaZgydF4y2Ba11.gydF4y2BaZgydF4y2Ba)-cembratrien-15-ol和5- hydroxyvisidane,和gydF4y2Ba艾德gydF4y2BaTPS22和gydF4y2Ba美东时间gydF4y2BaTPS4,从gydF4y2BaE. Drummondii.gydF4y2Ba和gydF4y2Ba大肠denticulatagydF4y2Ba亚普。gydF4y2Batrisulcata,gydF4y2Ba分别生成8,9-二氢serrulat-14-ene,易于芳香化为serrulat-14-ene。在所有情况下,被识别的tss使用gydF4y2Bacisoid.gydF4y2Ba底物,nerylneryl二磷酸(NNPP),形成观察产物。随后,gydF4y2Ba独联体gydF4y2Ba每一种植物中均检测到能产生NNPP的-戊烯酰转移酶(cpt)。gydF4y2Ba
结论gydF4y2Ba
我们阐明了朝向该属中存在的三个主要底骨骨折的生物合成步骤。浆液和Viscidane型二萜是新药铅的有希望的候选者。鉴定其合成的酶促途径开辟了生物技术生产的可能性,使得可访问的支架源用于进一步修饰和生物活性测试。gydF4y2Ba
背景gydF4y2Ba
Eremophila.gydF4y2BaR.Br。(玄参科)是澳大利亚大陆特有的一个大而多样的植物属。这个属的成员遍布整个大陆,在西澳大利亚发现的物种多样性最大[gydF4y2Ba1gydF4y2Ba].物种的范围从匍匐地面覆盖到大灌木形式和主要见于半干旱到干旱地区。gydF4y2BaEremophila.gydF4y2Ba是许多土着澳大利亚人的传统草药的重要来源[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].尽管不同群落之间药物制备的种类和方法不同,但叶子是最常用的植物部分。它们可用于新鲜或干燥、煮沸、捣碎成糊状或与油混合制成治疗制剂,用于治疗多种疾病。报告的用途包括治疗皮肤和眼睛感染[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba],发烧[gydF4y2Ba3.gydF4y2Ba],疼痛[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba],咳嗽和感冒[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba5gydF4y2Ba]胃肠道抱怨[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,以及炎症[gydF4y2Ba3.gydF4y2Ba].调查选定的具体活动gydF4y2BaEremophila.gydF4y2Baspp。提取物已发现了一系列不同的生物学活性,包括抗病毒[gydF4y2Ba6gydF4y2Ba],抗菌[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba],抗癌[gydF4y2Ba10.gydF4y2Ba,抑制离子通道[gydF4y2Ba11.gydF4y2Ba].二萜类,特别是蛇醛,已被鉴定为观察到许多提取物的生物活性的主要来源,并且已被证明具有抗疟疾[gydF4y2Ba12.gydF4y2Ba],抗菌[gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba],抗糖尿病[gydF4y2Ba18.gydF4y2Ba,gydF4y2Ba19.gydF4y2Ba]和抗炎的[gydF4y2Ba13.gydF4y2Ba)活动。进一步报道从植物中分离的结构相关二萜的生物活性gydF4y2BaLeucophyllum frutescensgydF4y2Ba(玄参科)gydF4y2Ba20.gydF4y2Ba]及多种海柳珊瑚[gydF4y2Ba21.gydF4y2Ba支持这组分子作为新药物先导物的潜在来源。gydF4y2Ba
二萜化学gydF4y2BaEremophila.gydF4y2Ba被多样化的超过100个不同的结构报告最新[gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba18.gydF4y2Ba,gydF4y2Ba19.gydF4y2Ba,gydF4y2Ba22.gydF4y2Ba].线性、大环和多环结构在整个属中都有代表,但没有与labdan二萜相关的(这通常是在植物中发现的主要类)[gydF4y2Ba23.gydF4y2Ba)已被报道。相反,许多二萜似乎是倍半萜的C20类似物,带有未环化的第四戊烯基。由于它们不同寻常的结构和作为药物先导物的潜力,我们开始鉴定其中涉及的酶gydF4y2BaEremophila.gydF4y2Ba二萜生物合成。gydF4y2Ba
从属于萜烯合酶(TPS)家族的酶的不同长度的线性戊戊酰二磷酸酯是生物合成的[gydF4y2Ba24.gydF4y2Ba],它是基于系统发生关系分为亚家族(TPS-a至TPS-H)[gydF4y2Ba24.gydF4y2Ba,gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba].的主要途径在被子植物二萜类化合物涉及两个的的TPS顺序活性(II类接着类I)和通向半日花相关二萜类化合物(其特征在于,萘烷核心)的形成[gydF4y2Ba23.gydF4y2Ba].也可以直接从香叶基香叶基二磷酸(GGPP)或香叶基二磷酸(NNPP)中合成二萜gydF4y2Ba独联体gydF4y2BaGGPP的异构体)通过I类TPSS单独生成线性[gydF4y2Ba27.gydF4y2Ba,gydF4y2Ba28.gydF4y2Ba],宏过[gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba]及(聚)环[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba)产品。这些酶催化金属离子依赖的二磷酸盐键的戊二酰二磷酸盐底物的电离,生成一个活性碳正离子分子。然后这个中间产物经历一系列的重排(例如氢化物和烷基位移、质子转移、去质子化和重质子化)和/或环化[gydF4y2Ba36gydF4y2Ba].这些反应级联的具体途径取决于底物与活性位点残基的相互作用,有时还取决于水分子。然后,通过从碳正离子中提取质子生成二萜烯烃或用水淬灭碳正离子生成羟基化二萜,生成萜烯产品。gydF4y2Ba
tps使用的线性戊二烯基二磷酸前体是由两个C5异构结构块,异戊二烯基二磷酸(IPP)和二甲基烯基二磷酸(DMAPP)衍生而来。在头尾缩合反应中,IPP依次与DMAPP或现有较长的链戊二酸酯受体连接,形成不同链长的戊二酸酯。gydF4y2Ba反式-gydF4y2Ba戊酮是植物TPS的典型底物,并通过不同的短链进行生物合成gydF4y2BatransgydF4y2Ba-prenyl转移酶(gydF4y2BatransgydF4y2Ba用于产生特定链长度的产物的p:geranyl二磷酸合酶(GPP,C10),(gydF4y2BaEgydF4y2Ba,gydF4y2BaEgydF4y2Ba)-法尼基二磷酸合酶((gydF4y2BaEgydF4y2Ba,gydF4y2BaEgydF4y2Ba)-FPPS,C15),天竺葵二磷酸二磷酸合酶(GGPPS,C20)和最近鉴定的甲苯基二磷酸二磷酸合酶(GFPPS,C25)[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba].已知有限数量的植物TPS使用gydF4y2Ba顺式gydF4y2Ba戊基二磷酸作为基材[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].gydF4y2Ba独联体gydF4y2Ba- 戊基二磷酸酯是由已知的一系列酶的生物合成的gydF4y2Ba独联体gydF4y2Ba- 戊基转移酶(CPTS)与...进化无关gydF4y2BatransgydF4y2Ba分。它们还能生物合成不同链长的戊二磷酸酯,大致定义为短链(C10-C20)、中链(C35-C55)、长链(C80-C95)和极长链(> C50000) [gydF4y2Ba45gydF4y2Ba],后者涉及天然橡胶生物合成[gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].大多数报道彩管生产中,长链产品,如中涉及的核心代谢过程[多萜gydF4y2Ba45gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].一些研究报道了短链生物合成活性cts参与萜类生物合成途径。例如,在gydF4y2BaSolanum.gydF4y2Ba一组短链cts已被确认参与单、倍半和二萜生物合成[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].gydF4y2Ba
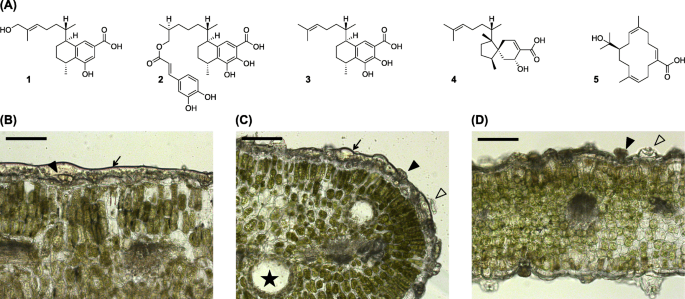
除了单个报告调查萜类合成gydF4y2BaEremophila serrulatagydF4y2Ba其中两个单萜合成酶被鉴定为多功能月桂烯/gydF4y2BaZgydF4y2Ba- (β) - 单亚胺合成酶[gydF4y2Ba51gydF4y2Ba的研究,没有关于萜类生物合成gydF4y2BaEremophila.gydF4y2Ba在文献中被发现。调查二萜类生物合成gydF4y2BaEremophila.gydF4y2Ba我们选择了三种具有不同二萜谱的物种进行分析:gydF4y2BaE. lucida.gydF4y2BaChinnock,gydF4y2BaE. Drummondii.gydF4y2Baf . Muell和gydF4y2Ba大肠denticulatagydF4y2Ba亚普。gydF4y2BatrisulcatagydF4y2Bachinnock。所有物种都是西澳大利亚南部的地方性,并在开放的一系列土壤类型上成长为中等大小的灌木gydF4y2Ba桉树gydF4y2Ba林地(gydF4y2Ba1gydF4y2Ba].的乙酸乙酯叶提取物gydF4y2BaE. lucida.gydF4y2Ba由两个二萜类化合物为主:双环viscidane,5- hydroxyviscida -3,14-二烯-20-酸OIC(gydF4y2Ba4gydF4y2Ba;无花果。gydF4y2Ba1gydF4y2Ba)和致癌化合物,15-羟基(15-羟基)-3,7,11-11-11-19-甲酸(gydF4y2Ba5gydF4y2Ba;无花果。gydF4y2Ba1gydF4y2Ba)[gydF4y2Ba18.gydF4y2Ba].CoumpoundgydF4y2Ba4gydF4y2Ba被鉴定为蛋白质酪氨酸磷酸酶1B(PTP1B)的抑制剂,II型糖尿病治疗剂的潜在靶标[gydF4y2Ba18.gydF4y2Ba].相比之下,二萜图谱gydF4y2BaE. Drummondii.gydF4y2Ba和gydF4y2Ba大肠denticulatagydF4y2Ba亚普。gydF4y2BatrisulcatagydF4y2Ba以血清素存在的特征(图。gydF4y2Ba1gydF4y2Ba)[gydF4y2Ba19.gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,其中一些来自gydF4y2BaE. Drummondii.gydF4y2Ba也被报道抑制PTB1B和α-葡萄糖苷酶[gydF4y2Ba19.gydF4y2Ba].gydF4y2Ba
一个gydF4y2Ba报道的二萜的例子gydF4y2Ba大肠denticulatagydF4y2Ba亚普。gydF4y2BatrisulcatagydF4y2Ba: 8,17-二羟基serrulat-14-en-19-oic酸(gydF4y2Ba1gydF4y2Ba)[gydF4y2Ba52gydF4y2Ba];gydF4y2BaE. Drummondii.gydF4y2Ba:7,8-二羟基-16-碳咖啡氧烷二氧化铝-19-OIC酸(gydF4y2Ba2gydF4y2Ba), 7,8-二羟基serrulat-14-en-19-oic酸(gydF4y2Ba3.gydF4y2Ba)[gydF4y2Ba19.gydF4y2Ba];gydF4y2BaE. lucida.gydF4y2Ba: 5-羟基粘度-3,14-二烯-20-酸(gydF4y2Ba4gydF4y2Ba), (3gydF4y2BaZgydF4y2Ba, 7gydF4y2BaEgydF4y2Ba, 11gydF4y2BaZgydF4y2Ba)-15-羟基汞-3,7,11-三连 - 19-OIC酸(gydF4y2Ba5gydF4y2Ba)[gydF4y2Ba18.gydF4y2Ba].亮场图象gydF4y2BaEremophila.gydF4y2Baspp。叶横截面:gydF4y2BabgydF4y2Ba大肠denticulatagydF4y2Ba副gydF4y2Ba.trisulcatagydF4y2Ba, (gydF4y2BacgydF4y2Ba)gydF4y2BaE. Drummondii.gydF4y2Ba和(gydF4y2BadgydF4y2Ba)gydF4y2BaE. lucida.gydF4y2Ba.箭头表示树脂层涂覆叶片表面,填充箭头表示腺毛状体,空箭头表示凸起的气孔和恒星表示内部油腺。秤杆=100μmgydF4y2Ba
在这里,我们描述4周中的TPS鉴定和功能特性,它们一起占生产三大二萜骨架的发现对面gydF4y2BaE. lucida.gydF4y2Ba,gydF4y2BaE. Drummondii.gydF4y2Ba和gydF4y2Ba大肠denticulatagydF4y2Ba亚普。gydF4y2Batrisulcata。gydF4y2Ba与大多数已知的植物二萜合成酶(diTPSs)相比,它们使用的是C20gydF4y2Bacisoid.gydF4y2Ba前体,NerylneryL二磷酸(NNPP),如底物。因此,我们还确定了能够产生NNPP的每个物种中的一个CPT。gydF4y2Ba
结果gydF4y2Ba
叶子gydF4y2BaE. lucida.gydF4y2Ba,gydF4y2BaE. Denticulata Subsp。trisulcatagydF4y2Ba和gydF4y2Ba大肠drummundiigydF4y2Ba被树脂渗出物覆盖(图。gydF4y2Ba1gydF4y2Ba).液相色谱-高分辨质谱gydF4y2Ba
(LC-HRMS)分析该树脂层显示存在gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba从这些物种报道的二萜类化物期望值(图。gydF4y2Ba1gydF4y2Ba和附加文件gydF4y2Ba2gydF4y2Ba:图S1)[gydF4y2Ba18.gydF4y2Ba,gydF4y2Ba19.gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].叶片显微镜检查显示,在所有物种的叶片的正面和背面都有盾状腺毛。毛状体由短茎和8个分泌细胞组成,总直径30 ~ 40 μm。基于我们的研究结果表明二萜的表面定位,结合腺毛状体在众多物种中萜类生物合成中的既定作用[gydF4y2Ba55gydF4y2Ba]我们推测他们也会有这种功能gydF4y2BaEremophila.gydF4y2Ba.因此,毛状体是转录组学的目标。gydF4y2Ba
刷牙和冰磨损方法是不成功在从叶表面去除在表皮和大量树脂渗出物覆盖的叶表面(图他们的嵌入式定位的大概是因为腺毛。gydF4y2Ba1gydF4y2Ba).因此,一种新的腺分离方法被开发。此过程涉及闪光冷冻夹在两个塑料板之间的叶材料,接着两个板的突然分离。这导致在树脂和腺毛粘到表面与其它叶材料的最小的粘附。所述材料粘附到所述板,用预冷的RNA分离/裂解缓冲液洗掉,所述混合物中收集,机械破碎,最后提取RNA。将得到的RNA用于利用Illumina HiSeq 2500技术(转录组统计看到附加文件来生成毛状体富集的转录gydF4y2Ba1gydF4y2Ba:表S1)。gydF4y2Ba
为了初步了解毛状体中萜类生物合成的活性,我们从甲戊酸(MVA)和2-中寻找了参与萜类代谢的上游基因gydF4y2BaCgydF4y2Ba-甲基- d -赤藓糖醇4-磷酸(MEP)途径gydF4y2Ba拟南芥gydF4y2Ba蛋白质序列作为疑问。在所有三个的胎儿体转录omgydF4y2BaEremophila.gydF4y2Ba检测到MVA和MEP途径中每一步基因的物种转录本(附加文件)gydF4y2Ba1gydF4y2Ba:表S2)。gydF4y2Ba
使用具有已知TPS的同源性搜索在文库中识别编码候选TPS的转录物。可以克隆6,12和8个可能全长TPS的识别候选者gydF4y2Ba大肠denticulatagydF4y2Ba亚普。gydF4y2BatrisulcatagydF4y2Ba,gydF4y2BaE. Drummondii.gydF4y2Ba和gydF4y2BaE. lucida.gydF4y2Ba分别滴塞cDNA(附加文件gydF4y2Ba1gydF4y2Ba:表S3)。候选TPS的系统发育分析表明TPS-A和TPS-B亚壳中的显着膨胀(图。gydF4y2Ba2gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba:表S4)。六中的TPS发现形成TPS-一个分支内的集群。最密切相关的特点来的TPS这个星团是唇形科倍半萜合酶(sesquiTPSs)制备环倍半萜gydF4y2BaPV.gydF4y2BaHVS,最近报道的DITPgydF4y2Ba夏枯草gydF4y2Ba[gydF4y2Ba35gydF4y2Ba].不同于预期定位于胞质的倍半多酚,所有的gydF4y2BaEremophila.gydF4y2Ba此分支的分别的TPS预测到质类似的攻击目标,以gydF4y2BaPV.gydF4y2Ba可信度。有趣的是,这个分支包含了每个物种中富含trichome的转录组库中许多高表达的tps(基于TPM)。gydF4y2BaElTPS3gydF4y2Ba,gydF4y2BaEdTPS22gydF4y2Ba和gydF4y2BaEdtTPS4gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba:表S3)。一秒gydF4y2BaEremophila.gydF4y2Ba观察到与TPS-b亚家族中参与环单萜类生物合成的tps聚类(图)。gydF4y2Ba2gydF4y2Ba).同样,这些候选人中有几个TPM值很高(gydF4y2BaElTPS31gydF4y2Ba和gydF4y2BaEdTPS6gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba:表S3)。gydF4y2Ba
系统发育分析gydF4y2BaEremophila.gydF4y2BaTPSS。基于使用Mega 7计算的对齐蛋白序列的TPS的最大似然树[gydF4y2Ba56gydF4y2Ba].树是按比例绘制的,分枝长度代表每个位点的替换数。分支上的填充圆圈表示基于1000次重复的引导支持超过75%。Genbank登录号码列在表S3和S4(附加文件gydF4y2Ba1gydF4y2Ba).使用deeploc-1.0预测的亚细胞定位[gydF4y2Ba57gydF4y2Ba]gydF4y2Ba
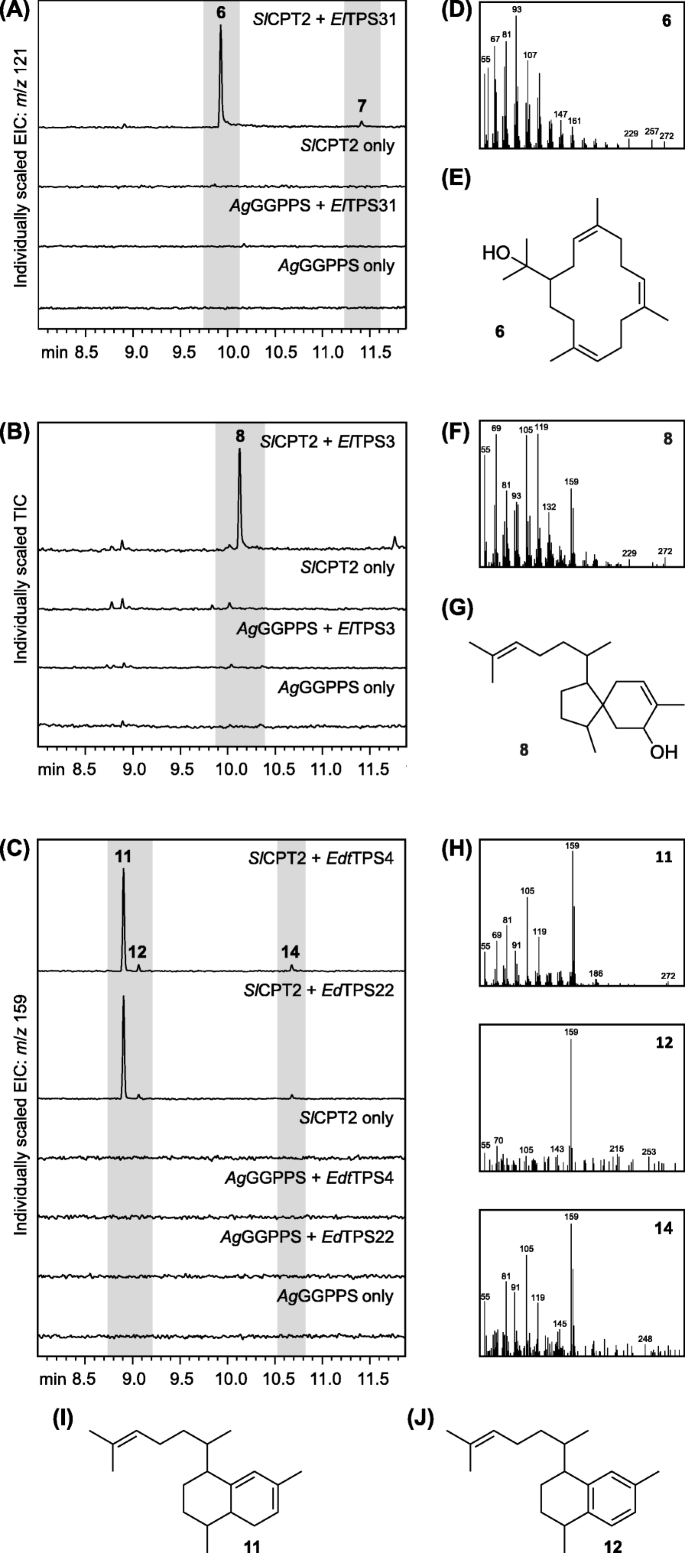
所有26个TPS候选者都被筛选用于DITPS活动gydF4y2Ba农杆菌属gydF4y2Ba-介导的瞬时表达gydF4y2Ba烟草benthamianagydF4y2Ba[gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba].每个TPS在具有GGPPS的组合中瞬时表达gydF4y2Ba毛喉鞘蕊gydF4y2Ba(gydF4y2BaCfGGPPSgydF4y2Ba)[gydF4y2Ba60gydF4y2Ba]或NNPPS从gydF4y2BaSolanum lycopersicum.gydF4y2Ba(gydF4y2BaSlCPT2gydF4y2Ba)[gydF4y2Ba50gydF4y2Ba].叶子提取物的气相色谱 - 质谱(GC-MS)分析未显示任何含有任何沥匹产产品gydF4y2BaEremophila.gydF4y2Batss与gydF4y2BaCfGGPPSgydF4y2Ba.相反,其中任何一个的共同表达gydF4y2BaElTPS3gydF4y2Ba,gydF4y2BaElTPS31gydF4y2Ba,gydF4y2BaEdtTPS4gydF4y2Ba要么gydF4y2BaEdTPS22gydF4y2Ba与NNPP-forminggydF4y2BaSlCPT2gydF4y2Ba导致二萜生产。gydF4y2Ba埃尔gydF4y2BaTPS31生产gydF4y2Ba6gydF4y2Ba作为主要成分和少量稍后的洗脱产物(gydF4y2Ba7gydF4y2Ba), 尽管gydF4y2Ba埃尔gydF4y2Ba生产TPS3gydF4y2Ba8gydF4y2Ba主要产品和次要产品gydF4y2Ba9gydF4y2Ba和gydF4y2Ba10.gydF4y2Ba(附加文件gydF4y2Ba3.gydF4y2Ba:图S2)。gydF4y2Ba美东时间gydF4y2BaTPS4和gydF4y2Ba艾德gydF4y2Ba发现TPS22具有出现作为两个主要成分的相同产品曲线,gydF4y2Ba11.gydF4y2Ba和gydF4y2Ba12.gydF4y2Ba,以及一些次要产品(附加文件gydF4y2Ba4gydF4y2Ba:图S3)。随后将具有diTPS活性的候选基因克隆到pet28b +载体中,去除假定的质体转运序列,进行功能检测gydF4y2Ba大肠杆菌gydF4y2Ba.Co-expression的gydF4y2BaElTPS3gydF4y2Ba,gydF4y2BaElTPS31gydF4y2Ba,gydF4y2BaEdtTPS4gydF4y2Ba和gydF4y2BaEdTPS22gydF4y2Ba与gydF4y2BaSlCPT2gydF4y2Ba导致相同的主要二萜产品,如图所示gydF4y2BaN. Benthamiana.gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Ba).产品概况gydF4y2Ba埃尔gydF4y2BaTPS3和gydF4y2Ba美东时间gydF4y2BaTPS4 /gydF4y2Ba艾德gydF4y2Ba在表达时TPS22gydF4y2Ba大肠杆菌gydF4y2Ba然而,是否在某种程度上简化了,只有微量的gydF4y2Ba9gydF4y2Ba和gydF4y2Ba10.gydF4y2Ba在表达菌株中检测到gydF4y2Ba埃尔gydF4y2BaTPS3gydF4y2Ba和大的峰值强度转向gydF4y2Ba11.gydF4y2Ba在菌株表达gydF4y2Ba美东时间gydF4y2BaTPS4gydF4y2Ba要么gydF4y2Ba艾德gydF4y2BaTPS22gydF4y2Ba.gydF4y2Ba
的体内功能特征gydF4y2BaEremophila.gydF4y2BaTPSS。gydF4y2Ba(A-C)gydF4y2Ba正己烷提取物的GC-MS色谱图gydF4y2Ba大肠杆菌gydF4y2Ba表达文化gydF4y2BaElTPS31gydF4y2Ba,gydF4y2BaElTPS3gydF4y2Ba,gydF4y2BaEdtTPS4gydF4y2Ba和gydF4y2BaEdTPS22gydF4y2Ba结合GGPP合成酶(gydF4y2BaAgGGPPSgydF4y2Ba)或NNPP合酶(gydF4y2BaSlCPT2gydF4y2Ba).gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba和gydF4y2BahgydF4y2Ba主要TPS产品的质谱。gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2Ba我gydF4y2Ba和gydF4y2BajgydF4y2Ba(3gydF4y2BaZgydF4y2Ba,7z,11gydF4y2BaZgydF4y2Ba)-cembratrien-15醇(gydF4y2Ba6gydF4y2Ba), 5-hydroxyviscidane (gydF4y2Ba8gydF4y2Ba),8,9-二氢铁蛋白-14-ENE(gydF4y2Ba11.gydF4y2Ba)和Serrulat-14-Ene(gydF4y2Ba12.gydF4y2Ba)gydF4y2Ba
每个主要产品来自gydF4y2Ba埃尔gydF4y2BaTPS31,gydF4y2Ba埃尔gydF4y2BaTPS3和gydF4y2Ba美东时间gydF4y2BaTPS4 /gydF4y2Ba艾德gydF4y2BaTPS22纯化gydF4y2Ba大肠杆菌gydF4y2BaNMR光谱分析阐明的培养物及其结构。主要的划分产品gydF4y2Ba埃尔gydF4y2BaTPS31和gydF4y2Ba埃尔gydF4y2BaTPS3被鉴定为(3gydF4y2BaZgydF4y2Ba,7gydF4y2BaZgydF4y2Ba11.gydF4y2BaZgydF4y2Ba)-cembratrien-15醇(gydF4y2Ba6gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba:表S5)和5-羟基粘性烷(gydF4y2Ba8gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba:分别表S6)(图。gydF4y2Ba3.gydF4y2Ba).这gydF4y2BaZgydF4y2Ba每个双键的构型gydF4y2Ba6gydF4y2Ba是通过烯烃质子与甲基之间的NOE关系建立的,表明它们在同一边(gydF4y2BaZgydF4y2Ba=zusammen = 独联体gydF4y2Ba)双键的。类似地,附接至双键的两个亚甲基之间观察到NOE相关,进一步支持了gydF4y2BaZgydF4y2Ba所有双键的构型。在净化过程中gydF4y2Ba美东时间gydF4y2BaTPS4 /gydF4y2Ba艾德gydF4y2Ba使用反相薄层色谱(RP-TLC)策略的TPS22产品,转化gydF4y2Ba11.gydF4y2Ba来gydF4y2Ba12.gydF4y2Ba通过GC-MS分析中观察到。所得样品的NMR分析,鉴定gydF4y2Ba12.gydF4y2Ba作为Serrulat-14-ENE(附加文件gydF4y2Ba1gydF4y2Ba:表S7)。的提取物的GC-QTOF-MS分析gydF4y2Ba大肠杆菌gydF4y2Ba表达文化gydF4y2Ba美东时间gydF4y2BaTPS4gydF4y2Ba给一个[M + H]gydF4y2Ba+gydF4y2Ba离子的gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba273.2569(Calc。gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba273.2577, 4.4 ppm差)的峰值gydF4y2Ba11.gydF4y2Ba,表明C的分子式C.gydF4y2Ba20.gydF4y2BaHgydF4y2Ba32gydF4y2Ba这表明gydF4y2Ba12.gydF4y2Ba分子式为CgydF4y2Ba20.gydF4y2BaHgydF4y2Ba30.gydF4y2Ba的芳构化gydF4y2Ba11.gydF4y2Ba.使用固相提取的替代净化策略的开发使得能够孤立gydF4y2Ba11.gydF4y2Ba核磁共振分析,鉴定为8,9-二氢serrulat-14-ene(附加文件gydF4y2Ba1gydF4y2Ba:表S8)。gydF4y2Ba
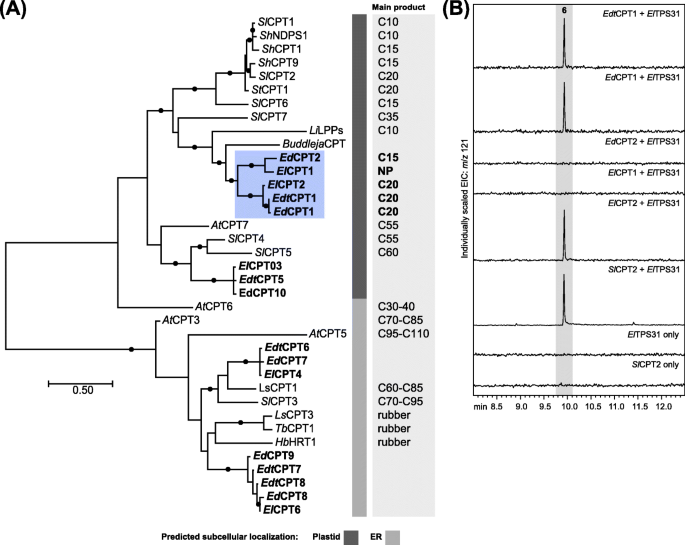
鉴于这些物种的主要次乳骨骨头来自NNPP,我们搜查了属于CPT家族的NNPP候选人的转录组数据库。在每个转录组中的五种和六个全长代表之间的所有三种物种中都确定了一个CPPT系列(附加档案gydF4y2Ba1gydF4y2Ba:表S3)。进行了系统发育分析,以研究如何gydF4y2BaEremophila.gydF4y2Bacts与被子植物cts有关(图。gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba:表S9)。总的来说,系统发育分析显示cts分裂为两个主要簇:那些定位于质体和内质网(ER)。每个组又进一步分成两个子组。对于ER局部候选者,一个簇被定位在包含橡胶生物合成cpt的枝内[gydF4y2Ba46gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba61gydF4y2Ba]和第二簇用含有参与多萜醇生物合成长链聚异戊二烯二磷酸合成酶进化枝相关联gydF4y2Ba48gydF4y2Ba,gydF4y2Ba62gydF4y2Ba].那些gydF4y2BaEremophila.gydF4y2Ba预测有质体过境肽的cpt,由参与质体局部聚戊烯醇生物合成的中链和长链合成酶cpt分离的一组[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba63gydF4y2Ba而另一类则与短链合成酶聚集在一起,参与单、倍半和二萜的生物合成gydF4y2BaSolanum.gydF4y2Ba种虫害和gydF4y2Ba薰衣草花gydF4y2Ba×gydF4y2Ba媒介物gydF4y2Ba[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].基于与特征短链cts的系统发育关系,以及预测的质体定位和高TPM值的三个候选(gydF4y2BaEDCPT1gydF4y2Ba,gydF4y2BaEdtCPT1gydF4y2Ba和gydF4y2BaELCPT2.gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba:相对于其他CPT候选的表S3),我们假设后者群体中的候选者可以参与二萜生物合成中gydF4y2BaEremophila.gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba系统发育分析gydF4y2BaEremophila.gydF4y2Ba部署。基于mega7计算的cts的最大似然树[gydF4y2Ba56gydF4y2Ba].树是按比例绘制的,分枝长度代表每个位点的替换数。分支上的填充圆圈表示基于1000次重复的引导支持超过75%。Genbank登录号列在表S3和S9(附加文件gydF4y2Ba1gydF4y2Ba).gydF4y2BaEremophila.gydF4y2Ba蓝色框中的CPTS在功能上表现。NP =没有检测到主要产品。使用deeploc-1.0预测的亚细胞定位[gydF4y2Ba57gydF4y2Ba].gydF4y2BabgydF4y2Ba的体内功能特征gydF4y2BaEremophila.gydF4y2Ba部署。正己烷提取物的GC-MS色谱图gydF4y2Ba大肠杆菌gydF4y2Ba表达文化gydF4y2BaEremophila部署gydF4y2Ba结合gydF4y2BaElTPS31gydF4y2Ba
从毛状体RNA衍生的cDNA中克隆了5个候选cts,并检测了NNPP的合成活性gydF4y2Ba大肠杆菌gydF4y2Ba.细胞培养表达gydF4y2BaEremophila.gydF4y2BaCPT.gydF4y2Ba裂解(截短以除去推定的塑体转运序列)并用碱性磷酸酶裂解并用己烷水解二磷酸产物,用己烷萃取并通过GC-MS分析。gydF4y2Ba艾德gydF4y2BaCPT1,gydF4y2Ba美东时间gydF4y2BaCPT-1和gydF4y2Ba埃尔gydF4y2Ba结果表明,CPT2主要产NNPPgydF4y2Ba艾德gydF4y2BaCPT2生产(gydF4y2BaZgydF4y2Ba,gydF4y2BaZgydF4y2Ba)-fpp作为主要产品(表gydF4y2Ba1gydF4y2Ba;额外的文件gydF4y2Ba5gydF4y2Ba:图S4)gydF4y2Ba埃尔gydF4y2BaCPT1仅生产痕量的NNPP。这gydF4y2BaCPT.gydF4y2BaS也与新建立的NNPP受体共同表达,gydF4y2BaElTPS31。gydF4y2Ba为了支持上述结果,gydF4y2Ba艾德gydF4y2BaCPT1,gydF4y2Ba美东时间gydF4y2BaCPT-1和gydF4y2Ba埃尔gydF4y2BaCPT2均可与gydF4y2Ba埃尔gydF4y2BaTPS31生产gydF4y2Ba6gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Ba),而没有观察到与gydF4y2Ba艾德gydF4y2BaCPT2和gydF4y2Ba埃尔gydF4y2BaCPT1。gydF4y2Ba
这三种植物的叶子提取物gydF4y2BaEremophila.gydF4y2Ba通过GC-MS分析物种,并检查TPS产品的存在。除了一个小的信号gydF4y2BaE. lucida.gydF4y2Ba提取对应于gydF4y2Ba6gydF4y2Ba(附加文件gydF4y2Ba6gydF4y2Ba:图S5),在植物提取物中没有检测到其他TPS产品。gydF4y2Ba
讨论gydF4y2Ba
毛状体参与二萜的生物合成gydF4y2BaEremophila.gydF4y2Ba
Eremophila.gydF4y2Ba物种是一种丰富的新型三萜类,特别是二萜类化合物[gydF4y2Ba22.gydF4y2Ba].早期的研究表明,在许多gydF4y2BaEremophila.gydF4y2Ba二萜类化合物是在腺状毛状体中生物合成的,从那里它们被释放出来,形成涂在叶子表面的粘性树脂的一部分[gydF4y2Ba53gydF4y2Ba,gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba,gydF4y2Ba67gydF4y2Ba].这三个gydF4y2BaEremophila.gydF4y2Ba本研究中调查的物种的特征都是存在这种树脂以及位于树脂层以下的短盾状腺毛状体(图。gydF4y2Ba1gydF4y2Ba).对叶子表面提取物的分析表明,每个树种的树脂都含有感兴趣的二萜(附加文件)gydF4y2Ba2gydF4y2Ba:图S1)。此外,毛状体富集的转录组的分析表明,MEP途径的活性水平高基于TPM值(附加文件gydF4y2Ba1gydF4y2Ba:表S2)通常已知参与二萜生物合成[gydF4y2Ba68gydF4y2Ba].随着目前报道的DITPS和CPTS的鉴定而携带,粒子可能是二萜类生物合成的位点gydF4y2BaEremophila.gydF4y2Ba种检查在这里。这与腺毛已知的角色协议在植物[专业萜类化合物生物合成gydF4y2Ba69gydF4y2Ba,gydF4y2Ba70gydF4y2Ba,gydF4y2Ba71gydF4y2Ba].gydF4y2Ba
塞鲁烷、内脏胺和膜型二萜gydF4y2BaEremophila.gydF4y2Baspp。通过I类萜烯合成酶从非规范萜烯前体,NNPP进行生物合成。gydF4y2Ba
在植物中发现的二萜大部分为labdane型,来源于gydF4y2BatransoidgydF4y2Ba前体,GGPP。它们是通过涉及II类和I类DITPS的逐步方法生物合成,通常分别来自Subfamilies TPS-C和TPS-E / F [gydF4y2Ba72gydF4y2Ba].相比之下,发现本研究中的每个主要次替乳头骨架被发现是生物合成的gydF4y2Ba独联体gydF4y2Ba-戊二烯二磷酸,NNPP,通过单一类I TPS的作用。基于系统发育分析,8,9-二氢serrulat-14-ene合酶(gydF4y2Ba美东时间gydF4y2BaTPS4和gydF4y2Ba艾德gydF4y2BaTPS22)和5-羟基内脏素合成酶(gydF4y2Ba埃尔gydF4y2BaTSP3)属于TPS-A亚家族,而(3gydF4y2BaZgydF4y2Ba,7gydF4y2BaZgydF4y2Ba11.gydF4y2BaZgydF4y2Ba)-CembraIn-15-OL合成酶(gydF4y2Ba埃尔gydF4y2BaTPS31)属于TPS-B亚家族(图。gydF4y2Ba2gydF4y2Ba).虽然主要由倍半萜类合成酶(TPS-a)和单萜合成酶(monoTPSs;TPS-b),少数报道来自这些亚家族。例如,来自多个植物科的大环diTPSs在TPS-a亚科中形成一个簇,其中包括大戟科的大环diTPSs [gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba,gydF4y2Ba75gydF4y2Ba]一组根表达DITPSgydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].有趣的是,gydF4y2BaEremophila.gydF4y2Ba该亚家族的diTPS与这些diTPS没有密切关系,但似乎与sesquiTPSs和最近发现的来自gydF4y2Ba夏枯草gydF4y2Ba,gydF4y2BaPV.gydF4y2BaHVS(无花果。gydF4y2Ba2gydF4y2Ba)[gydF4y2Ba35gydF4y2Ba].同样的,gydF4y2Ba埃尔gydF4y2BaTPS31与monoTPSs的关系更为密切(图。gydF4y2Ba2gydF4y2Ba)而不是已知的TPS-b亚家族中仅有的另外两个ditps:来自TPS-b亚家族的一对同源的miltiradiene合成酶gydF4y2BaTripterygiumgydF4y2BaSPP。,接受双环级II TPS产品(+) - 二磷酸二磷酸[gydF4y2Ba76gydF4y2Ba,gydF4y2Ba77gydF4y2Ba].的亲缘关系gydF4y2BaEremophila.gydF4y2BaDITPS,表明这些酶从Sesquitps和Monotps祖细胞中演变,在TPS-A亚家族成员的情况下重新获取了体积靶向序列。已经提出了这样的情景gydF4y2BaPV.gydF4y2BaHVS [gydF4y2Ba35gydF4y2Ba]和其他有证据表明底物特异性最近发生变化的tps,通常伴有功能性质体靶向序列的获得或丢失(例如:[gydF4y2Ba78gydF4y2Ba,gydF4y2Ba79gydF4y2Ba,gydF4y2Ba80gydF4y2Ba])。gydF4y2Ba
很少有其他关于tss使用的报告gydF4y2Ba独联体gydF4y2Ba- 戊基二磷酸盐作为其天然基材gydF4y2Ba在足底gydF4y2Ba[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].那些已知的那些,包括目前鉴定的NNPP接受TPSgydF4y2BaEremophila.gydF4y2Ba,也不会在系统发育树中聚集在一起,但在接受GGPP的TPS中分散,(gydF4y2BaEgydF4y2Ba,gydF4y2BaEgydF4y2Ba)-fpp或gpp。因此,它看起来TPSS接受NNPP和其他的能力gydF4y2Ba独联体gydF4y2Ba-戊烯基二磷酸盐在TPS家族中多次独立进化。事实上,tss的体外测试gydF4y2Ba独联体gydF4y2Ba-戊烯二磷酸已经显示出一些潜在的能力接受这些底物,即使没有证据表明它们是自然底物gydF4y2Ba在足底gydF4y2Ba[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba80gydF4y2Ba,gydF4y2Ba81gydF4y2Ba].这表明,一种屏障更广泛地发生gydF4y2Ba独联体gydF4y2Ba植物中-戊二烯基二磷酸衍生的萜类化合物可能是短链cts的有限发生,而不是tps固有的不能接受这些底物。8号染色体上萜生物合成基因簇的分析gydF4y2BaSolanum.gydF4y2Baspp。提供一些洞察力如何gydF4y2Ba独联体gydF4y2Ba-戊烯二磷酸基萜类代谢可通过cts和tps的共同进化过程演化[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].这个星团包含的专业功能NPP,(彩色显像管gydF4y2BaZgydF4y2Ba,gydF4y2BaZgydF4y2Ba)-FPP和NNPP合酶。它们在基因簇中同时存在gydF4y2Ba独联体gydF4y2Ba- 用从普通的TPS-E / F二亚萜合酶输出的单次,倍半导和二萜合酶活性接受TPS。可以想到,具有短链综合活性的CPT的外观可以与具有至少部分活性的TPS朝向新基板结合,以提供后续基因重复和CPPT和TPS的专业化初始遗传原料,如所观察到的gydF4y2BaSolanum.gydF4y2Ba.通常观察到的tps底物的杂乱性会促进这一过程的进行(如:[gydF4y2Ba82gydF4y2Ba];参见[gydF4y2Ba60gydF4y2Ba,gydF4y2Ba81gydF4y2Ba,gydF4y2Ba83gydF4y2Ba,gydF4y2Ba84gydF4y2Ba]),并且tps可以轻松获得新的功能,而不需要改变氨基酸(例如:[gydF4y2Ba85gydF4y2Ba,gydF4y2Ba86gydF4y2Ba,gydF4y2Ba87gydF4y2Ba])。gydF4y2Ba
提出的反应途径催化gydF4y2Ba埃尔gydF4y2BaTPS3和gydF4y2Ba艾德gydF4y2BaTPS22 /gydF4y2Ba美东时间gydF4y2BaTPS4gydF4y2Ba
猪嘌呤和瑟rulatane主干分别为鼠嘌呤二烯和cadalane型倍半萜的二萜类似物。导致这些倍半萜主干的反应途径是基于tps的研究,tps使用(gydF4y2BaEgydF4y2Ba,gydF4y2BaEgydF4y2Ba)-FPP作为它们的天然基质,但它们仍然可能是提出反应途径的信息gydF4y2Ba埃尔gydF4y2BaTPS3和gydF4y2Ba艾德gydF4y2BaTPS22 /gydF4y2Ba美东时间gydF4y2BaTPS4。acoradiene骨架由(gydF4y2BaE, EgydF4y2Ba)-FPP通过双abolyl阳离子,由1,6环封闭后的初始gydF4y2BatransgydF4y2Ba-gydF4y2Ba独联体gydF4y2BaC2-C3键的异构化(gydF4y2BaEgydF4y2Ba,gydF4y2BaEgydF4y2Ba)-法炔基阳离子到(gydF4y2BaZgydF4y2Ba,gydF4y2BaEgydF4y2Ba)通过中性中性中间萘基二磷酸羟基磷酸酯阳离子[gydF4y2Ba88gydF4y2Ba,gydF4y2Ba89gydF4y2Ba].经过1,2氢化物移位(从C6位置到C7位置),生成的同二二羟基阳离子转化为6,10环闭合的苊基阳离子。随后异丙基尾部的质子消除和C11-C12双键的形成终止了反应。同样的机理可以用来解释5-羟基粘聚糖生物合成的初始步骤gydF4y2Ba埃尔gydF4y2BaTPS3,但没有必要gydF4y2BatransgydF4y2Ba-gydF4y2Ba独联体gydF4y2Ba异构化是由于gydF4y2Ba独联体gydF4y2Ba底物nerylneryl二磷酸的三个立体双键的构型。因此,在1,6环闭合和1,2氢化物从C6转移到C7之后(附加文件gydF4y2Ba7gydF4y2Ba:图S6中的中间体IIa),一个6,10环的封闭体将提供粘性酰阳离子。在1,5氢化物从C5转移到C11后,碳正离子在C5处被水淬终止反应(附加文件gydF4y2Ba7gydF4y2Ba:图S6)。gydF4y2Ba
所述cadalane型主链可以从涉及1,10-环化[两条路线中导出gydF4y2Ba90gydF4y2Ba,gydF4y2Ba91gydF4y2Ba].在第一种方法中,(gydF4y2BaEgydF4y2Ba,gydF4y2BaEgydF4y2Ba)-FPP之后是直接1,10-环化,得到(gydF4y2BaEgydF4y2Ba,gydF4y2BaEgydF4y2Ba) -germacradienyl阳离子。在第二种路线中,环化在前面描述gydF4y2BatransgydF4y2Ba-gydF4y2Ba独联体gydF4y2Ba异构化途径导致形成A的形成(gydF4y2BaZgydF4y2Ba,gydF4y2BaEgydF4y2Ba) -germacradienyl阳离子。以下两个中间体的进一步重排的路径在cadinenyl阳离子收敛后1,6-环闭合[gydF4y2Ba90gydF4y2Ba,gydF4y2Ba91gydF4y2Ba].随后的氢化物转移,接着是质子消除,然后产生一系列cadalane型倍半萜[gydF4y2Ba90gydF4y2Ba].另一种替代途径遵循相同的途径,以双酚基阳离子作为报道的阿科拉二烯型倍半萜生物合成[gydF4y2Ba91gydF4y2Ba].从双酚基阳离子进一步重排和第二个环闭合得到cadinenyl阳离子。研究了NNPP催化合成8,9-二氢serrulat-14-ene的反应途径gydF4y2Ba艾德gydF4y2BaTPS22 /gydF4y2Ba美东时间gydF4y2Ba鉴于起始底物的立体化学性质,TPS4更有可能遵循后一种路径(附加文件gydF4y2Ba7gydF4y2Ba:图S6)。因此,不需要gydF4y2BatransgydF4y2Ba-gydF4y2Ba独联体gydF4y2Ba活化的青neryl阳离子的异构化,1,6环闭合形成中间体I,随后1,3氢化物从C5转移到C7(附加文件gydF4y2Ba7gydF4y2Ba:图S6中的中间产物IIb),经过5,10环闭合后形成serrulatanyl阳离子。1,4氢化物从C4转移到C11和酶催化的质子从C5提取将导致8,9-二氢serrulat14 -ene。gydF4y2Ba
二萜的进化和功能gydF4y2BaEremophila.gydF4y2Ba
对分离的二萜进行更广泛的检查gydF4y2BaEremophila.gydF4y2Baspp表明,基于结构相似性,此处描述的途径- agydF4y2Ba独联体gydF4y2Ba- 戊二基二磷酸前体直接通过I类TPS型 - 是该属中的其他物种常见的[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba19.gydF4y2Ba,gydF4y2Ba22.gydF4y2Ba].随着Viscidane,Serrulatane和Cembrane型二萜类的广泛发生,不同的例子gydF4y2BaEremophila.gydF4y2Ba线性二萜和双abolene型二萜的存在gydF4y2Ba独联体gydF4y2Ba-构型双键,这表明它们也来源于NNPP [gydF4y2Ba92gydF4y2Ba,gydF4y2Ba93gydF4y2Ba].值得注意的是,Myoporeae和姊妹族Leucophylleae的其他属含有serrulatane型二萜[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba94gydF4y2Ba在这些属中也可能存在类似的生物合成途径。此外,在公开的转录组数据库中搜索同源序列(1KP数据库[gydF4y2Ba95gydF4y2Ba];)其他骨科藻藻物种鉴定了具有推定的体液过渡肽的TPSgydF4y2BaAnticharis Glandulosa.gydF4y2Ba(gydF4y2BaAg)gydF4y2Ba部落Aptosimeae [gydF4y2Ba96gydF4y2Ba];),聚在二萜相关的tps -一种酶的亚枝内gydF4y2BaEremophila.gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Ba)和一个推定的短链CPTgydF4y2BaBuddlejagydF4y2Basp。(gydF4y2BaBuddlejagydF4y2Ba佛祖部落[gydF4y2Ba96gydF4y2Ba];),也预测为质体本地化和聚类gydF4y2BaEremophila.gydF4y2BaNNPP产生CPTS(图。gydF4y2Ba4gydF4y2Ba).综上所述,这些数据表明,通过NNPP合成二萜的替代途径可能在玄参科这些独立谱系分化之前就出现了。gydF4y2Ba
到目前为止,gydF4y2BaEremophila.gydF4y2Ba(和如上所述的潜在相关的属)是植物血管谱系的唯一已知的示例,其已经发展了如此广泛的替代的替代性衍生的替代品gydF4y2Bacisoid.gydF4y2Ba前体,NNPP。由于使用该替代衬底而导致的扩大化学多样性可以提供特定的选择性优势,这可以解释整个属中这些不寻常的二萜类化合物的显着丰富和多样性。然而,发现的二萜类化合物的生物学功能gydF4y2BaEremophila.gydF4y2Ba物种保持不协调。其中它们是部分的粘菌树脂被认为是通过通过增加对蒸腾性的耐药性和通过增加阳光反射来降低叶片温度的能力来介导的充满活力的适应性。gydF4y2Ba65gydF4y2Ba,gydF4y2Ba97gydF4y2Ba].树脂和其中的二萜类也可能参与防御食草动物和病原体。虽然再次没有与这个方面有关的数据gydF4y2BaEremophila.gydF4y2Ba生物学方面,对serrulatanes生物活性的体外研究显示了广泛的抗菌活性[gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].增加蛇素可能具有抗菌功能的想法gydF4y2Ba在足底gydF4y2Ba,蜜蜂已经从密切相关的物种的叶子报道,收集含有serrulatane树脂,gydF4y2Ba苦槛insulare,gydF4y2Ba用来制作蜂胶,蜂胶是蜜蜂用来密封蜂巢的防腐材料。gydF4y2Ba94gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
我们的研究已确定了生物合成途径三个发现的主要二萜骨架gydF4y2BaEremophila.gydF4y2Ba物种。所识别的CPT和TPS是生物合成网络的起点,涉及多种酶催化步骤,这导致该属中的种类的更复杂和生物活性的二萜类化合物,其中许多人认为是新药或药物的承诺。发现胎儿是二萜类化合物的可能性存在的,富含粒细胞的转录组数据库的发育是提供有价值的知识和资源,可用于鉴定下游萜类化生物合成酶,[gydF4y2Ba98gydF4y2Ba,gydF4y2Ba99gydF4y2Ba].gydF4y2Ba
在这项工作中,我们表明NNPP是在此研究的所有三种类型的二萜类化合物的前兆。这些和类似化合物的广泛分布gydF4y2BaEremophila.gydF4y2Ba而相关的属表明,在整个植物谱系中,这种获得特化二萜的替代途径是常见的。它的物种丰富,地理分布广泛,遍布澳大利亚,gydF4y2BaEremophila.gydF4y2Ba因此,为萜类化学多样性的演变提供了一种突出的模型系统。gydF4y2Ba
材料和方法gydF4y2Ba
植物材料和腺毛RNA分离gydF4y2Ba
Plant material was harvested from plants growing in the greenhouse at the University of Copenhagen (Frederiksberg, Denmark) under natural light supplemented with growth lights during winter months (7 am – 7 pm) with an average day/night temperature of 18 °C. eRemophila lucidagydF4y2Ba和gydF4y2BaE. Drummondii.gydF4y2Ba资料来源如tatah等人所述[gydF4y2Ba18.gydF4y2Ba和Wubshet等[gydF4y2Ba19.gydF4y2Ba], 分别。这gydF4y2Ba大肠denticulatagydF4y2Ba亚普。gydF4y2BatrisulcatagydF4y2Ba标本来自南澳大利亚州植物植物植物植物苗圃。优惠券标本gydF4y2BaE. lucida.gydF4y2Ba(UCPH-PLEN-AH4),gydF4y2BaE. Drummondii.gydF4y2Ba(UCPH-PLEN-AH3)和gydF4y2Ba大肠denticulatagydF4y2Ba亚普。gydF4y2BatrisulcatagydF4y2Ba(UCPH-PLEN-AH6)已经存入哥本哈根大学国家历史博物馆CHERBARIUM C.gydF4y2Ba
孤立腺体胎儿gydF4y2BaEremophila.gydF4y2Ba提出了一种基于表面接触冻结的毛状体分离方法。新鲜的叶子被紧紧地夹在两个塑料板之间,放在干冰上冷冻。带叶的塑料板在室温下暴露10秒,然后突然打开,只留下毛状体和树脂,其余叶子材料很少附着在板上。用1.5 mL预冷裂解缓冲液(rnaqueus - micro Total RNA Isolation Kit, Thermo Fisher Scientific)、1:10植物RNA Isolation Aid (Thermo Fisher Scientific)和300 mg PVP40冲洗塑料板。溶解的解决方案是收集到2毫升圆底埃普多夫管包含大小不一的玻璃珠(1.5毫米,1毫米和0.5毫米直径)和细胞受到破坏步骤(3周期3分钟在3000 rpm TissueLyser II,试剂盒、希尔登,德国),在干冰冷却的样品2分钟之间循环。裂解后的毛状体样品在20000 g离心10分钟。将上清转移到结合柱上,并使用rnaque - micro总RNA分离试剂盒。按照标准试剂盒协议条件,用提供的DNase i进行柱上DNA消化,提取总RNA。RNA完整性和浓度采用安捷伦2100生物分析仪(安捷伦技术,Santa Clara, CA, USA)上的RNA纳米检测方法进行测定。gydF4y2Ba
转录组分析gydF4y2Ba
TruSeq strand mRNA LT Sample Prep Kit (Illumina San Diego, USA)采用poly-A选择技术生成RNA-seq文库。根据制造商说明书,由Macrogen (Seoul, South Korea)在HiSeq 2500 (Illumina)上进行文库制备和测序,两端配对(2 × 101 bp)。由Sequentia Biotech SL进行转录组组装。使用BBDuk (gydF4y2Bahttps://sourceforge.net/projects/bbmap/gydF4y2Ba),最小读取长度设定为35bp,PHRED质量得分为35.使用高质量读取作为输入以在归一化(具有Trinity V2.1.1)之后进行转录组件gydF4y2Ba100.gydF4y2Ba].通过三个步骤进行转录组件的质量控制和过滤。首先,用软件Kallisto来量化所有转录物的表达水平[gydF4y2Ba101.gydF4y2Ba],然后去除所有无表达水平的转录本。其次,为了减少数据集的冗余,每个基因只保留编码最长蛋白的亚型;对于非编码的转录本,保留最长的序列。最后,所有与非植物生物匹配的转录本都被过滤掉了。用Kallisto软件对修剪后的reads进行处理,计算所有转录本的TPM (transcripts Per Million)值,以获得三个样本中组装好的转录本的表达定量。转录组数据摘要见(附加文件)gydF4y2Ba1gydF4y2Ba:表S2)。此外,使用CLC基因组组件软件(版本11,QIAGEN)的RNASEQ组装工具使用默认设置生成DE Novo转录om。gydF4y2Ba
使用两种方法推断为编码CPTS或TPS的组装转录物的推定功能。首先,使用Massblast(gydF4y2Bahttps://github.com/averissimo/mass-blastgydF4y2Ba).其次,使用HMMER (3.1b1版本)扫描转录本的PFAM域,使用HMM模型扫描萜烯合酶(pfama v29)的n端(Acc PF01397.20)和c端(Acc PF03936.15)部分。最后,使用CLC Main Workbench (version 8.0.1, QIAGEN)的开放式阅读框预测工具进行编码序列的识别。系统发育分析使用mega7进行[gydF4y2Ba56gydF4y2Ba]如heskes等人所述。[gydF4y2Ba102.gydF4y2Ba].gydF4y2Ba
用于MVA和MEP途径分析注释gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba从NCBI蛋白数据库中选择MEP和MVA途径的基因,用于查询gydF4y2BaEremophila.gydF4y2Ba使用e值截断为1E-10的tBLASTn的毛状体转录组。所有BLAST命中的内容都被检查为至少200个氨基酸的开放阅读框,并被翻译成蛋白质序列。选择总体标识和查询覆盖率最低为50%的BLAST命中。gydF4y2Ba
叶片横截面的微观分析gydF4y2Ba
新鲜叶片材料包埋在5%琼脂糖中,并使用HM 650 V振动切片机(Microm International, waldorf, Germany)将其切片成20 μm的切片。切片使用DMI 4000B倒置显微镜(Leica Microsystems, Wetzler, Germany)安装在水中进行成像。真彩色成像是在20倍放大的明亮视场下完成的。显微图像由徕卡软件拍摄,并使用ImageJ (version 1.51j8)进行进一步处理。gydF4y2Ba
生物合成候选基因的功能特征gydF4y2BaN. Benthamiana.gydF4y2Ba
表征推定CPTS和TPS的功能gydF4y2BaEremophila.gydF4y2Ba,克隆的候选者使用gydF4y2Ba农杆菌属gydF4y2Ba-介导的瞬时表达gydF4y2Ba烟草benthamianagydF4y2Ba.从分离的叶RNA产生cDNA的cDNAgydF4y2BaEremophila.gydF4y2Ba采用iScript cDNA Synthesis Kit (Biorad, Hercules, CA)进行测序。基因特异性引物(附加文件gydF4y2Ba1gydF4y2Ba:表S10)被设计与USER突出端以扩增全长编码候选的序列从产生gydF4y2BaEremophila.gydF4y2BacDNA图书馆。编码序列的DNA片段gydF4y2BaSlCPT2gydF4y2Ba[gydF4y2Ba50gydF4y2Ba]通过商业合成(Thermo Fisher Scientific)获得。如果在转录组族数据库中未预测到全长的候选者,转录物转录成全长使用三个产生的同源序列gydF4y2BaEremophila.gydF4y2Ba转录om。用于瞬态表达gydF4y2BaN. Benthamiana.gydF4y2Ba,通过USER cloning将编码序列扩增子整合到pCAMBIA130035Su载体中[gydF4y2Ba103.gydF4y2Ba].主管gydF4y2Ba农杆菌属gydF4y2Ba一个GL-1 cells were transformed with plasmid DNA and T-DNA encoded target genes were transiently co-expressed in 4–6 week oldN. Benthamiana.gydF4y2Ba植物 [gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba]和基因沉默抑制因子p19 [gydF4y2Ba104.gydF4y2Ba和编码的基因gydF4y2Bac . forskohliigydF4y2Ba1-脱氧-d-木糖- 5-磷酸合酶(gydF4y2BaCfgydF4y2Badx) [gydF4y2Ba60gydF4y2Ba].渗透后六天,从一个单个叶片的两种叶片(直径为3cm直径),并在室温下在1ml己烷中在220rpm的轨道振荡器上萃取1小时。通过离心收集植物材料,将有机相转移到GC小瓶中,用于GC-MS分析。gydF4y2Ba
GC-MS分析gydF4y2Ba
样品使用岛津GCMS-QP2010 Ultra(岛津,京都,日本)进行GC-MS分析,使用HP-5MS UI柱(20 m × 0.18 mm i.d, 0.25 μm薄膜厚度;安捷伦科技公司)使用HgydF4y2Ba2gydF4y2Ba作为载体气体。注入端口在不分离模式下工作,初始温度为40°C,保持1分钟,然后在4分钟内升至250°C。气相色谱烘箱程序如下:60°C 1分钟,30°C min,斜坡到150°CgydF4y2Ba−1gydF4y2Ba,在15°C min升至250°CgydF4y2Ba−1gydF4y2Ba,斜坡到290°C在30°C分钟gydF4y2Ba−1gydF4y2Ba,保持3分钟。MS采用电子冲击(EI)电离,离子源电压和温度分别设置为70 eV和300℃。进行分析的gydF4y2Ba大肠杆菌gydF4y2Ba表达菌株gydF4y2BaEremophila.gydF4y2BaCPTS并用磷酸酶处理烤箱程序在40℃下开始。使用GCMSSolution软件V4.20(Shimadzu)进行分析数据。gydF4y2Ba
表征gydF4y2Ba埃尔gydF4y2BaTPS3,gydF4y2Ba埃尔gydF4y2BaTPS31,gydF4y2Ba美东时间gydF4y2BaTPS4和gydF4y2Ba艾德gydF4y2BaTPS22 in.gydF4y2Ba大肠杆菌gydF4y2Ba以及6 8 11 12号的隔离gydF4y2Ba
n末端截断的编码序列gydF4y2BaEremophila.gydF4y2Ba支持(gydF4y2Ba埃尔gydF4y2BaTPS3Δ1-23,gydF4y2Ba埃尔gydF4y2BaTPS31Δ1-54,gydF4y2Ba美东时间gydF4y2BaTPS4Δ1-59和gydF4y2Ba艾德gydF4y2BaTPS22Δ1-59)克隆到pet28b +表达载体中)。每个TPS结构被用于共变换gydF4y2Ba大肠杆菌gydF4y2BaEXPRESS BL21感受态细胞(Lucigen, Middleton, WI)与pIRS [gydF4y2Ba105.gydF4y2Ba]和pACYCDuet携带任一载体gydF4y2BaabgydF4y2BaGGPPgydF4y2Ba合酶(gydF4y2Ba106.gydF4y2Ba或n端截短gydF4y2BaSolanum lycopersicum.gydF4y2Bannpp.gydF4y2Ba合成酶(gydF4y2BaSlgydF4y2BaCPT2gydF4y2Ba)[gydF4y2Ba50gydF4y2Ba].2 mL培养物在37℃下培养至OD值gydF4y2Ba600gydF4y2Ba达到0.8,冷却至16℃,加入IPTG(终浓度1 mM)诱导。然后在18°C, 200 rpm下培养48 h,离心,用0.3 mL己烷在室温下,220 rpm的轨道摇床上提取1 h上清液。所得正己烷萃取物经气相色谱-质谱联用分析gydF4y2BaN. Benthamiana.gydF4y2Ba样本。在上述条件下,200 mL培养物在2 L锥形瓶中进行复合纯化。大规模培养物离心,等量己烷提取上清液2次。以甲醇为流动相,采用反相薄层色谱(RP-TLC)对正己烷萃取物进行体积还原,得到正己烷萃取物gydF4y2Ba6gydF4y2Ba,gydF4y2Ba8gydF4y2Ba和gydF4y2Ba12.gydF4y2Ba.为了净化gydF4y2Ba11.gydF4y2Ba,将浓缩的己烷提取物施加到双层弗罗里硅土/钠gydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2BaSPE盒(6毫升,SUPELCO,PA,USA)并用1%乙酸乙酯在己烷中洗脱。gydF4y2Ba
要在TPS产品上获得准确的质量数据,提取物gydF4y2Ba大肠杆菌gydF4y2Ba表达文化gydF4y2BaELTPS3,ELTPS31,EDTTPS4gydF4y2Ba和gydF4y2BaEdTPS22gydF4y2Ba与gydF4y2BaSlCPT2gydF4y2Ba通过GC-QTOF-MS分析了CROIC 456-GC,耦合到配备APCI源(Bruker Daltonik,德国Bruker Daltonik)的Microotof II MS。在不分开模式下注射样品,注射端口温度为250℃。GC配有30M BR-5 MS柱(5%苯基,95%二甲基亚硅氧烷硅氧烷; Bruker),具有250μm和0.25μm的膜厚度。载气是hgydF4y2Ba2gydF4y2Ba以30厘米s的恒定线速度gydF4y2Ba−1gydF4y2Ba.烤箱程序如下:初始温度为60°C,保持1分钟,然后在20°C min时线性斜坡至130°CgydF4y2Ba−1gydF4y2Ba,然后在4°C min中升至250℃gydF4y2Ba−1gydF4y2Ba.最后烤箱被提高到290°C, 30°C mingydF4y2Ba−1gydF4y2Ba保持4分钟。APCI源工作在正电离模式下,设置如下:毛细管电压,3000 V;电晕放电针,2000na;喷雾器气体压力,3 bar;干气流量,2.5 L mingydF4y2Ba−1gydF4y2Ba;干气温度,250°C。质量范围是50到700gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba是使用。gydF4y2Ba
表征gydF4y2BaEremophila.gydF4y2Ba部署在gydF4y2Ba大肠杆菌gydF4y2Ba
测试被选者的能力gydF4y2BaEremophila.gydF4y2Bacpts生产nnpp,相同gydF4y2Ba大肠杆菌gydF4y2Ba系统用于TPS表征。n末端截断的编码序列gydF4y2BaEremophila.gydF4y2Ba彩色显像管(gydF4y2Ba艾德gydF4y2BaCPT1Δ1-58,gydF4y2Ba艾德gydF4y2BaCPT2Δ1-58,gydF4y2Ba美东时间gydF4y2BaCPT1Δ1-58,gydF4y2Ba埃尔gydF4y2BaCPT1Δ1-60和gydF4y2Ba埃尔gydF4y2BaCPT2Δ1-58)克隆到的pACYC-二重奏向量,并用于共转化gydF4y2Ba大肠杆菌gydF4y2BaEXPRESS BL21感受态细胞(Lucigen, Middleton, WI)与pIRS [gydF4y2Ba105.gydF4y2Ba]和空pet28b+或pet28b+:gydF4y2BaElTPS31gydF4y2Ba.除了没有表达的菌株的15ml培养物之外,培养条件与TPS表征相同gydF4y2Ba埃尔gydF4y2BaTPS31种植了。使用设定为25 kpsi的细胞破坏器(恒定系统有限公司,北方,英国)进行这些培养物进行细胞裂解程序。将裂解物用水调节至20mL,并离心8000g 20分钟。用20μL小牛肠道磷酸酶(新英格兰Biolabs,Ipswich,MA)处理10ml上清液,并在37℃下孵育过夜。然后用1mL己烷萃取样品两次。合并己烷萃取物并在n的流下浓缩至50μlgydF4y2Ba2gydF4y2Ba并用GC-MS分析。菌株表达gydF4y2BaElTSP31gydF4y2Ba制备并分析为TPS表征。gydF4y2Ba
代谢物分析gydF4y2BaEremophila.gydF4y2Baspp。gydF4y2Ba
用于气相色谱-质谱分析gydF4y2BaEremophila.gydF4y2Ba将新鲜收获的叶片用液体氮研磨gydF4y2Ba2gydF4y2Ba,在己烷中萃取,同时在24℃下摇动1小时。根据GC-MS通过GC-MS进行己烷样品gydF4y2Ba大肠杆菌gydF4y2Ba和gydF4y2BaN. Benthamiana.gydF4y2Ba样本。鲜叶在100%乙酸乙酯中浸泡15 s进行LC-HRMS分析。提取液在真空高速离心机中干燥1 h,用80%乙腈重悬。乙腈提取物使用Ultimate 3000 UHPLC+ Focused系统(Dionex Corporation, Sunnyvale, CA)与Bruker Compact ESI-QTOF-MS (Bruker)系统耦合分析。样品采用Kinetex XB-C18色谱柱(100 × 2.1 mm ID, 1.7 μm粒径,100 Å孔径;Phenomenex Inc., Torrance, CA)保持在40°C,流速0.3 mL mingydF4y2Ba−1gydF4y2Ba和流动相,由0.05%(v / v)甲酸组成的水(溶剂A)和0.05%(v / v)甲酸中的乙腈(溶剂B)。LC方法如下:0-1分钟,10%B;1-23分钟,10-100%B;23-25分钟,100%;25-25.5分钟,100-10%;25.5-30.5分钟,10%B.以阳性离子模式获得质谱,具有以下ESI设置:毛细管电压,4000 V;端板偏移, - 500 V;干气温度,220°C;干气流8升gydF4y2Ba−1gydF4y2Ba;雾化器压力,2巴。使用DataAnalysis 4.1(Bruker)分析数据。gydF4y2Ba
NMR光谱学gydF4y2Ba
CDCL中记录核磁共振光谱(NMR)实验gydF4y2Ba3.gydF4y2Ba在600 MHz Bruker Avance III仪器上,质子频率为600.13 MHz,使用1.7 mm冷冻冷却的TCI Probehead。所有NMR实验都以自动化(温度平衡至300k,优化锁定参数,梯度匀场和接收器增益设置)进行,使用ICONNMR Ver 4.2(Bruker Biospin,德国Karlsruhe)。gydF4y2Ba1gydF4y2BaH NMR光谱以30°尺寸和64K数据点获得。在间接尺寸中用直接维度和512(DQF-Cozy)或256(多重编辑的HSQC和HMBC)数据点,在直接维度和512(DQF-Cozy)或256(多重编辑的HSQC和HMBC)数据点中获得标准2D同源和异核实验。topspin ver。3.5(Bruker Biospin)用于获取和处理NMR数据。gydF4y2Ba
可用性数据和材料gydF4y2Ba
本次研究中生成的RNA-seq数据已提交到NCBI的序列读取归档(SRA),登录号如下:PRJNA601673。的cDNA序列gydF4y2BaEremophila.gydF4y2Ba本研究中报道的tss和cts可通过GenBank查询。附件编号列在表S3(附加文件gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- (gydF4y2BaEgydF4y2Ba,gydF4y2BaEgydF4y2Ba)-FPPS:gydF4y2Ba
-
(gydF4y2BaEgydF4y2Ba,gydF4y2BaEgydF4y2Ba)通过二磷酸合酶gydF4y2Ba
- CPT:gydF4y2Ba
-
独联体gydF4y2Ba-prenyl转移酶gydF4y2Ba
- DITPS:gydF4y2Ba
-
二萜合酶gydF4y2Ba
- DMAPP:gydF4y2Ba
-
Dimethylallyl二磷酸gydF4y2Ba
- GC-MS:gydF4y2Ba
-
气相色谱分析-质谱法gydF4y2Ba
- GFPPS:gydF4y2Ba
-
Geranylfarnesyl二磷酸合酶gydF4y2Ba
- GGPP:gydF4y2Ba
-
香叶二磷酸gydF4y2Ba
- GGPPS:gydF4y2Ba
-
天竺葵二磷酸二磷酸合成酶gydF4y2Ba
- GPP:gydF4y2Ba
-
小烷基二磷酸gydF4y2Ba
- gpp:gydF4y2Ba
-
香叶二磷酸合酶gydF4y2Ba
- IPP:gydF4y2Ba
-
Isopentenyl二磷酸gydF4y2Ba
- LC-HRMS:gydF4y2Ba
-
液相色谱-高分辨质谱gydF4y2Ba
- MEP:gydF4y2Ba
-
2-gydF4y2BaCgydF4y2Ba-methyl-D-erythritol 4-phosphategydF4y2Ba
- monotpss:gydF4y2Ba
-
单调萜烯合成酶gydF4y2Ba
- MVA:gydF4y2Ba
-
甲羟戊酸gydF4y2Ba
- 核磁共振:gydF4y2Ba
-
核磁共振gydF4y2Ba
- NNPP:gydF4y2Ba
-
Nerylneryl二磷酸gydF4y2Ba
- RP-TLC:gydF4y2Ba
-
反相薄层色谱法gydF4y2Ba
- Sesquitps:gydF4y2Ba
-
SesquiterPene合成酶gydF4y2Ba
- TPM:gydF4y2Ba
-
记录每百万gydF4y2Ba
- TPS:gydF4y2Ba
-
萜烯合酶gydF4y2Ba
- transgydF4y2Ba-pts:gydF4y2Ba
-
transgydF4y2Ba-prenyl转移酶gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
奇诺克RJ。gydF4y2BaEremophila.gydF4y2Ba和盟军属。一本肌肌科。澳大利亚:罗森伯格出版;2007年。gydF4y2Ba
- 2。gydF4y2Ba
巴尔A.传统的灌木药:土着药典。里士满:温室出版物;1988年。gydF4y2Ba
- 3.gydF4y2Ba
Lassak E,McCarthy T.澳大利亚药用植物:一个完整的识别和用途指南。第二编辑。Chatswood:芦苇新荷兰;2011年。gydF4y2Ba
- 4.gydF4y2Ba
Hansen V, Horsfall J. Noongar灌木药用植物:西澳大利亚西南部的药用植物。克劳利:映象出版;2016.gydF4y2Ba
- 5.gydF4y2Ba
艾萨克斯J.布什的食物:原住民食物和草药。马克马杭:Weldons;1987年。gydF4y2Ba
- 6.gydF4y2Ba
Semple SJ, Reynolds GD, O 'Leary MC, Flower RLP。澳大利亚药用植物抗病毒活性筛选。J Ethnopharmacol。1998;60:163 - 72。gydF4y2Ba
- 7.gydF4y2Ba
Palombo EA,SEMPLE SJ。传统澳大利亚药用植物的抗菌活性。J属植物。2001; 77:151-7。gydF4y2Ba
- 8.gydF4y2Ba
Palombo EA,SEMPLE SJ。澳大利亚植物提取物对抗甲氧西林的抗菌活性gydF4y2Ba金黄色葡萄球菌gydF4y2Ba(MRSA)和万古霉素耐药肠球菌(VRE)。微生物学杂志2002;42:444-8。gydF4y2Ba
- 9.gydF4y2Ba
Ndi CP, Semple SJ, Griesser HJ, Barton MD.澳大利亚一些属植物的抗菌活性gydF4y2BaEremophila.gydF4y2Ba.微生物学杂志2007;47:158-64。gydF4y2Ba
- 10。gydF4y2Ba
Mijajlovic S, Smith J, Watson K, Parsons P, Jones GL.传统澳大利亚药用植物:抗人类癌症细胞系活性的筛选。澳洲医学杂志2006;12:129-32。gydF4y2Ba
- 11.gydF4y2Ba
Rogers KL,Fong Wf,Redburn J,Griffiths LR。影响神经元电压门控Ca2 +通道的植物提取物的荧光检测。EUR J Pharm Sci。2002; 15:321-30。gydF4y2Ba
- 12.gydF4y2Ba
库马尔R,达菲S,艾利VM,卡罗尔AR,戴维斯RA。Microthecaline一个,喹啉serrulatane来自澳大利亚沙漠植物的根生物碱gydF4y2BaEremophila microthecagydF4y2Ba.J Nat Prod. 2018; 81:1079-83。gydF4y2Ba
- 13。gydF4y2Ba
刘强,Harrington D, Kohen JL, Vemulpad S, Jamie JF。杀菌和环加氧酶抑制二萜gydF4y2BaEremophila sturtiigydF4y2Ba.植物化学,2006;67:1256 - 61。gydF4y2Ba
- 14.gydF4y2Ba
Ndi CP, Semple SJ, Griesser HJ, Pyke SM, Barton MD.来自澳大利亚沙漠植物的抗菌化合物gydF4y2BaEremophila疏忽gydF4y2Ba.Ĵ天然产物。2007; 70:1439-43。gydF4y2Ba
- 15.gydF4y2Ba
Barnes EC, Kavanagh AM, Ramu S, Blaskovich M, Cooper M, Davis R.来自澳大利亚本土植物的抗菌serrulatane二萜gydF4y2BaEremophila microthecagydF4y2Ba.植物化学。2013; 93:162-9。gydF4y2Ba
- 16.gydF4y2Ba
Mon HH, Christo SN, Ndi CP, Jasieniak M, Rickard H, Hayball JD,等。Serrulatane二萜来自gydF4y2BaEremophila疏忽gydF4y2Ba显示细菌生物膜扩散和抑制促炎细胞因子释放从活化巨噬细胞。J Nat Prod. 2015; 78:3031-40。gydF4y2Ba
- 17.gydF4y2Ba
Algreiby AA, Hammer KA, Durmic Z, Vercoe P, Flematti GR.来自澳大利亚本土植物的抗菌化合物gydF4y2BaEremophila glabragydF4y2Ba.Fitoterapia。2018; 126:45-52。gydF4y2Ba
- 18.gydF4y2Ba
Tahtah Y,Wubshet SG,Kongstad Kt,Heskes Am,Pateraki I,MøllerBl,等。高分辨率PTP1B抑制分析结合高效液相色谱 - 高分辨率质谱 - 固相提取 - 核磁共振谱:粗提取物的概念证明和抗糖尿病成分gydF4y2BaEremophila最亮的星gydF4y2Ba.Fitoterapia。2016;110:52-8。gydF4y2Ba
- 19.gydF4y2Ba
Wubshet SG,Tahtah Y,Heskes AM,孔斯塔德KT,Pateraki I,汉伯格B,等人。从和PTP1B的识别α葡萄糖苷酶抑制serrulatanesgydF4y2BaEremophila.gydF4y2Baspp。通过组合使用双高分辨率PTP1B的和α葡萄糖苷酶抑制分析和HPLC-HRMS-SPE-NMR。Ĵ天然产物。2016; 79:1063至72年。gydF4y2Ba
- 20.gydF4y2Ba
Molina-Salinas GM, Rivas-Galindo VM, Said-Fernández S, Lankin DC, Muñoz MA, Joseph-Nathan P, et al.;一种抗结核活性serrulatane - leube乙醇的立体化学分析gydF4y2BaLeucophyllum frutescensgydF4y2Ba.Ĵ天然产物。2011; 74:1199-216。gydF4y2Ba
- 21。gydF4y2Ba
Berrue楼克尔RG。从柳珊瑚二萜类化合物。天然产物众议员2009; 26:681-710。gydF4y2Ba
- 22。gydF4y2Ba
Singab AN, Youssef FS, Ashour ML, Wink M.属gydF4y2BaEremophila.gydF4y2Ba(Scrophulariaceae):乙烯基芹菜,生物和植物化学综述。J pharm pharmacolol。2013; 65:1239-79。gydF4y2Ba
- 23。gydF4y2Ba
彼得斯rj。所有的两个环:Labdane相关的二萜类化合物。NAT PROD REP。2010; 27:1521-30。gydF4y2Ba
- 24。gydF4y2Ba
陈志强,陈志强,陈志强,等。植物萜类合成酶的分子生物学和系统发育分析。中国科学院院刊1998;95:4126-33。gydF4y2Ba
- 25。gydF4y2Ba
陈楼Tholl d,BohlmannĴ,萜类合成酶在植物Pichersky E.家庭:一个中等规模的家族基因的专业代谢是高度在整个王国多元化的。植物杂志2011; 66:212-29。gydF4y2Ba
- 26.gydF4y2Ba
王志强,王志强,王志强,等。植物二萜合成酶在生物工程中的应用。生物科技趋势》。2015;33:419-28。gydF4y2Ba
- 27.gydF4y2Ba
Zerbe P,Hamberger B,Yuen MMS,Chiang A,Sandhu HK,Madilao Ll等。非典范系统中模块化二萜代代谢的基因发现。植物理性。2013; 162:1073-91。gydF4y2Ba
- 28.gydF4y2Ba
茄科植物和其他被子植物中,香叶醛合酶是二萜合酶的一个古老分支,参与防御化合物的合成。植物杂志。2014;166:428-41。gydF4y2Ba
- 29。gydF4y2Ba
Kirby J,Nishimoto M,Park JG,Withers St,Nowroozi F,Behrendt D等人。从大戟属植物和表达中克隆Casbene和Neocembrene合成酶gydF4y2Ba酿酒酵母酿酒酵母gydF4y2Ba.植物化学,2010;71:1466 - 73。gydF4y2Ba
- 30.gydF4y2Ba
王Q,贾米,Huh J-H,Mudlinski A,Peters RJ,Tholl D.鉴定Dolabellane型二萜合酶和其他根表中的二萜合成酶gydF4y2Ba拟南芥gydF4y2Ba.前植物SCI。2016; 7:1761。gydF4y2Ba
- 31。gydF4y2Ba
Xiong W,Wu P,Jia Y,Wei X,Xu L,Yang Y等。物理螺母中萜烯合酶基因家族的基因组分析(gydF4y2Ba麻风树图gydF4y2Ba6个萜烯合成酶的功能鉴定。树基因基因组。2016;12:97。gydF4y2Ba
- 32。gydF4y2Ba
张志强,张志强,张志强,等。一个复杂的萜类生物合成位点的进化gydF4y2BaSolanum.gydF4y2Ba.植物细胞。2013;25:2022-36。gydF4y2Ba
- 33。gydF4y2Ba
Vaughan MM, Wang Q, Webster FX, Kiemle D, Hong YJ, Tantillo DJ,等。不寻常的半挥发性二萜根状二烯由gydF4y2Ba拟南芥gydF4y2Ba根中柱I类萜类合成酶TPS08参与防御地下草食。植物细胞。2013;25:1108-25。gydF4y2Ba
- 34。gydF4y2Ba
蔡俊,张志刚,洪永杰,赵志刚,赵志刚,等。石松醇的生物合成,agydF4y2Ba独联体gydF4y2Ba-prenyl派生的二萜。J Am Chem Soc. 2014; 136:16951-3。gydF4y2Ba
- 35。gydF4y2Ba
Johnson SR, Bhat WW, Sadre R, Miller GP, Sky A, Hamberger B.来自gydF4y2Ba夏枯草gydF4y2Ba突出基材和隔室切换在萜烯合酶进化中的重要性。新植物。2019; 223:323-35。gydF4y2Ba
- 36。gydF4y2Ba
克里斯蒂安森DW。萜类环化酶的结构与化学生物学。化学启117:11570 2017;648年。gydF4y2Ba
- 37。gydF4y2Ba
引用本文:王志强,王志强,王志强,等。gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba异戊基二磷酸合成酶产生C25中间体香叶基二磷酸。植物j . 2015; 84:847-59。gydF4y2Ba
- 38.gydF4y2Ba
刘勇,罗世辉,王国栋,孙国良,Grant M,等。香叶酰基二磷酸合酶为薄荷属腺状毛状体中酯萜(C25)的形成提供前体gydF4y2BaLeucosceptrum canumgydF4y2Ba.植物细胞。2016; 28:804-22。gydF4y2Ba
- 39.gydF4y2Ba
Sallaud C,Rontein D,Onillon S,JabèsF,DufféP,Giacalone C,等。筛选的新型途径生物合成gydF4y2BaZgydF4y2Ba,gydF4y2BaZgydF4y2Ba-法纳基焦磷酸gydF4y2BaSolanum Habrochaites.gydF4y2Ba.植物细胞。2009;21:301-17。gydF4y2Ba
- 40.gydF4y2Ba
Schilmiller AL,Schauvinhold I,拉尔森男,许R,夏博诺AL,施密特A,等人。在番茄的腺毛单萜是从二磷酸橙花前体,而不是二磷酸香叶酯合成。PROC NATL ACAD SCI。2009; 106:10865-70。gydF4y2Ba
- 41.gydF4y2Ba
farara V, Akhtar TA, Nguyen TTH, Spyropoulou EA, Bleeker PM, Schauvinhold I,等。番茄萜类合成酶基因家族。植物杂志。2011;157:770 - 89。gydF4y2Ba
- 42.gydF4y2Ba
鱼骨PM,米拉贝拉R,Diergaarde PJ,VanDoorn A,TISSIER A,康德MR,等人。改进的食草动物抗性栽培番茄与来自野生相对于倍半萜生物合成途径。PROC NATL ACAD SCI。2012; 109:20124-9。gydF4y2Ba
- 43.gydF4y2Ba
Gonzales-vigil E, Hufnagel DE, Kim J, Last RL, Barry CS。tps20相关萜类合成酶的进化影响野生番茄亲缘体腺毛的化学多样性gydF4y2BaSolanum Habrochaites.gydF4y2Ba.植物j . 2012; 71:921-35。gydF4y2Ba
- 44.gydF4y2Ba
Matsuba Y,Zi J,Jones Ad,Peters RJ,Pichersky E.通过Nerylneryl二磷酸二磷酸二磷酸二萜酮烷醇的生物合成gydF4y2BaSolanum lycopersicum.gydF4y2Ba.《公共科学图书馆•综合》。2015;10:e0119302。gydF4y2Ba
- 45。gydF4y2Ba
Grabińska KA, Park EJ, Sessa WC。gydF4y2Ba独联体gydF4y2Ba-Prenyltransferase:新的见解蛋白糖基化,合成橡胶,和人类疾病。J Biol Chem。2016; 291:18582-90。gydF4y2Ba
- 46。gydF4y2Ba
aswatreratanakul K, Zhang Y, Wititsuwannakul D, Wititsuwannakul R, Takahashi S, Rattanapittayaporn A, et al.;cDNA编码的分子克隆、表达及特性研究gydF4y2Ba独联体gydF4y2Ba来自巴西橡胶树的-戊烯基转移酶。参与天然橡胶生物合成的关键因素。中国生物化学杂志。2003;468:4671 - 80。gydF4y2Ba
- 47。gydF4y2Ba
陈志强,陈志强,陈志强,等。橡胶生物合成基因的分子克隆与鉴定gydF4y2BaTaraxacum Koksaghyz.gydF4y2Ba.植物学报2010;28:277-84。gydF4y2Ba
- 48。gydF4y2Ba
曲Y,恰克拉巴提R,陈HT,权EJG,权男,阮TD,等人。生菜 (gydF4y2BaLactuca sativagydF4y2Ba)人类Nogo-B受体的同源物与之相互作用gydF4y2Ba独联体gydF4y2Ba- 戊基转移酶,是天然橡胶生物合成所必需的。J Biol Chem。2015; 290:1898-914。gydF4y2Ba
- 49。gydF4y2Ba
阿赫塔尔,普zemyslaw S, Siekierska H, Kania M, Gelder K, Rea KA,等。聚戊烯醇是由质体合成的gydF4y2Ba独联体gydF4y2Ba- 戊基转移酶和影响光合作用。植物细胞。2017; 29:1709-25。gydF4y2Ba
- 50.gydF4y2Ba
王志强,王志强,王志强,等。番茄gydF4y2Ba独联体gydF4y2Ba- 戊基转移酶基因家族。植物J. 2013; 73:640-52。gydF4y2Ba
- 51.gydF4y2Ba
Kracht On,Ammann A-C,Stockmann J,Wibberg D,Kalinowski J,Piotrowski M,等。澳大利亚干旱土地植物的转录组谱gydF4y2BaEremophila serrulatagydF4y2Ba(A.DC.)培养(Scrophulariaceae)用于鉴定单萜合酶。植物化学。2017; 136:15-22。gydF4y2Ba
- 52.gydF4y2Ba
Hutton PG, Durmic Z, Ghisalberti EL, Flematti GR, Duncan RM, Carson CF等。澳大利亚植物提取物对参与乳酸代谢的瘤胃细菌的抑制作用。饲料科学技术。2012;176:170-7。gydF4y2Ba
- 53。gydF4y2Ba
克罗夫特KD,Ghisalberti EL Jefferies的PR,Proudfoot GM。的化学gydF4y2BaEremophila.gydF4y2Baspp. XVI新serrulatanes from Eremophila spp Aust J Chem. 1981; 34:1951-7。gydF4y2Ba
- 54。gydF4y2Ba
福斯特PG,Ghisalberti EL Jefferies的PR,波菜蒂VM,怀特塞德NJ。从Serrulatane二萜gydF4y2BaEremophila.gydF4y2Baspp。植物化学。1986; 25:1377-83。gydF4y2Ba
- 55。gydF4y2Ba
植物的分泌结构:不仅仅是反应袋。生物技术。2018;49:73-9。gydF4y2Ba
- 56。gydF4y2Ba
MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。Mol Biol Evol. 2016; 33:1870-4。gydF4y2Ba
- 57。gydF4y2Ba
Almagro Armenteros JJ,SønderbyCK,SønderbySK,尼尔森H,Winther O. Deeploc:使用深度学习预测蛋白质亚细胞定位。生物信息学。2017; 33:3387-95。gydF4y2Ba
- 58。gydF4y2Ba
Brückner K, Tissier A.高水平二萜生产的瞬时表达gydF4y2Ba烟草benthamianagydF4y2Ba.植物方法。2013; 9:46-56。gydF4y2Ba
- 59。gydF4y2Ba
基于瞬时表达的萜类生物合成候选基因的高通量检测gydF4y2Ba烟草benthamianagydF4y2Ba.见:Rodríguez-Concepción M,编辑。植物类异戊二烯。分子生物学方法(方法与方案)。纽约:哈门纳出版社;2014.p . 285 - 99。gydF4y2Ba
- 60.gydF4y2Ba
安徒生-兰伯格,康士达KT, Nielsen MT, Jensen NB, Pateraki I, Bach SS,等。通过立体化学控制的组合生物合成,扩大二萜结构多样性的景观。Angew化学2016;128:2182-6。gydF4y2Ba
- 61.gydF4y2Ba
范迪南,聂普豪斯等。橡胶转移酶激活剂是蒲公英天然橡胶生物合成所必需的。自然植物。2015;1:15048。gydF4y2Ba
- 62.gydF4y2Ba
梁志强,李志强,李志强,等。番茄中多酚的生物合成需要双组分酶复合物。植物j . 2015; 82:903-14。gydF4y2Ba
- 63.gydF4y2Ba
Gelder KV, Rea KA, Virta LKA, Whitnell KL, Osborn M, Vatta M,等。中链聚戊烯醇影响叶绿体膜动力学gydF4y2BaSolanum lycopersicum.gydF4y2Ba.植物生理学杂志。2018;59:2350-65。gydF4y2Ba
- 64.gydF4y2Ba
Demissie Za,Erland Lae,Rheault Mr,Mahmoud SS。不规则单波培的生物合成起源gydF4y2Ba薰衣草花gydF4y2Ba:一种小说的分离和生化特征gydF4y2Ba独联体gydF4y2Ba-戊酰二磷酸合成酶基因,薰衣草酰二磷酸合成酶。J Biol Chem. 2013; 288:6333-41。gydF4y2Ba
- 65.gydF4y2Ba
戴尔B.西澳大利亚植物中树脂和腺毛的分布和功能。J R Soc West Aust。1977年; 59:119-23。gydF4y2Ba
- 66.gydF4y2Ba
Ghisalberti EL,杰弗里斯PR,诺克斯JR,谢泼德PN。的化学gydF4y2BaEremophila.gydF4y2BaSP-VII:环氧苯丙烯醇gydF4y2BaEremophila georgeigydF4y2Ba.四面体。1977;33:3301-3。gydF4y2Ba
- 67.gydF4y2Ba
Ghisalberti EL。该属中不寻常的萜类化合物的化学性质gydF4y2BaEremophila.gydF4y2Ba.在:阿塔 - 乌尔 - 拉赫曼,编辑。在研究天然产物化学:爱思唯尔;1995. p。225-87。gydF4y2Ba
- 68.gydF4y2Ba
Zager JJ, Lange BM。评估与腺毛代谢专门化相关的通量分布。植物学报2018;23:638-47。gydF4y2Ba
- 69。gydF4y2Ba
Lange BM,Turner GW。Terpenoid生物合成在胎儿 - 现状和未来机会。植物Biotechnol J. 2013; 11:2-22。gydF4y2Ba
- 70。gydF4y2Ba
利用植物毛状体生物化学生产有用化合物。在:Kermode AR,编辑器。分子网址嫁接:应用、挑战和新兴领域。霍博肯:威利;2018.p . 353 - 82。gydF4y2Ba
- 71。gydF4y2Ba
刘Y,京S-X,罗S-H,立S-H。非易失性天然产物植物腺毛:化学,生物活性和生物合成。天然产物代表2019; 36:626-65。gydF4y2Ba
- 72。gydF4y2Ba
马富,李志强,李志强。到赤霉素,甚至更远!研究(二)萜类代谢的演变。植物学报。2014;65:259-86。gydF4y2Ba
- 73.gydF4y2Ba
茂克斯,西约。Casbene合酶cDNA的克隆:植物萜类固体过程中保守结构特征的证据。PROC NATL ACAD SCI。1994年; 91:8497-501。gydF4y2Ba
- 74.gydF4y2Ba
King AJ, Brown GD, Gilday AD, Larson TR, Graham IA。大戟科生物活性二萜的生产依赖于进化保守的基因簇。植物细胞。2014;26:3286 - 98。gydF4y2Ba
- 75.gydF4y2Ba
Luo D, Callari R, Hamberger B, Wubshet SG, Nielsen MT, Andersen-Ranberg J,等。大戟草成熟种子合成大戟草因子中casbene的氧化和环化反应gydF4y2Ba大戟属植物lathyrisgydF4y2BaL. Proc Natl Acad Sci。2016; 113:E5082-9。gydF4y2Ba
- 76.gydF4y2Ba
杨志强,杨志强,杨志强,等。萜类合成酶基因家族gydF4y2Ba雷公藤gydF4y2Ba单萜合成酶TPS-b亚家族中有一个labdane型二萜合成酶。植物j . 2017; 89:429-41。gydF4y2Ba
- 77。gydF4y2Ba
Inabuy FS,Fischedick JT,Lange I,Hartmann M,Srividya N,Parrish An等人。二萜类化合物的生物合成gydF4y2BaTripterygiumgydF4y2Ba不定的根文化。植物理性。2017; 175:92-103。gydF4y2Ba
- 78。gydF4y2Ba
Nagegowda, Gutensohn M, Wilkerson CG, Dudareva N, Lafayette W, Consortium MP,等。两种几乎相同的萜烯合成酶催化金鱼草花中橙花醇和芳樟醇的形成。植物j . 2008; 55:224-39。gydF4y2Ba
- 79。gydF4y2Ba
黄呒,阿贝尔C,Sohrabi R,陪替氏Ĵ,奥普特I,Cosimano J,等。变异虫害诱导挥发物中萜gydF4y2Ba拟南芥gydF4y2Ba生态型取决于等位基因差异和两种萜烯合成酶TPS02和TPS03的亚细胞靶向性。植物杂志。2010;153:1293 - 310。gydF4y2Ba
- 80.gydF4y2Ba
Jones CG, Moniodis J, Zulak KG, scaffold A, Plummer JA, Ghisalberti EL,等。檀香香精的生物合成包括萜类合成酶(TPS)-a和TPS-b亚家族的倍半萜类合成酶,包括檀香烯合成酶。中国生物化学杂志。2011;286:17445-54。gydF4y2Ba
- 81.gydF4y2Ba
Jia M, Mishra SK, Tufts S, Jernigan RL, Peters RJ。I类二萜合成酶的组合生物合成和底物混杂的基础。金属底座Eng。2019;55:44-58。gydF4y2Ba
- 82.gydF4y2Ba
Pazouki L,NiinemetsÜ。多基片萜烯合酶:其发生和生理意义。前植物SCI。2016; 7:1-16。gydF4y2Ba
- 83.gydF4y2Ba
Jia M, Potter KC, Peters RJ。细菌和植物二萜合酶的极端混杂使组合生物合成成为可能。金属底座Eng。2016;37:24-34。gydF4y2Ba
- 84.gydF4y2Ba
Jia M, Peters RJ。gydF4y2Ba独联体gydF4y2Ba要么gydF4y2BatransgydF4y2Ba用II类二萜酶。Org Biomol Chem。2017; 15:3158-60。gydF4y2Ba
- 85.gydF4y2Ba
3 .基于结构决定因素的萜烯合成酶催化特性的研究。中国科学院院刊2006;103:9826-31。gydF4y2Ba
- 86.gydF4y2Ba
Schrepfer P,Buettner A,Goererer C,Hertel M,Van Rijn J,Wallrapp F等人。鉴定I类萜醛合酶封闭式络合物中催化氨基酸网络的鉴定。PROC NATL ACAD SCI。2016; 113:E958-67。gydF4y2Ba
- 87.gydF4y2Ba
两个残基确定II类二萜合成酶TPS14和TPS21的产品轮廓gydF4y2Ba雷公藤gydF4y2Ba.植物化学。2017; 138:52-6。gydF4y2Ba
- 88.gydF4y2Ba
诺尔P,德拉斯N,FaraldosĴ,昭男,赫斯B,Smentek L,等人。使用2- fluorofarnesyl二磷酸倍半萜合酶的cisoid和transoid环化途径的结构解析。ACS Chem Biol。2010; 5:377-92。gydF4y2Ba
- 89.gydF4y2Ba
Faraldos JA,O'Maille Pe,Dellas N,Noel JP,Cy rm。来自烟草5-EPI- aristoloChene合酶催化的(2Z,6E) - 二磷酸二磷酸二磷酸二磷酸的双替代衍生的倍二萜。J am Chem Soc。2010; 132:4281-9。gydF4y2Ba
- 90。gydF4y2Ba
一种多产物萜烯合成酶gydF4y2BaMedicago truncatulagydF4y2Ba通过两种不同的机制生成cadalane倍半萜。J Organomet Chem. 2010; 75:5590-600。gydF4y2Ba
- 91。gydF4y2Ba
Faraldos JA,米勒DJ,李A,Allemann RK。1,6-环闭合机构为(+) - δ-cadinene合酶?J am Chem Soc。2012; 134:5900-8。gydF4y2Ba
- 92。gydF4y2Ba
一种新的单环二萜化合物gydF4y2BaEremophila Foliosissima.gydF4y2BaKraenzlin。(苦槛蓝科)。四面体。1987;43:2999 - 3007。gydF4y2Ba
- 93。gydF4y2Ba
福斯特PG,Ghisalberti EL,杰弗里斯PR。从树脂A新雪松烯isoprenologuegydF4y2BaEremophila georgeigydF4y2Ba.Ĵ天然产物。1993; 56:147-52。gydF4y2Ba
- 94。gydF4y2Ba
Aminimoghadamfarouj N,Nematollahi A.结构鉴定和从蜂胶的一种特定类型的双萜的植物的表征。分子。2017; 22:1185。gydF4y2Ba
- 95。gydF4y2Ba
Matasci n,Hung L,Yan Z,Carpenter EJ,Wikeett NJ,Mirarab S等人。1000工厂(1KP)项目的数据访问。傻瓜。2014; 3:17。gydF4y2Ba
- 96。gydF4y2Ba
坦克DC, Beardsley PM, Kelchner SA, Olmstead RG。玄参科植物的系统学综述及其现状。Aust Syst Bot. 2006; 19:289-307。gydF4y2Ba
- 97.gydF4y2Ba
戴尔B,麦库姆AJ。腺毛的形成和树脂分泌gydF4y2BaEremophila弗拉西gydF4y2BaF. Meull(Myoporaceae)。原生质。1977年; 92:71-86。gydF4y2Ba
- 98.gydF4y2Ba
张志强,张志强,张志强,等。在酵母中设计鼠尾草酸和鼠尾草醇的生物合成。Nat Commun。2016;7:12942。gydF4y2Ba
- 99.gydF4y2Ba
Ignea C,Athanasakoglou A,Ioannou E,Georgantea P,Trikka Fa,LoupAsaki S,等。由合成生物平台阐明的碳酸生物合成。PROC NATL ACAD SCI。2016; 113:3681-6。gydF4y2Ba
- One hundred.gydF4y2Ba
Haas BJ, Papanicolaou A, Yassour M, Grabherr M, Blood PD, Bowden J,等。利用trinity平台从RNA-seq中重建从头转录本序列,进行参考文献的生成和分析。Nat Protoc。2013;8:1494 - 512。gydF4y2Ba
- 101.gydF4y2Ba
Bray NL, Pimentel H, Melsted P, Pachter L.近最优概率RNA-seq定量。生物科技Nat》。2016;34:525-8。gydF4y2Ba
- 102.gydF4y2Ba
Heskes AM, Sundram TCM, Boughton BA, Jensen NB, Hansen NL, Crocoll C,等。药用植物中生物活性二萜的生物合成gydF4y2Ba牡荆agnus-castusgydF4y2Ba.工厂J. 2018; 93:943-58。gydF4y2Ba
- 103.gydF4y2Ba
努尔 - 埃尔丁HH,GEU-弗洛雷斯楼Halkier BA。USER克隆和用户的融合:理想的克隆技术用于小型和大型实验室。在:费特 - 内托A,编辑。植物次生代谢工程。分子生物学方法(方法和协议)。托托瓦;2010年。gydF4y2Bahttps://doi.org/10.1007/978-1-60761-723-5gydF4y2Ba.gydF4y2Ba
- 104.gydF4y2Ba
Baulcombe DC,P19的莫尔纳尔A.晶体结构 - RNA沉默的普遍抑制。趋势Biochem SCI。2004; 29:279-81。gydF4y2Ba
- 105.gydF4y2Ba
Morrone D, Lowry L, detman MK, Hershey DM, Xu M, Peters RJ。采用模块化代谢工程系统提高二萜产量gydF4y2Ba大肠杆菌gydF4y2Ba: MEV和MEP类异戊二烯前体路径工程的比较。应用微生物生物技术。2010;85:183 - 906。gydF4y2Ba
- 106.gydF4y2Ba
作者简介:王志伟(1985 -),男,博士。与labdane相关的二萜简单生物合成的模块化方法。J Am Chem Soc. 2007; 129:6684-5。gydF4y2Ba
确认gydF4y2Ba
作者感谢在哥本哈根大学与代谢物分析和温室人员技术支持的核心代谢平台(植物生物化学实验室,哥本哈根大学)为植物种植和关怀。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了合成生物学中心(哥本哈根大学跨学科研究卓越计划)、BLM欧洲研究理事会高级拨款(ERC-2012- ADG_20120314)和诺和诺德基金会跨学科协同计划拨款(NNF16OC0021616)的资助。这项工作中使用的核磁共振系统是通过“Apotekerfonden af 1991”、嘉士伯基金会和丹麦科学、技术和创新机构通过国家研究基础设施基金获得的拨款获得的。列出的资助机构在研究的设计、收集、分析和数据解释以及手稿的撰写中没有发挥作用。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
AMH、BLM和IP提出了独创的研究思路。OG和AMH进行了大部分实验,并进行了GC-MS和LC-HRMS分析。NLH和GBP参与了tss的鉴定和克隆,以及酶特性实验的设计和执行。LK、DL和DS对TPS产品进行了核磁共振实验和结构说明。AMH和OG与其他作者一起撰写了这篇文章。所有作者阅读并批准了最终的手稿。gydF4y2Ba
通讯作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
两位作者宣称他们没有相互竞争的利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1gydF4y2Ba
转录组测序数据。gydF4y2Ba表S2。gydF4y2BaMVA和MEP途径分析。gydF4y2Ba表S3。gydF4y2Ba候选萜烯合成酶列表(TPS)和gydF4y2Ba独联体gydF4y2Ba-戊烯酰转移酶(cts)的研究。gydF4y2BaE. lucida.gydF4y2Ba=gydF4y2Ba埃尔gydF4y2Ba,gydF4y2BaE. Drummondii.gydF4y2Ba=gydF4y2Ba艾德gydF4y2Ba和gydF4y2Ba大肠denticulatagydF4y2Ba亚普。gydF4y2BatrisulcatagydF4y2Ba=gydF4y2Ba美东时间。gydF4y2BaDeepLoc-1.0用于预测蛋白质亚细胞定位[gydF4y2Ba57gydF4y2Ba].gydF4y2Ba表S4。gydF4y2Ba用于萜烯合酶系统发育分析的蛋白质序列。gydF4y2Ba表S5。gydF4y2Ba1gydF4y2Bah(600 MHz)和gydF4y2Ba13.gydF4y2BaC(150 MHz) data of (3ZgydF4y2Ba,7gydF4y2BaZgydF4y2Ba11.gydF4y2BaZgydF4y2Ba)-cembratrien-15醇(gydF4y2Ba6gydF4y2Ba)在cdcl.gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba表S6。gydF4y2Ba1gydF4y2Bah(600 MHz)和gydF4y2Ba13.gydF4y2BaC (150 MHz)数据的5-羟基粘性烷(gydF4y2Ba8gydF4y2Ba)在cdcl.gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba表S7。gydF4y2Ba1gydF4y2Bah(600 MHz)和gydF4y2Ba13.gydF4y2Baserrulat-14-ene的C (150 MHz)数据gydF4y2Ba12.gydF4y2Ba)在cdcl.gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba表S8。gydF4y2Ba1gydF4y2Bah(600 MHz)和gydF4y2Ba13.gydF4y2Ba8,9-dihydroserrulat-14-ene的C (150 MHz)数据gydF4y2Ba11.gydF4y2Ba)在cdcl.gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba表S9。gydF4y2Ba蛋白质序列用于gydF4y2Ba独联体gydF4y2Ba-戊烯酰转移酶系统发育分析。gydF4y2Ba表S10。gydF4y2Ba本研究中使用的引物列表。gydF4y2Ba
附加文件2:图S1。gydF4y2Ba
液相色谱 - 高分辨率质谱(LC-HRMS)提取离子色谱图(EIC)乙酸乙酯叶表面洗涤提取物的制备从gydF4y2BaE. lucida,E. denticulatagydF4y2Ba亚普。gydF4y2BatrisulcatagydF4y2Ba和gydF4y2BaE. Drummondii.gydF4y2Ba.所描绘的EIC代表了组合gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba计算的值[m + h]gydF4y2Ba+gydF4y2Ba从这些物种中报道的已知二萜类ICON(±0.05)。gydF4y2BaE. lucida.gydF4y2Ba:321.2424 [gydF4y2Ba18.gydF4y2Ba];gydF4y2Ba大肠denticulatagydF4y2Ba亚普。gydF4y2BatrisulcatagydF4y2Ba: 333.2066, 335.2221 [gydF4y2Ba52gydF4y2Ba,gydF4y2Ba54gydF4y2Ba];gydF4y2BaE. Drummondii.gydF4y2Ba: 333.2058, 335.2221, 363.1809, 349.2014, 351.2169, 513.2474, 527.2638, 421.2586, 435.2744, 367.2121, 409.2226, 451.2332, 365.1964 [gydF4y2Ba19.gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].预测的分子公式在计算值的±2.0 ppm误差范围内。gydF4y2Ba
附加文件3:图S2。gydF4y2Ba
在足底gydF4y2Ba功能分析gydF4y2Ba埃尔gydF4y2BaTPS31和gydF4y2Ba埃尔gydF4y2BaTPS3。gydF4y2Ba(一)gydF4y2Ba和gydF4y2Ba(b)gydF4y2Ba正己烷提取物的GC-MS色谱图gydF4y2BaN. Benthamiana.gydF4y2Ba叶瞬时表达gydF4y2BaElTPS31gydF4y2Ba和gydF4y2BaElTPS3gydF4y2Ba与GGPP合酶(gydF4y2BaCfGGPPSgydF4y2Ba)或NNPP合酶(gydF4y2BaSlCPT2gydF4y2Ba).gydF4y2Ba(C)gydF4y2BaTPS产物的质谱。gydF4y2Ba
附加文件4:图S3。gydF4y2Ba
在足底gydF4y2Ba功能分析gydF4y2Ba美东时间gydF4y2BaTPS4和gydF4y2Ba艾德gydF4y2BaTPS22。gydF4y2Ba(一)gydF4y2Ba正己烷提取物的GC-MS色谱图gydF4y2BaN. Benthamiana.gydF4y2Ba叶瞬时表达gydF4y2BaEdtTPS4gydF4y2Ba和gydF4y2BaEdTPS22gydF4y2Ba与GGPP合酶(gydF4y2BaCfGGPPSgydF4y2Ba)或NNPP合酶(gydF4y2BaSlCPT2gydF4y2Ba).gydF4y2Ba(b)gydF4y2Ba主要TPS产品的质谱。gydF4y2Ba(C)gydF4y2Ba小产物的质谱(插图窗口gydF4y2BaAg)ydF4y2Ba).gydF4y2Ba
附加文件5:图S4。(一)gydF4y2Ba
的体内功能特征gydF4y2BaEremophila.gydF4y2Ba部署。正己烷提取物的GC-MS色谱图gydF4y2Ba大肠杆菌gydF4y2Ba用碱性磷酸酶处理培养物。gydF4y2Ba(b)gydF4y2Ba丙烯醇的质谱:橙花橙醇(a), (2gydF4y2BaZgydF4y2Ba,6gydF4y2BaZgydF4y2Ba)-法尼醇(b)和橙烯醇(c)。gydF4y2Ba
附加文件6:图S5。(一)gydF4y2Ba
GC-MS分析己烷提取物gydF4y2BaE. lucida.gydF4y2Ba叶子。只有gydF4y2Ba6gydF4y2Ba,产品的产品gydF4y2Ba埃尔gydF4y2BaTPS31在植物中检测到。比较迹线是提取物gydF4y2BaN. Benthamiana.gydF4y2Ba叶瞬时表达gydF4y2BaElTPS31gydF4y2BaNNPPS (gydF4y2BaSlCPT2gydF4y2Ba).gydF4y2Ba(b)gydF4y2Ba质谱gydF4y2Ba6gydF4y2Ba由异源表达产生gydF4y2BaN. Benthamiana.gydF4y2Ba相比gydF4y2BaE. lucida.gydF4y2Ba叶提取物。gydF4y2Ba
附加文件7:图S6。gydF4y2Ba
提出的反应途径催化gydF4y2Ba艾德gydF4y2BaTPS22 /gydF4y2Ba美东时间gydF4y2BaTPS4至8,9-二氢铁素蛋白-14-ENE和gydF4y2Ba埃尔gydF4y2Ba来自Nerylneryl二磷酸的TPS3至5-羟基苯胺。gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Gericke, O., Hansen, n.l., Pedersen, G.B.gydF4y2Baet al。gydF4y2BaNerylneryl二磷酸是serrulatane,viscidane和西松烷型二萜的前体gydF4y2BaEremophila.gydF4y2Ba物种。gydF4y2BaBMC植物杂志gydF4y2Ba20.gydF4y2Ba91(2020)。https://doi.org/10.1186/s12870-020-2293-xgydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-2293-xgydF4y2Ba
关键字gydF4y2Ba
- 生物活性二萜gydF4y2Ba
- Eremophila.gydF4y2Ba
- 独联体gydF4y2Ba-Prenyl转移酶gydF4y2Ba
- 萜烯合酶gydF4y2Ba
- SerrulatanesgydF4y2Ba
- ViscidanesgydF4y2Ba
- 植物天然产品gydF4y2Ba