摘要
背景
MicroRNAs (miRNAs)在植物发育和生长调控中起着至关重要的作用,但关于其在不同施氮水平下在籽粒发育中的作用的研究很少。我们的目标是鉴定与调控籽粒特性和对不同氮肥条件的响应相关的miRNAs。
结果
在高氮(HN)和低氮(LN)处理下,共鉴定出79个miRNAs(46个已知miRNAs和33个新miRNAs)在籽粒发育过程中表现出显著的差异表达。在籽粒发育靶基因中早期显著上调的miRNAs主要参与细胞分化、生长素激活信号转导和转录,这可能与籽粒大小有关;中后期丰富的miRNAs主要参与碳水化合物和氮的代谢、转运和激酶活性,并可能与籽粒灌浆有关。此外,我们鉴定了50个miRNAs(22个已知miRNAs和28个新miRNAs),其中11个、9个和39个在开花后7天、17天和27天在HN和LN文库中差异表达。在氮条件下差异表达的miRNAs靶向主要参与碳水化合物和氮代谢、防御反应和运输的基因以及编码泛素连接酶的基因。只有一个新的miRNA (PC-5p-2614_215)在LN处理的所有三个阶段都显著上调,21个miRNA仅在27 DAA时在HN和LN条件下表现出显著的表达差异。因此,我们提出了一个mirna在谷物发育过程中靶基因调控的模型,具有n响应模式。
结论
这些miRNAs的潜在靶点与碳水化合物/氮代谢、转录、细胞分化、转运和防御等多种生物过程有关。我们的研究结果表明,mirna介导的网络通过转录后调控在小麦籽粒发育和氮响应中起着至关重要的作用,这决定了小麦籽粒的重量和品质。本研究为今后研究提高粮食产量和品质的调控机制提供了有用的信息。
背景
作为世界上最大和种植最广泛的粮食作物之一,小麦提供了大约20%的人类所需卡路里摄入量[1].随着全球人口的迅速增长,提高小麦产量是满足未来粮食需求的主要目标[2].此外,随着经济的不断发展,提高小麦品质,包括提高蛋白质含量,是小麦生产的另一个重要目标。传统的育种方法依赖于对遗传变异的操纵,已经成功地培育出了产量和品质都有所提高的小麦品种;然而,通过现代基因工程技术,了解调控小麦发育和籽粒品质的分子机制将有利于进一步的小麦改良计划[3.].
小rna (sRNAs)是植物转录组中普遍存在的组成部分;它们已被发现调节细胞代谢、分化和生长,并参与植物对病毒和移动遗传元件的防御[4].MicroRNAs (miRNAs)是由内源性转录本产生的单链非编码sRNAs,具有不完善的自互补茎环结构[5,6].mirna在生物体中发挥着至关重要的调节作用,通过靶向特定的mrna进行切割或翻译抑制[7,8,9].据报道,miRNAs影响各种生物过程,如叶、根和花的发育,并影响籽粒灌浆[7,10,11,12].灌浆是作物籽粒发育的关键阶段。在水稻中,osa-miR167调控了在籽粒灌浆过程中起作用的生长素- mir167 - arf8 - osgh3.2通路[13].高通量测序结果显示,优劣小麦籽粒差异表达的miRNAs可能与细胞分裂、碳水化合物代谢和激素生物合成有关[14].韩等人。[15]的研究结果表明,miR164、miR160和miR169在籽粒灌浆过程中表现出不同的表达谱,表明它们的功能在小麦种子发育的不同阶段是协调的。类似地,孟等。[12]从小麦籽粒中鉴定出873个miRNAs,并指出其中许多miRNAs可能调控籽粒灌浆。通过对不同小麦组织中mirna的全基因组研究,Sun等人[16]鉴定了64个在小麦籽粒发育过程中表达的miRNAs,这些miRNAs可能在调控籽粒发育中发挥重要作用。
此外,在以前的研究中已经发现了对高等植物氮(N)缺乏反应的miRNAs [17,18,19].在玉米中,miR169、miR399、miR518和miR408在根和叶中对氮有反应,而miR160、miR167、miR168和miR395只在根中对氮缺乏有反应[18].几种mirna,包括miR167、miR171、miR398、miR827、miR408和miR857,已被证实对低氮条件有反应[20.],小麦miRNA TamiR444a对氮缺乏有反应,参与植物对氮饥饿胁迫的适应[21].苏卢阿加等人[22]鉴定了硬粒小麦中84个新mirna和161个保守mirna对N饥饿的响应,发现ttu-miR169c和ttu-novel-61在N饥饿条件下强烈下调。一些mirna,如miR159a、miR159b和miR399,在低氮处理下与高氮处理下表现出显著不同的表达谱[23].然而,关于miRNAs在小麦籽粒中对缺氮的调控作用,特别是在不同发育阶段的调控作用,目前所知甚少。
氮对植物生长和许多作物品种的农业生产力极为重要[24].与其他氮代谢物一起,硝酸盐还可以作为调控全球基因表达的信号[25].在中国,施用氮肥是提高作物产量和经济生产力的重要农艺措施[26].氮肥除对产量有影响外,还是提高籽粒蛋白质含量、改善小麦籽粒品质的重要农艺手段之一[27,28].然而,过量施用氮肥已造成环境污染[29]和土壤酸化[30.].人们在提高氮肥利用效率、减少资源浪费、解决生态环境问题等方面作出了许多努力。了解植物对施氮响应的分子机制,可能有助于培育养分利用效率更高、粮食产量和品质更高的作物品种。为了进一步了解小麦miRNA在不同氮肥水平下对小麦籽粒发育的响应作用,在高氮(HN)和低氮(LN)条件下培养了蛋白质含量高的小麦品种正麦119 (ZM119),并评估了miRNA在籽粒发育过程中的表达模式。本研究的发现将为研究小麦mirna的调控功能提供新的视角,这些mirna不仅与粮食产量和品质有关,而且对氮供应水平也有响应。
结果
纹理特征
如表所示1在HN条件下生长的小麦品种“ZM119”具有较高的籽粒产量、千粒重、总蛋白质含量和蛋白质组分含量(白蛋白、球蛋白、麦胶蛋白和谷蛋白),而在LN条件下生长的小麦籽粒值较低。相应地,HN处理的小麦粉的面团(流变学)特性值高于LN处理的面团。结果表明,与不施氮肥相比,施氮肥能提高小麦产量,改善小麦品质。
两种氮肥水平下小麦籽粒发育过程中srna的深度测序
为了研究不同氮肥施用水平下mirna在小麦籽粒发育中的作用,我们分别在LN和HN条件下(分别为3个生物重复)在开花后7、17和27天(DAA)对小麦籽粒进行了取样,共构建了18个sRNA文库(附加文件)1:表S1)。3个生物重复的平均数据列于表中2.
测序后,每个库产生了10,475,211到11,752,733个冗余原始reads(表22).去除低质量的reads后,每个库得到3,955,306到6,4300,010个干净的reads,占冗余原始reads总数的36.16-60.05%。唯一原始读取的数量从1,561,169到2,014,214不等,唯一干净读取的数量从891,960到1,412,072不等,占唯一原始读取总数的52.37-70.00%。在构建的文库中,大多数miRNAs的长度在21 - 24nt之间(图2)。1),其中21 nt类(59.83-74.34%)是最常见的,其次是24 nt类(7.08-14.64%)。21-nt miRNAs在HN-7和LN-7文库中更常见,而24-nt miRNAs在LN-17和HN-27文库中很常见。
已知mirna和预测的新mirna的鉴定
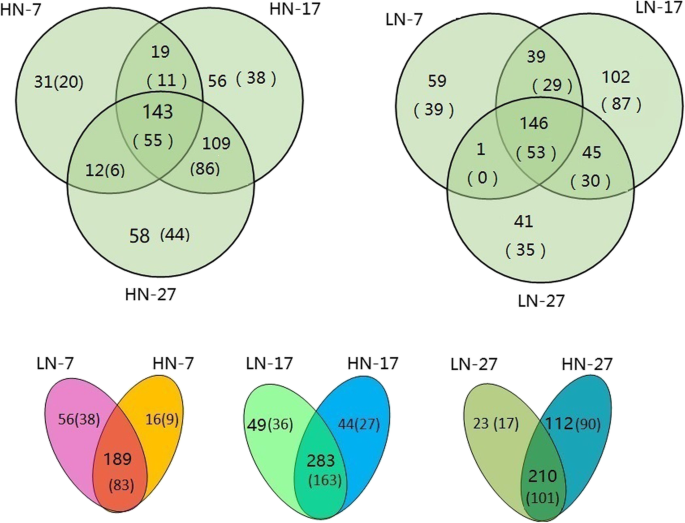
为了在本研究中识别构建文库中的保守miRNAs,每个文库中的唯一reads都与miRBase中已知的植物成熟miRNAs进行同源性搜索2:表S2)。此外,从与已知miRNAs没有相似性的未注释序列中预测出新的miRNAs(附加文件)2:表S2,附加文件3.:表S3)。由于许多mirna尚未沉积到miRBase中,本研究中鉴定的新mirna也与先前发表的小麦mirna进行了比较[12,14,15,16,31,32,33,34,35].总的来说,新鉴定出的39个miRNAs的序列与之前发现的新miRNAs的序列相同(表S2;黄色标记为miRNAs)。大多数新型miRNAs的表达水平相对较低。最丰富的新型miRNAs是tae-miR9655-p5和tae-miR2916-p3_2ss2TC17CA,分别在LN-17和LN-27文库中占24656个reads和27735个reads。在HN-7、HN-17和HN-27文库中分别发现了205、327和322个独特的mirna(其中92、190和191个是新的)。2).此外,在HN-7、HN-17和HN-27三个文库中共发现了143个miRNAs(55个新miRNAs)。HN-7和HN-17文库共享相同的19个mirna,其中11个是新的。在LN-7、LN-17和LN-27文库中分别表达了245、332和233个mirna(其中分别有121、199和118个是新mirna)。我们发现146个mirna(包括53个新mirna)在所有三个LN文库中都有表达。在比较两种氮肥施用水平的影响时,发现LN-7和HN-7有189个共同表达的mirna,其中83个是新的mirna。LN-17和HN-17共有283个表达的mirna,其中163个是新的。很明显,17个DAA文库(HN-17和LN-17)比其他文库包含更多的表达mirna。
发育中的小麦籽粒中差异表达的miRNAs
为了鉴定发育中的小麦籽粒中差异表达的mirna,我们分析了HN-7、HN-17和HN-27文库中mirna的相对丰度P以≤0.05为阈值,判断在籽粒发育过程中表达有显著变化。同样,我们也比较了LN-7、LN-17和LN-27中mirna的丰度。在三个HN处理库的比较中,共鉴定出179个miRNAs(91个已知miRNAs和88个新miRNAs)(附加文件)4:表S4-2和S4-4)。此外,在三个LN治疗文库中鉴定出80个已知miRNAs和76个新miRNAs(表S41,年代43)。所有这些miRNA都属于51个miRNA家族。如附加文件所示4(表S4-1),将三种LN处理文库中已知表达差异的miRNAs分为四组。A-I组中,鉴定miRNA的表达量随晶粒发育呈上升趋势;在该组中有17个miRNAs,包括2个mir156和3个mir167,其中tae-miR9674b-5p(表S4-1)和tae-miR9622a-3p含量最高(表S41)。tae-miR9666b-3p miRNA在发育颗粒中表达程度增加,在LN-7、LN-17和LN-27文库中分别有3,213和674个标准化reads。该表达谱可能表明这些mirna在籽粒发育后期具有更重要的调控作用。a - ii组miRNAs的表达谱随着晶粒发育呈下降趋势,该组共有30个miRNAs,其中2个mir159, 3个mir171, 4个mir169。在该组中,ata-miR5168-3p基因最为丰富,而ata-miR169d-3p_L-2R + 2基因在LN-17、LN-7、LN-27和LN-7的比较中分别表现出了3.81、1.18和4.99的巨大折叠变化。小麦籽粒发育早期高水平表达可能与籽粒胚乳分化和细胞分裂有关。a - iii组成员表现为单一表达峰,在17 DAA时丰度最高。本组共检出18个miRNAs,其中tae-miR9655-3p数量最多。此外,A-IV组中有15个miRNAs,包括3个mir159, 4个mir166和2个mir319(表S41)。
类似地,HN处理文库中有四个miRNA组(对于已知的miRNA)(表S42)。B-I组包含15个miRNAs,包括2个mir156、1个miR408和3个mir9666。B-II组有30个miRNA,属于17个miRNA家族。B-III组的24个miRNAs包括3个mir160、3个mir167和2个mir531,其中tae-miR160(从4129 reads增加到6157 reads)最多。B-IV组共有22个miRNAs,包括4个mir159和4个mir166。对于tae-miR159a, HN-17与HN-7、HN-27与HN-17比较的折叠变化分别为−2.23和−2.19(表S42)。我们注意到,在HN和LN处理下,一些miRNAs在颗粒发育过程中表现出相同的表达谱。例如,tae-miR408_L-1, osao - mir827, tae-miR9666b-3p, tae-miR9666a-3p, tae-miR9664-3p_L-1在HN和LN处理中都属于I组(A-I, B-I)。miR168、miR396和miR530属于II组(A-II和B-II), miR-528、miR-1127和miR9655属于III组(A-III和B-III)(表S)41,年代42)。这些在两种施氮水平上表现出相同表达模式的miRNAs可能与籽粒发育密切相关。当然,部分mirna在施氮水平上表现出不同的表达谱,这说明这些mirna的调控作用可能与施氮状态有关。例如,pt- mir894_l - 1r + 1仅在HN处理中存在差异表达,而tae-miR9652-5p仅在LN处理中存在差异表达。
此外,LN处理和HN处理下新型miRNAs在晶粒发育过程中的表达模式见表S4-3和表S44,分别。与已知的mirna相似,在LN治疗中鉴定出的新mirna也被分为四组(表S43)。C-I组包含24个新mirna,其中tae-miR2916-p5_2ss2AG17TG含量最多,15个mirna在LN-7文库中无表达。C-II组和C-III组分别有18个和31个新的miRNAs。C-IV组仅有3个新miRNAs,其中tae-miR9674a-p5含量最多(表S . 5)43)。同样,HN处理文库中差异表达的新型miRNAs也被分为四组(表S44)。D-I组有30个新miRNAs,其中21个在HN-7文库中无表达,但在HN-27文库中高表达。D-II组有12个mirna,其中tae-miR171a-p5从7个DAA到17个DAA表达倍数变化较大(−4.87)。在D-III组和D-IV组中分别发现了40个和6个新的miRNAs(表S44)。
miRNAs在籽粒发育过程中差异表达的靶基因功能
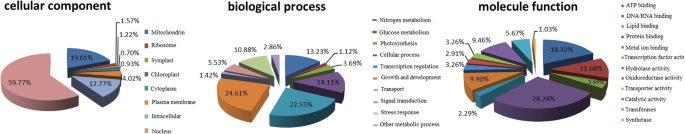
基于基因本体论(GO)赋值,我们鉴定了354个差异表达miRNAs的3011个潜在靶基因。按照“生物过程”(A)、“细胞成分”(B)和“分子功能”(C) GO分类分析mirna的目标功能。在“生物过程”类别中,靶基因主要与10个GO项相关(图。3.),其中“生长与发育”(24.61%)、“转录调控”(22.55%)及“细胞过程”(14.11%)是最具代表性的三项。共鉴定出12个分子功能GO术语,最常见的3个为“蛋白结合”(28.28%)、“ATP结合”(18.32%)和“DNA/RNA结合”(11.68%)。在“细胞成分”中,GO术语最多的是“细胞核”(59.77%),其次是“线粒体”(19.01%)。
为了探究这些差异表达的mirna在谷物发育中的作用,我们在表中列出了已知的mirna和新的mirna及其目标功能3.而且4(附加文件中的目标基因id5:表S5)。可见,目的基因功能多样,编码的基因产物包括转录因子、涉及Skp-cullin-F-box (SCF)泛素连接酶活性、编码细胞分裂素反应因子1 (CRF)、编码蛋白激酶和编码热休克蛋白(HSPs)。tae-miR9674b-5p、tae-miR160、ta- mir166a -3p、tae-miR159a在各生长发育阶段(RAGS)均相对丰富,其靶基因具有多种功能,编码SCF蛋白、蛋白激酶20样、丝氨酸羧肽酶、肌动蛋白-2样蛋白花粉半不育1 (PSS1)、MYB转录因子等蛋白(表3.),这表明这些mirna可能在谷物发育的所有阶段都有多种重要的作用。与发育后期相比,osa-miR171a、ta- mir172c -3p、3个miR396s (ta- mir396a -5p、ta- mir396e -5p和ta- mir396c -5p)、ta- mir393 - 5p_l - 1r + 1和ta- mir5168 -3p在早期(RAES) (HN-7和LN-7)相对更丰富,其预测靶点的基因产物包括DELLA蛋白RGL2 (GA1-3-LIKE 2的阻滞剂)、CRF1、生长素激活信号通路蛋白、丝氨酸型内肽酶、对赤霉素(GA)和富亮氨酸重复链(LRR)激酶有反应的蛋白质。这些mirna可能在种子形成中起着至关重要的调节作用。此外,包括ta- mir528 -5p、bdi-miR531_L-4R + 1_1ss5CT、tae-miR1127b-3p_1ss12TC、tae-miR9652-5p和tae-miR9655-3p在内的几种miRNAs在发育中期(RAMS) (LN-17和HN-17)表达相对较高。这些miRNAs的预测靶点是LRR受体激酶(参与淀粉和蔗糖代谢)、NAD(P)H脱氢酶、udp -葡萄糖苷酸脱羧酶、转运蛋白和L-聚焦酶,这表明它们可能调控淀粉积累和与籽粒灌浆相关的过程。miR156家族成员bdi-miR156h-3p_L + 1和zma-miR156d-3p_L + 1_1ss9TC、tae-miR167b-5p、tae-miR319、osa-miR827和tae-miR408_L-1等部分miRNAs的相对丰度在晚期(RALS)出现增加;他们预测的靶点是WRKY转录因子、SCF蛋白、MYB转录因子、l -抗坏血酸氧化酶、NB-ARC和SYG1/PHO81/XPR1 (SPX),这表明这些mirna可能在籽粒发育后期发挥重要的调控作用。
对于新miRNAs(表4),两个miR2916成员tae-miR2916-p5_2ss2AG17TG和tae-miR2916-p3_2ss2TC17CA不仅在籽粒中丰度最高,而且在灌浆过程中丰度有所增加。这两个miRNAs被预测靶向编码丝氨酸/苏氨酸激酶、谷胱甘肽s -转移酶(GSTF) 1、过氧化物酶、果糖-二磷酸醛缩酶、DELLA蛋白和具有GTPase活性的蛋白的基因,表明它们可能在籽粒发育过程中具有多种功能,在调节籽粒重量和养分积累方面发挥重要作用。许多miRNAs,包括台mir5384 -p5、PC-5p-3645_2157、PC-3p-4780_1750、PC-5p-24289_247、PC-5p-18073_397和PC-3p-21502_303,在小麦籽粒发育中期表现出较高的表达水平,并被预测为编码udp -糖基转移酶、金属内肽酶、神经前体细胞表达发育下调8 (NEDD8)特异性蛋白酶和葡萄糖苷酶的靶基因。
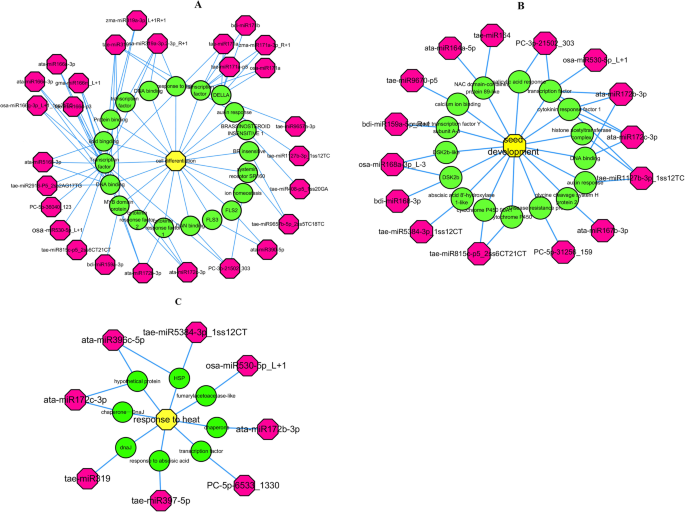
细胞分化在决定小麦籽粒大小中起着重要作用。为了阐明细胞分化的潜在调控机制,我们根据其GO注释选择miRNA及其靶基因,构建了miRNA靶基因GO网络(图2)。4一个)。
在这个网络中有27个miRNAs和20个基因,其中5个、5个和3个miRNAs分别属于miR171、miR166和miR319家族。可见,miR166成员主要靶向转录因子编码和核酸相关基因,miR171家族成员主要靶向参与激素反应的基因。此外,我们构建了一个含有与种子发育相关的GO注释的miRNAs网络(图2)。4b).该网络包含15个miRNAs和16个基因,包括ata-miR167b-3p,预计其靶向甘氨酸裂解系统H蛋白2。tae-miR815c-p5_2ss6CT21CT miRNA可能通过靶向细胞色素P450s调控晶粒发育,细胞色素P450s在碳水化合物代谢中起作用。此外,利用GO注释构建了一个包含8个mirna和8个靶基因的网络,与热应激反应相关(图。4c).该网络显示miRNA的靶点包括编码伴侣、转录因子、HSPs、DnaJ和ABA通路组分的基因,表明miRNA可能通过调控多种途径参与热应激反应。此外,miR172成员可能通过调节伴侣在热应激反应中发挥重要作用。
在两个N水平之间差异表达的miRNAs及其潜在的靶基因功能
在HN和LN之间的比较显示40(25个已知和15个新),44(26个已知和18个新)和100(48个已知和52个新)分别在7 DAA, 17 DAA和27 DAA处差异表达miRNAs(附加文件)6:表S6-1、S6-2和S6-3)。为了进一步探讨这些miRNAs在籽粒发育中的作用以及对施氮水平的响应,提出了log的标准2(fold change)≥1.0,以reads / million of total miRNA reads (RPM)≥20为指标,筛选出构建文库中的差异表达miRNA。在LN-7与HN-7、LN-17与HN-17、LN-27与HN-27的比较中,已知mirna的上调miRNAs比例分别为2/ 6,0 /6和5/10,而新miRNAs的上调miRNAs比例分别为5/ 5,2 /3和8/24(表25).
差异表达的miRNAs及其靶基因功能如表所示6.对于已知的miRNAs,在HN处理(HN-7和HN-17)中sbi-miR399a的丰度显著高于LN处理(LN-7和LN-17),在17和27 DAA时,HN处理中taimir9664 - 3p_l -1的表达显著高于LN处理。此外,在LN-27处理中ata-miR172b-5p的表达水平高于HN-27处理。对于新型mirna,我们发现更多差异表达的mirna在发育后期(LN-27和HN-27)。PC-5p-26413_215在LN处理中在三个籽粒发育阶段的表达量显著高于HN处理,并可能调控油菜素类固醇不敏感1相关受体激酶1 (BAK1)和LRR受体样丝氨酸/苏氨酸蛋白激酶。我们发现,与LN-27文库相比,HN-27文库中有16个新的mirna显著上调,其中包括两个tae-miR2916家族成员(tae-miR2916- p3_2ss2tc17ca和tae-miR2916- p5_2ss2ag17tg),它们在LN-27和HN-27之间的折叠变化为1.74-1.98。PC-3p-15988_474和PC-5p-6533_1330在LN-27中比HN-27中更丰富,可能通过靶向防御(过氧化物酶活性)和转录因子编码基因发挥作用。PC-5p-36040_123在LN-27中表达量也高于HN-27,其预测的靶基因产物为二硫异构酶,提示其可能与调控粮食贮藏和蛋白质品质有关。
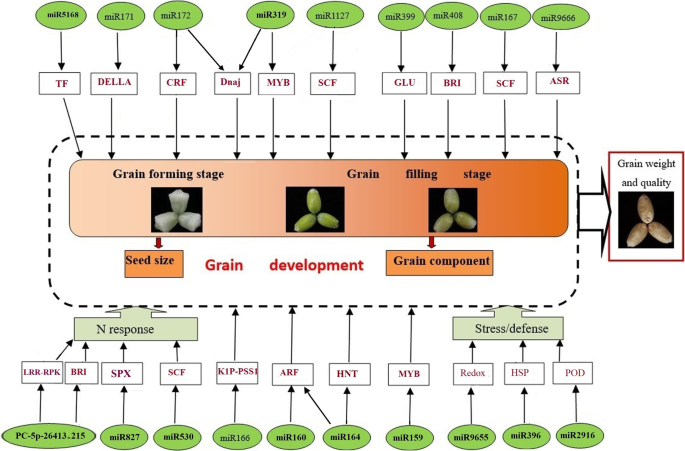
在Cytoscape平台v.3.6.0上构建了HN和LN处理之间表达差异的miRNAs网络(https:cytoscape.org) [36](附加文件7:图S1)。差异表达的miRNAs具有多种潜在功能,如靶向碳水化合物代谢、氮代谢、信号转导、激素反应和防御。但是,可以明确的是,tae-miR2916-p5_2ss2AG17TG、PC-3p-4066_99、tae-miR5386-p5、PC-5p-26413_215、ata-miR164a-5p、tae-miR9655-p5、PC-3p-21502_303和sbi-miR399a这8种miRNAs具有相同的靶基因编码转录因子。除了碳水化合物代谢和信号转导外,还预测了5种miRNAs: tae-miR2916-p3_2ss2TC17CA、PC-3p-15988_474、osa-miR530-5p_L + 1、tae-miR2592bj-p3_2ss12TC19AT和ata-miR528-5p可靶向转运功能基因。我们还注意到tae-miR9664-3p_L-1不仅具有多种潜在功能,而且通过RPP13和RPM1蛋白与转录因子组和转运基团相连。这些分析结果表明,差异表达的miRNAs可能通过调节多种代谢途径对不同氮肥条件作出反应。此外,转录因子和转运蛋白可能在氮供应状态的响应中发挥重要作用。我们还构建了一个模型,以展示差异表达miRNAs的调控如何与籽粒发育和对氮供应的响应相关(图2)。5).
与籽粒发育和氮水平响应相关的miRNAs及其靶基因模型。绿色圈内的黑色字母表示mirna,黑色框内的红色字母表示靶基因功能。黑色箭头表示监管方向。TF,转录因子;CRF,细胞分裂素反应因子;自洽场,Skp-cullin-F-box;GLU、葡糖基转移酶;BRI,油菜素类固醇不敏感;ASR,替代剪接调节器;LRR-RPK,亮氨酸富重复序列受体样蛋白激酶; K1P-PSS1, kinesin-1-like protein PSS1; ARF, auxin response factor; HNT, high-affinity nitrate transport; Redox, reduction-oxidation; HSP, heat-shock protein; POD, peroxidase
已鉴定的mirna及其靶基因的验证
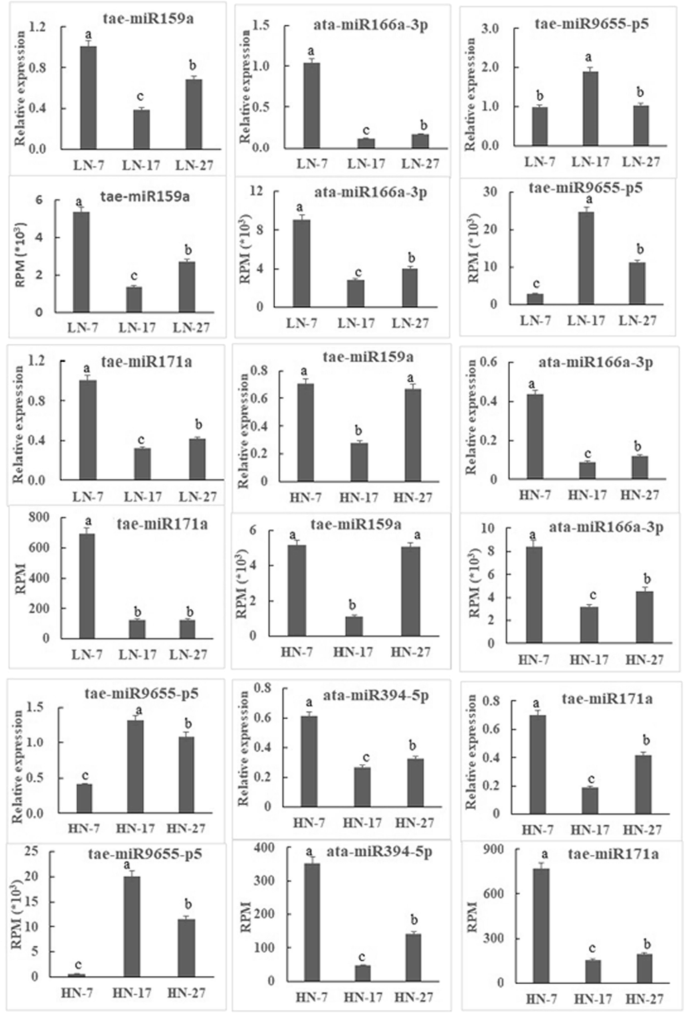
为了确认本研究中的miRNA表达并验证深度测序结果,我们分别从LN和HN文库中随机选择了4个和5个miRNA(包括一个新miRNA)进行实时聚合酶链式反应(qRT-PCR)定量分析。这些mirna的表达模式与深度测序结果相似,表明本研究获得的sRNA测序结果是可靠的(图2)。6).
为了验证潜在miRNA靶点的表达模式,附加文件中给出了四个靶基因(基因id和引物序列)8:表S7)分别在HN和LN处理下进行基因特异性qRT-PCR(图S7)。7).PC-5p-3645_2157、tae-miR9655-p5、tae-miR9655-3p和tae-miR319的表达水平随着籽粒发育而上调,其预测靶基因表达呈下调模式。这些结果表明,靶基因表达与其对应的miRNA表达谱之间存在负相关关系。
讨论
不同氮素处理下的籽粒特征
氮在植物生长和农业生产中起着重要作用[24,26],施氮是提高小麦籽粒产量和提高籽粒加工品质的有效农艺措施[27,28].在这里,HN处理可以提高籽粒产量、蛋白质含量和面团发育时间,这与以往报道的结果一致[27,28,37].我们还观察到谷蛋白(麦胶蛋白和谷蛋白)含量(27.80 mg g−1)高于白蛋白和球蛋白含量(9.74 mg g−1),表明籽粒蛋白质组分对氮肥的不同响应。根据国家优质小麦标准[38], HN条件下籽粒蛋白质含量较高,面团流变学特性(吸水率、面团发育时间和稳定性)符合强筋小麦标准,证实施氮可以改善籽粒加工品质。
参与小麦籽粒发育的miRNAs
更好地了解miRNAs在籽粒发育中的调控作用及其对施氮水平的响应,将为提高籽粒产量和品质提供新的视角。以前的研究已经在小麦中发现了几种保守的mirna,如miR159、miR160、miR164和miR156 [12,15].在本研究中,我们还发现了几个高度保守的miRNA家族,如miR156、miR396、miR160、miR172和miR164,这表明这些miRNA在小麦籽粒中含量丰富,并可能在籽粒发育中发挥重要的调控作用。小麦从开花到成熟的繁殖阶段包括籽粒形成和灌浆阶段;小麦胚乳细胞的数量直接关系到小麦的产量和品质[39].胚乳细胞数量在6-9 DAA时迅速增加,最终数量由14-18 DAA决定[39].在7 DAA时,osa-miR171a、ata-miR172c-3p、miR396 (ata-miR396e-5p、ata-miR396a-5p和ata-miR396c-5p)和ata-miR5168-3p家族的成员数量最多,表明这些miRNAs可能参与了籽粒发育的早期阶段。孟等在早期发育的籽粒中也发现miR171a和miR172成员丰度较高。[12].此外,通过分析miRNA靶基因GO术语,我们鉴定出27个与细胞分化相关的靶基因产物miRNA(图2)。4),包括osa-miR171a和ata-miR172c-3p。据报道,miR172成员通过调控APETALA2 (AP2)样基因的表达来控制水稻、玉米和大麦的花器官特性[40,41,42].过表达miR172b转基因水稻的花和种子发育存在缺陷;这些植物的小穗肥力也相对较低,种子重量也较低[42].在这里,ata-miR172c-3p的预测靶点是CRF基因。CRFs是aptala2 /乙烯反应因子(AP2/ERF)转录因子的一小部分,该转录因子作为细胞分裂素信号转导途径的一部分调控植物发育[43],表明ata-miR172c-3p可能通过细胞分裂素调控参与小麦种子发育。玉米和小麦籽粒发育过程中细胞分裂素水平与终粒重呈正相关[44,45].除了细胞分化外,我们还发现ata-miR172c-3p (DnaJ)和ata-miR172b-3p(伴侣结合)的靶基因产物参与了种子的发育和对热胁迫的响应(图。4),这可能表明它们在决定小麦籽粒大小和重量方面起着重要的调节作用。Ma等人。[46]的研究发现,miR171-SCL模块在介导赤霉素(GA)-DELLA信号在叶片生长和叶绿素生物合成的协调调节中起着关键作用。我们还预测osa-miR171a的潜在靶点是编码蛋白质的基因,如DELLA蛋白rg2样,这是GA信号通路中的调节因子。研究表明,miR396成员通过调控籽粒大小来影响水稻产量[47],靶基因从TT碱基替换为AA碱基可以抵消miR396的抑制,从而激活激素反应,增大晶粒尺寸[48,49].朔默等人[50]也发现miR396b的直接调控因子转录因子TCP4可以通过激活多种途径抑制细胞增殖。在本研究中,3个miR396s (ata-miR396e-5p, ata-miR396a-5p, ata-miR396c-5p)在7 DAA时相对丰富,靶基因编码的蛋白具有响应GA、转录因子、GTPases、蛋白激酶等功能,提示这些miRNAs的调控可能与晶粒大小有关。这些结果表明,这些miRNAs可能在调控籽粒胚乳细胞发育中发挥重要作用,而胚乳细胞发育与籽粒大小直接相关。然而,需要进一步的研究来探索目标基因及其功能。
籽粒灌浆是籽粒发育的重要过程,最终决定籽粒重量和面粉品质。有人认为,14-18 DAA是小麦淀粉类胚乳形成的主要过渡点,本质上标志着胚乳细胞分裂和淀粉和面筋蛋白沉积的结束[39].孟等。[12]鉴定出一些可能参与控制籽粒灌浆的miRNAs;这些miRNAs通过靶向许多不同的小麦基因参与各种生物过程,如参与碳水化合物代谢、蛋白质代谢、转运和转录的基因。在我们的研究中,我们发现了几种保守的miRNAs和新的miRNAs,它们不仅在小麦籽粒中高度丰富,而且在籽粒发育过程中显著上调或下调;例如tae-miR160和ata-miR166a-3p。这些miRNAs的潜在基因靶点基因产物包括转录因子、生长素反应因子(ARFs)、丝氨酸羧肽酶、肌动蛋白-1样蛋白PSS1、转运蛋白等。众所周知,miR160可指导几种ARF mrna的裂解,以调节植物生长和种子萌发[51,52].植物中miR160抗性ARF17的表达会导致显著的发育缺陷,miR160的过表达会导致淀粉颗粒减少和根尖紊乱[52,53].对植物miR166家族的保存和多样性的分析表明,miR166成员在种子发育中起着广泛而重要的调控作用[54].因此,这些数据表明这些miRNAs在籽粒灌浆过程中具有多种调节功能。在本研究中,我们还发现了一些在籽粒发育中期显著上调的新型miRNAs(如ae-miR5384-p5、PC-5p-3645_2157、PC-3p-4780_1750、PC-5p-24289_247、PC-5p-18073_397和PC-3p-21502_303) (17 DAA)。预测目标基因编码的蛋白包括udp -糖基转移酶、nedd8特异性蛋白酶、金属内肽酶和葡萄糖苷酶,提示这些上调的miRNAs可能与碳水化合物和氮代谢有关,影响淀粉沉积和蛋白质积累。
一些miRNAs,如tae-miR319、hvu-miR399和miR9666,在早期(7 DAA)表达量很少或没有表达,但随着籽粒发育的进行,这些miRNAs在27 DAA时表达量最多。这些mirna靶向基因的潜在编码蛋白包括myb、DnaJ、含NB-ARC结构域的蛋白和替代剪接调控因子。miR319是一种保守的microRNA,可调节参与多种发育途径的TCP转录因子,如激素生物合成、信号通路和叶片发育和衰老[55,56].我们还预测miR319在热应激反应中的潜在靶点之一是编码DnaJ蛋白的基因。籽粒灌浆高温胁迫是高品质小麦生产中的一个主要问题,进一步探索这些mirna响应热胁迫的内在机制将是降低高温胁迫影响的潜在途径。
谷物品质是一个复杂的性状,不仅包括蛋白质含量,还包括小麦麸质聚合物结构[57].陈等人。[58]报道了半胱氨酸和蛋氨酸代谢途径通过合成含硫氨基酸在储存蛋白质生物合成中发挥重要作用。KEGG (Kyoto Encyclopedia of Genes and Genomes)通路分析显示,bdi-miR531_L-4R + 1_1ss5CT和ta- mir396e -5p的靶基因被注释为参与半胱氨酸和蛋氨酸代谢。由蛋白质二硫异构酶调控的二硫键的形成是决定面筋蛋白聚合的关键因素[57,59].我们发现了一个新的miRNA PC-5p-36040_123,它被预测为靶向蛋白二硫异构酶,在HN-27处显著下调。高氮处理下表达下调可能导致二硫异构酶活性增加,促进籽粒蛋白聚合物的形成。除了SS键外,氢键或静电键或其他非共价键也参与面筋蛋白聚合物的形成[57].还需要进一步了解所鉴定的mirna的调节功能及其与谷物和面粉中蛋白质聚合物结构的关系。
不同施氮水平下差异表达的miRNAs
许多mirna已被鉴定出对营养物质和非生物胁迫(如盐胁迫和干旱胁迫)有反应[60].在这项研究中,我们鉴定了50个miRNAs(包括28个新miRNAs),它们在HN和LN处理中表现出显著的表达差异。miR399的表达因磷(P)缺乏而上调[61],通过调控靶蛋白的表达水平与P稳态相关PHO2该基因编码一种泛素偶联E2酶,UBC24 [62].Baek等。[63]还发现转录因子AtMYB2可以调节miR399的表达水平以响应磷饥饿。同样,Zhao等人。[23]报道称,在缺氮条件下,TamiR399被下调。在我们的研究中,我们发现在LN治疗中,两个mir399 (sbi-miR399a和hvu-miR399)的表达显著下调。这两种miRNAs参与调控转录因子、氧化还原酶(防御反应)和udp -糖基转移酶的靶基因,提示这两种miRNAs可能通过抑制翻译介导低氮胁迫下的信号转导。
拟南芥miR169已被证明参与了对LN胁迫的适应[64].赵等人。[19]还报道了两种新的miR169物种(miRC10和miRC68)通过与靶向核转录因子亚单位的mRNA相互作用,关键地调节玉米幼苗对LN的适应。LN胁迫下拟南芥miR169的强烈下调影响了其靶标NFYA (Nuclear Factor Y, subunit A)家族成员参与aba依赖通路的表达[65].我们发现两个miR169s (ta- mir169d - 3p_l - 2r + 2和ta- mir169d -5p)在LN-27中的表达明显低于HN-27,预测的靶基因功能包括激酶活性和E3泛素蛋白连接酶活性。此前有报道拟南芥MIEL1 E3连接酶通过促进MYB96的翻转负向调控ABA信号敏感性[66].由此可见,miR169调控籽粒对施氮水平的响应可能与ABA信号通路有关。
先前的研究表明,miR827通过靶向编码SPX-MFS蛋白的基因对磷饥饿产生强烈反应,这些蛋白被预测与磷的感知或转运有关[67].拟南芥中硝酸盐和磷之间存在串扰[68],在拟南芥中,miR827的过表达也导致NLA和PHO2 (PHOSPHATE2-ubiquitin conjugase)突变体在低硝酸盐或高磷条件下生长的生理反应相似[68].肥料试验也证实了氮磷肥之间的相互作用,氮磷肥配施可提高小麦产量和品质[69].在这里,我们发现了一个osa-miR827,它被预测靶向一个编码含有spx结构域的蛋白的基因,该蛋白在LN-17中表现出显著的下调。刘等。[70研究发现,NLA通过调控NRT1.7的降解来响应拟南芥中硝酸盐在源和汇之间的再动员,而NRT1.7的降解依赖于miR827。这表明miR827可能通过调控NLA来影响氮的积累和再动员。此外,作用方式通过翻译后调节途径发生,而不是在转录水平[71].在我们的研究中发现的所有差异表达的mirna中,只有PC-5p-26413_215在LN治疗的所有三个阶段都显著上调。预测PC-5p-26413_215的靶基因编码BAK1。众所周知,油菜素类固醇(brassinosteroids, BRs)控制植物发育和生长的各个方面,而BR的感知和信号转导需要活性的brassinosteroids INSENSITIVE 1 (BRI)和BAK1 [71].然而,需要进一步的工作来确认靶基因的功能和该miRNA的调控机制。
氮是小麦生长必需的无机养分,在籽粒发育中起着重要作用。在本研究中,我们发现21种新型miRNAs仅在LN-27处理中与HN-27相比显著上调或下调(例如PC-5p-6533_1330、PC-3p-15988_474、tae-miR9779-p3、PC-3p-11233_746和tae-miR5384-p5),它们被预测靶向参与防御(过氧化物酶)、编码转录因子(MYB)、参与氮代谢(金属内肽酶)、参与碳水化合物代谢(udp -糖基转移酶)、并参与运输(己糖运输)。Zhao等人也报道了LN和HN处理之间不同的表达模式。[23].因此,差异表达的mirna及其靶基因表明小麦籽粒中存在多个氮响应模块,mirna可能通过转录后或翻译后调控介导植物对氮剥夺的反应和适应。
结论
我们鉴定出79个miRNAs(46个已知miRNAs和33个新miRNAs)在HN和LN处理下小麦籽粒发育过程中表现出显著的差异表达。我们还鉴定出50个mirna(22个已知mirna和28个新mirna)对施氮水平有反应。这些miRNAs的潜在靶点参与多种生物过程,包括细胞分化、碳水化合物代谢、转录、信号转导、转运和防御。我们的结果表明,mirna介导的转录后调控网络在小麦籽粒发育和氮响应中起着至关重要的作用,这决定了小麦籽粒的重量和品质。我们的工作为进一步探索mirna在提高粮食产量和品质中的作用机制提供了有用的信息。
方法
实验设计和样品制备
由河南省农业科学院提供的冬小麦品种“ZM119”种子于2016-2017年生长季在河南农业大学科教园(河南省原阳35°06′N, 113°56′E)种植,该品种由河南省农业科学院选育,并于2014年经河南省作物品种审定委员会审定。表层土壤有机质含量为10.1 g kg−1,有效磷、有效钾含量均为35.0 mg kg−1和110.6毫克千克−1,分别。2个氮肥处理,每个处理3个重复:LN (0 kg ha−1)和HN(210公斤公顷−1).每块地面积为21 m2(3 m × 7 m),每个地块施磷315 g (P2O5)和315 g K (K2O)播种前。总氮的50%(以尿素形式)在播种前施,50%在伸长期追施。种子于2016年10月14日以200粒米的密度播种−2.在开花时,小麦穗具有相似的大小和开花时间在同一天被标记。小麦穗分别在7、17和27 DAA取样。采样的谷物立即在液氮中冷冻,然后储存在超低温冰箱中直到使用。之后,成熟的谷物在Cyclotec样品磨(Foss Tecator AB, Höganäs,瑞典)中经过清洗和去除外来谷物后被研磨。
小RNA文库构建及RNA测序
为了构建18个sRNA文库,根据制造商的说明,使用TRIzol试剂(Invitrogen, Carlsbad, CA, USA)分别提取6个独立样品,HN-7, HN-17和HN-27以及LN-7, LN-17和LN-27(分别在HN和LN条件下于7、17和27 DAA取样)和3个生物重复。RNA数量和质量使用Bioanalyzer 2100和RNA 6000 Nano LabChip试剂盒(Agilent Technologies, Santa Clara, CA, USA)进行评估。使用RIN (RNA完整性编号)> 7.0的RNA制剂构建sRNA文库。小RNA首先连接到5 ' RNA/DNA嵌合寡核苷酸适配器(Illumina),然后连接到3 '适配器以产生连接产物。然后通过反转录结扎产物产生cdna。根据制造商推荐的方案,使用Illumina HiSeq 2500仪器(Illumina, San Diego, CA, USA)对cdna进行测序。
生物信息学分析和miRNA鉴定
miRNA文库中的原始测序reads经过Illumina管道过滤器(Solexa 0.3)处理,然后使用内部程序ACGT101-miR (LC Sciences, Houston, TX, usa)对数据集进行处理,以去除适配器二齐聚体、常见RNA家族成员、重复序列和低复杂度reads。随后,miRBase 21.0中18到25个核苷酸长度的独特sRNA序列被映射到特定物种的前体(http://www.mirbase.org)使用BLAST搜索来识别保守的miRNAs和新的5p-和3p衍生的miRNAs [72].在对中过程中允许序列的内部错配和3 '和5 '端长度的变化。在发夹臂中映射到特定成熟miRNA物种的独特序列被表征为已知的miRNA。当将独特的序列映射到已知特定前体发夹的另一臂,与注释的成熟miRNA臂相反时,发现了一种潜在的新型5p或3p衍生miRNA。其余序列通过BLAST搜索与miRBase 21.0中其他选定的物种前体进行匹配,并将已映射的pre-miRNAs进一步作为BLAST查询,通过搜索特定物种的基因组来确定其基因组位置。以上两次搜索的结果被归类为已知miRNAs。最后,通过BLAST对特定基因组查询未映射的序列,并使用RNAfold软件预测包含侧翼120-nt序列的发夹RNA结构(http://rna.tbi.univie.ac.在/目录/ RNAfold.cgi)。文献报道了miRNA预测的关键标准[73].前体的二级结构也用RNAfold预测(http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi).原始数据已提交给NCBI的序列读取存档(SRA) (https://www.ncbi.nlm.nih.gov),注册编号为PRJNA563099。
差异表达mirna的鉴定
表达式级别被规范化为RPM值。一个t-test检验统计学意义。如果不同处理之间的RPM比值大于2(折叠变化≥2)P-value≤0.05,则定义为差异表达mirna。
miRNA目标预测和注释
通过使用计算目标预测算法(target Finder)识别mirna结合位点来预测mirna靶向的基因。目标搜索使用小麦L. IWGSC图书馆(http://plants.ensembl.org/index.html).通过BLAST对NCBI库查询目标序列,对潜在的miRNA靶标进行功能注释(https://www.ncbi.nlm.nih.gov/).最丰富的miRNA靶标也用GO标记(http://www.geneontology.org/)和KEGG路径(http://www.genome.jp/kegg/).
利用qRT-PCR定量miRNA和靶mRNA
根据制造商的说明,使用miRNA First-Strand cDNA Synthesis SuperMix (TransScript)进行逆转录反应。使用SYBR PrimeScript miRNA RT-PCR试剂盒在荧光检测系统(天根生物科技,北京,中国)中按照制造商的说明进行qRT-PCR。所有反应对每个样品进行三次。2——∆∆CT方法计算miRNAs的相对表达量[74].选择HN和LN处理籽粒发育过程中差异表达的mirna的靶基因,通过qRT-PCR验证其在小麦籽粒发育过程中的表达模式。随后采用Fisher最小显著性差异检验(LSD),用SPSS (Statistical Program for Social Science)软件区分不同发育阶段相对表达水平的差异;P< 0.05为有统计学意义。所使用的引物序列和目的基因鉴定结果见表S7(附加文件8).
籽粒总蛋白含量和各组分含量的测定
采用Liu等人的顺序提取方法提取四种颗粒蛋白组分,白蛋白、球蛋白、麦胶蛋白和谷蛋白。[75].采用全自动凯氏定氮分析仪(Kjeltec 2300, Foss Tecator,瑞典),按照ICC(1994)标准方法105/2(国际谷物化学协会,维也纳,奥地利)的方法对每个样品中的总蛋白质含量和个别分数含量进行分析。评价HN和LN的差异t-通过SPSS进行测试;值为P< 0.05为差异有统计学意义。
数据和材料的可用性
在本研究过程中产生或分析的所有数据都包含在本文中(及其补充信息文件)。测序原始读文提交到NCBI数据库,登录号为PRJNA563099 (https://www.ncbi.nlm.nih.gov).
缩写
- 阿坝:
-
脱落酸
- 东盟地区论坛:
-
生长素反应因子
- BAK1:
-
油菜素类固醇不敏感1相关受体激酶1
- 展望:
-
油菜素内酯不敏感
- CRF:
-
细胞分裂素反应因子
- DAA:
-
开花后几天
- 遗传算法:
-
赤霉素
- 走:
-
基因本体论
- GSTF:
-
谷胱甘肽S-transferase
- 接下来:
-
高氮处理
- HSP:
-
热休克蛋白的
- LN:
-
低氮处理
- 远程雷达:
-
富亮氨酸重复
- microrna的:
-
微
- 护士:
-
氮
- 国民:
-
氮素限制适应
- 存在:
-
定量逆转录聚合酶链反应
- 自洽场:
-
Skp-cullin-F-box;SPXSYK1 / PHO81 / XPR1
- sRNA:
-
小核糖核酸
参考文献
- 1.
张志刚,张志刚,张志刚。植物对全球气候变化响应的研究进展。入:雷诺兹议员,编辑。气候变化和作物生产。瓦林福德:CABI;2010.115 - 38页。
- 2.
Foulkes MJ, Slafer G, Davies WJ, Berry PM, Sylvester-Bradley R, Martre P,等。提高小麦产量潜力。3优化粮食分配,同时保持抗倒伏。中国科学(d辑),2011;
- 3.
陈志伟,陈志伟,陈志伟,等。利用基因沉默技术快速测定小麦和大麦的基因功能。作物科学2010;50:S77-84。
- 4.
Jinek M, Doudna JA。RNA干扰分子机制的三维视图。大自然。2008;457(7228):405 - 12所示。
- 5.
谢泽,艾伦恩,N法尔格伦,A卡玛尔,SA吉文,JC。拟南芥的表达microrna的基因。植物科学进展。2005;38(4):344 - 344。
- 6.
李勇,金敏,韩杰,严赫,李松,白硕,等。MicroRNA基因由RNA聚合酶II转录。中国生物医学工程学报。2004;23(20):4051-60。
- 7.
Bartel DP。MicroRNAs:基因组学,生物发生,机制和功能。细胞。2004;116(2):281 - 97。
- 8.
马洛丽,李志强,李志强,等。植物中microRNAs及相关小rna的功能。Nat Genet, 2006;38: S31-6。
- 9.
植物microRNAs的起源、生物成因和活性。细胞。2009;136(4):669 - 87。
- 10.
边红,谢勇,郭峰,韩娜,马松,曾震,等。miRNA393/TIR1同源物模块在水稻旗叶倾斜、初生根和冠根生长调控中的独特表达模式和作用(栽培稻).新植物,2012;196:149-61。
- 11.
陈霞。拟南芥花发育中作为APETALA2翻译抑制因子的microRNA。科学。2004;303:2022-5。
- 12.
孟FR,刘浩,王KT,刘丽玲,王士华,赵玉华,等。小麦籽粒发育相关microRNAs (小麦l .)。BMC植物生物学,2013;13:140。
- 13.
薛丽娟,张俊杰,薛华文。水稻种子中mirna的特征及表达谱。中国生物医学工程学报,2009;37(3):916-30。
- 14.
王友友,史国忠,杨天祥,赵玲,陈建华,张楠,等。高通量测序结果显示,microRNAs参与了面包小麦优质和劣质籽粒的发育。科学通报2018;8:13854。
- 15.
韩瑞,简春,吕建勇,闫颖,迟青,李志军,等。小麦旗叶和发育中的种子microrna的鉴定与鉴定(小麦l .)。BMC Genomics. 2014;15:289。
- 16.
孙福林,郭光华,杜建科,郭文伟,彭慧华,倪泽峰,等。小麦全基因组mirna的发现及其靶标(小麦l .)。BMC植物生物学。2014;14:142。
- 17.
吉福德ML,迪恩A,古铁雷斯RA,科鲁兹总经理,伯恩鲍姆KD。细胞特异性氮反应介导发育可塑性。中国科学(d辑),2008;26(2):349 - 349。
- 18.
徐震,钟山,李霞,李伟,Rothstein SJ,张松,等。玉米叶片和根中低硝酸盐可用性microRNAs的全基因组鉴定公共科学学报,2011;6(11):e28009。
- 19.
赵颖,徐震,莫青,邹超,李伟,徐勇,等。结合小RNA和降解体测序揭示了新的miRNAs及其在玉米低硝酸盐可利用性反应中的靶标。《中国科学》,2013;
- 20.
梁刚,何华,于德强。拟南芥氮饥饿响应microrna的鉴定。公共科学学报,2012;7(11):e48951。
- 21.
高松,郭超,张勇,张峰,杜霞,顾杰,等。小麦microRNA成员TaMIR444a是氮剥夺反应性的,涉及植物对氮饥饿胁迫的适应。植物摩尔生物学报告2016;34:931-46。
- 22.
朱鲁阿加,德保拉,杨晓明,陈晓明,等。籽粒灌浆期氮饥饿对硬粒小麦mirna的影响。PLoS One. 2017;12(8):e0183253。
- 23.
赵颖,郭林,陆伟,李霞,陈辉,郭超,等。小麦根组织中microrna的表达模式分析(小麦l)在常氮和低氮条件下。植物生物化学。毕奥。2015;24:143-53。
- 24.
Vidal EA, Araus V, Lu C, Parry G, Green PJ, Coruzzi GM,等。拟南芥硝酸盐响应miR393/AFB3调控模块控制根系结构中国科学(d辑),2010,26(3):379 - 379。
- 25.
Gutierrez RA, Lejiay LV, Dean A, Chiaromonte F, Shasha DE, Coruzzi GM.定性网络模型和全基因组表达数据定义了碳/氮响应分子机器拟南芥.中国生物工程学报。2007;8:R7。
- 26.
朱志林,陈德龙。中国氮肥的使用——对粮食生产的贡献、对环境的影响和最佳管理策略。农业生态学报。2002;63(2-3):117-27。
- 27.
马东,郭涛,王震,王超,朱勇,王勇。氮肥施用量对冬小麦的影响(小麦l)面粉质量和中国面条质量。中国农业科学学报。2009;49(2):529 - 529。
- 28.
张敏,马东,马刚,王超,谢晓,康刚。不同籽粒蛋白质含量冬小麦谷氨酰胺合成酶活性及基因表达对氮素水平的响应。中国农业科学(英文版),2017;
- 29.
鞠晓涛,邢广旭,陈小鹏,张世林,张丽娟,刘新军,等。提高中国集约化农业系统氮素管理,降低环境风险。中国科学:自然科学(英文版);2009;26(3):344 - 344。
- 30.
郭建华,刘学军。张勇,沈建林,韩文喜,张文峰,等。中国主要农田显著酸化。科学。2010;327(5968):1008 - 10。
- 31.
褚志林,陈建勇,徐海霞,董志东,陈峰,崔德强。小麦microRNA的鉴定与比较分析(小麦l)愈伤组织由发育成熟胚和未成熟胚形成体外文化。前沿植物学报2016;7:1302。
- 32.
马旭,辛哲,王震,杨强,郭松,郭旭,等。两种小麦叶片差异表达mirna的鉴定与比较分析(小麦l)脱水胁迫下的基因型。BMC植物生物学。2015;15:21。
- 33.
辛敏,王勇,姚勇,谢超,彭华,倪震,等。多种microRNAs对小麦白粉病感染和热胁迫有反应(小麦l .)。植物学报。2010;10:123。
- 34.
韩华,王强,魏林,梁勇,戴杰,夏刚,等。小RNA和降解体测序用于阐明小麦耐盐碱性的基础。BMC植物生物学2018;18:195。
- 35.
Achakzai HK, Barozai MYK, Din M, Baloch IA, Achakza AKK。小麦中新保守microRNAs及其靶标的鉴定与注释(小麦l .)。PloS ONE。2018; 13(7): 20200033。
- 36.
王俊杰,王俊杰,王俊杰,等。细胞景观:生物分子相互作用网络集成模型的软件环境。基因组决议2003;13:2498-504。
- 37.
Guttieri MJ, McLean R, Stark JC, Souza E.管理硬春小麦的灌溉和氮肥以获得最佳面包和面条质量。作物科学,2005;45:2049-59。
- 38.
SAC和AQSIQ。小麦品种品质分类:中华人民共和国国家标准GB/T 17320。的立场。管理。中华人民共和国总务处处长,总务处处长。质量监督,质量督察。中华人民共和国,北京,2013。
- 39.
王文辉,郭文伟,方明民,冯国成,朱新科,彭玉玉。小麦胚乳细胞增殖与灌浆动态。作物学报,2003;29(5):779-84。
- 40.
Lauter N, Kampani A, Carlson S, Goebel M, Moose SP。microRNA172下调glossy15促进玉米营养阶段的变化。美国国家科学研究院。2005; 102(26): 9412 - 7。
- 41.
王楠,陈国强,陈国强,等。大麦的闭锁花是microrna引导抑制的结果HvAP2信使rna乳沟。中国科学(d辑),2010,26(1):1 - 5。
- 42.
朱庆华,朱庆华,陈晓明,陈晓明。水稻高表达miR172导致小穗确定性丧失和花器官异常(栽培稻).BMC植物生物学,2009;9:149。
- 43.
rahotte AM, Goertzen LR。CRF结构域定义了植物中的细胞因子反应因子蛋白。中国生物医学工程学报。2010;10:74。
- 44.
Dietrich JT, Kaminek V, Belvins DG, Reinbett TM, Morris RD.外源细胞分裂素对玉米籽粒发育的影响。植物物理与生物化学。1995;33:27 - 36。
- 45.
古普亮,陈志强,陈志强,陈志强。不同基因型小麦不同剂量BA对产量和籽粒生长的影响(小麦属植物aestivuvml .)。植物生长学报。2003;40:201-5。
- 46.
马志祥,胡小鹏,蔡文杰,黄文华,周旭,罗强,等。拟南芥mir171靶向稻草人样蛋白与GT结合独联体在光照条件下,赤霉素调节叶绿素生物合成。公共科学图书馆。2014;10(8):e1004519。
- 47.
段鹏,倪松,王杰,张斌,徐锐,王勇,等。OsmiR396调控OsGRF4调控水稻籽粒大小和产量。植物学报。2016;2:15203。
- 48.
胡娟,王勇,方勇,曾玲,徐娟,于华,等。GS2的一个罕见等位基因增强了水稻的籽粒大小和产量。植物学报。2015;8:1455-65。
- 49.
李松,高峰,谢坤,曾欣,曹颖,曾杰,等。OsmiR396c-OsGRF4-OsGIF1调控模块决定水稻籽粒大小和产量。中国生物工程学报,2016;14(2):344 - 344。
- 50.
Schommer C, Debernardi JM, Bresso EG, Rodrguez RE, Palatnik JF。mir319调控的TCP4抑制细胞增殖。植物学报。2014;7(10):1533-44。
- 51.
刘PP, Montgomery TA, Fahlgren N, Kasschau KD, Nonogaki H, Carrington JC。镇压生长素反应因子10microRNA160对种子萌发和萌发后贮藏至关重要。植物J. 2007; 52:133-46。
- 52.
Mallory AC, Bartel DP, Bartel B. microrna对拟南芥生长素反应因子17的调控对于早期生长素反应基因的正常发育和调控表达至关重要。植物学报。2005;17(5):1360-75。
- 53.
王金文,王丽娟,毛一斌,蔡文军,薛华文,陈晓宇。microrna靶向生长素反应因子对拟南芥根冠形成的控制。植物学报。2005;17:2204-16。
- 54.
李霞,谢霞,李娟,崔勇,侯勇,翟磊,等。大豆miR166家族的保护和多样化及新发现的miR166的潜在作用BMC植物学报,2017;17(1):32。
- 55.
吴晓东,吴晓东,张晓东,张晓东,等。microRNAs对叶片形态发生的控制。自然。2003;425(6955):257 - 63。
- 56.
Ori N, Cohen AR, Etzioni A, Brand A,柳井O, Shleizer S,等。的监管矛尖形的通过miR319是番茄复叶发育所必需的。中国科学。2007;39(6):787-91。
- 57.
Johansson E, Malik AH, Hussain A, Rasheed F, Newson WR, Plivelic T,等。小麦面筋聚合物结构:基因型、环境和加工对其在各种应用中的功能的影响。谷物化学,2013;90:367-76
- 58.
陈旭,杨勇,冉林,董智,张娥,于旭,等。干旱胁迫下小麦颖果发育过程中miRNA调控贮藏蛋白生物合成的新见解。中国植物科学,2017;8:1707。
- 59.
每个D,格里芬WB,威尔逊PE。小麦籽粒发育过程中抗坏血酸氧化酶、蛋白质二硫化异构酶、抗坏血酸、脱氢抗坏血酸和蛋白质水平及其与蛋白质二硫化键形成的关系。谷物化学,2003;80:35-9。
- 60.
简海军,王杰,王泰,李伟,李娟,刘丽珍。盐胁迫和干旱胁迫下油菜种子萌发早期相关microrna的鉴定。前沿植物科学2016;13:00658。
- 61.
藤井浩,邱廷杰,林思,昂凯,朱建科。一个参与磷酸饥饿反应的miRNA拟南芥.动物学报,2005;15(22):2038-43。
- 62.
昂凯,林思,吴春成,黄奕婷,苏春林,邱天杰。pho2是由microRNA399靶基因的无义突变引起的。植物物理学报。2006;41:1000 - 11。
- 63.
白东,金钟,千洪杰,姜松,朴兴昌,申革,等。AtMYB2调控miR399f转录影响拟南芥的磷酸盐饥饿反应。中国生物医学工程学报,2013;
- 64.
赵敏,泰华,孙松,张峰,徐勇,李文祥。玉米氮素缺乏响应相关miRNAs的克隆与鉴定。公共科学图书馆,2012;7:e29669。
- 65.
赵敏,丁浩,朱建科,张福生,李文祥。miR169参与拟南芥氮饥饿反应。植物科学进展。2011;19(4):457 - 457。
- 66.
李鸿辉,徐普杰。拟南芥MIEL1 E3连接酶通过促进MYB96蛋白翻转负调控ABA信号。Nat Commun. 2016;7:12525。
- 67.
林思,Santi C, Jobet E, Lacut E, El Kholti N, Karlowski WM,等。水稻miR827编码SPX-MFS蛋白的两个靶基因对磷酸盐饥饿的复杂调控中国生物医学工程学报,2010;
- 68.
康德,彭,罗斯坦。NLA和microRNA827对拟南芥维持硝酸盐依赖性磷酸盐稳态的遗传调控PLoS Genet, 2011;7:e1002021。
- 69.
马东,张娟,侯杰,李勇,黄霞,王超,等。施氮磷肥对不同颜色小麦籽粒产量、加工品质和营养品质的评价。作物科学,2018;49:402 - 15。
- 70.
刘伟,孙强,王凯,杜强,李文祥。氮限制适应(NLA)通过介导NRT1.7 in的降解,参与了硝酸盐的源-汇再动员拟南芥.中国生物医学工程学报,2017;26(2):734-44。
- 71.
王旭,Goshe MB, Soderblom EJS, Phinney BS, Kuchar JA, Li J,等。拟南芥油菜素类固醇- insensitive1受体激酶体内磷酸化位点的鉴定和功能分析。《植物科学》,2005;17(4):366 - 366。
- 72.
格里菲思J,夏恩HK,范东恩S, Enright AJ。miRBase: microRNA基因组学工具。核酸研究,2008;36:D154-8。
- 73.
Meyers BC, Axtell MJ, Bartel B, Bartel DP, Baulcombe D, Bowman JL,等。植物MicroRNAs的注释标准。植物学报。2008;20(12):3186-90。
- 74.
Livak KJ, Schmitthen TD。相关基因表达数据的分析采用实时定量PCR和2−△△CT方法。方法。2001;25:402-8。
- 75.
刘志华,程芬芬,程卫东,张国平。粳稻穗内植酸和蛋白质含量的位置变化。中国农业科学,2005;
致谢
我们要感谢李永春教授在生物信息学分析方面的帮助。我们也感谢来自Elixigen公司(Huntington Beach, California)的英语母语科学家校对我们的手稿。此外,我们感谢审稿人的宝贵意见。
资金
国家重点研发计划资助项目2016YFD0300404,国家自然科学基金项目31571651。
作者信息
从属关系
贡献
CYW和YXX帮助设计实验;DYM设计实验并修改手稿。GGH进行了实验并撰写了草稿。CYD和HHG进行qPCR并制备部分图。HFL和JK进行了田间试验和取样。WS和SJL进行了籽粒品质分析。所有作者都对手稿的修改和批准做出了贡献。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
Illumina DNA测序数据的小RNA文库。
附加文件2:表S2。
本研究中鉴定的mirna。
附加文件3:表S3。
在发育中的小麦中发现了两种不同氮水平的新miRNAs。
附加文件4:表S4。
在小麦籽粒发育过程中差异表达的保守的和新颖的miRNAs。
附加文件5:表S5。
HN和LN处理籽粒灌浆过程中差异表达mirna的目标函数
附加文件6:表S6。
HN和LN处理中小麦籽粒mirna的差异表达。
附加文件7:图S1。
在HN和LN处理中鉴定出的差异表达的miRNAs与Cytoscape确定的预测靶点之间的关系。
附加文件8:表S7。
本研究用于qRT-PCR检测的寡核苷酸引物。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
侯G.,杜C.,高H.。et al。鉴定发育中的小麦籽粒中可能参与调控籽粒特性和对氮水平响应的microrna。BMC植物生物学20.87(2020)。https://doi.org/10.1186/s12870-020-2296-7
收到了:
接受:
发表:
关键字
- 施氮水平
- 差异表达的miRNAs
- 粮食发展
- 小麦