- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
全基因组分析GydF4y2Ba罗比夫GydF4y2Ba鉴定水稻花粉管生长相关基因的基因家族(GydF4y2Ba奥雅萨苜蓿GydF4y2Ba)GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba20.GydF4y2Ba, 文章编号:GydF4y2Ba95.GydF4y2Ba(GydF4y2Ba2020.GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
在植物中,已经识别了Ropgef介导的ROP信号传导的关键角色,包括极性尖端生长,包括极性尖端生长。尽管其重要作用在复制方面,但尚未在水稻中进行综合分析,尚未在稻米上进行(GydF4y2Ba奥雅萨苜蓿GydF4y2Ba).为了确定Ropgef调节剂是否参与水稻花粉管的生长,我们在稻米上进行了对这个家庭的全基因组分析。GydF4y2Ba
结果GydF4y2Ba
11个ropgef基因在水稻花粉中的系统发育和元表达分析表明,4个基因在成熟花粉中优先表达。这4个基因包含植物特有的Rop核苷酸交换(PRONE)结构域和可能的磷酸化残基,表明它们在极尖生长中具有保守的作用GydF4y2Ba拟南芥GydF4y2Ba.在四个亚细胞定位分析中GydF4y2Baropgefs.GydF4y2Ba通过烟草(GydF4y2Ba烟草benthamianaGydF4y2Ba)浸润,四种蛋白质主要鉴定在血浆膜中。此外,ROPGEF2 / 8的双突变体表现出降低的花粉萌发,导致部分雄性不育。与其他绳索基因相比,这些基因在其启动子中具有独特的顺式作用元素。GydF4y2Ba
结论GydF4y2Ba
本研究在水稻11个成员中鉴定了4个RopGEF基因,并与拟南芥进行了表达模式、启动子分析和进化关系的比较。我们的研究表明,4个RopGEF基因可能以不同的亚细胞定位在花粉萌发过程中发挥作用。本研究为RopGEF在水稻中的功能研究提供了有价值的信息。GydF4y2Ba
背景GydF4y2Ba
Rho-type GTPases of plants (ROP),又称RACs,是Rho小gtp结合蛋白的一个植物特异性亚家族[GydF4y2Ba1GydF4y2Ba],并参与多种信号转导过程,包括抗病、花粉管生长、根毛发育、活性氧(ROS)产生、细胞壁模式形成和激素反应[GydF4y2Ba2GydF4y2Ba].与其他真核细胞中的Rho家族蛋白类似,ROPs通过细胞骨架组织调节胞内吞和胞外吞,通过激活NADPH氧化酶调节胞内激酶级联,这些过程是植物细胞极性生长的关键[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba].通过GTP结合和水解(GTP -binding form)后ROP构象的变化,ROP的活化和失活,在信号转导中起分子开关的作用[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba].从GDP和GTP形式的RHO GTP酶的转化由鸟嘌呤核苷酸交换因子(GEF)催化。特定于植物的绳索通过催化植物特异性ROP核苷酸交换剂(PrONe)结构域来调节ROPS / RAC的活性[GydF4y2Ba8.GydF4y2Ba].GydF4y2Ba
虽然很少有研究GydF4y2Ba罗比夫GydF4y2Ba近年来,在模式植物拟南芥上的研究证实了它们在植物发育和防御过程中的作用。拟南芥有14GydF4y2Baropgefs.GydF4y2Ba在其基因组中,具有高度的序列相似度[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].功能研究表明AtRopGEF1和AtRopGEF4在ABA介导的气孔关闭中特异性调控ROP11 [GydF4y2Ba10GydF4y2Ba],并且Atropgef1在控制横向根系生长方面发挥作用[GydF4y2Ba11GydF4y2Ba]和极性生长素运输在植物发育早期实现细胞极性[GydF4y2Ba12GydF4y2Ba].其中,七名成员在花粉管中特别或高度表达,冗余函数[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba13GydF4y2Ba].特定花粉的绳索具有保守的C-Termini,其通过自动抑制易于域的功能[GydF4y2Ba13GydF4y2Ba].最近的发现表明,花粉特异性受体样激酶(PROKS)通过C-末端的Ropgefs的磷酸化转换ROP信号,以调节极性花粉管生长[GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba].萌发的花粉管进入雌配子体,将精子细胞传递给卵细胞和极中心细胞,在开花植物中进行双受精[GydF4y2Ba18GydF4y2Ba].当一些配体被受体样激酶(RLK)接收时,ropgef被激活并将GDP转化为GTP, GTP结合到ROP上[GydF4y2Ba19GydF4y2Ba].AtPRK2通过ropgef磷酸化促进ROP1调控极化花粉管生长[GydF4y2Ba16GydF4y2Ba].ATPRK6与ATROPGEF8和ATROPGEF12的相互作用在花粉管的极化生长中起重要作用[GydF4y2Ba17GydF4y2Ba].另一个rlk,feronia,属于GydF4y2Ba凯蒂斯希斯GydF4y2Ba被视为受体激酶(CRRLK)家族,被证明用作罗比夫的上游调节器,介导拟南芥的根毛生长中的生长素流出[GydF4y2Ba20.GydF4y2Ba那GydF4y2Ba21GydF4y2Ba那GydF4y2Ba22GydF4y2Ba].GydF4y2Ba
在水稻(GydF4y2Ba奥雅萨苜蓿GydF4y2Ba),在前12个报告的基因中,11GydF4y2BaOsRopGEFsGydF4y2Ba编码的全长蛋白质[GydF4y2Ba23GydF4y2Ba].GydF4y2BaOsropgef.GydF4y2BaS显示在激活中发挥作用GydF4y2BaosRac1.GydF4y2Ba在抗病抵抗力[GydF4y2Ba24GydF4y2Ba].GydF4y2BaosRac1.GydF4y2Ba通过生产ROS来负调节细胞死亡和先天免疫力[GydF4y2Ba25GydF4y2Ba那GydF4y2Ba26GydF4y2Ba].它表明了GydF4y2BaosRac1.GydF4y2Ba激活植物NADPH氧化酶,称为OSRBOHB(呼吸爆发氧化酶同源物),通过直接互动[GydF4y2Ba27GydF4y2Ba].此外,GydF4y2BaOsRopGEF10GydF4y2Ba在叶面上激活小型切口乳头的发育[GydF4y2Ba28GydF4y2Ba], 然而GydF4y2Baosropgef7b.GydF4y2Ba参与调节花器官的发育[GydF4y2Ba29GydF4y2Ba].与拟南芥相比,水稻RopGEF成员在响应植物发育线索方面的分子功能尚不清楚。GydF4y2Ba
为了揭示在保守的Ropgefs中存在极性尖端生长的角色,我们研究了水稻和拟南芥Ropgef蛋白的系统发育关系,分析了俯卧结构域并表征氨基酸残基。虽然对成功繁殖的配子传播重视其重视水稻花粉管生长的分子机制较少[GydF4y2Ba30.GydF4y2Ba].我们确定了四种花粉首选GydF4y2BaOsropgef.GydF4y2Ba通过花粉/花药数据库进行meta表达分析,然后通过qRT-PCR进行验证。此外,我们通过烟草渗透和GydF4y2Ba独联体GydF4y2Ba四种花粉优选的元素(CRE)分析GydF4y2BaOsropgef.GydF4y2Ba基因,揭示一个保守的CRE。最后,我们为功能研究生成和分析了单一和多个敲除突变体。GydF4y2Ba
结果GydF4y2Ba
表达分析分析GydF4y2Ba罗比夫GydF4y2Ba基因GydF4y2Ba
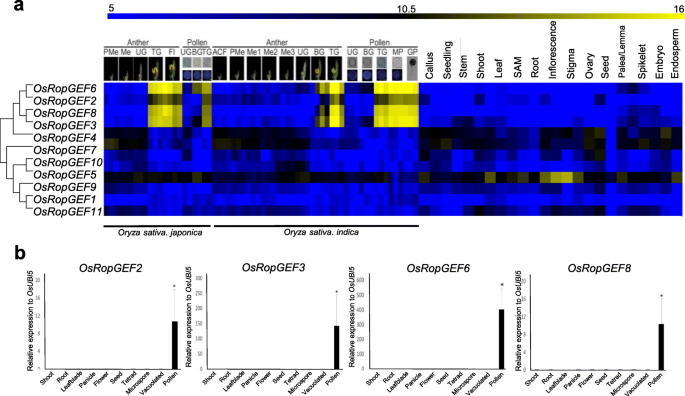
为了鉴定水稻的花粉优选的基因,我们研究了一个公共可用的无论水稻微阵列数据[GydF4y2Ba31GydF4y2Ba].表达模式之间保守GydF4y2BaindicGydF4y2Ba和GydF4y2Ba粳稻GydF4y2Ba水稻品种在化痰和花粉的各种发育阶段,以及来自我们已建立的数据库的解剖元表达数据,水稻花药花粉表达数据库(强奸)(GydF4y2Bahttp://ricephylogyomics-khu.org/raped/home.php.GydF4y2Ba),进行了分析。然后,我们通过比对所有的蛋白质序列,构建了一个系统发育树GydF4y2BaOsRopGEFsGydF4y2Ba.在系统发育树的上下文中组合了Meta表达数据以检查功能GydF4y2BaOsropgef.GydF4y2Ba与其他组织/器官相比,S关于花粉和花粉发育(图。GydF4y2Ba1GydF4y2Ba一种)。结果,米饭GydF4y2Ba罗比夫GydF4y2Ba基因家族可分为两个亚家族,其中一个属GydF4y2BaOsropgef2,3,4,6和8GydF4y2Ba其余六个基因所属的另一个,即GydF4y2BaOsropgef1,5,7,9,10,GydF4y2Ba和GydF4y2Ba11GydF4y2Ba.GydF4y2Ba
荟萃表达分析和基因组覆盖识别GydF4y2BaOsropgef.GydF4y2Ba和验证特定于花粉特异性的元表达模式GydF4y2BaOsropgef.GydF4y2Ba使用qPCR年代。GydF4y2Ba一种GydF4y2BaHEATMAP表达和11个系统发育分析11GydF4y2BaOsropgef.GydF4y2Ba基因揭示了四种基因在MP中特异性地表达。22微阵列数据GydF4y2BaindicGydF4y2Ba稻米,包括花树和花粉的三个阶段和42个微阵列数据GydF4y2Ba粳稻GydF4y2Ba水稻花药分为8个阶段,花粉分为5个阶段。ACF:原孢细胞形成阶段;BG:双细胞配子体期;Fl,开花阶段;GP,花粉发芽;我,减数分裂阶段;Me1:减数分裂瘦体期;Me2:减数分裂合子-粗线期;Me3:减数分裂双倍体-四分体阶段;MP:花粉成熟阶段; PMe, pre-meiosis; TG, tricellular pollen stage; UG, uni-cellular gametophyte stage. Yellow color in heatmap indicates high level of expression; dark blue, low expression. Numeric values indicate an average of the normalized log2 intensity of microarray data.B.GydF4y2Ba表达pollen-preferredGydF4y2BaOsropgef.GydF4y2Ba通过QPCR在水稻各种组织中分析基因;使用了四,微孔,真空花粉阶段和成熟花粉晶粒的花粉。杜白蛋白5(GydF4y2BaOsubi5.GydF4y2Ba, LOC_Os01g22490)用作内部控制。y轴,表达水平相对GydF4y2BaOsubi5.GydF4y2Ba;X轴,用于分析的样品。误差栏代表三个生物重复的标准错误。星号表示显着差异,*,GydF4y2BaP.GydF4y2Ba-Value <0.01。使用Tukey的成对比较测试,通过使用单向ANOVA进行分析数据进行分析GydF4y2Ba
另外,我们确定了它GydF4y2BaOsropgef2,Osropgef3,OsropgeF6GydF4y2Ba,GydF4y2BaOsRopGEF8GydF4y2Ba在晚期花粉发育的阶段显示选择性表达,即,以特里曲花粉颗粒,成熟花粉(MP)和发芽的花粉(GP)阶段。这四种基因用于进一步分析。自从GydF4y2Baosropgef3.GydF4y2Ba在根毛中也高度表达,我们预测该基因可能影响尖端增长(附加文件GydF4y2Ba1GydF4y2Ba).基因GydF4y2BaOsropgef4.GydF4y2Ba和GydF4y2BaOsRopGEF7GydF4y2Ba虽然其表达水平在后期阶段期间,但虽然它们的表达水平降低了一些表达。此外,因为在除花药和花粉以外的组织中也检测到表达,所以这两个基因不能被认为是花粉优选的表达基因。此外,GydF4y2BaOsRopGEF5GydF4y2Ba表现出薄弱的表达GydF4y2Ba粳稻GydF4y2Ba水稻花药和其他组织,在花药和花粉中显示出优选的表达。GydF4y2Ba
接下来,为了验证元表达数据,我们使用十种组织进行定量实时PCR(QPCR):芽,根,叶片,穗,花,种子,四微孔,幼小微孔,真空花粉和MP(图.GydF4y2Ba1GydF4y2Bab)。通过在各种发育阶段的对花粉进行取样,从花粉母细胞到MP和GP,我们试图确定靶基因表达的阶段。因此,GydF4y2BaOsropgef2,Osropgef3,OsropgeF6GydF4y2Ba,GydF4y2BaOsRopGEF8GydF4y2Ba被证明在MP中高度表达。GydF4y2BaOsropgef6.GydF4y2Ba在MP中表达水平最高GydF4y2BaOsropgef2.GydF4y2Ba和GydF4y2BaOsRopGEF8GydF4y2Ba在MP中显示出类似的表达水平。这些本土花粉首选GydF4y2BaOsRopGEFsGydF4y2Ba在其他组织中一般不表达,类似于微阵列数据的元表达谱。特别是在水稻中,成熟花粉和萌发花粉的基因表达谱高度相关[GydF4y2Ba31GydF4y2Ba].因此,这四个基因可能在花粉成熟后的花粉管生长和其他过程中发挥关键作用。GydF4y2Ba
水稻和拟南芥中Ropgef基因组和蛋白质序列保守域的比较分析GydF4y2Ba
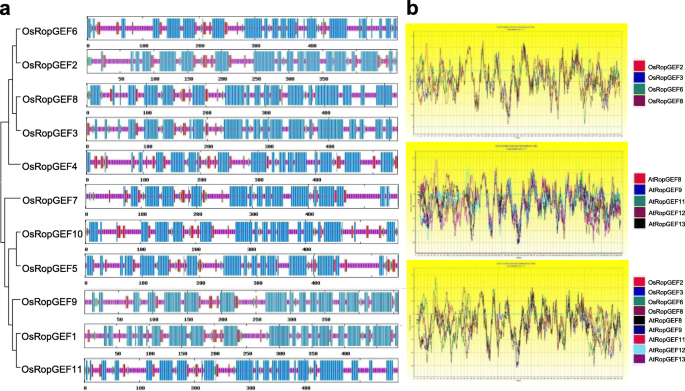
基因GydF4y2BaOsropgef2,Osropgef3,OsropgeF6GydF4y2Ba,GydF4y2BaOsRopGEF8GydF4y2Ba编码具有相似氨基酸序列的蛋白质。GydF4y2Ba罗比夫GydF4y2BaS被认为是一种新的基因家族,其具有独特的结构,其含有易于在植物中发现的易催化结构域GydF4y2Ba罗比夫GydF4y2Ba基因家族(GydF4y2Ba9.GydF4y2Ba].众所周知,在ropgef将GDP转换为GTP时需要使用PRONE域。ropgef的PRONE域在所有osropgef中都是高度保守的。更有趣的是,发现花粉偏好的osropgef保留了PRONE结构域后的c端区域(图)。GydF4y2Ba2GydF4y2Bab),而花粉是非优选的GydF4y2Baosropgef1.GydF4y2Ba那GydF4y2BaOsropgef9,GydF4y2Ba和GydF4y2BaOsRopGEF11GydF4y2Ba缺乏这个C-Terminus。GydF4y2Ba
RopGEF家族的系统发育分析GydF4y2Ba奥雅萨苜蓿GydF4y2Ba和GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2Ba一种GydF4y2Ba利用MEGA7注释各基因的蛋白序列,构建系统发育树。蛋白序列比对采用ClustalW方法,系统发育采用Neighbor-joining方法,通过1000次bootstrap检验估计可靠性。树之间的数字表示引导值。操作系统,GydF4y2Ba奥雅萨苜蓿GydF4y2Ba;在,GydF4y2Ba拟南芥GydF4y2Ba.红色和绿色星号表示GydF4y2Ba罗比夫GydF4y2Ba花粉中高表达的基因GydF4y2Bao .漂白亚麻纤维卷GydF4y2Ba(在这项研究中)GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba8.GydF4y2Ba], 分别。红色和蓝色框表明米饭和拟南芥之间的正交关系GydF4y2Ba罗比夫GydF4y2BaRGAP中表明的基因。GydF4y2BaB.GydF4y2Ba蛋白质结构方案。我们排列了蛋白质结构域方案的序列与A的系统发育树的基因序列相同。每个Ropgef蛋白的长度显示在右侧,其单位是AA(氨基酸)。C1,C2和C3(蓝色框)表示Ropgef家族的保守易发子域的位置和长度GydF4y2Ba
进行比较分析GydF4y2Ba罗比夫GydF4y2Ba基因家庭GydF4y2Ba那GydF4y2Ba我们收集了14株的蛋白质序列GydF4y2Baatropgefs.GydF4y2Ba11.GydF4y2BaOsRopGEFsGydF4y2Ba并且构造了邻接树(图。GydF4y2Ba2GydF4y2Ba四)。GydF4y2BaOsropgef.GydF4y2Ba表现花粉偏好表达的基因与GydF4y2BaAtropgef8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba,也表现出花粉偏好表达。在拟南芥GydF4y2Ba罗比夫GydF4y2Ba家庭,QPCR揭示的表达模式与上一份报告的表达模式不一致:GydF4y2BaAtropgef1,8,9,12,14GydF4y2Ba在花粉组织中检测到[GydF4y2Ba8.GydF4y2Ba] 和GydF4y2BaAtRopGEF8, 9, 10, 11,GydF4y2Ba和GydF4y2Ba13GydF4y2Ba分别显示花粉优选的表达式,其中后一种数据与Genevestigator中的转录组数据相对应更接近(附加文件GydF4y2Ba2GydF4y2Ba).根据水稻基因组注释项目(RGAP,GydF4y2Bahttp://rice.plantbiology.msu.edu/GydF4y2Ba)GydF4y2BaOsropgef2.GydF4y2Ba是GydF4y2BaAtropgef8.GydF4y2Ba和GydF4y2BaAtRopGEF9,GydF4y2Ba和那些GydF4y2Baosropgef3.GydF4y2Ba是GydF4y2BaATROPGEF11GydF4y2Ba那GydF4y2BaATROPGEF12GydF4y2Ba,GydF4y2BaATROPGEF13GydF4y2Ba.然而GydF4y2BaOsropgef6.GydF4y2Ba和GydF4y2BaOsRopGEF8GydF4y2Ba尚未确定。在系统发育树中,用花粉优选的表达的大米成分与拟南芥的那些密切地聚集,并且C-末端氨基酸序列比水稻中的其他成员更相似。在C末端内的不变丝氨酸残基(S510,在ATROPGEF12中编号),对于C末端抑制很重要[GydF4y2Ba13GydF4y2Ba]也位于花粉偏好区GydF4y2Ba罗比夫GydF4y2Barice中的成员(附加文件GydF4y2Ba3.GydF4y2Ba),支持磷酸化调控的GEF活性被保守的假设。GydF4y2Ba
蛋白质结构GydF4y2Ba
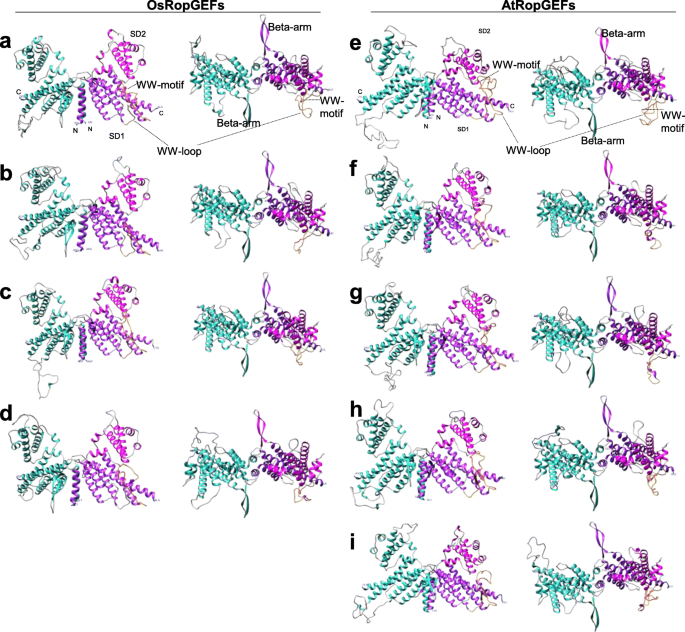
蛋白序列分析和亲水性分析显示,AtRopGEF和OsRopGEF都具有花粉偏好表达,它们的氨基酸序列基本相似,但在N和c端存在差异(图2)。GydF4y2Ba3.GydF4y2Ba).分析的水稻绳索3-D模型表现出蝴蝶形的三维结构,其中两个易于通过其N-末端基团二聚化(图。GydF4y2Ba4.GydF4y2Ba).每个引体由两个子域组成,其中含有WW环的子域1,这是拟南芥中的常见特征[GydF4y2Ba7.GydF4y2Ba)(表GydF4y2Ba1GydF4y2Ba).为了更精确地描述三维模型结构,我们将花粉偏好的水稻RopGEF三维模型与拟南芥的模型进行了比较。osropgef和atropgef的子结构域在WW-loop的α螺旋数和残基数上存在差异。在水稻和拟南芥的RopGEF三维模型中,α-螺旋的数量从14个增加到17个,w -环的残基数量从25个增加到50个。GydF4y2Ba
蛋白质序列分析。GydF4y2Ba一种GydF4y2Ba利用osropgef推导的氨基酸序列分析RopGEF的二级结构。蓝线表示阿尔法螺旋,紫色线表示随机线圈,红线表示延伸的股,绿色线表示β转弯。GydF4y2BaB.GydF4y2Ba水疗法情节分析。图的上半部分是4个osropgef的水势图,显示花粉特异性表达,中间部分是5个osropgef的水势图GydF4y2Baatropgef.GydF4y2Ba在Genevistigator中表达的花粉特异性的基因。最后一个数字是四个Osropgef和五个Atropgef水疗法的总和。水稻和拟南芥轮廓的概况在俯卧域中显示出相似之处,但不是N和C-TerminiGydF4y2Ba
预测的三维构造GydF4y2Ba罗比夫GydF4y2Ba水稻和拟南芥的基因。GydF4y2Ba一种GydF4y2BaOsropgef2.GydF4y2Ba, (GydF4y2BaB.GydF4y2Ba)GydF4y2Baosropgef3.GydF4y2Ba, (GydF4y2BaCGydF4y2Ba)GydF4y2BaOsropgef6.GydF4y2Ba, (GydF4y2BaD.GydF4y2Ba)GydF4y2BaOsRopGEF8GydF4y2Ba, (GydF4y2BaE.GydF4y2Ba)GydF4y2BaATROPGEF2GydF4y2Ba, (GydF4y2BaFGydF4y2Ba)GydF4y2BaAtropgef8.GydF4y2Ba, (GydF4y2BaGGydF4y2Ba)GydF4y2BaAtropgef9.GydF4y2Ba, (GydF4y2BaHGydF4y2Ba)GydF4y2BaATROPGEF12GydF4y2Ba, 和 (GydF4y2Ba一世GydF4y2Ba)GydF4y2BaATROPGEF13GydF4y2Ba.使用UCSF Chimera软件包进行比较表征。线圈、左启动子、子域1、子域2、WW-loop和WW-motif结构分别以灰色、天蓝色、紫色、洋红、橙色和红色表示。N和C端用蓝色表示GydF4y2Ba
Osropgefs包含14至15个alpha螺旋,25到40个残留物,而Atropgefs包含14至17个alpha螺旋,WW环中的38至50个残留物。Osropgefs与报告的Atropgef之间的主要区别[GydF4y2Ba32GydF4y2Ba]在WW-loop中,AtRopGEF在WW-loop中显示α-螺旋或β -股,而osropgef不包含α-螺旋或β -股。GydF4y2Ba
四个ropgef蛋白的亚细胞定位GydF4y2Ba
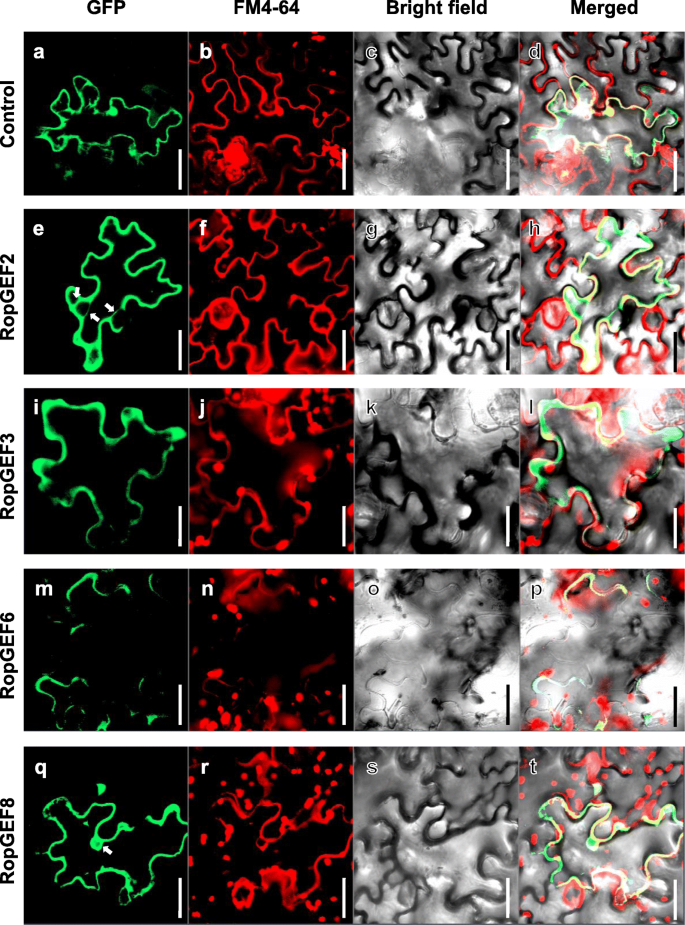
已知RopGEF调节质膜(PM)中的ROP信号。结果表明,拟南芥RopGEF8、RopGEF9和RopGEF14定位于花粉管顶端PM, RopGEF1定位于整个PM。另一方面,RopGEF12在PM中几乎检测不到,存在于花粉管的胞质中[GydF4y2Ba8.GydF4y2Ba,提示RopGEF在花粉管中的不同定位代表了ROP信号的多种调节作用的差异。因此,我们检查了OsRopGEF成员的亚细胞定位,以检查他们的空间位置是否相同或不同。将花椰菜花叶病毒(花椰菜花叶病毒,CaMV) 35S启动子控制的RopGEF-GFP融合蛋白导入烟草叶片表皮细胞,以空GFP蛋白作为对照。在PM中观察到4个RopGEF基因的GFP信号。进一步,我们使用FM4-64染色作为膜标记来确定膜标记与RopGEF蛋白的GFP信号如何相关(图)。GydF4y2Ba5.GydF4y2Ba).对照GFP信号存在于细胞核、细胞膜和细胞膜内的胞质中(图2)。GydF4y2Ba5.GydF4y2Ba广告)。大多数Ropgef蛋白信号与FM4-64染色的RFP信号合并了很好合并(附加文件GydF4y2Ba4.GydF4y2Ba).奥托普富6具体地定位到PM中,与普通的Ropgef位置一致(图。GydF4y2Ba5.GydF4y2Ba而OsRopGEF2、OsRopGEF3和OsRopGEF8的GFP信号主要在胞质和PM中发现(图2)。GydF4y2Ba5.GydF4y2BaI-L)。位于细胞溶溶胶中的Osropgef2的GFP信号似乎与内质网,而不是细胞核(图。GydF4y2Ba5.GydF4y2BaE-H)[GydF4y2Ba33GydF4y2Ba[虽然osropgef8信号与核有关(图。GydF4y2Ba5.GydF4y2BaQ-T)[GydF4y2Ba34GydF4y2Ba].结果表明,OsRopGEF的4个花粉偏好成员在花粉萌发过程中发挥着独特的作用,这体现在它们不同的亚细胞位置上。GydF4y2Ba
使用激光扫描共焦荧光显微镜烟草植物中脱摩托蛋白的亚细胞定位观察。GydF4y2Ba一种GydF4y2Ba-GydF4y2BaD.GydF4y2BaControl-GFP和(GydF4y2BaE.GydF4y2Ba-GydF4y2BaT.GydF4y2Ba)在烟草表皮细胞中观察到四种花粉特异性表达的奥波波胶合GFP信号。第二面板通过FM4-64染色显示膜标记,第三面板显示出明亮的场地图像,最后面板显示Marge图像。红色信号显示膜,绿色信号显示Ropgef定位,并且黄色信号显示合并。白色箭头表示除膜(Ropgef2-Cytoplasm,Ropgef8-nucleus)之外的信号。条=40μmGydF4y2Ba
花粉偏好基因的启动子分析GydF4y2Ba
到目前为止,有关在水稻中花粉萌发中的转录因子和调节基序的作用的信息尚不清楚。基于微阵列数据和QPCR结果,我们进行了启动子分析以识别GydF4y2Ba独联体GydF4y2Ba- 在启动子方面保守GydF4y2BaOsropgef.GydF4y2BaS与花粉偏好表达相关。GydF4y2Ba
我们搜查了已知的GydF4y2Ba独联体GydF4y2Ba基于现有研究的推动者中的 - 调节元素(CRES)(附加档案GydF4y2Ba5.GydF4y2Ba).主要花粉优选的Cles,如Pollen1lelat52(agaaa),Pb核心(CCAC)和GTGANTG10(GTGA)[GydF4y2Ba35GydF4y2Ba被确定。以POLLEN1LELAT52为例,共存在12个CREsGydF4y2Baosropgef3.GydF4y2Ba启动子和七个冠军存在于此GydF4y2BaOsRopGEF8GydF4y2Ba启动子。在GTGANTG10的情况下,存在11个CRESGydF4y2BaOsRopGEF8GydF4y2Ba启动子。以PB核心为例,有5份副本GydF4y2BaOsropgef2.GydF4y2Ba启动子,以及每个的四个副本GydF4y2BaOsropgef6.GydF4y2Ba和GydF4y2BaOsRopGEF8GydF4y2Ba启动子。但是,在剩下的情况下GydF4y2BaOsropgef.GydF4y2Ba家族基因,在基因的启动子中也存在许多花粉优选的CRES,在花粉中表现出很少或没有表达。平均而言,4.3份Pollen1Lelat52,6.4 Gtgantg10副本,七个七的Pb核心副本GydF4y2BaOsRopGEFsGydF4y2Ba与四种高度花粉优选的基因相比。我们计算了这一点GydF4y2BaP.GydF4y2Ba- 值得确定四种高度花粉中有多少表达GydF4y2BaOsropgef.GydF4y2Ba基因相对于其余的基因具有显着更多的冠军GydF4y2BaOsropgef.GydF4y2Ba基因,但都没有超过0.01。基于这些结果,我们假设已知的花粉CRE不调节四种花粉的表达GydF4y2BaOsropgef.GydF4y2Ba年代。GydF4y2Ba
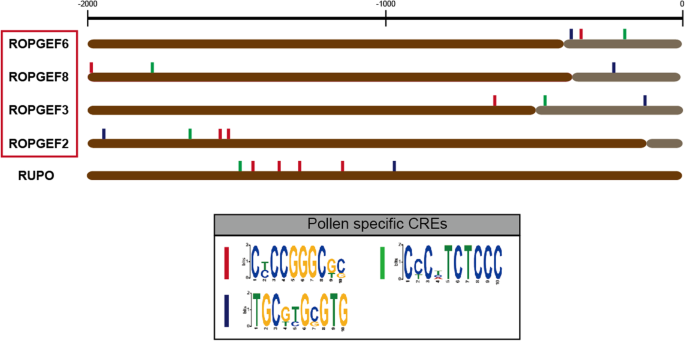
然后我们寻找只存在于花粉偏好的启动子中的CREsGydF4y2BaOsropgef.GydF4y2Ba首先,我们使用模因(MEME)搜索四个花粉偏好基因的启动子共同的基序(图。GydF4y2Ba6.GydF4y2Ba).我们下载了这四个的上游2000碱基对序列GydF4y2BaOsropgef.GydF4y2Ba并发现了10个保守元素。其中3个CREs在另一个非花粉偏好的启动子中缺失GydF4y2BaOsropgef.GydF4y2Ba基因。这3个CREs存在于- 2000 ~ - 1500 bp的转录起始位点GydF4y2Baosropgef3.GydF4y2Ba和osropgef6,主要存在于1000英镑的转录开始网站内GydF4y2BaOsropgef2.GydF4y2Ba和GydF4y2Baosropgef8。GydF4y2Ba除了第一个CRE之外,所有CRES都在每个基因的启动子中存在一次(呈现为深蓝色盒子;图。GydF4y2Ba6.GydF4y2Ba),在启动子中出现两次GydF4y2BaOsropgef2.GydF4y2Ba.我们预测,这三个CRES将参与花粉表达,表明转录调节过程中的功能相似性。我们分析了这三个CRE是否在启动子中保存GydF4y2Baatropgef.GydF4y2Ba,在花粉中高度表达。虽然GydF4y2BaATROPGEF2GydF4y2Ba拥有第一个和第三个CRE,和GydF4y2BaATROPGEF12GydF4y2Ba第三个CRE,另一个是通过花粉表达的吗GydF4y2Baatropgef.GydF4y2Ba基因不含有,表明水稻和拟南芥之间的不同调节系统可能存在。然而,GydF4y2BaOsCrRLK1L13GydF4y2Ba(loc_os06g03610),也称为GydF4y2BaRupo.GydF4y2Ba(GydF4y2Ba花粉管破裂GydF4y2Ba),在启动子区域拥有这三个CREs。RUPO在花粉中高度特异表达,已知可调节水稻花粉管的生长和完整性[GydF4y2Ba36GydF4y2Ba].我们的结果表明,这3种CREs可能是水稻花粉特异基因调控的候选基因,进一步的检测,如缺失检测,有待于进一步澄清我们的估计。接下来,我们利用TOMTOM技术,在MYB和bHLH等转录因子基因组序列中发现了这些元素GydF4y2BaOsRopGEFsGydF4y2Ba例如,可以通过诸如MYB等转录因子和BHLH调节花粉中。GydF4y2Ba
植物表型GydF4y2Ba罗比夫GydF4y2Ba突变体GydF4y2Ba
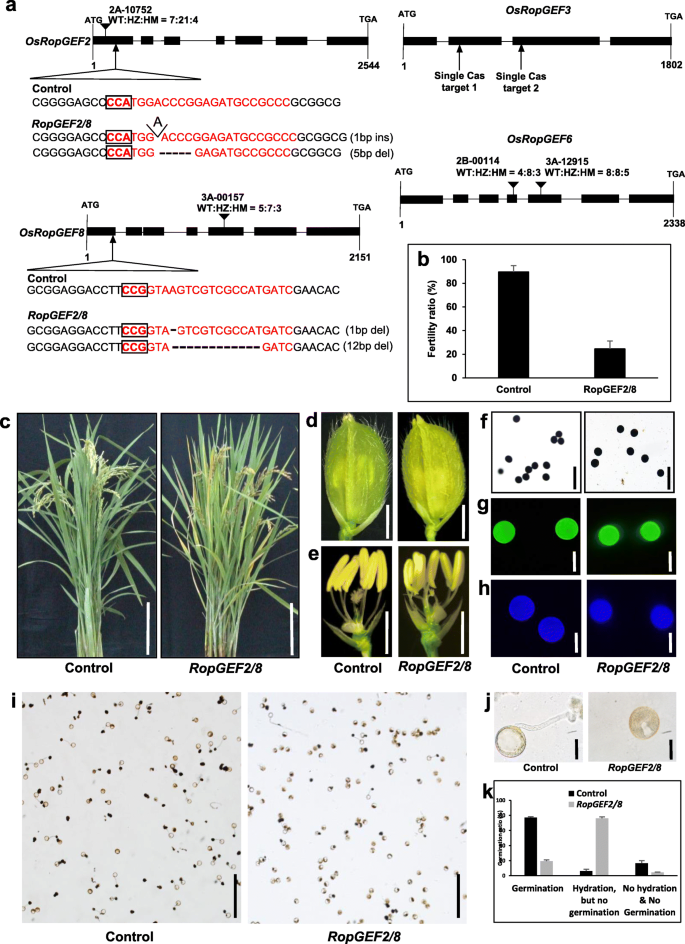
为了确定Ropgef在水稻花粉管生长中的作用,我们在T2代时鉴定了T-DNA插入线:2B-00114和3A-12,915,具有T-DNAGydF4y2Baropgef6,GydF4y2Ba3A-00157和2a - 10752,含有T-DNAGydF4y2Baropgef8.GydF4y2Ba和GydF4y2BaRopgef2.GydF4y2Ba,分别。在基因5′区附近的外显子区发现了约10kb T-DNA插入的片状区域,表明基因功能缺失。因此,我们将这些T-DNA品系作为敲除品系,并确定了种子分离率。所有的T-DNA插入系生长正常,产生纯合子种子(图。GydF4y2Ba7.GydF4y2Baa),表明雄性的麦基纤维速度不会受到单一基因敲击的干扰,可能是由于功能冗余,如拟南芥所示[GydF4y2Ba37GydF4y2Ba].要确认,我们使用CRISPR / CAS9系统在T处产生纯合多敲除突变体GydF4y2Ba0.GydF4y2Ba一代(GydF4y2Ba38GydF4y2Ba].在敲除纯合的突变体GydF4y2BaRopgef2.GydF4y2Ba,肥育率略微减少,但与野生型相当。与野生型植物相比,花粉萌发和管生长未显示出差异。此外,单次敲除纯合突变体GydF4y2BaRopgef3.GydF4y2Ba生长和种子产量均无显著变化,说明雄性配子传递正常(附加文件GydF4y2Ba6.GydF4y2Ba).GydF4y2Ba
使用T-DNA插入和CRISPR-CAS9系统鉴定Ropgef突变体。GydF4y2Ba一种GydF4y2BaDNA结构和突变区。在基因结构图中,黑盒子为外显子区域,黑线为内含子区域,箭头表示突变发生的位置。红色字母表示sgRNA的目标位点,黑框表示sgRNA目标位点前的PAM位点。Ins;插入,德尔;删除。GydF4y2BaB.GydF4y2Ba野生型和野生型和型生育率比较GydF4y2BaRopgef2 / 8.GydF4y2Ba突变植物。误差栏是植物中三个面三个面的标准偏差。植物生长的表型(GydF4y2BaCGydF4y2Ba)酒吧= 10厘米,(GydF4y2BaD.GydF4y2Ba)花状结构,杆= 2毫米,(GydF4y2BaE.GydF4y2Ba)生殖器官形成,酒吧= 2毫米,(GydF4y2BaFGydF4y2Ba)花粉淀粉积累染色,ki,酒吧=20μm,(GydF4y2BaGGydF4y2Ba)花粉壁脱落染色使用Auramin O,(GydF4y2BaHGydF4y2Ba)花粉壁有内染染料使用Calcoflour White,Bar =20μm,(GydF4y2Ba一世GydF4y2Ba)固体花粉介质中的体外花粉萌发试验,酒吧=250μm,(GydF4y2BajGydF4y2Ba)放大的花粉图片,酒吧=10μm,(GydF4y2BaK.GydF4y2Ba)花粉离体萌发率。黑色条为野生型花粉;灰色条形为RopGEF2/8突变体花粉。误差条是三次技术重复的标准偏差GydF4y2Ba
相比之下,GydF4y2BaRopgef2.GydF4y2Ba和GydF4y2Baropgef8.GydF4y2Ba双纯合双位等位基因植物(GydF4y2BaRopgef2 / 8.GydF4y2Ba) (图。GydF4y2Ba7.GydF4y2Baa),与野生型植物相比,种子肥力降低20-30%(图2)。GydF4y2Ba7.GydF4y2Bab)。野生型和突变体之间的植物和生殖发展没有显着差异(图。GydF4y2Ba7.GydF4y2BaC-E)。为了探讨花粉晶粒形成的任何缺陷的可能性,检查了成熟的花粉晶粒。在双敲除突变体中,通过碘染色测定的成熟花粉晶粒的淀粉形成与野生型的碘没有不同(图。GydF4y2Ba7.GydF4y2Baf).为了检查花粉粒是否形成完整的花粉壁,我们还用auramine O和calcofluor white对成熟花粉粒进行了染色,证实突变体和野生型之间没有差异(图2)。GydF4y2Ba7.GydF4y2BaG-H)。接下来,我们检查了双突变花粉的花粉萌发行为。在体外花粉萌发条件下,约77%的野生型花粉在83%水合花粉颗粒中发芽。相比之下,只有大约20%GydF4y2BaRopgef2 / 8.GydF4y2Ba双突变花粉发芽,即使突变花粉中的75%是水合的(图。GydF4y2Ba7.GydF4y2Bai (k)。这些数据表明GydF4y2BaOsropgef.GydF4y2Ba水稻花粉萌发的基因在功能上是多余的。多基因突变体的不同组合可以解释4个花粉特异性RopGEF基因之间的功能关系。GydF4y2Ba
讨论GydF4y2Ba
在动物和植物细胞中,Rho GTPases或ROPs调控一系列需要建立细胞极性的关键细胞过程[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba39GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].ROP以空间和时间调节的方式转化细胞内和细胞外刺激,导致细胞内反应的局部调节[GydF4y2Ba6.GydF4y2Ba].不同植物的ROP蛋白数量不同:水稻中有7个,玉米中有9个,拟南芥中有11个。在拟南芥中,三GydF4y2Ba罗普GydF4y2Ba(GydF4y2BaROP1GydF4y2Ba那GydF4y2BaROP3GydF4y2Ba,GydF4y2BaROP5GydF4y2Ba)在花粉中高度表达,在调控花粉管生长中具有功能冗余。AtROP1定位于花粉管顶端区域,在花粉管生长过程中受内吞作用的动态调节[GydF4y2Ba41GydF4y2Ba那GydF4y2Ba42GydF4y2Ba].扰乱GydF4y2BaATROP1.GydF4y2Ba通过对组成型活性形式的过表达产生溶胀的管,而ATROP1活化的扰动导致短花粉管[GydF4y2Ba43GydF4y2Ba那GydF4y2Ba44GydF4y2Ba[表明ROP活性水平的控制对于花粉管形状很重要。相比之下,没有花粉优先GydF4y2Ba罗普GydF4y2Ba通过组织表达的热图分析(附加文件7a)。相反,GydF4y2BaosRac6.GydF4y2Ba的一种亲缘关系很近的成员GydF4y2BaATROP1 / 3/5GydF4y2Ba(附加文件7b和c),在包括成熟花药和花粉在内的各种组织中表达,表明通过控制一个成员,GydF4y2BaOsRac6,GydF4y2Ba在水稻花粉萌发可能很重要。GydF4y2Ba
为了规管rop,植物可能会进化出特定的规管机构,例如ropgef [GydF4y2Ba9.GydF4y2Ba].由于对比表达分析,我们发现在11种水稻和14个拟南芥中的花粉中高度表达了四个和五种基因GydF4y2Ba罗比夫GydF4y2Ba分别为家庭成员。这表明RopGEF在花粉中调控ROP的机制可能在水稻和拟南芥之间是保守的。四倍的突变体GydF4y2BaAtRopGEF1、AtRopGEF9 AtRopGEF12,GydF4y2Ba和GydF4y2BaAtropgef14GydF4y2Ba表现出降低的花粉管伸长率,尽管这种效果未被任何单一基因突变表现出来[GydF4y2Ba16GydF4y2Ba].由于功能冗余,单个突变体在花粉萌发和花粉管生长方面均未出现缺陷。淘汰赛的突变体GydF4y2Baosropgef7b.GydF4y2Ba在不同的组织中广泛表达,包括花粉,引起花器官的异常发育,但在花粉形成或花粉萌发方面没有改变[GydF4y2Ba29GydF4y2Ba].相反,GydF4y2Baosropgef2,osropgef3,osropgef6,GydF4y2Ba和GydF4y2BaOsRopGEF8GydF4y2Ba在花粉中优先表达,强烈表明它们在花粉萌发和管生长中发挥重要作用。我们的表型分析表明产生的双纯合突变体花粉萌发缺陷GydF4y2BaOsropgef2.GydF4y2Ba和GydF4y2BaOsRopGEF8GydF4y2Ba,降低生育率,而任何单一突变体的花粉萌发都没有显着缺陷。它表明水稻花粉萌发和管生长需要至少两种绳索基因,并且在功能冗余中GydF4y2Ba罗比夫GydF4y2Ba基因,如拟南芥。GydF4y2Ba
四个基因的花粉优选的表达模式可能会通过三个存在的存在来解释GydF4y2Ba独联体GydF4y2Ba- 另外七个,花粉非优选成员的启动子缺席的元素。自这些以来GydF4y2Ba独联体GydF4y2Ba- 调节基因的启动子也存在 - 治疗基因的促进剂GydF4y2BamyGydF4y2Ba和GydF4y2BaBhlh.GydF4y2Ba,我们认为MYB或bHLH可能是潜在的转录因子调控的表达GydF4y2Ba罗比夫GydF4y2Ba然而,需要来自meme套件的结果来证明GydF4y2Ba独联体GydF4y2Ba通过进一步分析如使用酵母 - 一种杂交系统的进一步分析 - 转录因子的启动子中的元素。GydF4y2Ba
尽管具有同种型异构型,基因序列和蛋白质结构在整个Atropgefs和Osropgefs中保存得很好,特别是关于易于域,表明Ropgefs的保守活动。Ropgef 3-D结构中的alpha螺旋数的差异可能涉及稳定WW环构象[GydF4y2Ba45GydF4y2Ba].与报告的ATROPGEF8相比,OSROPGEF2和6的3-D结构显示相同的WW环(40个残基)[GydF4y2Ba32GydF4y2Ba],而OsRopGEF3和8的长度较短,分别为34和25个残基(表GydF4y2Ba1GydF4y2Ba).已知WW-loop在RopGEF家族不同成员之间的长度和序列是可变的[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba32GydF4y2Ba那GydF4y2Ba45GydF4y2Ba].我们发现可磷酸化的丝氨酸残留物[GydF4y2Ba13GydF4y2Ba在花粉偏好的OsRopGEFs中也和在AtRopGEFs中一样保守。需要进一步的研究来确定四种花粉偏好的osropgef是如何被相互作用的伙伴(如花粉偏好的RLKs)调控的[GydF4y2Ba17GydF4y2Ba那GydF4y2Ba46GydF4y2Ba].GydF4y2Ba
我们在烟草表皮细胞中奥摩托车差异分布的报告表明它们可以调节不同的花粉萌发过程。在拟南芥中,观察到绳索与ROP1的GTP和GDP结合形式差异相互作用,并且在不同的亚细胞位置局部化[GydF4y2Ba8.GydF4y2Ba].在ATROPGEF12中删除C末端域在烟草花粉中表达时废除了膜关联[GydF4y2Ba8.GydF4y2Ba].Ropgefs可能在PM激活ROP,其空间分布反映了ROP激活的网站[GydF4y2Ba6.GydF4y2Ba].建议ROP1的顶端位置反过来馈送前馈调节RLK和ROPGEFS的外尿病[GydF4y2Ba5.GydF4y2Ba].另一项研究报道,AGC激酶俯卧结构域的磷酸化对于沿顶部PM的定位至关重要,随后用于ROP活化和花粉管极性[GydF4y2Ba47GydF4y2Ba].细胞ROP信号也参与根毛的形成,这是另一种极性顶端生长的植物细胞类型。最近,功能分析显示,AtRopGEF3在AtROP2极化引发根毛的过程中起作用,而另一种AtRopGEF4调节随后的根毛生长[GydF4y2Ba48GydF4y2Ba].因此,可以通过激酶以不同的方式调节绳索成员以实现不同的本地化和激活,随后在极性细胞启动和生长的不同阶段中起作用。进一步研究其他信号或互动伴侣的奥斯波特夫的动态分布将更好地理解水稻花粉萌发过程所需的分子网络。GydF4y2Ba
结论GydF4y2Ba
我们的研究确定了在水稻中的Ropgef基因中花粉中高度表达的四种基因,并在蛋白质序列中确认了它们的保守结构域,蛋白质二级和三级结构的相似性,并确定了每个亚细胞定位。此外,我们确认双重敲除突变体GydF4y2BaRopgef2.GydF4y2Ba和GydF4y2Baropgef8.GydF4y2Ba显著降低花粉萌发和种子产量。通过启动子分析,我们还发现了一个新的顺式调控元件,该元件有望影响花粉的表达,并提出了花粉细胞中的RopGEF模型。本研究为RopGEF在水稻中的功能研究提供了有价值的信息。GydF4y2Ba
方法GydF4y2Ba
多序列比对和系统发育树构建GydF4y2Ba
在水稻和水稻中进行RopGEF和ROP/Rac系统发育分析GydF4y2BaA. Thaliana.GydF4y2Ba,我们将蛋白质序列与水稻基因组注释项目的基因座ID收集(GydF4y2Bahttp://rice.plantbiology.msu.edu/GydF4y2Ba),国家生物技术信息中心(NCBI,GydF4y2Bahttps://www.ncbi.nlm.nih.gov/GydF4y2Ba)和植物血统平台(GydF4y2Bahttps:///phytozome.jgi.doe.gov/pz/portal.html.GydF4y2Ba)(附加文件GydF4y2Ba8.GydF4y2Ba).使用ClustalW比对多个氨基酸序列[GydF4y2Ba49GydF4y2Ba].在最大可能性和邻近的方法下使用Mega 7.0.26进行系统发育分析[GydF4y2Ba50.GydF4y2Ba].GydF4y2Ba
Meta表达分析GydF4y2Ba
我们使用了一个公开的水稻Affymetrix微阵列数据集,该数据集来自不同的组织,包括来自NCBI GEO的花药和花粉[GydF4y2Ba51.GydF4y2Ba]鉴定晚期花粉优选的基因(GSE21494,GSE109811,[GydF4y2Ba31GydF4y2Ba])。要检查这些数据,我们使用R语言编码的辅助包来归一化信号强度,然后将它们转换为日志GydF4y2Ba2GydF4y2Ba价值观。然后将归一化数据具有平均的染色释放元表达数据,用于进一步调查,例如热映射结构和鉴定后花粉优选的基因[GydF4y2Ba52.GydF4y2Ba].GydF4y2Ba
植物生长和RNA提取GydF4y2Ba
大米材料包括cv。本研究使用的T-DNA插入系均来自庆熙大学T-DNA库(GydF4y2Bahttp://signal.salk.edu/ricege/ricege_data_source.html.GydF4y2Ba).种植水稻时,用50%次氯酸钠灭菌30 min,用蒸馏水洗涤,然后在控制条件下,在Murashige和Skoog (MS)培养基上(28/25°C昼/夜,8小时光周期,78%相对湿度)发芽7天。幼苗在温室中生长1个月后,转移到庆熙大学的稻田。植物栽培和植物材料的收集是根据韩国政府指导的改良活生物体许可和规定进行的。对于亚细胞定位,烟草(GydF4y2Ba烟草benthamianaGydF4y2Ba)植物如前所述成长[GydF4y2Ba53.GydF4y2Ba在生长室中。GydF4y2Ba
为了进行基因表达分析,将不同的水稻组织分别冷冻在液氮中,并用Tissue-Lyser II (Qjagen;希尔登,德国)。为了分离花粉,我们在RNA稳定溶液中收集成熟花粉(RNAlater Tissue Collection;Invitrogen)从刚刚开始开放的开裂的花药。用TRIzol缓冲液提取RNA如下[GydF4y2Ba54.GydF4y2Ba]和CDNA使用来自Genet Bio的Suprimecript RT预混物合成[GydF4y2Ba55.GydF4y2Ba].对于通过QPCR的组织特异性表达,我们使用了用于水稻泛素5的对照引物套(GydF4y2BaOsubi5.GydF4y2BaLOC_Os01g22490)。我们实验中用到的qRT-PCR引物都列在这里(补充文件)GydF4y2Ba9.GydF4y2Ba).使用的PCR循环条件为30℃,57℃,30℃,72℃,1分钟30秒为22-38次循环。对于实时PCR(QPCR),我们使用Roter-Gene Q仪器系统(Qiagen,Hilden,德国)使用95℃,57°C的循环条件为95℃,57°C,和72℃,60秒。我们使用了2x Prime Q-MasterMix(Genet Bio),其中包含Sybr Green1用于QPCR缓冲区。确定四个的重要表达变化GydF4y2Ba罗比夫GydF4y2Ba在不同组织中的基因,我们用三个独立的生物重复进行了QPCR分析。通过2计算相对转录水平和折叠变化GydF4y2Ba-GydF4y2Ba∆CtGydF4y2Ba和2GydF4y2Ba-ΔΔGydF4y2BaCtGydF4y2Ba方法,分别GydF4y2Ba56.GydF4y2Ba].GydF4y2Ba
蛋白质结构分析GydF4y2Ba
在全自动模式下在瑞士模型工作区上计算三维(3-D)结构模型[GydF4y2Ba57.GydF4y2Ba]使用Ropgef氨基酸序列作为模板。使用加州大学旧金山(UCSF)Chimera 1.10计划来了解所获得的3-D结构[GydF4y2Ba58.GydF4y2Ba].GydF4y2Ba
CIS作用元素分析GydF4y2Ba
分析四个花粉特异启动子区域GydF4y2BaOsropgef.GydF4y2BaLOCI,我们从起始密码子提取了2-KB上游序列11GydF4y2BaOsropgef.GydF4y2Ba来自embl的基因座(GydF4y2Bahttps://plants.ensembl.org/GydF4y2Baoryza.GydF4y2Ba_GydF4y2Ba苜蓿GydF4y2Ba/信息/索引GydF4y2Ba)和甘草(GydF4y2Bahttp://ensembl.grammene.org/GydF4y2Baoryza.GydF4y2Ba_indica /信息/索引GydF4y2Ba).找到GydF4y2Ba独联体GydF4y2Ba-Elements在启动子序列中GydF4y2BaOsropgef.GydF4y2Ba基因,使用该地方扫描2kb上游序列(植物GydF4y2Ba独联体GydF4y2Ba- 治疗DNA元素)数据库[GydF4y2Ba59.GydF4y2Ba].为了发现仅存在于花粉特异的RopGEF基因中的新基序,我们通过昆士兰大学(University of Queensland,简称:昆士兰大学)的Web服务器(GydF4y2Bahttp://meme-suite.org/tools/memeGydF4y2Ba)[GydF4y2Ba60.GydF4y2Ba].首先,我们分析了所有11的2-KB启动子序列GydF4y2Ba罗比夫GydF4y2Ba基因立刻。接下来,分析了四种花粉特异性RopGEF基因的2-KB启动子序列,并将两组使用MEME进行了比较。在发现的主题中,我们选择那些只在花粉特定的启动子序列中发现的那些GydF4y2Ba罗比夫GydF4y2Ba并使用TOMTOM在已知基序数据库中搜索一些基序。搜索条件是“motif长度5到10bp”,“表明只在输入数据中常见的motif,”和“检查两股”。GydF4y2Ba
亚细胞定位分析GydF4y2Ba
四个编码序列(CDS)GydF4y2Ba罗比夫GydF4y2Ba从成熟的花药cDNA中扩增基因,并克隆到与C末端绿色荧光蛋白(GFP)融合的PCHEEN载体中。我们在我们的实验中使用的所有克隆底漆都在这里列出(附加文件GydF4y2Ba9.GydF4y2Ba).将构建体转染GydF4y2Ba农GydF4y2Ba菌株GV3101,用于GydF4y2Ba烟草benthamianaGydF4y2Ba根据[GydF4y2Ba61.GydF4y2Ba].浸润后2 ~ 3天,用共聚焦激光扫描显微镜(Zeiss LSM 510,德国耶拿)观察GFP荧光,光谱设置为500-530 nm发射,488 nm激发。烟草叶片染色使用血浆和液泡膜标记物FM4-64 (Thermo Fisher Scientific)。我们在黑暗条件下处理0.1%的FM4-64烟叶15 min以上,并在558 nm波长下通过红色荧光蛋白(RFP)通道进行观察。GydF4y2Ba
载体构建与水稻转化GydF4y2Ba
为了设计单个和多种CA矢量克隆的指南RNA,我们通过CRISPRDIRECT工具为每个轨迹选择了两个目标区域[GydF4y2Ba62.GydF4y2Ba].对于CRISPR-CAS9载体克隆,我们用退火的引物合成寡聚二聚体并用PRGEB32二元载体连接二聚体[GydF4y2Ba38GydF4y2Ba].连接载体被转化为GydF4y2Ba大肠杆菌,GydF4y2Ba并通过测序确认了插入物。然后,将质粒转化为GydF4y2Ba根癌土壤杆菌LBA4404GydF4y2Ba.通过稳定的转化,获得了转基因水稻植株GydF4y2Ba农杆菌属GydF4y2Ba- 介绍的共同栽培[GydF4y2Ba63.GydF4y2Ba].我们在我们的实验中使用的所有克隆引物都列于额外的文件中GydF4y2Ba9.GydF4y2Ba.GydF4y2Ba
表型分析GydF4y2Ba
对于成熟花粉晶粒中的测试表型,淀粉积聚染色1%的碘溶液(GydF4y2Ba一世GydF4y2Ba2GydF4y2Ba)和碘化钾(KI)处理10-20分钟。用0.1%钙粉白染色10 min,用0.001%金胺O染色10 min。ki染色花粉粒采用亮场通道观察,金胺o染色花粉粒采用荧光素异硫氰酸酯(FITC)通道观察,钙粉白染色花粉粒采用紫外(UV)通道观察,波长为180 ~ 400 nm。将新鲜花粉粒置于由20%蔗糖、10% PEG、3mm硝酸钙、40 mg/L硼酸、10 mg/L维生素B1和1%琼脂组成的花粉萌发培养基上,进行花粉萌发试验。在28°C孵育10-30 min后,用SZX61显微镜(Olympus, Tokyo, Japan)观察花粉管。GydF4y2Ba
可用性数据和材料GydF4y2Ba
不适用。GydF4y2Ba
缩写GydF4y2Ba
- CRE:GydF4y2Ba
-
顺式元件GydF4y2Ba
- CRRLK:GydF4y2Ba
-
Catharanthus受体样激酶GydF4y2Ba
- 双:GydF4y2Ba
-
扩散b细胞淋巴瘤GydF4y2Ba
- GP:GydF4y2Ba
-
花粉发芽GydF4y2Ba
- GTP:GydF4y2Ba
-
鸟嘌呤核苷三磷酸GydF4y2Ba
- MP:GydF4y2Ba
-
成熟花粉GydF4y2Ba
- 下午:GydF4y2Ba
-
等离子体膜GydF4y2Ba
- PRK:GydF4y2Ba
-
花粉受体激酶GydF4y2Ba
- 易于:GydF4y2Ba
-
植物特异性ROP核苷酸交换剂GydF4y2Ba
- 罗普:GydF4y2Ba
-
植物的rho型GTPasesGydF4y2Ba
- RopGAP:GydF4y2Ba
-
ROP的GTPase-Activator蛋白GydF4y2Ba
- Ropgef:GydF4y2Ba
-
鸟嘌呤核苷酸交换因子GydF4y2Ba
- ROS:GydF4y2Ba
-
活性氧GydF4y2Ba
参考GydF4y2Ba
- 1.GydF4y2Ba
郑志强,杨志强。植物中Rop GTPase的表达。植物学报。2000;44(1):1 - 9。GydF4y2Ba
- 2.GydF4y2Ba
Akamatsu A,Uno K,Kato M,Wong HL,Shimamoto K,Kawano Y.新的洞察小GTPase Rac / ROP鸟嘌呤核苷酸核苷酸交换因子在水稻中的二聚体。植物信号表现。2015; 10(7):E1044702。GydF4y2Ba
- 3.GydF4y2Ba
Molendijk J, Bischoff F, Rajendrakumar CS, Friml J, Braun M, Gilroy S, Palme K.拟南芥Rop GTPases定位于根毛的顶端并控制极性生长。EMBO j . 2001; 20(11): 2779 - 88。GydF4y2Ba
- 4.GydF4y2Ba
Ory S,Gasman S. Rho GTP酶和外毒性症:分子链接是什么?Semin Cell Dev Biol。2011; 22(1):27-32。GydF4y2Bahttps://doi.org/10.1016/j.semcdb.2010.12.002GydF4y2Ba.EPUB 2010 12月8日。GydF4y2Ba
- 5。GydF4y2Ba
罗妮,闫阿,刘克,郭继,荣d,k ok mm,萧z,徐g,higashiyama t,cui x。尖吐胞症 - 尖端增长的协调机制底层花粉造成的调节指导。NAT Communce。2017; 8(1):1687。GydF4y2Ba
- 6。GydF4y2Ba
王志强,王志强,王志强,等。ROP GTPases的结构、功能和信号转导途径。植物杂志。2018;176(1):57 - 79。GydF4y2Ba
- 7。GydF4y2Ba
陈志强,陈志强。植物rho型分子开关的结构和功能研究。植物生理学与生物化学。2008;46(3):380-93。GydF4y2Ba
- 8。GydF4y2Ba
谷勇,李树华,杨振宇。一种新的拟南芥鸟嘌呤核苷酸交换因子调控rho gtpase依赖的极性生长。植物细胞。2006;18(2):366 - 81。GydF4y2Ba
- 9。GydF4y2Ba
Berken A, Thomas C, Wittinghofer A.一个新的RhoGEFs家族激活植物中的Rop分子开关。大自然。2005;436(7054):1176。GydF4y2Ba
- 10.GydF4y2Ba
Li Z,Liu D. Ropgef1和Ropgef4是ABA介导的拟南芥气孔闭合中ROP11 GTP酶的功能调节因子。费用。2012; 586(9):1253-8。GydF4y2Ba
- 11.GydF4y2Ba
李泽,沃德·克,施罗德·吉。通过ABA诱导的Ropgefs的快速降解介导GTP交换因子介导的脱落酸信号转导的下调。Plos Biol。2016; 14(5):E1002461。GydF4y2Ba
- 12.GydF4y2Ba
刘勇,董强,塔达,黄建平,刘刚,吴旭,朱旭,张AY,吴hm,陶立忠。RopGEF1在生长素早期的极性运输中起着关键作用。植物杂志。2017;175(1):157 - 71。GydF4y2Ba
- 13.GydF4y2Ba
张Y,McCormick S.一种明显的机制,调节拟南芥小GTPAse rop的花粉特异性鸟嘌呤核苷酸交换因子。Proc Natl Acad Sci U S A. 2007; 104(47):18830-5。GydF4y2Ba
- 14.GydF4y2Ba
在番茄、玉米和拟南芥中鉴定出新的花粉特异性受体激酶:番茄激酶在花粉管上表现出重叠但不同的定位模式。植物学报。2002;50(1):1 - 16。GydF4y2Ba
- 15.GydF4y2Ba
Tang W,Kelley D,Ezcurra I,Cotter R,Mccormick S. Lestig1,花粉受体激酶Leprk1和Leprk2的细胞外结合合作伙伴促进了体外花粉管生长。工厂J. 2004; 39(3):343-53。GydF4y2Ba
- 16。GydF4y2Ba
Chang F,Gu Y,Ma H,Yang Z.Atprk2通过Ropgefs促进了Rop1激活的偏振花粉管生长。莫尔植物。2013; 6(4):1187-201。GydF4y2Ba
- 17。GydF4y2Ba
Yu Y,Song J,Tian X,Zhang H,Li L,朱H.拟南芥PRK6特别用ATROPGEF8 / 12相互作用,并在过度表达时诱导花粉管的去极化生长。科学生中国生活SCI。2018; 61(1):100-12。GydF4y2Ba
- 18。GydF4y2Ba
魏立强,徐文耀,邓志勇,苏智,薛勇,王涛。水稻花粉发育和萌发过程中基因表达谱的基因组规模分析与比较。BMC基因组学。2010;11(1):338。GydF4y2Ba
- 19。GydF4y2Ba
Craddock C,Lavagi I,Yang Z.来自植物ROP / RAC GTP酶的RHO信号传导的新见解。趋势细胞BIOL。2012; 22(9):492-501。GydF4y2Ba
- 20.GydF4y2Ba
段琦,Kita D,李超,张AY,吴hm。FERONIA受体样激酶调控根毛发育的RHO GTPase信号通路。中国科学(d辑:地球科学)2010;GydF4y2Ba
- 21.GydF4y2Ba
Nibau C,Cheung A.新见解Crrlks在植物细胞增长和发展中的功能作用。植物信号表现。2011; 6(5):655-9。GydF4y2Ba
- 22.GydF4y2Ba
关键词:花粉管;真菌;入侵;科学。2010;330(6006):968 - 71。GydF4y2Ba
- 23。GydF4y2Ba
贾宾A,杨Z.钙和ROP信号传导的相互作用调节花粉管尖端生长。在:植物中钙信号的编码和解码。柏林:斯普林克;2011. p。25-39。GydF4y2Ba
- 24。GydF4y2Ba
Kawasaki T,Imai K,Wong HL,Kawano Y,Nishide K,okuda J,Shimamoto K.小鸟嘌呤核苷酸的小GTPase OSRAC1参与水稻先天免疫的奥罗拉克。:遗传学,基因组学和水稻爆炸疾病的控制进展。Springer,2009. p。179-84。GydF4y2Ba
- 25。GydF4y2Ba
Kawasaki T, Henmi K, Ono E, Hatakeyama S, Iwano M, Satoh H, Shimamoto K.小gtp结合蛋白rac是植物细胞死亡的调节因子。中国科学(d辑:地球科学)1999;96(19):10922-6。GydF4y2Ba
- 26。GydF4y2Ba
刘家,公园,王,王,王M,Bellizzi M,Zhang K,Zeng X,Liu W,Ning Y. rhoGap Spin6与Spl11和OsRac1的联系人,负面调节水稻的程序性细胞死亡和先天免疫。PLOS PARCOG。2015; 11(2):E1004629。GydF4y2Ba
- 27。GydF4y2Ba
Kosami K, Ohki I, Nagano M, Furuita K, Sugiki T, Kawano Y, Kawasaki T, Fujiwara T, Nakagawa A, Shimamoto K, kojimc .植物小GTPase OsRac1的晶体结构揭示了它与NADPH氧化酶的结合模式。[J] .中国生物医学工程学报,2014;GydF4y2Ba
- 28。GydF4y2Ba
Yoo J, Park J, Cho S, Yoo S, Li J, Zhang H, Kim K, Koh H, Paek N.水稻亮绿叶(bgl)基因座编码OsRopGEF10,激活叶表面表皮小乳头的发育。植物学报。2011;77(6):631-41。GydF4y2Ba
- 29。GydF4y2Ba
黄杰,刘H,Berberich T,Liu Y,Tao L,Liu T.鸟嘌呤核苷酸交换因子7b(Ropgef7b)参与Oryza Sativa的花式器官发展。米。2018; 11(1):42。GydF4y2Ba
- 30.GydF4y2Ba
Kim Y,张D,Jung K.谷物花粉萌发的分子基础。趋势植物SCI。2019; 24(12):1126-36。GydF4y2Ba
- 31.GydF4y2Ba
Moon S,OO mm,Kim B,Koh H,oh Sa,yi g,G,Park Sk,Jung K. Genome-Wouts-Wouts-Leats-Perminer-Perminery基因的基因组分析在各种水稻品种中保存,以及所涉及的基因的功能鉴定晚期花粉发育的关键过程。米。2018; 11:1-14。GydF4y2Ba
- 32.GydF4y2Ba
托马斯C,Fricke I,Scrima A,Berken A,Wittinghofer A.小于G蛋白-GEF反应中常见中间体的结构证据。Mol细胞。2007; 25(1):141-9。GydF4y2Ba
- 33.GydF4y2Ba
散热J,Brach T,Kühners,Hawes C. GFP的光激活显示内质网膜内的蛋白质动态。J Exp Bot。2005; 57(1):43-50。GydF4y2Ba
- 34.GydF4y2Ba
石y,刘H,高y,王Y,吴米,Xiang Y.莫斯竹(Phyllostachys Edulis)中生长调节因子的基因组鉴定:在硅和实验分析中。peerj。2019; 7:E7510。GydF4y2Ba
- 35.GydF4y2Ba
水稻花药特异基因ossipp3的上游调控区及其顺式元件的鉴定。籼稻。植物繁殖。2015; 28(3 - 4): 133 - 42。GydF4y2Ba
- 36.GydF4y2Ba
刘丽,郑超,邝波,魏林,严玲,王涛。受体样激酶RUPO与钾转运体相互作用对水稻花粉管生长和完整性的调控。公共科学图书馆麝猫。2016;12 (7):e1006085。GydF4y2Ba
- 37.GydF4y2Ba
Shin DH,Kim T,Kwon Y,Cho M,Yoo J,Jeon J,Hahn T,Bhoo Sh。拟南芥Ropgef家族基因对非生物胁迫的表征。植物生物科技植物。2009; 3(3):183-90。GydF4y2Ba
- 38.GydF4y2Ba
谢克,Minkenberg B,Yang Y.通过内源性TRNA处理系统提高CRISPR / CAS9多重编辑能力。Proc Natl Acad Sci U S A. 2015; 112(11):3570-5。GydF4y2Ba
- 39.GydF4y2Ba
杨志。拟南芥的细胞极性信号转导。Cell Dev Biol. 2008; 24:551-75。GydF4y2Ba
- 40.GydF4y2Ba
Jaffe Ab,Hall A. Rho GTP酶:生物化学和生物学。Annu Rev Cell Dev Biol。2005; 21:247-69。GydF4y2Ba
- 41.GydF4y2Ba
Hwang J,Vernoud V,Szumlanski A,Nielsen E,Yang Z.一种通过全局抑制细胞顶点的Rho GTP酶控制细胞极性。Curr Biol。2008; 18(24):1907-16。GydF4y2Ba
- 42.GydF4y2Ba
李H,罗妮,王W,刘Z,陈继,赵L,棕褐色,王C,Qin Y,Li C.REN4变阻性动态坐标拟南芥花粉管的顶端和侧域。NAT Communce。2018; 9(1):2573。GydF4y2Ba
- 43.GydF4y2Ba
李H,林Y,Heath RM,Zhu MX,杨Z.通过ROP GTP酶依赖性途径控制花粉管尖端的增长,导致尖端局部钙流入。植物细胞。1999; 11(9):1731-42。GydF4y2Ba
- 44.GydF4y2Ba
Kost B, Lemichez E, Spielhofer P, Hong Y, Tolias K, Carpenter C, Chua NH。Rac同系物和区室化的磷脂酰肌醇4,5 -二磷酸共同作用于调节极性花粉管的生长。中华细胞生物学杂志。1999;145(2):317-30。GydF4y2Ba
- 45.GydF4y2Ba
托马斯C,Fricke I,Weyand M,Berken A. 3D结构的二元rop-Prone复合物:最终中间的绳索反应的一整套分子快照。Biol Chem。2009; 390(5/6):427-35。GydF4y2Ba
- 46.GydF4y2Ba
LöckeS,Fricke I,Mucha E,Humpert M,Berken A.含有花粉特异性受体样激酶的相互作用 - 含有信令网络。EUR JBelt Biol。2010; 89(12):917-23。GydF4y2Ba
- 47。GydF4y2Ba
李娥,崔Y,Ge F,柴S,张W,冯Q,姜L,李S,张Y.AGC1。5激酶磷酸化Ropgefs控制花粉管生长。莫尔植物。2018; 11(9):1198-209。GydF4y2Ba
- 48。GydF4y2Ba
Philipp D, Reichelt A, Schmidt VAF, Mehlhorn DG, Asseck LY, Stanley CE, Keinath NF, Evers JF, Grefen C, Grossmann G.不同的ROPGEFs先后驱动根毛的极化和分枝。咕咕叫杂志。2019;29(11):1854 - 65。GydF4y2Ba
- 49。GydF4y2Ba
Thompson JD, Gibson TJ, Higgins DG。使用ClustalW和ClustalX进行多序列比对。生物信息学。2003;(1):2.3.1-2.3.22。GydF4y2Ba
- 50。GydF4y2Ba
MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。生物化学学报。2016;33(7):1870-4。GydF4y2Ba
- 51。GydF4y2Ba
洪W,金Y,Chandran Akn,Jung K.系统生物学的基础设施,促进水稻中功能基因组研究。米。2019; 12(1):15。GydF4y2Ba
- 52。GydF4y2Ba
Nguyen Q,Lee Y,Cho L,Jeong H,G,Jung K. Genome-Indum-Sike rinus rlk1样激酶的基因组。Planta。2015; 241(3):603-13。GydF4y2Ba
- 53。GydF4y2Ba
关键词:低温,小麦,花粉不育性,TaPaO1基因,功能分析植物学报,2018;61(1):25-32。GydF4y2Ba
- 54.GydF4y2Ba
拟南芥(Arabidopsis thaliana)中28-homodolichosterone可生物合成Castasterone。植物学报,2018;61(5):330-5。GydF4y2Ba
- 55.GydF4y2Ba
VO KTX,Kim C,Chandran AKN,Jung K,G,Jeon J.分子见解进入植物中Ankyrin蛋白的功能。J植物BIOL。2015; 58(5):271-84。GydF4y2Ba
- 56.GydF4y2Ba
月亮S,Jung K.跨时空样品水稻ABC转运蛋白系列的基因组表达分析及反应非生物胁迫。J植物理性。2014; 171(14):1276-88。GydF4y2Ba
- 57.GydF4y2Ba
Arnold K, Bordoli L, Kopp J, Schwede T. SWISS-MODEL工作空间:基于网络的蛋白质结构同源建模环境。生物信息学。2006;22(2):195 - 201。GydF4y2Ba
- 58.GydF4y2Ba
petersen EF, Goddard TD, Huang CC, Couch GS, Greenblatt DM,孟EC, Ferrin TE。UCSF chimera—一个用于探索性研究和分析的可视化系统。化学学报。2004;25(13):1605-12。GydF4y2Ba
- 59.GydF4y2Ba
植物顺式作用调控DNA元件(PLACE)数据库:1999。核酸学报1999;27(1):297-300。GydF4y2Ba
- 60.GydF4y2Ba
Bailey TL, Boden M, Buske FA, Frith M, Grant CE, Clementi L, Ren J, Li WW, Noble WS。MEME套件:motif发现和搜索工具。核酸Res. 2009;37(suppl_2): W202-8。GydF4y2Ba
- 61.GydF4y2Ba
火花IA,散迹J,Kearns A,Hawes C.烟草植物中的荧光融合蛋白的快速,瞬态表达以及稳定转化的植物的产生。NAT PROTOC。2006; 1(4):2019。GydF4y2Ba
- 62.GydF4y2Ba
Naito Y,Hino K,Bono H,Ui-Tei K.CrisPrieRect:用于设计CRISPR / CAS引导RNA的软件,具有减少的偏离目标网站。生物信息学。2014; 31(7):1120-3。GydF4y2Ba
- 63.GydF4y2Ba
李淑娟,李思,金振宇,具志成,林柯,崔永杰,韩灿,郑昌昌,龙崔正。农杆菌-水稻细胞互作和植株再生的品种变异。杂志。1999;107(3):338 - 45。GydF4y2Ba
致谢GydF4y2Ba
不适用。GydF4y2Ba
资金GydF4y2Ba
下一代生物绿色21计划(PJ01369001和PJ01366401 to KHJ);韩国国家研究基金会(NRF;2018R1A4A1025158和2019R1C1C1002636 to YJK),由韩国政府出资。资助方没有参与实验设计、数据分析、决定发表或手稿的准备。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
KHJ和YJK设计了这项研究并获得了资助;KHJ, YJK, EJK和SWP共同撰写了手稿和图形安排。YJK, EJK, SWP, WJH, JS进行了实验并分析了数据。WL和ZD提供了实验支持和批评意见。所有作者都已阅读并批准了手稿的最终版本。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
提交人声明他们没有竞争利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:图S1。GydF4y2Ba
荟萃表达分析和基因组覆盖识别GydF4y2Ba罗比夫GydF4y2Ba在米饭中。使用微阵列数据库检查各种水稻组织的表达。Heatmap中的黄色表示高水平的表达;深蓝色,表达水平低。数值表示微阵列数据的归一化Log2强度的平均值。GydF4y2Ba
附加文件2:图S2。GydF4y2Ba
AtRopGEF全基因的元表达分析。热图是用genevinvestigator制作的。我们选择了包括花粉在内的五种具有代表性的组织。结果表明,5种拟南芥ropgef在花粉中均有高表达。热图中暗红色表示最高的表达式;白色,最低表情。GydF4y2Ba
附加文件3:图S3。GydF4y2Ba
Ropgef基因的C-Termini的蛋白质序列取向结构域分析和保守磷酸化氨基酸残基。收集并对每种蒸馏物和ATROPGEF蛋白质序列进行收集并对齐,然后是易发域(C1,C2,C3)和WW-MOTIF。在序列的最后部分,我们发现了一些保守的区域。根据先前的研究,ATROPGEF12的C-末端的S510参与了GEF活性的C末端抑制。如在ATROPGEF12中,丝氨酸残基在每个OSROPGEF2,OSROPGEF3和OSTOPGEF8基因中保守,但不保守,但不包括在OSROPGEF6中。然而,K(赖氨酸)也可以磷酸化。GydF4y2Ba
附加文件4:图S4。GydF4y2Ba
烟草表皮细胞亚细胞定位的缩放图像。它示出了图1的放大部分。GydF4y2Ba5.GydF4y2Ba.左侧的第一面板显示控制和ROPGEF蛋白的GFP信号,第二面板显示使用膜标记FM4-64染色的RFP信号,第三面板显示出明亮的图像,右侧的最后一面板表示合并图像。除膜信号外,RFP通道中出现的大点是由于叶绿素的自动荧光。A-D,控制(PGREEN-GFP);E-H,Ropgef 2;I-L,Ropgef3;M-P,RopgeF6;Q-T,Ropgef8。酒吧= 10 um。GydF4y2Ba
附加文件5:图S5。GydF4y2Ba
启动子分析GydF4y2BaOsropgef.GydF4y2Ba基因。具体的GydF4y2Ba独联体GydF4y2Ba使用Place Database,即三花粉和塔塔盒鉴定了已知会影响花粉中表达的元素(CRE)。黄色条上方的数字显示在ATG的+ 1 + 1时的启动子碱基对的上游位置。我们分析了上游的2000个碱基对。这GydF4y2BaP.GydF4y2Ba-值表明在花粉中表现出高表达的4个基因与其他7个基因有多么显著的差异。GydF4y2Ba
附加文件6:图S6。GydF4y2Ba
使用CRISPR-Cas9系统进行单突变检测。(a-b, d-e)野生型花粉离体萌发试验(a, d),GydF4y2BaRopgef2.GydF4y2Ba(b,c),和GydF4y2BaRopgef3.GydF4y2Ba(E-F)固体花粉介质上的单突变体,条=50μm;(C,F)放大的花粉图片,条=20μm。每次对照和突变体在体外测定在同一天在同一环境中进行。(g)花粉萌发的比例。黑条表示野生型;灰棒表示GydF4y2BaRopgef2.GydF4y2Ba;白杆表示GydF4y2BaRopgef3.GydF4y2Ba突变花粉。误差栏是三种技术重复的标准偏差。(h)野生型和野生型的生育率比较GydF4y2BaRopgef2.GydF4y2Ba单突变植物。误差栏是植物中三个面三个面的标准偏差。GydF4y2Ba
附加文件7:图S7。GydF4y2Ba
七欧奥拉克和十个ATROP基因的荟萃表达分析和基因组鉴定。(a)热映射表达分析GydF4y2Ba奥斯德拉克GydF4y2Ba基因。(b)热插拔GydF4y2Ba阿托普GydF4y2Ba使用Genevestigator。(c)包括每一个的系统发育树构建体GydF4y2Ba奥斯德拉克GydF4y2Ba和GydF4y2Ba阿托普GydF4y2Ba.GydF4y2Ba
附加文件8:表S1。GydF4y2Ba
Ropgef基因和RAC / ROP基因的基因鉴定。GydF4y2Ba
附加文件9:表S2。GydF4y2Ba
OsRopGEF同基因特异性引物进行qPCR和克隆。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
金,EJ。那Park, SW., Hong, WJ.et al。GydF4y2Ba全基因组分析GydF4y2Ba罗比夫GydF4y2Ba鉴定水稻花粉管生长相关基因的基因家族(GydF4y2Ba奥雅萨苜蓿GydF4y2Ba).GydF4y2BaBMC植物杂志GydF4y2Ba20.GydF4y2Ba95(2020)。https://doi.org/10.1186/s12870-020-2298-5GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-020-2298-5GydF4y2Ba
关键字GydF4y2Ba
- 罗比夫GydF4y2Ba
- ROP / RAC.GydF4y2Ba
- 花粉GydF4y2Ba
- 奥雅萨苜蓿GydF4y2Ba
- 基因家族GydF4y2Ba