摘要
背景
“白日花”,品种繁多Catalpa Bungei.开花数量多,花期长,是研究树木开花的优良材料。SPL是调节开花过渡和发育的枢纽基因之一。
结果
SPL同源物CbuSPL9用与种族的堕落引物克隆。“Bairihua”开花过渡过程中的表达研究与拟南芥异位表达显示CbuSPL9与其拟南芥同源物同样有功能性。在下一步中,我们使用Y2H识别可以与CBUSPL9互动的蛋白质。鉴定了HMGA,建筑转录因子,并克隆了进一步的研究。BIFC和BLI表明CBUSPR9可以在细胞核中与CBUHMGA形成异二聚体。表达分析表明CbuHMGA有类似的表达趋势CbuSPL9在“白日花”开花期间。有趣的是,异位表达CbuHMGA在拟南芥中,会导致异常开花,但不影响开花时间。
结论
我们的结果暗示了一种新的途径CbuSPL9受管制开花发展,但不开花过渡,参与CbuHMGA.需要进一步的投资来验证这一途径的细节。
背景
花使开花植物有了更广泛的进化关系,扩大了它们的生态位,使它们能够主宰陆地生态系统。开花对多年生木本植物的发育和提高植物的经济价值具有极其重要的意义。然而,由于多年生木本植物基因组复杂等客观特性,对多年生木本植物开花过程的研究仍然有限。Catalpa Bungei.与木材和观赏树一样有价值[1].“Bairihua”,这是一种自然品种c .文艺其特点是幼期短、花多、花期长。“白日花”的花期约为15天,花期累计可达100天,这在木本植物(http://www.forestry.gov.cn/).“白日花”为评价木本植物的开花过程提供了一个极好的机会。
开花是由复杂的调控网络控制的[2那3.那4.那5.].这些过程涉及五个主要途径,包括衰老途径[6.,赤霉素途径[7.那8.那9.那10.,光周期通路[11.那12.那13.],春化途径[14.那15.那16.]和自主途径[17.].SQUAMOSA启动子结合蛋白样蛋白(SPL)家族转录因子(TFs)整合多种途径[18.那19.那20.那21.那22.].SPLS.已被证明在两种草药和木本植物中调节开花时间和花器官发展,如陆地棉[23.)、玉米(24.],桦树[25.],李属却已[26.],Platanus Acerifolia.[27.], 和杨树trichocarpa[28.].在模型植物拟南芥中,atspls.已经被证明是一组开花过程的主要调控者[29.那30.那31.那32.].过度的atspls.导致开花早和花序异常,反之,抑制AtSPL表达延迟了花卉过渡的发生[33.那34.那35.].SPLs作为一组转录因子,调控其他基因的表达。SPLs的大量下游基因已经被识别;例如,AtSPL3可以直接上调表达LFY.那富尔语和AP1.通过与它们的启动子结合[36.那37.那38.].然而,除了蛋白质- dna相互作用外,转录因子还通过形成蛋白质复合物影响植物的生长发育。例如,MYB-bHLH-WD40/WDR (MBW)复合物调控花青素生物合成的晚期基因,影响苹果果实品质[39.那40,并调节毛状体在拟南芥[41.].两种转录因子,AT-HOOK MOTIF NUCLEAR localizationprotein 3/4,调节拟南芥根原形成层和木质部组织边界的形成[42.].很少有研究调查是否有其他因素与SPLs相互作用并影响它们的结合能力,特别是在树木中。SPLs在木本植物中的作用尚处于起步阶段。
努力研究“Bairihua”中开花过程的分子机制,我们评估了在开花过程中是否存在参与SPL调节的蛋白质相互作用。作为解决这个问题的第一步,我们孤立并表征了SPL9.从“白日花”同源基因中提取基因,并进行植物原生基因表达分析。然后通过异位表达实验检测该基因推定的功能。该基因在拟南芥中表现出相似的表达模式和诱导花器官发育和早期开花的能力。这项研究的结果表明CbuSPL9在功能上保守。通过筛选CBUSPL9相互作用蛋白来发现建筑TF CBUHMGA。CbuHMGA参与“Bairihua”的花器官发展,但不在制定开花时间。这些结果为研究“Bairihua”开花的分子机制提供了分子基础,为常年的花卉过渡的研究提供了研究方向。
方法
植物材料
c .文艺是一棵多年生树,通常在30天开花时期花。但是,“Bairihua”,新品种c .文艺,发现于中国河南省,并经国家林业和草原局(http://www.forestry.gov.cn/).一朵花的开花时期约为15天,其累积开花期达到100天,这对于木本植物来说是非常罕见的。从2017年1月15日至4月2日,我们收集了FB和LB品种的第一轮腋芽。在休眠和发芽期间每10天收集样品。由于“Bairihua”的花卉过渡在7至10天内完成,因此每天在花卉过渡期间收集样品,并且在生殖生长阶段每5天收集样品。用于RNA提取的样品用蒸馏水洗涤,立即在液氮中冷冻,并储存在-80℃。组织学分析的样品在福尔马林中固定:冰醋酸:70%乙醇(5:5:90体积; FAA)溶液在真空下至少24小时。我们研究中的所有植物材料收集都符合国家指南。我们所取得的田间实验符合当地立法。优惠券标本沉积在中国林业学院林业研究所。 Dr. Wenjun Ma and Dr. Junhui Wang undertook the formal identification of the samples.
组织学分析
对于组织学分析,将样品浸入Faa固定剂中并在4℃下真空置于真空下。将样品在梯度乙醇中脱水,然后嵌入石蜡中。10毫米厚的部分(RM2255全自动旋转式显微电汇;徕卡,德国)用Safranine O和Fast Green FCF(Sigma-Aldrich,USA)染色。使用Leica DM 6000B全自动立式显微镜(Leica Microsystems GmbH,Wetzlar,Germany),观察和拍摄切片。
克隆CbuSPL9和CbuHMGA“Bairihua”的序列
使用RNA提取试剂盒(Takara)从突变体的芽中提取来自“Bairihua”的RNA,并用无RNase--TADNA(Takara)除去污染DNA。将一个或两个微克总mRNA模板加入到寡码(DT)18引物中并通过M-MLV拉热酶(Takara)反转转录成单链cDNA。全长cDNACbuSPL9根据制造商的说明,通过使用(Takara)来克隆3'-race和5'竞赛。在3场比赛中,CbuSPL9基于已发布和对齐的基因特异性前引物F1 / F2设计SPLNCBI的序列(http://blast.ncbi.nlm.nih.gov/Blast.cgi).F1紧靠F2的上游嵌套。试剂盒提供3 ' -cDNA合成引物。PCR产物克隆到PMD18-T载体并测序。CbuSPL9s用爆炸确定了。在5'族中,基因特异性反向引物R1 / R2(附加文件1)是根据3 ' -RACE的序列设计的。R2直接嵌套在R1的上游。PCR产物克隆到PMD18-T载体并测序。
“白日花”cDNA文库的酵母双杂交(Y2H)筛选
将休眠期、萌发期、花转换期、生殖生长期各期的“白日花”芽(采集“白日花”第一轮腋芽)等量汇集在一起。将四个时期的“白日花”花蕾的总RNA混合,提供mRNA样本。由Oebiotech(中国上海)将cDNA文库从mrna样本克隆到pGADT7载体,构建了酵母文库。CbuSPL9插入PGBKT7矢量。使用PGBKT7进行酵母文库的筛选CbuSPL9.相应的引物列于附加文件中1.转化细胞在补充有TRP的SD培养基上生长。将转化体筛选在缺乏Leu,TRP,His和Ade的补充SD培养基中,并补充有X-A-Gal和Aureobasidin A.将平板在30℃下温育48-72小时并拍摄。用PGBKT7载体共识引物验证阳性克隆。阳性对照交配如下:Y2HGOLD中的PGADT7-T和Y187中的PGBK-53。阴性对照配合如下:在Y187中的Y2HGOLD和PGBKT7-LAM中的PGADT7-T。
亚细胞本地化
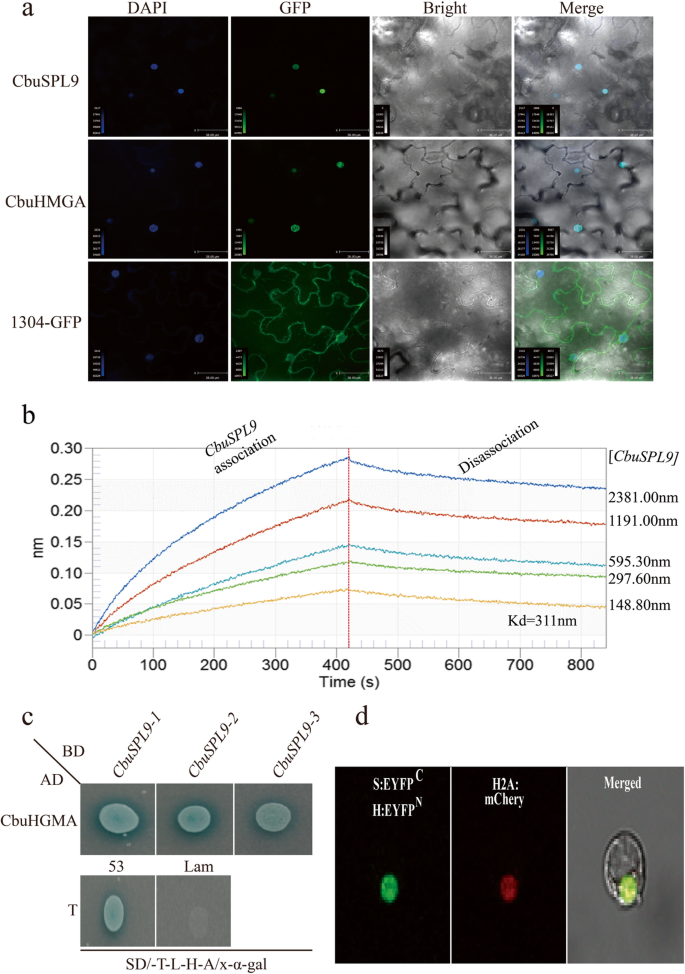
为验证亚细胞定位,将其全长编码序列(无终止密码子)CbuSPL9和CbuHMGA从RT-PCR从“Bairihua”芽的RNA中扩增。PCR产品CbuSPL9和CbuHMGA使用无缝装配克隆套件(克隆斯马特,北京,中国)连接到载体PCAMBIA1304。构建CbuSPL9/CbuHMGA-GFP融合基因由CAMV35S启动子驱动。PCAMBIA1304-GFP用作阳性控制。瞬态表达向量CbuSPL9“绿色荧光蛋白”,CbuHMGA-GFP和GFP-HDEL注入叶片下表皮细胞中烟草农杆菌转化L.。转化细胞孵育2天。取下叶片,切成方块,浸泡在含1 g mL的PBS缓冲液中- 1DAPI染色细胞核。在UltraVIEW VoX 3D活细胞成像系统旋转盘共聚焦激光扫描显微镜(PerkinElmer, Waltham, MA, USA)下观察CbuSPL9/CbuHMGA-GFP融合蛋白的瞬时表达。GFP激发波长为488 nm, DAPI激发波长为405 nm。
BiFC分析
确定和可视化CbuSPL9和CbuHMGA在原生质体中的相互作用杨树trichocarpa,基于分裂式EYFP进行BIFC测定。EYFP与CBUSPL9的C末端和CBUHMGA的N-末端融合,导致CBUSPL:EYFPC和CBUHMGA:EYFPN..阳性的EYFP信号表示EYFP相互作用C和Eyfp.N.由于CbuSPL9与CbuHMGA的异质二聚。CbuSPL: EYFPC用CBUHMGA进行COTRANSFECTED:EYFPN.和H2A:mCherry进入原生质体。在UltraVIEW VoX 3D活细胞成像系统旋转盘共聚焦激光扫描显微镜(PerkinElmer, Waltham, MA, USA)下观察CbuSPL9/CbuHMGA-GFP融合蛋白的瞬时表达。
•比奥雷的绯闻干涉法测定
CBUSPL9作为C末端GST标记的构建体克隆到PGEx6P-1中,通过测序确认构建体。将CBUHMGA克隆到PET28a中作为N-末端6his标记的构建体,通过测序确认构建体。使用如上所述的EMCV-3C和RV-3C的方法纯化蛋白质。CBUHMGA和CBUSPL9之间的实时相互作用被监测为基于BLI的八位型Qk(Forte-Bio)。BLI用于确定解离常数(kD.)以及开关率(k在和k从),用于HIS-CbuHMG与GST-CbuSPL1结合。
生物信息分析
采用MEGA6.0软件进行多序列比对和系统发育分析。对齐后,利用邻接(NJ)方法计算其演化历史。这棵树是从1000次自举复制中推断出来的,以显示基因的进化史。MEME在线工具(http://meme-suite.org/tools/meme.)用于鉴定CBUSPL9蛋白的基序。MEME与以下参数在本地运行:重复次数= MOTIFS = 20的任何和最大数量。通过域分析程序智能(简单的模块化架构研究工具)检查所有候选蛋白序列(http://smart.embl-heidelberg.de/).CBUSPL9已提交给PSRNATarget服务器(http://plantgrn.noble.org/psrnatarget/),其期望值< 3。CbuSPL9不超过4个错配和互补区域内的G/U对被认为是miRNA靶标。
RNA提取和定量实时PCR
从白日花不同发育阶段的芽中分离到总RNA。RNA的纯度和质量由NanoDrop8000 (Thermo Fisher Scientific, Waltham, MA, USA)检测,并进行凝胶电泳分析。使用SuperScript III逆转录试剂盒(Invitrogen公司)和随机引物,按照说明书,以~ 1 μg RNA合成第一链cDNA。引物采用Primer 3在线设计。引物的熔化温度为60℃,扩增长度为100 ~ 200 bp。所有的引物都在附加文件中列出1.Real-time qRT-PCR was performed on a Roche LightCycle 480 Real-Time PCR System (Roche Applied Science, Germany) using a SYBR Premix Ex Taq™ Kit (TaKaRa, Dalian, China) according to the manufacturer’s instructions using a 20 μl reaction volume (10 μl of 2× SYBR Premix, 2 μl of cDNA templates as prepared above and 1 μl of each specific primer to a final concentration of 200 nM) [43.].用2-ΔΔct方法。肌动蛋白用作内部对照,每次反应一次进行[1].将茎表达值设置为1。U6作为内源性控制被放大[44.].所有引物都显示在附加文件中1.我们检测表达(CEG)的相关性CbuSPL9/miR156,使用Pearson相关系数。Pearson相关系数由COR()计算,使用r中三个重复的平均相对表达式。Pearson相关是一个介于- 1和1之间的数字。0表示不相关,负值为负相关,正值为正相关[45.].
瞬态过度表达拟南芥
全身的CbuSPL9和CbuHMGA在花椰菜花叶病毒35S启动子的调控下,以感觉定向的方式克隆到二元载体pBI121 (BD Biosciences Clontech, USA)中。转基因植株用35S:CbuSPL9和35 s:CbuHMGA通过农杆菌肿瘤术GV3101采用花浸法。T1种子经表面消毒后,在含30 μg mL的0.5 × MS固体培养基上生长- 14°C下湿霉素处理2 d, 22°C下长日(16 h光照/8 h暗)处理10 d转入温室。随后,将幼苗移栽到土壤中。在T1代观察到转基因植株的表型,并观察到转基因植株的过表达CbuSPL9和CbuHMGAPCR基因分型证实了转基因植株的基因表达(附加文件)2和3.).每个构建至少观察到10个表型相似的转基因株系,其中3个进行详细分析[1].
开花时间测量
植物在22℃长日照条件下(16 h光照/8 h黑暗)在温室土壤上生长。开花时间通过计数莲座丛叶片总数和播种至花芽形成的天数来测定。对20株左右的莲座叶数进行了统计,并取平均值。使用Win-Excel对数据进行分类,并使用SPSS(8.0版,SPSS Inc., Chicago, IL, USA)统计软件包进行方差分析。两种治疗方法之间的比较使用Tukey的检验,其概率水平为P.< = 0.05 (46.那47.].
结果
与开花有关的cDNASPL是从《白日花》中克隆出来的
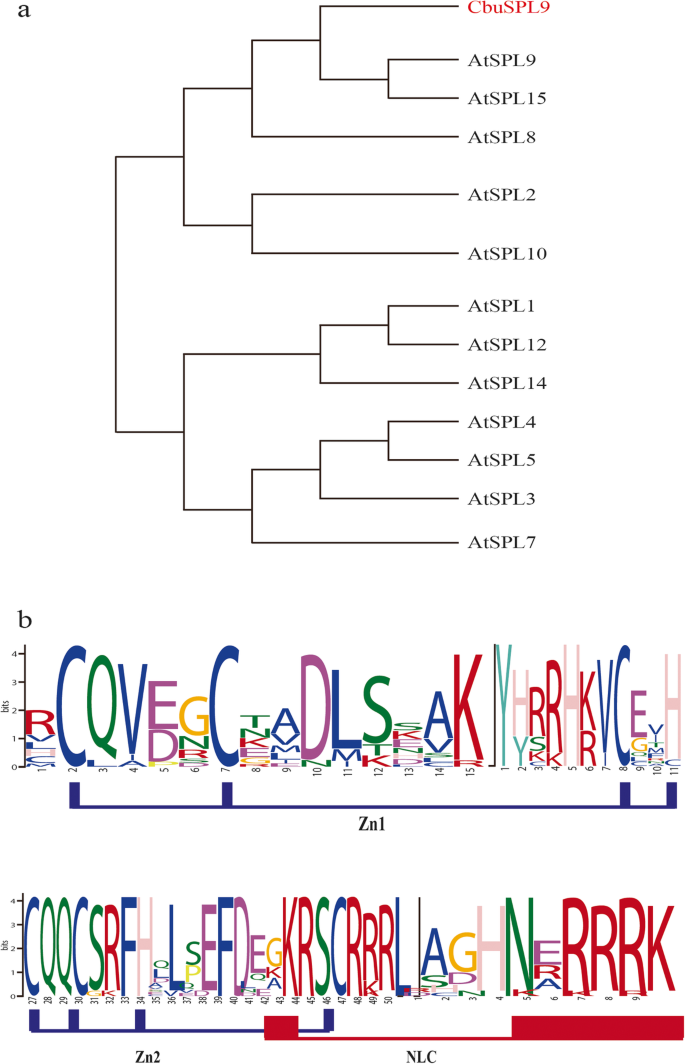
全身的互补的SPL从c .文艺通过使用基于同源性的克隆和种族技术分离。孤立的保守序列被基因组行走延伸以获取全基因组序列(外显子和内含子)。其中一种分离的序列编码了一种蛋白质,其具有典型的SPL蛋白质结构,其包括高度保守的SBP盒结构域,其中含有两个锌结合位点和一个二分核定位信号[6.那19.那48.](附加文件4.).第一个Zn-指状结构(图1中的Zn-1)。1a)为c3h型,第2(图中Zn-2)。1C2HC-type)。核定位序列(NLS)是位于SBP c端高度保守的二部域。系统发育分析表明,分离的序列与AtSPL9和AtSPL15聚类(图。1b).因为它具有更多的序列相似性AtSPL9,我们命名为SPL同源基因CbuSPL9.和CbuSPL9预计是miR156的目标(附加文件5.),这与以前的报告一致SPL在涉及开花过程的拟南芥中。
的表达CbuSPL9在开花过程中
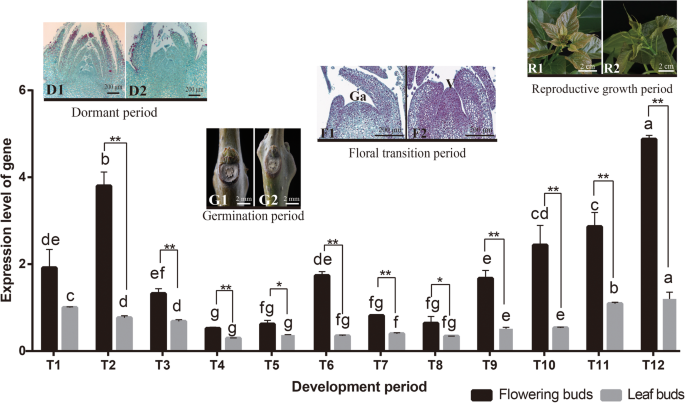
进行了密集抽样调查CbuSPL9开花过程中的表达(图。2).T1-T3的测定是基于“Bairihua”,芽的当前状态的挥发性,以及顶端商品的形态。T1-T3卵泡中的芽覆盖着厚厚的硬芽鳞片,其形态没有显着差异,观察到开花芽(FBS)和叶芽(LBS)之间观察到。T4-T5是萌发期。“Bairihua”的发芽期一般于3月初开始,当芽逐渐剥离硬芽秤,并揭示了柔软的红棕色尖端。
表达谱的CbuSPL9在花芽和叶芽的发育期c .文艺.T1-T3为休眠期采集的花芽和叶芽;T4-T5为萌发期采集的花芽和叶芽;T6-T9为花过渡时期采集的花芽和叶芽;T10-T12为生殖期采集的花芽和叶芽。D1:休眠期花芽图像;D2:休眠期叶芽图像;G1:萌芽期花芽图像;G2:萌发期叶芽图像;F1:花期转换期花蕾切片; note the flat generative apex (Ga); F2: Section of leaf buds in floral transition period, note the bulged vegetative apex (V); R1: Image of flowering buds in the reproductive period; and R2: Image of leaf buds in the reproductive period. Notably, even though floral transition was never observed in the leaf buds, the leaf buds collected in the period corresponding to floral transition are henceforth called F2 and R2 for convenience. Error bars indicate SD from three independent biological replicates. *Difference between flowering buds (black) and leaf buds (gray) is significant (Student’s test;P. < 0.05). **Difference between flowering buds (black) and leaf buds (gray) is highly significant (Student’s test;P.< 0.01)
在此期间,FBs和LBs的内部形态相似。T6-T9为短发芽期,为花的过渡期,在此期间,花原基和叶原基分别在FBs和LBs中发育。最后,T10-T12为生殖生长期。的表达水平CbuSPL9在休眠期和繁殖生长期,FBs显著高于LBs。microRNA 156 (miR156)调控开花的经典模型及其靶向SPLS.[35.那49.那50.].在“白日花”开花过程中,miR156在LBs中的表达量显著高于FBs,并随着年龄的增长逐渐降低。从总体趋势来看,CbuSPL9和mir156表现出负相关性R. < − 0.8 (Additional file6.).在T6-T12期,FBs的表达水平远高于LBsAtSPL目标基因同源。结果表明CbuAP1和cbuleafy.与CbuSPL9在FBs中从T6周期到T12周期(附加文件7.).总的来说,表达研究支持这一点CbuSPL9为SPL同源基因,参与开花调控。
过度的CbuSPL9在拟南芥
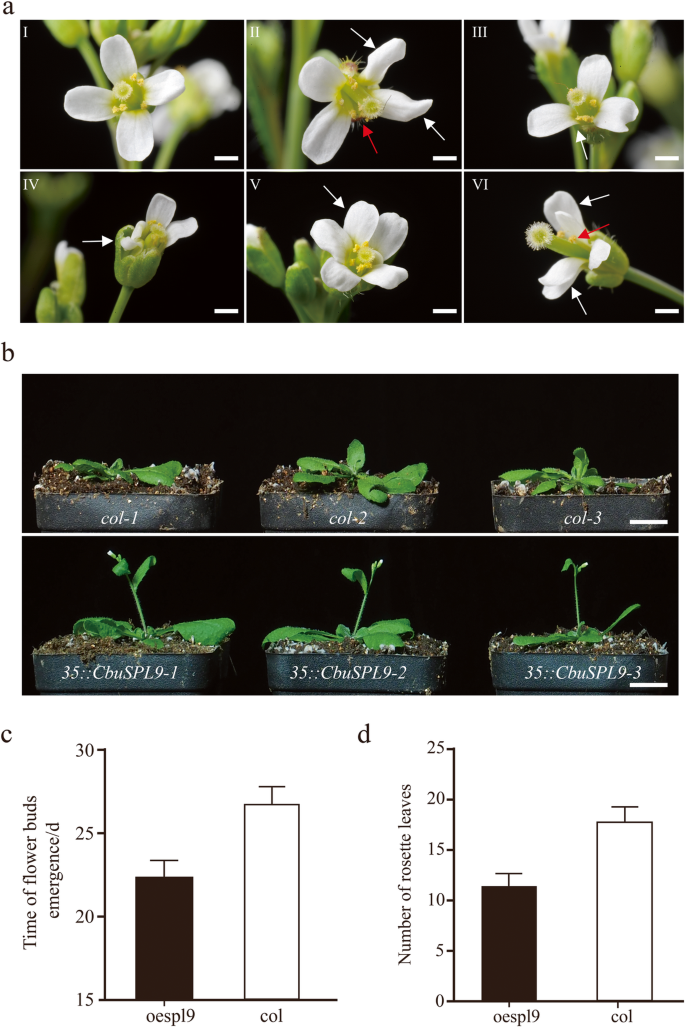
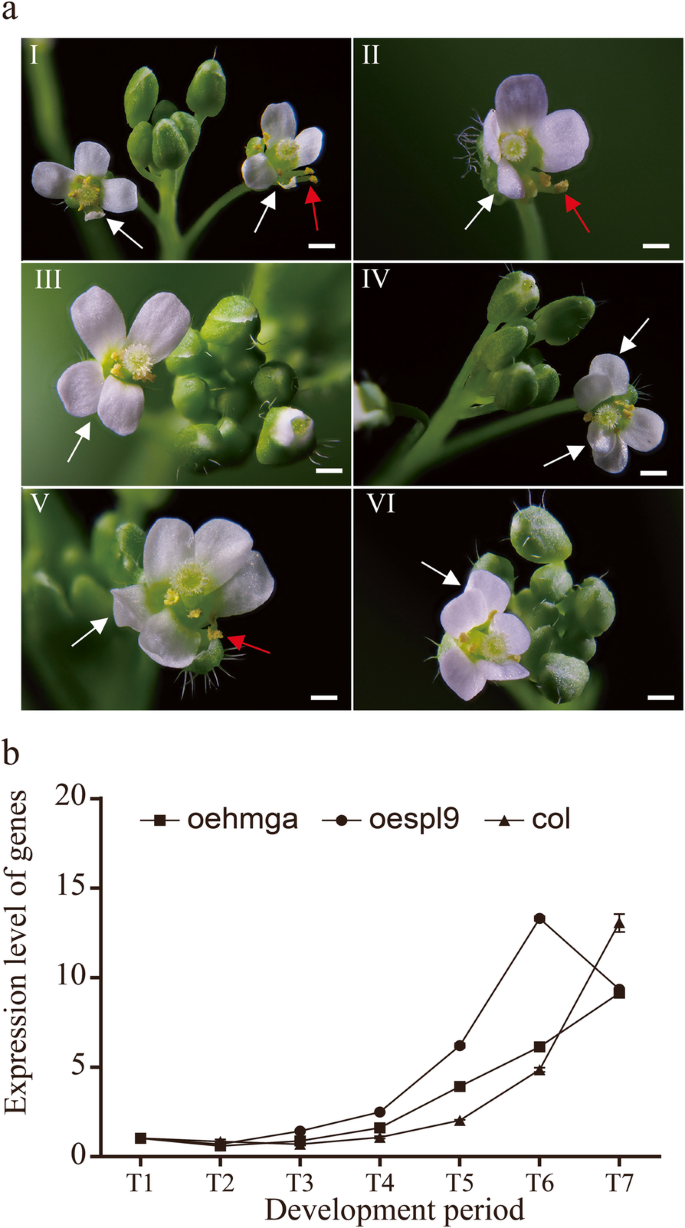
因为没有可用的转换系统c .文艺那CbuSPL9在拟南芥(哥伦比亚生态型,col)中过表达。的花上校是四腹状的,并在交叉类型中有四个花瓣(图。3.人工智能)。相比之下,oe-spl9.转基因植物显示异常的花器官(附加文件8.).的oe-spl9.转基因株系的花器官在数量和位置上都发生了变化,如花瓣萎缩、雄蕊增多和花瓣重叠。3.AII-VI)。除了明显的花器官形态的变化外,在开花时间的加速度还观察到oe-spl9.行(无花果。3.b,附加文件9.).的上校当14个莲座叶片存在时,株系开始开花。3.C)。然而,oe-spl9.抽薹时莲座叶片少于9片(图。3.d).这一结果表明CbuSPL9是守恒的。的调节机制CbuSPL9“白日花”中可能与拟南芥中相似。
过表达突变体的表型CbuSPL9.一种花卉器官的变化发生在CBUSPL9过表达转基因拟南芥系中。一朵正常花的图象从col的。作为控制(A / I);和来自OESPL9(A / II-VI)的花器官突变体。A / II显示缩小的花瓣(白色箭头)和增加的雄蕊(右箭头);A / III显示损失花瓣(白色箭头);A / IV显示损失花瓣(白色箭头);A / V显示增加的花瓣(白色箭头);A / VI显示重叠的花瓣(白色箭头)和损失雄蕊(右箭头);B.col和oespl9转基因植株开花表型的比较。从上到下:col(对照)和oespl9(转基因植物)。bar = 2 mm in (a/II-VI), 1.5 cm in (B.).C和D.是花蕾的统计数据出现和莲座叶的数量。OESPL9转基因植物(黑色),OE-HMGA转基因植物(灰色)和COL。植物(白色)。平均总共30株植物以获得平均值。误差栏表示SD
筛选CBUSPL9-相互作用的蛋白质
作为TF,已经广泛地进行了SPL-DNA相互作用研究。然而,TFS还可以通过蛋白质相互作用微调特异性生物过程。我们建造了A.c .文艺酵母双杂交cDNA文库,探索与之相互作用的蛋白质CbuSPL9.在QDO/Aba/X-a-Gal平板上共获得809个代表潜在阳性克隆的蓝色菌落。对文库质粒进行PCR检测,有406个阳性克隆。对得到的PCR产物进行测序,并利用NCBI BLASTp搜索功能对序列进行比对。最终鉴定出12个相互作用的候选蛋白(见表)1).预测蛋白包括HMGA、水通道蛋白、bHLH48、gata相关蛋白、PHD指蛋白ALFIN-LIKE 4、重金属相关蛋白等。
克隆的HMGA基因
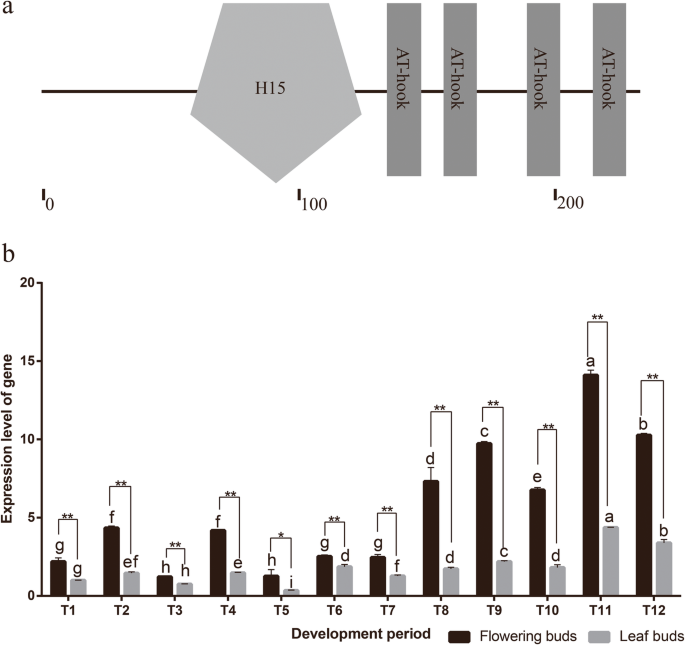
在这些候选蛋白中,HMGA是一种富含AT-hook的蛋白,属于细胞核中含量最丰富的非组蛋白家族。我们克隆了它的全长HMGA通过CDNA末端快速扩增的同源基因。系统发育分析显示,该蛋白质与Athmga具有密切的关系。因此,将该蛋白质更名为CBUHMGA。CbuHMGA编码H15结构域和4个钩子图案(图。4.a).表达分析表明,的表达趋势CbuHMGA与那样类似于CbuSPL9在《白日花》的四个时期(图。4.b).表示CbuHMGA在休眠期升高,在生殖增长期中检测到最高表达水平。但是,表达的增加CbuHMGA在生殖生长期前发生的时间略早于CbuSPL9.
的序列和表达谱分析CbuHMGA.一种CBUHMGA蛋白智能序列分析。B.表达分析CbuHMGA在开发期间开花芽和叶芽之间。T1-T3为休眠期采集的花芽和叶芽;T4-T5为萌发期采集的花芽和叶芽;T6-T9为花过渡时期采集的花芽和叶芽;T10-T12为生殖期采集的花芽和叶芽。值得注意的是,即使在叶芽中从未观察到花卉过渡,则在对应于花卉过渡的时期收集的叶芽是为了方便起见,因此称为花卉过渡期和生殖时期。误差条表示三个独立实验的SD。*开花芽(黑色)和叶芽(灰色)之间的差异是显着的(学生的测试;P. < 0.05). **Difference between flowering buds (black) and leaf buds (gray) is highly significant (Student’s test;P.< 0.01)
CBUSPL9和CBUHMGA蛋白的定位
我们在CbuSPL9和CbuHMGA的c端融合了GFP,并将其转化为烟草benthamiana叶表皮细胞中CbuSPL9和CbuHMGA蛋白的定位。35S:GFP作为对照。CbuSPL9-GFP和CbuHMGA-GFP中的GFP荧光只在细胞核中观察到,而对照组中GFP的荧光分布在整个细胞中(图)。5.一种)。这些结果表明,CBUSPL9和CBUHMGA位于细胞核中。该结果与基于蛋白质结构的预测一致。
两种蛋白质CBUSPL9和CBUHMGA之间的相互作用.一种CBUSPL9蛋白和CBUHMGA蛋白的核定位。GFP(对照)基因,CBUSPL9-GFP融合基因和CBUHMGA-GFP融合基因瞬时表达烟草benthamiana叶片表皮细胞,观察共聚焦显微镜。DAPI,DAPI用于核染色图像;GFP,GFP绿色荧光图像;合并,明亮场,GFP和DAPI染色的合并图像。B.GST-CBUSPR9与HIS-CBUHMGA的结合,GST-CBUSPR9浓度为2381.00nm,1191.0nm,595.30nm,通过实时Biolayer干涉测量评估的297.60nm,148.80nm。CCbuSPL9和CbuHMGA相互作用的酵母双杂交试验。CbuHMGA(作为猎物)与pGADT7中的GAL4激活域(AD)融合,而CbuSPL9(作为诱饵)与pGBKT7中的GAL dna结合域(BD)融合。阳性对照为pGADT7-T和pGBK-53。阴性对照为pGADT7-T和pGBK-Lam。在SD/−Trp/−Leu/−His/−Ade/X-α-gal培养基上显示为蓝色。D.来自原生质体中的BIFC分析的共聚焦图像p . trichocarpa.CBUSPR9与EYFP融合C, CbuHMGA与EYFP融合N..经H2A:mCherry和CbuSPL9:EYFP转染的S1-21原生质体细胞核中检测到EYFP信号C与(a)cbuhmga:EyfpN..柱= 50 μm
蛋白质相互作用分析
Biolayer干涉测量(BLI)[51.用来确定解离常数(kD.)以及开关率(k在和k从)的HIS-CbuHMGA绑定到GST-CbuSPL9(表2).评估五种不同浓度的GST-CBUSPR9(2381.00nm,1191.00nm,595.30nm,297.60和148.80nm),kD.为311 nm。这些结果表明CbuSPL9和CbuHMGA之间有很强的相互作用(图。5.b)。
为了证实这些相互作用,用全长cDNACbuSPL9插入载体pGBKT7(BD-CBUSPR9)作为诱饵,以及全长cDNACbuHMGA作为猎物插入载体pGADT7 (AD-CbuHMGA)。含有AD-CbuHMGA和BD-CbuSPL9的酵母菌株在合成定义的(SD)/−Trp/−Leu/−His/−Ade培养基上生长时,X-α-gal活性呈阳性(图2)。5.c).这些结果表明CbuSPL9与酵母中的HMGA相互作用。最后,进行了双分子荧光互补(BiFC)分析。CbuSPL: EYFPC用CBUHMGA进行COTRANSFECTED:EYFPN.和H2A:mCherry进入原生质体。增强黄色荧光蛋白(EYFP)信号与mCherry共定位(图。5.d).我们共同证明了CbuSPL9与CbuHMGA在细胞核中形成一个异源二聚体。
过度的CbuHMGA在拟南芥
表示…的势函数CbuHMGA,我们过表达了CbuHMGA在拟南芥。的OE-HMGA.转基因株系发育出异常的花(如图。6.aI-VI)。该突变体的表型与花器官的表型相似CbuSPL9过度表达(附加文件10.).然而,开花时间不受影响OE-HMGA.转基因线与此相比上校线(额外的文件11.).内源性的表达AtSPL9为进一步监测转基因株系的花发育进行了深入研究。在采样周期内,的表达水平AtSPL9不断增加OE-HMGA.和野生型。然而,在oe-spl9,的表达AtSPL9在T6中达到峰值,然后下降(图2)。6.b).转变AtSPL9表达oe-spl9,但不是在oe-hmga,进一步证实了观察CbuHMGA不能加速花朵发展,而CbuSPL9能促进花朵发育.
过表达突变体的表型CbuHMGA.一种花动器官的变化发生在CBUHMGA转基因拟南芥系过表达中。图像是来自OE-HMGA转基因拟南芥(A / I-VI)的花器官突变体。a /我显示缩小的花瓣(白色箭头);A / II显示错位花瓣(白色箭头)和分离雄蕊(红色箭头);A / III显示错位花瓣(白色箭头);A / IV显示重叠的花瓣(白色箭头);A / V显示增加的花瓣(白色箭头)和损失雄蕊(红色箭头);A / VI显示增加的花瓣(白色箭头);条= 2 mm(a / i-vi)。B.OESPL9转基因植物中ATSPR9同源基因的表达谱,OE-HMGA转基因植物和Col。 为oe-hmga的PCR结果;
为oe-hmga的PCR结果; 为oespl9的PCR结果;和
为oespl9的PCR结果;和 分别进行3个独立的生物学重复,每个重复测量3个重复。误差棒显示了三个技术重复结果的标准偏差
分别进行3个独立的生物学重复,每个重复测量3个重复。误差棒显示了三个技术重复结果的标准偏差
讨论
开花是一个非常复杂的过程,具有更高植物的生命史的定性变化,以及植物开发中的中央环节。“Bairihua”,各种开花多年生木本植物c .文艺,花量大,花期长。“白日花”是评价树木开花过程的优良材料。
SPL在许多植物中,最显著的是在拟南芥中,它在调节开花方面发挥着重要作用。在木本植物中,SPLS.被广泛研究,但关于开花的信息是有限的[25.那26.那28.那52.那53.].在这里,我们克隆了SBP域编码基因CbuSPL9在文艺。其保守的结构,花卉发展相关的表达趋势和与mir156的相关性,CbuAP1和cbuleafy.表明,CbuSPL9可能会被保守SPL9.函数文艺。此外,异质性的过度表达CbuSPL9在拟南芥中加速花的发育,导致花器官异常。
转录因子可以通过与其他转录因子形成复合物来影响生物过程。然而,大多数关于SPLs的研究都集中在它们与DNA基序的相互作用上[36.那37.那38.].可以直接与SPLS相互作用并参与花调节的蛋白质在很大程度上是未知的。为了进一步洞察力,我们筛选了芽中CBUSPL9的酵母杂交文库。检测到许多开花相关的蛋白质,例如,与Gata相关的蛋白质[54.那55.那56.那57.],bhlh48 [58.佛罗里达州][59.和PHD指蛋白ALFIN-LIKE [60.].此外,鉴定了高迁移率组(HMG)蛋白CBUHMGA与CBUSPL9直接相互作用。BIFC测定和BLI测定进一步证实了它们的相互作用。BIFC测定表明CBUSPL9和CBUHMGA可以在细胞核中形成蛋白质复合物。
Chuhmga包含一个H15域和4个钩子图案。在大多数植物HMGA蛋白中证实了这种类似的结构描述,其编码了四个四个钩子图案[61.那62.].此外,植物HMGA蛋白的氨基末端区域与组蛋白H1的dna结合区域具有显著的同源性[63.那64.].ChuHMGA蛋白具有高度保守的结构。HMGA是一个架构TF [65.那66.那67.].它通过控制某些基因启动子at富区多蛋白复合物的形成来调控体内的基因表达[63.那64.那66.那68.那69.].到目前为止,已经从大豆、水稻、玉米和拟南芥中分离出了一些HMGA蛋白[70那71.那72.那73.那74.那75.].又报告了钩状基序,钩钩蛋白也影响开花过程[71.那75.那76.].然而,关于HMGA在木本植物中的相互作用蛋白及其功能的研究还很少。在《白日花》中,表达CbuHMGA在休眠期升高,在生殖增长期中检测到最高表达水平。结果与拟南芥中的结果一致。虽然OE-HMGA.转基因株系未表现出开花时间表型,花器官突变OE-HMGA.与那相似oe-spl9.转基因线。
HMGA蛋白在生物过程中具有重要作用,并与不同的转录因子相互作用[66.那67.].其内在的灵活性允许HMGA蛋白参与特定的蛋白质- dna和蛋白质-蛋白质相互作用,诱导染色质的结构变化,并在基因的启动子/增强子区域形成被称为“增强体”的立体特异性复合物,这些复合物的转录由HMGA蛋白调控。染色质结构的变化影响转录因子与启动子/增强子区域结合的能力[61.那70那76.那77.那78.那79.].本研究结果提示,CbuHMGA与CbuSPL9的相互作用可能会增强或减弱CbuSPL9与相应DNA序列或下游蛋白的结合能力,从而影响开花过程。需要进一步的实验来检验这一假设。例如,在拟南芥突变体中过表达一个基因,揭示了CbuSPL9与CbuHMGA在拟南芥开花过程中相互作用的pstream和下游关系Caltalpa文艺.
结论
“白日花”为我们深入了解木本植物的开花过程提供了宝贵的机会。我们的研究表明SPLS.在多年生乔木和拟南芥中可能具有相似的结构和调控机制。通过对CbuSPL9相互作用蛋白的筛选,不仅为CbuSPL9调控途径的研究提供了额外的蛋白,而且还发现了CbuSPL9与CbuHMGA的相互作用。OE-HMGA.表现出影响花器官发育但不改变开花时间的表型。这一结果表明CbuSPL9影响开花的过程是一个复杂的过程,而且CbuHMGA参与花器官的发育,但不参与花期的调节。
数据和材料的可用性
支持文章结论的数据已作为其他文件上传。
参考文献
- 1。
荆D,夏y,陈F,王Z,张某,王J.王建国的异位表达(Bignoniaceae)Pistillata同源物拯救了拟南芥PI-1突变体的花瓣和雄蕊特征。植物SCI。2015; 231:40-51。https://doi.org/10.1016/j.plantsci.2014.11.004.
- 2。
王志强,王志强,王志强,等。植物开花时间的相互作用机制及其多样性研究进展。植物细胞。2002;14(增刊):S111-30。
- 3.
JM, Hanzawa Y, Hall MC, Moore RC, puruganan MD.拟南芥开花时间基因网络的群体基因组学。生物化学学报2009;26:2475-86。
- 4.
Fornara F,De Montaigu A,Concland G. Snapshot:控制拟南芥的开花。细胞。2010; 141:3-5。
- 5。
【关键词】拟南芥;开花时间;基因网络;核酸Res. 2016;44: D1167-71。
- 6。
王军。mir156介导的年龄通路对开花时间的调控。J Exp Bot. 2014; 65:4723-7430。
- 7。
Eriksson S.Ga4是在叶状转录和拟南芥的植物中的活性吉布林素。在线植物细胞。2006; 18:2172-81。https://doi.org/10.1105/tpc.106.042317.
- 8.
李志强,李志强,李志强,等。通过特征新的番茄前角突变体揭示不依赖della的赤霉素反应。植物细胞。2015;27:1579 - 94。
- 9.
Cao D,Cheng H,Wu W,Soo HM,Peng J.Gibberellin调动不同的Della依赖的转录om,调节拟南芥的种子萌发和花卉发育。植物理性。2006; 142:509-25。
- 10。
于松,张永春,张天强,郝永华,等。赤霉素通过mir156靶向的SQUAMOSA启动子结合样转录因子调控拟南芥的成花转变。植物细胞。2012;24:3320-32。https://doi.org/10.1105/tpc.112.101014.
- 11.
Matsubara K,Ogiso-Tanaka E,Hori K,EBANA K,ANDO T,Yano M. HD17的自然变化,拟南芥ELF3的同源物涉及水稻光周期开花。植物细胞生理。2017; 53:709-16。
- 12.
王H,Pan J,Li Y,Lou D,Hu Y,Yu D. Della-Constans转录因子级联与光纤酸和光周期信号传导整合到调节开花。植物理性。2016; 172(9月):479-88。
- 13。
张志强,张志强,张志强,等。拟南芥花器官发育过程中碳分布的光周期调控。植物细胞。2014;26:565 - 84。
- 14。
春化介导的非编码RNA的表观遗传沉默。科学。2011;331:76。
- 15.
Kim DH,Sung S通过拟南芥中的VIN3和FLC基因家庭监管网络协调vernalization响应。植物细胞。2013; 25:454-69。
- 16。
黄湾,钱P,高路,沉J,侯S.Fackel与甘蓝酸信号和春化相互作用,在拟南芥中介导开花。Planta。2017; 245:939-50。
- 17。
辛普森GG。自主途径:表述和转录后基因调控在拟南芥开花时间中的控制。CurrOp植物BIOL。2004; 7:570-4。
- 18.
Unte我们。SPL8:影响拟南芥花粉囊发育的SBP-box基因。植物学报2003;15:1009-19。
- 19.
Preston JC,Hileman LC。植物鳞状促进剂结合蛋白样(SPL)基因家族的功能演变。前植物SCI。2013; 4(四月):1-13。https://doi.org/10.3389/fpls.2013.00080.
- 20.
郑JH,李HJ,刘jy,朴cm。SPL3/4/5将发育衰老和光周期信号整合到拟南芥开花FT-FD模块中。摩尔。2016;9:1647-59。https://doi.org/10.1016/j.molp.2016.10.014.
- 21.
Casero D,Singh V,Wilson GT,Grande A,Yang H,Dodani Sc,等。转录组测序识别SPL7调节的铜采集基因来/ Fro5和拟南芥中铁稳态的铜依赖性。在线植物细胞。2012; 24:738-61。
- 22.
于宁,牛庆伟,吴克宏,蔡恩华。miR156/SPLs模块在拟南芥侧根发育中的作用植物j . 2015; 83:673 - 85。
- 23.
张晓霞,窦玲,庞超,宋敏,魏华,范绍峰。中国水稻SPL基因家族的基因组结构、差异表达及功能分析陆地棉.基因组学。2015;290:115-26。
- 24.
De Mao H,Yu LJ,Li Zj,Yan Y,Han R,Liu H等。基因组分析SPL系列转录因子及其对玉米中非生物胁迫的反应。植物基因。2016; 6:1-12。https://doi.org/10.1016/j.plgene.2016.03.003.
- 25.
lanenpaa M, Janonen I, Sopanen T, Porali I, Gardemeister M, holta - vuori M. silver birch (Betula pendula)的一个新的SBP-box基因BpSPL1。杂志。2004;120:491 - 500。
- 26.
徐志强,孙磊,周勇,杨伟,程涛,王军,等。梅花SQUAMOSA启动子结合蛋白(SBP)-box基因家族的鉴定与表达分析基因组学。2015;290:1701-15。
- 27。
韩华,刘刚,张军,张胜,蔡峰,鲍震,等。在拟南芥(Arabidopsis thalius acerifolia)中,4个SQUAMOSA启动子结合蛋白(PROMOTER BINDING PROTEIN-LIKE)同源基因表现出不同的表达模式和诱导早花的能力。Trees - Struct Funct. 2016; 30:1417-28。
- 28。
Li C,Lu S. Populus Trichocarpa中SPL基因家族的分子表征。BMC植物BIOL。2014; 14:131。
- 29。
兴S,Salinas M,Garcia-molina A,HöhmannS,伯尔尼特·r,Huijser P.SPL8和MIR156目标SPL基因冗余调节拟南芥差动图案。工厂J. 2013; 75:566-77。
- 30.
兴S,Salinas M,Höhmanns,伯尔尼特·伯恩省P.Mir156针对性和不确定的SBP-Box转录因子,以确保拟南芥的男性生育率。植物细胞。2010; 22:3935-50。
- 31.
燕j,chia j-c,盛h,jung h,zavodna t-o,lu z等。拟南芥花粉生育需要转录因子Cit1和SPL7调节铜递送给花药和茉莉酸合成。植物细胞。2017年。https://doi.org/10.1105/TPC.17.00363TPC.00363.2017。
- 32.
在拟南芥中,SQUAMOSA启动子结合蛋白- like7是铜稳态的中心调控因子。植物学报。2009;21:347-61。https://doi.org/10.1105/tpc.108.060137.
- 33.
花的发育能力:对环境信号的年龄控制敏感性。植物杂志。2017;173:36-46。
- 34。
Poethig卢比。植物中的植物相变和芽成熟。Curr Top Dev Biol。2013; 105:125-52。https://doi.org/10.1016/B978-0-12-396968-2.00005-1.
- 35。
俞ñ,蔡wj,王某,山厘米,王lj,陈xy。MicroRNA156靶向SPL基因的滴毛体分布的时间控制拟南芥.植物细胞。2010; 22(7):2322-35。
- 36。
Yamaguchi A,Wu M-F,Yang L,Wu G,Poethig Rs,Wagner D. MicroRNA调节的SBP-Box转录因子SPL3是叶状,富含氟化物和Apetala1的直接上游活化剂。DEV细胞。2010; 17:268-78。
- 37。
Wang J, Czech B, Weigel D. miR156-Regulated SPL Transcription Factors Define an内源性开花途径[J]拟南芥.细胞。2009;138:738-49。
- 38。
吴g,poethig卢比。MIRR156及其目标SPL3拟南芥氨化植物拍摄开发的时间调节。发展。2006; 133:3539-47。
- 39。
谢XB,李士,张立雷,赵家,陈烨,赵Q等。BHLH转录因子MDBHLH3促进苹果低温的花青素积累和果实着色。植物细胞环境。2012; 35:1884-97。
- 40.
安晓华,田勇,陈克强,刘学军,刘德东,谢晓波,等。MdMYB9和MdMYB11参与了茉莉诱导的苹果花青素和原花青素生物合成的调控。植物生理学。2015;56:650-62。
- 41.
齐涛,宋胜,任强,吴东,黄辉,陈勇,等。在拟南芥中,茉莉酸- zim -结构域蛋白与WD-repeat/bHLH/MYB复合物相互作用,调控茉莉酸介导的花青素积累和毛状体启动。植物细胞。2011;23:1795 - 814。
- 42.
周J,王X,李吉义,李吉义。拟南芥根血管组织图案中的两个相互作用的钩子因子的细胞 - 细胞运动。植物细胞。2013; 25:187-201。
- 43.
舒W,刘y,郭y,周h,张j,zhao s.杨树Tir1基因家庭调查显示出差异表达模式和对1-萘酸和应激处理的反应。前植物SCI。2015; 6(9月):1-10。
- 44.
王志,朱涛,马伟,王宁,曲刚,张胜,等。利用高通量测序技术分析梓属长链非编码rna及其在花过渡中的潜在功能。BMC麝猫。2018;19:1-16。
- 45.
康成,刘铮。草莓草莓花和果实发育过程中长链非编码rna的全球鉴定与分析。BMC基因组学。2015;16:1-15。https://doi.org/10.1186/s12864-015-2014-2.
- 46.
Jung J,Seo Y,SEO PJ,Reyes JL,Yun J,Chua N等人。Gigantea -Regulated MicroRNA172介导拟南芥中的致康星系的光学环化开花。植物细胞。2007; 19(9月):2736-48。
- 47.
拟南芥内源抗坏血酸含量对开花时间的影响。植物杂志。2009;149(2):803 - 15所示。
- 48.
张淑玲。陆生植物SBP-box基因的进化与分化。BMC基因组学。2015;16:787。
- 49.
俞S,Lian H,王JW。植物发育过渡:MicroRNA和糖的作用。CurrOp植物BIOL。2015; 27:1-7。https://doi.org/10.1016/j.pbi.2015.05.009.
- 50。
王杰,Mee Yp,Wang Lj,Yeonjong K,Chen Xy,Detlef W,Poithig Rs。树木植物相变的miRNA控制。Plos Genet。2011; 7(2):E1002012。
- 51。
张Y,Mao D,Roswit Wt,Jin X,Patel Ac,Patel da,等。PARP9-DTX3L泛素连接酶靶向宿主组蛋白H2Bj和病毒3C蛋白酶,以增强干扰素信号传导和对照病毒感染。NAT IMMUNOL。2015; 16:1215-27。https://doi.org/10.1038/ni.3279.
- 52.
Castillo MC,Forment J,Gadea J,Carrasco JL,Juarez J,Navarro L等。鉴定含有柑橘中成人相转变的少年涉及幼年的转录因子。Ann Bot。2013; 112:1371-81。
- 53.
Tewari S, Buonaccorsi JP。初季诱导瘿虫顶端分生组织损伤对蔓越莓昆虫生殖和营养生长的影响昆虫学报。2013;106:1339-48
- 54.
Mara CD,爱尔兰VF。两个GATA转录因子是拟南芥花卉归气基因作用的下游效应。植物理性。2008; 147:707-18。https://doi.org/10.1104/pp.107.115634.
- 55.
丁L,燕S,江L,刘M,张j,zhao j等。Hanaba Taranu在黄瓜(Cucumis Sativus L.)中调节拍摄顶端分类和叶片发育。J Exp Bot。2015; 66:7075-87。
- 56.
Ding L,Yan S,Jiang L,Zhao W,Ning K,Zhao J等。Hanaba Taranu(HAN)在拟南芥的花发育过程中,通过针头,锯齿状,叶片叶片2和细胞蛋白氧化酶3桥梁和器官原界界限。Plos Genet。2015; 11:1-23。
- 57.
Zhang X, Zhou Y, Ding L, Wu Z, Liu R, Meyerowitz EM.转录抑制因子HANABA TARANU通过整合多种激素、花器官规范基因和GATA3家族基因调控拟南芥花发育。植物细胞。2013;25:83 - 101。
- 58。
Li Y Y, Wang H ., Li X ., Liang G ., Yu D.两个della互作蛋白bHLH48和bHLH60调控拟南芥长日开花。J Exp Bot. 2017; 68:2757-67。
- 59。
李家,玉米,耿利,赵J.毛茸茸的阿拉伯乳糖蛋白基因FLA3涉及拟南芥的微孔发育。工厂J.2010; 64:482-97。
- 60。
平移W-J,张J-S,TAO J-J,LU L,MA B,Li Q-T等。来自Atriplex Hortensis的阿灰类似物基因增强了转基因拟南芥中的盐和耐旱性和脱落酸反应。SCI批准。2018; 8:1-13。https://doi.org/10.1038/s41598-018-21148-9.
- 61。
drgan AI, Liggins JR, kline - robinson C, Privalov PL. HMGA1 at -hook与靶DNA特异性结合的能量学。中华医学杂志。2003;327:393-411。
- 62。
Klosterman SJ,洛杉矶哈德威格带有AT-hook基序的植物HMG蛋白。植物科学。2002;162:855 - 66。
- 63。
植物染色体HMGI/Y蛋白和组蛋白H1具有共同起源的蛋白结构域。基因。1999;230:1-5。
- 64.
Reeves R. HMGA蛋白的分子生物学:核函数中心。基因。2001; 277:63-81。
- 65.
HMGI/Y蛋白:转录和染色质结构的灵活调节。生物物理学报。2001;1519:13-29。
- 66.
Sgarra R, Zammitti S, Lo Sardo A, Maurizio E, Arnoldo L, Pegoraro S, et al.;HMGA分子网络:从转录调控到染色质重塑。Acta botanica sinica; 2010:37-47。
- 67.
特萨里MA,Gostissa男,Altamur S,Sgarra R,Rustighi A,萨尔瓦尼奥C,Caretti G,Imbriano C,曼托瓦尼R,德尔萨尔G,Giancotti V,Manfioletti G.转录激活细胞周期蛋白的由建筑转录因子HMGA2的基因.Mol细胞Biol。2004; 23:9104-16 ..
- 68.
Reeves R,Beckerbauer L. HMGI / Y蛋白:柔性稳压器和染色质结构。生物物理学报。2001;1519:13-29。
- 69.
韦伯斯特CI, Gray JC。编码豌豆高迁移群蛋白HMG-I/Y的单拷贝基因包含一个内含子,并在所有器官中表达。植物学报1997;35:987-92。
- 70.
Pierantoni GM,Rinaldo C,Esposito F,Mottolese M,SODDU S,Fusco A.高迁移率组A1(HMGA1)蛋白与P53相互作用并抑制其凋亡活性。细胞死亡有所不同。2006; 13:1554-63。
- 71.
肖超,陈飞,于旭,林超,傅宇飞。在拟南芥(Arabidopsis thaliana)中,过表达AT-hook基因AHL22可以延缓开花并抑制下胚轴的伸长。植物学报。2009;41:39 - 50。
- 72.
Zhao J, Paul LK, Grafi G.玉米HMGA蛋白定位于核仁,在体外可以在其球状结构域乙酰化,CDK磷酸化降低了其与富含at的DNA的结合活性。Acta botanica sinica;2009:751 - 754。
- 73。
刘志强,刘志强。大豆胚胎cDNA编码具有组蛋白和hmg蛋白样结构域的DNA结合蛋白。核酸Res. 1991;19:4768。
- 74。
Yamamoto S, Minamikawa T.的基因组中存在两个高迁移率组蛋白HMG-Y的基因Canavalia Gladiata.D.C.植物mol Biol。1997年; 33:537-44。
- 75。
POZ / BTB和at -hook含锌指蛋白1 (PATZ1)通过p53依赖途径抑制内皮细胞衰老。细胞死亡不同。2011;19:703-12。https://doi.org/10.1038/cdd.2011.142.
- 76。
Matsushita A,Furumoto T,Ishida S,Takahashi Y. Agf1,AT-HOOK蛋白,对编码GA 3-氧化酶的负反馈是必要的。植物理性。2007; 143:1152-62。
- 77.
Norseen J, Thomae A, Sridharan V, Aiyar A, Schepers A, Lieberman PM。来源识别复合体的rna依赖募集。EMBO j . 2008; 27:3024-35。
- 78.
Richter T,Mu Te,Heinkele G,Tatzel S,Schwab M,Eichelbaum M等。HMGA1A与原点识别复杂之间的交互创建特定于站点的复制起源。pnas。2005; 308:1-24。https://doi.org/10.1240/sav.
- 79.
Gonzalez N,Pauwels L,Baekelandt A,De Milde L,Van Leene J,Besbrugge N等人。阻遏蛋白复合体调节拟南芥的叶片生长。植物细胞。2015; 27:2273-87。
致谢
感谢中国林业科学研究院提供的植物材料;感谢实验室参与本次研究;我们感谢匿名审稿人对论文提出的建设性意见,这些意见大大改善了论文的质量。
资金
中国林业学院的基本研究资金支持这项工作(CAFYBB217ZY002)。中国林业学院基础研究资金(CAFYBB217ZA001-8)。资助者在研究设计,数据分析和解释以及稿件写作中没有作用,但刚刚提供了财务。
作者信息
从属关系
贡献
JHW, SGZ, GZQ, LIS, ZW和WJM设计了实验。ZW和WJM分析了RNA-seq数据并撰写了手稿。ZW、FEQ、TQZ采用qRT-PCR检测基因表达。ZW, NL, FQOY, NW, GJY采集实验所用样品。所有的作者都阅读了这篇论文,并同意将他们的名字列为共同作者。作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
本文不包含任何与人类参与者或任何作者执行的动物的研究。本研究中使用的所有植物材料是由中国林业学院林业研究所提供的。现场实验是在局部立法和权限下进行的。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
本文中使用的所有引物的列表。
附加文件2:图S1。
的验证oe-spl9.积极的拟南芥。
附加文件3:图S2。
的验证OE-HMGA.积极的拟南芥。
附加文件4:表S2。
MEME鉴定了CBUSPR9的主题序列的细节。
附加文件5:表S3。
的细节CBUSPL.9被预测为miR156的靶点。
附加文件6:图S3。
MIR156在开发时期花蕾和叶芽中的MIR156的表达谱c .文艺.
附加文件7:图S4。
表达谱的cbuleafy.和CbuAP1在花芽和叶芽的发育期c .文艺.
附加文件8:表S4。
花卉器官突变体的统计oe-spl9.拟南芥。
附加文件9:表S5。
开花时间突变体的统计oe-spl9.拟南芥。
附加文件10:表S6。
花卉器官突变体的统计OE-HMGA.拟南芥。
附加文件11:表S7。
开花时间突变体的统计OE-HMGA.拟南芥。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
王,Z.,朱,T.,马,W。等等。势函数的CBUSPL.和在开花期间编码其相互作用蛋白的基因Catalpa Bungei..BMC植物BIOL.20.105(2020)。https://doi.org/10.1186/s12870-020-2303-z
收到了:
公认:
发表:
关键词
- Catalpa Bungei.
- 开花
- SPL
- HMGA
- 建筑转录因素