摘要
背景
Fenclorim (Fen)能有效保护水稻免受pretilachlor (Pre)的伤害,但其对水稻的作用尚未得到正式评价;因此,缓解Pre对水稻的植物毒性作用的Fen模式尚不明确。本研究旨在研究Fen对水稻的生化和生理作用,并在转录组水平上确定Fen诱导的变化。
结果
Pre处理对水稻叶绿素含量影响显著,Fen处理对叶绿素含量影响不显著。氧化应激酶活性表明,芬未引起氧化应激的任何变化;但能减轻Pre引起的脂质过氧化和氧化损伤。Fen不影响Pre的吸收,但影响其在水稻中的持久性。在转录组实验中,Fen上调了解毒途径中的基因。共鉴定出25个与解毒相关的基因,包括P450、GST和GT, qRT-PCR分析显示4个P450基因,CYP71Y83,CYP71K14,CYP734A2和CYP71D55和两个GST基因,GSTU16和GSTF5,被Fen和/或Pre上调。
结论
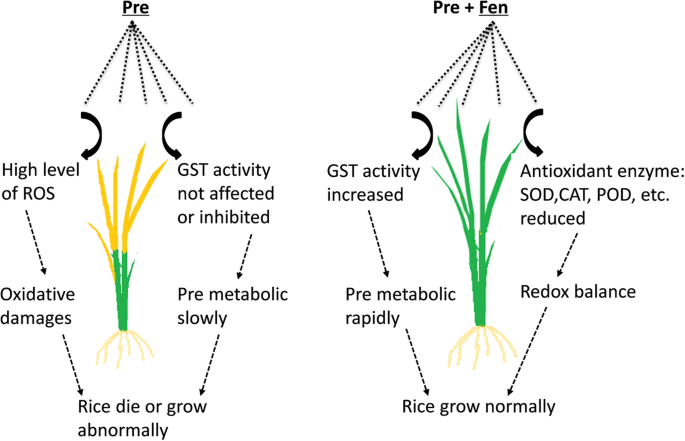
本研究表明,芬除促进除草剂代谢外,还具有抗氧化防御作用。
背景
众所周知,除草剂作为现代农业除草的主要手段,在控制农田杂草、降低劳动强度方面发挥了至关重要的作用。虽然除草剂有助于提高作物产量,但它们也会对对其敏感的作物构成风险;出于这个原因,安全剂被开发出来以增加作物的选择性[1].除草剂是一种具有生物活性的异种化合物,过度使用会破坏植物正常的生化和生理过程。每种除草剂至少有一个特定的靶点,抑制靶点活性是许多除草剂的主要作用方式。此外,许多研究表明,当植物细胞暴露于除草剂中时,活性氧(reactive oxygen species, ROS)会积聚在植物细胞中,这是一种次要效应[2,3.].过量的ROS可通过导致膜脂过氧化、蛋白质氧化、抑制酶活性、DNA和RNA损伤等途径损害植物细胞,甚至导致细胞死亡[3.,4,5,6,7,8].
在长期的进化过程中,植物已经进化出了将除草剂毒性降到最低的能力。它们的保护机制之一是抗氧化系统,该系统由多种酶组成,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)等酶,对氧化损伤起到保护作用[7].抗氧化酶活性已被证实与多种植物的抗除草剂能力有关[5,6,8,9].
另一种机制是解毒系统,也被称为异种组,它可以清除复杂的外源化合物[10].该解毒系统由大家族酶组成,如P450s、GTs、GSTs、ABC转运体和其他酶或转运体,其工作过程可分为四个阶段:第一阶段,水解或氧化;相II,共轭;第三阶段,削减;第四阶段,分解代谢[1,11].近年来,科学家对外源化合物在作物中的代谢途径进行了大量研究;然而,在异种代谢中,解毒系统中各制剂之间的关系仍不清楚[12].有趣的是,除草剂安全剂可以诱导作物的除草剂解毒反应。除草剂安全剂是用于减轻除草剂对作物的毒性而不降低杂草控制效率的合成化学品[1,13].除草剂与安全剂联合使用约占全球除草剂市场份额的30% [14].安全剂在农业生产中的重要性引起了人们对其作用方式的大量研究。作物和杂草之间除草剂代谢率的差异本质上是除草剂选择性的机制之一。安全剂的独特和有趣之处在于,它们可以明显同时诱导植物排毒途径的一系列关键成分,从而增强作物对除草剂的代谢、降解能力和隔离能力,增加杂草防治的选择性[1,12,15].在过去的几十年里,安全器的工作机制一直是一些科学家关注的焦点。然而,到目前为止,尚未有结论阐明安全剂的作用模式,特别是涉及安全剂作用的分子和遗传调控机制和信号通路,这在很大程度上仍然不清楚。
为了减少对水稻的伤害,研制了更安全的fenclorim(4,6 -二氯-2-苯基嘧啶,Fen) (栽培稻L.)由氯乙酰苯胺类除草剂引起。为了保证早期水稻的安全,Fen常与pretilachlor [2-chloro-2 ', 6 ' -二乙基- n -(2-丙氧乙基)乙酰苯胺,Pre]配制,Pre是东南亚国家稻田中使用最广泛的除草剂之一,但Pre对水稻具有植物毒性风险[16].汾水保护水稻不受Pre的伤害,主要是由于加速了Pre的代谢。17].大多数研究都集中在Fen的诱导与GST活性的关系以及GST编码基因表达的调控[18,19,20.,21].很少有研究关注除GSTs以外的解毒酶。据我们所知,只有一项研究在酶活性水平上调查了水稻,表明Fen提高了P450含量[22].此外,许多研究已经进行拟南芥[19,23,24,25,26].在一项转录水平的研究中,已经表明许多编码GSTs, UGTs和CYPs的基因在水稻和水稻中都可以被Fen诱导拟南芥[12,23].然而,人们认为只有少数上调基因具有很强的解毒能力[12];迄今为止,水稻中与Fen诱导和Pre解毒有关的确切基因尚未确定。
此外,安全剂和除草剂都是具有生物活性的异种生物化合物。由于除草剂会引起作物的过氧化反应,安全剂对水稻ROS的影响还没有明确的结果。我们现在报告了一项系统的研究,以阐明Fen对水稻生理的影响,水稻代谢Pre的能力,以及在转录组水平上Fen和Pre对水稻基因表达的影响。在这里,我们的目标是(1)研究Fen增强GST活性和Pre代谢率的能力,(2)研究Fen存在时水稻幼苗抗氧化酶对Pre底物的活性,(3)在处理过Fen的水稻中进行全局转录组研究,以确定与Fen和Pre代谢途径的作用方式密切相关的基因。
结果
Pre和Fen对叶绿素总量的影响
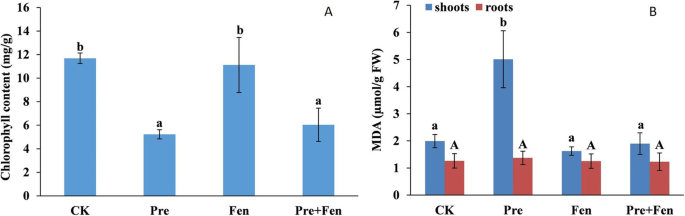
与对照相比,Pre处理水稻植株总叶绿素含量降低55.6%。单用Fen处理没有降低叶片叶绿素含量,单用Fen处理与单用Fen联合Pre处理之间差异不显著(图2)。1一个)。
Pre和/或Fen对氧化应激和抗氧化酶的影响
为了评估所选化学物质对细胞的损伤,定量测定了叶片和根组织中的丙二醛(MDA)含量。如图所示。1B,单施Pre处理水稻幼苗MDA含量显著增加,达到对照的2.5倍。有趣的是,Fen并没有增加MDA含量;与Pre合用时,可逆转Pre引起的MDA积累。然而,Pre和Fen均不能促进根系中MDA的积累。
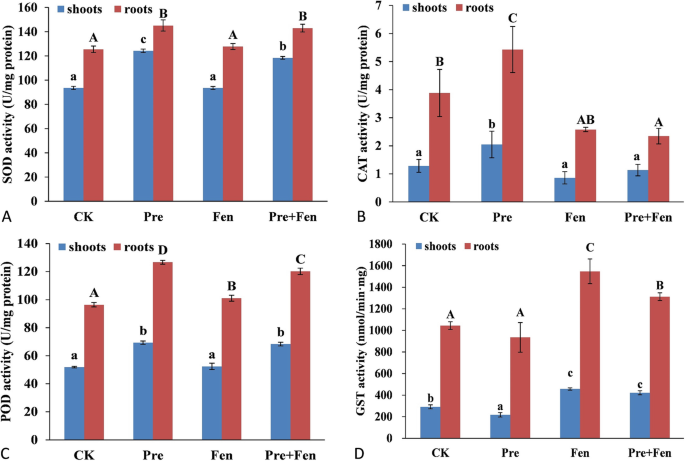
Pre和(或)Fen处理水稻幼苗和根系中SOD、CAT和POD活性变化较大。总体而言,根系的SOD、CAT和POD活性明显高于嫩枝(图2)。2A, B, C)。在Pre和Fen处理下,水稻幼苗和根系中SOD、CAT和POD活性变化相似。预处理诱导芽根中SOD、CAT和POD活性显著升高。幼苗中SOD、CAT和POD活性分别提高了32.7、59.6%和33.5%。根系中SOD、CAT和POD分别提高15.6、40.0和31.5%。单用芬不提高组织中SOD、CAT和POD活性;Fen与Pre联合使用时,与Pre单独处理相比,SOD和CAT活性分别降低4.9和80.5%。与单施Pre处理相比,根系中CAT和POD活性分别降低131.6和5.4%。但与Pre单用相比,Fen与Pre联合施用时,嫩枝POD活性和根系SOD活性均未显著降低。
Pre和Fen的GST活性测定及作用
水稻根系中GSTs的内在活性是对照处理的3.6倍。前处理显著抑制了芽中GSTs的活性,Fen处理使其活性提高了56.5%,Fen与Pre联合处理使其活性提高了44.3%。与对照相比,Pre没有提高根中的GST活性。Fen处理无论是单独使用还是与Pre联合使用,都显著提高了根中GSTs的活性(图2)。2D)。
水稻苗木预残
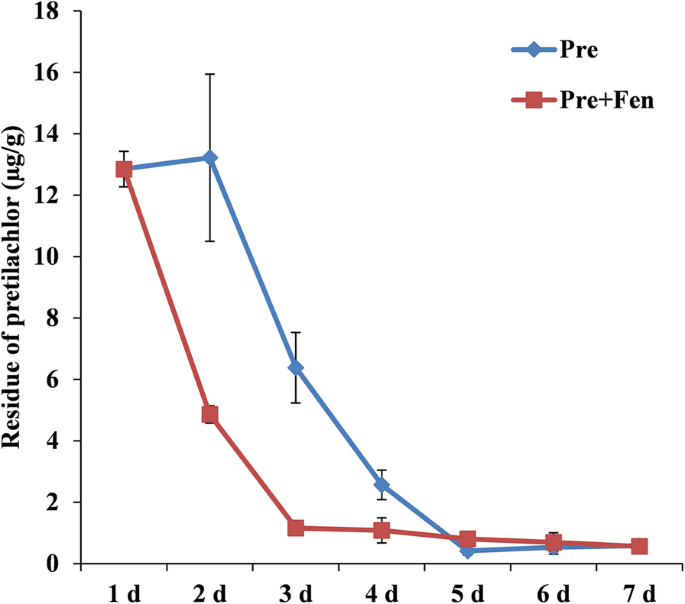
芬不影响前24 h水稻幼苗中Pre的积累。从48 h开始,Pre和Pre + Fen处理的Pre含量有显著差异。单独施用Pre时,48 h时,Pre在嫩枝中的含量略有增加,之后从72 h下降到120 h。当使用Pre和Fen的混合物时,Fen将Pre的含量从48小时迅速降低到120小时(图2)。3.)。
Illumina测序,组装和基因本体
为了研究Fen介导的水稻解毒基因激活的基因表达谱,我们比较了12个水稻样本的转录组,包括三个未处理对照(CK)和Fen处理的生物重复,两个时间点(4和24小时)。
考虑到Fen可以引起快速的异种反应,也可以监测次要事件,因此对12个样本的4 h和24 h转录物进行测序[12,23].经过质量控制和数据清理,我们获得了84.37 Gb的清洁数据,每个样本的读取量从20,9200,063到29,230,636;86.8%的清洁reads质量≥30,98.0%的清洁reads经过质量过滤,符合Illumina质量要求。然后,这些干净的reads被用于绘制水稻基因组序列的序列(表1)。每个样本映射到参考基因组的清洁reads比例为71.8-76.3%。所有原始序列读取数据上传到NCBI序列读取存档(SRA,https://submit.ncbi.nlm.nih.gov/subs/sra/),注册号为PRJNA560668。在样品合格后构建了一个库。最终共获得35301个基因。其中长度在1000元至300元之间的有16638件,超过1000元的有14743件。
基因本体论(GO)分析将28662个基因划分为54个功能类别:17个用于细胞成分(CCs), 17个用于分子功能(mf), 20个用于生物过程(BPs)(附加文件)1:图S1)。cc中富集最多的亚群是“细胞部分”(21579个基因,占75.29%),其次是“细胞”(21555个基因,占75.20%)和“细胞器”(19691个基因,占68.70%)。MF类中富集最多的亚群为“结合”(13871个基因,占48.40%)和“催化活性”(12970个基因,占45.25%)。BP中富集最多的亚群为“代谢过程”(15693个基因,占54.75%)、“细胞过程”(13512个基因,占47.14%)和“单生物过程”(11396个基因,占39.76个)。此外,京都基因和基因组百科全书(KEGG)分析将7752个基因分为124个通路。
差异表达基因(DEGs)功能分析
所有基因的读取计数都在附加文件中提供2:表S1。转录本水平由每千碱基的转录本每百万映射读取片段(FPKM)计算(附加文件3.:表S2)。4 h时,共发现200个差异表达基因(DEGs),其中107个基因上调,93个基因下调(附加文件)4:表S3)。24 h时,共发现81个deg,其中35个上调,46个下调(附加文件)5:表S4)。
基于GO数据库,分别标注168个deg (4 h)和68个deg (24 h)。4 h和24 h的deg被分为54个功能亚组,其中“BP”组20个,“CC”组17个,“MF”组17个(附加文件)6:图S2)。其中,Fen处理中MF类的“催化活性”和BP类的“代谢过程”较CK显著增强。
根据除草剂安全剂的已知作用模式[1,11,27],我们认为与代谢和信号通路相关的DEGs与除草剂代谢有关,可以通过安全剂来加强。我们选择了Fen处理与CK相比有相关功能注释的上调基因,包括P450、GST和UGT基因。芬诱导除草剂解毒过程中可能参与的基因列于表中2.有16个解毒基因属于I期,6个属于II期。在第一阶段,5个基因编码细胞色素P450s, 4个基因编码加氧酶,2个基因编码过氧化物酶。一些芬氯林诱导的水解酶(3个糖基水解酶,1个硫酯酶,1个脂肪酶)也可能包括在阶段i中。2个gst和5个糖基转移酶可能有助于阶段II。芬诱导24 h后,phi类和tau类两个GST基因表达上调。另一个重要的基因超家族,糖基转移酶,其成员可以催化有毒物质与糖的反应,形成亲水化合物,为进一步的分解代谢做准备,其中有四个成员也被Fen处理在4小时内诱导[28].
定量实时RT-PCR (qRT-PCR)验证代谢酶基因
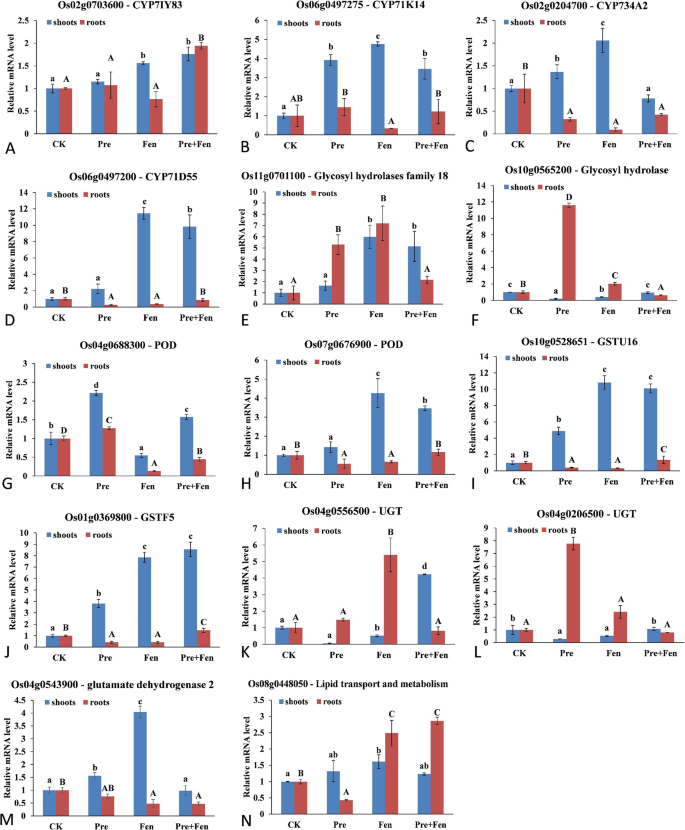
为了鉴定和验证Fen诱导的基因,通过qRT-PCR分析了14个上调的候选基因在Fen处理下的表达,并分析了这些基因在Pre诱导下的表达谱。所选基因大多具有相似的功能注释,包括P450基因、GST基因、GT基因、POD基因、水解酶基因、脱氢酶基因以及脂质转运蛋白和代谢基因(图)。4)。除Os10g0565200、Os04g0688300、Os04g0556500和Os04g0206500外,其余10个上调基因在Fen胁迫下的表达量均高于对照,这与RNA-Seq的数据基本一致,说明RNA-Seq得到的大部分DEGs具有进一步分析的价值。这10个上调基因中包括4个P450基因(CYP71Y83,CYP71K14,CYP734A2,CYP71D55)(图。4A, B, C, D),两个GST基因(GSTU16和GSTF5)(图。4I, J), 1个水解酶基因(图;4E), 1个POD基因(图;4H), 1个脱氢酶基因(图;4M)和一个脂质转运蛋白和代谢基因(图。4N),其中4个,2个水解酶基因(Os11g0701100和Os10g0565200)(图;4E, F),一个UGT基因(Os04g0556500)(图;4K),以及一个脂质转运蛋白和代谢基因(Os08g0448050)(图。4N),在芬处理的根中表达量显著高于对照。当用Pre处理植物时,7个基因(3个P450基因)(图;4B, C, D),两个GST基因(图;4I, J), 1个POD基因(图;4G)和一个脱氢酶基因(图;4M)在水稻幼苗中表达量显著增加,5个基因在根系中表达量显著增加。其中,POD基因Os04g0688300(图;4G)在嫩枝和根中均显著上调,但在嫩枝中上调幅度最大。此外,7个基因(3个P450基因)(图;4A, B, D),两个GST基因(图;4I, J), 1个水解酶基因(图;4E)和1个POD基因(图;4H)),当植物暴露于Fen时表达上调,而在Fen + Pre处理下,植株的芽中表达水平更高。
讨论
除草剂安全剂可以减轻除草剂对作物的伤害。虽然在安全器工作机制的描述方面已经取得了一些进展,但它们的作用模式还没有完全阐明。Fen是专门针对Pre研制的安全剂,使用Fen可显著提高水稻对Pre的耐受性。然而,以往的相关研究大多集中在解毒酶GST [17,18,19,21,26,29,30.],而Fen对水稻的其他影响仍然难以捉摸。本研究测定了Fen诱导的总叶绿素含量、脂质过氧化和转录表达。
我们的研究表明Pre会导致叶绿素含量的损失。Fen的添加并没有缓解叶绿素含量的降低,说明Pre破坏了叶绿素的生物合成,而更安全的Fen不影响叶绿素的生物合成。这一发现可能是这种特殊化合物的特征之一。这一观察结果也与单用芬不影响水稻生长的结果相吻合。然而,当Fen与Pre联合使用时,叶绿素含量并没有恢复,可能是因为叶绿素生物合成的恢复需要比本工作中使用的时间长得多的时间。
ROS与除草剂毒性有关,并通过脂质过氧化导致膜完整性的丧失;脂质过氧化被认为是所有生物中最具破坏性的分子过程[31].抗氧化系统在维持植物体内ROS生成和清除之间的平衡中起着关键作用。作物对除草剂的抗氧化反应是近年来研究的一个课题,大多数除草剂都能诱导ROS的形成,但关于安全剂对作物抗氧化系统影响的研究很少。因此,我们研究的另一个目的是明确芬对水稻脂质过氧化和抗氧化系统的影响。在本研究中,我们分别测定了作为植物细胞脂质过氧化和氧化应激指标的SOD、CAT和POD的MDA含量和活性。我们的研究表明Pre可引起高水平的ROS。Pre处理显著提高了SOD、CAT和POD的抗氧化活性,而Fen处理对茎部和根部SOD、CAT和POD活性均无显著影响。与此相反,Fen改善了Pre引起的氧化应激。此外,Fen还能将Pre引起的MDA在水稻幼苗中的积累降低到正常水平,与抗氧化防御的结果一致。由于Pre会对水稻幼苗造成严重伤害,因此水稻幼苗遭受Pre造成的严重氧化应激也就不足为奇了,但Fen对水稻抗氧化系统的影响表明,防御性抗氧化特性也是Fen保护水稻免受Pre伤害的一种方式。 In a previous study related to the effects of chloroacetamides and safeners (mefenpyr and dichlormid) on human blood cells, the safeners alone did not elicit any changes in oxidative stress but instead reduced the lipid peroxidation induced by the chloroacetamide herbicides [32].这一结果与我们的研究结果一起表明,安全剂作为抗氧化剂在人类血细胞和大米中都有作用(图2)。5)。
根据以往的研究,可以得出结论,提高代谢速率和/或除草剂的隔离是安全剂保护植物免受伤害的主要机制[1,33].关于Fen对Pre残留在水稻幼苗中的积累和持久性的影响,我们发现Fen没有干扰Pre的吸收,但会导致Pre持久性的迅速降低。这些结果是意料之中的,因为Fen能够通过增强水稻的代谢来保护水稻免受Pre - injury [34,35].此外,Pre在水稻中的解毒作用与GST活性高度相关。邓等。[18]和吴等人。[21]观察到Fen显著提高了水稻的GST活性。本研究结果还发现,Fen能显著诱导根、芽中GST的活性,这与以往的研究结果一致。我们的研究结果表明,Fen可以通过增加解毒酶(如GST)的活性来加强水稻的代谢(图2)。5)。
安全剂作用的分子机制可能涉及多种信号和解毒途径之间的复杂相互作用,从而保护植物免受除草剂和其他外源化合物的侵害[1].一些研究在模式植物和极少数禾本科作物的转录组水平上研究了安全因子的机制,但确切的机制尚不清楚。我们利用RNA-Seq技术鉴定了水稻中与Fen反应有关的新候选基因。考虑到mRNA表达的时间依赖性,我们为RNA-Seq方法设置了两个时间点。在4 h和24 h时,总共有107和35个基因被上调。在142个差异上调的基因中,有26个可能编码与除草剂代谢相关的解毒酶,其中大部分在24 h上调。这一结果与以往的研究结果一致,表明安全剂诱导排毒系统的一系列成分拟南芥[11,23].水稻和高粱也报告了类似的结果。大多数编码解毒酶的基因,包括P450s、GSTs和UGTs,在高粱中被氟沙芬上调[33].Brazier-Hicks等人用Fen处理水稻幼苗,发现许多酶,如CYP、GST和UGT表达上调[12].在本次研究中,5个CYP基因、2个GST基因、4个GT基因和其他几个解毒基因在Fen处理水稻时被上调。其中只有一个基因,CYP734A2,以前发现是由Fen [12].在Brazier-Hicks的研究和我们的研究结果之间,我们没有发现其他可诱导基因的重叠,而且在本研究中发现的可诱导基因比之前的报告要少得多[12],这可能与Fen的种类差异和用量减少有关(10 μM vs 100 μM)。由于推断只有少数安全剂诱导的酶对异种生物具有较高的解毒活性[12],这项研究中Fen诱导的少量基因并不是一件坏事。结合接下来的qRT-PCR验证,我们发现至少有4个P450基因、2个GST基因和1个UGT基因似乎与Fen作用模式有关,其中一些基因也是由Pre和Pre + Fen诱导的。特别是两个GST基因(GSTU16和GSTF5)表现出强烈的诱导性表达。这一结果表明这些基因可能参与了Pre的代谢,但Fen本身也可以被GSTs代谢[25].这些酶在Pre代谢中的作用有待进一步研究。
结论
本研究进一步证实了Fen可以通过增强Pre在水稻中的代谢来保护水稻免受Pre的损害。此外,我们没有发现芬对水稻的氧化损伤;相反,Fen减少了Pre诱导的脂质过氧化和ROS的产生。这些发现为Fen的抗氧化活性提供了新的认识,我们认为抗氧化防御特性是Fen的另一种作用方式。转录组分析表明,Fen诱导了许多与解毒途径相关的反应基因,包括P450、GST和gt, qRT-PCR结果显示,其中部分基因同时被Fen和Pre诱导。我们认为,对这些基因的进一步研究具有很大的价值。这些结果对阐明芬的作用方式有一定的参考价值。
方法
植物材料和生长条件
9311品种水稻种子(购自中国杂交水稻研发中心,李莉副研究员鉴定)用3%次氯酸钠杀菌5分钟,蒸馏水洗涤3 ~ 4次,自来水浸泡24小时,28℃暗箱发芽48小时[36].将发芽的种子转入盛有Hoagland营养液的塑料盒[37]在28/25±1°C(日/夜)的14小时/10小时光/暗循环下。
为了研究除草剂在水稻中的残留动态,6 d后将水稻分为4个处理:1个处理作为对照,2个处理为10 μM Pre, 3个处理为10 μM Fen, 4个处理为Pre + Fen (10 μM + 10 μM)。复合剂量的设计来自文献[23].对叶绿素、MDA和抗氧化活性进行分析,水稻种子接种后3 d,用除草剂和/或安全剂处理水稻幼苗,连续培养5 d。为了进行转录组分析和qRT-PCR检测,将水稻幼苗培养到3叶期,然后进行与残留动力学实验相同的处理。4 h和24 h收获水稻嫩枝和根系,提取总RNA,用于转录组分析和qRT-PCR测定[23].总共收集了12份用于转录组分析的样本,包括未处理对照(CK)和Fen处理的3个生物重复,两个时间点(4和24小时),并在液氮中冷冻,在−80°C保存,直到RNA提取。
这些实验中涉及的所有化学物质,包括Pre和Fen,都被溶解在丙酮中,并用含有0.1%吐温-80的水稀释。对照处理含有等量的丙酮和吐温-80。水稻幼苗的嫩枝和根分别采集,在- 70°C下保存,然后进行分析。
叶绿素和脂质过氧化分析
叶绿素提取和含量测定根据Porra等人描述的协议进行。[38].将新鲜的米旗叶(0.1克)称量,切成1毫米的细丝,加到10厘米3.在4°C下保存72小时。然后用紫外分光光度计(UVmini-1240, Shimadzu, Japan)测定溶液在663.6 nm和646.6 nm处的吸光度,并计算总叶绿素含量。
脂质过氧化按照Wang等的方法测定MDA含量[39].将新鲜组织(0.5 g)称量,在液氮中研磨,然后在3cm内提取3.0.67%三氯乙酸(TCA)溶液。匀浆以10,000 g离心30分钟,然后离心2厘米3.取上清液中2 cm混合3.0.5% TCA(溶剂为20% TCA)。将混合物放入沸水中30分钟,冷却至室温,在15,000 g下离心5分钟。在532 nm处测定上清液的吸光度,并减去600 nm处的非比吸光度值(0.5%硫巴比酸(溶剂中TCA为20%)为空白)。
GST与抗氧化活性分析
GST的提取和GST活性测定根据Li等人描述的协议进行。[40].CAT, POD, SOD活性根据生产厂家的说明用检测试剂盒(中国南京建城)测定。蛋白质含量采用Bradford法测定[41].
水稻中Pre含量的测定
采用上述方法从大米中提取Pre [35].笋样(2 g)在液氮中粉末状,提取20 cm均质3.甲醇与水(4:1,V/V)混合3分钟。5000 g离心15 min,取上清液30 cm分离2次3.的CHCl3..有机相蒸发至干燥,残液用1cm冲洗3.水/乙腈(3:7 v/v)。样品定性分析使用配备C18反相柱。在流动相(水:乙腈,3:7 v/v),波长210 nm,流速1 cm下,用紫外检测器定量Pre3./分钟。
用于转录组测序和生物信息学分析的文库制剂
共采集12份样品(3个生物重复× 2个处理× 2个时间点)。按照制造商的建议,使用RNAiso Plus (TaKaRa Biotech, Dalian, China)从每个样品中提取总RNA。使用Agilent Bioanalyzer 2100系统(Agilent Technologies, Santa Clara, CA, USA)分析总RNA的质量和数量。
cDNA文库构建,包括mRNA分离、mRNA片段化、cDNA合成和PCR扩增,均在北京生物标记技术有限公司(北京,中国)进行。测序文库使用NEBNext, Ultra RNA文库准备试剂盒for Illumina (Illumina, Inc, San Diego, CA, USA)按照标准方法生成。简言之,用携带聚t寡核苷酸的磁珠从总RNA中富集mRNA,然后在碎片缓冲液中随机分解成短序列。使用随机六聚体引物和M-MuLV逆转录酶(RNase H free)合成cDNA的第一链。随后,rna酶h处理后,用DNA聚合酶I PCR扩增cDNA, PCR产物采用AMPure XP系统(Beckman Coulter, Beverly, USA)筛选出片段(200-250 bp)。将纯化的双链cDNA进行末端修复,添加a尾,连接测序珠。使用AMPure XP珠子来选择珠子的大小。PCR产物纯化(AMPure XP系统),cDNA文库质量由Agilent Bioanalyzer 2100系统评估。最后在Illumina HiSeq 2500平台上对端reads进行测序,得到150 bp的配对端reads。
对原始数据进行过滤,去除适配器序列和低质量reads,随后获得高质量的干净数据。计算洁净数据的Q20、Q30、GC含量和序列重复水平。所绘制的数据是通过清洁数据和指定的参考基因组(ftp://ftp.ensemblgenomes.org/pub/plants/release-24/fasta/oryza_sativa/)使用Tophat2软件[42].
度分析
根据测图结果获得每个基因的读计数,通过FPKM测量基因转录丰度的定量[43].利用DESeq R包分析了对照组和芬处理株之间的基因表达差异。P数值计算和错误发现控制采用Benjamini方法[44].具有调节的基因P值< 0.05,|log2(倍数变化)|≥1为差异表达。deg进一步进行氧化石墨烯富集和KEGG通路富集分析。(http://geneontology.org/)分析采用超几何检验[45].KEGG (http://www.genome.jp/kegg)富集分析通过将代谢通路或信号转导通路的基因与全基因组背景进行比较。q < 0.05的GO或KEGG组被认为显著富集。
qRT-PCR转录本分析
为了验证DEGs的表达,我们选择了14个候选解毒基因,并通过qRT-PCR对其转录进行了定量。使用TRIzol从样品中提取总RNA。按照说明使用TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR (TransGen Biotech, Beijing, China)合成cDNA。qRT-PCR混合(20 mm3.)面积为10毫米3.2 × TransStart Tip Green qPCR SuperMix (TransGen Biotech, Beijing, China), 0.4 mm3.每个底漆(10 μM), 0.4 mm3.被动参考染料II, 2毫米3.长度为6.8 mm3.无核酸酶水的。
引物使用在线软件Primer3设计,引物序列在附加文件中列出7:表S5。肌动蛋白作为内参基因。qRT-PCR采用ABI 7300 +实时PCR系统(Applied Biosystems, Foster City, CA, USA)进行。qRT-PCR程序包括94°C 30 s, 94°C 5 s, 60°C 34 s,最后60°C 15 s的40个循环。计算各基因相对于对照的表达量——ΔΔCt方法(46].每个实验由3个生物重复组成。
统计分析
本研究分别进行了三次生物复制。数据以三次重复的均值±标准差表示。采用SPSS 20.0软件,以5%水平的最不显著差异(LSD)为基础,采用单因素方差分析(ANOVA)对各处理间差异的显著性进行统计学分析。
数据和材料的可用性
本研究中产生的测序数据保存在NCBI Sequence Read Archive (SRA)数据库(SRA,https://submit.ncbi.nlm.nih.gov/subs/sra/),注册号为PRJNA560668。在此研究期间生成或分析的数据集包括在本文及其补充信息文件中。
缩写
- 美国广播公司(ABC):
-
磷酸腺苷磁带
- 方差分析:
-
单向方差分析
- APX型:
-
抗坏血酸盐过氧化物酶
- 英国石油公司:
-
生物过程
- 猫:
-
过氧化氢酶
- 答:
-
蜂窝组件
- CYP:
-
细胞色素P450单加氧酶
- 度:
-
差异表达基因
- 分:
-
Fenclorim
- FPKM:
-
每千碱基的片段数
- 走:
-
基因本体论
- 消费税:
-
Glutathione-S-transferase
- GTs:
-
糖基转移酶
- KEGG:
-
京都基因与基因组百科全书
- KOG /齿轮:
-
蛋白质的同源基团簇
- MDA:
-
丙二醛
- MF:
-
分子功能
- 圆荚体:
-
过氧化物酶
- 前:
-
Pretilachlor
- 存在:
-
实时定量PCR
- RNA-Seq:
-
RNA序列
- ROS:
-
活性氧
- SOD:
-
超氧化物歧化酶
- 柠檬酸:
-
三氯乙酸
参考文献
李志刚,张强。除草剂安全剂可激活植物防御基因表达。植物科学进展。2010;32(1):1 - 13。
Cobb AH, Reade JP。除草剂与植物生理学。第二版。纽约:威利;2010 . .
Caverzan A, Piasecki C, Chavarria G, Stewart CN Jr, Vargas L.作物和杂草对ROS的防御:干扰和除草剂的影响。中华分子生物学杂志,2019;20(5):1086。
崔乐,杨慧。萘丙胺在苜蓿和土壤中的积累和残留与毒性反应有关。中国生物医学工程学报。2011;19(1):1 - 6。
王娟,钟霞,朱凯,吕军,吕霞,李峰,石忠。烟磺隆胁迫下糯玉米一对近等基因系活性氧、抗氧化酶活性及基因表达谱。环境科学学报,2018;25(19):19012-27。
张俊杰,陆玉春,张俊杰,谭丽仁,杨慧。阿特拉津在水稻作物中的积累及其毒性反应。生态环境学报,2014;102:105-12。
蒋玲,杨华。异丙氨酮诱导的小麦氧化应激及其对抗氧化酶的影响。环境科学学报。2009;32(6):1687-93。
Kaya A, Doganlar ZB。外源茉莉酸诱导烟草(nictiana tabum)对异氮杂胺胁迫的耐受性。生态毒理学杂志,2016;124:470-9。
袁晓霞,张乐林,黄玲,杨海军,钟宜婷,宁宁,文悠悠,董淑琪,宋晓霞,王海峰,等。喷施油菜素内酯可提高谷子的Sigma Broad耐受性(Setaria italicaL.)通过调节抗氧化活性和光合能力。科学通报2017;7(1):11232。
Edwards R, Buono DD, Fordham M, Skipsey M, Brazier M, Dixon DP, Cummins I.谷胱甘肽转移酶和糖基转移酶在小麦,玉米和拟南芥通过除草剂安全剂。科学发展观für自然科学学报。2005;60(3-4):307-16。
贝林格C, Bartsch K, Schaller A. Safeners招募多个信号通路,以协调诱导细胞的异种生物排毒机制拟南芥.植物细胞环境学报。2011;34(11):1970-85。
Brazier-Hicks M, Gershater M, Dixon D, Edwards R.植物udp -葡萄糖依赖家族1糖基转移酶超家族的底物特异性和安全诱导性。植物科学进展,2018;16(1):337-48。
戴维斯J,凯西利JC。除草剂安全剂研究进展。中国农业科学,1999;55(11):1043-58。
除草剂安全剂概述。Julius-Kuhn-Archiv。2014; 443:516-25。
基于代谢的除草剂抗性:安全剂的调控。杂草学报2004;52(3):454-67。
Sahoo S, Adak T, Bagchi TB, Kumar U, Munda S, Saha S, Berliner J, Jena M, Mishra BB。预噻草胺对热带水稻土壤微生物特性的非靶标效应。环境科学学报,2016;23(8):7595-602。
吴娟,王永明,王永明,谷胱甘肽年代-转移酶活性在未处理和芬氯林处理水稻中的表达(栽培稻)。农药生物化学物理,1996;54:20 20 - 9。
邓飞,哈齐奥斯。多重谷胱甘肽的表征及安全诱导年代3个水稻遗传系的-转移酶。生物化学学报。2002;72(1):24-39。
DeRidder BP, Dixon DP, Beussman DJ, Edwards R, Goldsbrough PB。谷胱甘肽诱导年代-转移酶在拟南芥中的作用。植物科学进展。2002;30(3):344 - 344。
李志强,李志强,李志强,等。异丙草胺和异丙草胺在水稻中的持久性和解毒作用。Agronomie。2003;23(2):147 - 51。
吴军,李志刚,李志刚。两个编码谷胱甘肽的cdna的鉴定年代-转移酶及其转录本的诱导。植物科学进展。1999;26(1):1 - 8。
刘华。植物微粒体细胞色素P450与异甲草胺和除草剂安全剂的光谱表征及手性相互作用。环境科学与健康杂志,2010;45(1):33-9。
Skipsey M, Knight KM, Brazier-Hicks M, Dixon DP, Steel PG, Edwards R.拟南芥除草剂安全剂衍生的化学系列。中国生物医学工程学报,2011;29(3):339 - 344。
刘娟,刘志刚,刘志刚,等。拟南芥中除草剂安全剂fenclorm的代谢动力学模型。生物化学学报,2009;43(1):1 - 8。
Brazier-Hicks M, Evans KM, Cunningham OD, Hodgson DR, Steel PG, Edwards R.谷胱甘肽结合物的分解代谢拟南芥.除草剂安全剂茴香菊代谢再活化的作用。生物化学学报。2008;283:21102-12。
DeRidder BP, Goldsbrough PB。谷胱甘肽的器官特异性表达年代-转移酶和除草剂安全剂在拟南芥中的作用。植物科学进展。2006;40(1):67 - 67。
Kraehmer H, Laber B, Rosinger C, Schulz A.除草剂作为杂草控制剂:最新进展:I.杂草控制研究和更安全的技术:通往现代农业的道路。中国生物医学工程学报。2014;36(3):344 - 344。
李志刚,李志刚,李志刚。植物次生代谢相关糖基转移酶:扩展知识和范围的最新进展。生物技术通报,2016;34(5):714-39。
邓飞,哈齐奥斯。两种谷胱甘肽的纯化与表征年代-转移酶同工酶籼稻型水稻参与除草剂解毒。生物化学学报。2002;72(1):10-23。
王志强,王志强,王志强,等。小麦和玉米谷胱甘肽诱导研究年代除草剂安全剂对-转移酶活性的影响。中国生物防治学报,2006;26(3):344 - 344。
杨晓明,王晓明,王晓明,等。活性氧和抗氧化机制在植物抗非生物胁迫中的作用。植物学报。2010;48(12):909-30。
王晓明,王晓明,王晓明,等。氯乙酰胺除草剂对人红细胞损伤的影响。环境毒理学杂志。2013;36(2):368-77。
Baek YS, Goodrich LV, Brown PJ, James BT, Moose SP, Lambert KN, Riechers DE.转录组分析和全基因组关联研究揭示了除草剂Safener诱导高粱中GSTs和其他防御基因的多种信号通路。中国植物科学,2019;10:192。
韩星,哈齐奥斯,KK。[的摄取、转运和代谢]14C .在芬氯林和非芬氯林保存的水稻幼苗中使用噻草胺。生物化学学报。1991;39(3):281-90。
李志强,李志强,李志强,等。异丙草胺和异丙草胺对水稻碳水化合物和蛋白质形成的影响。昆虫学报,2005;26(4):371-6。
胡玲,王玲,周欣,罗凯,白玲。白山参中两种具有安全剂活性的香豆素。杂草学报,2015;29(1):161-7。
Hoagland DR, Arnon DI。无土壤种植植物的水栽培方法。伯克利:加州农业实验站;1950.
Porra RJ。用联立方程精确测定叶绿素a和b的发展和使用的历史。光合学报,2002;73(1-3):149-56。
王硕,杨志明,杨华,吕波,李淑琪,吕永平。铜诱导的胁迫和根的抗氧化反应芸苔属植物juncea《中国科学院学报》2004;45:203-12。
许李D, L,彭日成年代,刘Z,王K,王c变量的谷胱甘肽水平S-Transferases负责微分公差之间Metolachlor玉米(玉米)芽和根。农业食品化学,2017;65(1):39-44。
一种利用蛋白质-染料结合原理快速而灵敏地定量微量蛋白质的方法。《肛门生物化学》1976;72:248-54。
Kim D, Pertea G, Trapnell C, Pimentel H, Kelley R, Salzberg SL. TopHat2:存在插入、缺失和基因融合时转录组的精确对齐。中国生物医学工程学报。2013;14(4):R36。
Mortazavi A, Williams BA, McCue K, Schaeffer L, Wold B.用RNA-Seq绘制和量化哺乳动物转录组。光子学报。2008;5(7):621-8。
张志刚,张志刚。依赖条件下多重测试错误发现率的控制。科学通报,2001;29(4):1165-88。
Young MD, Wakefield MJ, Smyth GK, Oshlack A. RNA-seq的基因本体分析:考虑选择偏差。中国生物医学工程学报。2010;11(2):R14。
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相关基因表达数据。方法(圣地亚哥,加利福尼亚州)。2001; 25(4): 402 - 8。
致谢
我们衷心感谢中国杂交水稻研究中心的李莉女士鉴定出9311水稻品种。
资金
本研究由国家自然科学基金资助(31301681)。资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面没有发挥任何作用。
作者信息
从属关系
贡献
本研究由LFH和LYB设计,YY进行qRT-PCR验证,RWC和KLL进行其余生化和生理分析,LP分析转录组数据并鉴定DEGs, LFH撰写稿件。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
所有基因的GO分类和统计结果。从生物过程、细胞成分和分子功能三个方面对基因进行了综述。共有28662个基因被分类。
附加文件2:表S1。
读取所有基因的计数。
附加文件3:表S2。
读取每个基因的FPKM。
附加文件4:表S3。
Fen处理与CK处理4 h的差异。
附加文件5:表S4。
Fen处理与CK处理24 h的差异。
附加文件6:图S2.;
GO分类和治疗4 h (A)和24 h (B)时DEGs的统计结果。从生物过程、细胞成分和分子功能三个方面对基因进行了综述。在处理4 h时共标记了168个差异表达基因,在处理24 h时标记了68个差异表达基因。
附加文件7:表S5。
用于水稻基因表达qRT-PCR验证的引物对。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
胡丽丽,姚勇,蔡锐,et al。芬氯胺对水稻生理、基因转录及前驱草胺脱毒能力的影响。BMC植物生物学20.100(2020)。https://doi.org/10.1186/s12870-020-2304-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-2304-y
关键字
- Safener
- 大米
- 抗氧化作用
- 新陈代谢
- 转录组