摘要
背景
与大多数动物物种相比,多倍体植物物种具有相当耐受的非整倍性。此处,获得了合成六倍体麦系的四种非植物衍生物的全局转录组,其目的是表征基因拷贝数和转录物丰度之间的关系。
结果
对于大多数基因映射到参与非倍性的染色体,对转录物的丰度反映了基因拷贝数。非整倍体对以非整倍体剂量映射到染色体上的基因的转录强度的影响大于对基因组中其他位置的基因的影响。总的来说,改变了职业集合的一个成员的拷贝数对从整个物质组产生的成绩单的丰富作用不大,这与各种多倍数展示的非整倍体的耐受性,无论是染色体赤字的形式(单体术)或染色体过量(三重奏)。
结论
我们的发现揭示了同源等位基因转录的遗传调控,有助于更深入地理解异源多倍体基因组的进化,对多倍体作物的育种具有重要意义。
背景
非整倍体的结果,无论是由于整个染色体或染色体片段的获得或丢失,都是非标准剂量的全部或部分基因,分别映射到涉及的染色体。在大多数二倍体物种中,特别是在动物王国中,这种情况通常会对生物体的健康和/或繁殖能力造成严重后果[1,2].例如,在人类中,22个潜在的常染色体三胞质,唯一的非常规是三术21(唐氏综合症);哺乳动物中的常染色体单体通常导致胎粪[3.].相比之下,许多植物物种耐受动脉倍性;因此,自整套以来已经几个世纪达尔氏藻藻三体分离[4].多倍体物种在植物王国中非常常见但在动物王国中很少罕见,是一种儿童差异的耐受性特别差异。也许通过六倍体物种提出了最佳研究的实际情况的例子Triticum aestivum.(面包小麦),西尔斯[5]能够基于在中国春季(CS)小麦×谷物Rye交叉的两倍单倍体后代后代的单体和三元素植物的单体和三元素植物的几乎成熟的无缺斑,单组理,三元素,四元素和Ditelosomic变体集。6].
鉴于它们在多倍化时增加,多倍体可以具有优异的非倍差耐受性。发散植物分类群的研究表明,新创建的多倍体植物似乎经历了高度的细胞遗传学不稳定性,伴随着一种短倍性的高频率[7,8,9,10,11,12,13,14].例如,在16个新的合成六倍体小麦(SHW)株系中发现非整倍体从20到100%不等[15].SHW是由四倍体小麦(小麦属植物turgidum,AABB Genome)和二倍体Aegilops Tauschii.(DD Genome),有点复制面包小麦的起源[16,17].SHW线路已成功地用于增强各种环境范围内的小麦产量[18,19,20.,21].
对初生多倍体植物的研究可以为祖先多倍体化事件早期基因表达的遗传控制提供重要信息。这些数据对利用新生多倍体进行繁殖也很重要,甚至可能为癌症研究提供线索,因为许多癌症细胞被发现是非整倍体[22,23].迄今为止,迄今为止,迄今为止,迄今为止,迄今为止,迄今为止迄今为止的频繁的环形倍性允许采集具有多种染色拷贝的真正的兄弟植物,这是几乎没有记录的。在此处描述的实验中,以解决非洲单倍性的转录组作用,早期几代人的趋势来自新合成的小麦所有多倍数,以产生非植物倍性和RNA-SEQ平台的力量,以迅速获得基因组宽的转录组被杠杆化。由此产生的转录组分分析的结果揭示了新的浅色作品转录并加深了我们对各种多肽基因组进化的理解,对多倍体作物种类的育种影响。
结果
非整倍体的核型验证及非整倍体对表型的影响
从杂交AS313 × AS60的后代中分离出的非整倍体包括如下(图3)。1):2N = 41植物缺少染色体4b(M4b)的一份拷贝,染色体4b的2n = 43种植物三元素(Tri4b),2n = 42株植物覆有四个染色体臂2as(segt2a)和a的拷贝2N = 40种植植物缺乏染色体7B拷贝,以及由SEGT2A携带的相同改变的染色体2a(N7B + SEGT2A)。将Euploid(2N = 42)SIB植物保留为对照。这些植物的原位杂交(鱼类)核型的荧光杂交如图1和2所示。S.1和S2.
染色体4B拷贝(M4B)的缺失导致幼苗第三叶片变窄,育性降低,而该染色体的额外拷贝(Tri4B)的存在,穗缩短,比整倍体穗产生更少的小穗。SegT2A植物产生的穗比整倍体的长。N7B + SegT2A植株的表型与整倍体非常不同,明显较短,活力和可育性较差(表)1和S1).
RNA-SEQ分析
用于转录组分析的RNA从在标题阶段采样的尖峰中提取(图。1b). 3或4株单株作为生物复制。获得的rna序列覆盖~ 87 × 109nt(表2).当用IWGSC Refseq V1.0映射时,独特对准的平均速度为81.9%(范围:78.8-83.4%)。每百万次映射的读取(FPKM)值的每千碱基片段在生物学复制之间强烈相关(平均值2= 0.94,见表S2).
基因剂量与转录物丰度之间的相关性
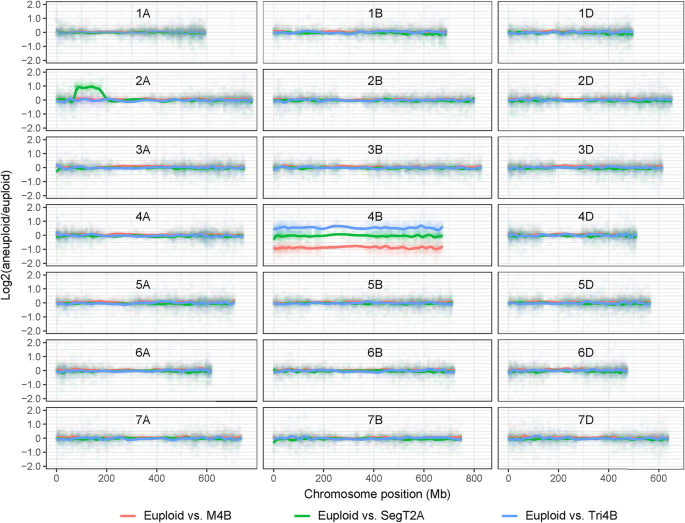
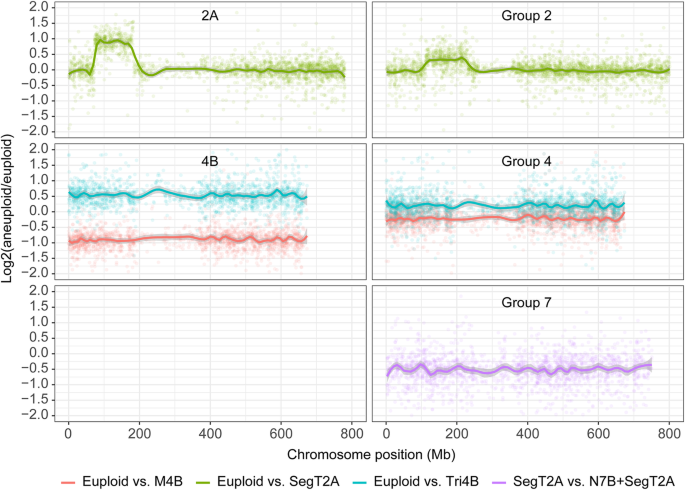
非整倍体对整体转录组的影响最初是通过产生fold change [log]来量化的2(非整倍体/整倍体)]的分布。一个明确的结论是,在非整倍体剂量下,映射到染色体上的基因,在大多数情况下,转录水平与它们的拷贝数成正比(图。2).因此,与4B染色体定位基因的整倍体转录水平相比,Tri4B植株的转录水平高约0.5倍,M4B植株的转录水平低约0.5倍。类似地,在染色体2A的片段中,涉及SegT2A复制的806个基因在SegT2A植物中转录量大约是整倍体植物的两倍;此外,对于位于复制片段之外的2A染色体基因,几乎没有证据表明非整倍体条件对其转录强度的任何影响(图。2).
Pearson相关测试估计了非整倍体染色体/染色体段内的基因比例,显示了它们的转录水平与剂量相关的改变。在4B染色体上鉴定的2171个基因中,1862个(85.8%)的转录本丰度与基因剂量呈正相关。对复制的染色体2A段内的465个基因进行类似的计算表明,有360个(77.4%)基因转录水平与该段的剂量相关。
非整倍体对受影响染色体上的基因转录的影响比其他地方的更大
利用非整倍体和整倍体植物之间的差异转录基因集(DTGs),比较非整倍体对受影响染色体/染色体段内的基因转录和其他位置的基因转录的影响。N7B + SegT2A的转录组不包括在本分析中,因为它对7B染色体无功能。基于M4B、Tri4B和整倍体转录组的比较表明,单体条件比三体条件对整体转录组的干扰更大:在M4B中,有1104个基因被分类为DTGs,而在Tri4B中只有236个(表)2),表明相对基因剂量效应明显(2为整倍体/M4B;1.5 Tri4B /整倍体)。在M4B与整倍体对比中,有1029(93.2%)定位于4B染色体,在Tri4B与整倍体对比中有225(95.3%)定位于4B染色体。在这些dgs中,有186个在M4B中下调,而在Tri4B中上调。对于使用SegT2A与整倍体对比分析的2A染色体基因,331个dgs中有265个(80.1%)定位到2A染色体。
在未被定位到非整倍体的染色体/染色体段的dgs中,大多数是由于非整倍体条件而下调的(表)2).例如,对比N7B + SegT2A和SegT2A的转录组,发现了1667个定位于7B以外染色体的DTGs(占转录组51,061个基因的3.3%);其中N7B + SegT2A低转录组904例,高转录组763例。同样,在SegT2A中更多的非染色体2A DTGs的下调而不是上调(48/66),M4B中非染色体4B DTGs的情况也是如此(53/75)。当对这三组DTGs进行基因本体论(GO)分析时,那些具有特定氧化还原产物的DTGs得到了很好的代表(表S3.).在从N7B + SegT2a的比对比度衍生的组中,下调的基因在对光合作用的响应中过度持续,而上调的基因在对压力的反应中持续过度呈现。没有证据表明这些DTG的可能性比不受受动脉百倍状况影响的人(表2).
同种等位基因的缓冲作用
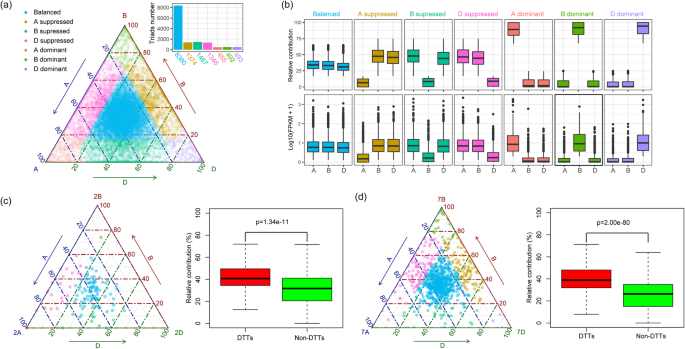
在六倍体小麦中,单拷贝基因通常由三联体同源等位基因表示。整体转录组分析显示,同源组4的染色体产生了1748个这样的三联体;同源组7染色体2102;和455来自染色体2A的复制片段(见表)3.).与基于完整转录组的分析一致(图。2),映射到在非倍差体中涉及的染色体/染色体片段的TRIAD基因的转录水平通常与它们的拷贝数成比例(对于M4B VS euploid VS TRI4B对比度,互联网对比度和1:2SEGT2a对比度)(图。3.).然而,在非整倍体中,三合体同源等位基因的总表达水平,特别是在染色体缺陷(M4B)或染色体过剩(Tri4B)的情况下,与整倍体相比,没有表现出如此显著的变化。这一关系表明,对于三联体而言,非整倍体诱导的转录紊乱在很大程度上被多个(高度相似的)基因副本的存在所缓冲。差异转录影响三联基因的频率低于影响非三联基因的频率,这证实了缓冲效应(表)3.).例如,在M4b vs Euproid对比中,1748个职业组4染色体三合组中没有一个显示差异转录的证据,而738(42.2%)映射到染色体4b的基因被归类为DTGS。额外的染色体4B副本对三合会产生的成绩的丰度几乎没有影响。然而,涉及染色体臂2分段的剂量的两个对比度(Segt2a与Euploid和N7b + segt2a Vs segt2a)揭示了相当大量的差异转录的三合会(DTT)。当在这三套非DTT上进行基因本体(GO)分析时,似乎没有明显地表示特定的GO期。
在CS小麦全基因组的18474个三联体中,75.8%(14007)的FPKM值在整倍体中高于统一。图中显示了组成三联体的每一个同源等位基因的相对贡献。4a,并且整个集合被分类为七个偏置类别,后者突出了拉姆里兹 - 冈萨雷斯等人。[24].的“平衡”范畴,三个homeoalleles做出了同等的贡献记录,由59.8%的三合会,而“single-homeoallele-suppressed”范畴是由29.9%的三合会(抑制homeolog subgenome-origin分布是:9.8%,B: 10.5%,和D: 9.6%)。“单同源等位基因显性”的频率最低(10.2%),显性同源等位基因的亚基因组来源分布为A: 3.2%, B和D均为3.5%。关于在整倍体植物中鉴定的七个转录偏倚类别(图。4b),Segt2a与Euproid对比度显示的压倒性大多数属于“平衡”,“染色体2a显性”,“染色体2b抑制”或“染色体2d抑制”类别(图。4C)。在N7B + SEGT2A VS SEGT2A对比度中识别的DTT(图。4d)也具有7B同源等位基因的强转录。
在Homeo alliales的转录中偏离映射到涉及非倍性的染色体。(一个)三元图显示整倍体植物中有14007个triads(52,021个基因)的转录丰富度。每个圆代表一个三元组,其a, B和D坐标给出了每个同源等位基因的相对贡献。同源等位基因转录偏倚类别的数量分布如图右上角所示。(b)箱线图显示了每个亚基因组的相对贡献(上图)和FPKM分布(下图),基于对七个类别的三元组分配。(c-d)左图显示的三元图显示了从对比中识别出的具有差异转录的三元组生成的转录本的丰度(c) SegT2A与整倍体(127个三联体)和(d)N7B + SEGT2A VS SEGT2A(987三合会);右侧面板显示出在各种百倍地区对DTT和非DTT的整体转录物丰富的相对贡献。学生t测试用于确定统计学意义
讨论
AllopolyPloidization是植物形态的重要驾驶员[25].一般来说,天然所有多重物种是遗传稳定的。然而,新生的所有聚倍数通常表现出高度的细胞遗传学,遗传和表观遗传不稳定[12,26,27,在全球范围内被认为是基因组冲击的后果[28].在新合成的六倍体小麦中也存在明显的遗传不一致[29,30.,31].最近的转录组比较揭示了CS面包小麦和新生SHW之间基因表达模式的明显差异[24].这些变化也可能导致新生小麦和现代小麦基因表达调控机制的差异。在这里分析的新生小麦中,非整倍体对不同染色体上的基因转录有更大的影响(CIS.-effect)比映射到其他地方的效果(反式效应)。然而,很难确切地研究CS小麦非整倍体的转录组效应,因为经过半个多世纪的驯化,基于CS小麦的非整倍体库存拥有丰富的染色体畸变,可能会混淆使用它们产生的一些实验结果[32,33].基于CS小麦品种的几条非动脉线的结果,有更多反式- 效应基因而不是CIS.- Effect基因[34].新生和现代小麦之间的这种差异表明,在面包小麦的进化过程中,一些基因的表达调节已经改变。
另一方面,我们对新生小麦的观察与CS小麦的早期观察相一致[5其中,单染色体组和三染色体组似乎略有异常,而无染色体组的活力和生育力则大大下降。在转录水平上,目前新生小麦材料的行为类似于已建立的小麦品种CS,其中大多数三合子显示平衡转录和同源等位基因显性三合子罕见[24].此外,六倍体小麦的三个组成亚基因组在转录水平上基本上是解耦的[34].换句话说,在其非整倍性诱导的对映射到无关染色体的基因的转录方面,本土从其他染色体中没有显着不同。新生和现代六倍体麦片之间的这些相似之值表明,多倍体背景和Allo oxaploidization过程本身在现代小麦的基因转录特征中发挥着重要作用。
基因产物的平衡剂量是细胞正常工作所必需的[1].由非整倍体引起的剂量改变的后果可能是细胞、组织和物种依赖的。许多非整倍体情况的一个共同特征是活力和/或生育能力的降低[2,4,5],但与二倍体相比,多倍体往往对非整倍体表现出更高的耐受性[5,7,8,9,10,11,12,13,14,15].直观地说,在一个多倍体中大多数基因的多个拷贝所代表的遗传缓冲应该赋予这种耐受性。在六倍体小麦中,这些基因以三合体表示,这些三合体似乎在转录上高度稳定,通过增加/减少其他两个同源等位基因的输出(视情况而定)来响应一个等位基因的变化量;结果是,在单体和三体系中,三合体的转录产物的丰度与整倍体相似(表)3.).当染色体增加或丢失的数目超过1时,稳定性就会崩溃,这可能是新合成的六倍体小麦的后代很少恢复严重的非整倍体状态(如缺体和四体)的原因之一[15].在同种异体情况植物中,例如那些属于属于属的物种芸苔和Tragopogon,单体植物经常需要存在额外的物质的可行性,而损伤需要通过职业中的四术来补偿[7,13].
在新形成的多倍体中建立的Homeo allialles的缓冲效果具有进化意义。一个Outalallele的突变可能具有微妙的表型效果。结果,作用以抑制新形成的新形成等位基因在新生多倍体中透射的选择压力不再适用于与它们相应的二倍体物种相同的程度[35,36].因此,缓冲是有利于遗传多样性的快速积累。在音乐会中,多倍体对突变更容忍[36,37].面包小麦从一个有限数量的创始两倍的倍数,从最近10,000年前发生了最近发生的全球多元化事件。然而,这种作物具有广泛的形态变异,占据了更大的生态利基和比其二倍体祖先的地理区域更大的多样性29].这一成功与其基因组允许快速进化的事实有关[35].
SHW是一种在各种环境中增强小麦产量的重要资源[19,20.,21].除了DNA水平的高多样性外,SHW还提供与现代小麦相比的新型基因表达模式[24,38].另外,SHW中的频繁生产是有利于操纵染色体剂量,这提供了改变基因剂量的育种策略。患有繁殖的许多基因是剂量敏感。然而,整个染色体的变化通常不利于植物生长繁殖。一些非异素体如三元组织是不稳定的,并将几代人恢复为发情类型[5].克服这个问题的一种方法是使用具有改变的基因剂量但不是改变的染色体数量的分段性非水倍性。Segt2a,其染色臂2a的一段的四个拷贝,是这种节条件的间倍性。Segt2a植物产生比欧倍体植物更大的尖峰。在小麦育种中使用Segt2a正在进行中。
异源多倍体植物对非整倍体的耐受性为研究基因剂量变化对基因互作的影响提供了一个方便的模型。目前的研究提出了许多调控同源等位基因转录的途径,这些见解可能有助于理解异源多倍体基因组的进化和多倍体作物物种的育种。
结论
在本研究中,我们对来自合成六倍体小麦的4个非整倍体系进行转录组分析,这4个非整倍体系代表原始面包小麦在祖先的六倍体化早期发生。我们发现,受影响染色体内的大多数基因转录水平与它们的拷贝数成正比。非整倍体对以非整倍体剂量映射到染色体上的基因的转录强度的影响大于对基因组中其他位置的基因的影响。此外,非整倍体对同源组没有偏倚影响。我们的实验揭示了一种被称为同源表达缓冲的显著现象,即同源词的一个副本的变化对所有同源词的总表达没有什么影响。这一机制可以维持重复基因的总表达量平衡,从而可以解释为什么异源多倍体植物对非整倍体具有高度的耐受性,特别是当一条染色体丢失(单倍体)或获得(三体体)时。我们的发现揭示了同源基因的遗传调控,并对理解异源多倍体基因组进化和作物育种具有重要意义。
方法
植物材料
使用的非细胞单独的个体从源自在四倍体亚种之间形成的杂种的SHW的自私后代产生小麦属植物turgidum ssp。turgidumAs313(含有六倍倍细小麦的A和B子组)和二倍体Ae。tauschiissp。tauschiiAS60 (D subgenome)。初始双异源单倍体(S1代)自花授粉产生S2代。所选非整倍体个体为S2分离株;参与非整倍体的染色体是整个4B和7B染色体和2A染色体短臂的一段(图2)。1)[39].通过对苗期根尖的核型分析,对选育的染色体组成进行了监测。选择的植株在2014-2015年作物生长季(北纬30°36′,西经103°41′)田间种植后进行表型监测。本研究使用的所有植物材料均由四川农业大学麦科研究所合成并保存。非整倍体植物的正式鉴定由本文通讯作者进行。
核型化
用于处理根尖样本的协议并执行多色鱼,然后执行komuro等人描述的那些。[40和Zeng等人[39].寡核苷酸探针Oligo-PSC119.2和Oligo-Pta535由清音生物技术公司(北京,中国)合成,5'末端标有Tamra或6-Fam。如Hao等人所述进行原位杂交(GISH)实验。[41.].为了区分三个小麦亚基因组的染色体互补,从A基因组供体中提取总基因组DNA小麦属植物urartu和D基因组供体Ae。tauschii分别标有Digoxigenin-11-DUTP和BIOTIN-16-DUTP(Roche Diagnostics GmbH,Mannheim,Germany)。未标记的基因组DNA来自Aegilops Spottoides.(推定的B基因组供体)用于阻断。
样品制备和转录组测序
在标题阶段收获的整个尖峰在液氮中冷冻并在-80℃下保持直至需要。根据制造商的说明,使用RNAPREP纯植物套件(天根,北京)从冷冻组织中提取总RNA。使用2100生物分析仪(Agilent Technologies,Palo Alto,USA)评估所得RNA的完整性和质量。根据制造商的建议,使用Nebnext®Ultra™RNA文库预制套件构建了转录组文库的Milumina(新英格兰Biolabs,USA)。在标准协议之后,使用Hiseq 2000平台(Illumina,San Diego,CA)使用Hiseq 2000平台进行测序。通过施加Q30阈值的80%的Q30阈值和最大0.2%的含糊不清的底座来丢弃污染物和低质量读数。
读取对齐和RNA-SEQ数据分析
Tophat V2.0.11软件(http://ccb.jhu.edu/software/tophat/index.shtml.)用于对准CS面包小麦参考基因组序列的清洁读数(urgi.versailles.inra.fr /下载/ iwgsc / IWGSC_RefSeq_Assemblies / v1.0),允许每个对准最多一个不匹配(参数:Bowtie1-N 1 -R 40 - Llibrary型Fr-Unstrand)。为了避免由于转录组序列的虚假分配给不正确的小麦基因组的偏见表达估计,如pfeifer等人所述,过滤了Tophat返回的“Accepted_hits.bam”文件。[42.].基于GFF文件和BAM文件,使用来自Python Package Htseq [43.].从FPKM值估算转录物丰富[44.].利用基于log的“cor”函数,对作为生物复制的三、四株单株进行Pearson相关分析2(fpkm + 1) - 转换数据[42.].使用DESeq2程序对原始读计数进行归一化后,识别出dgs [45.].与罗斯福调整相关的成绩单P价值 [46.< 0.05则认为转录本丰度差异有统计学意义。使用OmicShare平台(www.omicshare.com/tools/Home/Report/goenrich).小麦GO注释文件从URGI网站下载(urgi.versailles.inra.fr/download/iwgsc/iwgsc_refseq_annotations/v1.0/).
对转录本丰度差异的评估
每个转录物的观察到的每转录物的FPKM值都在每个基因型的三个或四个复制样品上进行平均。在至少一种基因型中记录了比统一的FPKM值大的基因被列入空腹和各种百倍的FPKM值之间的比率的计算中。日志2使用R软件包ggplot2 v3.1.0绘制这些比值与基因的物理位置的值[47.].同时,在r为0.1英寸的光滑跨度(箱宽)的跨度跨越0.1的跨度沿染色体的长度的分布施加黄土函数。
染色体剂量对转录本丰度的影响
进行Pearson相关试验以测试每个转录物的丰度是否(仅包括在至少一种基因型中记录在至少一种基因型中记录的FPKM值大的那些基因)与其定位的染色体的剂量有关。48.].给定基因型的每种重复被认为是一个独立的实验单元。所结果的P使用R中的调节方法调整FDR的FDR。用于考虑基因用量和转录物丰度之间的相关性的FDR阈值设定为0.05。
同源等位基因集成员的转录谱分析
分析集中于一组55,422个基因,代表三组三个家庭链路(“三合会”):在三种小麦子组织中的每一个中的三合组中映射到一个同期区域的17,400个基因,而在1074个三合会中映射到的那些非为期地区[24].为了使分析包括只有一个同源等位基因转录的三元组,假设当三个同源等位基因的FPKM值之和大于统一值时,一个三元组被转录。以每个三元组的FPKM值作为分母,标准化每个同源等位基因的相对转录丰度。每个同源等位基因的相对贡献用R package ggtern v3.1.0 (www.ggtern.com).利用R软件包ggplot2 v3.1.0计算和可视化基因型间的折叠变化[47.].FDR调整的P根据R的单因素方差分析,确定三联转录本丰度显著性的阈值设为0.05。
非整倍体的表型后果
当叶子完全扩张时,测量前三个幼苗叶中的每一个的长度和宽度。植物高度被认为是最长的分蘖高度,并且尖刺长度和小穗数量从该舵柄中测量。在仅基于初级和次级小花的基础上评估生育率。
统计分析
所有统计分析使用R v3.4.4软件或Microsoft Excel 2007实现的程序进行。
可用性数据和材料
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。本研究产生的RNA-SEQ数据已在国家生物技术信息序列读取存档中存放(登录号。Prjna607628)。
缩写
- CS:
-
中国的春天
- 壳体:
-
差异转录基因
- DTT:
-
差异转录的三合会
- 鱼:
-
荧光原位杂交
- FPKM:
-
每千碱基的基因片段每百万图读
- 吉斯”:
-
基因组原位杂交
- 走:
-
基因本体论
- M4B:
-
缺少一份染色体4B副本
- n7b + segt2a:
-
缺乏染色体7b的两份,以及SEGT2a携带的相同改变的染色体2a版本
- segt2a:
-
覆盖四个染色体臂2份的副本
- SHW:
-
合成六倍体麦
- Tri4b:
-
染色体4B的三元
参考
- 1.
Birchler JA, Veitia RA。基因平衡假说:连接生物学各学科剂量敏感性问题。美国国立科学院。2012; 109(37): 14746 - 53。
- 2.
基因拷贝数改变的成本效益分析。细胞。2013;152(3):394 - 405。
- 3.
朱家,蔡HJ,戈登Mr,Li R.与非倍性相关的细胞应激。DEV细胞。2018; 44(4):420-31。
- 4.
Blakeslee AF,Belling J,Farnham Me,Bergner广告。在Jimson杂草中的单倍体突变体,“Datura stramonium”。科学。1922年; 55(1):646-7。
- 5。
西尔斯ER。普通小麦的非整倍体。密苏里州哥伦比亚:密苏里大学农业试验站研究通报572.1954。
- 6。
西尔斯ER。小麦多倍体种的细胞遗传学研究。染色体畸变在单倍体的后代triticum vulgare..遗传学。1939; 24(4):509-23。
- 7。
Chester M, Gallagher JP, Symonds VV, da Silva AVC, Mavrodiev EV, Leitch AR等。最近形成的天然异源多倍体物种的广泛染色体变异,Tragopogon miscellus(菊科)。美国国立科学院。2012, 109(4): 1176 - 81。
- 8。
Gaeta RT,皮雷JC, Iniguez-Luy F, Leon E, Osborn TC。再合成中的基因组变化芸苔属植物显著以及对基因表达和表型的影响。植物细胞。2007;19(11):3403 - 17所示。
- 9。
Gupta PK,Priyadarshan PM。Trypitee:现状和未来的前景。adv genet。1982; 21(1):255-345。
- 10.
林志强,苏志强,苏志强,等。在新近形成的多倍体中染色体的快速进化Tragopogon(菊科)。《公共科学图书馆•综合》。2008;3 (10):e3353。
- 11.
Mestirei I,Chague V,Tanguy Am,Huneau C,Huteau v,Belcram H,等。新合成的小麦allohexpaploids显示祖先依赖性的减少稳定性和非倍性,但结构基因组添加性。新植物。2010; 186(1):86-101。
- 12.
Ramsey J, Schemske DW。开花植物的新多倍体。acta Ecol Syst. 2002;33(1): 589-639。
- 13.
Xiong Z,Gaeta Rt,Pires JC。同种振荡和染色体补偿在重新合成的全多倍体中保持基因组平衡芸苔属植物显著.美国国立科学院。2011; 108(19):7908-13。
- 14.
周平方。从陆地棉非整倍体看二倍体与多倍体的差异。Hereditas。2003;138(1):65 - 72。
- 15.
张浩,卞勇,勾小龙,朱波,徐超,齐波,等。持久的全染色体非整倍体通常与新生的六倍体小麦有关。美国国立科学院。2013年,110(9):3447 - 52。
- 16。
木原H.发现dd分析仪,其祖先之一triticum vulgare..阿格利司园艺。1944;19:889 - 90。
- 17。
McFadden es,Sears Er。的起源小麦属植物spelta和它的自由脱粒的六倍体亲戚。J在这里。1946;37(4):81 - 9。
- 18。
郝明,张丽,赵丽,戴胜,李安,杨伟,等。面包小麦二级基因库的育种策略:合成六倍体小麦的渐渗。acta photonica sinica, 2019;132(8): 2285-94。
- 19。
李安,刘丹,杨伟,毛磊。合成六倍体小麦:昨天、今天和明天。工程。2018;4(4):552 - 8。
- 20.
Trethowan R,Mujeeb-Kazi A.新的种质资源,用于改善六倍体小麦的环境压力耐受性。农作物科学。2008; 48(4):1255-65。
- 21.
Warburton ML,Crossa J,Franco J,Kazi M,Trethowan R,Rajaram S等人。将野生亲戚带回家庭:在CIMMYT改善小麦种质中恢复遗传多样性。Euphytica。2006; 149(3):289-301。
- 22.
陈志强,陈志强,陈志强,等。四倍体、非整倍体与癌症的关系。中国科学(d辑:地球科学)2007;17(2):157-62。
- 23.
非整倍体与癌症。大自然。2004;432(7015):338 - 41。
- 24.
Ramirez-Gonzalez Rh,Borrill P,Lang D,Harrington SA,Brinton J,Venturini L等。多倍体小麦的转录景观。科学。2018; 361(6403):eaar6089。
- 25.
Harlan JR, JMJ D,网址:Ö。退缩和祈祷:多倍体的起源。机器人启41 1975;(4):361 - 90。
- 26.
同源L.遗传和外延诱导植物中的遗传学相互作用。植物mol biol。2000; 43(2-3):387-99。
- 27。
Madlung A,Tyagi AP,Watson B,Jiangh H,Kagochi T,Doerge Rw等。合成拟南芥多倍体的基因组变化。工厂J. 2005; 41(2):221-30。
- 28。
基因组对挑战的响应意义。科学。1984;226(4676):792 - 801。
- 29。
Feldman M,Levy AA。小麦国内聚吡化倍化因基因组演变。遗传学。2012年; 192(3):763-74。
- 30.
李爱华,刘丹,吴建军,等。六倍体小麦异源多倍体杂种优势的mRNA和小RNA转录组动态同源调控。植物细胞,2014,26(5):1878 - 900。
- 31.
Yan J,Jiang X,Zhang L,Wu J,Yin L,Zhang R等人。制作面包:新合成的Allohexaploid小麦的见解。莫尔植物。2015; 8(6):847-59。
- 32.
Devos Km,Sorrells Me,Anderson Ja,Miller Te,Reader Sm,Lukaszewski Aj,等。小麦含有含有含氟类 - 四组织和diteloomic系的染色体畸变。咖喱店。1999年; 27(3):231-9。
- 33.
王D,杜P,Pei Z,庄L,齐Z。中国春季非素倍性高分辨率核型的开发与应用。Acta Genet Sin。2017; 43(11):1575-87。
- 34.
张安,李恩,龚升,苟X,王b,邓x等。六倍体小麦全染色体非倍性基因表达的全局分析。植物理性。2017; 175(2):828-47。
- 35.
关键词:多倍体小麦,基因组可塑性,驯化abstract:科学。2007;316(5833):1862 - 6。
- 36.
Krasileva kv,vasquelz-gross ha,howell t,bailey p,paraiso f,clissold l等。揭示多倍体麦的隐藏变异。美国国立科学院。2017; 114(6):E913-21。
- 37.
蔡H, Missirian V, Ngo KJ, Tran RK, Chan SR, Sundaresan V,等。通过多倍体化生产高效耕作群体。植物杂志。2013;161(4):1604 - 14所示。
- 38.
郝敏,李爱华,石涛,罗建军,张磊,张旭东,等。在合成的六倍体小麦中,同源转录本的丰度被杂交破坏,并通过基因组加倍部分恢复。BMC基因组学。2017;18(1):149。
- 39。
曾东,罗建军,李志,陈刚,张磊,宁胜,等。面包小麦和新合成的六倍体小麦品系之间的同源特异性标记的高转移性。《公共科学图书馆•综合》。2016;11 (9):e0162847。
- 40。
基于荧光原位杂交技术的小麦基因组和染色体分布模式研究。基因组。2013;56:131-7。
- 41。
Hao M,Luo J,Zeng D,Zhang L,Ning S,Yuan Z等。QTug.sau-3B是小麦六倍化的主要定量特质基因座。G3(Bethesda,MD。)。2014; 4(10):1943-53。
- 42.
Pfeifer M,Kugler Kg,Sandve SR,Zhan B,Rudi H,Hvidsten TR,等。基因组在六倍体面包小麦的晶粒转录组中相互作用。科学。2014; 345(6194):1250091。
- 43.
Anders S,Pyl Pt,Huber W. Htseq-A Python框架,用于使用高吞吐量排序数据。生物信息学。2015; 31(2):166-9。
- 44.
基于RNA-Seq的哺乳动物转录组的定位和定量研究。Nat方法。2008;5(7):621 - 8。
- 45.
Anders S,Huber W.序列计数数据的差异表达分析。基因组Biol。2010; 11:R106。
- 46.
Benjamini Y,Hochberg Y.控制虚假的发现率:多种测试的实用和强大的方法。J R STAT SOC B. 1995; 57(1):289-300。
- 47.
Wickham H. GGPLOT2:用于数据分析的优雅图形。纽约,纽约:Springer-Verlag;2016年。
- 48.
Shi X,张C,Ko DK,陈ZJ。基因组的剂量依赖性和无关调节有助于植物多倍体中的基因表达和进化新颖性。mol Biol Evol。2015; 32(9):2351-66。
致谢
不适用。
资金
该研究得到了中国(2016YFD0102000)和中国国家自然科学基金(31661143007)的国家重点研发方案的财务支持。该资助者在研究设计,数据收集和分析中没有作用,决定发布或准备稿件。
作者信息
从属关系
贡献
MH和DL构思并指导了这项研究;DZ、JG、MH和DL分析数据;DZ, MH, LM, DL撰写手稿。DZ,詹。,JL, LB Z, YL, WC, LQ Z, SN, ZY, AL, YZ, LM, DL. and MH conducted the experiments and provided key advice. All authors read and approved the final manuscript.
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1
:图。S1新合成的六倍倍麦的鱼核型。(a)含有2n = 42.(b)M4b:缺乏一份染色体4b副本(红色箭头)的植物。(c)TRI4B:携带额外染色体4B副本的植物(红色箭头)。(d)SEGT2a:植物含有染色体短臂短臂的重复段(红色箭头)。(e)N7B + SEGT2A,植物缺乏染色体7B的拷贝,并含有染色体2A的短臂的重复段(红色箭头)。图。S2基于FISH和gsh的核型分型用于验证SegT2A材料的非整倍体状态。(a)携带2A染色体野生型拷贝的SHW系的FISH核型;(b)带有2A染色体版本(箭头)的SHW系的FISH核型,显示包含其短臂部分的复制。(c)携带SegT2A的SHW系的GISH核型。核型表明,染色体2A的副本包含从a亚基因组染色体遗传的额外序列。基于探针Oligo-pSc119.2(红色)和Oligo-pTa-535(绿色)的标记。表S1非整倍体对叶长和叶宽的影响。*, **:表示不同的P ≤ 0.05 and ≤ 0.01, respectively (statistical significance was determined using Student’st测试)。在各种百倍的植物和非素倍增物M4b,三萜和segt2a和N7b + segt2a和segt2a之间进行比较。表S2RNA-SEQ读取及其与CS小麦参考基因组序列V1.0的对齐。一个根据PFEIFER等人建议的标准指定的唯一对齐读数。[42.].表S3去分析DTGS映射到不涉及非倍性的染色体。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
曾,D.,Guan,J.,Luo,J.等等。初生六倍体小麦耐受非整倍体能力的转录组学研究。BMC植物BIOL.20.97(2020)。https://doi.org/10.1186/s12870-020-2309-6
收到了:
接受:
发表:
关键词
- Homoeolog缓冲
- 非整倍性
- 多倍体
- 合成小麦