摘要
背景
干旱和高温胁迫都是严重的全球性问题,导致农业生产损失。MicroRNAs (miRNAs)在植物物种应对个体干旱和热胁迫中发挥着重要作用。然而,在像番茄这样的作物中,与干旱和高温结合有关的miRNAs和mrna仍然不清楚。
结果
我们研究了在田间条件下经常发生的干旱和热胁迫同时生长的番茄植株中mirna及其靶基因的串扰。共鉴定出代表55个miRNA家族的335个已知miRNA和430个潜在的新miRNA茄属植物lycopersicumL.使用小RNA深度测序。通过表达分析,研究了与干旱、高温及其组合相关的miRNAs。总的来说,分别有61、74和37个mirna在组合(两种胁迫)与对照、组合与干旱和组合与热的情况下受到差异调控。通过降解组测序发现不同表达水平的靶基因,主要涉及转录因子活性、序列特异性DNA结合、转录、转录调控、细胞核、DNA结合等。实时定量聚合酶链反应(qRT-PCR)结果证实了测序的准确性。
结论
我们的研究为作物如何通过调控miRNAs和mrna适应干旱和热胁迫提供了宝贵的知识,为作物改良以应对未来的气候变化提供了信息。
背景
由于缺水引起的干旱胁迫被认为是最具破坏性的非生物胁迫,它可以发生在作物的任何生长阶段,最终造成作物产量损失[1].高于最佳温度引起的热胁迫可引起植物的复杂反应[2].更重要的是,考虑到气候变化和极端天气事件,旱热同时发生的频率有所增加,尤其是在夏季[3.,4].
植物中的MicroRNAs (miRNAs)是一类内源性的非编码rna,约有21个核苷酸(nt) [5].由于miRNA与靶基因之间具有广泛的互补性,在植物中miRNA通过靶基因切割来调控基因的表达[5].miRNAs-mRNAs之间的关系已通过在各种作物中的dengradome测序得到广泛确认,如番茄[6]和果园草[7].植物中miRNAs和mrna的主动反应广泛与个体非生物胁迫有关,包括干旱条件[7,8]和高温[6].发现111个miRNAs主要在聚乙二醇(PEG)溶液脱水12 h后的小麦中表达[8], 41个mirna对18天单个干旱条件有响应,487个mirna靶向5950个基因[7].此外,96和150个miRNAs在耐热野生番茄中中等(33°C)和急性高温(40°C) 8 h中表现出不同的表达水平[6].57个保守mirna和41个新mirna在细胞中表达水平不同桦木属luminifera经45°C的0.5 h和4 h处理[9].然而,miRNAs在作物中响应复合胁迫的生物学和分子机制尚不清楚。
番茄作为研究科学研究生理和分子反应的模式作物,对干旱和高温都很敏感[10,11],在伴有热浪的半干旱/干旱地区,其生长和产量受到限制。与生理生化反应相比,番茄对干旱高温复合胁迫的遗传响应研究还很有限。例如,高温和干旱同时施用使番茄在气体交换、叶绿素荧光、碳水化合物和活性氧(ROS)等方面既有共同的反应又有独特的反应[10,11].转录组分析拟南芥在干旱和热联合胁迫下表现出独特的防御反应模式[12].然而,在复合胁迫下的番茄中,miRNAs与mrna之间的调控机制,以及个体与复合胁迫在转录后调控水平上的串扰,尚需进一步研究。
褪黑素,N-乙酰-5-甲氧基色胺,是一种众所周知的激素,在植物对非生物胁迫的反应中发挥作用[13,14].中等干旱(退水)和低温(2±0.5°C)条件下48h均可触发内源性褪黑素,参与大麦干旱启动和冷胁迫反应[13].马丁内斯等人(2018)指出,褪黑素调节与氧化应激和ROS解毒相关的基因和酶,以提高番茄在盐和热联合环境下的耐受性[14].在本研究中,褪黑素浓度的显著增加被认为是番茄对施加胁迫的响应信号,因为褪黑素在植物非生物胁迫中的重要作用[13,14].我们使用高通量测序(HTS)检测miRNA,并通过降解组分析在番茄中鉴定靶基因。在胁迫处理36小时后,当褪黑素浓度显著增加时,进行了3个生物重复。我们描述了具有显著不同表达水平的靶基因的作用。通过实时定量聚合酶链式反应(qRT-PCR)分析进一步验证miRNAs及其靶标的表达水平。我们旨在引起人们对干旱和高温同时发生时番茄miRNAs-mRNAs调控的关注。我们将概述在单独和联合胁迫下,番茄中以褪黑素为信号的差异表达miRNAs和靶基因之间的相互作用。这将有助于揭示作物复合胁迫反应的转录后调控机制。
结果
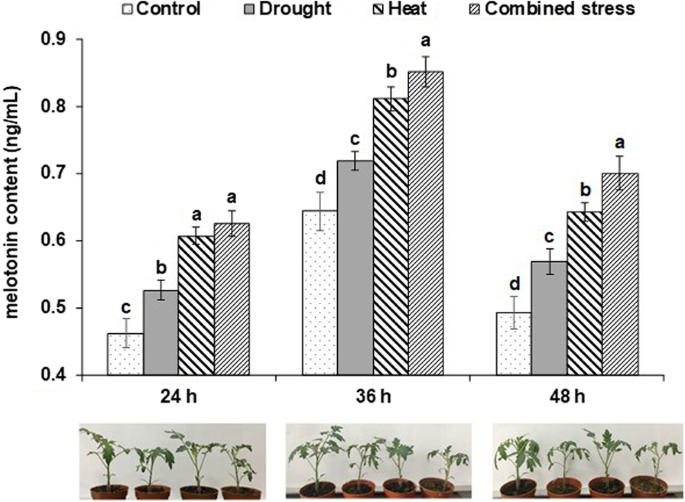
如图所示。1, 3种胁迫下番茄内源褪黑素含量在24 h、36 h和48 h均显著高于对照。在三个时间点上,与干旱胁迫相比,热应激诱导的褪黑素含量显著升高(图2)。1).在36小时和48小时,与单独的压力相比,联合压力引发了显著高的褪黑素含量积累(图2)。1).因此,我们选择了36 h的样本,这是四种处理之间褪黑素含量首次出现显著差异的时间点。
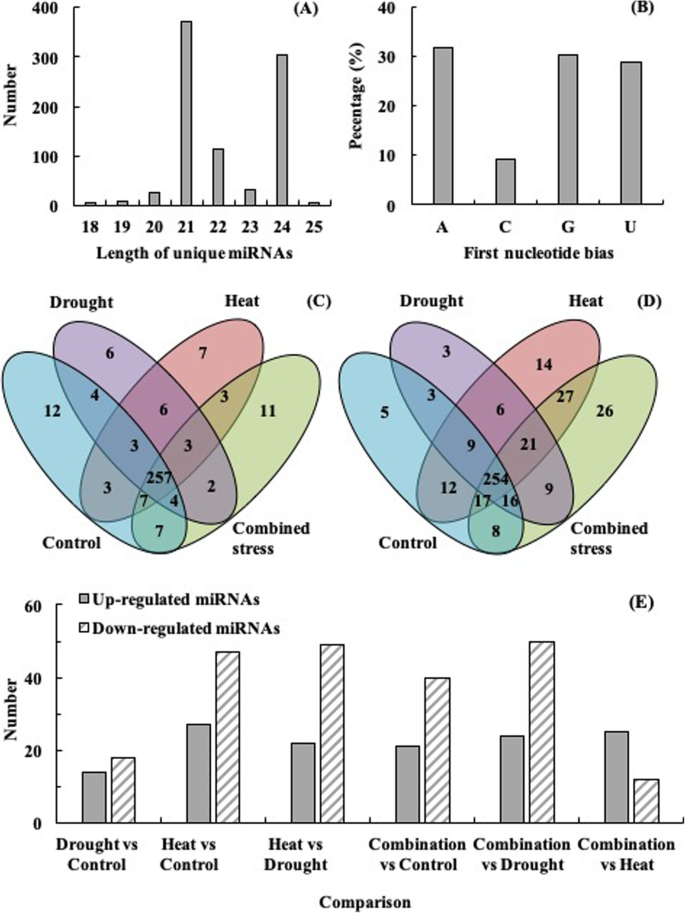
在对照、干旱、高温及其组合条件下,分别鉴定出11,490,162、10,175,417、12,103,236和13,096,254个原始reads(表1).从4个处理的番茄原始reads中筛选出34.39、32.01、32.68和32.94% (reads/reads)的冗余reads。然后,我们分别获得了7539,067、6,918,517、8,148,031和8,781,914个番茄在对照、干旱、高温及其组合下的有效读数(表1).在去除多余的miRNAs后,在四个处理的番茄中总共鉴定出765个miRNAs,其中335个是保守的,430个是新miRNAs(补充表)S1).所鉴定的miRNAs长度从18 nt到25 nt不等,其中21 nt(42.69%)最多,其次是24 nt(34.98%)(图2)。2a).在765个miRNAs中,分别有31.68、30.19和28.78%的miRNAs在5 '端以腺嘌呤、鸟嘌呤和尿苷开头(图1)。2b).四个文库中共有257个保守mirna和254个新mirna(图2)。2c, d)。与单独的干旱和高温相比,在联合胁迫下,番茄中特异性鉴定出28(7 + 7 + 11 + 3)和24(7 + 4 + 2 + 11)个保守mirna(图4)。2c).对于新型miRNAs, 78(17 + 8 + 26 + 27)和59(8 + 16 + 9 + 26)个miRNAs仅存在于番茄在复合胁迫下与单个干旱和高温相比(图。2d).在四种处理中,有11个保守的mirna和26个仅在联合胁迫下的番茄中发现的新mirna(图4)。2c, d)。
与对照相比,32、74和61 miRNAs的表达水平在干旱、高温及其组合条件下发生了显著变化(图2)。2e、补充表S2).此外,与单一干旱和高温相比,在联合胁迫下,番茄中74和37个miRNAs的表达水平发生了显著变化(图2)。2e、补充表S2).与单个干旱相比,sly-miR172a-5p的表达水平明显下降_stu和PC-298-5p显著降低,增加最多(−6.03和3.57 log . p)2足球俱乐部;FC表示复合胁迫下番茄的褶皱变化)(补充表S2).PC-113-3p表达水平下降最多(−1.90 log . 3p)2而sly-miR160a-3p_stu显著增加最多(3.52 log . FC)2与单独加热相比,在复合胁迫下番茄的FC含量(补充表S2).
基于降解体测序,在对照、干旱、高温及其组合条件下,番茄共鉴定出25,756,917、25,537,341、23,142,489和23,554,564个原始reads,分别对应4,346,794、3,377,985、3,056,688和2,869,388个独特原始reads2).鉴定出22个靶基因,33个mirna的表达水平显著改变,用于组合与对照(补充表)S3).同样,36个miRNAs的20个靶基因和26个miRNAs的14个靶基因在组合与干旱和组合与热时的表达水平分别发生了显著变化(补充表)S3).一个基因可以被多个miRNAs靶向。例如,RAP2-7由sly-miR172a-3p_csi, sly-miR172a_ath, sly-miR172e-3p_ath, sly-miR172k_gma, sly-miR172a和sly-miR172d-3p_stu在热量vs对照和组合vs对照(补充表S3).相比之下,一个miRNA可以靶向多个基因,例如sly-miR396a-5p靶向GRF3,GRF4而且GRF8(补充表S3).更重要的是,一个基因可能是单个miRNAs的靶标。例如,HSP22.7被PC-287-5p靶向,被鉴定为热与对照、热与干旱、组合与热(补充表S3),表明该miRNA及其靶标的具体调控作用。
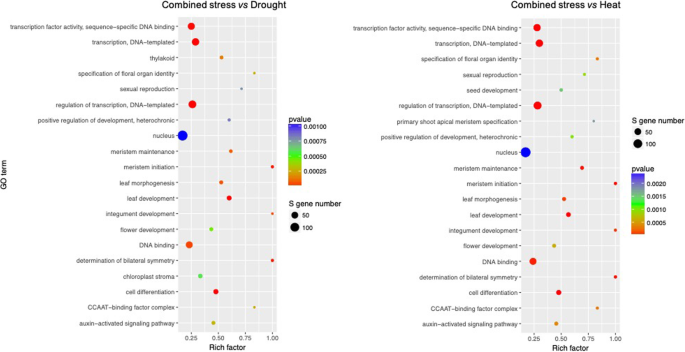
为了了解不同表达水平的靶基因的功能,我们进行了氧化石墨烯富集分析。与对照相比,不同表达水平的个体胁迫主要作用于转录因子活性、序列特异性DNA结合、转录、转录调控、DNA结合等方面(补充图)S1).与单个胁迫相比,组合胁迫后不同表达水平的基因主要在转录因子活性、序列特异性DNA结合、转录、转录调控、细胞核、DNA结合等方面发挥作用(图2)。3.).
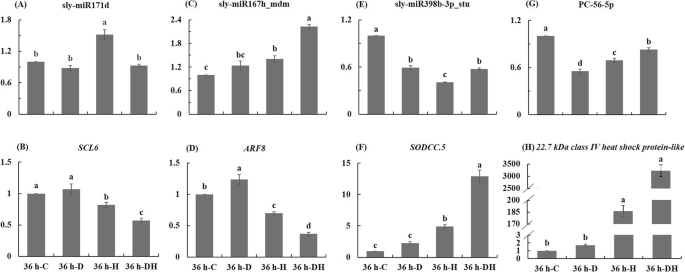
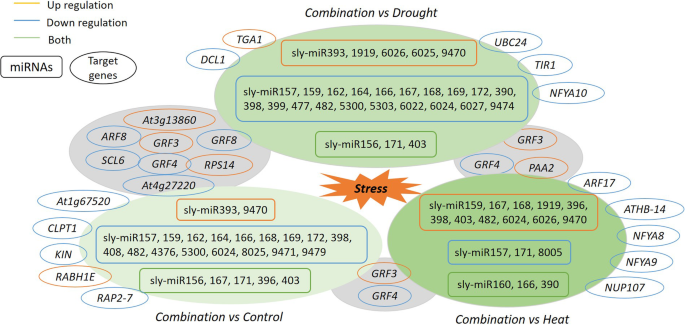
为了验证HTS的结果,通过qRT-PCR检测了4个mirna和4个靶基因的表达水平。热处理后sly-miR171d的表达水平显著升高,而其靶基因(SCL6)在加热和复合应力后显著降低(图;4a, b).经过高温和复合胁迫后,sly-miR167h_mdm的表达水平显著高于对照,而其靶基因(ARF8)在干旱后较高,在高温和复合胁迫后较低(图2)。4c, d).三种胁迫条件下,sly-miR398b-3p_stu和PC-56-5p的表达量均显著降低(图;4e, g).的表达水平SODCC.5其中,sly-miR398b-3p_stu的靶基因为22.7 kDa IV类热休克蛋白样,与对照组相比,在加热和复合应力后显著增加(图2)。4f, h).比较单独胁迫和组合胁迫下番茄叶片miRNAs-mRNAs网络。某些mirna (miR157、159、166、167、168、398、482和6024)在番茄复合胁迫下的响应是独特的,其表达水平与其他3个处理不同(图2)。5).复合胁迫对靶基因有上调作用GRF3但抑制GRF4与其他3个处理比较(图;5).
讨论
气候极端事件的频率和强度都在增加,例如自然耦合的干旱和热应激[4].了解非生物胁迫反应的潜在机制对于培育耐受性作物品种很重要[15].当干旱和高温同时发生时,番茄在生理、代谢和生化水平上产生动态和多样的反应[10,11].最近的研究广泛报道了番茄中miRNAs对高温等非生物胁迫的反应[6]和生物压力,例如5种[16),葡萄孢菌[17].
然而,迄今为止,miRNAs及其靶标在番茄中响应干旱和热胁迫的表达谱仍未被探索。因此,需要深入研究mirnas - mrna在番茄个体和组合胁迫下的调控机制,以了解它们之间的相互作用。
番茄叶片中mirna在单独和联合胁迫下的表达模式
在本研究中,结合miRNA测序和降解组分析来描述miRNA - mrna的表达谱。先前的证据表明,干旱和极端温度等非生物胁迫可以促进植物内源性褪黑素的积累[13,18].因此,以内源性褪黑素含量显著增加为信号,利用处理36 h后的番茄叶片进行HTS和降解分析。
在miRNAs中,21-nt miRNAs(42.7%)最多,其次是24-nt miRNAs(35.0%)。2a),表示植物物种中成熟miRNAs的主要长度,Zhou等人也报道过,(2016)[6]和Ji等(2018)[7].通常,成熟的miRNA被纳入argonaute (AGO)中形成rna诱导沉默复合体(RISC),导致植物中mrna的切割[5,19].AGO1优先招募具有5 '末端尿苷的mirna,而AGO2和AGO4则拥有有利于5 '末端腺苷的mirna [20.].miRNA的5 '末端nt是影响miRNA生物活性和功能的关键特征[20.].因此,我们检测了miRNAs的5 '端nt分布。本研究中鉴定出的mirna可以通过分别以腺苷和尿苷为5 '末端nt的31.68%和28.78%的mirna所示的mrna的分裂发挥关键作用(图。2b).共有335个已知的mirna分布在55个家族中,并鉴定出430个潜在的新mirna。此外,干旱与对照、高温与对照、组合与对照分别有32、74和61个mirna表达差异。
一方面,在包括番茄在内的各种植物中,miRNAs与个别干旱和高温有关。6,21].根据Candar-Cakir等人(2016)的结果[21],干旱条件对番茄幼苗地面组织miR166家族均有上调和下调的影响,但对miR165家族没有影响。Candar-Cakir等人(2016)发现干旱处理下地面组织中miR398家族miRNAs的表达普遍低于对照[21].这与我们的研究不同,这可能是由于干旱胁迫的持续时间、强度和途径以及品种特异性的差异[22].同样,miR156和miR167家族通过暴露于中度和急性升高的温度(33和40°C)而诱导[6].而sly-miR167b-3p_stu、sly-miR167d-3p_stu和sly-miR167c-3p_stu同时下调(−1.65、−0.76和−3.74 log)2FC)在这里的高温条件下。同时,sly-miR156a_stu和sly-miR156g-p3_nta表现出相反的趋势(0.92和−3.71 log)2FC)在热应力下。因此,来自同一个miRNA家族的成员可能对干旱和高温等非生物胁迫有不同的反应,尽管每个成员都很相似[21,23].MiR159是一种众所周知的对热应激敏感的miRNA [22].我们发现sly-miR159a-5p_gma和sly-miR159-p5下调(−4.16和−3.69 log)2番茄在高温下的FC),与小麦品种Ofanto的结果一致[22].另一方面,我们发现,与干旱和高温相比,联合胁迫引起了特定的mirna反应,其中74和37表现出上调/下调。加上我们之前的研究结果[10,11],在生理、ROS和miRNAs等方面,旱热结合在番茄中产生了独特的反应。
单独和联合胁迫下番茄mirnas - mrna的串扰
以往的研究揭示了番茄对个别高温或干旱胁迫的反应与miRNAs-mRNA之间的机制[6,24].例如,在番茄热反应中,163个基因靶向了138个保守的mirna, 10个基因靶向了8个新的mirna [6].在番茄干旱响应中,有1936个差异表达miRNAs的假定靶基因[24].然而,mirna在作物复杂复合胁迫反应中的作用仍未被探索。在降解组分析中,在联合与对照的情况下,共鉴定出33个miRNAs的22个表达水平改变的靶基因。此外,组合对干旱和组合对热分别上调或下调了36个mirna的20个靶基因和26个mirna的14个靶基因。
植物激素是信号通路的重要组成部分,在提高植物对非生物胁迫的耐受性方面发挥作用[25,26].SPL2在干旱和对照中检测到miR156家族靶向基因(sly-miR156a, sly-miR156a_stu, sly-miR156f-p5_stu和sly-miR156e_mtr),参与植物激素信号转导(补充表S3).此外,处理后的番茄miR398在不同程度上下调p . 5传染病、盐和干旱情况[27].SODCC.5在铜/锌超氧化物歧化酶中发挥作用,作为ROS的清除酶,保护植物免受超氧自由基的侵害[28].我们发现SODCC.5target by sly-miR398b-3p_stu(−1.20 log . log2FC)上调(2.80 log2FC)表示高温和干旱(补充表S3),表明高温和干旱条件下番茄铜/锌超氧化物歧化酶的不同调控机制。这与我们之前的研究相一致,两个番茄品种在第6天热胁迫下SOD活性高于干旱胁迫[11].
干旱和复合胁迫显著降低了3个番茄品种的气孔和气孔长、净光合作用和淀粉含量[10].的表达水平下降Solyc02g086820.3.1(5.65和5.23−−日志2FC)被PC-326-3p靶向于高温与干旱、组合与干旱,其功能主要涉及碳酸盐脱水酶活性、叶绿体、对二氧化碳的响应、气孔运动和气孔复合体发育的调控、碳利用、光合作用(补充表)S3).这表明,番茄气孔、气体交换和碳水化合物代谢的改变可能是某些mirna调控的靶点表达差异的部分结果。
生长素反应因子(东盟地区论坛)在生长素介导的应激适应和生理机制中起重要作用[29].我们发现ARF8以sly-miR167h_mdm和sly-miR167a-5p_ath为靶标的热表达水平低于对照(−2.16 log . sh)2FC),热与干旱(−2.35 log2FC)、组合vs控制(−2.37 log . log)2FC),组合vs干旱(−2.56 log . log2FC)(补充表S3).的表达水平也是如此ARF17针对sly-miR160a-5p_stu, sly-miR160a_vvi和sly-miR160a的组合与热量相比下降(−1.39 log .2FC)(补充表S3).因此,miR160和miR167抑制了arf介导的生长素反应基因的表达,导致植物在非生物胁迫下生长发育减弱[30.],特别是这里的复合应力。先前的研究表明,miR393下调了转运抑制剂反应1 (TIR1)在非生物胁迫下的植物[30.].因此,TIR1−2.98 log . log2由sly-miR393_ghr (0.97 log . ghr)定位的FC2FC基因的表达水平与干旱表达水平相反(补充表)S3).这表明,监管TIR1miR393基因可能在复合胁迫和干旱条件下发挥关键作用。生长调节因子(平),植物特异性转录因子,可协调植物在非生物胁迫下的生长过程,并已被确定在叶片发育中发挥作用[31].平在植物对干旱和高温的综合反应中起着独特的作用GRF3而且GRF4与其他三种处理相比,在联合胁迫下,miR396在番茄中显著调控。5).
高温和干旱的组合对各种植物施加了一组特定的生理抑制和独特的转录组反应,这些反应不会因施加单独的胁迫而改变[10,32,33,34].我们发现,当非生物胁迫同时发生时,mirnas - mrna一起工作并引发组合效应。具有共享miRNA识别元件(MREs)的竞争内源性rna (ceRNAs),如mrna、lncRNAs和circRNAs,竞争miRNA结合并相互调节[35].在胁迫条件下,miRNAs、mrna和其他ceRNAs的动态平衡对于调节植物细胞稳态至关重要。本研究阐明了番茄在应对联合胁迫时mirnas - mrna之间的调控网络。在未来的工作中,考虑包括lncrna和circrna在内的ceRNAs,以获得作物对动态气候的响应知识是很重要的。
结论
通过HTS、qRT-PCR和生物信息学分析,我们首次对番茄miRNA-mRNA调控网络在个体和组合胁迫下的响应进行了综合分析。我们发现,与对照和单独胁迫相比,干旱和高温联合处理的番茄中有11个保守的mirna和26个新的mirna。miRNAs-mRNAs在番茄对联合胁迫的反应中形成了复杂的调节网络。目的基因主要参与转录因子活性、序列特异性DNA结合、转录、转录调控、细胞核、DNA结合等途径。qRT-PCR验证结果与测序结果一致。综上所述,我们的研究结果为研究miRNA在复合胁迫下对番茄靶基因表达的调控提供了新的认识,为进一步分析作物在应对气候变化共同非生物胁迫过程中miRNA与靶基因之间的相互作用提供了有用的资源。
方法
植物培养和样品采集
选用江苏省农业科学院番茄热门品种“金陵美玉”种子,采用塞盘播种。该品种不耐个别高温、干旱及其组合,特别是严重干旱和复合胁迫。在相对湿度为50-60%的气候箱(RDN-560E-4,东南仪器有限公司,中国宁波)中进行栽培。气温26/18℃(白天6:00-20:00 14 h)。光强为300 μmol m−2年代−1光合光子通量密度(PPFD)(白光LED光源,宁波东南仪器有限公司)。每5天用水灌溉一次。15 d后,每3 d按日本园林试验配方进行营养液灌溉。干旱处理开始时,对一半生长24天的植株进行了蓄水。3 d后,以26℃为对照和干旱处理;在38°C的温度下,对灌溉和不灌溉的植株进行加热和联合胁迫处理。光照条件下处理48 h。在处理后24小时、36小时和48小时从顶部取下第一片完全展开的叶片,并在−80°C保存于江苏省农业科学院,江苏,南京。
内源性褪黑素含量测定
4个处理后24 h、36 h和48 h的叶片样品用于测定内源性褪黑素含量,每个处理重复3次。将叶片组织均质,并用植物MT ELISA试剂盒(蓝派生物,上海,中国)提取褪黑素。在孔中加入10 μL样品和40 μL样品稀释液,50 μL标准品作为对照。每孔加入100 μL辣根过氧化物酶。用胶条覆盖样品,然后在37°C下孵育1小时。样品在小孔中注入400 μL的洗涤液,用喷瓶抽吸冲洗5次。分别取50 μL显色剂A、50 μL显色剂B溶液与样品混合,37℃黑暗孵育15 min。加入50 μL止动缓冲液,轻拍平板,使混合充分。使用微量滴度板阅读器(F50 TECAN SUNRISE,德国)在450nm处记录15分钟内的读数。
全基因组miRNAs及其靶标鉴定
基于4个处理在不同时间点番茄内源性褪黑素含量的测定结果,采用LC-BIO(杭州,中国)公司对36 h的样品进行3个生物重复的HTS。
使用TruSeq小RNA样品制备试剂盒(Illumina, San Diego, USA)提取sRNAs。分离和结扎后,通过逆转录sRNAs文库获得cdna。纯化后,使用Illumina Hiseq2500 (LC-BIO,杭州,中国)对cdna进行测序。然后,通过对Rfam (http://rfam.janelia.org),重复数据库(http://www.girinst.org/repbase)和茄科基因组网络数据库(http://sgn.cornell.edu/).有效序列与miRbase 21.0中已知的成熟pre-miRNAs和植物中的miRNAs进行比对。在发夹臂和前体发夹的其他臂上映射到成熟mirna的序列被认为是保守的新mirna。
使用Trizon试剂(Ivitrogen, CA, USA)提取总rna进行降解组分析。样品与生物素化的随机引物混合,由珠子捕获并连接到5 '适配器。然后将连接的序列反向转录得到第一链cdna。经过纯化、消化、结扎和再纯化,利用Illumina Hiseq2500 (LC-BIO,杭州,中国)对降解文库进行测序。使用CleaveLand 3.0对降解组测序数据进行分析。降解产物密度文件由降解产物序列与。
ftp://ftp.solgenomics.net/tomato_genome/annotation/ITAG3.2_release.应用Targetfinder对靶基因进行预测。根据降解体密度文件和预测对靶基因进行关联计算,找到共同的靶基因,作为最终的靶基因。
功能分析
根据http:/进行基因本体(GO)注释geneontology.org/。对文库间不同表达水平的靶基因进行GO富集分析,公式如下:
B:有功能的mrna数量;S:具有与miRNAs功能对应的mrna数目;TB: mrna总数;TS:与miRNAs对应的mRNAs数量。
中存在的验证
4个miRNAs (sly-miR171d、sly-miR167h_mdm、sly-miR398b-3p_stu和PC-56-5p)和4个靶基因(SCL6,ARF8,SODCC.5而且22.7 kDa IV类热休克蛋白样)采用qRT-PCR方法进行验证。rna用Trizol试剂(Invitrogen, CA, USA)提取。rna使用PrimeScript第一链cDNA Synthesis Kit (TaKaRa, Dalian, China)进行反转录。miRNAs的转录条件为25°C for 10 min, 42°C for 30 min, 85°C for 5 min,靶基因的转录条件为30°C for 10 min, 42°C for 30 min, 95°C for 5 min。SYBR预混料Ex Taq由中国大连TaKaRa公司提供。qRT-PCR反应条件为95℃30 s 1次,95℃5 s, 60℃20 s,循环40次,72℃。mirna和mrna的引物见补充表S4及补充表S5,分别。根据我们之前的报道,U6snRNA和Actin分别作为miRNAs和mRNAs的参考[6].用2−ΔΔCt方法有三次生物重复和三次技术重复。
数据分析和访问
采用SPSS 16.0 (SPSS Inc., Chicago, IL, USA)对四个处理的番茄中褪黑素含量、四种mirna和四种靶基因表达水平进行方差分析(ANOVA)。用卡方检验比较mirna及其靶基因的表达水平P阈值≤0.05。
数据和材料的可用性
本研究所有数据均提交至GEO (Gene Expression Omnibus),登录号为GSE121089 (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE121089).
缩写
- 前:
-
Argonaute
- 方差分析:
-
方差分析
- 龙头:
-
竞争内源性RNA
- 地理:
-
基因表达综合
- 走:
-
基因本体论
- 高温超导:
-
高通量测序
- microrna:
-
小分子核糖核酸
- 绝笔:
-
MiRNAs识别元件
- nt:
-
核苷酸
- PPFD:
-
光合光子通量密度
- 存在:
-
实时定量聚合酶链反应
- RISC:
-
rna诱导沉默复合体
参考文献
法鲁克M,侯赛因M,瓦希德A,西迪基KHM。植物的干旱胁迫:综述。入:编辑Aroca R。植物对干旱胁迫的反应。柏林,海德堡:施普林格;2012.
柯塔克,李永强,李永强,李永强。植物热应激反应的复杂性。植物生态学报,2007;10(3):361 - 366。
非生物胁迫,野外环境和胁迫组合。植物科学进展,2006;11:15-9。
De Boeck HJ, Bassin S, Verlinden M, Zeiter M, Hiltbrunner E.模拟热浪只与干旱结合影响高寒草地。新植物,2015;209:531-41。
Jones-Rhoades MW, Bartel DP, Bartel B. MicroRNAs及其在植物中的调控作用。植物生物学,2006;57:19-53。
周荣,王强,姜峰,曹旭,孙敏,刘敏,等。通过高通量测序和降解分析,在中度和急性高温下鉴定野生番茄中的mirna及其靶标。科学代表2016;6:33777。
季勇,陈鹏,陈杰,Pennerman KK,梁霞,闫华,等。结合小RNA、RNA和降解组测序,揭示了适应干旱胁迫的叶片和根系microRNA-mRNA对的表达模式Dactylis glomerata中国生物化学杂志,2018;
马旭,辛哲,王震,杨强,郭松,郭旭,等。两种小麦叶片差异表达mirna的鉴定与比较分析(小麦l)脱水胁迫下的基因型。BMC植物生物学。2015;15:21。
潘艳,牛敏,梁娟,林娥,童志,张娟。热响应mirna在植物热应激反应调控网络中的鉴定桦木属luminifera.树木。2017;31:1635-52。
周睿,于旭,Ottosen CO, Rosenqvist E,赵玲,王勇,等。干旱胁迫对3个番茄品种复合胁迫的影响均大于热胁迫。BMC植物生物学,2017;17:24。
周荣,孔林,于旭,Ottosen CO,赵涛,姜峰,等。番茄对干旱和高温胁迫的氧化损伤及抗氧化机制植物学报。2019;41:20。
Rizhsky L, Liang H, Shuman J, Shulaev V, Davletova S, Mittler R.防御路径碰撞。回应拟南芥干旱和高温的结合。植物物理学报。2004;134:1683-96。
李霞,谭晓东,姜东,刘峰。褪黑素增强干旱启动野生型和脱落酸缺乏突变大麦的耐寒性。松果体科学,2016;61:328-39。
Martinez V, Nieves-Cordones M, Lopez-Delacalle M, Rodenas R, Mestre T, Garcia-Sanchez F,等。番茄植物对压力组合的耐受性:褪黑素保护作用的新见解。分子。2018;23:535。
Lamaoui M, Jemo M, Datla R, Bekkaoui F.作物高温干旱胁迫及其缓解方法。前沿化学。2018;6:26。
栾艳,崔娟,翟娟,李娟,韩玲,孟J.高通量测序揭示番茄接种mirna的差异表达5种.足底。2015;241:1405-16。
金伟,吴峰。与肿瘤相关的mirna的鉴定葡萄孢菌番茄叶片感染。中国生物医学工程学报。2015;15:1。
张楠,孙强,张宏,曹勇,Weeda S,任松,等。褪黑素在植物抗非生物胁迫中的作用。中国科学(d辑),2014;
Bartel DP。MicroRNAs:基因组学,生物发生,机制和功能。细胞。2004;116:281 - 97。
米生,蔡涛,胡勇,陈勇,Hodges E,倪峰,等。小rna的分类拟南芥Argonaute复合体是由5 '端核苷酸引导的。细胞。2008;133:116-27。
小RNA和降解体深度测序揭示了干旱和组织特异性microRNAs及其在干旱敏感和耐旱番茄基因型中的重要作用。中国生物工程学报,2016;14(2):366 - 366。
Giusti L, Mica E, Bertolini E, De Leonardis AM, Faccioli P, Cattivelli L,等。不同水分利用效率的硬粒小麦品种对高温和干旱胁迫的microrna差异调控。功能性整合基因组。2017;17:293-309。
张BH,潘XP,坎农CH,科布GP,安德森TA。植物microRNA基因的保存与分化。植物J. 2006; 46:243-59。
刘敏,余华,赵刚,黄强,陆勇,欧阳波。番茄干旱响应microrna的高通量测序鉴定。功能性整合基因组2018;18:67-78。
韩艳,李安,李峰,赵敏,王伟。一种小麦的性状分析(小麦L.)扩增素基因TaEXPB23参与非生物胁迫反应和植物激素调控。植物生理学报,2012;44:49 - 58。
胡赛恩·哈,胡赛恩·S,哈利克·A,阿什拉夫·U,安朱姆·SA,曼·S,等。作物植物的寒冷和干旱胁迫:影响,交叉对话,和潜在的管理机会。植物科学,2018;9:393。
栾艳,王伟,刘平。番茄新型和保守microrna的鉴定及功能分析。Mol Biol 2014; 41:5385-94。
孙佳,朱建军。两个cu / Zn超氧化物歧化酶基因的转录后诱导拟南芥是由miR398下调介导的,对氧化应激耐受性很重要。植物学报。2006;18:2051-65。
黄志刚,张志刚。生长素反应因子。植物学报。2007;10:453-60。
微rna在作物生物和非生物胁迫反应中的作用。中国生物工程学报,2014;
Omidbakhshfard MA, prost S, Fujikura U, Mueller-Roeber B.生长调节因子(GRFs):一个在植物生物学中具有重要功能的小转录因子家族。植物学报。2015;8:998-1010
Rasmussen S, Barah P, Suarez-Rodriguez MC, Bressendorff S, Friis P, Costantino P,等。转录组对胁迫组合的反应拟南芥.中国生物医学工程学报,2013;
Zandalinas SI, Rivero RM, Martínez V, Gómez-Cadenas A, Arbona V.柑桔植物对高温和干旱组合的耐受性与脱落酸水平降低调节的蒸腾增加有关。BMC植物生物学。2016;16:105。
乔杜里FK, Rivero RM, Blumwald E, Mittler R.活性氧,非生物胁迫和胁迫组合。植物学报,2017;30(4):556 - 567。
Kartha RV, Subramanian S.竞争性内源性rna (ceRNAs):基因调控复杂性的新参与者。Front Genet. 2014;5:8。
确认
不适用。
资金
感谢国家自然科学基金(NSFC, No. 31601745)、江苏省自然科学基金(No. 31601745)的资助。BK20160579)和奥胡斯大学研究基金会(AUFF资助,No. 30379)。资助机构在研究的设计、数据的收集、分析和解释以及撰写手稿方面没有发挥任何作用。
作者信息
从属关系
贡献
RZ进行实验。RZ和XY分析了数据并撰写了手稿。TmZ, CO, TlZ和ZW协助修改了手稿,所有作者都批准了最终版本的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
GO在干旱与对照、高温与对照、复合胁迫与对照中表达量差异显著的靶基因富集。
附加文件2:表S1。
对照、干旱、高温和综合胁迫下番茄中鉴定出的miRNAs的摘要
附加文件3:表S2。
对照、干旱、高温和复合胁迫下番茄差异表达miRNAs的总结
附加文件4:表S3。
通过降解分析,mirna在对照、干旱、高温和复合胁迫下对番茄中不同表达水平的靶转录物进行了裂解
附加文件5:表S4。
miRNAs的特异性qRT-PCR引物
附加文件6:表S5。
目的基因特异性qRT-PCR引物
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
周瑞,余X, Ottosen, CO.。et al。番茄叶片中响应干旱和高温联合胁迫的独特miRNAs及其靶标。BMC植物生物学20.107(2020)。https://doi.org/10.1186/s12870-020-2313-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-2313-x
关键字
- 茄属植物lycopersicuml
- microrna
- Degradome
- 功能分析
- 综合非生物胁迫