摘要
背景
基本螺旋-环-螺旋(bHLH)基因家族是植物中最大的转录因子家族之一,在不同的物种中具有不同的功能特征。然而,人们对其在经济上重要的异源多倍体油料作物中的作用知之甚少,芸苔属植物显著.
结果
我们鉴定了602个潜在的bHLHs显著基因组(BnabHLHs),根据系统发育、蛋白质结构和外显子-内含子组织分析,将其分为35个亚家族,其中包括7个新分离的亚家族。对该基因家族的内含子插入模式进行了分析,在其bHLH区域共鉴定出8种类型BnabHLHs.染色体分布和同位性分析表明,杂交芸苔属植物拉伯而且芸苔属植物oleracea膨胀机制主要为什么BnabHLHs.表达分析表明BnabHLHs广泛存在于不同的植物组织中,并形成了7种主要的模式,这表明它们可能参与了显著发展。此外,当用五种不同的激素(IAA,生长素;遗传算法3.赤霉素;6-BA,细胞分裂素;ABA,脱落酸和ACC,乙烯),表达谱BnabHLHs变化明显,很多人的表情增加了。五位候选人的入职BnabHLHs经5种激素处理后经qRT-PCR证实。最多246个BnabHLHs通过对9个亚家族的表达谱和同源功能的联合分析,预测其在根系发育中具有潜在作用。
结论
确定的602个BnabHLHs显著共分为35个亚科,同一亚科成员序列基序基本相似。总的来说,我们发现BnabHLHs可能广泛参与了植物根系的发育显著.此外,这项研究提供了重要的见解,对潜在的功能BnabHLHs在未来的基因功能研究中具有重要意义。
背景
转录因子基因广泛分布在真核生物王国中,通常包含两个不同的功能域,涉及DNA结合和转录活动[1,2].基本的螺旋-环-螺旋(bHLH)转录因子具有一个保守的50-60个氨基酸(aa)序列,负责DNA结合。该序列由两个主要区域组成,即基本区域和螺旋-环-螺旋(HLH)区域。该蛋白的n端有一个10-15 aa的碱基区,其功能是DNA识别基序,并允许与HLH区结合[3.].HLH区域由两条相对保守的两类螺旋组成,由一个发散的环连接,长约40 aa,含有母性疏水氨基酸,这有助于其在HLH区域的二聚化中发挥作用[4,5].
的bHLH基因家族早在4亿多年前就存在于陆生植物中,在植物进化过程中高度保守[6].作为植物中最大的转录因子基因家族之一,其数量bHLH基因似乎随着植物的进化而增加。例如,只有一个bHLH基因Cyanidioschyzon Merolae[6], 98 in moss [7], 208英寸玉米[8], 167英寸拟南芥[7],番茄159份[9],以及大白菜230份[10].的数量大幅增加bHLH基因参与不同的生理和发育过程,其中大多数参与代谢和发育。例如,拟南芥AtbHLH045 /静音控制顺序单元格命运[11];SlbHLH22在番茄中促进提早开花和加速果实成熟[12];bHLH转录因子刮刀(SPT)同系体对于心皮发育或内果皮边缘发育都是必需的拟南芥而且碧桃[13,14];bHLH转录因子MYC2同源物调节倍半萜和青蒿素在各种物种中的生物合成,如Aquilaria sinensis而且青蒿[15,16].与此同时,一些bHLHs与非生物胁迫反应有关,包括寒冷、干旱和盐胁迫。例如,bHLH转录因子光敏色素相互作用因子4 (PIF4)拟南芥介导植物气孔对高温的反应[17];StbHLH1马铃薯也通过调节花青素的生物合成来应对高温[18];另外,MdbHLH3在马吕斯有明显对低温有反应[19].bHLHs也对各种激素有反应。例如,拟南芥MYC2以其在脱落酸(ABA)、茉莉酸(JA)和光信号通路中的保守作用而闻名[20.,21,22].此外,bHLHs,例如,堵塞而且TT8茉莉酸应答转录因子是否参与次生代谢[23].bHLHs也有助于铁的稳态拟南芥还有大米[24,25].值得注意的是,bHLH蛋白倾向于在蛋白质复合物中发挥作用。例如,拟南芥bHLH基因GLABRA3 (GL3)/增强子glabra3 (EGL3),被广泛认为是一种表皮细胞命运规范基因和毛根调节基因,其功能是与TTG1 (WD40重复蛋白)和WER/GL1 (R2R3-MYB蛋白)形成蛋白复合体(MBW复合体)[26,27,28].
在这项研究中,我们确定了602个bHLHs在重要的经济作物中,芸苔属植物显著(BnabHLHs),并将它们映射到19个显著染色体。根据我们的系统发育分析和基因功能,我们认为B. napus bHLH基因家族分为35个亚科,其中新发现7个亚科。保守的非bhlh基序以及内含子插入模式分析进一步支持了我们的分类。染色体定位结合同步性分析揭示了其扩增机制BnabHLH年代显著.表达谱分析揭示了基因的潜在功能BnabHLHS,重点是它们在根中的可能作用。qRT-PCR分析证实了根中激素诱导直系同源功能基因的特征。
结果
显著包含大量的bHLHs
参考我们之前描述的方法[29],我们对两组测序的蛋白质组数据进行BLASTP搜索(e值< 1.0)显著基因组(Darmor -bzh[30.],以及Zhongshuang11, ZS11 [31]生态型),利用拟南芥bHLH蛋白[7]作为查询。我们发现了来自Darmor -的序列质量(包括序列完整性、序列号和基因组注释信息)bzh两种生态型的序列比较分析结果表明,该生态型优于ZS11。
结果共获得613个非冗余的bHLH编码基因显著基因组(Darmor -bzh).随后,通过ExPASy检测假定基因的蛋白序列,以确保候选基因包含bHLH结构域。因此,由于ExPASy分析未鉴定出bHLH结构域,因此从我们的数据集中排除了11个基因。同时,65BnabHLHs来自daror - bzh的数据被来自ZS11基因组的数据更正(附加文件1:表S1)。最后,共有602人BnabHLHs具有相对完整的开放阅读框架[32],约占显著蛋白质编码基因。在小麦,水稻,玉米,和拟南芥分别为0.55、0.47、0.59和0.61% [16].候选人BnabHLHs然后根据他们的染色体分布命名(附加文件1:表S1)。对BnabHLH的理化性质分析表明,BnabHLH蛋白的长度在63 ~ 1440 aa之间;分子量范围为6.9 (BnabHLH105) ~ 165 kDa (BnabHLH381);等电点范围为4.36 (BnabHLH562) ~ 11.79 (BnabHLH023)。亚细胞定位分析表明,所有的BnabHLHs都位于细胞核(附加文件1:表S1)。
为了进一步在不同物种之间进行比较分析,我们确定了245个物种bHLHs在b . oleracea用同样的方法获得基因组(附加文件2:表S2)。的序列信息bHLHs在其他物种中拟南芥,b·拉伯,番茄,土豆和大米的研究结果来源于先前发表的研究[8,9,10,16,33].
BnabHLH蛋白bHLH结构域的序列特征
为了研究aa序列特征,我们对候选BnabHLHs的602个bHLH结构域进行了多序列比对分析。使用Weblogo在线软件将结果可视化。
结果表明,BnabHLH结构域的长度约为55 aa,从39到57 aa不等。bHLH结构域在该基因家族中普遍保守显著,其中10个残基在bHLH结构域的保守性超过70%(图2)。1A),其中4个位于基区,5个位于两个螺旋区,1个位于环区。与其他研究一致[7,8,9,10], Leu-25是最保守的残渣,几乎100%(附加文件)3.:表S3),表明其在bHLH蛋白中起重要作用。有趣的是,fe -30部分被Ser in取代拟南芥然而,在其他食物中,没有观察到这种替代显著,b . oleracea或b·拉伯,(附加文件3.:表S3),表明这三个物种之间有较高的保护和/或密切的关系。
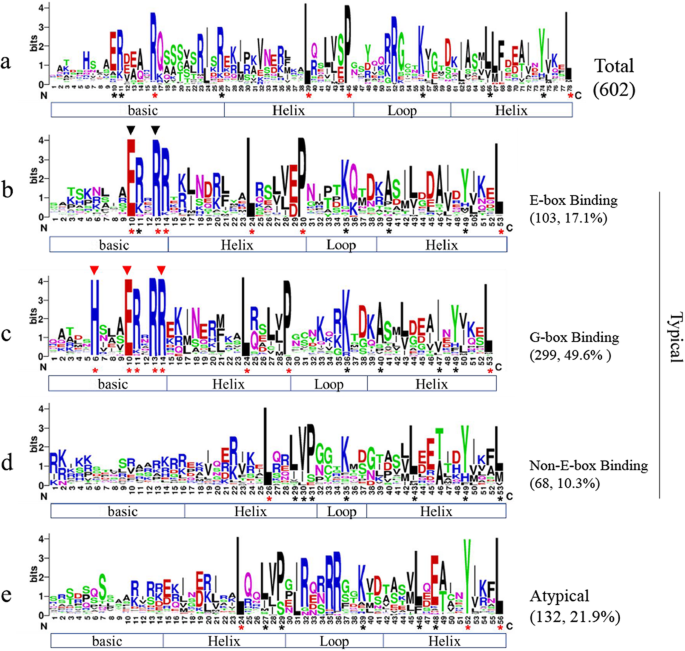
不同dna结合类型bHLH结构域的序列特征。对所有候选蛋白的bHLH结构域进行了多次序列比对,然后对给定dna结合类型的蛋白质的结构域进行了比对。括号内的数字表示某一类BnabHLHs的数量。蛋白质二级结构在序列下显示。红色星号表示相似度超过90%的残基;黑色星号表示相似性超过70%的残基。序列顶部的黑色三角形表示E-box识别位点;红色三角形表示g盒识别位点。如果bHLH结构域具有至少5个基本残基,但没有E-box/G-box结合位点,则被归类为非E-box结合基因,否则为非dna结合基因(非典型基因)[6]
为了进一步刻画BnabHLH序列特征,Massari和Murre [34)。1).我们的研究结果表明,根据bHLH结构域序列谱,602个BnabHLHs被分为两大类:132个(21.9%)非典型BnabHLHs(非dna结合蛋白)和470个(78.1%)典型BnabHLHs(图2)。1).后者进一步分为三类,其中G-box结合蛋白299个(49.6%),E-box结合蛋白103个(17.1%),非E-box结合蛋白68个(10.3%)(图2)。1).132个非典型性BnabHLHs的碱基区序列发散,但其HLH区序列相对保守,尤其是在环区(图2)。1d).在非e -box结合蛋白中也发现了类似的情况(图。1c),表明其与非典型BnabHLHs密切相关。相比之下,E-box/G-box DNA结合蛋白的碱基区域的残基比HLH区域的残基更为保守(图2)。1b, c)。
BnabHLHs的蛋白结构在各亚科中均较为保守
来确定进化的关系BnabHLHs从Brassicease在对769个bHLH结构域进行比对的基础上,构建了邻居连接(NJ)系统发育树显著(602)和拟南芥(167)。
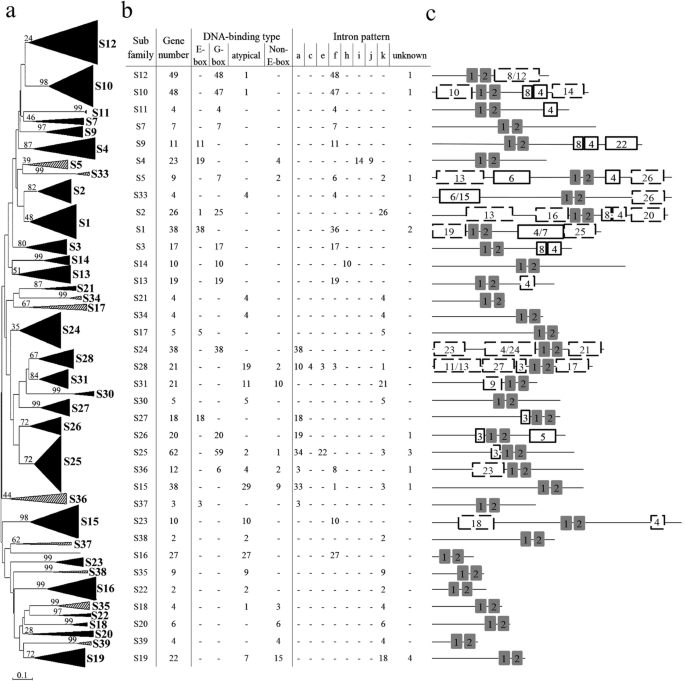
769个bHLH蛋白被分为35个亚家族,这是迄今为止发现的亚家族数量最多的亚家族。2a).在这些亚科中,先前发现28个亚科[7],其中7个(S33-S39)在本研究中新发现。先前报道的两个亚家族(S6和S8)在本研究中没有发现,因为它们只在低等植物(苔藓和藻类)中发现[7].与AtbHLHs的分裂相比,S5亚家族在显著分为S5和S33;S17分为S17和S34;S21分为S21和S35;S24分为S24、S36、S37;S30分为S30和S38;而S39的直方图拟南芥之前被定义为孤儿基因[7],本研究将其定义为一个新的亚科。BnabHLHs在35个亚家族中的分布偏倚,从2个(S22和S38)到62个基因(S25)不等。此外,不同DNA结合类型的BnabHLHs在不同亚家族间也有偏倚分布的趋势,但同一亚家族的BnabHLHs通常具有相同的DNA结合类型(图2)。2b).含有G-box结合蛋白的亚家族共有11个(S2、S3、S5、S7、S10、S11、S13、S14、S24、S25、S26);5个亚家族(S1、S9、S17、S27和S37)含有e -box结合蛋白;3个亚家族(S20、S23和S39)含有非e -box结合蛋白;而7个亚家族(S16、S21、S22、S33、S34、S35和S38)含有非dna结合蛋白(图2)。2b)。
随后,我们使用MEME工具发现了非bhlh结构域,并探索了它们在每个亚家族中的分布模式。通过分析,共获得27个可变长度的保守基序(8-103 aa)。2c附加文件4:表S4)。motif 1和motif 2分布在所有BnabHLHs中,分别由bHLH结构域的基本区和双螺旋区组成。环区位于基序1和基序2之间,表明该区域比基序区和螺旋区变化更大。在bHLH结构域之外,同一亚家族的成员通常具有几个相同的基元。例如,亚家族S9中的BnabHLHs均含有基序22;S26亚家族的蛋白均含有motif 5(图;2b、附加文件4:表S4)。此外,一些母题之前已经被定性,并被定义为额外的功能母题。例如,在不同物种的S2和S5亚家族中的许多蛋白质中检测到motif 4、8和20,如tabhlh39、AtMYC2、TabHLH184,和ZmbHLH103,它们与一个ACT结构域显著匹配,该结构域有助于将C1 R2R3-MYB因子募集到位于类黄酮生物合成基因启动子的C1结合位点[35].同时,这两个亚家族的motif 6也具有保守性,与茉莉酸ZIM-domains (jazz)相互作用的MIR和MYC_N结构域重叠[36].一些基序是亚科特异性的,但其功能尚不清楚(图2)。2c)。
内含子插入模式BnabHLHs在每个亚科中都是保守的
内含子和外显子结构是了解基因家族内基因进化关系和功能多样化的重要线索[37].候选基因的内含子和外显子模式BnabHLHs通过使用GSDS web服务器比较其全长CDS和DNA序列来确定[38].
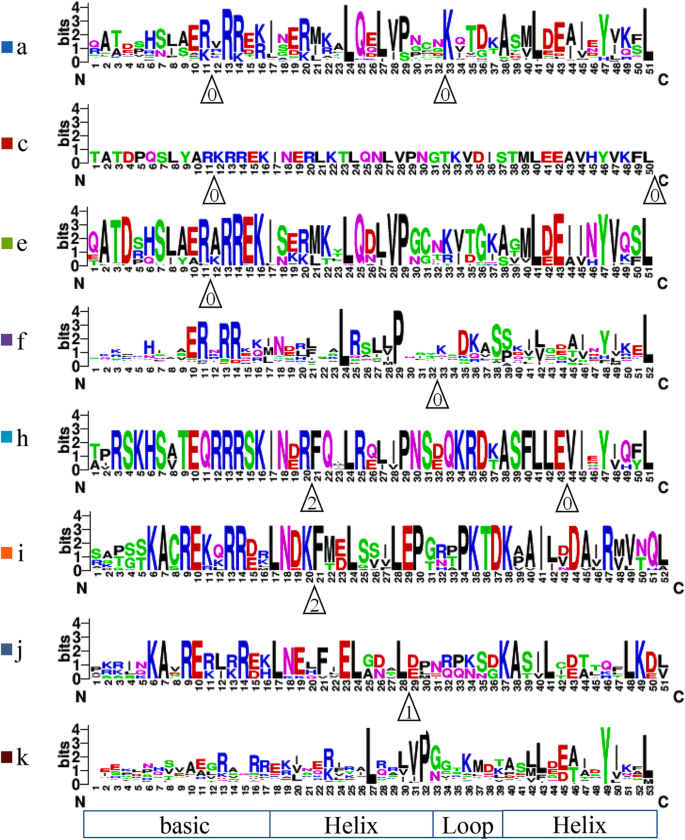
在bHLH结构域共观察到8种内含子插入模式(模式A到k)显著,包含0 ~ 2个内含子插入位点(图;3.).内含子插入模式的命名法BnabHLHs在cartero - paulet等人的研究中提到。[7].在本研究中,之前定义的模式a和b (Carretero-Paulet et al., 2010)由于具有相同的插入位点和插入阶段而被定义为同一类型,因此被统一命名为模式a。同样,模式d和f (Carretero-Paulet et al., 2010)被统一命名为f。内含子插入位置分布在bHLH结构域的碱基区和/或HLH区。在这些插入中,在基本区和环区观察到的插入更加保守,而在螺旋区观察到的插入在不同的模式中是可变的。碱基区和螺旋区的内含子插入位点位于三个高度保守的残基上,Arg-11 (E-box识别位点)、phi -21和Lys-33(图2)。3.).此外,除模式j外,大多数模式的内含子插入位点都是保守的。3.).a、c、e、f四种模式相似,可能是同源的,但f模式与a模式相比缺少第一个内含子,e模式缺乏第二个内含子,c模式与e模式相比在L-50插入第二个内含子。h和i模式也有类似的情况。同时,系统发育分析显示,a、c、e、f内含子插入模式之间关系密切,进一步证实了它们之间的密切关系。此外,模式k和i似乎是祖先的类型,因为它们存在于藻类的成员中[7].模式a、f和k是占大多数的三种类型BnabHLHs(分别为41.2%、26.2%和20.1%)。这一趋势与其他物种的结果相似,如拟南芥、水稻、马铃薯、杨树和番茄[8,9,10,16,33].因此,这三种模式在许多亚科中都得到了体现,而其余模式(即c、e、h、i和j模式)仅在一两个亚科中存在,显示出不同的扩展趋势。
BnabHLHs的bHLH结构域内内含子插入模式示意图。内含子模式分为8种内含子类型,分别为a-k。内含子插入位置用白色三角形表示,每个三角形内的数字表示剪接阶段:0表示阶段0,1表示阶段1,2表示阶段2。序列顶部的黑色三角形表示一个保守的电子盒子识别位点。每个亚家族的内含子模式如图所示。2
内含子插入模式的分布在大多数亚科中是保守的。例如,亚家族S12、S10、S11、S7、S9、S5、S33、S2、S1、S13、S23和S38的成员都包含f模式,除了一些可能由于基因组注释信息不完整而缺失的基因(图2)。2b).的内含子插入模式的守恒BnabHLHs为我们的系统发育分析的可靠性提供了一个独立的标准(图。2b).有趣的是,的内含子插入模式BnabHLHs几乎和他们的骨科医生一样拟南芥.唯一的例外是S27亚族,它包含模式a for显著成员的同系词在拟南芥是模式f [7].我们进一步将这些结果与其他物种进行了比较,例如水稻[7],并发现该亚科的同源物应该是模式a,包括拟南芥同源染色体(At080, At081, At122, At128, At129而且At130).
总的来说,内含子插入模式BnabHLHs在大多数亚科中是保守的,对应于AtbHLH还有骨科医生。此外,内含子插入位点在碱基区和环区比在螺旋区更为保守。
共时分析揭示了重复事件和扩展机制BnabHLHs
在这项研究中,高达602BnabHLHs被鉴定出来,这明显高于低等植物的基因数量,比如Volvox carteri只有三个[6].这表明该基因家族在植物进化过程中发生了大规模的扩张。探讨该基因家族在显著的染色体位置和同位关系BnabHLHs基于Genoscope和CoGe数据库中的基因组信息进行分析[39].
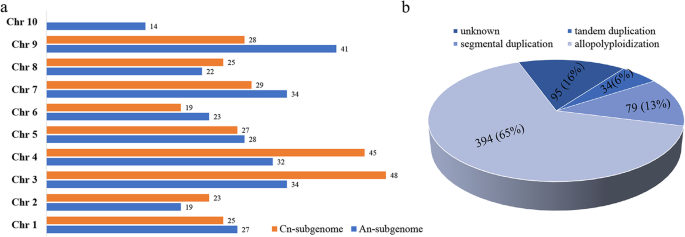
染色体定位分析显示有294个和306个BnabHLHs在一个n-和Cn-亚基因组,表明这两个亚基因组之间没有偏倚倾向(图;4一个)。BnabHLHs都分布在19个显著染色体,但每条染色体上的基因在两个亚基因组内是不均匀的。例如,An-亚基因组,A10至少有14个BnabHLHs而A09最多有41个基因。在C语言中n-亚基因组,C06至少包含19个BnabHLHs而C03基因多达48个。的平均数量BnabHLHs在一个n-和Cn-亚基因组分别为27.4和29.9。
根据共时性分析,602人中有475人BnabHLHs有共位关系,其中382个是遗传的b .报告或b . oleracea基因组(附加文件)5:表S5)。相比之下,79对共时对中只有79个基因(7.8%)发生了片段复制显著28对共联基因中34个基因(5.8%)进行了串联复制(图;4b).这些结果表明BnabHLHs都是从异源多倍体之间获得的b·拉伯而且b . oleracea.据此,我们发现全基因组重复基因占比最大BnabHLHs在大多数亚科中。然而,节段复制基因的数量最多BnabHLHs在S10和S25亚家族中(每个亚家族9个基因),串联复制基因在S12亚家族中数量最多(11个基因)。此外,BnabHLHs内含子模式f扩展最多显著(31份),占比最大BnabHLHs(附加文件1:表S1)。
综上所述,主要的膨胀机理BnabHLHs是全基因组复制(异源多倍体化),而节段和串联复制事件优先发生在具有特定内含子模式的某些亚家族中。
表达谱BnabHLHs在每个亚科内变化很大并保守
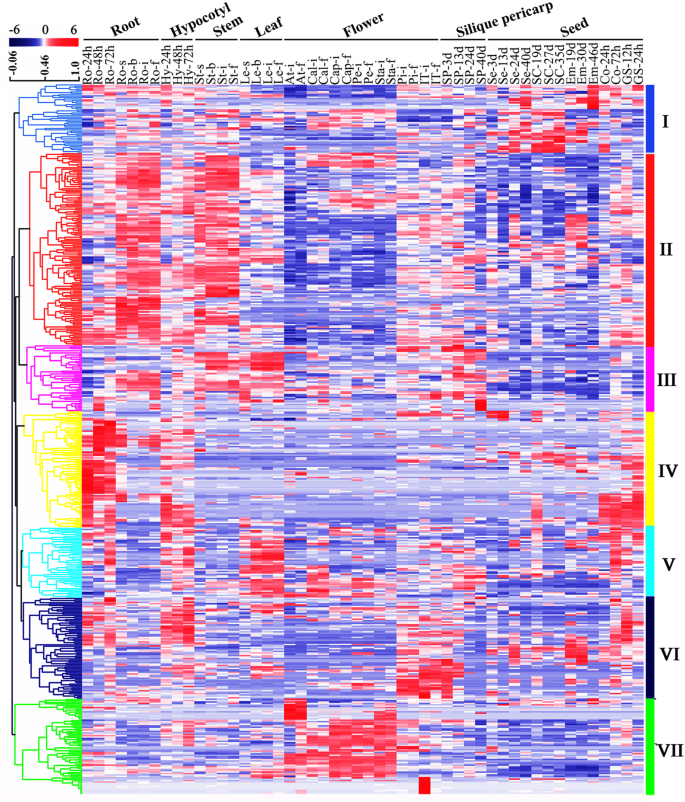
不同条件下的基因表达模式往往可以反映基因的功能。为了探索可能的功能BnabHLHs的时间和空间转录组BnabHLHs在50显著利用RNA-seq (BioProject ID: PRJNA358784)对不同发育阶段的根、叶、花和种子组织进行了特征分析。
总共47个BnabHLHsFPKM < 1的(7.79%)被排除在我们的分析之外,这可能是假基因或仅在特定发育阶段或特殊条件下表达。其余基因(555个)具有较高的置信表达水平(FPKM≥1),其中大多数在一个或几个组织/器官中优先表达。很少有基因在所有测试的组织或器官中都有组成性表达,这表明该基因家族倾向于在特定的发育阶段或组织中发挥调节作用。的宽表达剖面BnabHLHs说明它们在显著.的表达模式BnabHLHs总结为7个主要区块(I至VII)(图。5).的BnabHLHs基因块I ~ VII表现出明显的组织特异性表达模式:基因块I在种皮中高度表达;block II基因在根和茎组织中均高表达;block III基因主要表达于根、茎、叶、角果果皮等营养器官;第IV区基因主要在苗期器官中表达,如发芽期(24 ~ 72 h)种子、根和下胚轴;V区基因主要在雌蕊、硅果果皮、种皮和种子组织中表达;区序VI基因在雌蕊和花序尖组织中表达量较高;而第七区基因主要表达于毛丝、花瓣、雄蕊等花组织中。总的来说,是153、136、129、137、149和145BnabHLHs在茎、下胚轴叶、硅果果皮、花和种子中均有较高的表达量,而在根中高表达的基因多达301个BnabHLHs在根中可能具有一些以前未知的功能。
候选人表达谱BnabHLHs在50显著不同发育阶段的组织或器官。右侧显示了7个不同表达模式的主要块。用于表达分析的组织列在每列的顶部:GS,发芽种子;Hy,下胚轴;Ao,珊瑚茎;罗依,根;圣,阀杆;勒,叶;卡尔,花萼;帽,capillament; Pe, petal; Sta, stamen; Pi, pistil; IT, inflorescence tip; SP, silique; Se, seed; SC, seed coat; Em, embryo; Co, cotyledon. The ‘h’, ‘d’, ‘s’, ‘b’ ‘i’, ‘f’ indicate hour, day, seeding, budding, initial flowering, and full-bloom stages, respectively. The color bar represents log2 (FPKM ≥1)
通常,给定亚族的成员通常表现出相同/相似的表达谱。例如,S2亚家族成员主要在幼苗、出芽和花期的根和叶片中表达(附加文件)6:表S6)。此外,bHLHs在同一亚科中,不同物种可能处理相同或相似的表达谱,因此在进化过程中可能共享保守功能。例如,AtbHLH155 / CPU而且AtbHLH156 / LHW在根分生组织中维管细胞的建立和维管初始群体的大小中起重要作用[40].中相应的同系物显著也表达在根(附加文件6:表S6);发芽24 ~ 72 h后,其在根中表达量较低,而在成熟根中表达量较高,这可能与其在根维管细胞中的作用有关。此外,28对串联复制基因和79对节段复制基因的表达谱显示相似的表达模式,表明这些重复基因具有功能冗余(附加文件5而且6:表S5和S6)。
总的来说,BnabHLHs广泛表达,但在不同的水平显著.在根中尤其如此,这为该基因家族可能发挥的作用提供了重要线索。此外,BnabHLHs来自某一特定亚科的基因在不同物种间往往具有保守的表达模式和高度的结构相似性,这表明在进化过程中可能存在功能的保守性。
许多BnabHLHs是在激素处理过的根中诱发的吗
如上所述,有几个BnabHLHs在根中高度表达显著这表明它们在一些与根相关的生物过程中起着作用。为进一步探讨其在根系中的功能特征,对候选基因进行综合表达分析BnabHLHs5种激素(IAA、生长素;遗传算法3.赤霉素;6-BA,细胞分裂素;基于之前获得的RNA-seq数据(BioProject ID PRJNA608211)进行ABA,脱落酸和ACC,乙烯)。
我们的结果显示有很多BnabHLHs(221, 36.7%)的根对一种以上激素处理有反应,这些基因大多集中在10个亚家族(S2, S16, S18, S19, S20, S21, S25, S27, S35和S39),占每个亚家族基因的50%以上(附加文件)7:表S7)。同时,5种激素处理对S1、S4、S5、S7、S9、S10、S12、S13、S14、S15、S24、S26、S34和S38 14个亚家族的基因有部分诱导作用。有趣的是,BnabHLHs5种激素处理均使S16、S18和S21亚科的根系表达上调BnabHLHs在S7、S23和S34亚家族中均表达下调。值得注意的是,BnabHLHs在S12中,其根低表达或无表达(图12)。5)在五种激素处理后高表达(附加文件7:表S7)。相反,一些通常在根中高表达的基因对激素处理没有反应。的确,BnabHLHsS3、S11、S17、S22、S23、S28、S30、S31、S33、S36和S37的根对激素处理几乎没有任何反应(附加文件)7:表S7)。总的来说,最BnabHLH根茎中基因对激素处理有反应,表明它们在根茎激素反应中起重要作用显著的根源。
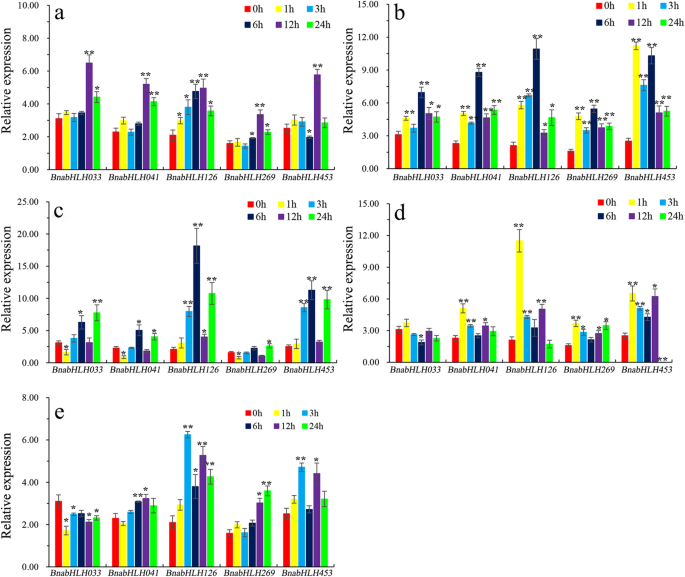
为了进一步验证rna测序结果,五BnabHLHs在根中有高表达水平(附加文件6:表S6),对激素诱导有明显反应(附加文件7:表S7)采用qRT-PCR方法分析其在激素诱导下的表达谱。其中,三个基因(BnabHLH033,BnabHLH041,而且BnabHLH269的正交正交拟南芥ILR3参与生长素缀合代谢的基因[41],以及两个基因(BnabHLH453而且BnabHLH126的正交正交拟南芥MYC2该基因与ABA、JA和光信号通路有关。如图所示。6,我们的qRT-PCR结果与RNA-seq分析中观察到的结果相似。这五个BnabHLHs所有五种激素治疗均呈阳性,其中BnabHLH126一般具有较高的表达水平。此外,来自同一分支的基因在某些激素处理下表现出相似的表达模式。例如,BnabHLH033,BnabHLH041,而且BnabHLH269从ILR3在IAA、ACC和ABA处理下,S4亚家族的分支具有相似的表达模式(图2)。6a - c)。但在遗传算法下,它们的表达谱不同3.6-BA诱导,其中BnabHLH033被大幅下调了BnabHLH041而且BnabHLH269显著上调(图;6d e)。类似地,的表达式BnabHLH453而且BnabHLH126从MYC2S2亚家族的分支在5种激素处理下表现出相似的表达模式(图2)。6).此外,顺式作用元件分析揭示了这五种基因的启动子区域BnabHLHs含有多个与激素反应相关的顺式作用元素(附加文件)8:表S8)。这进一步支持了我们的上述结果。
总之,我们的表达谱分析揭示了很大比例的BnabHLHs该基因家族可能在根发育过程中起重要作用显著.此外,我们的qRT-PCR实验证实了激素诱导的表达特征BnabHLH033,BnabHLH041,BnabHLH269,BnabHLH453,而且BnabHLH126这为今后的功能研究提供了有价值的基础。
讨论
系统发育树和亚科划分
作为重要的植物转录因子超级基因家族,全基因组分析bHLHs已经在一些物种中进行了研究[7,8,9,10].然而,我们发现该基因家族在植物中仍然缺乏统一的亚家族分类。迄今为止,根据Pires和Dolan[的多物种数据,该基因家族在植物中有两个典型的系统亚家族划分。6]和卡雷特罗-波雷等人[7),分别。虽然这两项研究都将该基因家族划分为28个亚家族,但实际上结果差异很大,只有19个亚家族相同,9个亚家族不同。这两部分之间的差异可能是由的数量造成的bHLHs包括在它们的系统发育分析中,以及在系统发育树的基础上应用于分类的标准。在Pires和Dolan的研究中[6],他们采用了拟南芥Heim等人提出的bHLHs [3.]其中包括118AtbHLHs.然而,由于本研究的限制,有大量的bHLHs被遗漏拟南芥使用基因组版本。相比之下,共有162人AtbHLHs皮雷和多兰的研究[6]产生了12个新发现的孤儿基因,比如AtbHLH022 / DYT1,AtbHLH159 / P1r2,而且AtbHLH102 / BIM2等。一般来说,基因家族的划分是基于系统发育树的拓扑结构和bootstrap值[42,43].然而,我们在Pires和Dolan的结果中发现,亚家族VII (a + b)、IX和IIIf [6]不是由共识节点组成的,而是跨不同的分支/分支。相比之下,这种情况在Carretero-Pault等人的结果中得到了很好的定义。[7],表明这些结果可能更可信。此外,皮雷和多兰发现的大多数孤儿基因(62个基因)[6]被cartero - paulet等人分为不同的亚科。[7].因此,观察到孤儿基因比例明显下降(共15个基因,2%),这表明他们的方法为孤儿基因分类提供了更好的解决方案。迄今为止,该基因家族已在各种植物中鉴定,如z梅斯[8],西红柿[9),而b·拉伯[10],而这些研究大多采用皮雷和多兰的分类[6].因此,这些研究中的亚科分类有些不充分。例如,在z梅斯,亚家族VII、VIII、IX、XVI和XVIII未聚在一致节点上[8];同样的情况在b·拉伯IIIf和Ib亚科(2)[10].因此,我们发现cartero - pault等人提出的标准。7更可信.
在这项研究中,602候选人BnabHLHs采用Carretero-Pault等人提出的方法,将其分为35个亚科[7(图。2).在这些亚科中,新发现一个(S39)亚科(AtbHLH151在cartero - pault等人的研究中,11个从五个引导值相对较低的前亚科中分离出来。[7],包括四个亚科,分为两个新亚科(S5和S33;S17和S34;S21和S35;S30和S38)和一个亚科被划分为三个新的亚科(S24、S36和S37)。这些差异可能归因于来自的序列的更大可用性十字花科被应用的物种有密切的进化关系。
在进行亚科分类时,必须考虑其他几个遗传特征,包括每个亚科中高度保守的内含子模式和motif分布[42,43].在本研究中,每个亚科的bHLH序列特征也高度保守,这独立支持了我们的系统发育分析和分类结果。例如,亚族S39的bootstrap值相对较高(图39。2a)和共享一个保守的非e -box和k内含子模式(图。2b, c);S24亚科,由Carretero-Pault等人定义。[7],在本研究中被分为S24、S36和S37亚家族(图。2a),这三个新的亚家族包含一个亚家族特异性的DNA结合类型、内含子插入模式和基序(图。2b, c);原S17亚家族在本研究中被分离为S17和S34亚家族。2A),和BnabHLHs在新的S17亚家族中有一个E-box在DNA结合域,而那些BnabHLHsS33均为非dna结合型;同样,cartero - paulet等人研究的前S5亚家族[7]在我们的研究中也分为两个新的亚科(S5和S33)。
综上所述,我们的研究提供了植物中bHLH蛋白更系统的分类,为探索bHLH基因家族的进化特征奠定了良好的基础。
潜在的作用bHLHs在显著根
由于bHLHs在多种植物生物学过程中起着至关重要的作用,近三十年来对其功能特性的研究已引起广泛关注。的大部分已知函数bHLHs集中于它们在控制许多生物过程的转录网络中的作用,包括代谢和发育。然而,越来越多的研究表明,它们在植物根系发育中也起着重要的作用。的功能bHLHs在植物根系中的作用主要集中在对铁的吸收、盐和干旱胁迫的响应、激素反应(如对ABA、JA、BR和IAA的响应)以及对根和分生组织中维管系统大小的调节(表1)1).
如前所述,bHLHs在植物的根组织中广泛表达显著.因此,该基因家族的9个亚家族(S5, S7, S15, S23-S28)中的许多成员已被鉴定为调节许多根过程(表51).例如,AtbHLH156 / LHW在根分生组织中维管细胞的建立和维管初始群体的大小中起重要作用[40].此外,AtbHLH024 / SPT在S24中通过控制根分生组织的大小来调节根的生长[64].同源染色体的AtbHLH002 / GL3(S5),AtLRLs(S26),AtRSLs(S28)也参与根毛的发育[35,54,66,67,69,70,71,72,73,74,75].此外,AtbHLH92在S7及AtbHLH129在S27中调节根伸长[50,56),而AtbHLH74调控幼苗根系生长[65].在这项研究中,我们发现BnabHLH那些功能特征的正交物bHLHs高度表达于显著根(图。5),表明它们在根系发育中的潜在重要性。
在这项研究中, bHLHs还被证明与植物根中的激素信号通路和环境胁迫有关。迄今为止,11个亚家族(S1-S4、S7、S12、S15、S16、S19、S26和S27)中的许多成员参与了植物对铁、盐和干旱胁迫的反应,并参与了ABA和JA途径(表4)1).例如,亚家族S1、S4和S12的成员会影响铁的摄取[44,52,57].研究还发现AtbHLH17 /爱尔兰联合银行(S2),AtbHLH92(S7),AtbHLH112(S15),bHLH122(S27)对盐胁迫的反应[45,56,60,76),而AtbHLH68(S15)和ZmPTF1(S26)对干旱胁迫的响应[61,69].与此同时,许多MYC2S2亚家族中的同源基因(例如:玫瑰Catharanthus rosecrmyc2[46),丹参SmMYC2[47])参与细胞对ABA和JA的反应[20.,21,22].类似地,亚家族S15和S26的成员已被证明对ABA有反应[61,69],而S19亚家族成员负向调控BR信号通路[63].此外,S4亚家族中的基因参与生长素缀合代谢[41,53)(表1).因此,我们的RNA-seq数据显示许多BnabHLHs(221, 36.7%)对一种以上激素治疗有反应显著根(附加文件)7:表S7)。我们的qRT-PCR分析进一步证实了两者BnabHLHs(BnabHLH126而且BnabHLH453)在S2和3BnabHLHs(BnabHLH033,BnabHLH041,而且BnabHLH269)在S4中由激素处理诱导显著根(图。6).总之,这些结果表明bHLHs在植物根的激素信号传导中具有重要作用。
综上所述,表达谱分析以及之前的基因功能研究表明BnabHLHs可能涉及到积分显著根系生物学过程包括根系生长和激素信号传递。本研究为进一步研究提供了有价值的基础bHLH基因功能研究。
结论
在这项研究中,是602BnabHLHs从显著被分为35个亚家族。在BnabHLHs的bHLH结构域观察到8种保守的内含子插入模式。同一亚科的成员一般具有保守的基因结构和蛋白基序组成。Allopolyploidization之间b·拉伯而且b . oleraceabHLH基因大基因扩增的主要驱动力是什么显著基因组。的BnabHLHs在50中有不同的表达谱显著不同发育阶段的组织,但同一亚科成员的表达模式普遍相似。此外,许多BnabHLHs有相对较高的表达水平显著的根源。许多BnabHLHs(约37%)是激素诱导的显著RNA-Seq分析。其中,激素诱导的5个基因的表达特征,BnabHLH033,BnabHLH041,BnabHLH269,BnabHLH453,而且BnabHLH126经qRT-PCR检测证实。总的来说,这项研究提供了重要的线索,关于潜在的功能BnabHLHs这将为今后的基因功能研究提供参考。
方法
序列检索
167的序列拟南芥bHLHs蛋白(AtbHLHs)从TAIR (http://www.arabidopsis.org/).鉴定bHLH基因显著基因组,我们参考了Guo等人之前描述的方法。[29稍加修改。简而言之,我们对蛋白质组进行了重复的BLASTP搜索(e值< 1.0)显著(Darmor -bzh生态型)(http://www.genoscope.cns.fr/brassicanapus/) [30.],对每个bHLH亚家族使用至少一个bHLH结构域的代表性蛋白序列[7]作为查询。然后使用每个匹配序列来搜索显著基因组数据库,直到没有发现新的序列。根据基因组中的位点,剔除冗余序列。确保bHLH基因数据的完整性显著,我们还搜索了另一个测序显著品种基因组(ZS11生态型)在NCBI数据库(http://www)。ncbi.nlm.nih.gov /基因组/ annotationeuk / Brassica_napus / 101 /) (31].然后我们确认假定的非冗余序列,以确保候选序列使用ExPASy (http://expasy.org/prosite/) [77]及MEGA 5.0 [78)软件。对这两个生态型的候选基因序列信息进行了人工比对和校正。最后,根据所有候选个体的染色体位点进行命名。同样,候选bHLH基因在b . oleracea基因组(v1.0)采用相同方法在BRAD数据库(http://brassicadb.org/brad/).
系统发生树的构建
167个bHLH结构域的多序列比对拟南芥(AtbHLHs)和602显著(BnabHLHs) bHLH蛋白通过MAFFT在线软件在默认参数下(http://mafft.cbrc.jp/alignment/server/) [79].基于多序列比对结果,利用MEGA 5.0构建NJ树[78]采用基于p-距离模型的自举试验(1000重复),并成对删除间隙处理。树文件使用FigTree v1.3.1 (http://tree.bio.ed.ac.uk/software/figtree/).
染色体定位与基因同步性分析
染色体长度和bHLH基因位置信息由BRAD (http://brassicadb.org/brad/index.php)和基因镜数据库(http://jacob.cea.fr/drf/ifrancoisjacob /页面/划分/ Genoscope.aspx) [30.,80),分别。候选者的染色体图谱BnabHLHs由Mapchart软件绘制。同样,染色体的位置bHLHs在拟南芥,b·拉伯,芸苔属植物oleracea用同样的方法分析基因组。基因同步性分析bHLHs在拟南芥,显著,b·拉伯,b . oleracea通过CoGe在线软件(https://genomevolution.org/coge/) [39].因此,所有候选基因的复制事件bHLH基于syntenic block分析基因,进行基因组内和基因组间比较。串联复制基因根据其在单个染色体中的物理位置和< 1个介入基因进行鉴定。
内含子/外显子结构分析
中bHLH候选基因对应的CDS和DNA序列显著均从Genoscope数据库中获得。候选内含子的分布、位置和相位显著基因结构显示服务器(GSDS)在线工具分析bHLH基因,包括外显子和内含子数量,默认参数为(http://gsds.cbi.pku.edu.cn/) [38].我们也手动定位了内含子在相应蛋白质序列中的插入位点。
保守母题的鉴定
为了鉴定bHLH结构域外的保守蛋白基序,对候选蛋白序列进行了分析BnabHLHs采用MEME Version 5.1.1软件(http://meme-suite.org/tools/meme) [81].参数设置为:寻找的motif数量,30个;图案最小宽度为6;图案的最大宽度为250。
表达分析BnabHLHs
的显著表达数据集下载自BioProject (NCBI数据库:PRJNA358784)。数据是从不同的组织中获得的显著在5种不同激素(IAA、ABA、6-BA、ACC和GA)的诱导下3.).的表达式配置文件BnabHLHs采用MeV v4.9软件(https://sourceforge.net/projects/mev-tm4/files/) [82],热图采用R包绘制;在至少一个组织样本中z评分高于3的组织高表达基因[82].所有FPKM < 1的基因都被排除在热图之外,因为它们可能是假基因,或者可能只在特定的胁迫或处理下表达。
用于qRT-PCR分析,种子显著品种ZS11从西南大学农业与生物技术学院获得,在培养皿中萌发。5叶期,在含有5种激素(50 μM ABA、120 μM GA、75 μM 6-BA、60 μM ACC和10 μM IAA)中的一种的Hoagland液体培养基中处理幼苗。然后将幼苗种在25°C的人工气候室中,光周期为16/8小时(白天和黑夜)。然后在处理后0、1、3、6、12和24小时收获根系组织,并立即在液氮中冷冻,并储存在−80°C下用于RNA分离。如Guo等人所述,提取总RNA并随后进行cDNA合成。[29].B. napus actitin7(BnActin7) (GenBank登录号:内部控制采用AF024716)。在CFX Connect™实时PCR系统(Bio-Rad,中国重庆)中使用SYBR-Green PrimeScript RT-PCR试剂盒(Takara,中国大连)进行qRT-PCR扩增。实时PCR反应条件为:95℃初始变性3 min, 95℃变性10 s, 58℃退火20 s,循环40次。候选基因的相对表达量用2−ΔΔCt方法(83].每个处理包括三个技术重复。表达水平计算为三个重复的平均信号强度。本分析中使用的引物列在附加文件中9:表S9。
数据和材料的可用性
目前研究中使用的RNA-Seq数据集可在NCBI的序列读取档案(SRA) (SRA登录号:PRJNA574049和PRJNA608211)存储库中获得。
缩写
- 6-BA:
-
细胞分裂素
- 阿坝:
-
脱落酸
- ACC:
-
乙烯
- bHLH:
-
基本helix-loop-helix
- FPKM:
-
每千碱基中转录本的片段数
- 遗传算法3.:
-
赤霉素
- 德牧:
-
基因结构显示服务器
- 国际宇航科学院:
-
生长素
- NJ:
-
Neighbour-Joining
- 存在:
-
定量实时聚合酶链式反应
参考文献
张志刚,张志刚,张志刚,等。10亿年的bZIP转录因子进化:二聚体和dna结合位点特异性的保护和变化。分子生物学杂志,2007;24(3):827-35。
Riechmann JL, Heard J, Martin G, Reuber L, Jiang C, Keddie J,等。拟南芥转录因子:真核生物全基因组比较分析。科学。2000;290(5499):2105 - 10。
Heim MA, Jakoby M, Werber M, Martin C, Weisshaar B, Bailey PC。植物中基本螺旋-环-螺旋转录因子家族:蛋白质结构和功能多样性的全基因组研究。中国生物医学杂志,2003;20(5):735-47。
tolido - ortiz G, Huq E, Quail PH.拟南芥基本/螺旋-环-螺旋转录因子家族。植物学报。2003;15(8):1749-70。
Murre C, McCaw PS, Baltimore D.在免疫球蛋白增强子结合,无子,MyoD和myc蛋白中的一种新的DNA结合和二聚化基元。细胞。1989;56(5):777 - 83。
王志刚,王志刚。植物基-螺旋-环-螺旋蛋白的来源和多样性。分子生物学杂志,2010;27(4):862-74。
卡雷特罗-保莱特L,加尔斯特安A,罗伊-维拉诺瓦I,马丁内斯-加西亚JF,比尔巴奥-卡斯特罗JR,罗伯逊DL。拟南芥、杨树、水稻、苔藓和藻类中bHLH转录因子家族的全基因组分类和进化分析。中国生物医学工程学报。2010;29(3):344 - 344。
张涛,吕伟,张慧,马琳,李鹏,葛林,等。玉米基本螺旋-环-螺旋(bHLH)转录因子家族的全基因组分析。中国生物医学工程学报。2018;18(1):235。
孙浩,范海杰,凌海海。番茄bHLH基因家族的全基因组鉴定与鉴定。BMC基因组学。2015;16(1):9。
宋小明,黄宗忠,段伟科,任杰,刘德科,李勇,等。大白菜bHLH转录因子家族的全基因组分析学报)。中国生物医学工程学报,2014;29(1):457 - 457。
Pillitteri LJ, Sloan DB, Bogenschutz NL, Torii KU。不对称细胞分裂和气孔分化的终止。大自然。2007;445(7127):501 - 5。
李楠,陈娟,李忠,陈娟。番茄螺旋-环-螺旋转录因子基因SlbHLH22的过表达促进番茄早花和果实成熟。足底。2019;250(1):173 - 85。
吉林T, Paicu T, Stephenson P, Fuentes S, Korner E, O'Brien M,等。拟南芥中,不裂和铲裂相互作用,使心皮和瓣缘组织发育,从而促进种子的传播。植物学报。2011;23(10):3641-53。
陈志伟,陈志伟,陈志伟,等。桃果实发育过程中spatula样bHLH转录因子的研究。植物化学学报。2011;49(6):654-63。
项玲,简东,张峰,杨超,白刚,兰霞等:低温诱导bHLH转录因子AabHLH112促进青蒿素生物合成青蒿.J Exp Bot 2019。
徐玉华,廖玉春,吕佛夫,张震,孙培文,高志华,等。转录因子AsMYC2控制Aquilaria sinensis (Lour.)中调控倍半萜生物合成的ASS1的茉莉酸响应性表达Gilg。中国生物医学工程学报,2017;29(4):344 - 344。
刘国强,宋震,周震,杨旭,等。PIF4直接控制无言在气孔发育的高温响应。中国生物医学杂志,2018;28(8):1273-80 e1273。
刘勇,林王K, Espley RV,王玲,李勇,刘震,等。StMYB44对马铃薯块茎肉中花青素的高温生物合成具有负向调控作用。中国生物医学工程学报,2019;29(3):339 - 344。
谢小斌,李松,张富峰,赵军,陈玉春,赵强,等。bHLH转录因子MdbHLH3在低温下促进苹果花青素积累和果实着色。植物细胞环境学报。2012;35(11):1884-97。
Abe H, Urao T, Ito T, Seki M, Shinozaki K, Yamaguchi-Shinozaki K.拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)作为脱落酸信号的转录激活因子。植物学报。2003;15(1):63-78。
Lorenzo O, Chico JM, Sanchez-Serrano JJ, Solano R. JASMONATE-INSENSITIVE1编码MYC转录因子,对区分拟南芥不同茉莉酸调控的防御反应至关重要。植物学报。2004;16(7):1938-50。
拟南芥中一个基本的螺旋-环-螺旋转录因子MYC2在蓝光介导的光形态发生生长中的抑制因子。植物细胞学报,2005;17(7):1953-66。
周敏,王志军,王志军,等。茉莉酸转录因子在植物次生代谢中的调控作用。生物技术,2016;34(4):441-9。
小吾Y, Itai RN, Nakanishi H, Kobayashi T,高桥M, Mori S,等。水稻bHLH蛋白OsIRO2是在缺铁条件下参与铁摄取的基因的重要调节因子。植物学报,2007;21(3):366 - 366。
杨晓明,李志强,李志强,等。拟南芥铁缺乏诱导转录因子的研究进展。植物化学学报。2007;45(5):260-1。
Bernhardt C, Zhao M, Gonzalez A, Lloyd A, Schiefelbein J. bHLH基因GL3和EGL3参与控制拟南芥根表皮细胞模式的细胞间调节电路。发展。2005;132(2):291 - 8。
Bernhardt C, Lee MM, Gonzalez A, Zhang F, Lloyd A, Schiefelbein J. bHLH基因GLABRA3 (GL3)和ENHANCER OF GLABRA3 (EGL3)决定了拟南芥根表皮细胞的命运。发展。2003;130(26):6431 - 9。
张峰,张立军,张立军。GL3编码bHLH蛋白,通过与GL1和TTG1相互作用调节拟南芥的毛状体发育。遗传学。2000;156(3):1349 - 62。
郭萍,文娟,杨娟,柯勇,王敏,刘敏,等。通过对甘蓝型油菜(Brassica napus) GRAS基因家族的全基因组调查和表达分析,揭示了其在根系发育和胁迫响应中的作用。足底,2019:1-22。
王晓霞,唐海华,王晓霞,等。植物遗传学。后新石器时代甘蓝型油菜种子基因组的早期异源多倍体进化。科学。2014;345(6199):950 - 3。
孙峰,范刚,胡强,周勇,管明,童春,等。甘蓝型油菜品种ZS11的高质量基因组揭示了半冬季形态型的渐渗历史。中国植物学报,2017;29(3):344 - 344。
Chigri F, Flosdorff S, Pilz S, Kolle E, Dolze E, Gietl C,等。拟南芥钙调素样蛋白AtCML30和AtCML3分别靶向线粒体和过氧化物酶体。植物分子生物学杂志,2012;29(3):344 - 344。
李旭,段旭,姜辉,孙勇,唐勇,袁智,等。水稻和拟南芥碱基/螺旋-环-螺旋转录因子家族的全基因组分析。植物科学进展。2006;39(4):366 - 366。
masari ME, Murre C.螺旋-环-螺旋蛋白:真核生物中的转录调控因子。分子生物学杂志,2000;20(2):429-40。
Feller A, Hernandez JM, Grotewold E.一个act样结构域参与了几种植物基-螺旋-环-螺旋转录因子的二聚化。中国生物医学工程学报,2006;29(4):344 - 344。
张峰,姚军,柯军,张玲,林文强,辛晓峰,等。茉莉酸盐信号通路中JAZ抑制MYC转录因子的结构基础。自然。2015;525(7568):269 - 73。
Rameneni JJ, Dhandapani V, Paul P, Im S, Oh MH, Choi SR,等。油菜MADS-box转录因子的全基因组鉴定、表征和比较系统发育分析。中国生物工程学报。2014;36(4):509-25。
胡斌,金俊,郭爱英,张宏,罗娟,高刚。GSDS 2.0:一种升级版的基因特征可视化服务器。生物信息学,2015,31(8):1296 - 7。
Lyons E, Freeling M.如何有效地比较同源植物基因和染色体作为DNA序列。植物学报,2008;36(4):366 - 366。
Ohashi-Ito K, Bergmann DC。LONESOME HIGHWAY对拟南芥根维管束初始群体的调控。发展。2007;134(16):2959 - 68。
Rampey RA, Woodward AW, Hobbs BN, Tierney MP, Lahner B, Salt DE,等。拟南芥碱性螺旋-环-螺旋亮氨酸拉链蛋白调节金属稳态和生长素偶联反应。遗传学。2006;174(4):1841 - 57。
杜华,梁震,赵松,南明明,陈立林,陆凯,等。50种真核生物R2R3-MYB蛋白的进化史:亚家族分类和扩展的新见解。科学通报2015;5:11037。
牛霞,关勇,陈松,李慧。短柄藻bHLH转录因子的全基因组分析。BMC Genomics. 2017;18:619。
Gratz R, Manishankar P, Ivanov R, Koster P, Mohr I, Trofimov K等:cipk11依赖性磷酸化调节FIT活性促进拟南芥铁获取对钙信号的响应。生物技术学报,2019,48(5)。
Krishnamurthy P, Vishal B, Khoo K, Rajappa S, Loh CS, Kumar PP. AoNHX1的表达提高了水稻和拟南芥的耐盐性,bHLH转录因子调控了拟南芥的AtNHX1和AtNHX6。植物细胞代表2019:1-17。
张华,赫蒂丽,孟铁尔,张勇,夏特尔,普雷,等。基本的螺旋-环-螺旋转录因子CrMYC2控制着调控Catharanthus rose生物碱合成的ORCA基因的茉莉酸响应性表达。植物学报,2011;36(1):344 - 344。
杜涛,牛娟,苏娟,李松,郭霞,李林,等。SmbHLH37与SmMYC2在丹参中茉莉酸介导的酚酸生物合成中起拮抗作用。植物科学,2018;9:1720。
Gupta N, Prasad VB, Chattopadhyay S. LeMYC2作为蓝光介导的光形态发生生长的负调节因子,促进番茄成体植株的生长。BMC植物生物学。2014;14:38。
Penuelas M, Monte I, Schweizer F, Vallat A, Reymond P, Garcia-Casado G,等。茉莉酸相关MYC转录因子在多形马属植物中具有功能保守性。植物学报,2019;31(10):2491-509。
田浩,郭辉,戴旭,程勇,郑凯,王旭,等。bHLH129是ABA下调bHLH转录抑制基因,在拟南芥中过表达时,bHLH129调控根伸长和ABA反应。科学通报2015;5:17587。
Chiasson DM, Loughlin PC, Mazurkiewicz D, Mohammadidehcheshmeh M, Fedorova EE, Okamoto M,等。大豆SAT1(共生铵转运蛋白1)编码bHLH转录因子,参与结节生长和NH4+转运。中国科学:自然科学(英文版),2014;
Tanabe N, Noshi M, Mori D, Nozawa K, Tamoi M, Shigeoka S.基本螺旋-环-螺旋转录因子bHLH11在拟南芥铁吸收系统中的作用植物学报2019;132:95-105。
李斌,李斌,李志强,李志强,等。bHLH转录因子ILR3调控拟南芥多重胁迫响应植物分子生物学杂志,2018;
Zimmermann IM, Heim MA, Weisshaar B, Uhrig JF。拟南芥MYB转录因子与R/ b样BHLH蛋白相互作用的综合鉴定植物学报,2004;40(1):22-34。
张斌,张志刚,张志刚。植物MYB、bHLH和WDR蛋白竞争性蛋白复合物形成的进化比较。中国机械工程学报,2019;
蒋艳,杨波,戴宏明。拟南芥bHLH92转录因子在非生物胁迫下的功能表征。中国生物医学工程学报。2009;28(5):339 - 344。
Kurt F, Filiz E.拟南芥、番茄、水稻、大豆和玉米中bHLH38、bHLH39、bHLH100和bHLH101基因的全基因组和比较分析:铁(Fe)稳态的洞见。生物金属学报。2018;31(1572-8773(电子)):489-504。
Ramamurthy RK, Waters BM。控制甜瓜铁吸收的fefe基因的定位与鉴定(Cucumis梅洛l .)。植物科学,2017;8:1003。
李琳,高伟,彭强,周波,孔强,应勇,等。两种大豆bHLH因子调节对铁缺乏的反应。中国生物医学工程学报,2018;
陈华辉,谢峰五,廖培平,程文华,刘丽丽,杨玉文,等。OsbHLH068在盐胁迫响应调控中的功能与其同源基因AtbHLH112部分冗余,而在拟南芥开花调控中的功能则相反。中国生物医学工程学报,2017;44(4):531 - 531。
Le Hir R, Castelain M, Chakraborti D, Moritz T, Dinant S, Bellini C. AtbHLH68转录因子对拟南芥ABA稳态调控和抗旱性的影响中国生物医学工程学报,2017;
郑凯,王勇,张楠,贾强,王霞,侯超,等。多效唑抗性6/KIDARI,非典型bHLH转录因子,参与拟南芥生长素反应。中国植物科学,2017;8:1813。
金艳,宋俊华,朴苏,郑玉生,金晓华。油菜素类固醇诱导的转录抑制和脱磷酸化依赖蛋白降解对blh转录因子AIF2 (BR信号负调控因子)的负调控作用。中国生物医学工程学报,2017;
bHLH转录因子SPATULA通过控制根分生组织的大小调节根的生长。BMC植物生物学2013;13:11。
鲍敏,边红,查艳,李峰,孙艳,白波,等。mir396a介导的碱性螺旋-环-螺旋转录因子bHLH74抑制对拟南芥幼苗根系生长的调控作用。中国生物医学工程学报。2014;
王彩霞,齐春春,罗建辉,刘林,何勇,陈丽强。LRL5作为玉米根毛生长关键调控因子的特性研究。植物J. 2019; 98:71-82。
Breuninger H, Thamm A, Streubel S, Sakayama H, Nishiyama T, Dolan L.一个转录因子家族的多样化导致了拮抗作用的根毛生长遗传调控因子的进化。《当代生物学》2016;26:1622-8。
Gajewska P, Janiak A, Kwasniewski M, Kedziorski P, Szarejko I.正向遗传学方法发现bHLH转录因子编码基因突变是大麦根无毛表型的最佳候选基因。植物科学,2018;9:1229。
李志,刘超,张勇,王斌,冉强,张娟:bHLH家族成员ZmPTF1通过促进根系发育和ABA合成调控玉米抗旱性。J Exp Bot 2019。
李志强,李志强,李志强,等。一种古老的机制控制着陆地植物中具有生根功能的细胞的发育。科学。2007;316(5830):1477 - 80。
Honkanen S, Thamm A, artega - vazquez MA, Dolan L:保守RSL I类bHLH转录因子负调控在陆生植物中独立进化。Elife 2018, 7。
张晨,Simpson RJ, Kim CM, Warthmann N, Delhaize E, Dolan L,等。更长的根毛能提高磷的吸收吗?用过表达内源RSL基因的短柄藻转基因株系验证这一假设。新植物,2018;217:1654-66。
谭志强,李志强,李志强,等。陆生植物生根功能细胞发育的保守调控机制。中国科学院学报(自然科学版)2015;
皮雷ND, Yi K, Breuninger H, Catarino B, Menand B, Dolan L.陆生植物进化过程中远古基因调控网络的招募和重构。中国科学(d辑:自然科学),2013;29(3):344 - 344。
张峰,赵敏,张志刚,张志刚,张志刚。拟南芥ttg1依赖通路中冗余bHLH蛋白的表达。发展。2003;130(20):4859 - 69。
Babitha KC, Ramu SV, Pruthvi V, Mahesh P, Nataraja KN, Udayakumar M.拟南芥AtbHLH17和AtWRKY28的共表达对非生物胁迫的抗性转基因res 2013;22(2): 327-41。
Apweiler R, Attwood TK, Bairoch A, Bateman A, Birney E, Biswas M,等。InterPro数据库,一个集成的蛋白质家族,域和功能位点的文档资源。核酸研究,2001;29(1):37-40。
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然,进化距离和最大简约方法进行分子进化遗传学分析。分子生物学杂志,2011;28(10):2731-9。
Katoh K,我是Standley DMB。MAFFT多序列比对软件版本7:性能和可用性的改进。中国生物医学杂志,2013;30(4):772-80。
程峰,刘松,吴娟,方林,孙松,刘波,等。BRAD,芸苔属植物的遗传学和基因组数据库。植物学报。2011;11(1):136。
贝利TL,威廉姆斯N,米斯勒C,李WW。模因:发现和分析DNA和蛋白质序列的模因。核酸决议2006;34(Web服务器问题):W369。
易峰,顾伟,陈杰,宋楠,高旭,张旭,等。早期玉米种子发育的高时间分辨率转录组景观。植物学报,2019;31(5):974-92。
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25:402-8。
致谢
不适用。
资金
国家自然科学基金(31671727)和中央高校基本科研业务费专项资金(XDJK2020B031)资助。
作者信息
从属关系
贡献
H.D.对研究的概念做出了贡献;Y.Z.K和W.Y.W在本研究中有同等的贡献;Y.Z.K、W.Y.W和h.d.起草并修改了手稿。杨志强,王永文,洪德正,洪洪杰,M.M.L对数据分析有贡献。杨志强、王永文、洪丹、c.p.、M.M.W、P.F.L、杨杰和J.N.L构思并设计了实验。所有作者审阅并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
602的特点bHLH基因芸苔属植物显著在本研究中确定。
附加文件2:表S2。
245的识别bHLH基因芸苔属植物oleracea在这项研究中。
附加文件3:表S3。
不同物种bHLH结构域的氨基酸组成。
附加文件4:表S4。
本研究在不同bHLH亚家族中鉴定出保守基序。
附加文件5:表S5。
的共向关系bHLH基因在芸苔属植物显著,芸苔属植物强奸,而且芸苔属植物oleracea.
附加文件6:表S6。
的表达式值BnabHLHs在50芸苔属植物显著不同发育阶段的组织。
附加文件7:表S7。
的表达式值BnabHLHs在不同的激素治疗下。
附加文件8:表S8。
的顺式作用单元分析BnabHLH启动子序列
附加文件9:表S9。
用于实时PCR分析的引物列表。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
柯,YZ。,Wu, YW., Zhou, HJ.et al。bHLH超级基因家族的全基因组研究芸苔属植物显著.BMC植物生物学20.115(2020)。https://doi.org/10.1186/s12870-020-2315-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-2315-8
关键字
- 芸苔属植物显著
- bHLH转录因子
- 根
- 基因表达