- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发表:GydF4y2Ba
一氧化氮参与黄瓜中的芸苔醇诱导的不定根发育GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba20.GydF4y2Ba文章编号:GydF4y2Ba102.GydF4y2Ba(GydF4y2Ba2020.GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
油菜素内酯(Brassinolide, BR)作为一种新型的植物激素,参与植物的生长和胁迫反应过程。以往的研究报道了BR在调节植物发育过程和响应植物对非生物胁迫的耐受性方面的作用。本研究的主要目的是探讨一氧化氮(NO)是否在br诱导的黄瓜不定根形成过程中发挥作用。GydF4y2BaCucumis sativusGydF4y2Bal .)。GydF4y2Ba
结果GydF4y2Ba
外源性施加1μmBR显着促进了不定种植,而高浓度的Br(2-8μm)有效地抑制不定根。没有捐赠者(S-Nitroso-n-Acerylpenicillamine,Snap)促进了不定根的发生。同时,BR和SNAP一起施加在一起显着促进不定根,并且组合效果优于BR或单独捕获的应用。此外,没有清除剂(C-PTIO)和抑制剂(L-名称和钨酸酯)抑制了BR对不定根的积极作用。Br在1μm的内部没有含量增加,没有合成酶(网状)和硝酸还原酶(NR)活性,而BRZ(特定BR生物合成抑制剂)降低了这些效果。此外,相对表达水平GydF4y2BaNR.GydF4y2Ba被BR和SNAP上调,而BRz下调。在BR中应用NO抑制剂(钨酸盐)也抑制了BR的上调GydF4y2BaNR.GydF4y2Ba.GydF4y2Ba
结论GydF4y2Ba
BR通过在黄瓜中产生内源性NO的生产来促进不定根的形成。GydF4y2Ba
背景GydF4y2Ba
在筛查花粉颗粒期间首次发现新型植物激素(Br)(Br)[GydF4y2Ba1GydF4y2Ba].作为一种类固醇激素,它在调节包括根和下胚轴伸长在内的各种发育过程中发挥着重要的作用[GydF4y2Ba2GydF4y2Ba]。此外,它调节植物对各种刺激的反应,如缺氧胁迫[GydF4y2Ba3.GydF4y2Ba],寒冷伤害[GydF4y2Ba4.GydF4y2Ba,盐压力[GydF4y2Ba5.GydF4y2Ba,重金属压力[GydF4y2Ba6.GydF4y2Ba]和干旱压力[GydF4y2Ba7.GydF4y2Ba].袁等。[GydF4y2Ba8.GydF4y2Ba报道2,4-表油菜素内酯(EBL)对Ca(NOGydF4y2Ba3.GydF4y2Ba)GydF4y2Ba2GydF4y2Ba胁迫对黄瓜植株矿质养分的吸收和分配的调控。赵等人[GydF4y2Ba9.GydF4y2Ba外源EBR处理改善了光合作用抑制作用、抗氧化酶活性和Rubisco活化酶(RCA)基因表达GydF4y2BaTriticum aestivum.GydF4y2Ba通过干旱和热应激的组合诱导。BR对植物生长和发育过程的影响取决于浓度。低浓度BR适用于愈伤组织生长和芽再生GydF4y2BaSpartina Patens.GydF4y2Ba[GydF4y2Ba10.GydF4y2Ba],而高浓度表油菜素内酯则抑制其生长GydF4y2BaBrassica oleraceae.GydF4y2Ba子叶[GydF4y2Ba11.GydF4y2Ba].铜唑(Br.GydF4y2BaZ.GydF4y2Ba)是一种特异性BR生物合成抑制剂。布尔GydF4y2BaZ.GydF4y2Ba处理后的西洋菜呈矮化,叶片形态改变,包括向下卷曲和深绿色的典型GydF4y2Ba拟南芥GydF4y2BaBR缺陷型突变体和10nm芸苔醇的施用可以扭转矮主义[GydF4y2Ba12.GydF4y2Ba].GydF4y2Ba
一氧化氮(NO),一种普遍存在的信号分子,在不同的植物组织中起重要作用,并参与各种生理过程[GydF4y2Ba13.GydF4y2Ba].许多研究人员观察到没有诱导的根本发展GydF4y2BaZea Mays.GydF4y2Ba[GydF4y2Ba14.GydF4y2Ba],并能诱导不同植物的种子萌发、幼苗发育、气孔反应、衰老、开花及对病原菌的保护[GydF4y2Ba15.GydF4y2Ba那GydF4y2Ba16.GydF4y2Ba那GydF4y2Ba17.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba].植物体内NO的产生有两种途径,即酶途径和非酶途径。硝酸还原酶(NR)和NO合酶(NOS)样酶是在植物中发现的产生NO的酶[GydF4y2Ba21.GydF4y2Ba].Zhu等[GydF4y2Ba22.GydF4y2Ba[endno_3]的研究报道了黄瓜外植体的不定根通过NOS和NR途径产生NOGydF4y2Ba2GydF4y2Ba.NR和nos类酶的活性参与了BR信号转导[GydF4y2Ba23.GydF4y2Ba].此外,NO作为第二信使可与某些激素互作,调控植物的生理生化反应。参与水杨酸(SA)、细胞分裂素(CTK)、茉莉酸(JA)、乙烯(ETH)、过氧化氢(HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba)和吲哚-3-乙酸(IAA) [GydF4y2Ba24.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba那GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba那GydF4y2Ba28.GydF4y2Ba].pagnussat等。[GydF4y2Ba29.GydF4y2Ba[报告了在外源性IAA对黄瓜外源性IAA作用过程中的IAA和NO在信号通路中的作用。澄清说,通过GC催化的CGMP的合成,IAA的下游促进不定根开发的下游。否而hGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba对万寿菊(GydF4y2BaTagetes Eerecta.GydF4y2BaL.)[GydF4y2Ba30.GydF4y2Ba].GydF4y2Ba
不定根的形成是根生物学的根本过程,通过哪种外来根部的细胞在胚胎后形成新的根源。不定根的发展是各种环境和植物激素因素调节的复杂过程[GydF4y2Ba31.GydF4y2Ba那GydF4y2Ba32.GydF4y2Ba].pagnussat等。[GydF4y2Ba27.GydF4y2Ba]观察到NO浓度的瞬时增加是必需的,是吲哚乙酸(IAA)诱导不定根发育的分子事件的一部分,说明NO介导了生长素反应导致不定根的形成。外源br增强玉米对水分胁迫的耐受性是由于外源br诱导的NO生成和NO激活的ABA生物合成[GydF4y2Ba33.GydF4y2Ba].导致Br介导的全身病毒抗性的信号通路的存在涉及局部呼吸爆发氧化酶同源物B(RBOHB) - 依赖性H.GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba生产和随后的系统性NR依赖性没有代[GydF4y2Ba34.GydF4y2Ba].Kwak等人。[GydF4y2Ba35.GydF4y2Ba据报道,较低浓度的BL增加不定根的数量和长度,而较高浓度的BL引起毛细血管状根。如上所述,BR和禁止都可以促进不定根开发,这表明BR和否之间可能的关系。karpets和kolupaev [GydF4y2Ba36.GydF4y2Ba[报道,没有参与2,4-呕血素源性诱导的小麦粥的耐热性和NO,ROS和钙离子之间的功能相互作用作为信号介质。到目前为止,许多研究侧重于研究否和其他植物激素之间的关系[GydF4y2Ba24.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba那GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba].然而,关于布鲁斯之间的关系很少,在不定根的发展期间都不知道。为了探索这个问题,使用黄瓜进行药理学实验(GydF4y2BaCucumis sativusGydF4y2BaL.)作为试验材料,调查NO在BR诱导的不定根发展中的作用。结果对黄瓜BR诱导的不定根发育的纳入NO参与提供了新的洞察。GydF4y2Ba
结果GydF4y2Ba
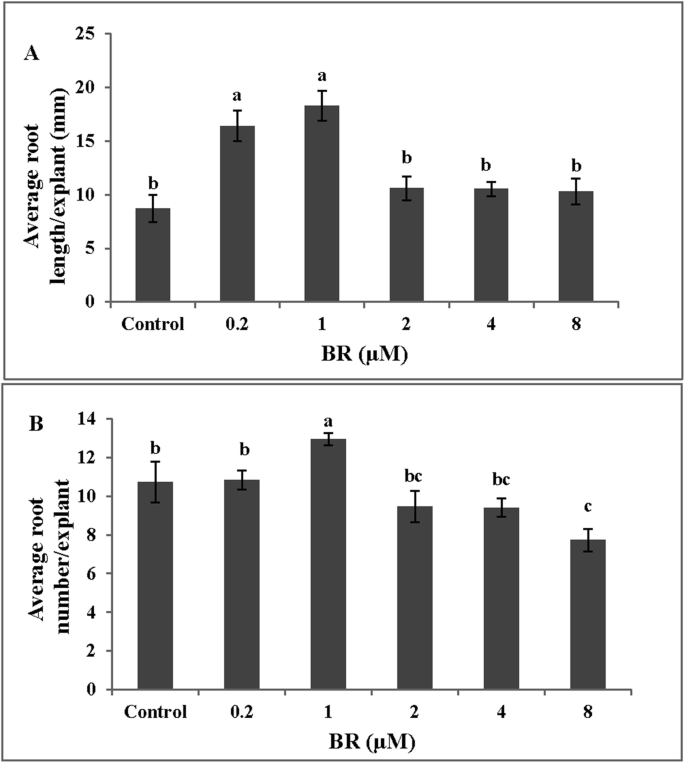
BR浓度影响不定根的数量和长度GydF4y2Ba
为了探讨Br对不定根的影响,黄瓜外植体暴露于不同浓度的Br(0,0.2,1,2,4和8μm)。偶然根部的根长和根部数量最初增加,然后随着BR浓度的增加而降低,两者都达到1μm的最大值(图。GydF4y2Ba1GydF4y2Ba).因此,在后续实验中采用最佳BR浓度(1 μM)。GydF4y2Ba
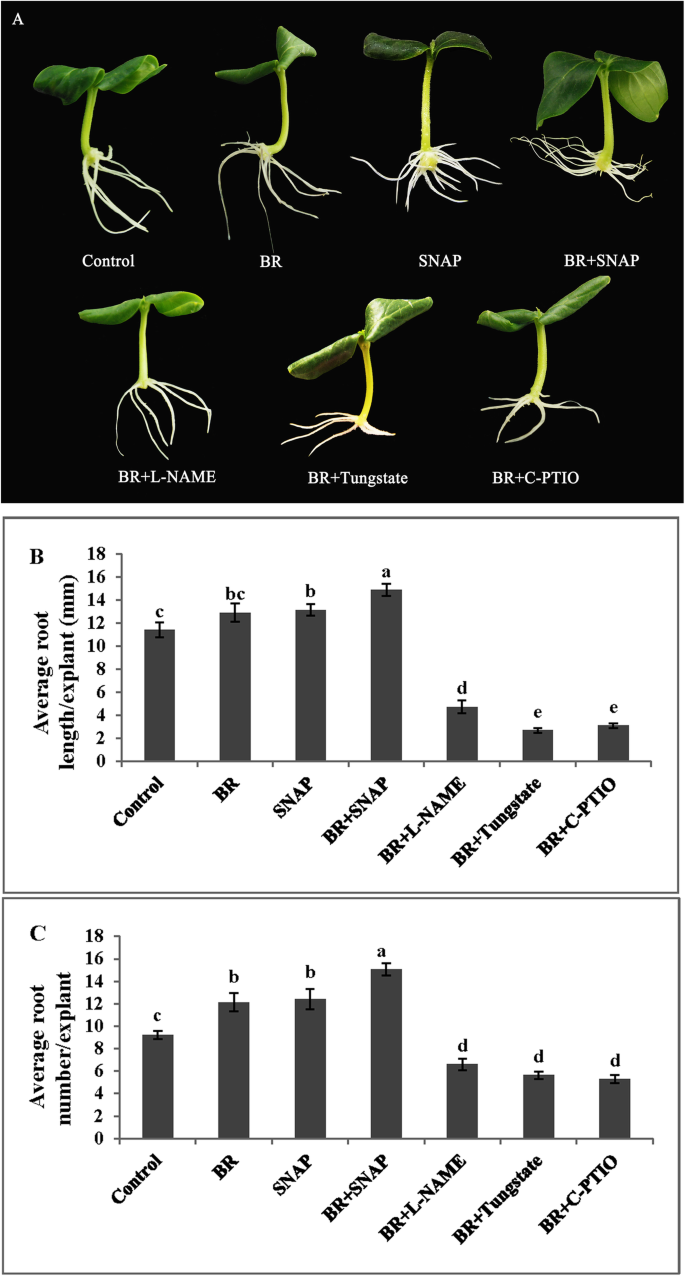
不定根的数量和长度没有清除剂和抑制剂的影响GydF4y2Ba
研究了NO清除剂(c-PTIO)、nos样酶抑制剂(L-NAME)和NR抑制剂(钨酸盐)对br诱导不定根的影响。如图所示。GydF4y2Ba2GydF4y2Ba,与BR治疗相比,200μmC-PTIO,20μmL-name或100μm钨酸盐与BR治疗组合施用显着抑制不定根根形成。用Snap(无捐赠者)Plus Br处理的不定根数和后植体的长度明显高于用BR或单独捕获的外植体的外植体。GydF4y2Ba
NO清除剂或抑制剂对br诱导不定根形成的影响。将5日龄萌发黄瓜幼苗下胚轴上的主根去除。外植体分别在蒸馏水、1 μM BR、50 μM SNAP、20 μM L-NAME、100 μM钨酸盐和200 μM c-PTIO中培养5 d。治疗后5天拍摄照片(GydF4y2Ba一种GydF4y2Ba).不定根根长度(GydF4y2BaB.GydF4y2Ba)和根编号(GydF4y2BaCGydF4y2Ba)表示为平均值±se(GydF4y2BaNGydF4y2Ba = 10 explants from three independent experiment). Bars denoted by different letters were significantly different according to Duncan’s multiple test (P.GydF4y2Ba< 0.05)GydF4y2Ba
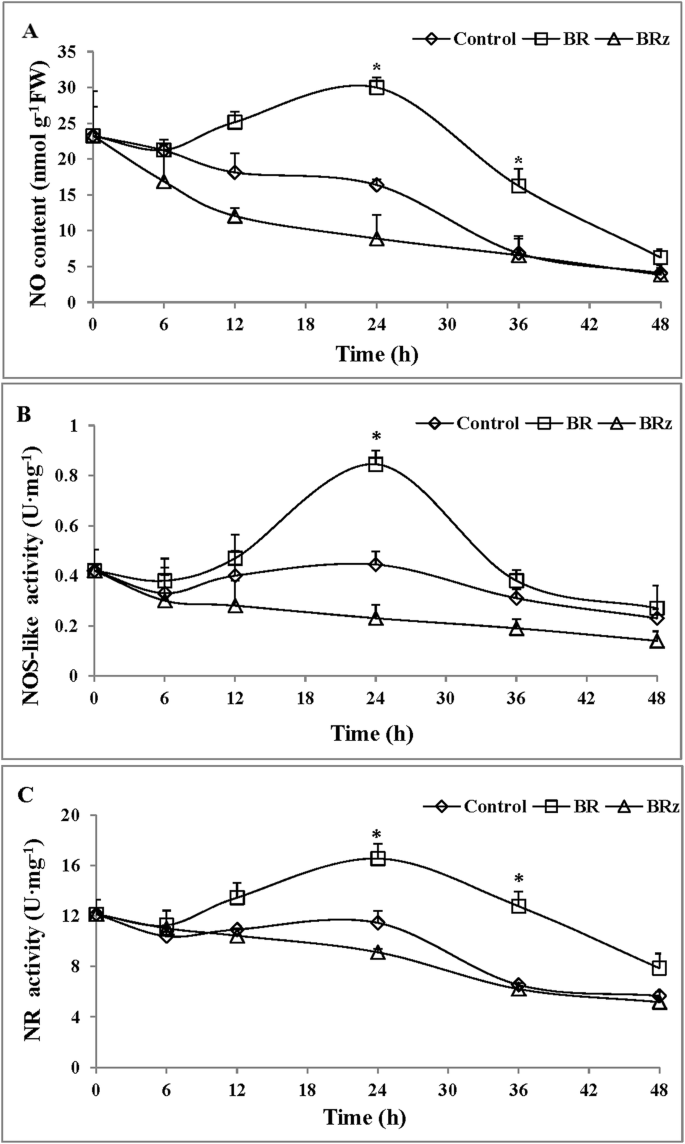
内源的时间调节无含量,NOS样和NR活性由BRGydF4y2Ba
没有1μmBr或1.5μm的内容的时间过程GydF4y2BaZ.GydF4y2Ba处理如图所示。GydF4y2Ba3.GydF4y2Ba一种。与对照相比,Br治疗的外植体的含量在0h-6 h处具有缓慢的下降趋势,这可能是由于伤口反应。从6小时到24小时,无需治疗的外植体的含量增加,随后逐渐降低至48小时(图。GydF4y2Ba3.GydF4y2Ba一种)。BR治疗中NO的含量在24小时达到最大值,与对照相比的约1.8倍。此外,BRZ处理的外植体的含量从0小时逐渐降低到48小时,并且无水平总是低于BR处理的外植体的水平。因此,数据表明,BR规范内源性NO,以促进黄瓜中不定根的发展。GydF4y2Ba
BR对内源NO含量、nos样和NR活性的影响呈时间依赖性。将5 d龄萌发的黄瓜幼苗下胚轴上的主根去除。从下胚轴基部取1厘米长的片段测定酶活性。没有水平(GydF4y2Ba一种GydF4y2Ba分别用蒸馏水(对照)或1 μM BR、1.5 μM BRz处理的外植体下胚轴,用Griess反应试剂测定。偶然的(GydF4y2BaB.GydF4y2Ba)及NR活动(GydF4y2BaCGydF4y2Ba)使用NOS样和NR测定试剂盒(南京,中国)根据制造商在用蒸馏水(对照)或1μmBR,1.5μmBRZ治疗的外植体的说明书中测定胚轴(1cm)。值(平均值±SE)是三个独立实验的平均值(GydF4y2BaNGydF4y2Ba = 15 explants from each of three independent experiments). Asterisks indicate that mean values are significantly different between treatments and control (P.GydF4y2Ba< 0.05)一种CCording to Duncan’s multiple test
为了探讨BR和否之间的关系,我们进一步分析了BR在不定根形成期间在黄瓜外部植物中的NOS样和NR酶的活性的影响(图。GydF4y2Ba3.GydF4y2Bab、c). BR的应用明显影响nos类活性的时间进程。外源br处理的NOS-like活性在0 ~ 6 h时略有下降,在6 ~ 24 h时上升,24 h达到最大值,约为对照的2倍。然后,从24 h到48 h, NOS-like活性有逐渐下降的趋势(图2)。GydF4y2Ba3.GydF4y2Bab)。同时,与对照和BR治疗相比,BR的NOS样酶活性GydF4y2BaZ.GydF4y2Ba在整个实验过程中,处理量持续下降(图。GydF4y2Ba3.GydF4y2Bab)。类似地,在前6 H期间,用BR处理的外植体的NR活性在瞬时减少,然后从6小时到24小时显着增加,其在24小时(对照的约1.4倍)达到其最高活性,并且然后在48小时下降(图。GydF4y2Ba3.GydF4y2Bac)。然而,brz处理的外植体的NR活性在实验期间持续下降(图。GydF4y2Ba3.GydF4y2BaC)。总之,BR处理促进了NOS样和NR酶的活性,而BRZ抑制了这两种酶的活性。在这里,我们展示BR通过在不定根形成期间诱导NOS样和NR酶的增加,通过诱导内源性NO的产生。GydF4y2Ba
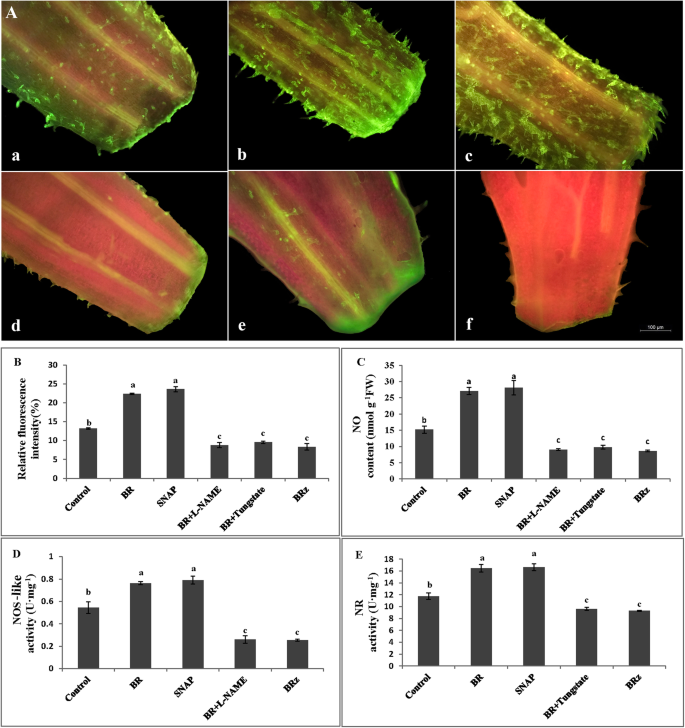
BR、SNAP、L-NAME、钨酸盐和BR对NO含量、NOS-like和NR活性的影响GydF4y2BaZ.GydF4y2Ba治疗方法GydF4y2Ba
为了进一步验证NO是否参与了BR诱导的黄瓜不定根形成,将外植体置于BR、SNAP、BR + L-NAME、BR +钨酸盐和BRz处理24 h。分析了下胚轴中NO的荧光定位、内源NO含量以及NR和nos类酶的活性。如图所示。GydF4y2Ba4.GydF4y2Baa和b,经BR和SNAP处理后,下胚轴产生不定根处的组织中可见更亮的绿色荧光,且荧光强度显著高于对照外植体,说明NO的产量急剧上升。相反,BR+ L-NAME、BR+钨酸盐和BRz处理的外植体下胚轴的荧光值低于对照植株(图2)。GydF4y2Ba4.GydF4y2BaA和B)。为了支持定性分析,在黄瓜外科植体的幼琼基,内源性的量化无含量。如图1和图2所示。GydF4y2Ba4.GydF4y2BaC,与对照相比,用Br和Snap治疗后的内源性不显着增加78.03和84.79%。与BR处理相比,当将L-NAME和钨酸盐加入BR溶液时,BR的效果逆转。实际上,没有减少66.5%和63.8%的含量(图。GydF4y2Ba4.GydF4y2Bac)。此外,BRGydF4y2BaZ.GydF4y2Ba与BR处理相比,单独的处理显着降低68.1%(图。GydF4y2Ba4.GydF4y2Bac).黄瓜外植体下胚轴NO的定性和定量分析表明,外源施用BR和SNAP显著增加了黄瓜下胚轴内源NO的产生和分配。如图所示。GydF4y2Ba4.GydF4y2BaD和E,BR诱导的NOS样和NR活性由L-NAME和钨酸酯阻断。与对照,单独的BR和Snap的应用显着增加了NOS样酶的活性分别将40.24和45.22%的活性增加(图。GydF4y2Ba4.GydF4y2Bad)。此外,BR + L-名称和BRZ处理分别将NOS样酶活性显着降低65.92和66.97%(图。GydF4y2Ba4.GydF4y2Bad)。同样,与对照相比,BR和SNAP处理后NR的活性分别显著提高了40.17和41.53%(图4)。GydF4y2Ba4.GydF4y2Bae).与BR处理相比,BR +钨酸盐和BR处理后NR酶活性增加GydF4y2BaZ.GydF4y2Ba分别显著降低了41.65和43.59%(图4)。GydF4y2Ba4.GydF4y2Bae)。因此,BR通过调节NOS样和NR酶的活性来诱导NO的产生,并促进黄瓜外植体的不定根形成。GydF4y2Ba
BR、SNAP、L-NAME、钨酸盐和BRz对NO含量及BR诱导的NOS-like和NR活性的影响。NO在黄瓜外植体下胚轴中的荧光定位(GydF4y2Ba一种GydF4y2Ba)用对照(蒸馏水)处理(GydF4y2Ba一种GydF4y2Ba),1μmbr(GydF4y2BaB.GydF4y2Ba),50μmsnap(GydF4y2BaCGydF4y2Ba),br +20μml-name(GydF4y2BaD.GydF4y2Ba)和BR + 100 μM钨酸盐(GydF4y2BaE.GydF4y2Ba), 1.5 μM BRz (f), 24 h。使用Image J软件分析荧光强度,并表示为对照的百分比(GydF4y2BaB.GydF4y2Ba).黄瓜外植体下胚轴内源NO含量测定GydF4y2BaCGydF4y2Ba).偶然的(GydF4y2BaD.GydF4y2Ba)及NR (GydF4y2BaE.GydF4y2Ba)从备用碱基碱的1cm-Long段中测量酶活性。根据三个独立实验计算平均值和SE值(GydF4y2BaNGydF4y2Ba= 15)。经邓肯多重检验,以相同字母表示的条形图差异不显著,P < 0.05GydF4y2Ba
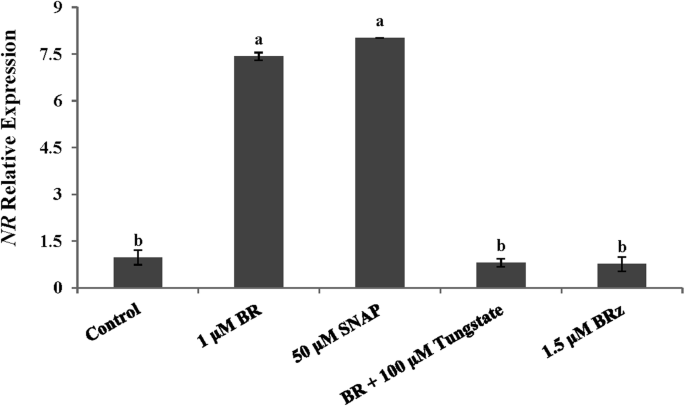
的相对表达GydF4y2BaNR.GydF4y2BaBR下的基因GydF4y2BaZ.GydF4y2BaSNAP和钨酸盐处理GydF4y2Ba
在不定的生根过程中,我们进行了实时RT-PCR以测量相对表达GydF4y2BaNR.GydF4y2Ba基因(图。GydF4y2Ba5.GydF4y2Ba).与对照组相比GydF4y2BaNR.GydF4y2BaBR-和SNAP-处理24 h后表达水平显著高于对照,分别比对照高642.3和701.2%(图2)。GydF4y2Ba5.GydF4y2Ba).相对表达水平差异无统计学意义GydF4y2BaNR.GydF4y2Ba在Br +钨酸酯和控制之间。相对表达水平GydF4y2BaNR.GydF4y2Ba基因在BR +钨酸盐和BR中减少了89.15%和89.69%GydF4y2BaZ.GydF4y2Ba分别与BR处理的外植体进行比较(图。GydF4y2Ba5.GydF4y2Ba).GydF4y2Ba
QRT-PCR的QRT-PCR的效果,Snap,Tungstate和BRZ表达的影响GydF4y2BaNR.GydF4y2Ba黄瓜外科植物的基因。如图所示,将外植物在水中孵育24小时,或者在图中浓缩的不同化合物存在。使用ΔΔCT方法测定相对表达[GydF4y2Ba37.GydF4y2Ba],服用GydF4y2Ba施GydF4y2Ba基因作为参考。数据收集自3个独立的生物学重复。每个复制代表10个外植体。用相同字母表示的条形图没有显著差异(Duncan多重检验;GydF4y2BaP.GydF4y2Ba< 0.05)GydF4y2Ba
讨论GydF4y2Ba
这里报道的数据显示了BR之间的相互作用,在黄瓜外的偶然生根期间。结果表明,外源性BR在低浓度下增强了不定根的数量和长度,而高浓度的BR治疗抑制了不定的根部发育(图。GydF4y2Ba1GydF4y2Ba),提示BR对不定根的影响是剂量依赖性的。前人研究表明,施用BR (0.1 ~ 10 μM)可促进下胚轴伸长GydF4y2Ba拟南芥GydF4y2Ba这种影响与浓度有关[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba38.GydF4y2Ba].同样,在番茄方面,关和罗迪克[GydF4y2Ba39.GydF4y2Ba结果表明,施用浓度超过1.0 μM的24-表油菜素内酯(24-EBR)抑制了根系生长、根数和根长,而0.1 μM的较低浓度的EBR增加了根数和根长。可以看出,在前人的研究中,BR的最适生根浓度[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba38.GydF4y2Ba和我们的实验不同。这可能与不同植物对溴化铵的敏感性有关。GydF4y2Ba
BR在生物测定中具有生物活性,用于植物蛋白,其类似于葛根素,乙烯和细胞素素的功能,并且它影响植物的根部形成和发育[GydF4y2Ba40GydF4y2Ba那GydF4y2Ba41.GydF4y2Ba].BR还参与植物生活过程,例如对各种生物和非生物应激的反应[GydF4y2Ba42.GydF4y2Ba那GydF4y2Ba43.GydF4y2Ba那GydF4y2Ba44.GydF4y2Ba].我们的结果表明,BR促进了不定根形成。此外,BR的外源性应用GydF4y2BaZ.GydF4y2Ba对不定根的发育有重要的抑制作用。结果与Kurepin等人的研究结果一致,他们还发现BR的应用GydF4y2BaZ.GydF4y2Ba抑制下胚轴生长GydF4y2Ba拟南芥GydF4y2Ba效果取决于应用的浓度[GydF4y2Ba2GydF4y2Ba].此外,BR与其他激素的相互作用也对植物的生长发育产生一定的影响[GydF4y2Ba45.GydF4y2Ba那GydF4y2Ba46.GydF4y2Ba那GydF4y2Ba47.GydF4y2Ba].例如,在GydF4y2Ba拟南芥GydF4y2Ba, BR与生长素信号转导存在互作点,诱导生长素的合成[GydF4y2Ba48.GydF4y2Ba].油菜素内酯与乙烯的相互作用可以控制油菜素内酯的负向引力GydF4y2Ba拟南芥GydF4y2Ba这取决于生长素的信号成分[GydF4y2Ba49.GydF4y2Ba].与单一的表油菜素内酯(BL)处理相比,水稻叶面喷施茉莉酸甲酯(MeJA)和BL处理显著降低了水稻黑条矮缩病毒(RBSDV)的侵染[GydF4y2Ba50.GydF4y2Ba].此外,一些生物气体分子如一氧化碳(CO)、NO和过氧化氢(HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba)在不定根过程中表现出类似于信号发射器的激素效应[GydF4y2Ba51.GydF4y2Ba那GydF4y2Ba52.GydF4y2Ba那GydF4y2Ba53.GydF4y2Ba].已证实NO参与生长素诱导万寿菊不定根形成[GydF4y2Ba30.GydF4y2Ba].没有对其他激素的相互作用也被广泛报道了[GydF4y2Ba22.GydF4y2Ba那GydF4y2Ba54.GydF4y2Ba那GydF4y2Ba55.GydF4y2Ba].然而,据报道,BR之间的相互作用和不偶然根部发育中的互动。我们的研究结果表明,BR-诱导的不定根源未通过清除剂(C-PTIO)或抑制剂(L-NAME,钨酸酮)抑制(图。GydF4y2Ba2GydF4y2Ba).不仅抑制内源性NO的产生,而且抑制了外源BR的作用。这种观察结果与Li等人的发现一致。[GydF4y2Ba56.GydF4y2Ba].本研究结果表明,一氧化氮参与了油菜素内酯诱导的黄瓜不定根发育过程。GydF4y2Ba
在随后的实验中,通过增加的NOS样和NR的活性进一步证实了BR诱导的不定根中的内源性NO的累积(图。GydF4y2Ba3.GydF4y2Ba).布尔GydF4y2BaZ.GydF4y2Ba降低了NO的生成和NOS-like和NR的活性,且其作用具有时间依赖性。先前的研究还表明,甲烷(CHGydF4y2Ba4.GydF4y2Ba)触发了黄瓜不定根形成过程中NO的积累[GydF4y2Ba57.GydF4y2Ba].乙烯利处理增加了不定根内源NO水平,显著提高了NOS-like和NR活性[GydF4y2Ba58.GydF4y2Ba].通过增强没有水平来赋予氢气诱导不定根[GydF4y2Ba22.GydF4y2Ba].Hemin可能促进NO积累调节黄瓜外植体不定根发育[GydF4y2Ba59.GydF4y2Ba].如上所述,通过某些外源性物质诱导的内源性积累可以促进不定根的根本发展。因此,我们的实验解释了BR通过增加内源性无水平并改善NOS样和NR酶的活性来促进不定根的形成。最近,据报道,Euhalophyte中的C-Ptio抑制了内源性的NOS样和NR的产生和活性GydF4y2Ba碱蓬莎莎GydF4y2Ba[GydF4y2Ba60.GydF4y2Ba].采用NO清除剂抑制了BR诱导的茶叶中NO含量[GydF4y2Ba54.GydF4y2Ba].这一最新的观察结果与我们的结果一致(图。GydF4y2Ba4.GydF4y2Ba).外源施用BR和SNAP显著增加了内源NO产量。然而,L-NAME和钨酸盐,BRGydF4y2BaZ.GydF4y2Ba逆转了BR和SNAP对NO积累的积极作用。L-NAME、钨酸盐和BR均能抑制BR诱导的NOS-like和NR活性GydF4y2BaZ.GydF4y2Ba.综上所述,BR通过刺激NOS-like和NR酶的活性来诱导内源NO的产生,促进黄瓜不定根的发育。本研究通过DAF-FM DA荧光探针技术观察植株内源NO的产生和分配,证实了BR在黄瓜不定根过程中促进内源NO的产生和积累。此外,NO抑制剂可以逆转BR对内源NO的促进作用,说明NO参与了BR诱导黄瓜不定根的过程。类似的研究也报道了内源性NO的产生和分布也被DAF-2DA检测,DAF-2DA是一种荧光NO指示染料GydF4y2Ba拟南芥GydF4y2Ba在玉米[GydF4y2Ba33.GydF4y2Ba那GydF4y2Ba61.GydF4y2Ba].事实上,众所周知,NR活性一方面受到磷酸化和与14-3-3蛋白相互作用的调节[GydF4y2Ba62.GydF4y2Ba那GydF4y2Ba63.GydF4y2Ba另一方面,NR的活性受到一定程度上的NR酶丰度的影响。虽然NR蛋白的丰度受到积累的影响GydF4y2BaNR.GydF4y2Ba基因转录。因此,我们进一步研究了GydF4y2BaNR.GydF4y2Ba基因表达。我们的数据显示BR和Snap诱导成绩单的积累,而BRGydF4y2BaZ.GydF4y2Ba和钨酸盐处理下调相对表达水平GydF4y2BaNR.GydF4y2Ba(图。GydF4y2Ba5.GydF4y2Ba).这些结果与朱等人的结果类似。[GydF4y2Ba22.GydF4y2Ba]据表明,50%富含氢水(HRW)治疗诱导不定根发育和上调表达的表达GydF4y2BaNR.GydF4y2Ba在黄瓜。Xu等[GydF4y2Ba54.GydF4y2Ba还报告说,eth提高了相对表达GydF4y2BaNR.GydF4y2Ba并改善黄瓜中的偶然生根。完全采取的数据表明,BR和Snap刺激了NR酶的活性,诱导转录物的积累,并且可能是相应的蛋白质,导致NO和促进的生产和积累,随后,在黄瓜中偶然生根。同样,在黄瓜,朱等。[GydF4y2Ba22.GydF4y2Ba据报道,氢气诱导的不定根形成和Pagnussat等人需要一氧化氮。[GydF4y2Ba29.GydF4y2Ba]报道一氧化氮和环GMP参与了吲哚乙酸诱导的不定根过程,提示氢气和吲哚乙酸可能是不定根过程中一氧化氮的上游信号分子。这将为BR、氢气和吲哚乙酸在不定根形成中的上下游关系提供一个新的研究课题。GydF4y2Ba
结论GydF4y2Ba
在本研究中,我们证实了BR和NO在黄瓜外植体不定根形成过程中发挥重要作用。BR通过上调根的相对表达量来诱导不定根的形成GydF4y2BaNR.GydF4y2Ba外源一氧化氮(NOS-like)和NR酶活性的提高,进而提高黄瓜外植体内源一氧化氮(NO)水平。因此,我们认为NO参与了br诱导黄瓜外植体不定根的形成。在今后的研究中,我们将通过分子和遗传学方法研究BR与NO的相互作用机制和信号转导途径。GydF4y2Ba
方法GydF4y2Ba
植物材料及生长条件GydF4y2Ba
黄瓜种子,GydF4y2BaCucumis sativusGydF4y2Ba新春4号,购自甘肃省农业科学院(中国兰州)。种子表面用5%次氯酸钠消毒10min,用水冲洗,用蒸馏水浸湿双层滤纸在培养皿中发芽。种子在25±1℃的电子生长室中培养5 d,光周期14 h(光合有效辐射= 200 μmol m .)GydF4y2Ba- 2GydF4y2Ba年代GydF4y2Ba- 1GydF4y2Ba).切除5天幼苗的初级根部,然后在与下文所示的不同处理下在温度和光周期的相同条件下维持黄瓜外植体5天。该研究中使用的分析级化学品是从中国公司获得的。记录和分析每个外部植物的根数和根长度。GydF4y2Ba
治疗和实验设计GydF4y2Ba
黄瓜外植体被放置在培养皿(直径= 9厘米)内衬双层纸和滋润60毫升蒸馏水作为各种浓度的控制(控制)或60毫升(0.2、1、2、4、8μM)的油菜素内酯(BR,σ,美国)和保持在25±1°C。加入适量BR的化学试剂如下:50μM (S-nitroso-N-acerylpenicillamine,σ,联合声明),200μM c-PTIO (2 - (4-carboxy-2-phenyl) 4、4、5,5-tetramethy limidazoline-1-oxyl 3-oxide,σ,联合声明),20μM L-NAME (N-nitro-l-arginine甲酯,σ,联合声明)和钨酸100μM(中泰化学有限公司。中国上海)。1.5 μM BRGydF4y2BaZ.GydF4y2Ba(芸苔唑,西格玛,联合陈述)被施用给外植体。基于初步实验的结果(数据未显示)选择这些化学品的浓度。在三次重复中,该处理以完全随机化设计排列。每个实验单元由来自拍摄数据的十个个体外植物组成。数据表示为平均值±标准错误(SE)。GydF4y2Ba
Cucumber外植体的根数和长度的测定GydF4y2Ba
处理5天后,用直尺测量各外植体的根数和根长(精度为0.1 cm)。进行了3次独立的生物复制,并对每个复制的10个外植体进行了分析。数据以平均值±SE表示。GydF4y2Ba
测定内源NO含量GydF4y2Ba
如Liao等人所述的内源性没有水平。[GydF4y2Ba30.GydF4y2Ba]使用GRIESS试剂方法。一半的克(0.5g)的下胚轴(从底部的碱的段长1厘米)在液氮中冷冻,然后用砂浆和杵研磨,并在3ml 50mM冰冷的乙酸缓冲液中均化(pH值 3.6), containing 4% (w/v) zinc diacetate. The homogenates were centrifuged at 10,000×GGydF4y2Ba4℃保存15 min,收集上清液。GydF4y2Ba
用1.0 mL以上提取缓冲液洗涤微球并离心。上清液中加入0.1 g活性炭,过滤后在540 nm处测定吸光度。通过与纳米标准曲线的比较,计算出NO含量GydF4y2Ba2GydF4y2Ba.测量在3个独立的生物复制和数据中完成,数据表示平均值±SE。GydF4y2Ba
NOS样和NR活性测定GydF4y2Ba
硝酸还原酶测定试剂盒和一氧化氮合酶测定试剂盒根据厂家说明书测定NR和NOS-like的活性。试剂盒购自中国南京建城生物工程有限公司。测量在3个独立的生物复制和数据中完成,数据表示平均值±SE。GydF4y2Ba
内源性NO的荧光显微镜成像GydF4y2Ba
在50 mM Tris-HCl (pH 7.5)溶液中,20 μM DAF-FM DA(4-氨基-5-甲基- 2,7 -二氨基-荧光素二乙酸酯,sigma)存在的情况下,在平板上培养的黄瓜下胚轴(1 cm)在黑暗中培养2 h。用蒸馏水广泛冲洗下胚轴以去除多余的荧光团。用荧光显微镜(Leica 400x, Planapo, German Weizla)观察各条件下胚轴。使用ImageJ软件分析荧光强度,并表示为对照的百分比。实验重复3次,每次观察10个下胚轴。GydF4y2Ba
通过实时PCR测定转录物丰度GydF4y2Ba
将总RNA从100mg(重量)中分离出100mg(重量的)切除的黄瓜缺口(长距离下杆基的段),使用植物RNA提取试剂盒(Takara Minibest 9769; Takara Biomedicals(Takara Minibest)磨削砂浆和杵。那Japan) according to the manufacturer’s instructions. Synthesis of cDNA was performed with Prime Script™ RT reagent Kit (TaKaRa Biomedicals, Japan) starting from 500 ng of total RNA according manual’s instructions. The real time quantitative RT-PCR was used to analyze the relative expression ofNR.GydF4y2Ba用SYBR Premix Ex Taq II (Tli RNaseH Plus;豆类生物医学、日本)。GydF4y2Ba肌动蛋白GydF4y2Ba基因(登录号:DQ641117)用作内部控制。由Primer3Plus设计基因特异性引物:对于GydF4y2BaNR.GydF4y2Ba(登录号:JQ692875.1),前进5'-aAccctAcatcctTcactcg-3'和反向5'-ggtccattgccatttcttct-3',适用于GydF4y2Ba施GydF4y2Ba,正向5 ' - cccatctatgagggttacgcc -3 ',反向5 ' - TGAGAGCATCAGTAAGGTCACGA-3 '。每次反应总体积为20 μL,包含10 μL SYBR Premix Ex Taq II、稀释10倍的cDNA 2 μL、10 μ m正向和保留引物0.8 μL,加水至最终体积20 μL。扩增程序由一个周期95°C的60年代,40周期5 s的95°C,和融化分析60°C 20年代,和95°C 15年代,紧随其后的是一个周期60°C的60年代,并为15秒95°C。每个基因的qRT-PCR均在3个生物重复中进行,每个实验3个技术重复。mRNA水平的相对定量是基于Livak和Schmittgen的方法[GydF4y2Ba37.GydF4y2Ba].阈值循环值(CT)GydF4y2Ba施GydF4y2Ba从目的基因中减去,得到ΔCt值。实验中对照样本的Ct值减去ΔCt值,得到ΔΔCt值。每个样本相对于对照的表达水平表示为2GydF4y2Ba-ΔΔctGydF4y2Ba.GydF4y2Ba
统计分析GydF4y2Ba
每次实验重复三次,并将收集的数据表示为平均值±标准误差(SE)。使用SPSS统计执行方差分析17.0软件和治疗方法由Duncan的多个范围测试分开(GydF4y2BaP.GydF4y2Ba< 0.05).GydF4y2Ba
可用性数据和材料GydF4y2Ba
在当前的研究中生成的数据集可从第一作者在合理的要求。GydF4y2Ba
缩写GydF4y2Ba
- 24-EBR:GydF4y2Ba
-
24-呕血素GydF4y2Ba
- 提单:GydF4y2Ba
-
epibrassinolideGydF4y2Ba
- BR:GydF4y2Ba
-
芸苔GydF4y2Ba
- 布尔GydF4y2BaZ.GydF4y2Ba:GydF4y2Ba
-
铜唑.GydF4y2Ba
- c-PTIO:GydF4y2Ba
-
2-(4-羧基-2-苯基)-4,4,5,5-四甲基咪唑啉-1-氧基-3-氧化物GydF4y2Ba
- 与原:GydF4y2Ba
-
cytokinin.GydF4y2Ba
- HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba:GydF4y2Ba
-
过氧化氢GydF4y2Ba
- 国际宇航科学院:GydF4y2Ba
-
indole-3-acetic酸GydF4y2Ba
- JA:GydF4y2Ba
-
茉莉酸GydF4y2Ba
- L-NAME:GydF4y2Ba
-
N-Nitro-L-精氨酸甲酯GydF4y2Ba
- 不:GydF4y2Ba
-
一氧化氮GydF4y2Ba
- 号:GydF4y2Ba
-
没有合酶GydF4y2Ba
- NR:GydF4y2Ba
-
硝酸还原酶GydF4y2Ba
- 山:GydF4y2Ba
-
水杨酸GydF4y2Ba
- 折断:GydF4y2Ba
-
S-nitroso-N-acerylpenicillamineGydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
Grove MD, Spencer GF, Rohwedder WK, Mandava N, Worley JF, Warthen JD, Steffens GL, Flippen-Anderson JL, Cook JC。油菜素内酯,一种植物生长促进类固醇GydF4y2Ba芸苔属植物显著GydF4y2Ba花粉。自然。1979年; 281(5728):216-7。GydF4y2Ba
- 2。GydF4y2Ba
Kurepin LV, Bey MA, Back TG, Pharis RP。油菜素内酯类的四种立体异构体在下胚轴和根伸长的结构-功能关系GydF4y2Ba拟南芥GydF4y2Ba.J工厂增长调节。2016; 35(1):215-21。GydF4y2Ba
- 3.GydF4y2Ba
康艳艳,郭世荣,李娟,段建军。24-表油菜素内酯对低氧胁迫下黄瓜幼苗根系抗氧化系统的影响。中国农业科学。2007;6(3):281-9。GydF4y2Ba
- 4.GydF4y2Ba
AGHDAM MS,Mohammadkhani N.通过采后芸苔属治疗提高番茄果实的冷凝胁迫耐受性。食品生物过程技术。2014; 7(3):909-14。GydF4y2Ba
- 5。GydF4y2Ba
Tanveer M, Shahzad B, Sharma A, Biju S, Bhardwaj R. 24-表油菜素内酯;一种活性油菜素内酯及其在植物耐盐胁迫中的作用研究进展。植物生理生化。2018;130:69-79。GydF4y2Ba
- 6。GydF4y2Ba
植物激素表油菜素内酯调控植物对重金属胁迫的耐受GydF4y2Ba栽培稻GydF4y2Ba通过调节抗氧化防御表达。Environ Exp Bot. 2016; 122:1-9。GydF4y2Ba
- 7.GydF4y2Ba
Anjum SA, Wang LC, Farooq M, Hussain M, Xue LL, Zou CM。油菜素内酯通过调节酶解抗氧化剂和叶片气体交换提高了玉米的耐旱性。作物学报,2011;197(3):177-85。GydF4y2Ba
- 8.GydF4y2Ba
2,4-表油菜素内酯对Ca(NO)植物矿质养分吸收和离子分布的调控GydF4y2Ba3.GydF4y2Ba)GydF4y2Ba2GydF4y2Ba强调黄瓜植物GydF4y2Ba☆GydF4y2Ba.J植物理性。2015; 188:29-36。GydF4y2Ba
- 9.GydF4y2Ba
赵光国,徐辉,张鹏,苏旭东,赵红霞。2,4-表油菜素内酯对植物光合作用和Rubisco激活酶基因表达的影响GydF4y2BaTriticum aestivum.GydF4y2Ba在干旱和热胁迫的组合下,L.幼苗。植物生长规律。2017;81(3):377-84。GydF4y2Ba
- 10。GydF4y2Ba
吕铮,黄敏,葛丹平,杨永华,蔡晓宁,秦鹏,佘建民。油菜素内酯对油菜愈伤组织生长和再生的影响GydF4y2BaSpartina Patens.GydF4y2Ba(禾本科)。植物学报。2003;73(1):87-9。GydF4y2Ba
- 11.GydF4y2Ba
不同浓度表油菜素内酯对离体红甘蓝叶绿素、蛋白质、花青素含量及过氧化物酶活性的影响(GydF4y2BaBrassica oleraceae.GydF4y2Bal .)子叶。生物技术装备。2007;21(4):422-5。GydF4y2Ba
- 12.GydF4y2Ba
Asami T, Min YK, Nagata N, Yamagishi K, Takatsuto S, Fujioka S, Murofushi N, Yamaguchi I, Yoshida S. brassinazole的研究进展。植物杂志。2000;123(1):93。GydF4y2Ba
- 13。GydF4y2Ba
Sanz L,Albertos P,Mateos I,Sánchezvicentei,Lechónt,Fernándezmarcosm,洛伦佐O.一氧化氮(NO)和早期植物发育过程中的雌激素串扰。J Exp Bot。2015; 66(10):2857。GydF4y2Ba
- 14。GydF4y2Ba
Gouvêacmcp,souza jf,magalhãesacn,martins是。NO· - 诱导玉米根系中生长伸长率的物质。植物生长调节。1997年; 21(3):183-7。GydF4y2Ba
- 15.GydF4y2Ba
Neill Sj,Desikan R,Hancock JT。植物中的一氧化氮信号传导。新的Phytol新植物学家。2003; 159(1):11-35。GydF4y2Ba
- 16。GydF4y2Ba
Parani M,Rudrabhatla S,Myers R,Weirich H,Smith B,Leaman DW,Goldman SL。氧化氮响应转录物的微阵列分析GydF4y2Ba拟南芥GydF4y2Ba.中国生物技术学报;2004;2(4):359-66。GydF4y2Ba
- 17.GydF4y2Ba
Delledonne M.没有新闻是植物的好消息。CurrOp植物BIOL。2005; 8(4):390-6。GydF4y2Ba
- 18.GydF4y2Ba
植物一氧化氮信号通路的新认识。植物学报。2008;59(1):21。GydF4y2Ba
- 19.GydF4y2Ba
汉考克JT,威尔逊HR,尼尔SJ。植物中的一氧化氮信号:John Wiley & Sons, ltd;2017.GydF4y2Ba
- 20。GydF4y2Ba
一氧化氮是维持植物细胞氧化还原平衡的普遍信号:抗坏血酸过氧化物酶的调控。J Exp Bot. 2015;66(10):2913。GydF4y2Ba
- 21。GydF4y2Ba
植物一氧化氮合酶:来自藻类的惊奇。植物科学。2018;268:64-6。GydF4y2Ba
- 22。GydF4y2Ba
朱艳,廖伟,王敏,牛玲,徐强,金霞。氢气诱导黄瓜不定根形成所需的一氧化氮。植物生理学杂志。2016;195:50-8。GydF4y2Ba
- 23。GydF4y2Ba
Tossi V,Lamattina L,Cassia R.药理学和遗传证据支持一氧化氮要求的根系结构的2,4-倍刺素醇调节GydF4y2Ba拟南芥GydF4y2Ba.植物学报。2013;8(7):e24712。GydF4y2Ba
- 24。GydF4y2Ba
Zottini M, Costa A, De MR, Ruzzene M, Carimi F, Lo SF。水杨酸能激活一氧化氮的合成GydF4y2Ba拟南芥GydF4y2Ba.中国农业科学。2007;58(6):1397。GydF4y2Ba
- 25。GydF4y2Ba
Tun NN, Livaja M, Kieber JJ, Scherer GF。玉米素诱导一氧化氮(NO)的生物合成GydF4y2Ba拟南芥GydF4y2BaNO生物合成和双组分信号基因突变体。新植醇。2008;178(3):515。GydF4y2Ba
- 26。GydF4y2Ba
关键词:一氧化氮,茉莉酸,损伤,诱导,信号通路GydF4y2Ba拟南芥GydF4y2Ba.Planta。2004; 218(6):938。GydF4y2Ba
- 27。GydF4y2Ba
Pagnussat GC,Simontacchi M,Puntarulo S,Lamattina L.根机组织需要一氧化氮。植物理性。2002; 129(3):954-6。GydF4y2Ba
- 28。GydF4y2Ba
XU Xiaoting, Xin J, Liao W, University GA: no在乙烯诱导黄瓜不定根发育中的作用。GydF4y2BaActa Horticulturae SinicaGydF4y2Ba2017.GydF4y2Ba
- 29.GydF4y2Ba
一氧化氮和环GMP是吲哚乙酸诱导的不定根过程的信使分子。植物杂志。2003;132(3):1241 - 8。GydF4y2Ba
- 30.GydF4y2Ba
Liao W,Huang G,Yu J,张M,Shi X.一氧化氮和过氧化氢参与了万寿菊的吲哚-3-丁酸诱导的不定根发育。j hortic sci biotechnol。2011; 86(2):159-65。GydF4y2Ba
- 31.GydF4y2Ba
Pacurar di,Perrone I,Bellini C.植物结中是一种中央球员,串联谈话,控制不定的生根。physiol植物。2014; 151(1):83-96。GydF4y2Ba
- 32。GydF4y2Ba
扦插不定根的分子和生理控制:植物激素作用与资源分配的关系。安机器人。2019;123(6):929 - 49。GydF4y2Ba
- 33。GydF4y2Ba
Zhang A, Zhang J, Zhang J, Ye N, Zhang H, Tan M, Jiang M. no介导油菜素内酯诱导的ABA合成及其对玉米叶片抗氧化能力的影响。植物生理学杂志。2011;52(1):181-92。GydF4y2Ba
- 34。GydF4y2Ba
邓旭,朱涛,邹lj,汉xy,周x,xi dh,张dw,林hh。芸薹类化合物介导的全身病毒抗性氢过氧化氢和一氧化氮的编排GydF4y2Ba烟草benthamianaGydF4y2Ba.细胞和分子生物学植物杂志。2016; 85(4):478。GydF4y2Ba
- 35。GydF4y2Ba
郭ms, Kim IH, Kim SK, Han TJ。油菜素内酯和萘乙酸对培养烟叶不定根、毛状根和愈伤组织形成的影响及CNT103的表达模式植物学报。2009;52(6):511。GydF4y2Ba
- 36。GydF4y2Ba
Karpets YV, Kolupaev YE报道。一氧化氮对24-表油菜素内酯诱导的小麦胚芽鞘耐热性的参与:一氧化氮与活性氧和Ca离子的功能相互作用。acta botanica yunnanica(云南植物研究). 2018;65(2):177-85。GydF4y2Ba
- 37。GydF4y2Ba
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据GydF4y2Ba-ΔΔctGydF4y2Ba方法。方法。2001; 25(4):402-8。GydF4y2Ba
- 38。GydF4y2Ba
Müssigc,Shin GH,Altmann T. Brassinosteroids促进了拟南芥的根生长。植物理性。2003; 133(3):1261-71。GydF4y2Ba
- 39。GydF4y2Ba
关m,罗迪克jg。番茄素醇醚抑制番茄的切除,不定和完整根源的发育(GydF4y2BaLycopersicon esculentumGydF4y2Ba):与甾体雌激素的影响进行比较。physiol植物。1988; 74(4):720-6。GydF4y2Ba
- 40.GydF4y2Ba
关m,罗迪克jg。春季糖苷和甾体雌激素对绿豆切割偶然根生长及早期拍摄发展的影响。physiol植物。2010; 73(3):426-31。GydF4y2Ba
- 41.GydF4y2Ba
田永强,闵永强,田中野,麻美,吉田GydF4y2Ba拟南芥GydF4y2Ba用油菜素类固醇生物合成抑制剂,油菜素唑,诱导一些轻生长植物的特性。足底。2000;211(6):781 - 90。GydF4y2Ba
- 42.GydF4y2Ba
38 .高油菜素内酯改善鹰嘴豆的盐胁迫(GydF4y2Ba中投arietinumGydF4y2Bal .)。环境实验机器人。2007;59(2):217-23。GydF4y2Ba
- 43.GydF4y2Ba
Ali B, Hayat S, Fariduddin Q, Ahmad A. 24-Epibrassinolide保护盐和镍产生的压力GydF4y2BaBrassica Juncea.GydF4y2Ba.化学层面。2008; 72(9):1387-92。GydF4y2Ba
- 44。GydF4y2Ba
法迪德丁Q,Khanam S,Hasan Sa,Ali B,Hayat S,Ahmad A. 28-同型rassinolide对干旱胁迫诱导的光合作用变化的影响和抗氧化系统的影响GydF4y2BaBrassica Juncea.GydF4y2BaActa physica sinica . 2009;31(5): 889-97。GydF4y2Ba
- 45。GydF4y2Ba
Engin H,Gokbayrak Z.22,23s-Homobrassinolide和胃酸酸的影响在“Bing”甜樱桃中的双果实中的形成。Acta Hortic。2016; 1139:299-302。GydF4y2Ba
- 46。GydF4y2Ba
元素磅,彭震,zhi tt,zho z,liu y,zhu q,xiong xy,ren cm。Brassinosteroid增强细胞素蛋白诱导的花青素生物合成GydF4y2Ba拟南芥GydF4y2Ba幼苗。医学杂志。2015;59(1):99 - 105。GydF4y2Ba
- 47。GydF4y2Ba
船闸JM。油菜素内酯诱导的伸长和生长素。杂志。2010;80(3):401 - 8。GydF4y2Ba
- 48。GydF4y2Ba
Nakamura A,Higuchi K,Goda H,Fujiwara M.T,Sawa S,Koshiba T,Shimada Y,Yoshida S. Brassinolide诱导IAA5,IAA19和DR5,一种合成的养羊酸响应元件GydF4y2Ba拟南芥GydF4y2Ba,暗示芸薹类化合物和养蛋白信号传导的十字谈话点。植物理性。2003; 133(4):1843-53。GydF4y2Ba
- 49。GydF4y2Ba
Vandenbussche F,Callebert P,Zadnikova P,Benkova E,Van der Straeten D. Brassinosteroid对芽原料控制与乙烯相互作用,取决于植物素信号传导组分。我是J机器人。2013; 100(1):215-25。GydF4y2Ba
- 50。GydF4y2Ba
他,张h,孙z,李继,洪g,朱q,周X,麦克法兰s,yan f,陈俊酸介导的防御抑制了大米黑色条纹矮化病毒感染的芸苔类固醇介导的敏感性。新植物。2017; 214(1):388。GydF4y2Ba
- 51。GydF4y2Ba
李X-P,徐Q-Q,廖W-B,MA Z-J,XU X-T,王M,REN P-J,NIU L-J,JIN X,ZHU Y-C。过氧化氢参与脱落酸诱导的黄瓜偶然生根(GydF4y2BaCucumis sativusGydF4y2Ba干旱胁迫下的土壤含水量。植物学报,2016;59(5):536-48。GydF4y2Ba
- 52.GydF4y2Ba
陈勇,王敏,胡丽,廖伟,达uda MM,李晨。模拟干旱胁迫下氢气诱导黄瓜不定根发育的机理。植物学报2017;8:128。GydF4y2Ba
- 53.GydF4y2Ba
廖W,萧H,张M.氧化氮与过氧化氢的角色与关系在万寿菊的不定根发育中。acta physiol植物。2009; 31(6):1279。GydF4y2Ba
- 54.GydF4y2Ba
徐晓涛,金旭,廖文斌,大uda MM,李晓平,王明,牛丽娟,任丕杰,朱永春。一氧化氮参与乙烯诱导黄瓜不定根发育(GydF4y2BaCucumis sativusGydF4y2Bal .)外植体。Sci Hortic。2017;215:65 - 71。GydF4y2Ba
- 55.GydF4y2Ba
一氧化氮和油菜素内酯对番茄生理生化的影响GydF4y2BaLycopersicon esculentumGydF4y2Ba在干旱胁迫下。植物学报。2017;39:3。GydF4y2Ba
- 56。GydF4y2Ba
李X,张立,答复GJ,李紫猫,魏吉,沉C,燕P,张立吕,韩国。一氧化氮介导芸苔类固醇诱导的黄酮类生物合成GydF4y2Ba茶树GydF4y2BaL. J植物理性。2017; 214:145-51。GydF4y2Ba
- 57。GydF4y2Ba
齐F,Xiang Z,Kou N,Cui W,Xu D,Wang R,朱D,沉W.一氧化氮参与黄瓜中的甲烷诱导的不定根形成。physiol植物。2017; 159(3):366-77。GydF4y2Ba
- 58。GydF4y2Ba
金X,Liao DW,Yu JH,REN MP,Dawuda MM,Wang MM,Niu ML,Li MX,XU MX:一氧化氮涉及乙烯诱导的乙烯诱导的植物科学杂志2017。GydF4y2Ba
- 59。GydF4y2Ba
轩W,徐某,李米,汉B,张B,张j,林y,黄j,沉w,崔j.一氧化氮涉及血葱诱导的黄瓜不定的生根过程。J植物理性。2012; 169(11):1032-9。GydF4y2Ba
- 60。GydF4y2Ba
Chen T,Yuan F,Song J,Wang B.一氧化氮通过Euhalophyte中增强的不定根形成参与疏水性耐受性GydF4y2Ba碱蓬莎莎GydF4y2Ba.植物生态学报。2016;43:3。GydF4y2Ba
- 61。GydF4y2Ba
硝酸还原酶介导的一氧化氮的生成是脱落酸诱导的气孔关闭的必要条件GydF4y2Ba拟南芥GydF4y2Ba.Proc Natl Acad Sci U S A. 2002; 99(25):16314-8。GydF4y2Ba
- 62。GydF4y2Ba
Lambeck I,Chi J-C,Krizowski S,Mueller S,Mehlmer N,Teige M,Fischer K,Schwarz G.动力学分析为14-3-3抑制GydF4y2Ba拟南芥GydF4y2Ba硝酸还原酶。生物化学,2010;49(37):8177 - 86。GydF4y2Ba
- 63。GydF4y2Ba
Athwal GS,Huber JL,Huber Sc。磷酸化的硝酸还原酶和14-3-3蛋白。植物理性。1998年; 118(3):1041。GydF4y2Ba
致谢GydF4y2Ba
感谢程立祥博士(甘肃省旱地作物科学重点实验室,甘肃农业大学,兰州730070)提供的方法支持。GydF4y2Ba
资金GydF4y2Ba
该研究工作是由中国国家自然科学基金(Cars-23-C-07),甘肃省科技项目(17ZD2NA015-03)和国家的国家自然科学基金(第31660584号),中国农业研究系统提供资金中国重点研发项目(2018YFD0201205)。该资助者在设计实验,数据收集和分析,数据解释以及写作稿件方面没有作用。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
YL和JY2构思和设计了这项研究。YL和WL进行了实验。YL,YW,XJ,JY1和ZT分析了数据并准备了数字和插图。yl写了稿件。WL,LH和MD阅读手稿并制作了有价值的投入。所有作者都阅读并批准提交稿件。GydF4y2Ba
通讯作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
李,Y.,吴,Y.,廖,W。GydF4y2Ba等等。GydF4y2Ba一氧化氮参与了油菜素内酯诱导的黄瓜不定根的发育。GydF4y2BaBMC植物BIOL.GydF4y2Ba20,GydF4y2Ba102(2020)。https://doi.org/10.1186/s12870-020-2320-yGydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-020-2320-yGydF4y2Ba
关键词GydF4y2Ba
- 芸苔GydF4y2Ba
- 一氧化氮GydF4y2Ba
- 一氧化氮合酶GydF4y2Ba
- 硝酸还原酶GydF4y2Ba
- 硝酸还原酶基因GydF4y2Ba