- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
使用RNA测序分析识别控制苜蓿花卉色素沉着变化的调节网络和轮毂基因gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba, 文章编号:gydF4y2Ba110gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
为了解控制紫花苜蓿花色形成的基因表达网络,利用Defu和中天3号两种花色对比材料鉴定花色苷,并用PacBio全长测序结合RNA测序进行转录组分析。横跨花的四个发育阶段。gydF4y2Ba
结果gydF4y2Ba
德福花的花色苷主要为Malvidin和petunidin苷类衍生物,中天3号花中缺乏这两种花色苷。这两个转录组数据集提供了一个全面的系统水平的动态基因表达网络支持苜蓿花颜色形成。通过加权基因共表达网络分析,我们从与花发育阶段密切相关的模块中识别出候选基因和中心基因。gydF4y2Ba朋友gydF4y2Ba,gydF4y2Ba4CLgydF4y2Ba,gydF4y2BaCHSgydF4y2Ba,gydF4y2Ba空空的gydF4y2Ba,gydF4y2BaF3'HgydF4y2Ba,gydF4y2BaDFRgydF4y2Ba,gydF4y2BaUFGTgydF4y2Ba在重要的模块中得到了丰富。此外,gydF4y2BaPAL6gydF4y2Ba,gydF4y2BaPAL9gydF4y2Ba,gydF4y2Ba4 cl18gydF4y2Ba,gydF4y2BaCHS2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba和gydF4y2Ba8gydF4y2Ba被鉴定为枢纽基因。因此,提出了中天3号花缺乏紫色的假说。gydF4y2Ba
结论gydF4y2Ba
这些分析发现了大量潜在的调控花色素形成的关键调控因子,从而为苜蓿花发育的分子网络提供了新的认识。gydF4y2Ba
背景gydF4y2Ba
花卉颜色是高等植物的重要园艺性状[gydF4y2Ba1gydF4y2Ba].花的颜色变化可以通过吸引传粉者的造访来实现重要的生态功能,并影响开花植物的繁殖成功[gydF4y2Ba2gydF4y2Ba],可以保护植物及其生殖器官来自紫外线损伤,害虫和病原体[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,并在植物进化中起着极其重要的作用[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].此外,花色与植物的农艺性状有直接或间接的联系,经典的育种方法已被广泛应用于花色变异品种的培育[gydF4y2Ba7gydF4y2Ba].gydF4y2Ba
属的三种gydF4y2BaMedicagogydF4y2BaL.是欧洲俄罗斯中部最典型的草甸生态系统代表:紫花苜蓿(gydF4y2BaM. Sativa.gydF4y2Ba黄苜蓿(L.)gydF4y2Ba黄花苜蓿gydF4y2BaL.)和黑色军医(gydF4y2Bam . lupulinagydF4y2BaL.),被广泛栽培和野生[容易生长gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].这些物种的明显差异是它们的形态特征,其中花的颜色是区分它们的主要特征[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].了解与花色相关的不同苜蓿种质材料的生长期,植物特征,农艺特征,质量和光合特性的差异在苜蓿育种中具有重要意义[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].gydF4y2Ba
上述gydF4y2BaMedicagogydF4y2Ba紫花苜蓿是最高产的多年生豆科植物,具有高的生物量生产力,优良的营养结构和足够的持久性[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].黄花的黄苜蓿与苜蓿密切相关,比苜蓿更好的耐寒耐寒性[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].此外,野生植物gydF4y2BaM. Varia.gydF4y2Ba具有多种花色变化具有对生物和非生物压力的潜在抵抗力[gydF4y2Ba20.gydF4y2Ba].植物中丰富的花色素突变体的可用性gydF4y2BaMedicagogydF4y2Ba物种提供了一种理想的系统,用于调查花色与苜蓿的应力抗性之间的关系。了解苜蓿中花色形成的分子机制,鉴定相关的关键基因将有助于构建苜蓿核心种质。gydF4y2Ba
类黄酮、类胡萝卜素和甜菜碱是三种主要的花卉色素[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].类黄酮,特别是花青素,有助于植物中花的色素沉着[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].在花朵盛开的过程中,从隐性白色到色素还原等位基因发生体细胞突变,花朵的斑驳不可避免地是调控基因差异表达的结果[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].迄今为止,在许多观赏植物和许多研究中,如葡萄风信子,gydF4y2Ba山茶花nitidissimagydF4y2Ba,gydF4y2BaErysimum cheirigydF4y2Ba,gydF4y2BaMatthiola incanagydF4y2Ba[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].利用与花色形成相关的关键基因来创造具有特殊花色的植物新品种是基因工程的回避,而传统育种方法可能难以准确获得表型[gydF4y2Ba30.gydF4y2Ba].例如,表达gydF4y2BaF3’5是什么gydF4y2Ba(类黄酮-3',5'-羟化酶)基因gydF4y2BaRosa HybridagydF4y2Ba导致转基因玫瑰品种,通过杂交育种未实现新的蓝色花色[gydF4y2Ba31gydF4y2Ba].通过转移反义gydF4y2BaCHSgydF4y2Ba[关键词]矮牵牛;查尔酮合成酶;gydF4y2Ba32gydF4y2Ba].虽然在许多重要的观赏作物中,花色改良已经通过分子育种实现,但由于缺乏花色形成的分子机制,花色特殊的紫花苜蓿品种往往通过自然选择进行选择。gydF4y2Ba
RNA测序(RNA- seq)技术在没有参考基因组的情况下为非模式生物的分子特征提供了独特的见解,并对涉及类黄酮色素生物合成和类胡萝卜素生物合成的一系列基因进行了系统分析[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].然而,短读测序的局限性导致了大量的计算挑战,阻碍了转录本重建和剪接事件的检测[gydF4y2Ba35gydF4y2Ba].Chao等人。[gydF4y2Ba36gydF4y2Ba]发现,PacBio Iso-Seq (isoform sequencing)平台可以细化短读测序数据,包括对转录本进行分类和量化,以及搜索更多的选择性拼接事件。gydF4y2Ba
在这里,我们使用PacBio Iso-Seq结合RNA-Seq,在两种不同花色的紫花苜蓿材料中鉴定与花色变异相关的特异性基因。该数据集提供了一个全面的和系统级概述的动态基因表达网络及其在控制花色素的潜在作用。采用加权基因共表达网络分析(WGCNA)方法,对不同花色紫花苜蓿的共表达基因模块和候选中心基因模块进行了鉴定。这项研究为了解紫花苜蓿乳白色花色素形成的分子网络提供了重要的线索。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
2002年3月25日至31日,“神舟3号”返回式宇宙飞船将优质苜蓿品种德福(C)的种子送入太空,在太空中飞行了7天。2009年在兰州市西郭源将1/3的空间暴露种子与对照C一起种植,发现单株乳白色花,单独采集种子。2010年在兰州市秦王川隔离播种后,F1代有29株呈乳白色。收集种子,混合种植3代,2014年确认F4代的突变株为乳白色。与对照C相比,突变系在花期表现出稳定的乳白色花色,命名为“中天3号”(M)。M的原种子保存在中国农业科学院兰州畜牧医药研究所。gydF4y2Ba
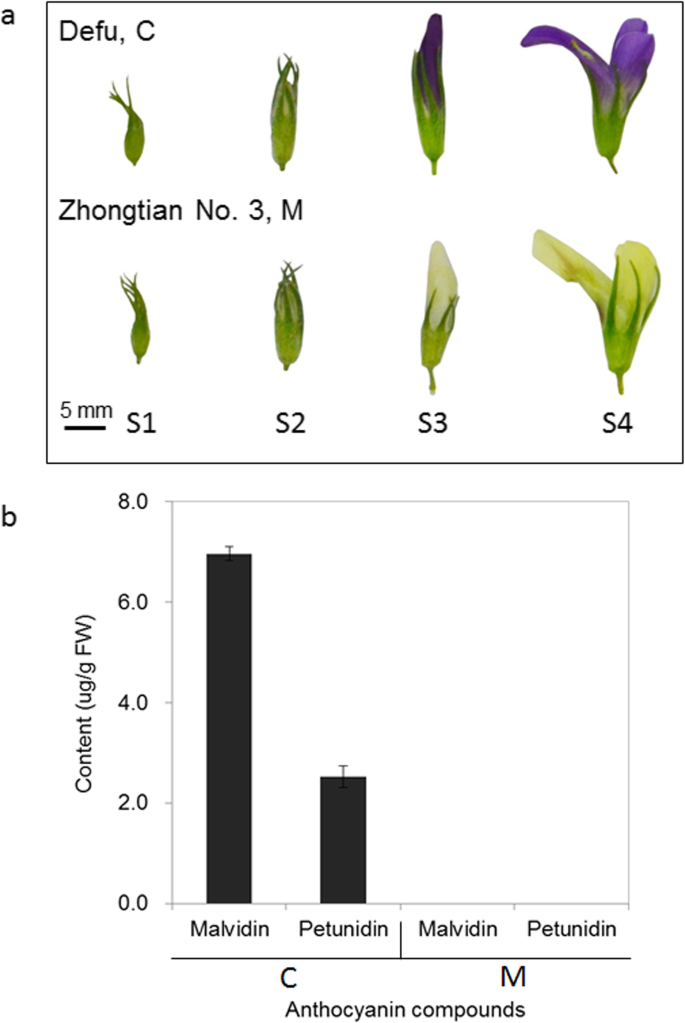
品种C和M的苜蓿种植在Dawashan实验站(36°02'20''N,103°44'36''E,1697 1H)兰州,甘肃,中国的在4月22日2018年的所有幼苗同年龄的培养上在同一管理下的做法同质绵土(土壤管理,灌溉,施肥,和疾病控制)。C和M的花瓣从四个不同的发展阶段收集。四个阶段中根据花器官的定性观察定义:S1(小花分离的阶段和萼包装花瓣),S2(花萼裂片之间出现的花瓣的阶段,与该花瓣的长度不exceeding more than 2 mm of the calyx), S3 (the stage where the petals exceed the calyx by 2 mm or more, the keel is still wrapped by the vexil, and during which the petals were just beginning to accumulate pigmentation), and S4 (the stage where the floret was in full bloom, with fully pigmented petals) (Fig.1gydF4y2Ba一种)。这四个阶段分别为苜蓿无限期花序同时进行评估。Samples were harvested at the same time of day (9–11 AM) on July 4, 2018. Representative floral organs in each stage from three different plants were combined to form a sample, and three biological replicates were used for each floral development stage. All the samples in each stage endowed the same characteristics both of size and flower color, which were prepared for anthocyanin contents measurement and Illumina sequencing. Tissues of the leaves, shoots, stems, roots, flowers from the four different developmental stages above, and the young fruits from three C plants, were collected and pooled together in approximately equivalent weights. The mixed sample from 9 different tissues was then prepared for PacBio full-length sequencing. The samples were immediately frozen in liquid nitrogen and stored at − 80 °C until use.
花青素的高效液相色谱分析(HPLC)gydF4y2Ba
C-S4和M-S4分别从完全开放的苜蓿花中提取新鲜花瓣组织,提取花青素。简单地说,从每个样品中提取0.5 g组织,在4°C下接地在1 mL含有1.6%甲酸的98%甲醇中。超声提取30 min后,12000 g离心10 min,将上清液转移到新鲜管中,再次提取残留。然后将上清液混合,通过0.45 mm尼龙过滤器(Millipore)过滤。标准物质为飞燕草苷3-gydF4y2BaOgydF4y2Ba花青色素3 -葡萄糖苷gydF4y2BaOgydF4y2Ba天竺葵色素3 -葡萄糖苷gydF4y2BaOgydF4y2Bapeonidin 3 -葡萄糖苷gydF4y2BaOgydF4y2Ba葡糖苷,二甲翠雀素3-gydF4y2BaOgydF4y2Ba-glucoside和petunidin 3-gydF4y2BaOgydF4y2Ba-葡萄糖苷(上海ZZBIO有限公司)根据Tripathi等人的方法[gydF4y2Ba24gydF4y2Ba], 10 μL的提取物采用高效液相色谱法(Rigol L-3000,中国)进行分析。从3个生物重复中获得平均值和标准误差(SEs)。gydF4y2Ba
RNA定量和质量评估gydF4y2Ba
使用mirvana miRNA隔离套件(Thermo Fisher Scientific,Waltham,Ma,USA)提取总RNA。在1%琼脂糖凝胶上评估RNA降解和污染。使用Agilent 2100 Bioanalyzer(Agilent Technologies,Santa Clara,Ca,USA)评估RNA数量和质量,使用Agilent 2100生物分析仪(Agilent Technologies,Santa Clara,CA)评估RNA的数量和质量。gydF4y2Ba
PacBio Iso-Seq文库的制备和测序gydF4y2Ba
使用SMRTbell™Template Prep Kit 1.0-SPv3 (Pacific Biosciences, Menlo Park, CA, USA)对C混合样品中的1 μg总RNA进行测序。最终文库的数量和浓度由Qubit 2.0荧光计(Life Technologies, Carlsbad, CA, USA)验证。文库的大小和纯度使用安捷伦2100生物分析仪(安捷伦技术公司,Santa Clara, CA, USA)确定。按照Sequel Binding Kit 2.0 (Pacific Bioscience, USA)的引物退火和聚合酶结合指令,装载磁珠的SMRTbell模板在上海大oe生物技术有限公司(中国上海)的PacBio Sequel仪器上完成。gydF4y2Ba
Illumina的转录组文库制备和测序gydF4y2Ba
在四个阶段的两种材料的三份生物样品产生24个非定向cDNA文库(C-S1,C-S2,C-S3,C-S4,M-S1,M-S2,M-S3和M-S4),从4μg的总RNA获得。库的大小和纯度用Agilent 2100 Bioanalyzer(Agilent Technologies,Santa Clara,CA,USA)进行了测试。最终图书馆是在上海OE Biotech Co的Illumina Hiseq™XTEN仪器生成的。,Ltd。(上海,中国)gydF4y2Ba
PacBio数据分析gydF4y2Ba
Isoseq (gydF4y2Bahttps://github.com/PacificBiosciences/IsoSeq_SA3nUP/wiki#datapubgydF4y2Ba),包括圆形的共有序列(CCS),分类和聚类分析,高品质的共识同种型和低质量亚型产生从原始subreads识别。高和低品质结合同种型的错误校正用的是RNA测序数据与软件LoRDEC进行。校正后的同种型使用所述软件GMAP(参照基因组进行了比较gydF4y2Bahttp://www.molecularevolution.org/software/genomics/gmapgydF4y2Ba).之后,然后将冗余同种型除去,以使用豆腐(以下)的程序生成高质量的转录数据集(gydF4y2Bahttp://github.com/PacificBiosciences/cDNA_primer/gydF4y2Ba)识别值为0.85。使用软件Busco(V3.0.1)评估转录数据集的完整性(gydF4y2Bahttps://busco.ezlab.org/gydF4y2Ba).所有鉴定出的非冗余转录本均用BLASTX进行搜索(e值≤1)gydF4y2BaE-5gydF4y2Ba)与Non-redundant (NR)、SWISS-PROT和Kyoto Encyclopedia of Genes and Genomes (KEGG)的蛋白数据库进行比对,从排序最高的蛋白中确定推定的编码序列(CDS)。此外,用软件包ESTScan预测了不匹配转录本的CDS。将非冗余转录本与PlantTFDB (gydF4y2Bahttp://planttfdb.cbi.pku.edu.cn/index.phpgydF4y2Ba)和AnimalTFDB (gydF4y2Bahttp://bioinfo.life.hust.edu.cn/AnimalTFDB/gydF4y2Ba)数据库,获取转录因子(转录因子)的注释信息。gydF4y2Ba
AStalavista软件[gydF4y2Ba37gydF4y2Ba]用于检测样本中备选剪接事件。选取长度大于200 bp的转录本作为候选lncRNA,筛选出大于300 bp的开放阅读框(open reading frames, ORFs)。使用最小外显子长度和数目阈值过滤掉推定的蛋白编码rna。采用CPC2、CNCI、Pfam和PLEK四种计算方法进一步筛选lncrna。gydF4y2Ba
Illumina公司数据分析gydF4y2Ba
根据基于标签的数字基因表达(DGE)系统协议,构建了24个独立的C和M花在不同发育阶段的cDNA文库。在去除低质量标签后,包括未知核苷酸“n”标签、空标签和只有一个拷贝数的标签,干净标签被映射到我们的转录组参考数据库。为了分析基因表达,计算每个基因的干净标签的数量,并将其归一化为FPKM(片段/千碱基转录本/百万图读)。一个gydF4y2BaPgydF4y2Ba-value在多次试验中≤0.05,且为绝对对数gydF4y2Ba2gydF4y2Ba以Fold change值≥2为阈值,判断基因表达是否存在显著差异。gydF4y2Ba
加权基因共表达网络分析gydF4y2Ba
利用R包WGCNA根据归一化表达矩阵数据识别高度相关基因模块[gydF4y2Ba38gydF4y2Ba].R包装用于基于基因的表达和方差(标准偏差≤0.5)过滤基因。总共剩下16,581个基因。通过进行函数拾取,选择相关矩阵的软阈值为16,并且相关系数为0.83。拓扑重叠(to)矩阵由TOM相似性算法生成,然后用混合树切割算法60分层群集转录物[gydF4y2Ba29gydF4y2Ba].第一主成分由模块特征表示。gydF4y2Ba
实时定量(RT-Q)PCR验证gydF4y2Ba
参与类黄酮合成十二选择DEGS通过RT-qPCR测定。总RNA从24个样品(一式三份)萃取如上所述。First-strand cDNA was synthesized from 0.1 μg of total RNA by the manufacturer’s instruction (Vazyme, R223–01). The reactions were performed using a QuantiFast® SYBR® Green PCR Kit (Qiagen, Germany), and RT-qPCR was carried out on an Applied Biosystems QuantStudio™ 5 platform (Thermo Fisher Scientific, Waltham, MA, USA). The primers were designed with the Primer premier 5.0 software and synthesized by TsingKe Biological Technology Co., Ltd. (Xi’an, China) (TableS1gydF4y2Ba).gydF4y2BaRER1gydF4y2Ba(JZ818481)用作内标[gydF4y2Ba39gydF4y2Ba].使用2的基因的相对表达水平计算gydF4y2Ba−ΔΔCtgydF4y2Ba方法(gydF4y2Ba40gydF4y2Ba].gydF4y2Ba
统计分析gydF4y2Ba
所有RT-QPCR数据都表示为平均值±SE(gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba
结果gydF4y2Ba
量化的花青素gydF4y2Ba
我们定量了六种已知参与颜色形成的花青素(飞燕花素、花青素、天竺葵素、牡丹花素、锦葵素和牵牛花素)。C-S4中检测到两种高含量的malvidin和petunidin,其含量分别为7.0 μg/g鲜重(FW)和2.5 μg/g鲜重。此外,M-S4乳白色花中未检测到颜色花青素。gydF4y2Ba1gydF4y2Bab)。gydF4y2Ba
利用PacBio Iso-Seq平台对花的转录组进行测序和分析gydF4y2Ba
为了识别尽可能长是转录物,选自C的不同组织(详见方法)的混合样品的转录是由异SEQ系统测序,得到14330000个subreads。一个fter the quality control of Isoseq, 140,995 isoforms were obtained, including 16,340 high-quality isoforms (accuracy > 99%). Most of the corrected isoforms (98.52%) were mapped to theMedicagogydF4y2Ba基因组(gydF4y2BaM. Truncatula.gydF4y2BaMt4.0v2),豆腐加工得到33,908个非冗余亚型(表gydF4y2Ba1gydF4y2Ba).非冗余转录本亚型用于后续分析。gydF4y2Ba
我们比较了33908个亚型与gydF4y2BaMedicagogydF4y2Ba利用MatchAnnot软件(Mt4.0v2)和7784个(23%)注释基因的新同型(比率覆盖< 50%)。gydF4y2Bahttps://github.com/tomskelly/matchannot.gydF4y2Ba),获得了513个与任何注释基因不重叠的新亚型。为了确定这513个新异构体是否存在于其他植物中,我们对Swiss-Prot (e值≤egydF4y2Ba−10gydF4y2Ba,见方法)。总共有309(60.23%)这些同种型在Swiss-Prot数据库中注释,并且剩余的同种型是未解说的(表gydF4y2BaS2gydF4y2Ba).gydF4y2Ba
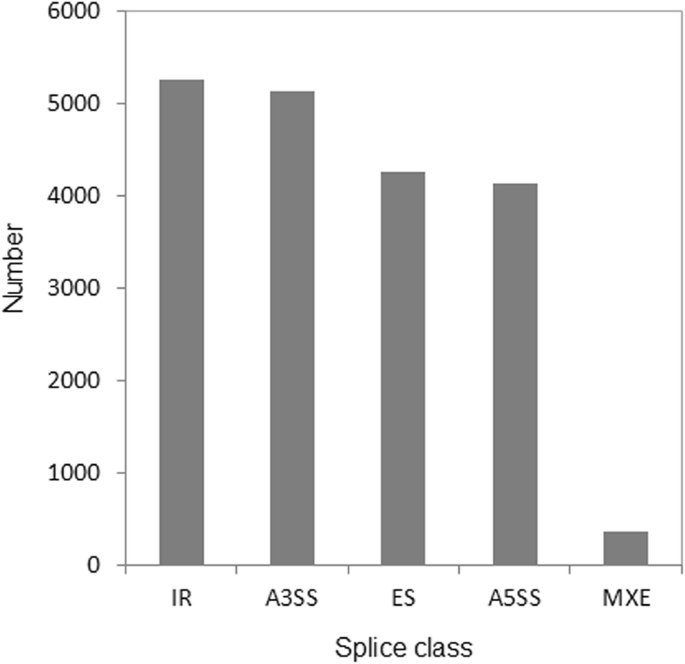
分析了分布在5个主要剪接事件中的异构体的数量。内含子保留(IR)是最具代表性的,占可变剪接转录本的27.5%(图2)。gydF4y2Ba2gydF4y2Ba).MXE(互斥外显子)最少,占可变剪接转录本的1.9%。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
By filtering and excluding transcripts with an ORF of more than 300 bp, 143 lncRNAs were finally obtained. The lncRNAs exhibited a wide length range from 202 bp to 2733 bp, and most of which (72%) were shorter than 700 bp. The average length of the lncRNAs (682 bp) was much shorter than the average length of all 33,908 isoforms (2146 bp).
使用Illumina平台的花卉转录组测序和分析gydF4y2Ba
为了性能比较和验证,我们还在Illumina HiSeq™XTen测序平台上独立生成了标准短读RNA-Seq数据。对两个品种的花器官进行了不同发育阶段的取样。因此,鉴定不同花器官的DEGs有助于了解花色素沉着调控的差异。对上述样品进行RNA-Seq分析,每个样品有三个生物重复。gydF4y2Ba
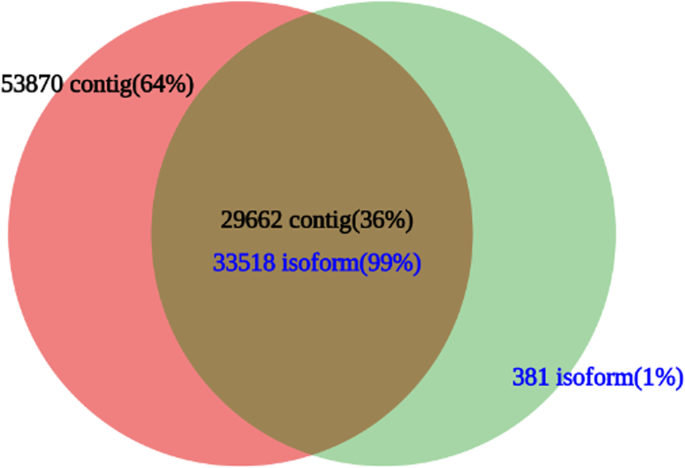
与BLASTN的PacBio转录本亚型相比(覆盖率≥0.85,e-value≤1)gydF4y2Bae-20gydF4y2Ba36%的转录组(29662 contigs)与99%的PacBio转录组(33,518 isoforms)具有相似性。每个数据集有64%的转录contigs(53,870)和1%的PacBio转录亚型(381亚型)是唯一的(图)。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
将标准化reads低于0.5 FPKM的转录本从分析中去除。C-S1、C-S2、C-S3和C-S4中分别有28365、28242、28088和28185个转录本表达。同样,在m各阶段的样本中,分别鉴定出27,810,27,726,27,711和27,878个转录本。表达的转录本数量分布在0.5-1 FPKM范围,1-10 FPKM范围和≥10 FPKM范围如图所示。gydF4y2Ba4gydF4y2Ba一种。gydF4y2Ba
主成分分析(PCA)透露,24个样品可以清楚地分配给八组为C-S1,C-S2,C-S3 C-S4,M-S1,M-S2,M-S3和M-S4(无花果。gydF4y2Ba4gydF4y2Bab)。来自同一阶段的C和M的样品表现出远处的聚类关系,表明整个转录组曲线在每个发育阶段的C和M显然不同(图。gydF4y2Ba4gydF4y2Bab)。gydF4y2Ba
紫花苜蓿和乳花材料的花发育过程中的差异gydF4y2Ba
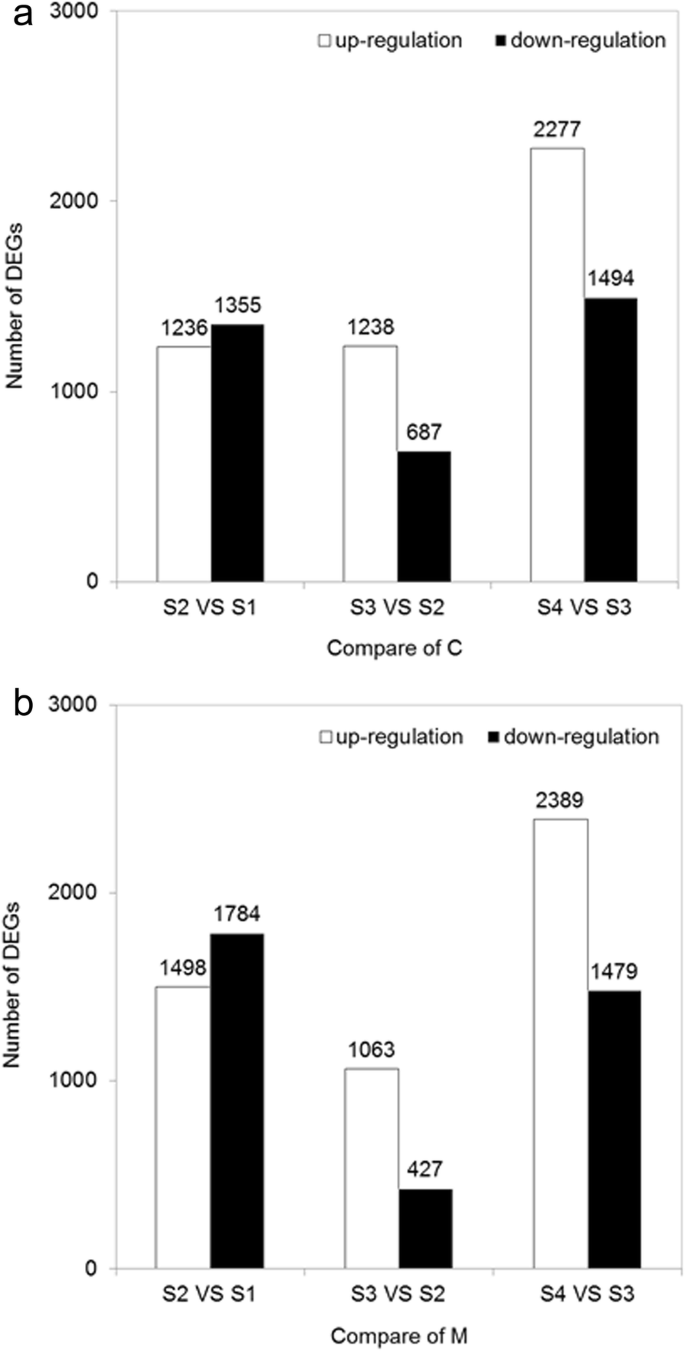
通过比较四种不同的花卉发育阶段,使用假发现率(FDR)值<0.05且折叠变化> 2的阈值来分析基因表达的差异。总计2591,1925和3771次C-S2之间鉴定对C-S1,C-S3对C-S2,C-S4对C-S3,分别(图gydF4y2Ba5gydF4y2Ba一种)。类似地,M-S2之间进行鉴定VS M-S1,M-S3 VS M-S2,M-S4 VS M-S3,分别(图3282,1490和3868度的视角。gydF4y2Ba5gydF4y2Bab)。与S1的对比S2,C和M的下调unigenes类似于上调的unigenes。不同地,上调的unigenes在S3 VS S2之间占主导地位,以及C和M的S4 VS S3之间。gydF4y2Ba
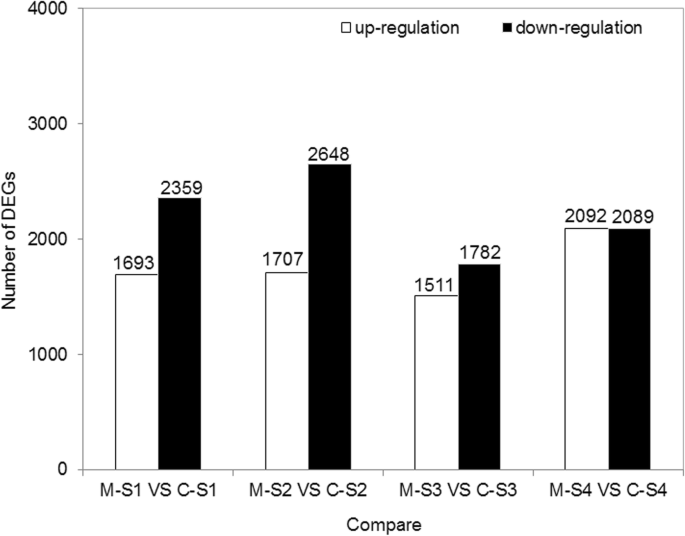
为了分析C和M的花色形成差异,我们比较了同一花发育阶段C和M的DEGs。M-S1与C-S1、M-S2与C-S2、M-S3与C-S3、M-S4与C-S4之间分别鉴定出4052、4355、3293和4181个差异基因。此外,1693、1707、1511和2092个DEGs分别上调(图2)。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
为了识别富集的类黄酮生物合成相关代谢途径,我们通过比较C和m不同花期的KEGG途径进行分析。随着花的开花,富集的类黄酮生物合成相关代谢途径明显增加。特别是M-S4与C-S4之间,前5个KEGG通路富集黄酮和黄酮醇生物合成(ko00944)、类黄酮生物合成(ko00941)和苯丙素生物合成(ko00940)(图)gydF4y2BaS1gydF4y2Ba),暗示花色形成的关键阶段。gydF4y2Ba
类黄酮生物合成相关基因的转录谱gydF4y2Ba
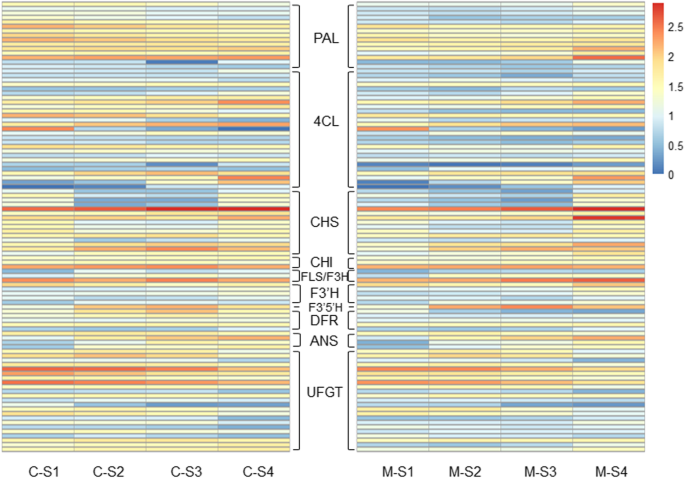
为了确定类黄酮生物合成的关键基因,我们排除FPKM值小于5的基因。苯丙氨酸ammonia-lyase (gydF4y2Ba朋友gydF4y2Ba4-香豆酸:辅酶A连接酶(gydF4y2Ba4CLgydF4y2Ba,27个同种型),gydF4y2BaCHSgydF4y2Ba(15个同种型),查耳酮异构酶(gydF4y2Ba气gydF4y2Ba、黄酮3-羟化酶(gydF4y2BaF3HgydF4y2Ba)/黄酮醇合成(gydF4y2BaFLS的gydF4y2Ba)(3亚型)、类黄酮3 ' -单加氧酶(gydF4y2BaF3'HgydF4y2Ba5亚型),gydF4y2BaF3’5是什么gydF4y2Ba(1个同种型),二氢酚酰酚4-还原酶(gydF4y2BaDFRgydF4y2Ba, 5个异构体)、花青素合酶(gydF4y2Ba答gydF4y2Ba,4个同种型)和UDP-葡萄糖:黄酮类化合物3-O-葡糖糖基转移酶(gydF4y2BaUFGTgydF4y2Ba共鉴定出23个亚型gydF4y2BaS3.gydF4y2Ba).共101个亚型(编码11种酶)的表达模式在热图中显示出来,在花发育过程中,C和M亚型的表达变化不同。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
类黄酮生物合成DEGs的表达热图。deg的表达式以log的形式显示gydF4y2Ba10gydF4y2Ba(FPKM+ 1).朋友gydF4y2Ba,苯丙氨酸氨酶;gydF4y2Ba4CLgydF4y2Ba, 4-香豆酸:辅酶A连接酶;gydF4y2BaCHSgydF4y2Ba查耳酮合酶;gydF4y2Ba气gydF4y2Ba,查尔酮异构酶;gydF4y2BaFLS的gydF4y2Ba黄酮醇合成;gydF4y2BaF3HgydF4y2Ba醇,黄烷酮3-羟化酶;gydF4y2BaF3'HgydF4y2Ba类黄酮3 ' -羟化酶;gydF4y2BaF3’5是什么gydF4y2Ba类黄酮3 ' 5 '羟化酶;gydF4y2BaDFRgydF4y2Ba, dihydroflavonol 4-reductase;gydF4y2Ba答gydF4y2Ba花青素合成酶;gydF4y2BaUFGTgydF4y2Ba, udp -葡萄糖:类黄酮3- o -葡萄糖基转移酶gydF4y2Ba
在这些舞台中,最多gydF4y2Ba朋友gydF4y2Ba基因在C中表达下调,而在m中表达上调gydF4y2Ba暂定配额通知书gydF4y2BaC组显著高于M组(图3)。gydF4y2Ba7gydF4y2Ba).这些“伙伴”可能在花的颜色形成过程中起着至关重要的作用。大多数基因编码gydF4y2Ba4 clsgydF4y2Ba,gydF4y2BachsgydF4y2Ba,gydF4y2Ba气gydF4y2Ba,gydF4y2BaFLS的gydF4y2Ba/gydF4y2BaF3HsgydF4y2Ba,gydF4y2BaF3'HsgydF4y2Ba,gydF4y2BaF3'5'HsgydF4y2Ba,gydF4y2Ba答gydF4y2Ba,gydF4y2BaUFGTsgydF4y2Ba在C和M表现出类似的表达模式与花盛开然而,FPKM值C和M之间差异很大,这表明差异表达丰度在C和M此外,我们发现4gydF4y2BaDFR.gydF4y2Ba在C和M中具有不同的表达变化(特别是gydF4y2BaDFR1gydF4y2Ba和gydF4y2BaDFR2.gydF4y2Ba),在C中的FPKM值明显高于m,暗示它们在不同花中的颜色形成中的潜在功能(图。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
基于花卉颜料的基因共表达网络分析gydF4y2Ba
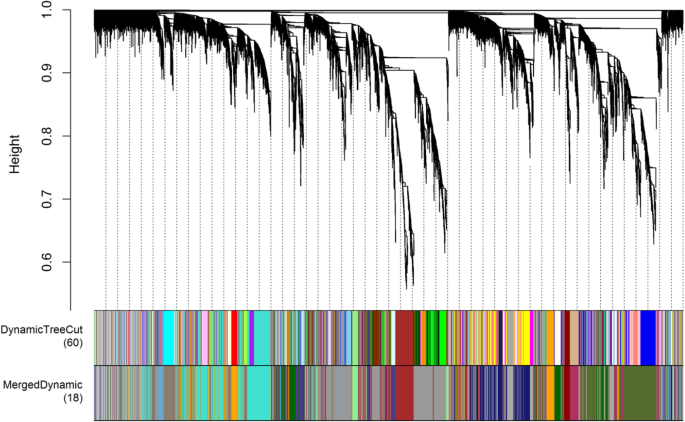
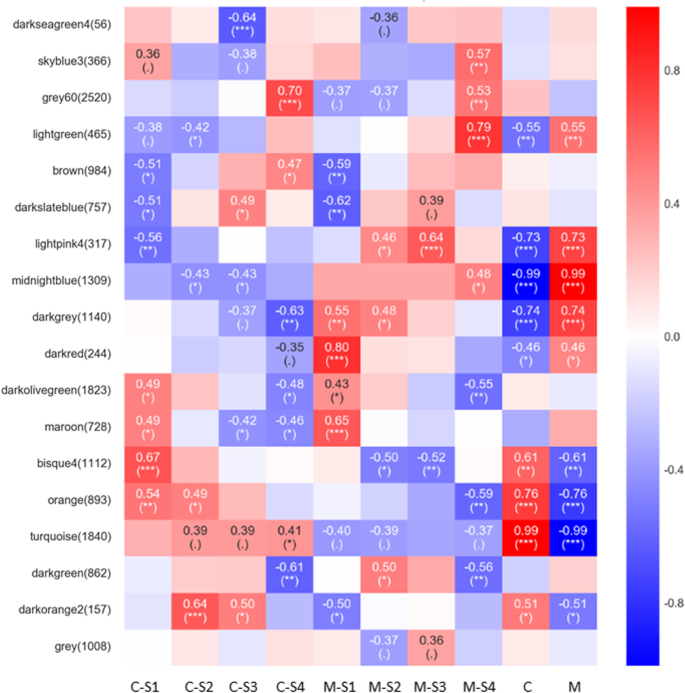
为了揭示与两个品种连续发育阶段变化相关的调控网络,我们构建了WGCNA共表达模块分析(图)。gydF4y2Ba8gydF4y2Ba).基于对所有样品的基因表达的成对相关性构建共表达网络。模块被定义为高度相互连接的基因的簇,同一簇内的基因在它们之间具有高相关系数。从WGCNA,构造了18个共表达模块,其中灰色60模块是最大的模块,由2520 ungigenes组成,而Darksegeen 4模块是最小的,由56个unigenes组成。在图2中示出了每个模块中的同种型的分布(标记为不同颜色)和模块性状相关关系。gydF4y2Ba9gydF4y2Ba.许多模块显示出与不同阶段的密切关系。gydF4y2Ba
我们所关注的最重要的模块是在C或M组中富集的模块,特别是在C和M组的S4中富集的模块,这有助于区分花色表型。因此,根据|r| > 0.5和标准选择感兴趣的模块gydF4y2BaPgydF4y2Ba < 0.05, and were further annotated by KEGG and GO analysis. The module of skyblue 3 displayed a close relationship with M-S4. In the skyblue 3 module, many pathways related to color formation were enriched (PgydF4y2Ba < 0.01). Among them, flavonoid biosynthesis (ko00941) and phenylpropanoid biosynthesis (ko00940) were the top 2 pathways (TableS4gydF4y2Ba).此外,Bisque 4和绿松石的模块表现出与M或C的密切关系,富集的途径(gydF4y2BaPgydF4y2Ba< 0.01),汇总见表gydF4y2BaS4gydF4y2Ba.gydF4y2Ba
候选人负责的紫色损失紫花苜蓿与米色花gydF4y2Ba
23个候选基因按封闭模块的表达模式见表gydF4y2Ba2gydF4y2Ba.总之,9gydF4y2Ba暂定配额通知书gydF4y2Ba而在M-S4中则保持稳定或先下降后上升。C中S1-S3的相对表达量显著高于m。gydF4y2BaPAL6gydF4y2Ba和gydF4y2BaPAL9gydF4y2Ba被鉴定为Bisque 4模块的候选轮毂基因。gydF4y2Ba4 cl18gydF4y2Ba和gydF4y2Ba4 cl22gydF4y2Ba在浓汤中得到了丰富,还有gydF4y2Ba4 cl18gydF4y2Ba被鉴定为该模块的候选集线基因。更高的表达水平gydF4y2Ba4 cl18gydF4y2Ba在C的S1-S3中明显高于M,说明4CL18在该通路中发挥着特别重要的作用。四个gydF4y2BachsgydF4y2Ba在天蓝3中富集,其中,gydF4y2BaCHS2gydF4y2Ba,gydF4y2BaCHS4gydF4y2Ba,gydF4y2BaCHS8gydF4y2Ba被鉴定为候选枢纽基因。它们具有不同阶段的相同表达变化,以及在M-S4中,相对表达水平gydF4y2BaCHS2gydF4y2Ba,gydF4y2BaCHS4gydF4y2Ba,gydF4y2BaCHS8gydF4y2Ba分别是C-S4的2.1、1.3和2.5倍。我们也搜索了3gydF4y2Ba空空的gydF4y2Ba丰富了这些重要的模块,发现表达式改变模式gydF4y2BaCHR1gydF4y2Ba,gydF4y2BaCHR2gydF4y2Ba,gydF4y2BaCHR3gydF4y2Ba和浓缩的一致吗gydF4y2BachsgydF4y2Ba.此外,gydF4y2BaF3'H4gydF4y2Ba,gydF4y2BaDFR1gydF4y2Ba,gydF4y2BaDFR2.gydF4y2Ba,gydF4y2BaUFGT22gydF4y2Ba,gydF4y2BaUFGT23gydF4y2Ba在这些模块中得到了丰富。在S1和S2中,gydF4y2BaF3'H4gydF4y2Ba在c中比米为1.2 - 和2.0倍。在c中的花卉开发,gydF4y2BaDFR1gydF4y2Ba上调和S3见顶,但是,gydF4y2BaDFR1gydF4y2Ba在M中几乎没有表达。gydF4y2BaDFR2.gydF4y2Ba在C中表达量上调并在S3处达到峰值,而在m中表达量较低且保持稳定gydF4y2BaDFR1gydF4y2Ba和gydF4y2BaDFR2.gydF4y2Ba在C的所有阶段明显高于M. C中的表达水平也被发现gydF4y2BaUFGT22gydF4y2Ba和gydF4y2BaUFGT23gydF4y2Ba(表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
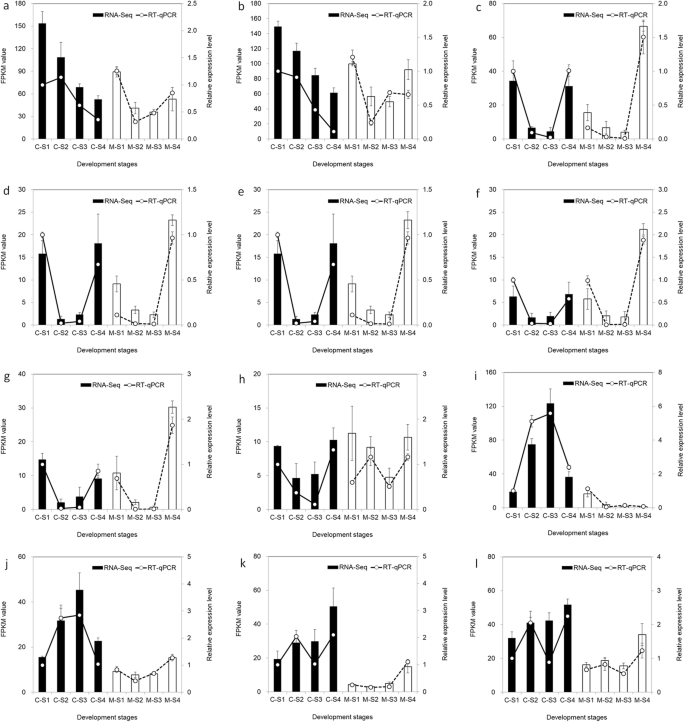
为了进一步确认这些结果并验证C和M中上述基因的表达,进行RT-QPCR以分析12个基因的表达模式(图。gydF4y2Ba10gydF4y2Ba).大多数基因在RT-QPCR和RNA-SEQ数据之间表现出类似的表达模式,这证实了RNA-SEQ数据的可靠性。gydF4y2Ba
12个候选基因表达谱及RT-qPCR验证。gydF4y2Baef1a.gydF4y2Ba用作内部控制。误差条表示RT-QPCR数据的SES(gydF4y2BangydF4y2Ba= 3)。“r”表示Pearson相关系数。使用对数计算RNA-Seq数据与RT-qPCR数据之间的Pearson相关性gydF4y2Ba2gydF4y2Ba褶皱变化和相对表达水平。gydF4y2Ba一个gydF4y2BaPAL6gydF4y2Ba;gydF4y2BabgydF4y2BaPAL9gydF4y2Ba;gydF4y2BacgydF4y2BaCHS2gydF4y2Ba;gydF4y2BadgydF4y2BaCHS4gydF4y2Ba;gydF4y2BaegydF4y2BaCHR1gydF4y2Ba;gydF4y2BafgydF4y2BaCHR2gydF4y2Ba;gydF4y2BaggydF4y2BaCHR3gydF4y2Ba;gydF4y2BahgydF4y2BaF3'H4gydF4y2Ba;gydF4y2Ba我gydF4y2BaDFR1gydF4y2Ba;gydF4y2BajgydF4y2BaDFR2.gydF4y2Ba;gydF4y2BakgydF4y2BaUFGT22gydF4y2Ba;gydF4y2BalgydF4y2BaUFGT23gydF4y2Ba
讨论gydF4y2Ba
从两种不同材料的果皮中鉴定花青素gydF4y2Ba
颜色突变体广泛应用于园艺和其他作物,特别是那些通常通过营养繁殖的作物,如大多数果树[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].紫花苜蓿的花瓣呈紫色(gydF4y2BaM. Sativa.gydF4y2BalgydF4y2Ba黄花苜蓿gydF4y2BaL.和它们的杂交种)是由于存在可溶的花青素[gydF4y2Ba43gydF4y2Ba].苜蓿花花青素已被广泛研究。Lesins [gydF4y2Ba44gydF4y2Ba鉴定出三种色素为牵牛花苷、马尔维苷和飞燕苷苷。此外,Cooper和Elliott [gydF4y2Ba45gydF4y2Ba]鉴定苜蓿花,具有三个花青素,作为Petunidin,麦芽素和德尔菲啶的3,5-千兆糖苷。不同的是,使用HPLC,我们只发现Malvidin 3-gydF4y2BaOgydF4y2Ba葡糖苷和矮牵牛3-gydF4y2BaOgydF4y2Ba- 在紫色的紫色花中葡萄糖苷,而在M的奶油花中没有检测到彩色颜料(图。gydF4y2Ba1gydF4y2Ba).结果表明,花青素积累的激烈差异是品种和遗传特异性的结果。gydF4y2Ba
PACBIO全长测序延伸了苜蓿注释并提高了转录量化的准确性gydF4y2Ba
由于技术上的限制,目前还没有紫花苜蓿的参考基因组。我们目前对苜蓿转录组的了解主要是基于RNA-Seq基因表达数据。因此,由于缺乏全长cDNA,紫花苜蓿转录组尚未被完全描述。本研究利用PacBio第三代技术对C品种进行序列注释,并利用Illumina测序平台对C和M不同花发育阶段的DEGs进行分析。我们获得了140995个异构体,其中包括513个新的异构体。经过Swiss-Prot的比较,鉴定出了204个苜蓿特异的新亚型,但功能未知,这将在未来的研究中有用(表)gydF4y2BaS2gydF4y2Ba).在杨树、玉米和高粱的单分子长读序列转录组研究中,分别鉴定出59,977(69%)、62,547(57%)和11,342(41%)新亚型[gydF4y2Ba36gydF4y2Ba].由于物种差异,我们只发现了23%的新亚型。然而,我们的数据表明,PacBio全长测序可以提供一套比下一代测序更全面的亚型。gydF4y2Ba
通过基于基于基于基于基于基于基于基于基于基于基于基于的重建策略gydF4y2BaMedicagogydF4y2Ba基因组(gydF4y2BaM. Truncatula.gydF4y2BaMt4.0v2)作为基准,通过PacBio全长测序校正同种型的映射比例为98.52%。不幸的是,清洁的映射比读取由RNA-SEQ是小于50%(数据未示出)。我们还比较了同种型和重叠群,从中我们发现了同种型(33518)可匹配到已知个Unigenes的99%的匹配率,表明长读RNA测序的结果进行更集成和准确。gydF4y2Ba
与黄酮类化合物的不同苜蓿材料的生物合成的基因的比较gydF4y2Ba
黄酮类化合物是许多植物的花瓣中最重要的颜料中[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].花青素是类黄酮生物合成途径的最终产物,能产生最广泛的颜色,从淡黄色到蓝紫色[gydF4y2Ba47gydF4y2Ba].我们的结果表明,紫花苜蓿的紫色花和奶油花之间的颜色差异是由于花的花青素、malvidin和petunidin的损失(图。gydF4y2Ba1gydF4y2Ba).从紫色到奶油换档要求花青素生物合成途径,这可能发生在二甲花翠素之前的一些反应和矮牵牛中形成的堵塞。因此,候选基因的丰度下进行比较和M转录识别奶油色代谢的关键基因。大多数亚型有关黄酮类化合物的合成,包括gydF4y2Ba暂定配额通知书gydF4y2Ba,gydF4y2Ba4 clsgydF4y2Ba,gydF4y2Ba气gydF4y2Ba,gydF4y2BaDFR.gydF4y2Ba,gydF4y2Ba答gydF4y2Ba和gydF4y2BaUFGTsgydF4y2Ba,紫色花C的转录表达量比奶油花M的转录表达量大,尤其是前三个阶段(图2)。gydF4y2Ba2gydF4y2Ba),表明这些基因的突变诱导的表达变化可能比表型的出现更早发生。在黄酮类生物合成的过程中,CHS催化第一反应步骤,并帮助合成中间氯酮,这对所有类黄酮非常重要[gydF4y2Ba48gydF4y2Ba].因此,CHS反应的功能抑制始终伴随着消除不仅是花青素生物合成,而且还伴随着植物素生物合成,还伴随着其他黄酮化合物[gydF4y2Ba49gydF4y2Ba].单个CHS酶的突变导致了葡萄风信子的白色花系[gydF4y2Ba31gydF4y2Ba],佩妮[gydF4y2Ba50gydF4y2Ba],gydF4y2Ba硅宾littoreagydF4y2Ba[gydF4y2Ba33gydF4y2Ba]和北极芥菜花[gydF4y2Ba51gydF4y2Ba].相反,在我们的研究中,我们发现gydF4y2BachsgydF4y2BaM-S4的表达高于C-S4(图4)。gydF4y2Ba10gydF4y2Ba).有趣的是,CoMaroyl-CoA可以通过CHS和Chr的共函数转化为Isoliquiritigenin(Isoflavone生物合成途径的重要产品)[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba].通过进一步的数据分析,我们发现gydF4y2Ba空空的gydF4y2Ba是类似于gydF4y2BachsgydF4y2Ba(无花果。gydF4y2Ba10gydF4y2Ba).因此我们推测gydF4y2BachsgydF4y2Ba参与在类黄酮生物合成中的另一个分支点,是在异黄酮生物合成中产生的中间体,并且M-S4中的CHS和CH值可能对伊索里替氏菌素的生物合成至关重要。gydF4y2Ba
F3H,F3'H和F3'5'H中起关键作用的类黄酮生物合成途径,它们催化黄酮类化合物,包括二氢莰,二氢槲皮素,二氢杨梅和,这是必要的花青素合成的羟基化[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].另外,中间体二氢氯酰酚是通过DFR产生的有色花青素的主要前体,并通过杂物产生无色黄酮醇[gydF4y2Ba55gydF4y2Ba].因此,二氢黄酮醇的底物竞争会导致的反向表达调控gydF4y2BaFLS的gydF4y2Ba和gydF4y2BaDFRgydF4y2Ba,伴随着异丙唑类和花青素的不同积累[gydF4y2Ba55gydF4y2Ba].在我们的研究中,更高的表达gydF4y2BaFLS的gydF4y2Ba/gydF4y2BaF3HsgydF4y2Ba,gydF4y2BaF3'HsgydF4y2Ba,gydF4y2BaF3’5是什么gydF4y2Ba与c相比,在M的大部分分期中,?的表达较高gydF4y2BaDFRgydF4y2Ba在C中,但在M的S2到S4中处于非常低的水平(图2)。gydF4y2Ba10gydF4y2Ba).Lou等人发现了类似的观察。[gydF4y2Ba28gydF4y2Ba他的结论是gydF4y2BaDFRgydF4y2Ba可能是白葡萄葫芦(Delphinidin)丧失蓝色色素沉着(Delphinidin)的靶基因。因此,表达更高gydF4y2BaFLS的gydF4y2Ba/gydF4y2BaF3HsgydF4y2Ba,gydF4y2BaF3'HsgydF4y2Ba,gydF4y2BaF3’5是什么gydF4y2Ba可能会增加其他类黄酮化合物的产量,如二氢槲皮素,二氢山奈酚,二氢杨梅素。M中杨梅素和山奈酚,DFR的下调可能部分阻断花青素的合成,从而消除紫色色素的形成过程。gydF4y2Ba
C的紫花成熟提示了上游基因的基本转录调控gydF4y2Ba朋友gydF4y2Ba到最后gydF4y2BaUFGTgydF4y2Ba可能在类黄酮中间体的积累和花色形成中起重要作用。gydF4y2Ba
WGCNA鉴定了与成花相关的Hub基因gydF4y2Ba
奶油色中天3苜蓿代表着一种颜色突变,因为紫色污染苜蓿是野生型。了解奶油花表型的变化作为野生型的突变体可以阐明苜蓿花色素沉着的机制。类黄酮化生物合成途径中的关键酶的任何功能丧失可能导致奶油色突变,包括通过基因的转录性丰度变化和黄酮产品的分支变化[gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba].从本研究中的一部小说发现是,通过进行WGNCA,我们鉴定了花卉发育阶段特异性基因模块(图。gydF4y2Ba8gydF4y2Ba和gydF4y2Ba9gydF4y2Ba).到这个结束,9gydF4y2Ba暂定配额通知书gydF4y2Ba,2gydF4y2Ba4 clsgydF4y2Ba,4gydF4y2BachsgydF4y2Ba,3gydF4y2Ba空空的gydF4y2Ba,gydF4y2BaF3'H4gydF4y2Ba,2gydF4y2BaDFR.gydF4y2Ba,2gydF4y2BaUFGTsgydF4y2Ba在与M4或M组密切关系模块是高度相关的。他们都拥有在转录丰度在C和M明显差异,说明在花的形成变化的重要作用。这是值得注意的是,上述基因不具有最高表达水平的基因,这意味着高表达基因是没有必要区分不同花色[gydF4y2Ba29gydF4y2Ba].因此,WGCNA分析本研究选择与特定表型的重要基因提供了一个有用的方法。杜等人。[gydF4y2Ba58gydF4y2Ba]通过WGCNA分析确定了在种子成熟早期的种皮网络中运行的枢纽基因。类似的WGCNA分析在金茶花中用于鉴定与花色相关的unigenes,发现CHS、F3H、ANS和FLS在调节黄酮醇和花青素的形成中起关键作用[gydF4y2Ba29gydF4y2Ba].gydF4y2Ba
这6个hub基因位于类黄酮生物合成途径的上游,说明M的奶油花色素沉着主要在上游受阻。表达减少gydF4y2BaPAL6gydF4y2Ba,gydF4y2BaPAL9gydF4y2Ba,gydF4y2Ba4 cl8gydF4y2Ba,是否在C或M中,符合图1中的结果[gydF4y2Ba57gydF4y2Ba].Wang等[gydF4y2Ba57gydF4y2Ba发现表达下降gydF4y2Ba暂定配额通知书gydF4y2Ba和gydF4y2Ba4 clsgydF4y2Ba影响“紫皮”成熟果皮中肉桂酸的含量。我们推测gydF4y2BaPAL6gydF4y2Ba,gydF4y2BaPAL9gydF4y2Ba,gydF4y2Ba4 cl8gydF4y2Ba也可能影响C和m花瓣中肉桂酸的含量gydF4y2BachsgydF4y2Ba在M-S4中可能对异黄酮等其他黄酮的生物合成起重要作用,而异黄酮也是紫花苜蓿不同花颜色形成的关键因素。gydF4y2Ba
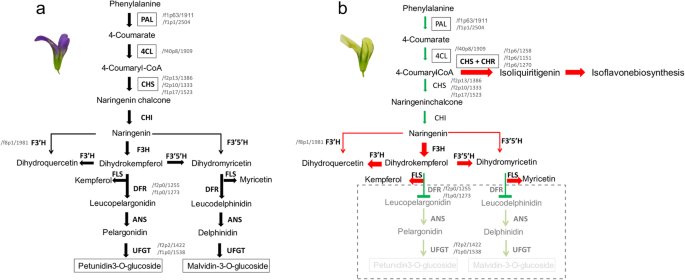
基于上述结果,我们推断出紫色和米色紫花苜蓿中不同的类黄酮生物合成途径(图2)。gydF4y2Ba11gydF4y2Ba).简而言之,与C相比,M的类黄酮生物合成被上游阻断gydF4y2Ba朋友gydF4y2Ba和gydF4y2Ba4CLgydF4y2Ba,其中异黄酮生物合成的分支通过调节以下gydF4y2BaCHSgydF4y2Ba和gydF4y2Ba空空的gydF4y2Ba占主导地位,完成花青素合成途径。此外,上调gydF4y2BaF3H / FLSgydF4y2Ba,gydF4y2BaF3'HgydF4y2Ba,gydF4y2BaF3’5是什么gydF4y2Ba导致其他类黄酮化合物,如杨梅黄酮和莰非醇的增加,进一步降低了花青素合成。最后,表达水平低gydF4y2BaDFRgydF4y2Ba伴随着低丰度gydF4y2BaUFGTgydF4y2Ba可能会破坏花青素的合成,导致奶油色的形成。gydF4y2Ba
C的紫色花和m的乳白色花的花青素合成过程的参考模型。关键的异构体id显示在每个基因的侧面。的上游,gydF4y2Ba朋友gydF4y2Ba和gydF4y2Ba4CLgydF4y2Ba被抑制,并增加了异黄酮生物合成的增加的分支gydF4y2BaCHSgydF4y2Ba和gydF4y2Ba空空的gydF4y2Ba是占主导地位的。此外,上调gydF4y2BaF3HgydF4y2Ba/gydF4y2BaFLS的gydF4y2Ba,gydF4y2BaF3'HgydF4y2Ba,gydF4y2BaF3’5是什么gydF4y2Ba导致其他类黄酮化合物的增加,如杨梅素和山奈酚,进一步减少花青素的合成。最后,表达水平低gydF4y2BaDFRgydF4y2Ba伴随着低丰度gydF4y2BaUFGTgydF4y2Ba可能会破坏花青素的合成,导致乳白色的形成gydF4y2Ba
结论gydF4y2Ba
通过HPLC,转录组分析和RT-QPCR分析了中南3号污水和奶油花紫色花中的花青素和黄酮途径的机制。麦芽素和喇叭蛋白糖苷衍生物是污垢花中的主要花青素,其缺乏中天的花。PACBIO长读RNA测序比RNA-SEQ更集成和准确。提出了一种新的假设,用于紫花苜蓿花中缺乏紫色表型,一系列候选基因可以通过黄酮类生物合成阻断共同作用,其它类黄酮化合物形成的竞争,花青素合成阻断等。需要进一步的研究来充分阐明这些过程。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
所有原始序列数据已在访问号Prjna565675下提交到序列读取存档(SRA)数据库。地址如下:gydF4y2Bahttps://submit.ncbi.nlm.nih.gov/subs/sragydF4y2Ba.gydF4y2Ba
缩写gydF4y2Ba
- 4CLgydF4y2Ba:gydF4y2Ba
-
4-香豆酸:辅酶A连接酶gydF4y2Ba
- A3SS:gydF4y2Ba
-
替代3'拼接网站gydF4y2Ba
- 投产:gydF4y2Ba
-
替代5'拼接网站gydF4y2Ba
- 答gydF4y2Ba:gydF4y2Ba
-
花青素合成酶gydF4y2Ba
- C:gydF4y2Ba
-
辩号gydF4y2Ba
- CCS技术:gydF4y2Ba
-
圆形的共有序列gydF4y2Ba
- cd:gydF4y2Ba
-
假定的编码序列gydF4y2Ba
- 气gydF4y2Ba:gydF4y2Ba
-
Chalcone异构酶gydF4y2Ba
- 空空的gydF4y2Ba:gydF4y2Ba
-
查耳酮还原酶gydF4y2Ba
- CHSgydF4y2Ba:gydF4y2Ba
-
查耳酮合酶gydF4y2Ba
- DFRgydF4y2Ba:gydF4y2Ba
-
二氢烷醇4-还原酶gydF4y2Ba
- DGE:gydF4y2Ba
-
数字基因表达gydF4y2Ba
- ES:gydF4y2Ba
-
外显子跳过/包含gydF4y2Ba
- F3’5是什么gydF4y2Ba:gydF4y2Ba
-
黄酮-3',5'-羟化酶gydF4y2Ba
- F3'HgydF4y2Ba:gydF4y2Ba
-
类黄酮3'-单加氧酶gydF4y2Ba
- F3HgydF4y2Ba:gydF4y2Ba
-
黄烷酮3-hydroxylasegydF4y2Ba
- 罗斯福:gydF4y2Ba
-
假发现率gydF4y2Ba
- FLS的gydF4y2Ba:gydF4y2Ba
-
黄酮醇合成gydF4y2Ba
- FPKM:gydF4y2Ba
-
每百万百万映射的成绩单每千碱基映射的碎片gydF4y2Ba
- 弗兰克-威廉姆斯:gydF4y2Ba
-
鲜重gydF4y2Ba
- HPLC:gydF4y2Ba
-
高效液相色谱分析gydF4y2Ba
- 红外光谱:gydF4y2Ba
-
基因内区保留gydF4y2Ba
- ISO-SEQ:gydF4y2Ba
-
同种型测序gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因和基因组百科全书gydF4y2Ba
- M:gydF4y2Ba
-
中天3号gydF4y2Ba
- 黄花苜蓿gydF4y2BaL。gydF4y2Ba
-
Medicago falcatagydF4y2Bal;gydF4y2Ba
- m . lupulinagydF4y2BaL。gydF4y2Ba
-
Medicago lupulinagydF4y2BaL.gydF4y2Ba
- M. Sativa.gydF4y2BaL。gydF4y2Ba
-
紫花苜蓿gydF4y2BaL.gydF4y2Ba
- M. Truncatula.gydF4y2Ba:gydF4y2Ba
-
Medicago truncatulagydF4y2Ba
- M. Varia.gydF4y2Ba:gydF4y2Ba
-
苜蓿gydF4y2Ba
- MXE:gydF4y2Ba
-
相互排斥的外影gydF4y2Ba
- NR:gydF4y2Ba
-
非冗余的蛋白质数据库gydF4y2Ba
- 子:gydF4y2Ba
-
开放阅读框gydF4y2Ba
- 朋友gydF4y2Ba:gydF4y2Ba
-
苯丙氨酸解氨gydF4y2Ba
- 主成分分析:gydF4y2Ba
-
主成分分析gydF4y2Ba
- RIN:gydF4y2Ba
-
RNA数量完整gydF4y2Ba
- RNA-SEQ:gydF4y2Ba
-
RNA序列gydF4y2Ba
- RT-qPCR:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- SES:gydF4y2Ba
-
标准错误gydF4y2Ba
- TFs:gydF4y2Ba
-
转录因子gydF4y2Ba
- :gydF4y2Ba
-
拓扑重叠gydF4y2Ba
- UFGTgydF4y2Ba:gydF4y2Ba
-
UDP-glucose:黄酮类3-O-glucosyltransferasegydF4y2Ba
- WGCNA:gydF4y2Ba
-
加权基因共表达网络分析gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
高LX,杨HX,刘HF,杨杰,胡耶。广泛的转录组在花色强度变异下面的变化gydF4y2Ba芍药属ostiigydF4y2Ba.植物学报2016;6:1205。gydF4y2Ba
- 2.gydF4y2Ba
孟益,王泽,王毅,王CN,朱···伯,刘H等。MyB激活剂白PET1与MTTT8和MTWD40-1相关联,以调节类胡萝卜素衍生的花色素沉着gydF4y2BaMedicago truncatulagydF4y2Ba.植物细胞。2019年。gydF4y2Bahttps://doi.org/10.1105/tpc.19.00480gydF4y2Ba.gydF4y2Ba
- 3.gydF4y2Ba
营养组织中的花青素:光保护的统一功能。新植醇。2002;155:349 - 61。gydF4y2Ba
- 4.gydF4y2Ba
Winkel-Shirley B. flavonoid生物合成。遗传学,生物化学,细胞生物学和生物技术的彩色模型。植物理性。2001; 126:485-93。gydF4y2Ba
- 5.gydF4y2Ba
戴维斯KM, Albert NW,施文KE。从着陆光到模仿:花颜色的分子调控和色素沉着模式的机制。acta botanica yunnanica(云南植物研究). 2012;39:619-38。gydF4y2Ba
- 6.gydF4y2Ba
Sobel JM,Streisfeld MA。花色作为植物Evo-Devo研究的模型系统。前植物SCI。2013; 4:321。gydF4y2Ba
- 7。gydF4y2Ba
陈志强,陈志强,陈志强,等。外源查尔酮合成酶对红花颜色的调控作用。J Exp Bot. 2007; 58:2471-8。gydF4y2Ba
- 8。gydF4y2Ba
Burkin AA, Kononenko GP。豆科植物微菌类次生代谢产物的研究gydF4y2BaGalegagydF4y2Ba,gydF4y2Baglycyrrhiza.gydF4y2Ba,gydF4y2BaLupinusgydF4y2Ba,gydF4y2BaMedicagogydF4y2Ba,gydF4y2Ba草木樨gydF4y2Ba.生物学公牛。2018; 45:235-41。gydF4y2Ba
- 9。gydF4y2Ba
Sharpe SM, Boyd NS, Dittmar PJ, Macdonald GE, Darnell RL, Ferrell JA。对黑人医生的控制建议(gydF4y2BaMedicago lupulinagydF4y2Ba)基于草莓竞争中的增长和发展。杂草科学。2018; 66:226-33。gydF4y2Ba
- 10.gydF4y2Ba
张学明,刘丽霞,苏志明,沈志军,高发国,易勇,等。转录组分析gydF4y2BaMedicago lupulinagydF4y2Ba高钙处理的幼苗叶片提供了草酸钙形成的见解。土壤植物。2019。gydF4y2Bahttps://doi.org/10.1007/S11104-019-04283-8gydF4y2Ba.gydF4y2Ba
- 11.gydF4y2Ba
张志强,张志强,张志强,等。基于分子系统学的植物进化研究进展gydF4y2BaMedicagogydF4y2Ba生物化学学报。1998;26:441 - 451。gydF4y2Ba
- 12.gydF4y2Ba
Gunn CR, Skrdla WH, Spencer HC。利用豆科性状和花色对紫花苜蓿进行分类。华盛顿:农业研究局;1978.gydF4y2Ba
- 13.gydF4y2Ba
霍金斯,余丽霞。紫花苜蓿(gydF4y2Ba紫花苜蓿gydF4y2Ba基因组学与基因组选择。作物j . 2018; 6:565 - 75。gydF4y2Ba
- 14.gydF4y2Ba
Buker RJ, Davis RL。二倍体紫花苜蓿的花色遗传。作物科学。1961;1:437。gydF4y2Ba
- 15.gydF4y2Ba
潘昆·P,博尔顿紫花苜蓿开花特性及其对种子生产的影响。中国植物科学(英文版)。gydF4y2Ba
- 16.gydF4y2Ba
Sheridan KP,Mckee GW。紫花苜蓿中紫花色的比色测量受各种,土壤pH,土壤肥力,光源和种子源的影响。农作物科学。1970; 10:323-6。gydF4y2Ba
- 17。gydF4y2Ba
刘文新,熊超,闫立峰,张志生,马凌玲,王玉林,等。转录组分析揭示了可能参与紫花苜蓿铝胁迫反应的候选基因。植物学报。2017;8:26。gydF4y2Ba
- 18。gydF4y2Ba
Riday H, Brummer EC, Moore KJ。紫花苜蓿饲用品质杂种优势研究。作物科学。2002;42:1088 - 93。gydF4y2Ba
- 19。gydF4y2Ba
卓春林,梁亮,赵玉琴,郭志峰,卢淑英。一个冷响应ERFgydF4y2BaMedicago falcatagydF4y2Ba通过对多胺周转的上调,抗氧化保护和脯氨酸积累来赋予耐寒性。植物细胞环境。2018; 41:2021-32。gydF4y2Ba
- 20.gydF4y2Ba
沃尔德伦LR。紫花苜蓿芽突变:在一种淡紫色植物上发现的一朵白花紫花苜蓿枝。J在这里。1925;10:423-4。gydF4y2Ba
- 21.gydF4y2Ba
Rodriguez-Amaya DB。天然食用色素的更新-关于类胡萝卜素,花青素和甜菜碱的一个小综述。国际食品Res。2019;124:200-5。gydF4y2Ba
- 22.gydF4y2Ba
周勇,吴XX,张震,高振华。桃花颜色斑纹的比较蛋白质组学分析。生物化学学报。2015;464:1101-6。gydF4y2Ba
- 23.gydF4y2Ba
田中Y,佐佐木N,植物色素的大宫A.生物合成:花青素,甜菜红色素和类胡萝卜素。植物杂志2008; 54:733-49。gydF4y2Ba
- 24。gydF4y2Ba
两种不同花色美人蕉品种的基因表达及色素分析。植物生理生化。2018;127:1-10。gydF4y2Ba
- 25。gydF4y2Ba
林旺,王志强,王志强,等。高温通过调控花青素调节复合物来降低苹果果实的颜色。植物学报。2011;34:1176-90。gydF4y2Ba
- 26。gydF4y2Ba
马玉军,段海瑞,张飞,李勇,杨海生,田鹏飞,等。转录组分析gydF4y2Ba枸杞ruthenicumgydF4y2BaMurr。在果实成熟过程中提供了花青素生物合成途径的结构和调控基因。《公共科学图书馆•综合》。2018;13:e0208627。gydF4y2Ba
- 27。gydF4y2Ba
陈德志,刘勇,潘强,李飞,张庆华,葛晓辉,等。gydF4y2Ba德诺维gydF4y2Ba研究了十字花科两种园林植物花颜色变化的转录组组装、基因表达和代谢物。Sci Hortic。2018;240:592 - 602。gydF4y2Ba
- 28。gydF4y2Ba
楼强,刘玉玲,祁媛媛,焦淑珍,田飞,姜玲,等。转录组测序和代谢产物分析揭示了飞燕草素代谢对葡萄风信子花色的影响。J Exp Bot. 2014; 65:3157-64。gydF4y2Ba
- 29.gydF4y2Ba
周晓伟,李建勇,朱玉玲,倪胜,陈建林,冯晓军,等。gydF4y2Ba德诺维gydF4y2Ba汇编gydF4y2Ba山茶花nitidissimagydF4y2Ba转录组揭示了花色素生物合成的关键基因。植物学报,2017;gydF4y2Ba
- 30.gydF4y2Ba
吴强,吴杰,李世生,张宏军,冯春英,尹德东,等。揭示睡莲蓝色花形成的转录组测序和代谢产物分析。BMC基因组学。2016;17:897 - 909。gydF4y2Ba
- 31.gydF4y2Ba
Katsumoto Y, Fukuchi-Mizutani M, Fukui Y, Brugliera F, Holton TA, Karan M,等。玫瑰类黄酮生物合成途径工程成功地产生了积累飞燕草苷的蓝色花。植物生理学报。2007;48:1589-600。gydF4y2Ba
- 32.gydF4y2Ba
王志强,王志强,王志强,等。植物黄酮基因工程研究进展。Biotechnol。2011;33:433-41。gydF4y2Ba
- 33.gydF4y2Ba
Casimiro-Soriguer I, Narbona E, Buide ML, del Valle JC, Whittall JB。花颜色多态性的转录组和生化分析gydF4y2Ba硅宾littoreagydF4y2Ba(石竹科)。植物学报。2016;7:204。gydF4y2Ba
- 34.gydF4y2Ba
沈玉华,杨凤英,卢斌杰,赵伟伟,姜涛,冯磊,等。探讨木瓜黄皮和红肉中类胡萝卜素生物合成的差异机制。BMC基因组学。2019;20:49。gydF4y2Ba
- 35.gydF4y2Ba
戈登SP,曾雅妮E,Salamov A,张JW,孟XD,康DW,等人。在真菌中普遍存在多顺反子成绩单揭示的单分子测序的mRNA。Plos一个。2015; 10:e0132628。gydF4y2Ba
- 36.gydF4y2Ba
Chao Q,Gao ZF,张D,赵BG,东FQ,FU CX等。发展动态gydF4y2Ba杨树gydF4y2Ba阻止转录组。生物技术学报。2018。gydF4y2Bahttps://doi.org/10.1111/pbi.12958gydF4y2Ba.gydF4y2Ba
- 37.gydF4y2Ba
自定义基因数据集中可变剪接事件的动态和灵活分析。核酸学报2007;35:W297-9。gydF4y2Ba
- 38.gydF4y2Ba
张志强,张志强。基于遗传算法的基因共表达网络分析。Stat Appl Genet Mol Biol. 2005;4:第十七条。gydF4y2Ba
- 39.gydF4y2Ba
Castonguay Y,Michaud J,DubéMM。RT-QPCR参考基因对苜蓿环境和发育型基因表达的RT-QPCR分析。美国J植物SCI。2015; 06:132-43。gydF4y2Ba
- 40。gydF4y2Ba
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据gydF4y2Ba−ΔΔCTgydF4y2Ba方法。方法。2001; 25:402-8。gydF4y2Ba
- 41。gydF4y2Ba
董婷婷,韩瑞平,于建文,朱明康,张勇,龚勇,等。绿色和紫色天冬酰胺的花青素积累和相关基因的代谢组和转录组的分子分析(gydF4y2Ba芦笋officinalisgydF4y2Bal .)。食品化学。2019;271:18-28。gydF4y2Ba
- 42.gydF4y2Ba
Massonnet M, Fasoli M, Tornielli GB, Altieri M, Sandri M, Zuccolotto P, et al.;红白葡萄品种的成熟转录组程序与浆果皮花青素积累相关。植物杂志。2017;174:2376 - 96。gydF4y2Ba
- 43.gydF4y2Ba
二倍体紫花苜蓿花色素苷遗传的生化方面。遗传学。1970;65:267 - 78。gydF4y2Ba
- 44.gydF4y2Ba
Lesins K.苜蓿中的躯体花色突变。j hered。1956; 47:171-9。gydF4y2Ba
- 45.gydF4y2Ba
Cooper RL,Elliott FC。在二倍体苜蓿中的花颜料。农作物科学。1964; 4:367。gydF4y2Ba
- 46.gydF4y2Ba
赵迪强,陶杰。观赏植物花色发育与调控的研究进展。植物学报。2015;6:261。gydF4y2Ba
- 47.gydF4y2Ba
王玉玲,王玉琴,宋志强,张海云gydF4y2BaMYBL2gydF4y2Ba双方microRNA858a和HY5导致花色素苷的生物合成途径的拟南芥激活。莫尔植物。2016; 9:1395-405。gydF4y2Ba
- 48。gydF4y2Ba
Koes RE, Spelt CE, Elzen PJ, Mol JN。查尔酮合酶多基因家族的克隆及分子特征gydF4y2Ba矮牵牛gydF4y2Ba.基因。1989; 81:245-57。gydF4y2Ba
- 49。gydF4y2Ba
Clark ST, Verwoerd WS。一种鉴定植物色素丧失相关基因靶点的系统方法。BMC生物信息学。2011;12:343。gydF4y2Ba
- 50.gydF4y2Ba
王志强,王志强,王志强,等。花香味反向遗传:烟草响尾蛇病毒基因沉默在矮牵牛花中的应用。植物杂志。2007;145:1241-50。gydF4y2Ba
- 51.gydF4y2Ba
迪克加利福尼亚州迪克,布伦斯特罗·j,巴特勒t,卡尔森ml,kliebenstein dj,whittall jb。北极芥末花色多态性受花瓣特异性下调的阈值,在花青素生物合成途径的阈值下。Plos一个。2011; 6:E18230。gydF4y2Ba
- 52.gydF4y2Ba
Bomati EK,奥斯汀MB,鲍曼ME,迪克森RA,诺埃尔JP。查尔酮还原酶的结构解析和deoxychalcone生物合成的影响。J Biol Chem。2005; 280:30496-503。gydF4y2Ba
- 53.gydF4y2Ba
Lozovaya VV, Lygin AV, Zernova OV, Li S, Hartman GL, Widholm JM。大豆毛状根中异黄酮的积累gydF4y2Ba腐皮镰孢霉菌gydF4y2Ba.植物生理与生物化学。2004;42:671-9。gydF4y2Ba
- 54.gydF4y2Ba
刘XQ,杨WZ,穆BN,李SZ,李源,周XJ等。“紫玉米胚”与来自双向启动子和自我裂解肽2A衍生的多基因表达系统的工程。植物生物技术J. 2018; 16:1107-9。gydF4y2Ba
- 55.gydF4y2Ba
Davies Km,Schwinn Ke,Deroles Sc,Manson DG,Lewis DH,Bloor SJ等人。通过改变黄酮醇合成酶和二氢酚酰酚4-还原酶谱系的衬底竞争来增强花青素的生产。Euphytica。2003; 131:259-68。gydF4y2Ba
- 56.gydF4y2Ba
罗德利戈·MJ,马科斯·j·F, Alférez F, Mallent MD, Zacarías lgydF4y2Ba素类gydF4y2Ba突变体具有果实特异性改变,导致黄色色素沉着和ABA含量下降。J Exp Bot. 2003; 54:727-38。gydF4y2Ba
- 57.gydF4y2Ba
王ZR,崔YY,Vainstein A,陈SW,马总部。无花果的法规(gydF4y2Ba无花果gydF4y2Ba果实颜色:类黄酮生物合成途径的代谢组学和转录组学分析。前面。植物科学。2017;8:1990。gydF4y2Ba
- 58.gydF4y2Ba
杜杰,王某,嗯,周B,阮友,守HX。使用RNA测序分析控制调节网络和控制大豆种子组和尺寸的枢纽基因。J Exp Bot。2017; 68:1955-72。gydF4y2Ba
致谢gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了中国国家自然科学基金(Grant No.31700338和31860118)的支持,是中央公共利益科学机构的基本研究资金(1610322019012和161032201913)以及中国学院的农业科学和技术创新计划作者:王莹,农业科学(CAASASTIP-2019-LIHPS-08)。资金机构在研究和收集,分析和写作稿件中的数据的设计方面没有作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
D. H. R.和Y H. S.设计的实验。D. H. R.,Y. H. S.和Z. X. H.进行的实验。D.H。R.,C. G. X.,和D. X. R.分析转录组数据。D. H. R.写文章。W. L. R.和Y H. S.修订本文。所有作者都读过并批准了稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
M-S4与C-S4之间显著富集的DEGs KEGG通路。gydF4y2Ba
附加文件2:表S1。gydF4y2Ba
RT-qPCR的引物。gydF4y2Ba
附加文件3:表S2。gydF4y2Ba
513个新异构体的统计。Swiss-Prot数据库中共注释了309种新亚型,其余204种亚型未注释。gydF4y2Ba
附加文件4:表S3。gydF4y2Ba
与类黄酮合成相关的基因在热图上的ID。gydF4y2Ba
附加文件5:表S4。gydF4y2Ba
在M的所有级富集的模块的信息,特别是M-S4。skyblue3显示具有M-S4的bisque4和绿松石模块密切的关系,并且所述的模块表现出与M的密切的关系富集与每个模块的花的颜色形成途径进行了总结。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
段,人力资源,王,lr。,崔,gx。gydF4y2Ba等等。gydF4y2Ba使用RNA测序分析鉴定控制苜蓿花色素沉着变化的调节网络和轮毂基因。gydF4y2BaBMC植物杂志gydF4y2Ba20.gydF4y2Ba110(2020)。https://doi.org/10.1186/s12870-020-2322-9gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-2322-9gydF4y2Ba
关键词gydF4y2Ba
- Pacbio Iso-SEQgydF4y2Ba
- 转录组gydF4y2Ba
- 花色素gydF4y2Ba
- 苜蓿gydF4y2Ba
- 奶油色gydF4y2Ba
- 中心基因gydF4y2Ba