- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
在藤茶参与高水平的二氢杨梅素生产的基因注释(GydF4y2Ba藤茶GydF4y2Ba),通过转录组分析GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba20.GydF4y2Ba文章编号:GydF4y2Ba131GydF4y2Ba(GydF4y2Ba2020.GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
药用植物的叶子GydF4y2Ba藤茶GydF4y2Ba,俗称藤茶,是中国西南地区广泛使用的一种传统饮料。叶中含有大量二氢杨梅素,这是一种具有多种生物活性的化合物。然而,在该植物中参与其生物合成途径的转录谱尚不清楚。GydF4y2Ba
结果GydF4y2Ba
我们使用Illumina测序进行了葡萄茶厂的年轻和旧叶片的转录组分析。在转录组数据集中,分别从年轻人和旧的叶子获得了52.47亿和4725万张清洁读数。在471,658个转录物和177,422个基因中,在这两个发育阶段的叶片中鉴定了7768个差异表达基因。根据转录组分析分析研究葡萄蛋白生物合成途径。鉴定了编码苯丙烷化生物合成酶的大多数基因,发现在葡萄茶的不同组织和叶阶段中差异表达,并且在葡萄茶中也大大有助于Diyromyricetin的生物合成。GydF4y2Ba
结论GydF4y2Ba
据我们所知,这是第一次正式研究探索的转录组GydF4y2BaA.藤茶。GydF4y2Ba本研究为了解藤茶中二氢杨梅素生物合成相关基因的表达模式和差异分布提供了依据。这些信息可能为开发高黄酮类化合物含量植物的代谢工程技术铺平道路。GydF4y2Ba
背景GydF4y2Ba
藤茶(藤茶)是一种著名的中国传统茶,由茶叶制成GydF4y2Ba藤茶GydF4y2Ba()配伍及化学成分地下水面王(GydF4y2Ba1GydF4y2Ba].该植物广泛分布在中国南部的山区,经常被消耗[GydF4y2Ba1GydF4y2Ba].藤茶一直被认为是数百年来,在中国的功能,健康的饮料。不同于传统的绿茶(GydF4y2Ba茶树GydF4y2BaL.),其含有高含量儿茶素[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba],藤茶的主要生物活性代谢物是二氢杨梅(DHM),一个黄酮醇化合物[GydF4y2Ba4.GydF4y2Ba].DHM,也称为Ampelopsin,在抗氧化剂等各种药理活动中起重要作用[GydF4y2Ba1GydF4y2Ba], 消炎(药 [GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba],抗微生物[GydF4y2Ba7.GydF4y2Ba], reno-protective [GydF4y2Ba8.GydF4y2Ba],以及防癌活动[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba)等。GydF4y2Ba11GydF4y2Ba].此外,DHM在缺血性脑卒中的治疗中发挥着治疗作用[GydF4y2Ba12GydF4y2Ba].藤茶有能力抑制黑色素生成,并在色素脱失的皮肤护理产品也使用[GydF4y2Ba13GydF4y2Ba].GydF4y2Ba
次生代谢产物在植物防御系统和发育过程中起重要作用[GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba].次生代谢物的积累可能受到环境因素和植物不同生长阶段的影响[GydF4y2Ba17GydF4y2Ba那GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba].以前的研究报告说,绿茶的代谢产物(GydF4y2Bac . sinensisGydF4y2Ba)根据地理,发育阶段,和栽培品种[变化GydF4y2Ba2GydF4y2Ba那GydF4y2Ba21GydF4y2Ba那GydF4y2Ba22GydF4y2Ba].另一项研究报告,主要酚类化合物主要分布在较年轻的植物部位,而不是较老的植物部位[GydF4y2Ba23GydF4y2Ba].绿茶的质量主要取决于茶叶中儿茶素的含量。然而,儿茶素的含量通常随叶期、海拔和季节而变化[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba].此外,一些研究已经阐明了不同的代谢产物的生物合成模式GydF4y2Bac . sinensisGydF4y2Ba,特别是在转录水平,使用Illumina HiSeq转录组测序技术[GydF4y2Ba24GydF4y2Ba那GydF4y2Ba25GydF4y2Ba那GydF4y2Ba26GydF4y2Ba].GydF4y2Ba
苯丙素是藤茶中一类重要的次生代谢物。苯丙类生物合成途径中的结构基因已经得到了很好的研究[GydF4y2Ba27GydF4y2Ba那GydF4y2Ba28GydF4y2Ba那GydF4y2Ba29GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba].近年来,随着Illumina HiSeq技术的发展,转录组分析已成功应用于广泛的物种中,探索次生代谢途径[GydF4y2Ba25GydF4y2Ba那GydF4y2Ba31GydF4y2Ba那GydF4y2Ba32GydF4y2Ba那GydF4y2Ba33GydF4y2Ba].然而,藤茶中苯丙素生物合成途径的机制尚不清楚。在本研究中,我们应用转录组测序技术,对藤茶进行了图谱分析,以明确苯丙素生物合成途径。GydF4y2Ba
结果GydF4y2Ba
高效液相色谱法分析藤茶中DHM的含量GydF4y2Ba
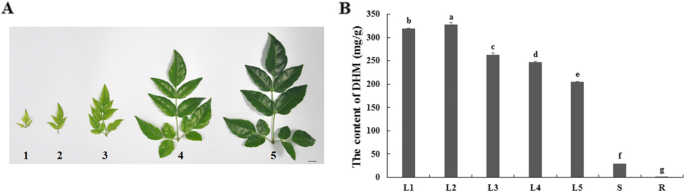
采用高效液相色谱法测定藤茶不同叶期和组织中DHM的含量;无花果。GydF4y2Ba1GydF4y2Ba,附加文件GydF4y2Ba1GydF4y2Ba:图S1)。葡萄叶被分为五个生长期(图1)。GydF4y2Ba1GydF4y2Baa).与葡萄叶(葡萄叶4期:247.32 mg/g,葡萄叶5期:204.55 mg/g)相比,葡萄叶(葡萄叶1期:319.23 mg/g,葡萄叶2期:327.84 mg/g,葡萄叶3期:263.25 mg/g)发育中的DHM含量更高(图)。GydF4y2Ba1GydF4y2Bab).最高的水平是在幼叶的第2阶段,这是超出顶端点的一个阶段。蔓茶不同组织中,茎(29.50 mg/g)和根(0.27 mg/g)的DHM含量显著低于蔓茶。GydF4y2Ba1GydF4y2Bab). DHM含量的显著差异表明蔓茶叶片生长阶段和组织中DHM的积累程度不同。GydF4y2Ba
转录组测序和从头组装GydF4y2Ba
利用Illumina HISeq 2000测序了从幼叶和老叶中制备的cDNA文库,并对其转录组进行了表征GydF4y2BaA. Grossedentata.GydF4y2Ba.转录组阅读是使用Trinity [GydF4y2Ba34GydF4y2Ba].年轻叶子的测序GydF4y2BaA. Grossedentata.GydF4y2Ba(每个三个样本)随后总共生成了1.574亿和1.418亿次读取,在删除包含低质量读取的适配器后,平均分别生成了52.47和4725万次读取(附加文件GydF4y2Ba2GydF4y2Ba:表S1)。最大读长为101个碱基,最小读长为50个碱基。使用SeqQC-V2.2确定原始读取的质量。短读值用汇编软件编译,提高了转录组汇编的质量。GydF4y2Ba
使用三个独立的生物学重复进行的转录组测序。的Hi-SEQ的Illumina转录的概要组件被呈现在表GydF4y2Ba1GydF4y2Ba.在471,658个转录物中,351,096份转录物(74.44%)的长度为200-500bp,63,451份转录物(13.45%)为500bp-1000bp长,57,111转录物(12.11%)长于1000 bp(表GydF4y2Ba1GydF4y2Ba).在两个样品中,contigs的平均长度在200 bp到1000 bp以上。将重新测序的序列组装成一个N50长度为1633 bp、N90长度为469 bp的基因转录组数据集(附加文件)GydF4y2Ba3.GydF4y2Ba:表S2)。所有原始序列上传到NCBI序列读取档案(登录号PRJNA608806)。GydF4y2Ba
基因功能注释与分类GydF4y2BaA. Grossedentata.GydF4y2Ba转录组GydF4y2Ba
一共有177422个Unigenes七个公共数据库即NCBI非冗余蛋白质序列数据库(NR),NCBI非冗余核苷酸数据库(NT),蛋白家族数据库(PFAM),真核直系同源组(KOG),基因本体进行注释(GO),蛋白质数据库的直系同源组(COG)和SWISS-PROT蛋白质数据库的集群(表GydF4y2Ba2GydF4y2Ba).由五个代表性数据库(NT,NR,Kog,Go和PFAM)注释的基因数量在Venn图中呈现(附加文件GydF4y2Ba4.GydF4y2Ba:图S2)。总共21556个Unigenes(12.14%)在打开的数据库被提及之前,通常对齐到同源序列,而152254个Unigenes(85.81%)中的至少一个开放数据库中注释(表GydF4y2Ba2GydF4y2Ba).对NCBI Nr数据库中unigenes的最佳爆破命中的e值分布和相似度分布见附加文件GydF4y2Ba5.GydF4y2Ba:图S3。此外,根据Nr数据库,unigenes的物种同源分布分析以所占总同源序列的百分比表示。共8229个unigenes(59.9%)与该序列高度匹配GydF4y2Ba葡萄GydF4y2Ba, 其次是GydF4y2BaCoccomyxa subellipsoideaGydF4y2Ba(4.8%),GydF4y2Ba大麦芽GydF4y2Ba(2.9%),GydF4y2Ba云杉sitchensisGydF4y2Ba(2387 2.0%)和GydF4y2BaGaldieria sulphurariaGydF4y2Ba(1117年0.9%)。GydF4y2Ba
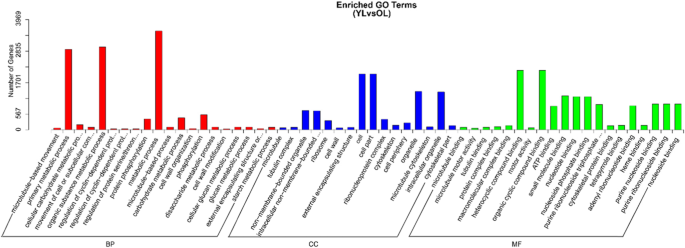
基因本体论(GO)富集分析表明,该基因被注释为56个亚类。最丰富的类别是“细胞过程”、“代谢过程”、“结合”和“催化活性”,它们属于藤茶的“生物过程”和“分子功能”类别(补充文件)GydF4y2Ba6.GydF4y2Ba:图S4)。根据KOG分类体系和京都基因与基因组百科全书(KEGG),将unigenes分别划分为26个KOGs和19个pathway(补充文件)GydF4y2Ba7.GydF4y2Ba和GydF4y2Ba8.GydF4y2Ba:图S5-6)。大部分unigenes(47,612)被发现是互补的GydF4y2BaA. Grossedentata.GydF4y2Ba与一般功能预测、翻译、核糖体结构、生物发生和翻译后修饰、蛋白质转换和伴侣基因具有同源性(附加文件)GydF4y2Ba7.GydF4y2Ba:图S5)。由此可见,与翻译聚类同源的unigenes最多(6542个),其次是碳水化合物代谢(4600个)和次级代谢产物生物合成(1066个)GydF4y2Ba8.GydF4y2Ba:图S6)。GydF4y2Ba
差异表达基因(DEGs)分析GydF4y2Ba
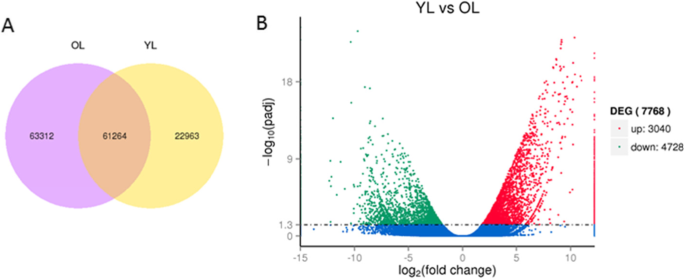
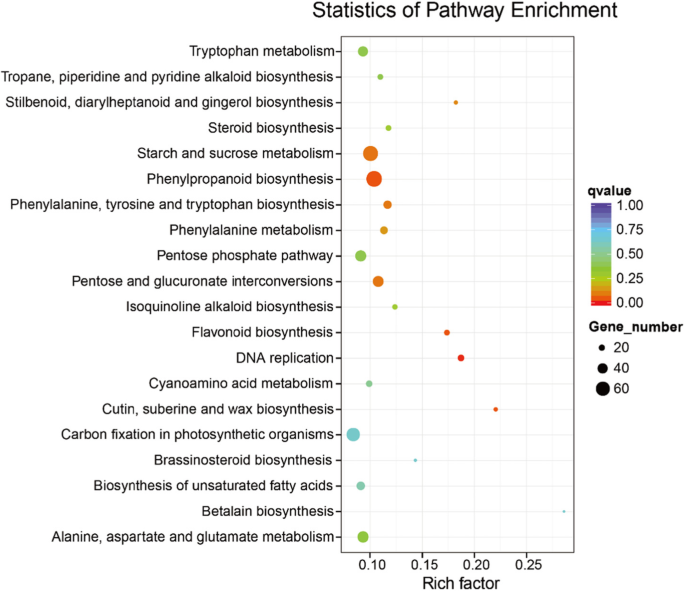
在幼叶和老叶藤茶植物的差异表达的基因进行了分析,比较转录组表达模式。我们的研究结果表明,出177422倍表达的基因,在年轻和老叶发现61264个Unigenes,而7768个基因在两个叶期之间的差异表达(图GydF4y2Ba2GydF4y2Baa).我们还发现,与老叶相比,幼叶中大量转录本(4728)显著下调。GydF4y2Ba2GydF4y2Bab).根据DEGs的GO分类,其余基因与代谢过程、有机物代谢过程和初级代谢过程基因具有同源性(图)。GydF4y2Ba3.GydF4y2Ba).KEGG通路富集分析表明,这些在幼叶和老叶间差异表达的基因主要参与苯丙素的生物合成和淀粉和蔗糖的代谢(图2)。GydF4y2Ba4.GydF4y2Ba,附加文件GydF4y2Ba9.GydF4y2Ba:表S3)。GydF4y2Ba
苯丙素生物合成途径基因在藤茶中的表达GydF4y2Ba
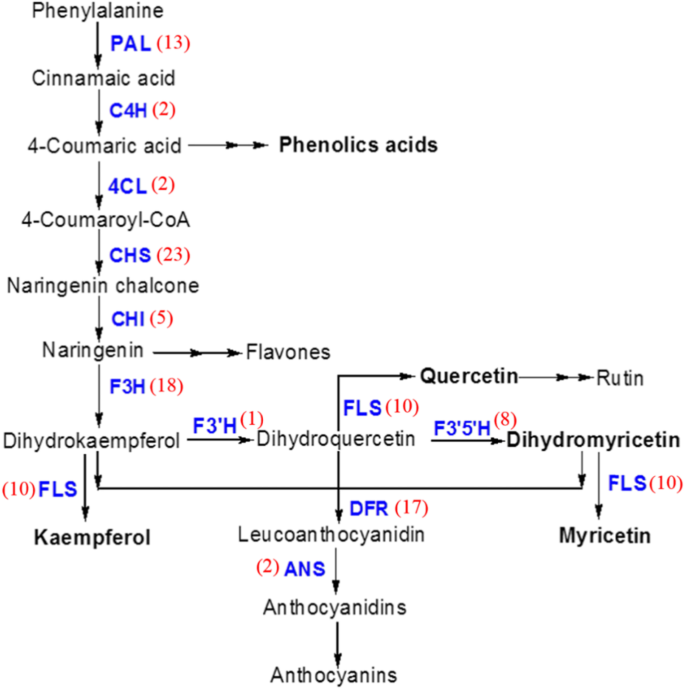
大多数与苯丙生物合成途径相关的已知成绩单是在嫩叶比老叶发现更丰盛。基于KEGG数据库上,共有124个基因和同种型在苯丙生物合成途径进行注释(表GydF4y2Ba3.GydF4y2Ba和额外的文件GydF4y2Ba10GydF4y2Ba:表S4)。为了确确化注释的转录本,并评估不同阶段叶片之间的差异基因表达谱,我们选择了一些与苯丙烯生物合成同源的转录本进行qRT-PCR分析(Figs。GydF4y2Ba5.GydF4y2Ba和GydF4y2Ba6.GydF4y2Ba).研究发现,大多数与苯丙酸途径相关的转录本包括编码肉桂酸4-羟化酶(C4H)、4-香豆酸-辅酶a连接酶(4CL)、查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄酮-3-羟化酶(F3H)、黄酮-3 ' -羟化酶(F3 ' -3 ' -羟化酶)和黄酮-3 ',5 ' -羟化酶(F3 ' - 5 ' -h)的基因。在幼叶中表达量高于老叶(图。GydF4y2Ba6.GydF4y2Ba一种)。在来自葡萄茶的不同器官的组织中也检测到显着差异基因表达谱。显然,大多数主要的苯丙烯酸异合物合成结构基因在根,茎和旧叶阶段5中表现出较低水平的表达。GydF4y2BaAgANSGydF4y2Ba基因在叶期3 ~ 5和藤茶组织中表达稳定,表达量较低。GydF4y2Ba6.GydF4y2Baa).对苯丙烯生物合成途径的主要结构基因与DHM进行相关性分析(图。GydF4y2Ba6.GydF4y2Bab).结果表明DHM与苯丙类生物合成途径中的大部分基因呈显著正相关。(无花果。GydF4y2Ba6.GydF4y2Bab)。GydF4y2Ba
苯丙酸的生物合成途径GydF4y2BaA. Grossedentata.GydF4y2Ba.主要的苯丙类生物合成途径的基因用蓝色标记。括号中的数字表示RNA-Seq鉴定的非基因。苯丙氨酸解氨酶;C4H:肉桂酸4-羟化酶;4 cl, 4-coumarate-CoA连接酶;CHS、查耳酮合酶;气,查耳酮异构酶;F3H flavanone-3-hydroxylase;F3'H, flavonoid-3羟化酶; F3’5’H, flavonoid-3′,5′-hydroxylase; FLS, flavonol synthase; DFR, dihydroflavonol reductase; ANS, anthocyanin synthase
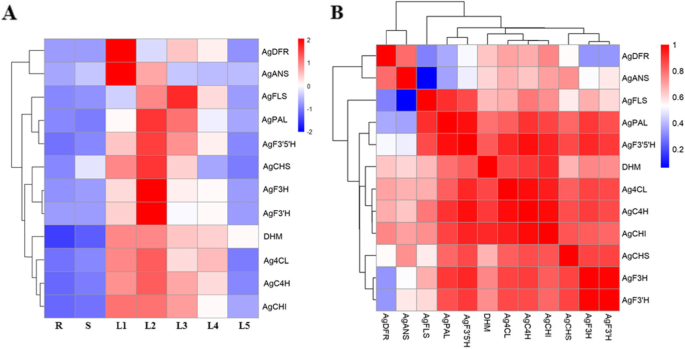
基因表达的热爱图(GydF4y2Ba一种GydF4y2Ba), DHM的积累与生物合成相关基因表达的相关性分析(GydF4y2BaB.GydF4y2Ba)在不同的叶阶段和藤茶的组织。R:根,S:茎,L1-L3:幼叶,L4- L5:老叶。Pearson correlation coefficients were calculated and used to generate a heatmap (B), Each square indicates the Pearson’s correlation coefficient of a pair of data, and the value for the correlation coefficient is represented by the intensity of the blue or red color, as indicated on the color scale
讨论GydF4y2Ba
藤茶是中国南方一种常用的凉茶。藤茶原料经一步自然发酵加工而成[GydF4y2Ba35GydF4y2Ba]并且产品通常作为滋补品消耗,因为它含有高水平的类黄酮DHM [GydF4y2Ba1GydF4y2Ba那GydF4y2Ba36GydF4y2Ba].葡萄茶树粗提物显示出比叔丁基对苯二酚高的抗氧化活性[GydF4y2Ba36GydF4y2Ba].先前的研究表明,绿茶(GydF4y2Bac . sinensisGydF4y2BaL.)根据季节和植物发育阶段的不同而变化[GydF4y2Ba37GydF4y2Ba那GydF4y2Ba38GydF4y2Ba].在本研究中,藤蔓茶树也发现了类似的现象。GydF4y2Ba
先前的研究人员报告说,DHM和其他黄酮类化合物的含量可在不同的植物部分,发展阶段和藤茶树季节条件[内变化GydF4y2Ba39GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].同样,由于地理环境的不同,藤茶的主要化学成分也有所不同;以南方地区为例,DHM和杨梅素的含量分别为0.53 ~ 33.58%和0 ~ 0.48% [GydF4y2Ba41GydF4y2Ba].虽然有少数样品DHM含量较低(< 1%),但大多数样品DHM含量较高,范围在18.03 -33.58% [GydF4y2Ba36GydF4y2Ba那GydF4y2Ba41GydF4y2Ba].以前的一些研究表明,叶龄会降低藤茶的质量[GydF4y2Ba39GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].在本研究中,HPLC数据证实了DHM在藤茶不同组织和不同叶期的差异积累(图。GydF4y2Ba1GydF4y2Ba).记录在老叶的DHM内容与以前的研究结果[证实GydF4y2Ba36GydF4y2Ba那GydF4y2Ba41GydF4y2Ba];然而,第2个阶段嫩叶产生多种化合物的1.3-1.6倍,比老叶在阶段4-5老叶,和DHM内容茎和藤茶很少发现的根。通常,无论是古老而又年轻的芽的商业化生产藤茶的收获在一起;然而,嫩枝通常分级具有更好的质量和价值是更高的价格。随着在转录和化学级藤茶的不同组织之间的差异,我们的研究结果表明,进一步的农业实践和机理研究的有用信息。藤茶的质量可能受年龄,甚至藤茶的叶的化学成分进行分级。这种看法是绿茶品质方面有关。传统上,由新开发的味蕾得到最优质的绿茶。一项研究表明,在芽的茶氨酸和花青素存在于显著较高水平高于绿茶计划等叶[GydF4y2Ba42GydF4y2Ba].花蕾和花蕾旁边的三片嫩叶也比老叶含有更高的儿茶素[GydF4y2Ba42GydF4y2Ba].本研究结果表明,藤茶幼枝DHM含量高于老叶或其他组织。但枝条中较高的DHM含量是从老叶中转移过来的,还是在枝条中局部合成的,目前尚不清楚。GydF4y2Ba
通过转录组分析对非模式物种进行注释是一种常见的策略,以探索一个独特的剖面。由于任何一种化合物占植物部分重量的10%以上的情况都是罕见的,因此单是DHM就占藤茶叶片成分的近三分之一,占幼叶重量的40%以上,这是很重要的。由于没有相关数据,我们进行了全基因组转录本分析,以阐明DHM及其相关类黄酮代谢产物在植物体内的生物合成。利用嫩叶和老叶的rna,我们对藤茶进行了详细的转录组分析,发现了7768个差异表达的ungenes。通过对NCBI非冗余数据库和KEGG的单基因搜索进行最佳匹配,分配不同生物过程下的功能GO注释。将unigenes定位到KEGG上后,我们发现大部分unigenes参与苯丙类生物合成和淀粉、蔗糖代谢。GO分类分析也显示差异表达基因高度参与有机物和初级代谢过程。结果表明,这些转录本编码大量与藤茶嫩叶黄酮类化合物生物合成相关的基因。GydF4y2Ba
138个基因和亚型的发现与类黄酮生物合成途径中,有5个气,10 FLS的,18 3 gt, 17 DFR, 23 CHS, 13个朋友,18 RT, 18 F3H, 8 F3的5是什么,2为4 cl, C4H ANS,和每个C4H和F3'H(图1。GydF4y2Ba5.GydF4y2Ba).暂且不论通过序列的不同长度的组件带来的可能的错误,该基因数是2.7倍更大比那些绿茶,其具有51个Unigenes儿茶素,具有结构的化合物类似于DHM [GydF4y2Ba25GydF4y2Ba].在绿茶植物中,只有一个单基因PAL有超过10个亚型,而其余的有1到3个亚型[GydF4y2Ba25GydF4y2Ba].藤茶极有可能含有更多的单基因或这些基因的同型。FPKM与基因表达量有统计学关系。然而,每个基因在幼叶和老叶中的比例似乎相当随机,一些ungenes在幼叶中数量较多,一些在老叶中数量较多GydF4y2Ba3.GydF4y2Ba).令人困惑的是,一些基因,如GydF4y2BaAgCHIGydF4y2Ba那GydF4y2BaAgFLSGydF4y2Ba那GydF4y2BaAg3GTGydF4y2Ba那GydF4y2BaAgCHSGydF4y2Ba那GydF4y2BaAgPALGydF4y2Ba那GydF4y2BaAgrt.GydF4y2Ba,GydF4y2Baagf3h.GydF4y2Ba都在年轻和老叶高水平的表达不同的个Unigenes。只有一个基因,GydF4y2BaDFRGydF4y2Ba,在老叶中表现出一致较高的FPKMGydF4y2Ba3.GydF4y2Ba).这种差异将在未来的研究中使用功能分析进行进一步研究。GydF4y2Ba
采用定量RT-PCR方法检测类黄酮生物合成途径中部分基因的表达水平(图)。GydF4y2Ba6.GydF4y2Ba).在这项研究中使用的所有设计引物,根据以前公布的数据[GydF4y2Ba42GydF4y2Ba还有NCBI的。每个基因只选择一个片段,每个基因的对应物可以与我们的RNA-Seq unigenes中的一个匹配(表)GydF4y2Ba3.GydF4y2Ba).q-PCR结果表明,在11个检测片段中,大部分片段在幼叶中表达明显强于老叶,说明幼叶中生物合成活性可能高于老叶。青藤茶幼叶的转录水平明显高于对照GydF4y2BaAgC4HGydF4y2Ba那GydF4y2BaAg4CLGydF4y2Ba那GydF4y2BaAgCHSGydF4y2Ba那GydF4y2BaAgCHIGydF4y2Ba那GydF4y2Baagf3h.GydF4y2Ba那GydF4y2BaAgF3'HGydF4y2Ba,GydF4y2BaAgF3'5'HGydF4y2Ba与老叶、茎和根的基因比较。相关分析表明,DHM与主要结构基因呈显著正相关GydF4y2BaAgC4HGydF4y2Ba那GydF4y2BaAg4CLGydF4y2Ba那GydF4y2BaAgCHIGydF4y2Ba那GydF4y2Baagf3h.GydF4y2Ba那GydF4y2BaAgF3'HGydF4y2Ba,GydF4y2BaAgF3'5'HGydF4y2Ba(无花果。GydF4y2Ba6.GydF4y2Ba).DHM与GydF4y2BaAgFLSGydF4y2Ba那GydF4y2BaAgANSGydF4y2Ba,GydF4y2BaAgDFRGydF4y2Ba,不直接参与DHM的生物合成。本研究结果表明,与苯丙烯生物合成相关的基因表达水平较高可能是藤茶幼叶比老叶或其他组织中DHM积累较多的原因。然而,真实的单基因数目还需要通过分子克隆和功能分析来进一步验证。进一步的实验可能也有助于确定这些unigenes在幼叶和老叶中的行为。GydF4y2Ba
此外,已经证实许多转录因子(TFs)参与了植物代谢生物合成的调控,包括MYBs、NACs、bHLH、WD40s、wrky等,这些转录因子的调控方式通常是组织特异性的[GydF4y2Ba43GydF4y2Ba那GydF4y2Ba44GydF4y2Ba那GydF4y2Ba45GydF4y2Ba那GydF4y2Ba46GydF4y2Ba那GydF4y2Ba47GydF4y2Ba].MYBs通过调控类黄酮或花青素生物合成途径中的结构基因,在果实和花的颜色形成中发挥关键作用[GydF4y2Ba43GydF4y2Ba那GydF4y2Ba44GydF4y2Ba那GydF4y2Ba45GydF4y2Ba那GydF4y2Ba48GydF4y2Ba那GydF4y2Ba49GydF4y2Ba那GydF4y2Ba50GydF4y2Ba那GydF4y2Ba51GydF4y2Ba].有报道称,R2R3 MYB转录因子在葡萄和苹果果实发育过程中对黄酮的时空生物合成起到重要调控作用[GydF4y2Ba44GydF4y2Ba那GydF4y2Ba51GydF4y2Ba].两个MYB转录因子,GydF4y2BaCsMYB2GydF4y2Ba和GydF4y2BaCsMYB26GydF4y2Ba据报道,据报道,茶中的黄酮类生物合成(GydF4y2Bac . sinensisGydF4y2Ba(L.)O. Kuntze)GydF4y2Ba52GydF4y2Ba].此外,GydF4y2BaGmMYB58GydF4y2Ba和GydF4y2BaGmMYB205GydF4y2Ba被证明是种子特异性的类异黄酮生物合成激活剂GydF4y2Ba大豆GydF4y2Ba[GydF4y2Ba45GydF4y2Ba].大量报道表明,MYB、bHLH和WD-repeat (WDR)家族的转录因子一般形成三元复合物(MBW复合物),协同激活或抑制调控网络中的多个基因,从而影响代谢生物合成[GydF4y2Ba46GydF4y2Ba那GydF4y2Ba47GydF4y2Ba那GydF4y2Ba53GydF4y2Ba那GydF4y2Ba54GydF4y2Ba].我们的研究确定了许多转录因子,包括来自葡萄茶的MyB,BHLH和Bzip基因(附加档案GydF4y2Ba11GydF4y2Ba:表S5)。在4825个被鉴定的转录因子中,MYBs、C2H2s、bHLHs和bzip在幼叶和老叶之间有显著差异。在青茶幼叶和老叶之间MYB基因分别有34和16个,C2H2s基因4和49个,bHLHs基因20和12个,bzip基因9和22个GydF4y2Ba11GydF4y2Ba表S5),可能在葡萄藤茶树DHM生物合成调控中起重要作用。在分子水平上了解这些转录因子对提高藤茶类黄酮水平具有重要意义。GydF4y2Ba
结论GydF4y2Ba
在本研究中,比较了幼叶和老叶组织的转录组分析GydF4y2BaA. Grossedentata.GydF4y2Ba研究了该重要茶树类黄酮生物合成途径的可能转录本。蔓茶不同发育阶段和不同组织中基因表达模式的差异表明,蔓茶中类黄酮代谢产物的合成和积累具有组织特异性,尤其是DHM。本研究为藤茶类黄酮生物合成途径的研究提供了有用的资源,以确定藤茶类黄酮大量积累和数量的原因。这些信息可能为提高黄酮类化合物含量的植物代谢工程铺平道路。GydF4y2Ba
方法GydF4y2Ba
植物材料和培养条件GydF4y2Ba
藤茶(GydF4y2BaA. Grossedentata.GydF4y2Ba)植物生长在来凤县,恩施地区,湖北省,中国(29°14'N一个私人农场,109°26'E)。茶是在天然环境中生长。在不同的生长阶段和藤茶的叶组织在六月份进行收集,2016年植物利用勃胡教授,博士[一个物种鉴定键标识GydF4y2Ba55GydF4y2Ba华中农业大学植物科学技术学院,武汉,中国。代用标本保存于华中农业大学植物标本馆(中国虚拟植物标本馆CCAU分馆),登录号为HBES0801和HBES0802。将5个生长期的叶片从顶芽分离到老枝进行高效液相色谱分析(图。GydF4y2Ba1GydF4y2Ba).采集后将样品快速冷冻在液氮中,置于−80℃保存至分析。并将样品送到中国北京诺沃金公司进行cDNA文库构建和转录组分析。GydF4y2Ba
RNA分离,文库制备,转录组测序GydF4y2Ba
使用液氮将三个重复的样品合并并研磨成砂浆中的粉末。使用Trizol试剂(Invitrogen)从约100mg粉末中提取总RNA。使用Nanodrop分光光度计(旨在的CA,USA),Qubit RNA测定套件(Life Technologies,Ca,USA)和安捷伦生物分析仪2100系统(Agilent Technologies,CA,USA)测试MRNA包括纯度,数量和完整性,包括纯度,数量和完整性,包括纯度,数量和完整性。.每个样品的总量为1.5μgRNA作为RNA样品制剂的输入材料。使用Nebnext®Ultra™RNA库预备套件为Illumina®(Neb,USA)生成测序库,后,制造商的建议和索引代码被添加到每个样本的属性序列。最后,通过PCR进一步富集纯化的双链cDNA样品,构建使用Novogene公司(北京,中国)使用Hiseq 2500(150bp配对末端)测序的最终cDNA文库。GydF4y2Ba
总RNA的提取和cDNA合成GydF4y2Ba
总RNA从中分离出来GydF4y2BaA. Grossedentata.GydF4y2Ba使用RNeasy Plant Mini Kit (Qiagen, Valencia, CA, USA) TIANGEN RNAprep Pure Kit (TIANGEN)。对于第一链cDNA的合成,1 μg高质量总RNA用Takara FastQuant RT kit (Takara,日本)进行逆转录(RT)。以20 μL稀释20倍的cDNA为模板进行实时荧光定量PCR。GydF4y2Ba
实时定量PCR (qRT-PCR)分析GydF4y2Ba
从不同样品的转录水平GydF4y2BaA. Grossedentata.GydF4y2Ba采用qRT-PCR分析。设计基因特异性引物,对类黄酮生物合成途径中涉及的主要转录本进行qRT-PCR分析(图)。GydF4y2Ba5.GydF4y2Ba,附加文件12:Tab。S6)。这是管家基因GydF4y2BaGAPDHGydF4y2Ba从GydF4y2BaA. Grossedentata.GydF4y2Ba用作内部标准[GydF4y2Ba56GydF4y2Ba].基因表达归一化到管家基因GydF4y2BaGAPDHGydF4y2Ba.在MiniOpticon系统(Bio-Rad Laboratories, Hercules, CA, USA)上使用SYBR Premix Ex Taq™(TIANGEN,中国)进行3个重复的实时PCR反应。每次试验都包含一系列标准品和阴性对照品(用水代替cDNA)。qRT-PCR方案为:95℃变性5 min, 95℃变性15 s, 56℃退火15 s, 72℃延伸20 s,共40个循环。每个样品进行3个重复,qRT-PCR结果取3个重复处理的平均值。GydF4y2Ba
藤茶中黄酮类化合物的提取GydF4y2Ba
藤茶样品经冻干后磨成粉末。黄酮类化合物提取方法如下。将样品磨成细粉,用1.5 mL 70%甲醇(MeOH)提取粉状物质0.1 g。提取液旋流1 min, 30℃超声0.5 h。1000×离心后GydF4y2BaGGydF4y2Ba5分钟后,上清液通过0.45 μm聚四氟乙烯注射器过滤器(Cameo 25F, Micron separation Inc., Westboro, MA)过滤,用于代谢产物分析。GydF4y2Ba
定量HPLC分析GydF4y2Ba
采用Waters HPLC系统(Milford, MA, USA), Waters ODS色谱柱(150 mm × 4.6 mm, 5 μm;沃特斯公司,米尔福德,马,美国)。流动相为(a):乙酸-水(0.15%)和(B)甲醇的混合物。初始流动相成分为20%溶剂B,线性梯度范围为5 ~ 80%溶剂B,检测波长为285 nm,柱箱温度为30℃。流速为0.8 mL/min,进样量为10 μL。(+)-二氢杨梅素(DHM)标准化合物(> 99%)购自Sigma Chemicals Co. (St. Louis, MO)。将不同化合物的定量计算为代表性标准化合物的当量。所有含量均以mg/g干重表示。GydF4y2Ba
数据处理和统计分析GydF4y2Ba
图中数据以3个独立重复的平均值表示。实验数据采用方差分析(ANOVA)处理,均数之间的显著差异采用邓肯多范围检验(SPSS 22.0, Chicago: SPSS Inc.)。的值GydF4y2BaP.GydF4y2Ba< 0.05被认为有统计学意义。采用SPSS 22.0软件进行Pearson相关分析,以代谢物浓度和基因相对表达值计算相关系数。然后用R (GydF4y2Bahttp://www.r-project.org/GydF4y2Ba).GydF4y2Ba
可用性数据和材料GydF4y2Ba
本研究中的转录组clean raw reads数据已保存在NCBI Sequence Read Archive (GydF4y2Bahttps://www.ncbi.nlm.nih.gov/Traces/sra_sub/GydF4y2Ba),登录号PRJNA608806。本研究的相关数据包括在本文和补充文件中。GydF4y2Ba
缩写GydF4y2Ba
- 4CL:GydF4y2Ba
-
4-coumarate-CoA连接酶GydF4y2Ba
- 答:GydF4y2Ba
-
花青素合成酶GydF4y2Ba
- C4h:GydF4y2Ba
-
肉桂酸4-羟化酶GydF4y2Ba
- CHI:GydF4y2Ba
-
查耳酮异构酶GydF4y2Ba
- CHS:GydF4y2Ba
-
查耳酮合酶GydF4y2Ba
- 度:GydF4y2Ba
-
差异表达基因GydF4y2Ba
- DFR:GydF4y2Ba
-
Dihydroflavonol还原酶GydF4y2Ba
- F3GydF4y2Ba“5”GydF4y2BaHGydF4y2Ba:GydF4y2Ba
-
Flavonoid-3 ', 5 ' -羟化酶GydF4y2Ba
- F3'H:GydF4y2Ba
-
类黄酮3'-羟化酶GydF4y2Ba
- F3H:GydF4y2Ba
-
Flavanone-3-hydroxylaseGydF4y2Ba
- 读者:GydF4y2Ba
-
黄酮醇合成酶GydF4y2Ba
- 去:GydF4y2Ba
-
基因本体论GydF4y2Ba
- 高效液相色谱法:GydF4y2Ba
-
高效液相色谱法GydF4y2Ba
- KEGG:GydF4y2Ba
-
京都基因和基因组百科全书GydF4y2Ba
- Kog:GydF4y2Ba
-
真核同源基因组GydF4y2Ba
- Nr:GydF4y2Ba
-
NCBI非冗余蛋白序列GydF4y2Ba
- Nt:GydF4y2Ba
-
NCBI非冗余核苷酸序列GydF4y2Ba
- 朋友:GydF4y2Ba
-
苯丙氨酸裂解酶铵GydF4y2Ba
参考文献GydF4y2Ba
- 1.GydF4y2Ba
叶磊,王海涛,王海涛,王海涛。藤茶的抗氧化活性(GydF4y2Ba藤茶GydF4y2Ba)在大豆油和煮熟的牛肉中提取物及其主要成分二氢含油蛋白。食品化学。2015; 172:416-22。GydF4y2Ba
- 2.GydF4y2Ba
徐YQ,刘PP,石Ĵ,高Y,王QS,殷樱。质量求发展,从新鲜的竹笋不同部分加工铁观音乌龙茶的主要化学成分。食品化学。2018; 249:176-83。GydF4y2Ba
- 3.GydF4y2Ba
茶儿茶素和多酚的健康作用、代谢和抗氧化功能。食品科学。2003;43(1):89-143。GydF4y2Ba
- 4.GydF4y2Ba
穆罕默德·乌,卢华,王军,韩军,朱旭,卢泽,塔雅巴,易哈桑。藤茶中二氢杨梅素最大回收率的优化GydF4y2Ba藤茶GydF4y2Ba,采用响应面法。摩尔。(瑞士巴塞尔)。2017; 22(12): 2250。GydF4y2Ba
- 5.GydF4y2Ba
徐斌,黄胜,王超,张华,方胜,张艳。二氢杨梅素对哮喘模型小鼠的抗炎作用。中华医学杂志2017;15(6):3674-80。GydF4y2Ba
- 6.GydF4y2Ba
侯晓丽,童强,王文强,史春英,熊伟,陈杰,刘旭,方建国。二氢杨梅素抑制炎症反应,黄酮类GydF4y2Ba藤茶GydF4y2Ba,通过抑制NF-κB和MAPK信号传导途径的活化。J Nat Prod。2015; 78(7):1689至1696年。GydF4y2Ba
- 7.GydF4y2Ba
魏旭,吕雄辉,王海波,朱茹,魏金昌。二氢杨梅素的抑菌活性及其与苯甲酸钠的比较。生物化学工程。2016;2(1):12-4。GydF4y2Ba
- 8.GydF4y2Ba
吴飞,李勇,宋辉,张勇,张勇,姜敏,王飞,穆强,张伟,李丽,等。二氢杨梅素对顺铂肾毒性的体内外预防作用。evidence Based Complement Alternat Med. 2016;2016:7937385。GydF4y2Ba
- 9.GydF4y2Ba
刘军,舒莹,张强,刘波,夏军,邱敏,苗华,李敏,朱瑞丽。二氢杨梅素诱导肝癌细胞凋亡及抑制增殖。肿瘤防治杂志。2014;8(4):1645 - 51。GydF4y2Ba
- 10.GydF4y2Ba
黄酮类化合物蛇葡萄素抑制前列腺癌体外和小鼠的生长和转移。《公共科学图书馆•综合》。2012;7 (6):e38802。GydF4y2Ba
- 11.GydF4y2Ba
李华,李强,刘铮,杨坤,陈智,程强,吴磊。二氢杨梅素对人体健康的多种作用。基于Evid的Complement Alternat Med. 2017;2017:1053617。GydF4y2Ba
- 12.GydF4y2Ba
叶晓丽,陆立强,李伟,娄强,郭海根,石启军。口服蛇葡萄素对大鼠局灶性脑缺血后急性脑损伤具有保护作用。医学杂志。2017;13(5):1725-34。GydF4y2Ba
- 13.GydF4y2Ba
黄宏昌,廖传昌,彭传昌,林建明,肖建辉,魏传明,陈传昌,吴传胜,张天明。Dihydromyricetin从GydF4y2Ba藤茶GydF4y2Ba通过下调MAPK、PKA和PKC信号通路抑制黑色素生成。Chem.-biol。交互。2016;258:166 - 74。GydF4y2Ba
- 14.GydF4y2Ba
贝德纳雷克P.化学战或防御反应调节剂 - 植物免疫力次生代谢物的功能。CurrOp植物BIOL。2012; 15(4):407-14。GydF4y2Ba
- 15.GydF4y2Ba
Wurst S, Wagenaar R, Biere A, van der Putten WH。微生物和线虫增加了根和根系分泌物的次生代谢物水平GydF4y2BaPlantago生长状况GydF4y2Ba.植物土壤。2010; 329(1):117-26。GydF4y2Ba
- 16.GydF4y2Ba
哈兹木霉(Trichoderma harzianum)真菌处理提高抗旱性与次生代谢产物和脯氨酸含量的增加有关。农业工程学报。2017;16(8):1751-7。GydF4y2Ba
- 17.GydF4y2Ba
Costantini L, Kappel CD, Trenti M, Battilana J, Emanuelli F, Sordo M, morretto M, Camps C, Larcher R, Delrot S, et al。绘制从转录组到代谢物的链接。莫斯卡托比安科(GydF4y2Ba葡萄GydF4y2BaL.)。正面。植物SCI。2017; 8:780。GydF4y2Ba
- 18.GydF4y2Ba
Deluc LG, Grimplet J, Wheatley MD, Tillett RL, Quilici DR, Osborne C, Schooley DA, Schlauch KA, Cushman JC, Cramer GR.赤霞珠葡萄果实发育的转录组和代谢产物分析。BMC基因组学。2007;8:429。GydF4y2Ba
- 19.GydF4y2Ba
菊科开花头状花序次生代谢产物的海拔变化趋势及原因。Phytochem启2010;9(2):197 - 203。GydF4y2Ba
- 20.GydF4y2Ba
Yadav RK, Sangwan RS, Sabir F, Srivastava AK, Sangwan NS。长期水分胁迫对特化次生代谢物、盾状腺毛及通路基因表达的影响GydF4y2Ba青蒿GydF4y2Baacta botanica yunnanica(云南植物研究中心),2014;GydF4y2Ba
- 21.GydF4y2Ba
Lee J-E, Lee B-J, Chung J-O, Kim H- n, Kim E-H, Jung S, Lee H, Lee S- j, Hong Y-S。一系列绿茶的代谢组学揭示(GydF4y2Ba茶树GydF4y2Ba)取决于地理位置的代谢物。食品化学。2015;174:452-9。GydF4y2Ba
- 22.GydF4y2Ba
关键词:安吉白茶,颜色,发育阶段,代谢产物,转录组分析GydF4y2Ba茶树GydF4y2Ba).植物学报。2016;16(1):195。GydF4y2Ba
- 23.GydF4y2Ba
黄志刚,王志强,王志强,等。黄酮类化合物的合成及其在生物合成中的应用GydF4y2Ba茶树GydF4y2Ba苗和基因的表达编码生物合成酶。植物化学。2010; 71(5):559-66。GydF4y2Ba
- 24.GydF4y2Ba
魏凯,张勇,吴丽,李华,阮磊,白鹏,张超,张飞,徐磊,王磊,等。茶叶芽和叶色的基因表达分析。植物生理生化。2016;107:310-8。GydF4y2Ba
- 25.GydF4y2Ba
郭飞,郭颖,王鹏,王颖,倪东。茶树叶片发育过程中儿茶素生物合成基因的转录分析。足底。2017;246(6):1139 - 52。GydF4y2Ba
- 26.GydF4y2Ba
郝晓霞,杨艳艳,岳超,王磊,王雪梅。转录组综合分析揭示不同基因表达谱GydF4y2Ba茶树GydF4y2Ba腋芽在对 - ,内切,生态休眠和芽冲洗阶段。前植物SCI。2017; 8:553。GydF4y2Ba
- 27.GydF4y2Ba
Zhao S, Tuan PA, Li X, Kim YB, Kim H, Park CG, Yang J, Li CH, Park SU. phenylpropanoid biosynthesis genes and transcriptome analysis of phenylpropanoidGydF4y2Ba枸杞子GydF4y2Ba.BMC基因组学。2013;14(1):802。GydF4y2Ba
- 28.GydF4y2Ba
从莽草酸和苯基丙酸途径中提取的化合物及其药用价值综述。中华医学杂志。2017;17(12):1013-27。GydF4y2Ba
- 29.GydF4y2Ba
王刚,吴丽,张辉,吴伟,张敏,李旭,吴辉(英文)GydF4y2Ba落花生hypogaeaGydF4y2Bal .)幼苗。农业食品化学学报,2016;64(18):3626-35。GydF4y2Ba
- 30.GydF4y2Ba
8 .金宗杰,李旭,金耀斌,乌丁先生,金世杰,Suzuki T, Park NI, Park SU.苦荞麦毛状根的代谢组学分析和苯丙类生物合成。《公共科学图书馆•综合》。2013;8 (6):e65349。GydF4y2Ba
- 31.GydF4y2Ba
黑胡椒的转录组测序研究(GydF4y2Ba吹笛者nigrum.GydF4y2Ba和响应苯丙代谢相关基因的分析GydF4y2Ba疫霉capsiciGydF4y2Ba.BMC基因组学。2016;17(1):822。GydF4y2Ba
- 32.GydF4y2Ba
Wang Z, Cui Y, Vainstein A, Chen S, Ma h (GydF4y2Ba无花果GydF4y2Ba果实颜色:类黄酮生物合成途径的代谢组学和转录组学分析。前面。植物科学。2017;8:1990。GydF4y2Ba
- 33.GydF4y2Ba
Massonnet M, Fasoli M, Tornielli GB, Altieri M, Sandri M, Zuccolotto P, Paci P, Gardiman M, Zenoni S, Pezzotti M.红白葡萄品种成熟转录组程序与浆果皮花青素积累相关。植物杂志。2017;174(4):2376 - 96。GydF4y2Ba
- 34.GydF4y2Ba
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Adiconis X, Fan L, Raychowdhury R, Zeng Q, et al.;没有参考基因组的RNA-Seq数据的全长度转录组组装。生物科技Nat》。2011;29(7):644 - 52。GydF4y2Ba
- 35.GydF4y2Ba
郑XJ,萧H,曾Z,Sun Zw,雷卡,董JZ,王Y.发酵葡萄茶中主要黄酮类化合物的组成和血清抗氧化(GydF4y2Ba藤茶GydF4y2Ba).Ĵ功能该食品。2014; 9:290-4。GydF4y2Ba
- 36.GydF4y2Ba
高J,刘B,宁Z,Zhao R,Zhang A,Wu Q.叶片富含类黄酮富萃取物的特征及抗氧化活性GydF4y2Ba藤茶GydF4y2Ba.J Food Biochem。2009; 33(6):808-20。GydF4y2Ba
- 37.GydF4y2Ba
中国茶、阿萨姆茶和柬埔寨茶的比较转录组分析(GydF4y2Ba茶树GydF4y2Ba)使用RNA-SEQ技术开发和季节性变化期间的类型。SCI批准。2016; 6:37244。GydF4y2Ba
- 38.GydF4y2Ba
刘俊,张Q,刘男,马L,石Y,阮J.代谢组学分析表明一个春暖花开的季节的短时间内,代谢物和绿茶品质的显着变化。JAgric Food Chem。2016; 64(16):3302-9。GydF4y2Ba
- 39.GydF4y2Ba
何桂霞,郭培,杨伟林,李斌。不同部位二氢杨梅素的测定GydF4y2Ba藤茶GydF4y2Ba采用高效液相色谱法测定不同季节。中华医学杂志。2004;26(3):210-2。GydF4y2Ba
- 40.GydF4y2Ba
张永,杨伟林,龚永。中二氢杨梅素的测定GydF4y2Ba藤茶GydF4y2Ba产物。中国中药杂志。2001;32(11):983-4。GydF4y2Ba
- 41.GydF4y2Ba
范LL,李李,魏W,曹楼张英姿,苗JH。二氢杨梅素的含量测定和叶杨梅素GydF4y2Ba藤茶GydF4y2Ba并对其热稳定性进行了研究。下巴制药。2012;23(35):3316 - 9。GydF4y2Ba
- 42.GydF4y2Ba
杨华,张丽,陈强,邓伟,魏胜,张军,方超,何超,等。茶叶生物合成特征成分的转录组学和植物化学分析(GydF4y2Ba茶树GydF4y2Ba)与油茶(GydF4y2Ba山茶花鉴定GydF4y2Ba).BMC Plant Biol. 2015;15:190。GydF4y2Ba
- 43.GydF4y2Ba
张伟,宁光,吕华,廖磊,鲍明。myb型转录因子AtCAPRICE基因的克隆及其在烟草花青素生产中的应用。生物化学学报。2009;388(4):742-7。GydF4y2Ba
- 44.GydF4y2Ba
关键词:MYB转录因子,黄酮类化合物,生物合成,葡萄原生质。2012;249 (2):S109-18。GydF4y2Ba
- 45.GydF4y2Ba
韩旭,尹强,刘杰,姜伟,狄胜,庞勇。GydF4y2BaGmMYB58GydF4y2Ba和GydF4y2BaGmMYB205GydF4y2Ba种子中异黄酮生物合成的特异性激活剂是什么GydF4y2Ba大豆GydF4y2Ba.植物学报2017;36(12):189 - 902。GydF4y2Ba
- 46.GydF4y2Ba
王磊,唐伟,胡勇,张勇,孙军,郭旭,吕华,杨勇,方超,牛旭,等。MYB/bHLH复合物调节红心猕猴桃内果皮组织特异性花青素生物合成GydF4y2Ba猕猴桃对GydF4y2Ba简历。红阳植物杂志2019; 99(2):359-78。GydF4y2Ba
- 47.GydF4y2Ba
Schaart JG,杜伯士C,Romero的德拉丰余,AMML v H,RCH d V,琼克HH,许W,Routaboul J-男,Lepiniec L,Bovy酒店AG。识别和MYB-的bHLH-WD40调节复合物控制草莓原花色素合成的表征(GydF4y2Ba草莓×ananassaGydF4y2Ba)水果。新植醇。2013;197(2):454 - 67。GydF4y2Ba
- 48.GydF4y2Ba
曹X,邱Z,王X,范江T,刘X,王阶,王X,高Ĵ,郭Y,杜Y,等人。推定的R3 MYB阻遏是候选基因底层atroviolacium,在番茄果实花青素色素沉着的轨迹。J Exp Bot。2017; 68(21-22):5745-58。GydF4y2Ba
- 49.GydF4y2Ba
盖茨DJ,奥尔森B,克莱门特TE,史密斯SD。与花卉色素沉着在Iochroma损失相关联的新颖R3 MYB转录阻遏。新植物。2017; 217:1346至1356年。GydF4y2Ba
- 50。GydF4y2Ba
李伟,丁志强,阮敏,于晓霞,彭敏,刘宇宇。猕猴桃R2R3-MYB转录因子及其对猕猴桃花青素合成的影响。Sci众议员2017;7(1):16861。GydF4y2Ba
- 51。GydF4y2Ba
林旺,王志强,王志强,等。一个古老的复制苹果MYB转录因子负责新的红色水果果肉表型。植物杂志。2013;161(1):225 - 39。GydF4y2Ba
- 52.GydF4y2Ba
王伟林,王玉祥,李辉,刘志伟,崔旭,庄杰GydF4y2BaCsMYB2GydF4y2Ba和GydF4y2BaCsMYB26GydF4y2Ba)参与茶树类黄酮的生物合成[GydF4y2Ba茶树GydF4y2Ba(L.)O. Kuntze]。BMC植物BIOL。2018; 18(1):288。GydF4y2Ba
- 53.GydF4y2Ba
Albert NW, Davies KM, Lewis DH, Zhang H, Montefiori M, Brendolise C, Boase MR, Ngo H, Jameson PE, Schwinn KE。一个保守的转录激活因子和抑制因子的网络调节花青素色素沉着。植物细胞。2014;26(3):962 - 80。GydF4y2Ba
- 54.GydF4y2Ba
徐伟,王志强,王志强,等。MYB-bHLH-WDR配合物对黄酮类化合物合成的调控作用。植物科学进展。2015;20(3):176-85。GydF4y2Ba
- 55.GydF4y2Ba
中国科学院中国植物区系编辑委员会。《中国植物志》第48卷。北京:科学出版社;1998.p53。GydF4y2Ba
- 56.GydF4y2Ba
徐敏,易慧杰,赵胜,张永文,杨志军,张建国。定量RT-PCR分析内参基因的筛选与验证GydF4y2Ba藤茶GydF4y2Ba.中国中药杂志。2017;48(6):1192-8。GydF4y2Ba
致谢GydF4y2Ba
不适用。GydF4y2Ba
资金GydF4y2Ba
这项工作是由中国号的国家自然科学基金31600234(XL),中央高校计划号2662015QD005基本科研基金(XL)号2662017PY104(XH)和国家重点R&d项目中国号的支持2017YFD0501500(XH)。供资机构并没有参与这项研究,数据收集,数据的解释的设计,或以书面稿件。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
所有作者发起和设计了实验,XL, MC, WM, CJ, JL, MZ, CL, ZC进行了实验,XL和WM分析数据并撰写了手稿,MC贡献了植物材料。XH和财政部对手稿进行了修改和编辑。所有作者均已阅读并批准本稿件。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
我们声明,我们得到了农场主人的许可来收集样本,标本收集遵循了机构和国家指南。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
附加信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:图S1。GydF4y2Ba
葡萄酒茶叶中的DHM分析HPLC色谱图。A,二氢肌酐素(1),芦丁(2),霉素(3),槲皮素(4)和Kaempferol(5)的标准色谱图,在285nm处;B和C,年轻(B)和旧(C)叶片的HPLC色谱图葡萄茶。GydF4y2Ba
附加文件2:表S1。GydF4y2Ba
阅读注释与参考数据库。GydF4y2Ba
附加文件3:表S2。GydF4y2Ba
基于从头组装的转录本分布和基因长度。GydF4y2Ba
附加文件4:图S2。GydF4y2Ba
藤茶转录组中所有ungenes的注释。5个代表性数据库(nt, nr, kog, go, pfam)注释的基因数量用维恩图表示。GydF4y2Ba
附加文件5:图S3。GydF4y2Ba
Nr数据库中注释的unigenes的特征。A,每个unigene BLAST命中top的e值分布(e值为1.0eGydF4y2Ba−5GydF4y2Ba);B,每个单基因BLAST top命中的相似性分布;C,同源物种分布与Nr数据库。GydF4y2Ba
附加文件6:图S4。GydF4y2Ba
单基因的基因本体(GO)分类GydF4y2BaA. Grossedentata.GydF4y2Ba.GydF4y2Ba
附加文件7:图S5。GydF4y2Ba
功能分类,转录组GydF4y2BaA. Grossedentata.GydF4y2Ba.GydF4y2Ba
附加文件8:图S6。GydF4y2Ba
单基因的KEGG分类GydF4y2BaA. Grossedentata.GydF4y2Ba.GydF4y2Ba
附加文件9表S3。GydF4y2Ba
YL VS OL DEG富集KEGG通路前20名。GydF4y2Ba
附加文件10:表S4。GydF4y2Ba
中鉴定的苯丙类生物合成途径的转录本丰度GydF4y2BaA. Grossedentata.GydF4y2Ba转录组。GydF4y2Ba
附加文件11:表S5。GydF4y2Ba
差异表达的转录因子在藤茶(TFS)。GydF4y2Ba
附加文件12:表S6。GydF4y2Ba
的用于qRT-PCR的引物的核苷酸序列。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
李,X.,曹,M.,马,W。GydF4y2Ba等等。GydF4y2Ba在藤茶参与高水平的二氢杨梅素生产的基因注释(GydF4y2Ba藤茶GydF4y2Ba),通过转录组分析。GydF4y2BaBMC植物杂志GydF4y2Ba20.GydF4y2Ba131(2020)。https://doi.org/10.1186/s12870-020-2324-7GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-020-2324-7GydF4y2Ba
关键词GydF4y2Ba
- 藤茶GydF4y2Ba
- 转录组分析GydF4y2Ba
- Phenylpropanoid通路GydF4y2Ba
- 基因表达GydF4y2Ba
- 二氢杨梅素GydF4y2Ba