抽象的
背景
Styrax Tonkinensis.(Pierre)克劳布前哈特维奇作为具有高油含量的种子核,优异的脂肪酸组成和良好燃料性能的木质生物柴油物种具有巨大潜力。但是,在开发中的石油积累的分子调节机制上没有转录的信息美国tonkinensis内核。
结果
分析了在开花(DAF)后的50至150天的11个时间点的油含量和脂肪酸组成的动态模式。油含量百分比显示出上下升压模式,在140个DAF上或之后的不饱和度和不饱和度的程度。选择四个时间点(50,70,100和130个DAF)用于Illumina转录组测序。产生了大约7300万质量的清洁读数,然后组装成168,207个unigenes,平均长度为854 bp。在不同的时间点之间存在5916个基因差异表达。将这些差异表达基因基于其表达模式分成9个簇。通过QRT-PCR确认12个unigenes子集的表达模式。基于通过基本局部对准搜索工具和公开的蛋白质数据库的功能注释,确定了编码关键酶,跨膜转运蛋白和与油积聚相关的转录因子的特异性未成熟。表达的三种主要模式是显而易见的。大多数ungigenes达到70个DAF,在内核发育过程中迅速增加油含量。 Unigenes with high expression at 50 DAF were associated with plastid formation and earlier stages of oil synthesis, including pyruvate and acetyl-CoA formation. Unigenes associated with triacylglycerol biosynthesis and oil body development peaked at 100 or 130 DAF.
结论
油累积过程中的转录组变化显示出具有很少的突然过渡的不同时间趋势。表达型材表明油脂合成的乙酰-CoA形成直接由丙酮酸和间接通过乙醛,并表明脂肪酸生物合成的主要碳源是源自塑体外部磷酸己糖的三代考验。不同的sn -甘油-3-磷酸酰酰基转移酶在早期的油积累后期与晚期阶段涉及二酰基甘油生物合成。三酰基甘油生物合成可以通过双酰基甘油和磷脂:二酰基甘油酰基转移酶完成。
背景
生物柴油是世界上最重要的可再生和清洁能源之一,于1853年首次成功地用第一代生物柴油原料植物油生产[1那2].第二代生物柴油原料源自非可食性源,例如油Millettia pinnata(l)Panigrahi,麻风树图L.和微藻,解决了“粮食与燃料”的争端,降低了生产成本,特别是原材料成本[3.].最近,作为生物柴油原料的潜在来源,已经注意到了木质植物,以低成本和易于培养[4.那5.].
Styrax Tonkinensis.(皮埃尔)克劳布前哈特维奇,一名成员安息香科,原产于老挝北部和越南的次生雨林,并传入西非和中国南部[6.].这种植物是一种经济上重要的树种,因为其木材,苯并素树脂,种子油和观赏价值[7.那8.那9.那10.].在中国,美国tonkinensis具有巨大的潜力,作为具有高油含量的种子核(54.86%),优异的脂肪酸组成和良好燃料特性的木质生物柴油物种[9.].迄今为止,相关研究美国tonkinensis主要集中于种植、木材生产、安息香树脂生产和生物燃料生产[11.那12.那13.那14.].研究美国tonkinensiskernels, Zhang等[15.],采集花期30 ~ 140 d的植株,进行形态计量指标(纵切面、重量和含水量)、营养成分(油、可溶性糖、淀粉、游离氨基酸和可溶性蛋白)及相关酶活性分析。石油聚集发育的动力模式美国tonkinensis种子粒也被分析[15.那16.那17.].然而,目前对该物种油脂积累的分子调控机制知之甚少,也没有任何种类的RNA-seq数据集可供该物种的任何成员使用安息香科.认识石油成藏的分子基础是发展和加强油气成藏的必要条件美国tonkinensis谷物作为生物柴油的原料。
在油籽中,DE Novo油生物合成,包括脂肪酸(FA)和三酰基甘油(标签)生物合成,需要乙酰基辅作,ATP和还原功率。关键催化酶包括丙酮酸脱氢酶复合物(PDC),乙酰-COA羧化酶(ACC)复合物,脂肪酸合酶(FAS)复合物,和酰基 - COA:DG酰基转移酶(DGAT)[18.那19.那20.].Zhang等[15.]此前表明PDC和ACC活动在发展中支持FA生物合成美国tonkinensisDGAT支持TAG生物合成。这个过程的不同部分被定位在不同的区域;例如,胞质和质体中的糖酵解、质体中的FA生物合成和内质网(ER)中的TAG生物合成[20.].因此,在油籽发育过程中,需要许多跨膜转运体来介导必要代谢物在室间的转移[21那22那23那24].
对石油积累途径的理解美国tonkinensis核的发育需要功能基因、转录因子和跨膜转运体的研究。RNA-seq是下一代测序(NGS)技术之一,广泛用于探索功能基因,构建表达谱和转录调控途径,研究比较和进化基因组学[25那26那27].它为获取非模式植物物种的大规模基因组和转录组数据提供了一种现成、廉价和全面的方法,并已被用于分析木本油料植物积累油脂过程中FA和TAG生物合成的转录组谱和构建概述,如Elaeis Guineensis.jacq。,Prunus SibiricaL.,Pistacia chinensis.Bunge,Symplocos paniculata.miq。,和属glauca(保留&调查。)布卢姆(28那29那30.那31那32].然而,在石油生物合成和代谢的功能基因表达和调控谱美国tonkinensis尚未进行分析。
在本研究中,我们在种子内核发育过程中探讨了基因表达,油含量和FA组成的变化美国tonkinensis在延长的时间课程中。该研究的目的是:(1)在内核发展期间确认油含量和FA组成的动态模式;(2)在通往内核成熟的四个时间点评估转录概况;(3)鉴定编码与FA和标签生物合成相关的重要酶的功能unigenes;(4)确认在开发功能unigenes表示的核中的籽粒中与油积累相关的代谢途径。
结果
油含量和脂肪酸组成的动态模式
在本研究中,我们评估了籽粒发育过程中基于鲜质量和干质量的油浓度动态规律(图。1一种)。在开花(DAF)后60至70天的百分比油含量急剧增加。此后,百分籽油含量随后是80 DAF的峰和籽粒成熟度的上升模式。最终的油含量分别表示约44和56%的籽粒新鲜质量和干肿块。
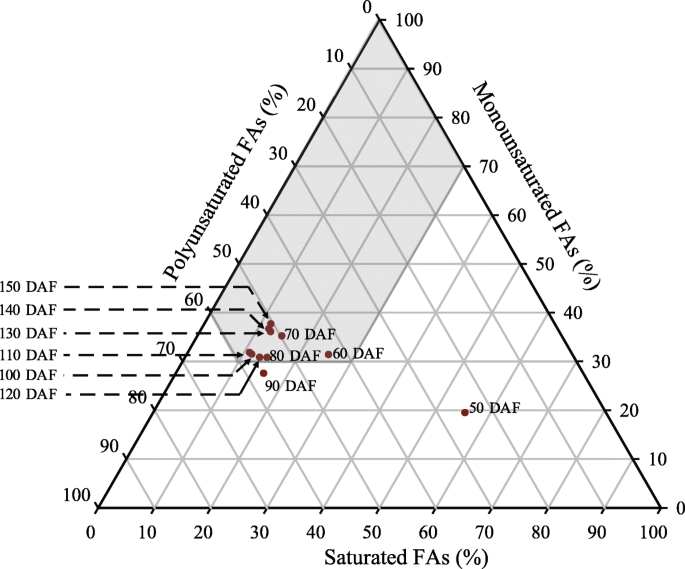
如图1所示。1B,在内核开发期间发生了FA组成。在11个检测到的FAS中,有四个主要的FAS:C16:0(棕榈酸),C18:0(硬脂酸),C18:1(油酸)和C18:2(亚油酸)。它们在最早采样时间(50 DAF)的比例分别为36.2,19.3,19.5和25.1%。100 DAF,C16:0和C18:0降低至10.2和2.5%,C18:1和C18:2分别增加至30.5%和55.8%。其他次要FAS显示出不同的图案,在120dAF中整体峰值(图。1c).饱和、单不饱和和多不饱和脂肪酸的比例变化(图。1d)主要依赖于四种主要的FAs。
生物柴油的燃料特性,包括密度(ρ),运动粘度(η),十六烷值(CN),碘值(IV)和冷过滤器堵塞点(CFPP),根据FA组成进行了预测(附加文件)1).在美国tonkinensis核开发,估计ρ从0.856(90个DAF)到0.868(50 DAF)kg / m3.平均为0.859千克/米3..估计的η从3.35(110个DAF)到3.71(50个DAF)mm2/秒,平均3.42毫米2/ s。CN为47.4 (90 DAF) ~ 56.7 (50 DAF),平均为49.1;IV为71.5 (50 DAF) ~ 122.8 (90 DAF) g/100 g,平均为113.4 g/100 g。估计的CFPP范围为−11.2 (90 DAF)至8.49 (50 DAF)°C,平均为−7.95°C。籽粒成熟期(120 ~ 150 DAF)的ρ、η、CN、IV和CFPP值估计平均值为0.86 kg/m3.,3.40毫米2/ s,48.2,118.3g / 100g和-9.80°C。
序列分析和从头转录组组装
根据图中观察到的含油量和质量的变化。1,以及以往研究中形态和生理指标的相关变化[15.那17.],我们定义了四个阶段的内核开发:初始阶段在含量(50-60dAF)的主要升高之前,升高油含量的活跃阶段(60-80 DAF),第三阶段,油含量下降和高多不饱和Fas(80-120 DAF)和最终成熟阶段,具有稳定的油含量和组成(120-150个DAF)。为了探讨转录的变化,我们在50,70,100和130个DAF下采样这些阶段。由在这四个时间点中的每一个中获得的独立核RNA样品构建三个cDNA文库。
每个RNA-Seq样本分别生成5 GB以上的原始数据。平均72,584,106(97.15%)的干净读是在移除适配器和低质量读之后获得的(表1).使用Trinity软件获得总长度为1146bp和40.45%GC含量的365,312个ContIg。随后,最终环节组装在平均长度为854bp的平均长度产生168,205个unigenes(n50:1437)。在本研究中组装的unigenes的数量与在其他木质植物中的核开发研究中组装的数量相当[29那30.那31那32].我们发现的unigenes中,42.25%(71,071)的长度为200-400bp,32.17%(54,119)为400-1000 bp,15.62%(26,268)为1000-2000 bp,9.96%(6747)超过2000 bp(桌子2).
功能辅助和分类
为了注释和识别推定功能,使用基本的本地对准搜索工具(BLAST)程序对所有组装的unigenes进行注释,以防止具有10的截止值10的五个公共可用的蛋白质数据库−5.总共有74,524(44.30%),63,788(37.92%),60,017(35.81%),49,305(29.31%)和20,424(12.14%)ungenes,其中非冗余蛋白质中已知蛋白质(NR),Swiss-Prot蛋白(Swissprot),基因本体学(GO),局部群(COG)簇,以及基因和基因组(KEGG)数据库的京都百科全书。在所有组装的unigenes中,89,387(53.14%)在五个数据库中的至少一个中有一个显着的爆炸比赛,而14,105(8.39%)在所有数据库中都有很大的命中。然而,剩余的78,818(46.86%)未经突出的批注,因为它们代表了不在数据库中的新型组织特异性基因,或者因为缺乏表征蛋白质结构域的大量短序列(71,071,42.25%)得到爆炸点击。
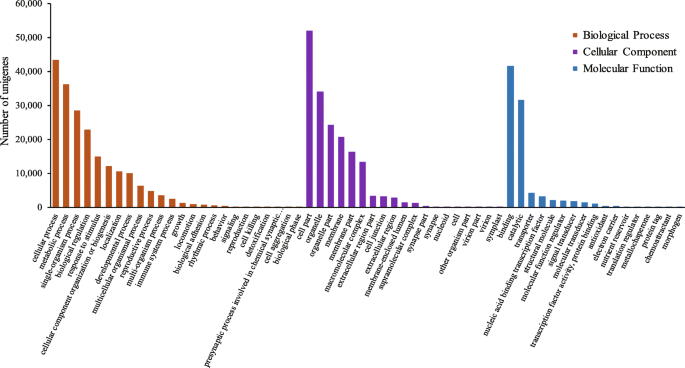
共有60,017个组装的unigenes被分配到三个主要的功能类别(生物过程,细胞组分和分子函数)和60个子类别(图。2).生物过程范畴分为24个子范畴。最丰富的两个子类是“细胞过程”和“代谢过程”,其中包含43,503个unigenes(69.65%)和36285个unigenes(58.10%)。细胞组分类分为19个亚类,其中“细胞部分”的unigenes最多(51,935,83.16%),其次是“细胞器”(34131,54.65%)。分子功能类分为17个子类,其中“结合”子类(41,690,66.75%)和“催化”子类(31,649,50.66%)最为丰富。
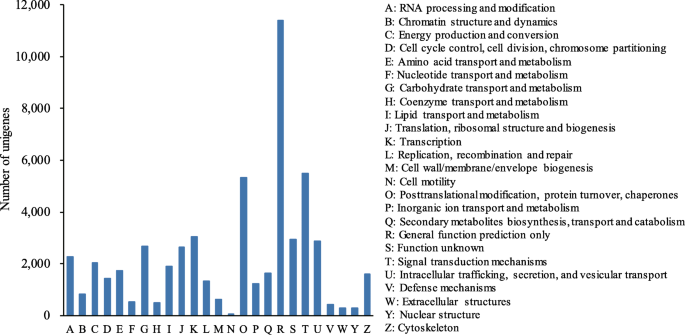
共有49305个unigenes被划分到25个COG分类中,以“一般功能预测”(11,403,23.13%)居多,其次是“信号转导机制”(5485,11.12%)和“翻译后修饰、蛋白质转换、伴侣”(5318,10.79%)(图5)。3.).此外,分配了1889(3.83%)的未成年人分配到“脂质翻译和新陈代谢”中,建议候选人可能与石油积累有关美国tonkinensis内核。
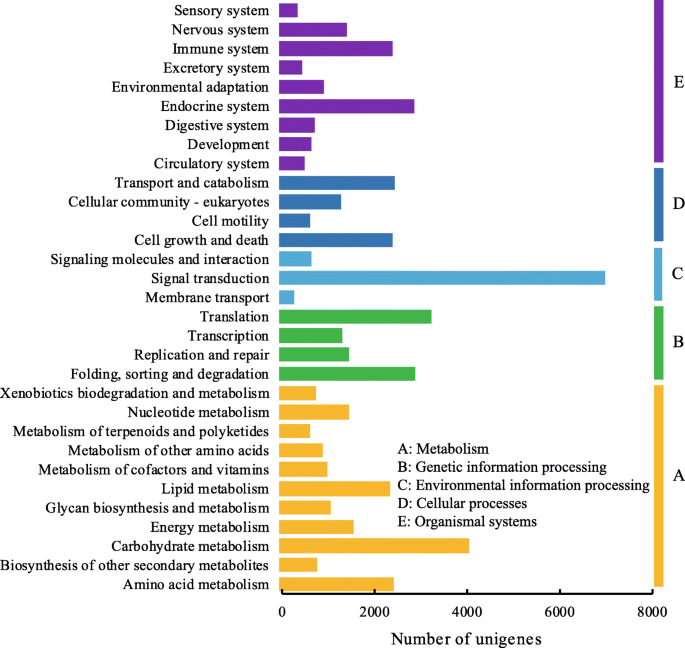
KEGG对组装的unigenes的分类被用来评估转录组文库的完整性和注释过程的有效性[33]并且共有20,424个unigenes被分配为五个Kegg类别,31个子类别和427 kegg路径(图。4.).在20424个unigenes中,约2280个unigenes被定位于17个脂类代谢典型途径中的16个,“二级胆汁酸生物合成”是例外。其中,“甘油磷脂代谢”的unigenes最多(410个),其次是“脂肪酸降解”(299个)、“甘油脂代谢”(269个)和“脂肪酸生物合成”(194个)。此外,与脂质代谢相关的其他途径还有“亚油酸代谢”(80个unigenes)、“脂肪酸延伸”(97个unigenes)、“不饱和脂肪酸的生物合成”(122个unigenes)和“α -亚麻酸代谢”(166个unigenes)。
基因表达分析
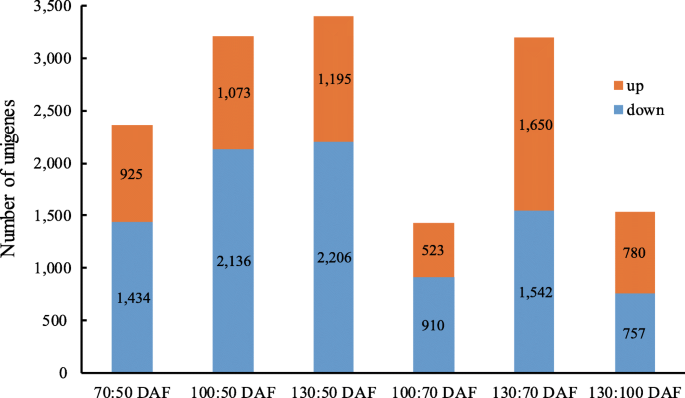
为了研究与油积聚相关的特定基因的动态表达模式,比较来自不同时间点的转录组谱。统计地分析每千乘语百万映射的读取(RPKM)值以使用DESEQ方法选择不同的Unigenes [34].统计不同时间点间上调和下调的单基因(图2)。5.,附加文件2).共有2359个unigenes在50至70dAf之间具有不同的表达模式,具有925个上调的未造成的未造林和1434个下调的unigenes。总共3209个unigenes在100daf(50个Daf为对照)上差异,具有比上调的unigenes(1073)更下调的unigenes(2136)。存在3401个未在50至130个DAF之间具有不同的表达模式,其中包括1195个上调的unigenes和2206个下调的unigenes。总共1433个unegenes在70至100个DAF之间具有不同的表达模式,其中523个上调的unigenes和910个下调的unigenes。总共3192个ungigenes在70%至130个DAF之间表达,具有1650个上调的未造林和1542个下调的unigenes。存在1537个unigenes,其在100至130个DAF之间具有不同的表达模式,其中包括780个上调的unigenes和757个下调的unigenes。
对所有5916个差异表达基因(deg)进行Mfuzz聚类分析,得到9个聚类(附加文件)3.).含有1115℃的簇I主要由unigenes组成,在50至70个DAF之间的表达快速降低,其后仍然低。浓缩群体中的主要途径I焦点对氨基酸,甘油脂代谢和淀粉和蔗糖代谢的生物合成。群体II含有1035°,代表unigenes,从50到100 daf的连续下降趋势。群体II的未成熟是富集的氨基酸,糖酵解/葡糖生成和嘌呤代谢的生物合成的途径。含有839℃的簇III代表了50和70 DAF的表达水平较高的未成年人。群体III中未成语的途径主要集中在脂肪酸生物合成,脂肪酸代谢,糖酵解/葡糖生成,戊糖磷酸盐途径(PPP),内质网,丙酮酸代谢和TCA循环中的蛋白质加工。簇IV和V,分别含有485和580°,在最活跃的油含量的最活跃期间,在70dAF中达到峰值。群体IV富集在unigenes中,用于ABC转运蛋白,氨基糖和核苷酸糖代谢,脂肪酸生物合成和PPP。群体V在70dAF突然比簇IV突然升至峰值,并在甘油磷脂代谢,丙酮酸代谢和酪氨酸代谢中富集植物。 Cluster VI contained 226 DEGs, and represented the unigenes with expression levels that mostly continued to increase from 70 to 100 DAF, as oil accumulation was slowing down. This cluster was mainly enriched in the pathways of glycolysis/gluconeogenesis, pyruvate metabolism and ubiquitin mediated proteolysis. Cluster VII contained 339 DEGs, representing the unigenes that showed a more-or-less gradual increase during all of kernel development and peaking at either 100 or 130 DAF. Cluster VII was enriched in unigenes for alpha-linolenic acid metabolism, glycerolipid metabolism, glycerophospholipid metabolism, purine metabolism and ribosomal proteins. Cluster VIII contained 565 DEGs, representing the unigenes with somewhat up-down-up change trends during kernel development and was mainly enriched in the pathways of fatty acid metabolism, glycolysis/gluconeogenesis, protein processing in endoplasmic reticulum and starch and sucrose metabolism. Cluster IX, containing 731 unigenes, represented the unigenes with complex change trends and lower expression levels at 70 or 100 DAF. The pathway enrichment of unigenes in cluster IX was mainly focused on biosynthesis of amino acids, fatty acid degradation, fatty acid metabolism, glycerolipid metabolism, oxidative phosphorylation, phenylpropanoid biosynthesis, protein processing in endoplasmic reticulum and pyrimidine metabolism.
为验证RNA-Seq结果,采用qRT-PCR分析12个关键基因的相对表达和时间转录谱。这些基因的相对表达量与RPKM的比较比值具有很好的一致性(附加文件)4.).因此,RNA-Seq揭示的核单基因动态表达模式是可靠的。
与丙酮酸和乙酰辅酶组合相关的unigenes
代表糖浆途径中的关键酶的未成熟和与丙酮酸和乙酰-COA形成相关的磷酸磷酸盐途径(PPP)包括ATP依赖性磷酸溶酶(PFK,EC:2.7.1.11),酰磷依赖性磷化氢酶(PFP,EC:2.7。1.90),丙酮酸激酶(PK,EC:2.7.1.40),乙酰-CoA合成酶(ACS,EC:6.2.1.1),葡萄糖-6-磷酸脱氢酶(G6PD,EC:1.1.1.49),6-磷葡萄糖脱氢酶(PGD,EC:1.1.1.44)和PDC,包括丙酮酸脱氢酶(PDC E1-α和PDC E1-β,EC:1.2.4.1),二氢丙基酰胺晶丙烯酶(PDC E2,EC:2.3.1.12)和二氢甲基酰胺脱氢酶(PDC E3,EC:1.8.1.4)。
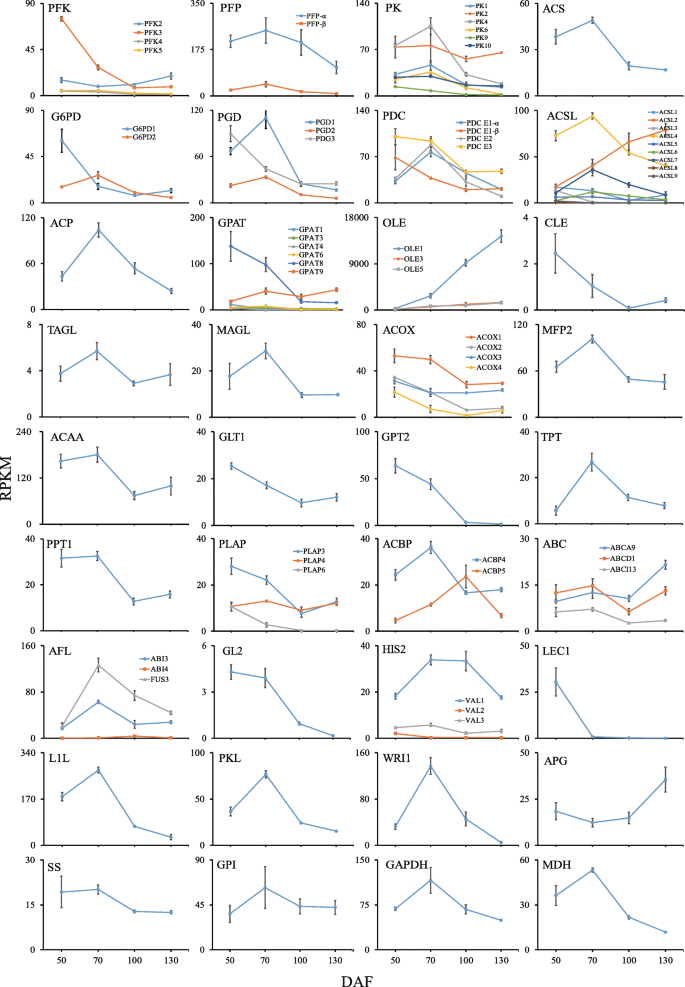
共鉴定到10个编码PFK的ungenes,其中2个为PFK2, 4个为PFK3, 2个为PFK4, 2个为PFK5。共鉴定出9条与PFP相关的ungenes,其中6条为PFP-α, 3条为PFP-β。共发现23条编码PK的ungenes,其中PK1 9条,PK2 6条,PK4 4条,PK6 1条,PK9 1条,PK10 2条。此外,鉴定出3条编码ACS的非基因,22条编码PDC的4个亚基,其中2条编码PDC E1-α, 5条编码PDC E1-β, 8条编码PDC E2, 7条编码PDC E3。共鉴定出7个编码G6PD的ungene (G6PD1 4个,G6PD2 3个)和5个编码PGD的ungene (PGD1 2个,PGD2 1个,PGD3 2个)。对于每个蛋白,选择RPKM值最高的unigene来检测随时间的表达水平(附加文件5.).所选的ungenes显示了两种主要的表达模式(图。6.),在50个DAF(pfk3那g6pd1那PGD3.那pdc E1 -β和PDC E3),或70 DAF (亲那PK.那ACS.那g6pd2那pdg1那pdg2那pdc E1 -α和PDC E2).所有这些unigenes在最后两个时间点(100和130 dAf)处具有相对低的表达水平。
蔗糖转化为三酰基甘油的相关unigenes和转录因子的动态模式。数据是三个生物重复的±SD。缩写:FPK,ATP依赖性磷化氢酶;PFP,焦磷酸依赖性磷化氢酶;PK,丙酮酸激酶;ACS,乙酰CoA合成酶;G6PD,葡萄糖-6-磷酸脱氢酶;PGD,6-磷葡萄糖酸脱氢酶;PDC,丙酮酸脱氢酶复合物;ACSL,长链酰基COA合成酶; ACP, malonyl-acyl carrier protein; ACBP, acyl-CoA binding protein; GPAT,sn-G3P酰基转移酶;Ole,Oleosin;CLE,塞勒斯汀;ACOX,酰基 - COA氧化酶;MF2,Enoyl-CoA水解酶/ 3-羟基乙酰-COA脱氢酶;ACAA,乙酰-CoA酰基转移酶;TAGL,三酰基甘油脂肪酶;Magl,单酰基甘油脂肪酶;glt1,糖脂运输司机;TPT,三糖磷酸盐转运蛋白; GPT2, glucose-6-phosphate transporters; PPT1, phosphoenolpyruvate transporters; PLAP, plastid-lipid-associated protein; ABC, ATP-binding cassette transporters; ABI3, abscisic acid insensitive 3; ABI4, abscisic acid insensitive 4; FUS3, fusca3; GL2, glabra 2; HSI2/VAL1, high-level expression of sugar-inducible gene 2; HSIL1/VAL2, HSI2-like1; HSIL1/VAL3, HSI2-like2; LEC1, leafy cotyledon 1; L1L, LEC1-like; PKL, pickle; WRI1, wrinkled 1; APG, glucose-1-phosphate adenylyltransferase; SS, starch synthase; GPI, glucose-6-phosphate isomerase; GAPDH, glyceraldehyde 3-phosphate dehydrogenase; MDH, malate dehydrogenase
与脂肪酸生物合成相关的ungenes
鉴定了涉及FA生物合成的酶的所有未成年人,包括乙酰基辅羧基化酶(ACC,EC:6.4.1.2;三个亚基:ACC:羧基转移酶(ACCA),生物素羧基载体蛋白(ACCB)和生物素羧酸酯(ACCC)),Malonyl-CoA-ACP蛋白酶(MAT,EC:2.3.1.39)和FAS复合物(3-氧代酰基-ACP合酶I(KASI,EC:2.3.1.41),3-酮酰基-ACP合成酶II(KASII,EC:2.3.1.179),3-酮酰基-ACP合成酶III(KASIII,EC:2.3.1.180),3-酮酰基-ACP还原酶(KAR,EC:1.1.1.100),3-羟基乙酰-ACP脱水酶(EC:4.2.1.59)和ENOYL-ACP还原酶(EAR,EC:1.3.1.9))。此外,鉴定了参与FA延长和去饱和度的酶的未成合:SteAROYL-ACP去饱和酶(SAD,EC:1.14.19.2),酰基-ACP硫代酯酶(FAT,EC:3.1.2.14),长链酰基-COA合成酶(ACSL,EC:6.2.1.3),溶血磷脂酰胆碱酰基转移酶(LPCAT,EC:2.3.1.23),脂肪酸去饱和酶2(FAD2,EC:1.14.19.6)和磷脂酶A2(PLA2,EC:3.1.1.4)。
共发现9个编码ACC的ungenes,其中3个编码accA, 3个编码accB, 3个编码accC。38个ungene被鉴定为FAS成分的必要辅助因子,其中KAS 20个(KASI 6个,KASII 5个,KASII 9个),KAR 8个,HAD 3个,EAR 7个。发现了6个编码SAD的ungenes。鉴定了8个编码FAT的ungenes (FATA 2个,FATB 6个)和21个编码ACSL的ungenes (ACSL1 3个,ACSL2 3个,ACSL3 1个,ACSL4 7个,ACSL5 1个,ACSL6 3个,ACSL7 1个,ACSL8 1个,ACSL9 1个)。3个ungenes编码FAD2, 5个编码LPCAT1, 7个编码PLA2。通过功能注释分析鉴定了8个与ACP相关的unigenes。分析了参与FA生物合成的酶的非基因表达趋势(图。6.).除KAR和PLA2外,所有FA生物合成unigenes的动态表达模式均与丙酮酸和乙酰辅酶a形成相关unigenes相似,且在第二个时间点(70 DAF)达到表达高峰。这FATB.unigene在晚期低表达(100和130 DAF),而fad2早期低表达(50 DAF)。
与三酰基甘油和油体生物合成有关的Unigenes
鉴定了5种与三酰基甘油(TAG)生物合成相关的酶:甘油激酶(GK, EC: 2.7.1.30);sn-G3P酰基转移酶(GPAT, EC: 2.3.1.15)、溶血磷脂酰酰基转移酶(LPAT, EC: 2.3.1.5)、酰基辅酶a:DAG酰基转移酶(DGAT, EC: 2.3.1.20)、磷脂:甘油二酰基转移酶(PDAT, EC: 2.3.1.158)。我们鉴定了2个编码GK的基因,13个编码GPAT(4个编码GPAT1, 2个编码GPAT3, 1个编码GPAT4, 3个编码GPAT6, 1个编码GPAT8, 2个编码GPAT9), 18个编码LPAT(5个编码LPAT1, 5个编码LPAT2, 3个编码LPAT4, 5个编码LPAT5), 7个编码PAP。鉴定了9个DGAT基因和7个pdatat基因(6个PDAT1基因和1个PDAT2基因)。与TAG生物合成相关的unigenes变化趋势复杂(附加文件)5.).GK在内核开发过程中呈下降趋势,GPAT在70 DAF处呈上升-下降-上升趋势。LPAT和PAP的变化趋势相似,在70 DAF处达到峰值,而PDAT和DGAT分别在100和130DAF处达到峰值。
分析了编码油体膜蛋白(OLE),亚葡聚糖(CLE)和杀虫素(SLES)的unigenes。鉴定了编码OLE的九个unigenes(对于OLE1,两个用于OLE3的六个,以及用于OLE5的六个),但仅发现一个未编码CLE的ULE,而且为SLE。随着内核开发,ole1.表达水平连续增加,但其他百建合较低,并且没有显得太大变化。
与脂肪酸和三甘油酯降解代谢相关的Unigenes
与FA和标签的unigenes有关,包括两种标签脂肪酶(三酰基甘油脂肪酶(Tagl,EC:3.1.1.3)和单酰基甘油脂肪酶(Mag1,EC:3.1.1.1.23)和β-氧化途径的三种核心(酰基-COA氧化酶(ACOX,EC:1.3.3.6),ENOYL-COA水解酶/ 3-羟基乙酰-COA脱氢酶(MFP2,EC:4.2.1.17,1.1.1.1.1.1.1.1.35,1.1.1.1.211)和乙酰-COA酰基转移酶(ACAA,EC:2.3.1.16))。我们确定了编码TAGL,两个编码的Magl,九个编码ACOX(ACOX1,ACOX2的四个,ACOX3的四个,ACOX4的四个),四个编码MFP2和三个编码ACAA。该这些unigenes的表达模式在核开发中早期达到50或70dAf(图。6.).
与跨膜转运蛋白、转录因子和碳分配相关的ungenes
我们发现了5个糖酵解代谢产物跨膜转运蛋白和2个不同细胞器之间的FA或酰基- coa交换蛋白的unigenes;即糖脂转运体(GLT)、葡萄糖-6-磷酸转运体(GPT)、磷酸三糖转运体(TPT)、磷酸烯醇丙酮酸转运体(PPT)、质体脂相关蛋白(PLAP)、酰基辅酶a结合蛋白(ACBP)和atp结合盒转运体(ABC)。本研究共鉴定出5个、9个、29个、5个和11个编码GLT1、GPT2、TPT、PPT1和PLAP的非基因(PLAP3 6个、PLAP4 3个、PLAP6 2个)。表达水平的glt1那GPT2.那plap3,plap6最高达50 DAF,而TPT,PPT1,plap4最高达70 DAF(图。6.).ACBP共发现6个ungenes(3个为ACBP4, 2个为ACBP5), ABC共发现7个ungenes(1个为ABCA9, 5个为ABCD1, 1个为ABCI13)。的表达acbp4在70 DAF的峰值,而acbp5达到100ddaf。他们三个ABC.unigenes在内核开发过程中显示了上下的变化趋势(图。6.).
鉴定为编码相关转录因子(TFS)的unigenes包括脱落酸不敏感3(abi3),脱落酸不敏感4(abi4),fusca3(fus3),glabra 2(gl2),糖诱导基因2的高水平表达(HSI2/ Val1),HSI2样1(HSIL1 / VAL2),HSI2样(HSIL2 / VAL3),叶状子叶1(LEC1),LEC1样(L11),叶状子叶2(LEC2),泡菜(PKL)和皱纹1(wri1)。发现二十一根unigenes,其中11种TFS(属于六个家庭),包括ABI3(两个unigenes),Abi4(一个Unigene),Fus3(一个Unigene),GL2(一个Unigene),HSI2 / Val1(三个unigenes),HSIL1 / VAL2(两个unigenes),HSIL2 / VAL3(两个unigenes),LEC1(一个UNIGENE),L1L(一个UNIGENE),PK1(五个未填充)和WRI1(两个ungenes)。然而,没有unigenes向LEC2表现出同源性。在这些TFS中,ABI3,ABI4,HSI2 / VAL1,L11,PK1和WRI1的unigenes在70dAF中具有峰值表达,而GL2和LEC1的未成亮于50dAF(图。6.).FUS3的unigenes,HSIL1 / Val2和HSIL1 / Val3在整个内核开发中具有低表达水平。
分析了糖氧化途径中与碳分配相关的5种酶:葡萄糖-1-磷酸腺苷转移酶(APG, EC: 2.7.7.27)、淀粉合酶(SS, EC: 2.4.1.21)、葡萄糖-6-磷酸异构酶(GPI, EC: 5.3.1.9)、甘油醛- 3-磷酸脱氢酶(GAPDH, EC: 1.2.1.12)和苹果酸脱氢酶(MDH, EC:1.1.1.37)。共鉴定出9个、7个、5个、4个和7个编码APG、SS、GPI、GAPDH和MDH的非基因。除APG外,其余均在70 DAF处有非基因表达高峰(图。6.).
讨论
发展中的油脂积累与生物柴油燃料性能评价美国tonkinensis内核
含油量是评估生物柴油原料潜力的主要因素[4.那9.].以前的研究表明,完全成熟的油含量美国tonkinensiskernel的范围从58.6到63.0% [9.那14.那15.],它高于许多其他油厂,包括L. glauca.(31.6%),P. Chinensis.(35.1%),j . curcas(39.8%),和Vernicia fordii.(Hemsl)。艾里肖(40.0%)[32那35那36那37].以干质量为基础的含油量动态格局呈现出上升-下降-上升的趋势,在80和140 DAF处达到峰值。这些数据相对于淡水质量的转换,基于Zhang等人在相应时间的水分含量[15.],导致一种非常相似的模式(ρ = 0.936,P.< 0.01)。60 ~ 70 DAF籽粒含油量的快速增加与籽粒生物量快速增长的启动相一致。此后,在已知籽粒生物量稳步增长的时期[15.,含油量波动(图。1一种)。但是,考虑到含量和尺寸,预计140个DAF将最大的油产量。
除了数量,原料质量,如不饱和Fas的比例所示,尤其是C18:1和C18:2,至关重要[38那39].在籽粒发育过程中,籽粒的主成分稳定,与前人的分析结果非常吻合美国tonkinensis仁油(15.,其中C18:1和C18:2合计占总FA含量的86%。考虑到130 DAF的含油量和组成均相对稳定,最佳采收时间为美国tonkinensis内核将与最大产量相对应,其在140 daf达到[15.].
重要的生物柴油燃料特性,包括密度(ρ),运动粘度(η),十六烷数(CN),碘值(IV)和冷过滤器堵塞点(CFPP)是用于利用木质生物柴油物种的关键指标,并且可以预测从原料的FA组成[9.那32那40].为了美国tonkinensis在本研究中,估计的平均ρ, η, CN, IV和CFPP值在籽粒成熟期为0.86 kg/m3.,3.40毫米2/s 48.2, 118.3 g/100 g和−9.80°C(附加文件1).当饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸的百分比在三角形预测模型的阴影区域内时,指标CN、IV和CFPP被认为是满足的。7.)[40].除50和90 DAF外,核FA成分始终在该区域。Wu et al. [9.]先前已经表明美国tonkinensis成熟籽仁油符合中国生物柴油标准(GB/T 20828)、欧盟生物柴油标准(EN 14214)、德国生物柴油标准(DIN V51606)、美国生物柴油标准(ASTM D6751)。在本研究中,对成熟油的ρ、η和IV值进行了测定美国tonkinensis内核符合所有四个标准,而CN和CFPP则分别符合ASTM D6751和DIN V51606的标准。
聚类分析
根据unigenes的功能注释和分类以及KEGG通路分配[31那33,鉴定了多个编码油脂积累关键酶的ungenes。所有在不同采样日期间差异表达的ungene,无论路径分配如何,根据它们的时间表达模式分为9个簇(附加文件)3.).这些簇在整个内核发育过程中表现出不同的表达模式,但在相关通路和过程方面也有显著的时间重叠。例如,聚类I和II代表50 DAF高表达的deg,富集于与氨基酸生物合成相关的deg中,而与FA生物合成相关的deg主要富集于III和IV聚类,主要富集于70 DAF高表达的ungene中。这些模式与蛋白质积累开始早于FA积累是一致的[15.].
与标记生物合成相关的段主要发现在簇V,VII和IX中。簇V和VII代表了具有相对于簇III和IV延迟的高表达水平的未成年体,但与群体IX的储油没有明确的时间关系。此外,在核发发育过程中,其表达改变趋势最佳地恰逢核心开发期间的籽油积累的上下趋势,其表达改变趋势在糖醇分析/葡糖生成,淀粉和蔗糖代谢和内质网的蛋白质过程中明显富集,而不是FA或标记生物合成。这些糖酵解/葡糖生成和淀粉和蔗糖代谢相关的未成语可能涉及提供基材以支持FA生物合成的两相。
丙酮酸和乙酰辅酶组形成
为了支持FA生物合成,蔗糖,在大多数植物中运输的主要形式的糖,分解成果糖和葡萄糖,以通过糖浆途径产生丙酮酸[19.那21那41].在该途径中的三种酶,PFK,PFP和PK,在丙酮酸的形成中发挥关键调节作用[21那29].丙酮酸用于通过PDC直接产生乙酰-CoA,并且AC也可以通过利用来自乙醛制备的丙酮酸制备的醋酸乙烯酯来生产乙酰基辅辅酶。此外,PPP从G6PD开始平行于糖醇分解,同时还通过PDG向NADP提供脂肪酸生物合成[19.那21].
酶PFK和PFP均催化果糖-6-磷酸的磷酸化,糖酵解的首个承诺步骤,但PFK在胞质溶胶和体层中被鉴定,而PFP仅限于塑植[28那42].同时,G6PD1位于胞质,其表达模式与PFK相似,而G6PD2位于质体,其表达模式与PFP相似。这些表达模式与胞质和质体中磷酸己糖的存在一致。大多数编码PK的ungenes的动态模式与亲,包括PK1那PK2.那pk4, pk6和pk10,这限制了塑体。质量性PDC E1-α和PDC E2的unigenes具有类似的模式,如ACs,表明乙酰-CoA可以由两种不同的途径形成,这与结果形成鲜明对比P. Sibirica这表明对ACS的作用不太重要[29].像pfk,并符合P. Sibirica,非体积PDC E1-β和PDC E3的unigenes的表达模式从50个DAF向下趋向于向下趋向。与丙二酸途径中的丙酮酸和乙酰辅酶组合相关的大多数未在前两个时间点(50个DAF和70个DAF)处具有更高的表达水平,表明在早期阶段期间更加强调这些初级基材的形成美国tonkinensis内核开发。
脂肪酸的生物合成和油脂积累
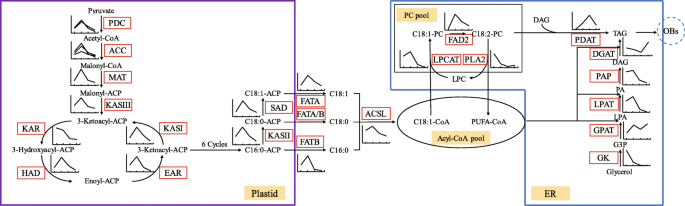
本文从油脂生物合成和积累的关键酶入手,对籽粒发育过程中油脂积累过程进行了综述(图2)。8.).来自乙酰辅酶的前体的DE Novo FA生物合成在塑性化中发生,并在催化Fas复合物催化的每个缩合反应循环中加入两种碳单位到丙二醇 - 酰基载体蛋白(ACP)中[43那44那45].作为第一个承诺的钥匙和速率限制酶,转化为丙酮 - CoA [29].垫将丙酰基-COA转化为丙二酰基-ACP,其是后续缩合反应系列的初级基质[45].在每个缩合循环中,FAS复合物向丙二酰- acp增加两个额外的碳单元[46]分别在六个或七个循环后产生棕榈酸-ACP(16:0-ACP)或硬脂酸-ACP(18:0-ACP)。另外,难度转化为18:0-ACP至油酸-ACP(18:1-ACP)。然后,FAT释放来自ACP的免费FA;具体而言,FATA从C18:1-ACP发布F18:1,并且FATB免于C16:0-ACP的FATB免除C16:0,而FATA或FATB可以从C18:0-ACP释放C18:0。塑体酯化酯的外膜上的ACS1,以产生酰基-CoA池[19.那47].之后,一些酰基 - COA将与甘油-3-磷酸(G3P)结合形成标签,而其他酰基 - 特别是C18:1-COA将进入磷脂酰胆碱(PC)池,并酯化以通过LPCAT形成酰基-C.在PC池中,FAD2将C18:1-PC转换为C18:2-PC,额外的基板用于标签生物合成[31那46].PLA2回收PC至溶血磷脂酰胆碱(LYSO-PC)[46].
油积累途径概述和颞型表达模式。伴随酶的图标显示了相关unigenes的表达趋势。缩写:PDC,丙酮酸脱氢酶复合物;Acc,乙酰-CoA羧化酶;垫子,丙二酰基-Co-ACP蛋白酶;Kasi,3-氧代酰基-ACP合成酶I;Kasii,3-酮酰基-ACP合成酶II;Kasiii,3-酮酰基-ACP合成酶III;kar,3-酮症-ACP还原酶;有,3-羟基乙酰-ACP脱水酶; EAR, enoyl-ACP reductase I; SAD, stearoyl-ACP desaturase; FATA, acyl-ACP thioesterase A; FATB, acyl-ACP thioesterase B; ACSL, long-chain acyl-CoA synthetases; LPCAT, lysophosphatidylcholine acyltransferase; FAD2, fatty acid desaturase 2; PLA2, phospholipase A2; GK, glycerol kinase; GPAT,sn-G3P酰基转移酶;LPAT,溶血磷脂酰酰基转移酶;PAP,磷脂酸磷酸盐酶;DGAT,酰基 - COA:DAG酰基转移酶;PDAT,磷脂:二酰基甘油酰基转移酶
在本研究中,大多数FA生物合成unigenes的动态表达模式与丙酮酸和乙酰辅酶a形成相关的unigenes相似;然而,根据碳从糖到油的流动,在某些情况下,FA生物合成相关酶(如MAT、HAD、EAR和SAD)的表达水平从50 DAF上升到70 DAF,比丙酮酸和乙酰辅酶a形成相关的unigenes更明显[15.那19.].FATB的unigenes,负责自由饱和的FA释放的主要酶,在最后两个时间点(100和130个DAF)的表达水平低,与实际的FA型材(特别是C16:0和C18:0)一致,在无花果。1湾FAD2的unigenes,负责不饱和FA生物合成中的去饱和的主要酶[48[表现出50至70dAF的表达水平的快速上升,然后稍后的相对缓慢的下降,与实际的FA型材(CF.,相对于50至70dAF的不饱和的不饱和的增加。1b, d).识别StFAD2会对基因工程有用吗美国tonkinensis用于生产种子油最佳用于生物柴油燃料特性。
标签是油籽中的主要形式的碳储存。从G3P的前体的De Novo标签生物合成通过肯尼迪途径发生在ER中[20.那49].标签储存在由脂质单层和相关的油体膜蛋白包围的油体中,包括OLE,CLE和SLE,从ER中释放到细胞质中[50那51].GPAT作为Kennedy途径中第一个被授权的关键酶,催化G3P酰化形成溶血磷脂酸(LAP)sn1的位置(52].LPAT催化LAP酰化形成磷脂酸(PA)sn2的位置。PAP将PA转化为二酰基甘油(DAG)。在此之后,限速酶DGAT和PDAT催化DAG的酰化sn-3用酰基-CoA或acyl-pc形成标签[47那53].此外,G3P由甘油经GK转化而成[31].
在13中GPAT.unigenes,持续表达gpat9在美国tonkinensiskernel提示GPAT9是TAG生物合成的关键初始酰基转移酶[29那53].相比之下,gpat8,参与Cutin Biosynthesis [54],在内核发育(50和70个DAF)的早期强烈表达。与PC,PA和DAG生物合成相关的unigenes,如lpcat.那fad2那pl2,GK.那gpat9那LPAT2.,PAP.而与TAG生物合成相关的unigenes如dgat和PDAT2,达高峰较晚(100 DAF或130 DAF)。6.和8.).的最大表达式PDAT2和dgat分别为100和130 DAF(图1)。8.),表明TAG的生物合成是通过甘迺基途径与酰基辅酶a的DGAT和PC池中的酰基-PC的PDAT完成的[31那55].
随着在核发育过程中累积的FA和标签,与油脂合成相关的unigenes(ole1.那ole3.和ole5.),从而形成油体,并急剧而稳定地上调(图。6.).其中的表达水平ole1.是非常高的。相比之下,继续教育在整个内核开发过程中,表达量仍然很低。这些模式与报道的种子籽粒发育结果一致P. Sibirica[29].表达模式ole1.与Zhang等报道的籽粒发育过程中可溶性总蛋白含量的变化非常相似[15.].
脂肪酸和三酰基甘油降解和代谢
在高等植物中的碳和能量缺乏期间,标签水解以释放自由的Fas和甘油,这对于细胞能量平衡,脂质稳态,膜增殖,细胞生长和存活至关重要[56].有两种TAG脂肪酶,TAGL和MAGL,负责大部分油的分解[31那56].释放的游离FAs和/或酰基辅酶a酯在乙醛酸循环和糖异生中通过β-氧化途径与三种核心酶(ACOX, MFP2和ACAA)转化为乙酰辅酶a [57].在美国tonkinensis,与FA和标签劣化和代谢相关的未成年体的表达模式在70dAF下具有峰(图。6.),类似于与FA和TAG生物合成相关的主要单基因。因此,TAG途径中3种重要酶DGAT、PDAT和TAGL的ungenes的表达模式不一致,提示有机会进行基因克隆和修饰,以提高细胞的油脂含量和质量。ACOX1在长链和中链酰基辅酶as的去饱和中都有活性,ACOX2针对长链酰基辅酶as,在核发育早期就显示出高的单基因表达水平,这表明游离FA(特别是C16:0和C18:0)可能被分解提供乙酰辅酶a,这是产生能量的关键代谢物。
参与油脂积累的跨膜转运体和转录因子
一般来说,植物糖酵解发生在胞质和质体中,而FA和TAG生物合成分别发生在质体和ER中[43那45].因此,糖酵解中间体和FA在不同细胞器之间的交换是必要的。几种高度选择性的塑性转运体,包括GLT、GPT、TPT、PPT和PLAP,将胞质中产生的糖酵解代谢物运输到质体进行质体糖酵解[19.那21那24那29那58].ACBP和ABC可能是与FA或酰基辅酶a转移相关的转运体[23那59].在本研究中,表达水平glt1和GPT2.最高达50 DAF,而课程的和ppt1在70 DAF中最高,后者显示出类似于在显影核中的糖醇与糖醇相关的unigenes类似的图案(图。1和6.).这些RPKM水平和模式表明FA生物合成的主要碳源美国tonkinensis尽管相对较高,但核是源自脓肿外的磷酸己糖的三代磷酸酯。亲所有采样点的表达式。PLAP6的表达,可能与质体形成有关[60],在很大程度上仅限于早期的阶段。ACBP4和ACBP5作为酰基 - COA酯的细胞内载体的unigenes的表达水平[59[均均通过70〜100 DAF持续,表明它们在油积累期间将酰基COA运输到ER。对于ABCA9的未核果,也将FA或acyl-CoA运输到ER中[23[最后一次点,在70个DAF的比例下有一个小峰,但验证ABCA9以及ACBP4和ACBP5,当储存脂质在开发内核中积累时起着重要作用。
根据以往的研究,TFs在种子油的合成和沉积中起着积极或消极的作用[61那62那63那64那65].在本研究中,ABI3、ABI4、HSI2/VAL1、L1L、PKL和wr1的表达模式表明,它们在石油生物合成的调控基因中发挥积极作用,而其他转录因子可能是消极或模糊的调控因子。其中,wr1表现出与PK.那PDC.那ACC.那内那悲伤的,fad2,与其作为中枢调节剂的功能一致,该功能指导碳通量从糖酵解到FA生物合成的种子油积累[65那66].在之前的调查中也看到了类似的结果大肠guineensis和P. Sibirica[28那29].
内核开发过程中的碳竞争
在显影种子中,碳分配决定了最终的淀粉/石油平衡[44].Zhang等[15.]建议在脂肪酸和淀粉生物合成期间存在碳竞争美国tonkinensis内核开发。他们发现,在40至60个DAF之间,总可溶性糖浓度从120升至200mg / g fw,但随后将其降至大约90dAf的初始水平,其保持直至核成熟。同时,淀粉浓度在30至80dAF之间保持低(约3mg / g fw),但是开始稳定地增加至18mg / g fw。这种现象可能是由一系列与糖氧化相关的一系列酶的组合作用,例如APG,SS,GPI,GAPDH,MDH和PDC。这些酶的未成根的表达模式类似于早期研究中报告的各自活动的变化[15.].SS、PDC和ACC的unigenes与淀粉或脂肪酸的生物合成有关,峰值在70 DAF。然而,随后的表达水平下降PDC.和ACC.在100daf和130 DAF时,比为更明显党卫军,这可能有利于玉米籽粒发育中后期淀粉积累的碳通量。
结论
在本研究中,籽粒含油量在发育过程中呈上下向上的积累模式,分别在80和140 DAF处有两个峰值,而FA组成相对稳定。成熟种子籽粒油具有良好的生物柴油燃料性能。因此,如果在开发完成时收获籽粒,油的数量和质量都将最大化。选择4个时间点进行进一步转录组分析,共成功组装和注释了168,205个unigenes。根据表达模式将差异表达的ungene分为9个簇。与石油积累相关的ungenes有三种主要的表达模式。大多数编码脂肪酸生物合成相关酶的unigenes在70 DAF达到峰值,处于油脂含量快速增加的尖端。在籽粒生长过程中,这些ungenes的表达量下降,而油的合成则维持在较低水平。Unigenes在50 DAF时达到峰值或相对高表达,往往与质体形成和细胞质中油合成的早期阶段有关,如丙酮酸和乙酰辅酶a形成(直接由丙酮酸形成,间接通过乙醛)。说明FA生物合成的主要碳源是来源于质体外磷酸己糖的三磷酸。 Relatively few unigenes peaked at 100 or 130 DAF, but notable exceptions were unigenes associated with TAG biosynthesis and oil body development. TAG biosynthesis is likely accomplished both by DGAT via the Kennedy pathway and by PDAT from the PC pool. Expression patterns were also consistent with some carbon competition for starch accumulation at middle to late stages of kernel development, as reported by Zhang et al. [15.].
这是对开发中的石油积累相关的基因转录组和序列信息的第一次综合分析美国tonkinensis内核。本研究结果将为进一步深入探讨该生物柴油对油脂积累的调控机制奠定重要基础,并可为其他潜在生物柴油品种提供参考。
方法
植物材料和RNA提取
这美国tonkinensis本研究使用的植物(江西吉水)由江苏国兴股份有限公司于2011年购入,种植于安息香科南京六合区(北纬32°32′,东经118°50′),在自然条件下生长。2017年5月初,对15棵树进行了取样。从7月15日开始(50 DAF),每10 d随机采集新鲜水果。剥去果仁和种皮后,立即用液氮冷冻,在−70℃下保存直至使用。在65°C的烤箱烘干后72 h和权衡,含油量和足总成分,包括饱和的比例,单不饱和脂肪酸和多不饱和FA,测定在索氏提取器再加上气相色谱分析-质谱法(GC / MS),使用方法之前被Zhang et al。15.].根据Wang等人的研究,生物柴油的燃料特性包括密度(ρ)、运动粘度(η)、十六烷值(CN)、碘值(IV)和冷过滤器堵塞点(CFPP)等。40]并使用三角预测模型表达,基于饱和,单不饱和和多不饱和酸的百分比[40].
来自四个代表性时间点的核粒用于比较深层转录组分析。每个时间点有3个生物复制,每个复制由5个不同的树木汇集的材料组成。根据制造商的说明,使用Plant RNA Kit (Omega Bio-Tek, Doraville, GA, USA)提取总RNA。使用1%琼脂糖凝胶和Nanodrop nd2000分光光度计(Nanodrop Technologies, Wilmington, DE, USA)评估总RNA的数量和质量。使用Bioanalyzer 2100 RNA 6000 Nano Kit (Agilent Technologies, Santa Clara, CA, USA)评估总RNA的完整性和浓度。
cDNA图书馆建设和测序
根据制造商说明,使用Oligotex mRNA Mini Kit (Qiagen, Inc., Valencia, CA, USA)从总RNA中分离poly(A) mRNA。cDNA文库的构建和归一化采用Niu等人先前描述的方法[29].12个cDNA文库在Illumina Hiseq 4000测序平台(Illumina, Inc., San Diego, CA, USA)上测序,得到150 bp的配对序列。原始数据通过去除低质量序列(50% Q < 19个碱基的读值)、适配器污染序列和碱基读值不明确占5%以上的序列来处理。通过Trinity软件(Trinity Release v2.4.0, Broad Institute of MIT and Harvard, Cambridge, MA, USA)将干净的reads组装成unigenes [67].
unigenes的功能注释
为了解其功能,将组装的unigenes与包括NCBI非冗余蛋白(NR)、Swiss-Prot蛋白(SwissProt)、Gene Ontology (GO)、Clusters of Orthologous Groups (COG)、NCBI非冗余蛋白(NR)、Swiss-Prot蛋白(SwissProt)、geneontology (GO)、和京都基因和基因组百科全书(KEGG),使用基本局部比对搜索工具(BLAST),截断e值为10−5[68].
ungenes的表达分析
unigenes的表达水平被计算为每千碱基百万映射读取(RPKM)的读数,这消除了测序深度和基因长度对基因表达水平的影响,并通过DESEQ方法进行直接数据比较[69].计算与籽油积累相关代谢途径相关的ungenes的表达水平。对不同时间点间的差异进行了识别P.adj. < 0.05 and |log2 (foldchange value) | ≥ 1 [69].使用Mfuzz进行聚类分析[70[基于所有已识别的DEG的表达式图案进行(https://www.omicsolution.org/).
QRT-PCR验证
选择与油积累相关的12个unigenes通过定量实时PCR(QRT-PCR)进行验证。扩增引物由Primer Premier 5.0软件(Premier Biosoft International,Palo Alto,CA,USA)设计。根据制造商的说明,使用Sybr Green Dye(Takara,大连,中国)的Sybr Green Dye(Takara,Ca,USA)对所有反应进行所有反应。通过2计算相对基因表达-ΔΔct18S核糖体RNA作为内部对照的方法[32].本研究中使用的所有引物列于其他文件中6..
可用性数据和材料
SRR8832448, SRR8832449, SRR8832450, SRR8832451, SRR8832452, SRR8832453, SRR8832454, SRR8832455, SRR8832456, SRR8832457, SRR8832458和SRR8832459的登录号码在NCBI序列读取归档(SRA) (https://www.ncbi.nlm.nih.gov/bioproject/prjna530204).本研究中分析的所有数据都包含在本发布的文章及其补充信息文件中。
缩写
- 美国广播公司(ABC):
-
ATP结合盒式磁带传送器
- ABI3:
-
脱落酸不敏感
- ABI4:
-
脱落酸不敏感
- ACAA:
-
乙酰-CoA酰基转移酶
- ACBP:
-
酰基-CoA结合蛋白
- ACC:
-
乙酰-CoA羧化酶
- ACOX:
-
酰coa氧化酶
- ACP:
-
酰基载体蛋白
- ACS:
-
乙酰辅酶a合成酶
- ACSL:
-
长链酰基-CoA合成酶
- AGP:
-
葡萄糖-1-磷酸亚苯甲酰转移酶
- 爆炸:
-
基本的局部比对搜索工具
- C16:0:
-
棕榈酸
- C18:0:
-
硬脂酸
- C18:1:
-
油酸
- C18:2:
-
亚油酸
- CLE:
-
Caleosin
- COG:
-
局部群体的簇
- DAF):
-
几天后开花
- 表演:
-
二酰基甘油
- DGAT:
-
酰基CoA:DAG酰基转移酶
- 耳朵:
-
Enoyl-ACP还原酶
- 呃:
-
内质网
- 费尔南多-阿隆索:
-
脂肪酸
- FAD2:
-
脂肪酸desaturase2
- FAS:
-
脂肪酸合酶
- 胖的:
-
Acyl-ACP thioesterase
- Fus3:
-
Fusca3.
- G3G:
-
Glycerol-3-phosphate
- G6PD:
-
Glucose-6-phosphate脱氢酶
- GAPDH:
-
甘油醛3-磷酸脱氢酶
- GC:
-
鸟嘌呤 - 胞嘧啶
- GC / MS:
-
气相色谱分析-质谱法
- GK:
-
甘油激酶
- GL2:
-
Glabra 2.
- glt:
-
醣脂类转运蛋白
- 走:
-
基因本体论
- GPAT:
-
sng3p酰基转移酶
- 谷歌价格指数:
-
Glucose-6-phosphate异构酶
- GPT:
-
葡萄糖-6-磷酸转运蛋白
- 有:
-
3-羟基乙酰-ACP脱水酶
- HSI2 / VAL1:
-
糖诱导基因2的高水平表达2
- HSIL1 / VAL2:
-
HSI2-like1
- HSIL2 / VAL3:
-
HSI2-like2
- 冰斗:
-
3-酮症-ACP还原酶
- KASI:
-
3-oxoacyl-ACP合成酶我
- KASII:
-
3-酮酰基-ACP合成酶II
- KASIII:
-
3-ketoacyl-ACP合酶3
- Kegg:
-
Kyoto基因和基因组的百科全书
- L1L:
-
LEC1样
- 膝盖:
-
溶血磷脂酸
- LEC1:
-
叶状鹅卵石1
- LPAT:
-
Lysophosphatidyl酰基转移酶
- LPCAT:
-
Lysophosphatidylcholine酰基转移酶
- MAGL:
-
单酰基甘油脂肪酶
- 垫:
-
丙二酰基CoA-ACP蛋白酶
- MDH:
-
苹果酸脱氢酶
- MF2:
-
Enoyl-CoA水合酶/ 3-hydroxyacyl-CoA脱氢酶
- NCBI:
-
国家生物技术信息中心
- ngs:
-
新一代测序
- NR:
-
非冗余蛋白质
- OLE:
-
Oleosin
- PA:
-
磷脂酸
- 人民行动党:
-
磷脂酸phosphohydrolase
- 个人电脑:
-
磷脂酰胆碱
- PDAT:
-
磷脂:二氨基甘油酰基转移酶
- PDC:
-
丙酮酸脱氢酶复合物
- PFK:
-
ATP-dependent磷酸果糖激酶
- 亲:
-
焦磷酸依赖性磷化氢酶
- PGD:
-
6-phosphogluconate脱氢酶
- PK:
-
丙酮酸激酶
- PKL:
-
泡菜
- PLA2:
-
磷脂酶A2
- PLAP:
-
Plastid-lipid-associated蛋白质
- PPT:
-
磷酸丙酯运输司
- QRT-PCR:
-
定量实时聚合酶链反应
- rpkm:
-
读数每千票万映射读数
- SLE:
-
杀虫剂
- SRA:
-
短读存档
- SS:
-
淀粉合成酶
- 标签:
-
三酰甘油
- 塔尔:
-
三酰甘油脂肪酶
- TF:
-
转录因子
- 课程:
-
磷酸丙糖转运蛋白
- WRI1:
-
皱纹1
参考文献
- 1。
Saqib M, Mumtaz MW, Mahmood A, Abdullah MI.优化生物柴油生产和生产生物柴油环境评价。生物技术生物过程工程。2012;17:617-23。
- 2.
朗X,达赖AK,巴克希NN,雷尼MJ,赫兹PB。生物柴油的制备与表征。Bioresour抛光工艺。2001;80:53 - 62。
- 3.
Bušić A, Kundas S, Morzak G, Belskaya H, Marđetko N, Ivančić Šantek M,等。生物柴油和沼气生产的最新趋势。生物技术。2018;56:52 - 73。
- 4.
阮C,邢W,蒂西拉达席尔瓦JA。五种植物在非生产性农业土地上生长的潜力作为生物柴油资源。更新能源。2012; 41:191-9。
- 5.
Haas MJ, McAloon AJ, Yee WC, Foglia TA。生物柴油生产成本估算的过程模型。Bioresour抛光工艺。2006;97:671-8。
- 6.
Pinyopusarerk K。Styrax Tonkinensis.分类、生态学、造林和用途。ciar技术报告第31号。堪培拉:尼泊尔共产党出版;1994.20页。
- 7.
Hieu PS,Thuy VH,Thuan Pd,van lt。越南木材和木材加工产品统计数据的主要特点。小规模。2011; 10:185-98。
- 8.
作者介绍了一种新型的抗肿瘤药物,它是一种新型的抗肿瘤药物。苯偶姻香化学成分的新认识。食品化学。2016;210:613-22。
- 9。
吴庆科,费晓荣,高艳,陈超,曹媛媛,于飞。8种生物柴油植物的燃料特性比较分析斯泰克斯SPP。中国油脂。2019; 44:27-30(中文)。
- 10.
徐丽,于飞。花冠结构与芳香成分Styrax Tonkinensis..树木。2015; 29:1127-34。
- 11.
吴庆科,吴永利,于飞。不同科的苗木生长变化Styrax Tonkinensis..J南京为一个大学。2018; 42:191-6(中文)。
- 12.
Phuong LX,Shida S,Saito Y.热处理对脆性的影响Styrax Tonkinensis.木头。中国林业科学(英文版)2007;53:181-6。
- 13.
王飞,华华,裴艳,陈东,景宇Styrax Tonkinensis.及其在人白血病HL-60细胞中的抗增殖和分化作用。J Nat Prod. 2006; 69:807-10。
- 14.
刘国宝,黄刚成,刘玉强,杜tz,李百娇。果油的提取Styrax Tonkinensis.生物柴油的制备。江西农业大学学报,2007;29:685-9。
- 15.
关键词:苯偶姻,种子,成熟期,脂肪酸,淀粉,碳竞争树木。2017;31:1025-39。
- 16.
张志强,罗勇,王旭东,于芳。喷施24-表油菜素内酯和遮荫对水稻果皮光合作用和种子脂质积累的影响Styrax Tonkinensis..J工厂增长调节。2018; 37:1066-84。
- 17.
张Z,罗y,王X,yu f.定量时尚血油体超微结构有助于验证苯并素胚乳和胚胎细胞中的明显脂质沉积图案。森林。2018; 9:265。
- 18.
脂质生物合成。植物细胞。1995;7:957 - 70。
- 19.
植物碳通量与脂肪酸合成。脂质研究进展2002;41:182-96。
- 20。
Bates Pd,Stymne S,Ohlrogge J.种子油合成中的生化途径。CurrOp植物BIOL。2013; 16:358-64。
- 21。
安德里奥提斯,克鲁格,派克,史密斯。发育中的拟南芥胚的质体糖酵解。新植醇。2010;185:649 - 62。
- 22。
Knappe S,Lottgert T,Schneider A,Voll L,Flugge U,Fischer K.两个功能性磷酸丙酮酸/磷酸盐镀膜器的表征(PPT)基因在Arabidopsis-AtPPT1可能与为正确的叶肉发育提供信号有关。植物j . 2003; 36:411-20。
- 23。
Li N,Xu C,Li-Beisson Y,Philippar K.植物细胞中脂肪酸和脂质运输。趋势植物SCI。2016; 1:145-58。
- 24。
金志强,山冈勇,小野浩,金浩,沈达,Maeshima M,等。AtABCA9转运体为内质网的脂质合成提供脂肪酸。美国国立科学院。2013; 110:773-8。
- 25。
等。基因组分析工具包:用于分析下一代DNA测序数据的MapReduce框架。基因组研究》2010;20:1297 - 303。
- 26。
Morozova o,Marra Mar。下一代测序技术在功能基因组学中的应用。基因组学。2008; 92:255-64。
- 27。
Goodwin S,McPherson JD,McCombie WR。到世:十年的下一代测序技术。NAT Rev Genet。2016; 17:333-51。
- 28。
张志强,张志强,张志强,等。碳分配差异显著的油棕和枣椰树中果皮的转录组和代谢产物比较分析。美国国家科学研究院2011;108:12527-32。
- 29。
牛建军,安军,王丽,方超,哈德,付晨,等。转录组分析揭示了西伯利亚杏发育过程中油脂动态积累的机制Prunus Sibirica木质生物柴油开发之种子粒。Biotechnol生物燃料。2015;8:29。
- 30.
董某,刘y,xiong b,jiang x,张z.潜在生物能量树的转录组分析,Pistacia chinensis.Bunge,以及参与石油生物合成的候选基因的鉴定。生物能源研究》2016;9:740-9。
- 31.
刘强,孙勇,陈静,李鹏,李超,牛刚,姜玲Symplocos paniculata.水果。BMC基因组学。2016;17:929。
- 32.
林志,安军,王静,牛军,马超,王磊,等。454和Illumina转录组测序的综合分析特征碳通量和能量来源的脂肪酸合成正在发展属glauca木质生物柴油的果实。Biotechnol生物燃料。2017; 10:134。
- 33.
Ogata H, Goto S, Sato K, Fujibuchi W, Bono H, Kanehisa M. KEGG:京都基因和基因组百科全书。核酸Res. 1999; 27:29-34。
- 34.
基于RNA-Seq的哺乳动物转录组的定位和定量研究。Nat方法。2008;5:621-8。
- 35。
王L,Yu H,他X.中国四种木质生物柴油植物植物燃料特性评估。SCI SILV SIN。2012; 48:150-4。
- 36.
Wen Y,Tang M,Sun D,Zhu H,Wei J,Chen F等人。气候因子和土壤类型对种子重量和油含量的影响麻风树图中国广西。环境科学学报。2012;12:439-44。
- 37.
詹志,陈勇,肖基,韩旭,王宇。桐树的蛋白质组学分析(英文)Vernicia fordii.)在发育阶段的油籽。分子。2016; 21:1486。
- 38.
Ramos MJ, Fernández CM, Casas A, Rodríguez L, Pérez Á。原料脂肪酸组成对生物柴油性能的影响。Bioresour抛光工艺。2009;100:261-8。
- 39.
Reddy Anr,Saleh Aa,伊斯兰教Ms,Hamdan S,Rahman Mr,Masjuki HH。脂肪酸成分对影响的实验评价麻风手套生物柴油理化性质。J Renew Sustain Energy. 2018;10:13103。
- 40.
关键词:木质生物柴油,脂肪酸组成,燃料性能燃料化学学报,2012;40:397-404。
- 41.
波特S,Boutin JP,Miquel M,Lepiniec L,Rochat C.综合概述种子发展拟南芥,生态型ws。植物理性生物化学。2002; 40:151-60。
- 42.
Plaxton Wc。植物糖酵解的组织和调节。Annu Rev植物植物植物Mol Biol。1996年; 47:185-214。
- 43。
Topfer R,Martinijn,Schellt J.植物脂质合成的改性。科学。1995年; 268:681-6。
- 44。
林y,cluettebrown je,Goodman HM。过氧化血组缺乏拟南芥突变体SSE1.显示脂肪酸合成受损。植物杂志。2004;135:814-27。
- 45。
Chan di,Vogel HJ。目前对脂肪酸生物合成和酰基载体蛋白的理解。Biochem J. 2010; 430:1-19。
- 46。
Riezman H.脂肪酸合成的长短短而缺乏。细胞。2007; 130:587-8。
- 47。
王磊,沈伟,陈光,陈强,等。中甘油脂合成的肯尼迪途径与陆地循环之间的代谢相互作用拟南芥发展的种子。植物细胞。2012;24:4652 - 69。
- 48。
陈永春,崔青青,徐永军,杨树生,高敏,王东东.桐油籽粒FAD2和DGAT2基因对不饱和脂肪酸积累的影响rhodotorula glutinis.和拟南芥.基因组学杂志。2015;290:1605-13。
- 49。
陈建明,齐伟伟,王少英,管荣洲,张海生。甘蓝型油菜肯尼迪途径效率与籽粒含油量的相关性(芸苔属植物显著l .)线。acta botanica yunnanica(云南植物研究)2011;91:251-9。
- 50。
Napier Ja,Stobart Ak,Shewry Pr。植物油体的结构和生物发生:ER膜和油蛋白类别蛋白的作用。植物mol biol。1996年; 31:945-56。
- 51.
Frandsen GI, Mundy J, Tzen JTC。油体及其相关蛋白,油苷和钙苷。杂志。2001;112:301-7。
- 52.
Frentzen M,Heinz E,Mckeon Ta,Stumpf PK。甘油-3-磷酸酰基转移酶和单酰基甘油-3-磷酸二烷基转移酶的特异性和选择性豌豆和菠菜叶绿体。EUR J Biochem。1983; 129:629-36。
- 53.
Shockey J, Regmi A, Cotton K, Adhikari N, Browse J, Bates PD。拟南芥的识别GPAT9.(AT5G60620)作为参与三酰基甘油生物合成的基因。植物理性。2015; 170:163-79。
- 54.
Gidda SK,鞋跟JM,Rothstein SJ,Dyer JM,Mullen Rt。拟南芥GPAT8和GPAT9本地化为ER并具有明显的ER检索信号:植物细胞中Dilysine ER检索基序的功能分歧。植物理性生物化学。2009; 47:867-79。
- 55.
张敏,范建平,刘志强。DGAT1和PDAT1酰基转移酶功能重叠拟南芥三酰基甘油的生物合成和是正常花粉和种子发育所必需的。植物细胞。2010;21:3885 - 901。
- 56.
徐传春,李建林。三酰基甘油在植物营养组织中的代谢、功能和积累。植物生物学学报。2016;67:179-206。
- 57.
种子贮藏油的分解代谢:一个给予和索取的故事。植物生态学报。2012;15:322-8。
- 58.
质体包膜的溶质转运。植物学报2005;56:33 - 64。
- 59。
关键词:拟南芥,脂酰辅酶a, ACBP4, ACBP5, kelch基序acta botanica sinica(云南植物学报),2004;55:497 - 497。
- 60。
Singh DK, Maximova SN, Jensen PJ, Lehman BL, Ngugi HK, McNellis TW。FIBRILLIN4是苹果和拟南芥质体发育和抗逆性所必需的。植物杂志。2010;154:1281 - 93。
- 61。
关键词:小麦,籽油产量,籽油产量FUSCA3芸苔属植物显著突变体植物。植物生理生化。2015;96:222-30。
- 62。
Elahi N,Duncan Rw,Stasolla C.在Canola种子中改变油和葡萄糖苷含量的改变甘蓝型油菜叶状子叶.植物理性生物化学。2016; 100:52-63。
- 63.
波特S,Lepiniec L.种子油生产的生理和发育调节。Prog Lipid Res。2010; 49:235-49。
- 64.
Tan H,Yang x,Zhang F,Zheng X,Ch C,Mu J等。通过条件表达增强油菜籽的种子油生产甘蓝型油菜叶状子叶和LEC1-LIKE在发展种子。植物理性。2011; 156:1577-88。
- 65.
吴晓丽,刘振华,胡振华,黄忠。BnWRI1协调油菜籽油积累过程中脂肪酸的生物合成和光合作用途径。acta botanica yunnanica(云南植物研究),2014;
- 66.
邓淑英,麦日特,水丽,牛健。WRINKLED1转录因子调控了碳分配对西伯利亚杏籽粒C18:1(油酸)积累的调控。Sci众议员2019;9:2693。
- 67。
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I,等。没有参考基因组的RNA-Seq数据的全长度转录组组装。生物科技Nat》。2011;29:644-52。
- 68。
张建军,张志强,张志强,等。gap BLAST和PSI-BLAST:新一代蛋白质数据库搜索程序。核酸Res. 1997; 25:3389-402。
- 69。
Anders S,Huber W.序列计数数据的差异表达分析。基因组Biol。2010; 11:106。
- 70。
Kumar L, Futschik ME。Mfuzz:用于微阵列数据软聚类的软件包。信息学手段。2007;2:5-7。
致谢
感谢纪晓月先生(南京林业大学高级分析测试中心)的GC/MS技术支持。我们也感谢王继华先生(江苏国兴有限公司)的提供Styrax Tonkinensis.种子。
资金
这项工作得到了南京林业大学博士学位基金,国家自然科学基金(3197140894)和由江苏高等教育机构(PAPD)的优先学术计划开发资助的项目。资助者在研究和收集,分析和解释的设计中没有作用,以及编写手稿。
作者信息
隶属关系
贡献
QW和FY设计了这项研究。QW进行所有实验并分析数据。YC,CC和ZG参与样品收集并进行QRT-PCR测定。QW,FY和RDG写了稿件。作者阅读并批准了最终手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
额外的文件1。
预测发展的生物柴油燃料特性美国tonkinensis内核。
额外的文件2。
不同时间点的差异表达基因(DEGs)列表。
额外的文件3。
使用Mfuzz聚类分析所有的差异基因。红、绿、蓝三种颜色表示基因变化与簇的主要变化之间的匹配程度。红、绿、蓝分别代表高、中、低匹配度。
额外的文件4。
RNA-Seq对瞬时单基因表达模式的验证。面板显示12个关键基因(以50 DAF为对照)的相对表达量和RNA-Seq(以50 DAF为对照)的RPKM值(accC那垫那有那kasI那kasII那悲伤的那FATA.那FATB.那ACP.那gpat9那dgat那PDAT2).这些结果证实了accC那垫那有那内那悲伤的,胖的对于fa生物合成,和dgat和PDAT2表达量分别为70DAF和100 ~ 130 DAF。
额外的文件5。
石油富集相关关键基因的注释与表达。
附加文件6。
qRT-PCR引物序列。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
吴,q.,曹,y。,陈,c。等等。油菜籽粒发育中油脂积累相关代谢途径的转录组分析Styrax Tonkinensis.是木质生物柴油种类。BMC植物杂志20,121(2020)。https://doi.org/10.1186/s12870-020-2327-4
收到了:
公认:
发表:
关键词
- Styrax Tonkinensis.
- 生物柴油
- 油藏
- 代谢途径
- 转录组分析