抽象的
背景
射击架构从根本上对作物的生长和生产力很重要。作为射击架构的关键组成部分,已知植物高度由遗传和环境因素控制,尽管具体细节仍然稀缺。
结果
在本研究中,来自核心收集的308条代表大豆线和168 F.9.大豆后代种植在不同的田间场地。结果证明存在显着的基因型×环境相互作用(G×e)对天然大豆群中植物高度相关的性状的影响。总共含有用于植物高度的51个QTLS(定量特质轨迹)的19个基因座,在四个环境中识别,23,13和15是SH(拍摄高度),SNN(STEM节点数)和AIL(平均节电长度)的QTL, 分别。从2.50到16.46的显着LOD解释了2.80-26.10%的表型变异。有趣的,只有两个基因座,LOC11.和LOM19-1,包含20个QTL,在所有环境中同时检测到。Pearson相关性分析和PCA(主要成分分析)的结果显示,五种农业气象因素和四种土壤性质中的每一个显着影响大豆植物高度特征,并且相应的QTL具有添加剂效应。在显着的环境因素中,AD(平均日长),amat(平均最高温度),pH和(可用氮)对大豆植物高度的影响最大。因此,尽管有无法控制的农气气象因素,但大豆射击架构可能通过组合努力重塑以产生优质大豆遗传物质,同时还优化土壤性质。
结论
总之,本文概述的环境因子、大豆基因型和qtl在株高效应中的综合关系为通过改善茎型来提高大豆产量的研究开辟了新的途径。
背景
随着世界人口不断增加,农业供给足够的食物的需求将为可预见的未来留下巨大挑战[1].人们常常强调,提高作物产量是应对不断增长的人口的粮食供应挑战的潜在解决方案[2那3.].现场规模的植物特征,例如植物密度和耐植物抗性,是许多作物的谷物产量的关键决定因素。因此,理想的拍摄架构被认为是许多作物最重要的育种目标之一[4.那5.].理想射击架构的关键组成部分是植物高度。在水稻,小麦和玉米中,较短的茎长度通过改善对植物的抗性而导致更高的产量[6.那7.那8.那9.那10.].例如,在20世纪60年代和70年代,亚洲各地广泛将半矮秆品种纳入小麦和水稻育种项目,这是引领绿色革命的一个重要因素[11.那12.那13.].在大豆中,有利的射击架构被认为是许多高产的半矮种品种的重要组成部分,例如Hobbit87,Charleston和Apex [8.那9.].目前,商业大豆品种的最佳高度一般为70-90厘米,林分越矮或越高会导致产量下降[14.那15.那16.那17.].简而言之,现有证据强烈表明,理想的茎结构往往取决于合适的植株高度,但这仍有待于开发高产新品种。
作为特征性的定量性状,植物高度在遗传背景中显示出显着的变化[18.那19.].传统的育种过程是时间和劳动力消耗努力,而在现代育种计划中,已成功应用于许多作物的标记辅助选择(MAS)允许快速选择所需的特征[20.].因此,在MAS努力中探索更多的遗传资源,可能会加快培育适宜株高和最佳产量的大豆的进程。迄今为止,在许多作物中已经鉴定出许多与株高相关的qtl,并通过图位克隆鉴定出若干相应的基因。此外,这些基因中的一部分已被证明在多个育种项目中发挥了关键作用[7.那21.].例如,绿色革命基因,sd1(半矮人),与缩短的水稻植物有关,在那里它也提高了封闭性抗性[22.].同时,众所周知的小麦矮化基因,rht.(减少高度)在全球商业小麦品种的70%中发现了赋予抗衰子抵抗和增加分配的抗性和增加的分配,以70%的商业小麦品种21.那23.].此外,过表达ZmPIN1a玉米中的(销形成的蛋白质)显着降低了植物高度,节间长度和耳朵高度,所有这些都导致射击在高密度栽培条件下茁壮成长的架构[24.].最后,对植物高度负责的其他QTL或基因进行了充分的功能,包括QDH1.那QDTH8,D18(矮人18.),D61.(61年矮),BRD1.(芸苔类固醇依赖性1),HTD2.(高分蘖和矮人2),IPA1(理想的工厂建筑),mph1.(植物高度的MyB样基因1),SLR1.(纤细的米饭1), 和SDD(T)(优势半矮人)[7.那25.那26.那27.那28.那29.那30.那31.].在大豆中,20个染色体中有239个、37个和28个qtl分别与株高、茎节数和节间长相关。https://www.soybase.org)。在这些QTL中,两个基因座,DT1.(不确定生长1),DT2.(半决生生长2),已经与大豆射击建筑和最终谷物产量有关。现有的证据表明DT1.(确定增长1),DT2.通过终止根尖生长,协同调控茎的发育,导致株高和茎节数下降[20.那32.那33.那34.那35.].
超越遗传效果,作物射击建筑也受到环境条件的大大影响[36.].例如,可以促进主干的伸长率,而在低光强度条件下抑制侧芽的生长[5.].另外,大多数植物生理过程仅在0-40℃的温度范围内保持活性。然而,最佳温度在不同的生理过程中变化,例如,18°C被报告为番茄干延伸的最佳夜间温度[37.].作为一种伴随的短日植物,大豆受日常长度和温度的影响,两者也在拍摄建筑的形成中发挥着关键作用[38.那39.那40].例如,暴露于短纬度地区的短光周期和高温的大豆通常表现出早开花,营养生长短期,植物高度短,以及产量的重大减少[41.那42.].同时,已经鉴定了几种感觉基因座或赋予光周期敏感性的感觉基因座或基因,并克隆了大豆,最值得注意的是E1.-E9.(早开花和成熟),j(长少年轨迹)[43.那44.那45.那46.那47.那48.那49.].然而,尽管有很多关于光周期对大豆芽结构影响的报道,但仅有少数实验涉及温度效应。除气象因素外,土壤特性也会影响作物的枝条结构。众所周知,作物需要一系列合适的营养物质来满足生长发育的需要。然而,大多数农业土壤不能提供足够数量的所有必要的养分来满足高产作物的需求,所以农民继续依赖施肥。目前收集到的证据表明,主要肥料元素N、P和K可能在枝条结构发育中起作用。例如,在棉花、小麦和水稻中,施氮通过形成更长的节间节段而增加株高,但不会增加节数[7.那50.那51.].相比之下,K施肥显着降低了节水长度[52.那53.].
大豆是食物和饲料的石油和蛋白质的主要来源[54.那55.]但在全球平均产量低于其他谷物作物的产量低,如米饭,玉米和小麦2].根据发布的数据,2016年,北部和南美洲的三个国家发生了81.3%的全球大豆产量,包括美国,巴西和阿根廷。另一方面,中国是大豆最大的消费者,尽管中国仅占全球大豆生产的3.57%[56.].在中国,主要大豆生产区包括六个不同地区[57.,每个地区的土壤性质都不同于其他地区。华南地区大部分土壤属于酸性土壤类型,pH值较低,营养条件较差,这与巴西和阿根廷的土壤条件相似[41.那42.那56.那58.].来自黄淮海地区的土壤和长江盆地中下游往往具有比华南同行更高的pH值和更可用的营养素,这使得它们类似于美国发现的许多土壤类型[56.那59.].尽管在其他地方发现的中国土壤和土壤之间存在这些相似之处,但尽管中国农民在田间施用丰富,但有时肥料过多,但中国平均大豆产量(1.8吨- 1)远低于美国获得的平均收益率(3.51吨- 1)、阿根廷(3.02吨公顷- 1),或巴西(2.91吨公顷- 1)[56.].这些情况表明,土壤性质和施肥量都不是限制我国大豆产量的因素。这表明,肥料管理可能是将大豆产量提高到与主要大豆生产国报告的产量一致的关键因素,而肥料管理通常被中国农民和育种家所忽视。此外,过量施肥常常导致大豆的产量显著下降,可能是由于不良的茎型发育导致植株更高,植株更大,产量更少,抗倒伏能力更弱[60.].因此,阐明土壤性质,特别是营养物供应的影响,因此可以帮助育种者和农民实现较低的投入成本的产量。此前,大豆遗传资源已被广泛研究大豆射击架构特征的变化(例如,植物高度,节点数和节点长度)。然而,关于遗传和环境影响的信息对大豆射击架构的信息仍然很大程度上是未知的。为了解决这个问题,含有168 f的重组近交系数(RIL)人口9.在4种不同的环境条件下,研究了与3个茎型性状相关的qtl的存在。进一步分析qtl与重要环境因子的相关性。本研究结果可为培育既能适应不同土壤健康特性又能适应不同土壤健康特性的大豆品种提供参考。
结果
基因型×环境相互作用对大豆植物高度特征的影响
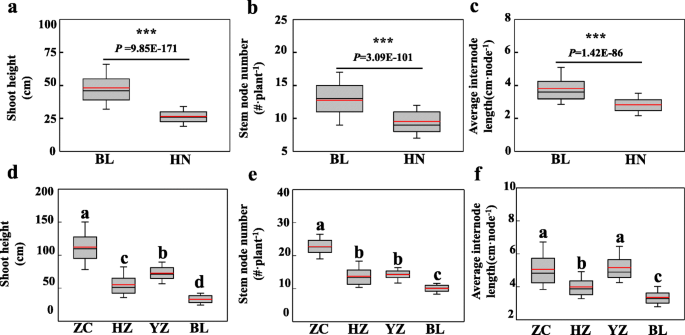
为了评估G×E是否在天然大豆种群中的影响植物高度,来自核心大豆种质收集的308个代表品种[61.]在博罗(114.29°E, 23.17°N)和海南(109.48°E, 18.31°N) 2个不同的试验点进行种植。与株高相关的3个性状:SH、地上部高;SNN,茎节数;和AIL,平均节间长度)。在这些试验中,BL的SH、SNN和AIL的平均值分别比HN高81.46、34.05和36.24% (P.值<0.001)(图。1a,b和c)。这证明了大豆的植物高度在两个不同的环境之间显着变化。此外,遗传分析表明,根据三个重复计算的峰值和偏斜值,在两种环境中测量的三种测试性状的分布大致正常(表1)。广泛的感人遗传性(H2B.)对于测试环境下的所有特征,从0.74到0.92变化,对于SH而言,对于其他两个特征,均较高的值(表1)。无论特征之间的这些相对较小的差异如何,本文的结果清楚地表明,SH,SNN和AIL的变异主要依赖于单一环境中的基因型效应。然而,跨位置H2B.对于SH,SNN和AIL之间的范围为0.38和0.40,所有这些都显着低于各个环境。在一起,这些结果强烈表明Sh,SNN和AIL都受到基因型和环境的大大影响。为了进一步确定G×E,执行双向ANOVA。正如预期的那样,结果表明,SH,SNN和AIL非常受影响(P.价值<0.001)通过环境,基因型和G×e(表2)。然而,环境本身包括许多因素,包括温度,天长,降水,土壤性质等。要排序,通过这些无数的环境影响,我们进一步评估了几种主要环境因素的影响,以及QTLS和QTL×环境(QTL×e)对测试的特征。以这种方式分析特定的环境因素可能有助于育种大豆,针对特定的环境条件套装优化的射击架构。
重组自交系中的表型变异
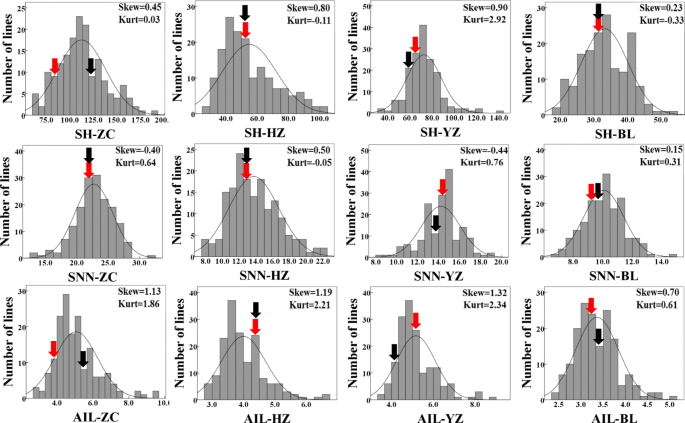
鉴于上述植物高度实验中鉴定的大豆鉴定的G×E的患病率,因此选择了两个代表性的大豆载体,用于开发旨在在大豆中更充分地探索QTL×e的RIL群体。此外,在扩展的四个地理上不同的生长环境中进行现场表征。在这些试验中,祖先系的植物高度特征,BX10具有基因型E1E2E3E4E9DT1DT2TOF11TOF12J和bd2具有基因型E1E2E3E4E9DT1DT2TOF11TOF12J,在4个测试环境中差异显著,SH的观测范围为33.56 ~ 122.00,SNN的观测范围为9.63 ~ 23.00,AIL的观测范围为3.43 ~ 5.27(表1)3.)。虽然各种环境中的父母在父母之间没有观察到的显着差异,但来自RIL群体的数据呈现出父母极端的最大值和最小值,并且根据计算的三种环境测试的特征的大多数分布均致大致正常。计算超过三次重复(图。2)。这些结果表明大豆植物高度特征是典型的定量性状,父母均含有一种或多种基因,朝向测试的性状造成含量造成的贡献。当分开观察到位点时,SH,SNN和AIL的平均值分别在33.20-112.39,1.07-22.70和3.36-5.06的范围内显着变化(图。1d,e,f和表3.)那暗示环境因素对测试性状的巨大影响。此外,ANOVA结果表明,rils之间观察到的变异,rils之间的变异受环境和基因型的显着影响,单独或互动条款(P.值<0.001)(表4.)。这与从使用核心收集种质品种获得的结果一致(表2)。总体而言,本文的结果表明观察到的RIL群体适合进一步分析。
株高性状qtl的鉴定
由3319个重组箱标记物组成的高密度遗传联系地图已经使用先前研究中产生的RIL群体构建[62.].为了识别重要的QTL,为每个RIL线计算特征平均值。随后的QTL分析鉴定了总共19个具有51个QTL的有效基因座,用于三个测试的特征,分别与SH,SNN和AIL相关的23,13和15个QTL。这些QTL的LOD值范围从2.50到16.46,并解释了2.80-26.10%的表型变异(附加档案1:表S1)。在环境中,在赵县(ZC,114.48°E,37.50°N),杭州(Hz,120.69°E,30.51°N),阳中(YZ,118.20°E,分别为26.17°N)和BL场部位。但是,只有两个基因座,LOC11.和LOM19-1,在四个不同的环境中的每一个中识别出共20个QTL。有趣的是,添加剂效应LOC11.衍生自BX10和BD2,分别在两个南部(包括YZ和BL)和两种北部(ZC和HZ)实验站中确定。此外,七个基因座(QTL)仅针对四个测试环境之一观察到的单个特征。其他基因座有助于两个或多个特征和/或至少两个环境的变化(附加文件1:表S1)。这些QTL的显著数量变化和加性效应的程度表明,大豆株高QTL可能在一定程度上取决于位点内存在的特定环境条件,从而导致株高受基因型、环境和G × E的影响。
QTL在各种环境条件下对大豆植物高度特征的贡献
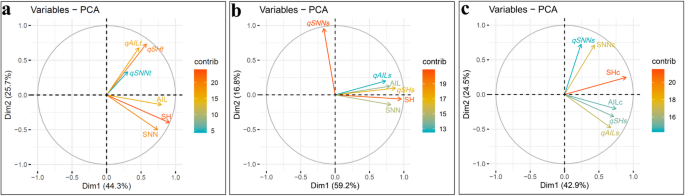
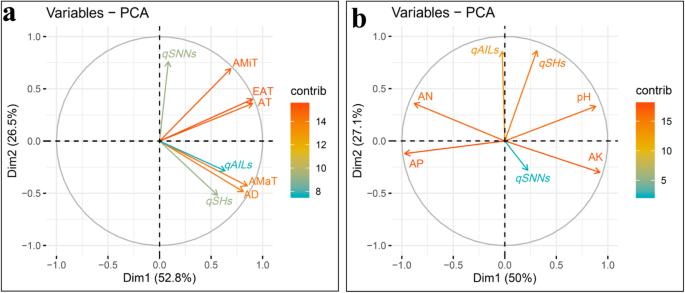
为了探讨检测到QTL对植物高度特征的贡献的稳定性,QTL和来自四个测试环境的植物高度数据受到主成分分析(PCA)。在这种情况下,前两个主要成分分别占总性别变异和QTL添加剂效应的44.3和25.7%(图。3.一种)。与植物高度(SH,SNN和AIL)相关的特征倾向于组合在一起,表明它们之间的相关性高。相比之下,植物高度特征的总添加剂QTL效应(即QSHT.那QSNNT.和qAILt)分别倾向于组,在方向向量中观察到几乎90°角的程度(图。3.a),这表明这些效果独立起作用。这些结果表明,检测到的QTL没有完全解释在各种环境中观察到的植物高度特征的变化程度,因此这51个QTL在一个或多个测试中的大部分中没有显着,加强了现场特定条件显着影响的结论大豆高度结果。测试这个假设,QSHT.那QSNNT.和qAILt通过总添加剂QTL效果所取代(QSH.那QSNNS.和qAILs)从进一步的PCA中的相应环境。与先前的PCA结果一致,本试验中的前两个主要成分分别占总变化的59.2和16.8%(图。3.b)。除了矢量QSNNS.,其他5个vectors紧密分组(图。3.B),这表明,与我们的假设一致,研究的特征是高度相关的。另一方面,意外的PCA结果QSNNS.,其传染媒介大大偏离了SNN的载体,强烈暗示环境差异极大地影响了SNN的QTL。为了最大限度地减少环境效应,植物高度特征数据(SH,SNN和AIL)被校正的数据(SHC,SNNC和AILC)取代并再次进行了PCA。正如预期的那样,前两个主要成分占大多数变异,在这种情况下,分别为42.9和24.5%的总变化(图。3.C)。此外,所有三种添加剂效应(QSH.那QSNNS.和qAILs)相对接近它们的相应特征(SHC,SNNC和AILC)。总之,上面的所有结果都强烈表示G×E和QTL×E都有助于测试大豆群中的植物高度表型。
基因型×环境因子与植物高度特征的相互作用效应在rils中表达的
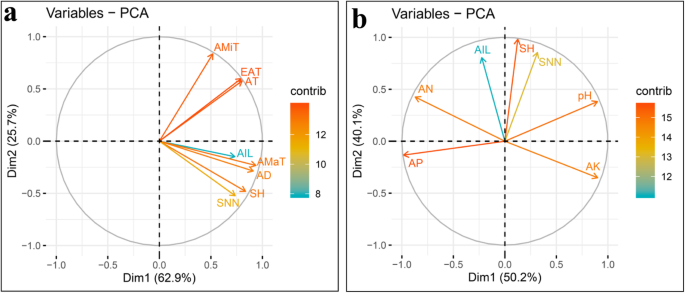
为了进一步评估大豆植物高度特征对大豆植物高度特征的主要环境因素的影响,通过收集的数据进行相关分析和PCA,用于测试性状,农业气象因素和基本土壤化学性质。PCA的结果清楚地表明,前两个主要成分占总变化的88%以上,以及与SH,AIL和SNN的载体密切相关的AD和AMAT的载体(图。4.a).这说明AD和AMaT都有助于提高SH、SNN和AIL。尽管AMiT、EAT和AT与大多数其他载体分开分组,且放置在90°以下,表明这三个环境因子也可能增强SH、SNN和AIL(图1)。4.一种)。通过Pearson相关性分析的结果进一步支持,其中测试性状的特性和农业气象因子之间鉴定了显着的相关性,相关系数在0.220-0.827之间变化(P.价值<0.01)(表5.)。当没有与SH,SNN或AIL密切相关的土壤因子没有载体时获得对比结果(图。4.b)。除了pH和A之间的角度外,AP和AK载体和植物高度特征之间的所有其他角度大于90°,这表明pH和AP和AP和AK在植物高度上存在正或负相互作用。特征(图。4.b)。在Pearson相关性分析中进一步证实了这一点,其中建立了对pH和A的pH和AN和AK的负相关的显着正相关(表5.)。这些结果强烈表明,农业气象和土壤特性均影响植物高度特征,但农业气象因素在很大程度上主要占主导地位。
植物高度特征,农业气象数据和基础土壤化学性质关系的主成分分析(PCA)曲线。基于PCA图一种三种植物高度特征和农业气象数据,和B.3个株高性状与土壤基本性状;承宪:拍摄高度;SNN:茎节数;AIL:平均节间长度;AMaT:平均最高温度;AMiT:平均最低温度;在:积温;EAT:有效积温;广告:平均日长变化;一个:可用氮; AP: available phosphorus; AK: available potassium; The contributions to phenotypic variation are represented by the color and lengths of the vectors
QTL×rils环境因子相互作用
为了进一步探讨赋予QTL添加剂效应的主要因素,还对农业气象因素,土壤性质和QTLS添加剂效应进行了Pearson相关分析和PCA。这里,广告和amat紧密分组QSH.和qAILs,虽然分开分发,amit,吃,吃,吃,而在分布5.a),与在环境因素和植物高度特征的PCA中获得的关系一致(图。4.a)。有趣的是,QSNNS.与Amit非常紧密地对齐,但远离Amat,表明添加剂效应QSNNS.随着amit或减少的增加而增加。之间的积极关系QSNNS.和amit,以及之间的负面关系QSNNS.通过相关性分析进一步证实了amat,其中Pearson相关系数为0.491QSNNS.和amit,或 - 0.263之间QSNNS.和amat(P.价值<0.01)(表5.)。进一步评价土壤性质和植物高度特征表明QSH.与AP显着呈负相关,但与pH正面相关。同时,QSNNS.与AK的AN和正相关性表现出显着的负相关性qAILs与两个土壤因子(pH和A)有显着的正相关,但与AK负相关(图。5.b,表5.)。总之,这些结果表明,农业气象因素和土壤特性均可显着影响QTLS在调节大豆植物高度方面的添加剂效应。
讨论
与环境因素相比,可以通过传统或现代技术轻松预测和手动设计遗传因素,例如交叉育种或遗传修饰。此外,一旦建立了遗传因素,就不需要进一步监测标记。因此,QTLS的挖掘良好等位基因赋予理想植物高度的发展成为促进作物产量的最经济策略之一。近几十年来,许多研究人员试图确定在不同环境下调节大豆植物高度的稳定QTLS,这些努力试图克隆潜在的基因[63.那64.那65.那66.那67.那68.那69.那70那71.].迄今为止,已有超过304个qtl被记录在大豆(https://www.soybase.org),然而,许多已报道的效应无法在不同环境下证实,或者它们的相加效应在不同条件下显著下降[16.那63.那67.].这加强了本文建议的重点,QTLS效应取决于大豆生长的特定环境条件。因此,它不成熟,只有在所有四个不同的环境中检测到识别的19个LOCI(51 QTL)中只有2个LOCI(20 QTL)(附加文件1:表S1),并且51检测到的QTL不能解释在4个不同环境中生长的rils之间观察到的大部分表型变异(图。3.一种)。不幸的是,这些“环境QTLS”可能在特定的环境条件下发挥关键作用,在先前的研究中通常被忽略,因为更多的注意力致力于检测在不同环境条件下保持稳定的QTL。同时,每个优势都有其缺点,通过仅使用一种方法来省略一些QTL来检测,特别是对于较小的QTL。为了检测更多的遗传基因座调节大豆植物高度,本研究采用了两种算法,MQM和ICIM。在51个QTL中,可以通过两种方法同时检测到超过半QTL,而8和15 QTL分别可以分别由ICIM和MQM检测到。我们推测这些不一致的QTL主要来自MQM和ICIM之间的不同算法。但是,大多数主要QTL可以通过两种方法同时检测,特别是对于聚集在内的QTLLOC11.和LOM19-1这些不一致的qtl可以解释特定环境条件下更多的遗传变异。
在给定的环境下,通过豆豆植物的开花,成熟和生长习性,射击建筑得到了大幅度调节,一些基因下调了着名的遗传基因座,例如E1.-E9.那j那Tof11(开花的时间11),Tof12(开花的时间12),DT1.和DT2.,被克隆了[32.那33.那34.那43.那44.那45.那46.那47.那48.那49.那72.].因此,为了进一步评价这些开花、成熟和生长习性相关基因在我们RIL群体中对大豆芽结构的影响,我们根据我们最近发表的re-sequence数据,分析了BX10和BD2的基因型[62.].如预期的那样,与开花、成熟和生长习性相关的三个基因序列,Tof11那Tof12和DT1.,在BX10之间显示了显着的变化(tof11tof12dt1.)和BD2(tof11tof12dt1.),可能导致表型变异。此外,Tof11和DT1.只是位于两个环境稳定的基因座(LOC11.和LOM19-1)强烈的那个Tof11和DT1.潜在的LOC11.和LOM19-1, 分别。有趣的是,添加剂效应LOC11.衍生自BX10和BD2,分别在两个南部(包括YZ和BL)和两种北部(ZC和HZ)实验站中确定。我们认为这可能是由于遗传角色Tof11依赖于光周期中心基因,E1.。在短日环境下,表达E1.受到了极大的抑制[47.那72.]这显着损害了功能Tof11,而两个关键的表达FT.同源物,FT2A.(开花轨迹T.),FT5a(开花轨迹T.),显着增加,导致较早的开花和成熟时间和豆豆植物高度相对较低的时间。比较的是,在漫长的环境下,占主导地位Tof11基因可以显着增强表达E1.而且很大损害FT2A.和FT5a表达导致稍后的开花和成熟时间和相对较高的大豆植物高度。因此,在我们的研究中,对比的功能LOC11.在低纬度和高纬度主要依赖于其中枢基因的表达,E1.[72.].此外,DT1.,它刚刚找到LOM19-1,是大豆生长习性和植物高度最着名的基因[33.]和高表达FT5a可以通过居住地加速终止顶端茎生长DT1.开花阶段的表达[73.]强烈地暗示了这一点DT1.函数也依赖于E1.。因此,并不感到惊讶的是添加效果LOM19-1在短日环境中较高,在短日环境中更高(附加文件1:表S1)。无论如何,探索和整合能够调控有效qtl的环境因素,将有助于通过标记辅助选择(MAS)选择出适合在广泛环境条件下生产粮食的新品种。
为了促进这种育种计划的发展,主要大豆生产国对各种生态环境进行了分类和特征分析[74.那75.那76.那77.那78.].例如,光周期和温度是影响大豆射击建筑发展的关键环境因素[38.那39.那40那79.那80那81.那82.].在大豆中,光周期对各种发育过程的影响已经很好地描述了,并且已经克隆了超过10个对光周期变化的遗传基因群[40那41.那42.那44.那83.].这些基因座的敏感等位基因可以在长日条件下提高大豆幼年相的持续时间,这导致较高的植物。此外,这些光周期敏感等位基因也已被证明在驯化和改进过程中起着关键作用,因为它们能够改变射击建筑和增强谷物产量的能力[44.].
与已知的基因数量是光周期敏感的,虽然记录良好的温度效应,但尚未得到充分的解释,并且对温度敏感的遗传基因座保持罕见。在本研究中,为了解释温度对大豆植物高度的影响,与日间长度一起观察到四个温度因子和三种植物高度特征。有趣的是,AMAT似乎对三个测试的植物高度特征发挥影响,而amit,吃,并且在表现相对较小的影响(图。4.一种)。此外,AMAT也受影响超过AD(图。4.a),它导致了amat对AIL QTL上的相当大的影响(图。5.一种)。另一方面,当PCA中的SNN的载体分组与SH和AIL的载体进行分组(图。4.a),载体QSNNS.与那些非常不同qAILs和QSH.(图。5.a)似乎QSNNS.在环境中没有显着影响STEM节点号。在这个群体中,两个基因型E1.,光周期的中央基因[44.那72.,是双亲的一致性。最近,据报道GMFT5A和GMAP1S.(Apetala1.)能有效终止花后茎节数[73.那84.].然后,在长日照条件下,高表达E1.可以大大抑制GMFT5A和GMAP1S.表达和显着增加干节点数[47.那73.那84.].因此,可能会引起环境中SNN的主要变化E1.或者E1.- 化的基因×环境相互作用。无论如何,这些结果都强烈表示,在测试环境中的SNN变化主要由G×E调节,而不是QTL×E.
已知较高的温度促进大豆节点开发。例如,当温度从30/22℃至38/30°C和42/34℃/夜间/夜间制度增加时,大豆节点数量从18至29增加到29至40点至40个,分别增加[85.].还据报道,主要茎节点,植物高度和均值的作物的数量随温度的增加而增加[86.那87.].然而,尚未进行研究以确定大豆温度变化的影响。对于大豆,在中国新疆等温度下大大变化的地区通常产生更高的大豆产量[88.].在这项研究中,我们发现AMIT具有积极的影响,并且AMAT对提高QTLS对SNN的添加剂影响产生负面影响。这可能有助于解释为什么昼夜温度的大波动可能是有益的,因为需要进一步的工作来揭示潜在的分子和遗传机制。
基于目前的结果,土壤pH值似乎对植物高度产生了广泛的影响(图。5.b和表5.),可能是由于具有低pH值的土壤提供N和P的生物利用度有限。所有的阳性相关性都是为pH和SH,SNN或AIL建立的,以及pH和pHQSH.或者qAIL, 除了QSNN.根据PCA和Pearson相关分析(图。4.b,5.b和表5.)。表明通过适当地增加土壤pH来增加大豆植物高度。因此,在ZC和Hz实验站中促进了与大豆植物高度特征相关的QTL的添加效果,并在YZ和BL实验站中抑制,这导致QTL的添加剂效果来自ZC和Hz中检测到的BD2,以及添加剂QTL源自yz和B1中检测到的BX10的效果。因此,在酸性土壤中,应该首先考虑可以提高土壤pH值的肥料。相反,碱性土壤往往具有更好的营养可用性条件,以及大豆的更高的生物氮固定(BNF)能力而不是其酸性对应物。大豆生长所需的N占70%的N型可以来自BNF [89.],过量的氮肥投入不仅损害了大豆的生物固氮能力[62.]但也导致更高的植物(图。4.B),导致抗倒伏能力差。此外,长期过量施肥会导致土壤酸化[90.那91.那92.],这通常会导致土壤条件恶化。因此,在含碱性土壤的地区,应严格控制N肥的量。与K,富含P的钾肥可以增强AIL,并下降SNN,这是不利于最终产量的SNN。但是,p,这对于花数字至关重要,荚和填充谷物至关重要[93.那94.],易于通过土壤颗粒修复[95.]或者迅速浸入水供应中,特别是在南方田间的酸性土壤中,P不足可能导致更严重的产量损失。因此,应考虑富含P和K的肥料进行更广泛的应用。
结论
总的来说,本研究提供了综合结果,有助于了解环境,基因型,QTL和大豆射击建筑之间的关系。最重要的是,这些结果还表明,不仅可以通过遗传调制器来调节射击架构,也可以通过旨在优化大豆生产的土壤性质的管理策略来调节。因此,本研究开辟了制定策略的新途径,以培育大豆品种,改进的射击架构在各种环境中实现高大豆产量的可持续生产。
方法
植物材料
共有308种代表性大豆品种,选自应用核心种质收集[61.包括168 f9.RIL后代在植物高度特征的基因型和环境之间的相互作用的测试中,包括芽高度(SH),茎节点数(SNN)和平均节电长度(AIL)。实验在地理上独特的现场环境中进行。选择两种栽培品种,BX10和BD2,具有对比的开花,光周期敏感度,射击结构和酸性土壤的适应能力,使用单种子下降(SSD)方法构建RIL群体[96.].该群体用于构建QTLS的遗传联系地图,用于大豆植物高度特征,以及探讨QTL×E的基因机制。此外,还基于重新序列数据分析[61.],BX10和BD2中一些众所周知的开花,成熟和生长习惯相关基因的基因型是E1E2E3E4E9DT1.DT2.TOF11TOF12.j和E1E2E3E4E9DT1.DT2.TOF11TOF12.j, 分别。
现场试验
308份大豆种质选择分别于2018年和2019年分别在博洛(114.29°E, 23.17°N)和海南(109.48°E, 18.31°N, HN)实验站种植。168个RIL子代在4个不同农业气象条件和土壤基本性质的试验站生长(表1)6.)。具体而言,这些网站包括赵县(河北省ZC,河北省114.48°E,37.50°N)实验农场的遗传和发展生物学研究所,中国科学院,杭州(浙江省Hz,浙江省120.69°E,30.51°n)浙江省农业科学院作物与核技术利用研究所,BL和Yangzhong(福建省yz,福建省118.20°E,26.17°N)实验站福建农业和林业大学。所有试验都被定为随机完整块设计,具有三种复制。每个基因型的30个种子在单个3米行间隔0.5m的单个3 m行中播种。在大豆生长期间没有施肥没有实验,并且所有这些都纳入了一致的现场管理实践。
植物采样和遗传分析
每条线的三种代表植物的SH和SNN在R6阶段的场上直接测量,并且将AIL计算为SH的比率为SNN。所有数据用于通过SPSS中的双向ANOVA确定基因型和环境对测试性状的影响[97.],并估计使用公式的每个特征的广义遗传性H2B.= VG /(VG + VE),具有VG和VE,作为RILS之间的相应方差。
农业气象和基本土壤化学性质的测定
每个字段网站的农业气象数据列于表中6.。在测量条件下,最大温度(垫,°C),最低温度(MIT,°C)和平均日长度(广告,小时·日- 1)的天气资料http://tianqi.2345.com/和https://www.51240.com/。计算平均最大温度(Amat,°C),平均最低温度(amit,°C)和累积温度(act,°C·d)为:
同时,由于有效积温(EAT,°C·d),即日平均温度与生物零点的差值之和,对植物生长发育有显著影响[98.[还评估了在播种过程中为大豆的用途。对于大豆,生物零点是10°C并为大豆的用途计算如下:
在哪里马和米特是垫子和麻省理工具R.th(R.= 1,2,......,N),分别为大豆生长日。
使用来自每个实验部位的10个随机收集的土壤样品测定每个位置的底部0-20cm土壤的基本土壤化学性质。根据土壤和农业化学分析协议测量的土壤pH,可用的氮(AN),可用磷(AP)和可用的钾(AK)[99.]列于表中6.。
遗传联系地图和QTL映射
基于先前构建的遗传连锁图谱[62.],使用每个绘图中的三个植物的每个性状的平均值用于使用QTL ICIMAPPED 4.1识别显着的定量性状基因座(QTL),运行包含复合间隔映射(ICIM)方法[100.]以及在MapQTL6.0运行间隔映射(IM)和多QTL模型(MQM)算法中[101.].对于QTL ICIMAPPAING 4.1,选择ICIM-ADD的映射方法来识别具有步进宽度的QTL,逐步回归的概率分别设置为1cm,0.001和2.5。首先,对QTL分析进行了IM分析,选择具有最高LOD分数的标记作为辅助actO actO actO actO actO actor来进行MQM分析。LOD评分超过2.5的QTL被认为是MQM映射中的高置信QTL。为了精确地评估候选QTL的广泛情感,将连锁组聚集在一起的分离的QTL作为遗传基因座组合。
在四个不同位置测量的植物高度参数的遗传效应评估
每个单一环境中识别的QTL的添加剂效果之和(QSH.那QSNNS.和qAILs)或所有四个环境(QSHT.那QSNNT.和qAILt)通过主成分分析(PCA)评估。这QSH.那QSNNS.那qAILs那QSHT.那QSNNT.和qAILt计算如下:
在哪里QTS.IJ.和QTT.j供试性状qtl的总体加性效应是jth(j单一环境中的RIL = 1,2,...,168)分别进行组合的环境试验。其他参数是AR.代表添加剂的效果R.th(R.= 1,2,......,K.)QTL,QTS.代表这一点QSH.那QSNNS.或者qAILs那QTT.代表QSHT.那QSNNT.或者qAILt, 和一世表示实验站(ZC,Hz,YZ和BL)。
从添加剂QTL效应中消除了环境效应,SH,SNN和AIL的值分别被纠正并命名为SHC,SNNC和AILC。使用的公式列出如下:
在哪里TC.j和T.j是每个特征的各自的纠正和测量值jth(j= 1,2,...,168)ril,和Tm值在一个环境中的每个特征是168个rils的平均值,TC.代表SHC,SNNC或AILC。
PCA分析
利用性状、农业气象资料、土壤基本性状、QTL的加性效应和每个性状的校正值(R + ' factoextra '、' factoMineR '和' ggplot2 ')以及函数(fviz_pca_var ')进行主成分分析(PCA),评估大豆株高的QTL × E效应。102.那103.那104.](版本3.6.1,https://www.r-project.org/)。
可用性数据和材料
在当前研究期间生成和/或分析的数据集可在国家生物技术信息(NCBI)存储库中提供,以及生物创新数据库和序列读取存档(SRA)数据库的登录号分别为Prjna688599和SRR13341345-SRR13341514。所有支持数据都可以从相应的作者获得合理的请求(YYQ287346@163.com)。
缩写
- SH:
-
拍摄高度
- SNN:
-
干节点数
- AIL:
-
平均节间长度
- SSD:
-
单种子血清
- ZC:
-
赵县
- 赫兹:
-
杭州
- yz:
-
杨忠
- BL:
-
Boluo.
- HN:
-
海南
- 垫:
-
最高温度
- 麻省理工学院:
-
最低温度
- 广告:
-
平均天长
- amat:
-
平均最高温度
- 阿米特:
-
平均最小温度
- 在:
-
积温
- 吃:
-
有效累计温度
- 一个:
-
可用氮
- AP:
-
可用磷
- AK:
-
可用的钾
- QTL:
-
定量特质基因座
- H2B.:
-
广义遗传性
- QSH.:
-
单一环境中SH的QTLS的添加效应之和
- QSNNS.:
-
单型环境中SNN的QTL的添加效应之和
- qAILs:
-
单一环境下AIL qtl的加性效应总和
- QSHT.:
-
在所有环境下SH的QTLS添加剂效应的总和
- QSNNT.:
-
在所有环境下SNN QTLS对SNN的添加效应的总和
- qAILt:
-
所有环境下QTLS对AIL的添加剂效应的总和
- SHC:
-
SOYBEAN SH的校正值
- SNNC:
-
大豆SNN的校正值
- AILC:
-
大豆矫正值
- env:
-
环境
- SD:
-
标准偏差
- 分钟:
-
最小值
- 最大限度:
-
最大值
- CV %:
-
变异系数
- 库尔特:
-
峰度
- 歪斜:
-
歪斜
- PVE(%):
-
QTL解释的表型方差的百分比
- 添加:
-
添加剂效果
参考
- 1。
Khan Ms,Zaidi A,Wani Pa。磷脂溶解微生物在可持续农业中的作用 - 综述。Agron Center Dev。2007; 27(1):29-43。
- 2。
Ray DK,Mueller Nd,West PC,Foley Ja。产量趋势不足以通过2050年双重作物生产.PLO。2013; 8(6):E66428。
- 3.
Jez JM, Lee SG, Sherp AM。下一个绿色运动:保护环境和可持续发展的植物生物学。科学。2016;353(6305):1241 - 4。
- 4.
莱因哈特D,库勒迈耶C.植物建筑。EMBO众议员2002;3(9):846 - 51。
- 5。
王B,史蒂文女士,李Jy。射击建筑的遗传调节。Annu Rev植物Biol。2018; 69(1):437-68。
- 6。
主席F,Sanchez-Bragado R,Serret Md,Aparicio N,Nieto-Taladriz MT,Luis AJ。与半矮小杜兰姆小麦遗传进展相关的农艺和生理性状:西班牙的案例。植物SCI。2019; 295:110210。
- 7。
1 .陈晓,徐鹏,周军,陶东,于丹。旱稻半显性半矮秆基因的定位及育种价值评价。植物潜水员。2018;40:238-44。
- 8。
Cooper Rl,Martin Rj,圣马丁斯SK,Calip-Dubois A,Fioritto RJ,Schmitthenner Af。注册“查尔斯顿”大豆。农作物科学。1995年; 35(2):593。
- 9。
Cooper Rl,Mendiola T,圣马丁SK,Fioritto RJ,Dorrance Ae。'apex'yoybean的注册。农作物科学。2003; 43(4):1563-4。
- 10。
玉米植物高度QTL映射,验证及候选基因分析。印度j genet pl br。2018; 78(4):443-53。
- 11.
Hedden P.绿色革命的基因。趋势类型。2003; 19(1):5-9。
- 12.
Khush GS。绿色革命:前进的方向。李建平。2001;2(10):815-22。
- 13。
Peng J, Richards DE, Hartley NM, Murphy GP, Devos KM, Flintham JE, et al.“绿色革命”基因编码突变的赤霉素响应调节剂。自然。1999;400(6741):256 - 61。
- 14。
陈y,纳尔逊rl。野生大豆早期植物高度的变异。农作物科学。2006; 46(2):865-9。
- 15.
黄泽,王文,徐XJ,温ZX,李英克,李杰,等。大豆重组近交系的动态植物高度及其相对生长速率的关系。Acta Agron Sin。2011; 37(3):559-62。
- 16。
Josie J,Alcivar A,Rainho J,Kassem Ma。含有QTL的基因组区域,用于植物高度,间距和大豆中的花色[甘氨酸最大(l)稳定)。Bios。2007;78(4):119 - 26所示。
- 17。
Thompson J,Bernard RL,Nelson RL。大豆的第三个等位基因DTL.轨迹。农作物科学。1997年; 37(3):757-62。
- 18。
王y,cheng lr,sun y,周z,zhu lh,xu zj等。遗传背景对QTL QTL QTL和QTL与环境的相互作用在稻米中的QTL与环境之间的相互作用。Acta Agron Sin。2009; 35(8):1386-94。
- 19。
张俊,宋Q,钱财,纳尔逊rl,王x,wu j等。初期成熟大豆的开花时间,成熟日期和植物高度的基因组关联研究(甘氨酸最大)种质。BMC基因组学。2015; 16:217。
- 20.
Cao Y,Li SG,He Xh,Chang Fg,Kong JJ,等。在中国夏季种植大豆里拉人口中映射QTL的植物身高和开花时间。Euphytica。2017; 213:39。
- 21.
Miedaner T,牧民CP,EBMEYER E,Kollers S,Korzun V,Butersmayr H.使用非适应的定量特质基因座来增加培养半矮小小麦的镰刀菌长抗性。植物品种。2019; 138:140-7。
- 22。
Srivastava D,Shamim M,Mishra A,Yadav P,Kumar D,Pandey P等人。用标记辅助选择育种促进kalanamak米半矮化基因的血栓增长。Curr Sci印度。2019; 116(4):597-603。
- 23。
格罗弗g,sharma a,gill hs,srivastava p,bins ns。Rht8在印度春小麦品种中作为矮秆互交基因。《公共科学图书馆•综合》。2018;13 (6):e0199330。
- 24。
李Z,张x,赵y,李y,张g,彭z等。增强玉米根提示中的养阴累积改善了根生长和矮化植物高度。植物Biotechnol J. 2018; 16:86-99。
- 25。
Wei X,Xu J,Gu H,Jiang L,Chen S,Yu C,等。DTH8.抑制水稻开花,同时影响株高和产量潜力。植物杂志。2010;153(4):1747 - 58。
- 26。
(1) Mori M, Nomura T, Ooka H, Ishizaka M, Yokota T, Sugimoto K等。一个油菜素内酯合成缺陷的水稻矮化突变体的分离与鉴定。植物杂志。2002;130(3):1152 - 61。
- 27。
刘,吴c,傅y,hu g,si h,zhu l等。鉴定和表征HTD2.:一种新的基因对水稻中的分蘖芽过度产生了负面调节。Planta。2009; 230(4):649-58。
- 28。
卢Z,yu h,xiong g,王j,jiao y,liu g等。转录激活剂理想工厂架构1的基因组 - 宽结合分析显示了一种复杂的网络调节稻米厂建筑。植物细胞。2013; 25(10):3743-59。
- 29。
张YX,YU CS,LIN JZ,刘j,刘b,王j等。osmph1.调节植物高度,提高水稻籽粒产量。Plos一个。2017; 12(7):1-17。
- 30.
张耶,卞XF,张某,凌j,王yj,魏xy等。鉴定新型功能突变体等位基因,SLR1-D5,水稻della蛋白质。J Intent agr。2015; 15(7):1441-8。
- 31。
刘民族,吴怡,傅XD,Qian Q.一种新型显性半矮种基因的特征和分子映射SDD(T)在米饭中(奥雅萨苜蓿)。植物品种。2008; 127(2):125-30。
- 32。
Bernard RL。影响大豆茎终止的两种基因。农作物科学。1972; 12(2):235-9。
- 33。
刘B,Watanabe S,Uchiyama T,Kong F,Kanazawa A,夏Z等。大豆干生长习性基因DT1.是一个拟南芥的正直终端FLOWER1。植物理性。2010; 153(1):198-210。
- 34。
Ping J,Liu Y,Sun L,Zhao M,Li Y,She M,等。DT2.是致功能增益的疯狂域因子基因,指定大豆中的半et。植物细胞。2014; 26(7):2831-42。
- 35。
婷cl。野生栽培大豆的遗传研究。J AM Soc Agronomy。1946; 38(5):381-93。
- 36。
Osiru Mo,Olanya OM,Adipala E,Kapinga R,Lemaga B.产量稳定性分析Ipomoea batatus.L.各种环境中的栽培品种。Aust J Croc SCI。2009; 3(4):213-20。
- 37。
去FW。温度对植物生长的影响。Annu Rev植物植物植物Mol Bioi。1953; 4(1):347-62。
- 38。
张力,王H,王Z,任y,Niu L,Liu J等。大豆驯化过程中的光周期动态。科学生中国生活SCI。2017; 60(12):1416-27。
- 39。
Alliprandini LF,Abatti C,Bertagnolli PF,Cavassim JE,Gabe HL,Kurek A等人。了解巴西的大豆成熟团:环境,品种分类和稳定性。农作物科学。2009; 49(3):801-8。
- 40。
Gupta S,Bhatia Vs,Kumawat G,Thakur D,Singh G,Tripathi R等人。遗传分析解体主要印度大豆品种中光周期和成熟基因的状态和作用。J Genet。2017; 96(1):147-54。
- 41。
Abrahão GM, Costa MH.雨水和光周期限制在巴西大豆生长季节的演变:双季稻制度的兴起(和可能的衰落)。农业森林气象。2018;256-257:32-45。
- 42。
Coker,Curtis DF,Stewart DW,Morrison MJ。量化光周期,温度和日辐照对大豆素开花时间的影响。植物。2014; 3(4):476-97。
- 43.
李XM,方C,XU ML,张FG,LU SJ,NAN HY等。大豆成熟基因的定量特质基因座映射E6.。农作物科学。2017; 57(5):2547-54。
- 44.
鲁斯,赵X,胡y,刘某,南h,李x等。大豆的自然变化j基因座改善了对热带的适应性,提高产量。NAT Genet。2017; 49(5):773-9。
- 45.
Watanabe S,夏Z,Hideshima R,Tsubokura Y,Sato S,Yamanaka N,等。采用残余杂合线的基于地图的克隆策略揭示了Gigantea.基因参与大豆成熟和开花。遗传学。2011; 188(2):395-407。
- 46。
徐米,徐Z,刘B,孔福,Tsubokura y,Watanabe S等人。四个成熟基因的遗传变异影响了大豆的光周期内不敏感性和植物调节的开花后反应。BMC植物BIOL。2013; 13:91。
- 47。
Xu M, Yamagishi N, Zhao C, Takeshima R, Kasai M, Watanabe S, et al. .大豆特异性成熟基因E1.花卉压缩机系列通过下调控制夜间休息开花轨迹T.orthologs。植物理性生物生物。2015; 168(4):1735-46。
- 48。
赵C,Takeshima R,朱家,徐M,Sato M,Watanabe S等人。大豆成熟轨迹延迟开花的隐性等位基因E9.是一种泄漏的等位基因FT2A., 一种开花轨迹T.ortholog。BMC植物BIOL。2016; 16:20。
- 49。
赵立,李米,徐c,杨x,li d,zhao x等。自然变异GMGBP1启动子影响大豆开花时间和成熟度的光周期控制。植物j . 2018; 96(1): 147 - 62。
- 50。
Malik MNA,Edwards DG,Evenson JP。花芽去除和氮气供应对棉花生长发育的影响(gossypium hirsutumL.)。AUST J植物理体。1981; 8(3):285-91。
- 51。
熊WB,徐财富,王XY。不同氮施用率对水稻茎特征的影响。农业生物科技。2018; 7(5):204-7。
- 52。
Moura WM,拍卖YJ,Amaral Junior At,Gravina Ga,Barili Ld,Vieira HD。温室条件下低钾营养液生物咖啡的生物统计学分析。genet mol res。2016; 15(3):GMR.15038753。
- 53。
Sun JW,Li N,Wang Cy,Zhao JH,Zhang SW,Jiang Mj等。移栽方法和钾速率对杂交稻植入抗性的影响。J Nucl Agric SCI。2017; 31(12):2408-17。
- 54。
Lee S,Jun Th,Michel Ap,Rouf Mian Ma。SNP标记与QTL调理植物高度,住宿和大豆成熟的标记相关联。Euphytica。2014; 203(3):521-32。
- 55。
张X,王某,郭n,张y,bu y,zhao j等。将QTL-SEQ和联系映射结合到精细图的野生大豆等位基因较大的植物高度。BMC基因组学。2018; 19(1):1-12。
- 56。
Terzić D, Popović V, Tatić M, Vasileva V, Đekić V, Ugrenović等。大豆面积、产量和产量居世界前列。Eco-Conference。2018; 10:135-44。
- 57。
王ys,盖jy。中国大豆生态地区的研究II。生态环境与代表品种。Chin J Appl Ecol。2002; 13(1):71-5。
- 58。
关键词:酸性硫酸盐土壤,共生微生物,先驱植物abstract:土壤植物。2008;310(1 - 2):55 - 65。
- 59。
徐X,他p,pampolino mf,li y,liu s,xie j等。利用东北地区玉米营养专家系统缩小产量差距和营养素使用效率。现场裁剪。2016; 194:75-82。
- 60。
张XC,陈H,黄股,尹XW,Du CZ,张JJ。重庆氮肥和春豆豆品种的最佳组合。大豆科学。2012; 31(2):255-8。
- 61。
赵杰,傅杰布,廖开,他,y,n,hu ym等。大豆种质磷效率应用核心集合的根系结构特征。Chin Sci Bull。2004; 49(15):1611-20。
- 62。
杨Q,杨yq,Xu rn,LV Hy,廖H.在各种现场条件下QTLS QTL遗传分析与QTL谱图。前植物SCI。2019; 10:75。
- 63。
Eskandari M,Cobcan I.大豆种子油的遗传控制:II。QTL和增加油浓度而不降低蛋白质或增加种子产量的基因。Al Appl Genet。2013; 126(6):1677-87。
- 64。
葛杰,王yj,吴xl,陈调。植物中定量性状的分离分析和QTL映射的比较研究 - 用大豆壳。Front Agr China。2007; 1(1):1-7。
- 65。
Lark Kg,Chase K,Adler F,Mansur LM,ORF JH。大豆中定量性状基因座之间的相互作用,其中一个基因座的特征变异是彼此特异性等位基因的条件。P Natl Acad Sci USA。1995; 92(10):4656-60。
- 66。
Lee Sh,Bailey Ma,Mian Mar,Spucher,Ashley Da,Parrott Wa,等。鉴定植物高度,住宿和成熟度的定量性状基因座,在大豆种群中进行生长习性。Al Appl Genet。1996; 92(5):516-23。
- 67。
ORF JH,Chase K,Jarvik T,Mansur LM,Cregan PB,Adler Fr,等。大豆农艺性状的遗传学:I。三种相关重组近亲群体的比较。农作物科学。1999; 39(6):1642-51。
- 68.
Pathan Sm,Vuong T,Clark K,Lee JD,Shannon JG。大豆种子蛋白和油含量和种子重的定量定位和定量性状基因座的遗传映射和确认。农作物科学。2013; 53(3):765-74。
- 69.
Sun DS,Li WB,Zhang ZC,Chen QS,Ning HL,Qiu LJ等。大豆发育行为的定量特质基因座分析(甘氨酸最大L. MERR。)。Al Appl Genet。2006; 112(4):665-73。
- 70.
王D,GRAEF GL,Procopiuk Am,DIES BW。鉴定特异性大豆回流雄厚的产量下的推定QTL。Al Appl Genet。2004; 108(3):458-67。
- 71。
姚D,刘Zz,张继,刘Sy,曲j,关sy,等。大豆主要植物性状定量特性区分轨迹分析。genet mol res。2015; 14(2):6101-9。
- 72。
吕S,东路,方C,刘某,程Q,孔L等。逐步选择romogonousPRR.在大豆驯化期间控制开花和成熟的基因。NAT Genet。2020; 52(4):1-9。
- 73。
Takeshima R,Nan Hy,Harigai K,Dong Ld,Zhu Jh,Lu Sj,等人。大豆之间的功能分歧开花轨迹T.正轨,FT2A.和FT5a,在开花后茎生长。J Exp Bot。2019; 70(15):3941-53。
- 74。
Co-er,voldeng HD。一种新的大豆成熟和光周期敏感性座位E1.和T.。农作物科学。2001; 41:698-701。
- 75。
Hao G,Chen X,Pu M.中国大豆品种分类为成熟团。Acta Agron Sin。1992年; 18(4):275-81。
- 76。
Hartwig E.大豆的生长和生殖特征[甘氨酸最大(L.)Merr。]在短日的条件下种植。Trop Sci。1970; 12:47-53。
- 77。
王gx。中国大豆品种的生态分类。科学农业学报。1981; 14(03):39-46。
- 78。
张立伦,京都博门S,张俊,张MH,Freeland TB,Watson Ce,等。美国大豆成熟组最佳适应区的修改。作物管理。2007; 6:1。
- 79。
Hatfield JL,Prueger JH。极端温度:对植物生长发育的影响。天气气候极端。2015; 10:4-10。
- 80。
Kiss T,Dixon Le,Soltesz A,Banyai J,Mayer M,Balla K,等。环境温度与光周期相关对苯上的影响及对小麦大植物发育基因表达的影响(Triticum aestivum.L.)。植物细胞环境。2017; 40(8):1629-42。
- 81。
栾WJ,陈赫兹,傅yp,si hm,peng w,song ss等。光周期与温度与水稻标题日期串联串联的影响。Plos一个。2009; 4(6):E5891。
- 82。
田L,王SX,宋Xh,张俊,刘p,陈z等。长光周期会影响从植物生殖阶段的玉米过渡:光周期敏感性近交系和其复发性父母之间的蛋白质组学比较。氨基酸。2018; 50(1):149-61。
- 83。
夏Z,Watanabe S,Yamada T,Tsubokura Y,Nakashima H,Zhai H,等。定位克隆和表征揭示了大豆成熟基因座的分子基础E1.调节光纤的开花。P Natl Acad Sci USA。2012; 109(32):E2155-64。
- 84。
陈丽,南海,孔吕,悦朗,杨立,赵Qs等。大豆AP1.同源物控制开花时间和植物高度。J Intent Plant Biol。2020; 00(00):1-12。
- 85。
张磊,张丽丽,张丽丽,张丽丽。高温胁迫对大豆节间伸长、主茎节数和单株荚果数均有影响。作物j . 2018; 6(2): 148 - 61。
- 86。
托马斯JF,互相摇动CD Jr.Soybeans的形态反应,受到皮肤病,温度和治疗年龄的治疗。BOT GAZ。1977年; 138(3):321-8。
- 87。
Van Schaik PH, Probst AH。一些环境因素对大豆花产量和繁殖效率的影响。阿格龙j . 1958;(4): 192 - 7。
- 88。
王XG,赵立,魏俊,东Z。超高产大豆品种案例分析,中华35.大豆科。2011; 30(6):1051-3。
- 89。
Peoples MB,Brockwell J,Herridge DF,Rochester IJ,Alves BJR,Urquiaga S等人。氮素固定作物豆类对农业系统生产率的贡献。共生。2009; 48(1/3):1-17。
- 90.
郝t,朱q,zeng m,shen j,shi x,liu x等。氮肥施用与作物收获对麦玉米双种分类系统土壤酸化的贡献。植物土壤。2019; 434(1-2):167-84。
- 91.
林h,静厘米,王jh。长期施肥对土壤酸化的影响。普通人res。2014; 955-9:3552-5。
- 92.
施罗德(Schroder JL),张浩(Zhang H),吉玛(Girma K),劳恩(Raun WR),潘志强(Penn CJ),佩顿(Payton ME)。长期施用氮肥对冬小麦土壤酸化的影响。土壤学报;2011;40(3):457 - 461。
- 93.
杨yq,佟y,李xx,他,xu rn,liu d等。遗传分析与磷效率的精细映射轨迹1(PE1)在大豆。Al Appl Genet。2019; 132:2847-58。
- 94.
Chen Ly,Qin L,周LL,Chen ZC,Sun LL,Wang Wf等。结核局部磷酸盐转运蛋白GmPT7在大豆中提高共生N2固化和产量方面发挥着重要作用。新植物。2019; 221(4):2013-25。
- 95。
SchröderJJ,Smit Al,Cordell D,Rosemarin A.改善了农业的磷利用效率:可持续利用的关键要求。化学层面。2011; 84(6):822-31。
- 96。
Knott博士,Kumar J.早期发电产量测试的比较和小麦育种中的单种子血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液血液下降术。农作物科学。1975; 15(3):295-9。
- 97。
灰色CD,Kinnear Pr。IBM SPSS统计数据19表示简单。am stat。2012; 66(2):143。
- 98。
李泽,徐mg,张·赫姆,张谢,张wj。在长期施肥和不同生态条件下,中国作物产量的可持续性。Chin J Appl Ecol。2010; 21(5):1246-69。
- 99。
宝SD。在:李gz,杨gd,编辑。土壤和农业化学分析。北京:中国农业出版社;2000. p。56-108。
- 100。
QTL IciMapping:构建双亲本群体遗传连锁图谱和数量性状位点定位的集成软件。作物j . 2015; 3(3): 269 - 83。
- 101。
范ooijen JW。MAPQTL 6,在二倍体物种实验群体中定量特质基因座的映射软件。Wagieningen:Kyazma B.V;2009年。
- 102。
飞蛾传粉花粉的花蜜组成Platanthera Bifolia和P. vallantha.以及它对繁殖成功的重要性。足底。2019;250(1):263 - 79。
- 103。
卡萨拉A,Mundt F. FactoExtra:提取并可视化多变量数据分析结果。R包版,卷。1.0;2017. p。5。http://spout.ussg.indiana.edu/cran/web/packages/factooextra/index.html.
- 104。
Lês,Josse J,Husson F.Ifacominer:用于多变量分析的R包。j stat softw。2008年:25。https://doi.org/10.18637/jss.v025.i01.。
致谢
我们想承认中国科学院遗传和发展生物研究所的工作人员,河北农业和林业科学院浙江省农业科学院作物和核技术利用研究所。我们还要感谢福建省生物中心,福建农业和林业大学大豆收获的研究生,以及托马斯博士的Golden Fidelity LLC批评审查。
资金
该工作得到了中国国家自然科学基金(31830083)和河北省自然科学基金的创新研究小组支持(C2020301020)。资助机构在研究的设计,集合,分析和解释方面没有作用,以及编写稿件。
作者信息
从属关系
贡献
HL和YY设计实验并对稿件进行批判性修改。QY和YY对数据进行分析并撰写稿件。QY、YY、GL、HLv和CW进行了实验。所有作者均已阅读并批准稿件。
通讯作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明,这项研究是在没有任何商业或财务关系的情况下进行的,这可能被认为是一个潜在的利益冲突。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
利用MapQTL 6.0和QTL icimaping4.1分别检测到株高性状相关的QTL9.不同环境下的大豆rils。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
杨,Q.,林,G.,LV,H.等等。大豆植物高度的环境和遗传调节。BMC植物BIOL.21日,63(2021)。https://doi.org/10.1186/s12870-021-02836-7.
已收到:
公认:
发表:
关键词
- 拍摄建筑
- 植物高度
- 基因型
- QTLS.
- 农业气象因素
- 土壤性质