- 研究文章
- 开放获取
- 发表:
细菌3-脱氢气候脱水酶(QSUB)的表达减少了木质素,并提高了SwitchGrass中的生物质糖化效率(黍virgatuml .)
BMC植物生物学体积21文章编号:56.(2021)
摘要
背景
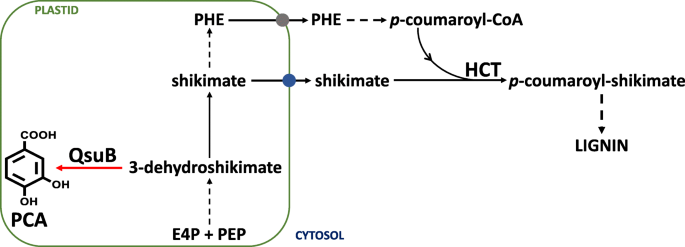
沉积在植物细胞壁中的木质素对生物质转化产生负面影响到晚期生物过程中。因此,对开发生物能量作物的兴趣强烈兴趣降低木质素含量或改变木质素结构。生物能源作物的另一个所需特性是积累新型生物化学的能力,这将增强经济上可持续的生物猎犬的发展。如前所述在模型植物拟南芥中,植物中的3-脱水气动脉脱水脱水酶的表达提供了降低木质素含量和过度加入适用于生物升级的增值代谢副产物(即,Protocatechuate)的可能性。
结果
3-Dehydroshikimate脱水酶qsub棒状杆菌属glutamicum在生物能源作物柳枝稷(黍virgatumL.)使用O-甲基转移酶基因的茎特异性启动子(Pshomt.从甘蔗)。的活动Pshomt.在柳枝稷上进行了β -葡萄糖苷酸酶(GUS)活性的原位观察pShOMT:格斯融合构建。在受控的生长条件下,包含a的工程式交换机线Pshomt :: QSUB.与对照植株相比,Construct植株木质素含量降低,生物量糖化效率提高,并积累了更多的原茶酸。试图在构成型启动子控制下产生携带QsuB基因的转基因柳枝稷株系pZmUbi-1结果表明,在植株再生过程中,QsuB的异位表达可能与毒性有关。
结论
本研究验证了QsuB工程方法从模型植物到柳枝稷的转移。我们已经证明了两个重要性状的表达改变:木质素含量和副产物的积累。我们发现选择了促销员来开车QSUB.在将这一策略应用于其他生物能源作物时,应仔细考虑其表达方式。目前正在对转基因柳枝稷进行田间试验,以评估转基因植株的农艺性状表现。
背景
为了减少我们对不可再生化石燃料资源的依赖,发展生物精炼厂需要生产专门的生物能源作物,这些作物可以在边际土地上以很少的投入种植。生物能源作物所需的其他特性包括高生物量产量、抗逆力、降低转化为生物燃料和生物产品的阻力,以及有价值的副产品的积累[1那2].柳枝稷长期以来一直被认为是一种理想的生物能源作物,考虑到其抗病虫害、高生物量产量、因添加肥料相对较少而在贫瘠土壤上的生长性能、通过其广泛的根系固碳能力、耐旱性和高效的水资源利用[3.].因此,通过育种和遗传转化对柳枝稷进行改良的努力得到了显著的实施[4.那5.].
木质素是植物生物量中的一种主要聚合物,它对细胞壁多糖转化为高级生物制品产生负面影响,已经建立了几种工程方法来修改木质素含量及其单体组成[6.那7.].例如,针对质体的细菌3-dehydroshikimate脱氢酶(QsuB)的异源表达在拟南芥中导致了强烈的木质素降低(高达50%)[8.].该观察的一个解释是可以减少合成所需的细胞溶质Shikimate池P.-COUMAROYL-SHIKIGAR催化羟基氨基酰基COA:木质素生物合成期间Shikimate羟基氨基酰基转移酶(HCT)(图。1).
在柳枝稷,几个HCT.基于用相应重组酶测定的HCT活性及其在木质化细胞悬浮培养中的表达谱,基因候选已被提出在木质素生物合成中有作用[9.那10].事实上,这两种基因的转录水平都降低了90%以上PVHCT1.或PVHCT2.对木质素含量没有影响,但同时下调两种基因导致木质素含量轻微减少(5-8%),基于硫酸吡啶解释放后的木质素单体的产率[11].这些结果不仅表明了HCT在柳枝稷木质素生物合成中的作用(PvHCT1和PvHCT2是冗余的),还表明了其他具有类似功能的HCT的参与。
本文报道了利用甘蔗o -甲基转移酶基因启动子(Pshomt.)[12].几个柳枝稷QsuB转化事件显示木质素含量降低和细胞壁顽强性降低。生物量中原儿茶酸的含量也显著增加。
结果
的分子特征Pshomt :: QSUB.切换线条
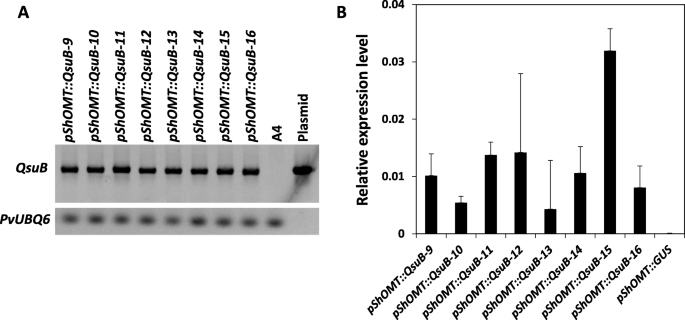
在重新生成八个独立的转型事件之后农杆菌使用含有在下游熔化的体积靶向QSUB编码序列的DNA构建体的DNA构建体介导的转化Pshomt.启动子。的QSUB.通过来自每个转化剂的GDNA检测转基因(图。2一个),QSUB.对E2期各品系第一个节间获得的rna合成的cDNA进行qPCR验证其表达。2b)。由...组成的DNA构造Pshomt.在GUS报告基因的上游融合也转移到SwitchGrass中。窝水植物的尤基节点分析pShOMT:格斯在E4阶段的构造表明Pshomt.主要在节点中活跃,而在节间中观察到几乎没有活动(图S1).在控制的生长条件下,所有转基因株系都没有表现出任何特殊的表型或生长缺陷,并且在视觉上无法与其他株系区分,也无法与未转化的野生型植物相比较。
Protocatechuate内容Pshomt :: QSUB.switchgrass.
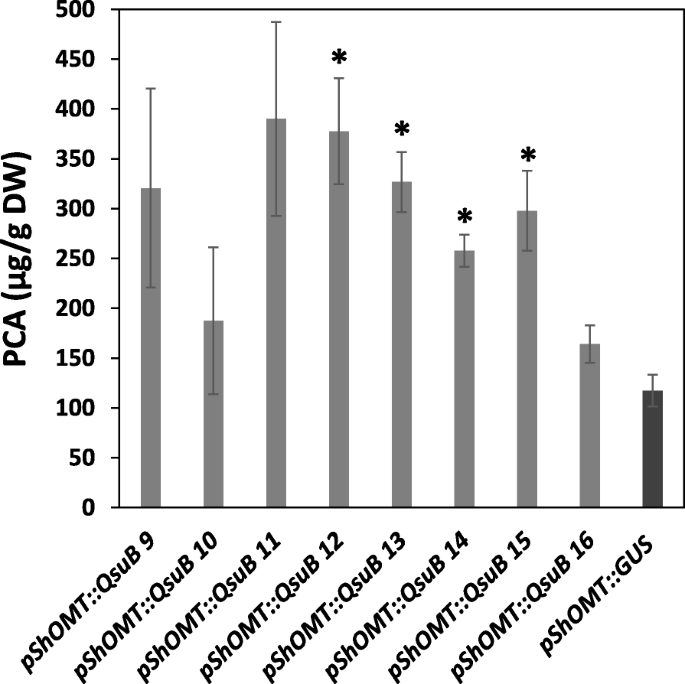
Protocatech本种(PCA),QSUB活性的产物从E5阶段的Switchgrass植物的总体上面提取,并量化。与携带的对照植物相比pShOMT:格斯在4个独立组中,PCA显著增加~ 2 - 3倍Pshomt :: QSUB.干重可达380 μg/g(图5)。3.).这一数据表明,在转基因柳枝草中表达质体靶向QsuB使内源性3-脱氢草酸转化为PCA。
木质素含量与生物质糖化效率的关系Pshomt :: QSUB.switchgrass.
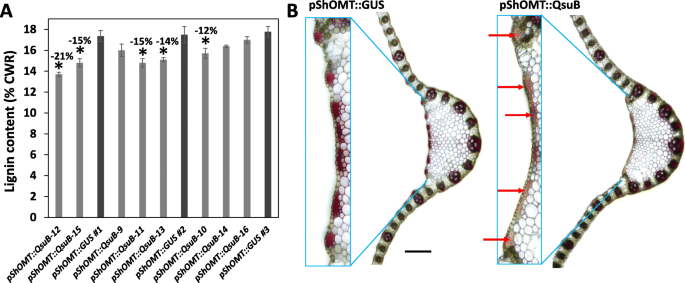
从生物质中总木质素含量Pshomt :: QSUB.使用Klason方法测量切换线。与包含的控制线相比pShOMT:格斯构造,几Pshomt :: QSUB.木质素含量显著降低,从12 ~ 21%不等(图。4.a).检测经间苯三酚- hcl处理的茎切片木质素染色,两者之间没有任何差异Pshomt :: QSUB.线路和控件pShOMT:格斯行(数据未显示)。然而,在叶片切片上,典型的红色染色强度的降低被观察到的情况下Pshomt :: QSUB.与对照组相比,尤其在位于背面的粗纤维中(图。4.b)。
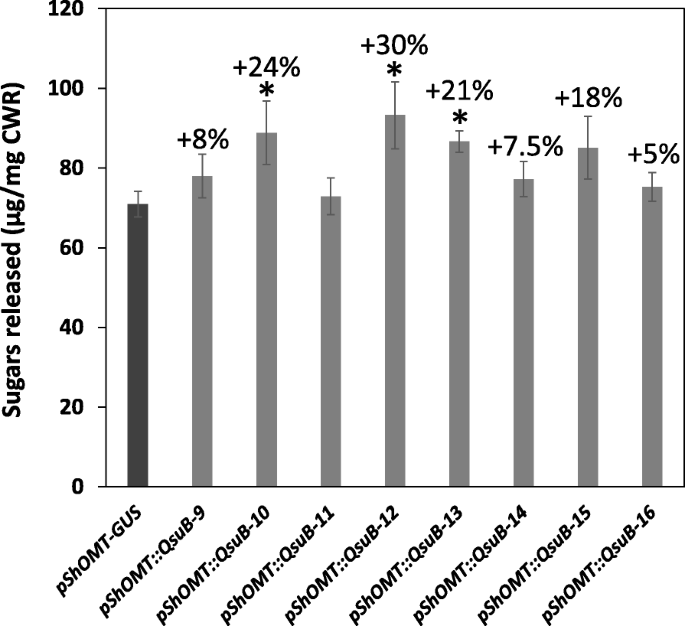
通过测量热水预处理后,通过使用商业纤维素酶鸡尾酒(CTEC2),通过测量从细胞壁残基释放的糖的量来评价工程化切换释放的生物质的酶促降解的酶促降解。使用商业纤维素酶鸡尾酒(CTEC2)。如图1所示。5.,获得了较高数量的还原糖Pshomt :: QSUB.与pShOMT:格斯控制线,显著增加了21%至30%。
讨论
在这里,我们描述了细菌3-脱氢草酸脱氢酶QsuB基因在控制下的成功表达Pshomt.柳枝稷。结果表明,所得到的植物显示出12-21%的木质素减少,2 - 3倍的生物积累PCA和5-30%的糖化效率提高。
Pshomt.在甘蔗、水稻、玉米和高粱的茎维管组织中具有优先活性[12],使它成为表达的良好推动者候选人QSUB.特别是在血管束内的血糖组织中。类似于以前的甘蔗制成的观察结果,我们能够从携带的SheckGrass线路中检测阀杆节点中的GUS活动pShOMT:格斯构造。然而,在携带的植物中,在一些离散区域观察到木质素含量的表观减少了来自携带的植物的叶片(即,纤维)Pshomt :: QSUB.结构表明,Pshomt.在次生壁积累的叶细胞中也很活跃(图。4.b).此外Pshomt.,试图用包含QSUB.在玉米泛素1基因组成启动子的控制下(pZmUbi-1)是不成功的,而使用pZmCesa10: QsuB含有玉米纤维素合酶基因启动子的结构体CESA10参与二次细胞壁形成[13](数字2,年代3.).这可能是使用这两种植物再生过程中发生毒性的结果pZmUbi-1: QsuB和pZmCesa10: QsuB构造。考虑到QsuB利用木质素生物合成基因的启动子来驱动木质素生物合成的转向QSUB.在植物发育期间,表达可能更适合空间上。有趣的是,单身pZmCesa10: QsuB线显示总木质素含量的降低以及叶片纤维中的甘油蛋白染色(图)2E, F).获得更多的柳枝稷转基因事件pZmCesa10: QsuBConstruct的有效性将被必不可少的验证PZMESA10驱动QsuB表达降低木质素含量。
QsuB表达降低柳枝稷木质素的确切机制尚不清楚;特别是,是否需要莽草酸的细胞质池HCT活性P.-COUMAROODL-SHIKITAY仍然待证明。同样,在不同的QSUB切换线中确定木质素单体组合物是有趣的,特别是相对量P.-羟基苯基(H)单位,已知在拟南芥QsuB植物中较高,通常在HCT下调的双子叶植物中增加[8.那14那15那16那17那18那19那20.].此外,在几种植物物种中最近发现 - 抑制推定的3-羟基酶(C3h)的切换基因的基因P.- 肉豆蔻酸盐,以及它们在木质素形成中作用的遗传证据Brachypodium distachyon,质疑HCT的独家作用和参与P.-香豆酸酯在单子叶木质素生物合成中的作用[21].
表达QSUB的SheckGrass线中PCA的过量生产可能是由QSUB活性催化的3-Dehydroshikim的内源库的部分转化产生。值得注意的是,PCA滴度的增加(与对照切换臂相比2-3倍)小于先前在拟南芥和烟草植物中报道的那些在拟南芥4-羟化酶基因的启动子下含有QSUB基因的烟草基因(Patc4h.)与对照植物相比,这与比较高至少两个数量级[8.那22].与这些观察结果相关,体外研究表明PCA作为柳枝稷至少一种HCT亚型(即PvHCT2)的竞争性抑制剂[23].因此,尝试识别推定是信息P.-COUMAROYL-PROTICATECH处理代谢物提取物中的缀合物Pshomt :: QSUB.SwitchGrass以确定是否这样的HCT混杂的活动 - 以及可能的HCT抑制 - 也发生在体内。最后,希望遵守QSUB工程战略有可能在SwitchGrass生物量中增强PCA滴度,因为若干技术经济学分析表明了生产共同产品的益处在足底使生物能源作物在经济上可持续发展[1那24那25].事实上,已经有几项研究报道了PCA作为碳源或途径中间体用于生物合成各种有价值的产品,如-酮己酸、穆康内酯、穆康酸、2-吡酮-4,6-二羧酸、二苯二烯和甲基酮[22那26那27那28那29那30.].
结论
QsuB工程方法已在柳枝稷建立。这项工作强调了一个事实,选择一个适当的推广驱动器QSUB.该基因的表达量是利用组织培养法成功转化其他作物的重要参数。考虑到Pshomt.通过生物和非生物应激反应的关键调节剂如水杨酸,茉莉酸和茉莉甲酸甲酯,诱导活性。12,对我们的设计进行实地测试是必要的Pshomt :: QSUB.Switchgrass评估其农艺性能和对环境压力的弹性。
方法
载体构建和植株转化
的启动子Pshomt.[12],PZMESA10(2. 6kb,位于玉米CESA10基因起始密码子上游——GenBank: AY372244.1)pZmUbi-1[31]用以下侧翼限制性位点合成:5'-ASCI / 3'-AVRIIPshomt.和5 ' - hindi / 3 ' -AvrIIPZMESA10和pZmUbi-1(Genscript,Piscataway,NJ)。通过酶消化释放启动子序列并将其连接到二元载体PA6-GW中[32]用AscI/AvrII或HindII/AvrII分别生成PA6-Pshomt-GW那PZMESA10-GW.,pA6-pZmUbi-1-GW二进制向量。进入载体pDONR221-schl::QsuB含有3-dehydroshikimate脱氢酶QsuB基因棒状杆菌属glutamicum前面含有叶绿体过渡肽的核苷酸序列[8.LR与之重组PA6-Pshomt-GW那pA6-pZmCesa10-GW,pA6-pZmUbi-1-GW利用Gateway克隆技术(Thermo Fisher Scientific, Waltham, MA)生成构建的载体pa6-pshomt-schl :: qsub那pA6-pZmCesa10-GW-schl: QsuB,PA6-PZMUBI-1-GW-SCHL :: QSUB,分别。来自-葡糖苷酸酶基因(GUS)编码的核苷酸序列大肠杆菌在pCAMBIA1301基因中,分别扩增attB1(5’)和attB2(3’)Gateway重组位点,并插入PA6-Pshomt-GW和pA6-pZmCesa10-GW通过网关克隆的向量生成构造pA6-pShOMT:格斯和PA6-pZmCesa10:格斯,分别。克隆引物列于表S1.二元载体转化为根癌土壤杆菌柳枝稷菌株AGL1 (黍virgatum如前所述,在密苏里大学的植物转化核心设施进行的转换[33]的胚性愈伤组织用于转化,由柳枝稷品种Alamo-A4(大德市汉考克农种公司)的成熟种子诱导。将潮霉素B (Life Technologies, Foster City, CA)以50 mg/L的浓度添加到选择培养基中。
植物生长条件
每组4株转基因柳枝稷移栽到含有Pro-Mix土壤的2加仑盆中,在22°C、60%湿度、250 μmol/m光照强度的条件下生长2/s,每天16小时的光照。
PCR基因分型
使用Plant DNeasy Plant mini kit (Qiagen, Carlsbad, CA)从每个事件中克隆的叶片组织中提取基因组DNA。特异性PCR引物QSUB.采用基因检测和引物对柳枝稷进行特异性检测PvUBQ6基因(GenBank: FE609298.1)评价gDNA质量。本研究所用引物见表S1.
RT-QPCR.
从E2阶段的植物第一个节间中提取总rna [34使用TRIzol试剂(Thermo Fisher Scientific, Waltham, MA)和cDNA合成使用高容量cDNA逆转录试剂盒(Applied BioSystems, Foster City, CA)如前所述[35].如先前使用的40次循环在95℃下组成的40个循环进行RT-QPCR,以在60℃下在60℃下组成的40℃,用于退火和扩增[35].相对量化QSUB.用2-计算成绩单ΔCT方法并标准化为参考基因PvUBQ6(基因库:FE609298.1)。结果为两个生物重复的平均值,每个生物重复在技术重复中进行分析。RT-qPCR引物列表见表S1.
木质素测定
Wiesner组织化学试验使用间苯三酚- hcl,一种与木质素中的针叶醛组反应的试剂,对E2阶段植物的茎和叶片横切面进行了如上所述[36那37].对于Klason木质素测量,将整个SwitchGrass植物从底部切割3厘米,在50℃下在烘箱中干燥生物质7天。干燥的生物质用配备1毫米网孔的4型威利研磨机(Thomas Scientific, Swedesboro, NJ)研磨。如前所述提取研磨的生物质[8.]和Klason木质素的测量使用标准NREL生物质协议[38].
糖化化验
使用搅拌机轧机MM 400(Retsch Inc.,Newtown,PA)和不锈钢球,从E5阶段的植物中获得的磨削和提取的生物量在E5阶段的植物中获得。对于糖化测定,用液态热水预处理来自每根线的10mg细化生物质粉末的四个生物学重复,然后使用1%w / w Cellic CTEC2酶混合物(Novozymes,丹麦),如前所述[35].使用3,5-二二硝基丙烯酸(DNS)测定,水解物用于测量还原糖[39].
ProtocateChuer测量
在E5期(旗叶不可见),将柳枝稷植株从底部3 cm处整株切下,在50°C的烘箱中烘干7天。干燥的生物质用配备1毫米网孔的4型威利研磨机(Thomas Scientific, Swedesboro, NJ)研磨。磨碎的生物质被球磨成细粉使用Mixer Mill MM 400 (Retsch Inc., Newtown, PA)和不锈钢球。代谢物从200毫克干燥的球磨生物质中提取,使用80% (v/v)甲醇:水,然后进行如上所述的酸水解步骤[8.].如前所述,使用高效液相色谱(HPLC)、电喷雾电离(ESI)和飞行时间(TOF)质谱(MS)检测代谢物提取物中原茶酸[40].定量使用6点校准曲线,从原茶酸溶液制备的可信标准(Sigma-Aldrich, St. Louis, MO)。
组织化学GUS测定
茎和叶的切片是用刀片从E4期的植物中手工获得的。如前所述,用2 mM 5-溴-4-氯-3-吲哚基-β-D-glucuronide (Sigma-Aldrich, St. Louis, MO)作为底物,在37°C下培养48小时,在植物切片上进行GUS测定[41].培养后,切片在95% (v/v)乙醇中脱水,然后观察70% (v/v)乙醇中的GUS染色。
可用性数据和材料
作者确保了支持数据和材料的可用性。在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。
缩写
- 轨:
-
细胞壁残留
- 格斯:
-
Beta-glucuronidase
- HCT:
-
羟基肉桂酰辅酶a:草酸羟基肉桂酰转移酶
- HPLC-ESI-TOF-MS:
-
高效液相色谱、电喷雾电离和飞行时间质谱
- 主成分分析:
-
Protocatechuate
- RT-QPCR:
-
实时定量逆转录PCR
参考文献
- 1.
Baral NR, Sundstrom ER, Das L, Gladden J, Eudes A, Mortimer JC,等。更有效地将木质纤维素原料转化为生物燃料和生物产品的方法。ACS维持化学工程2019;7:9062-79。
- 2.
马克尔女士,施贵文女士。定义和工程生物能源植物的原料原型。生物技术。2020;62:196-201。
- 3.
Sanderson Ma,Reed RL,McLaughlin SB,Wullschleger SD,Conger BV,Parrish DJ等。Switchgrass作为可持续的生物能源作物。贪婪的技术。1996年; 56:83-93。
- 4.
柳枝稷作为生物能源作物的改良。正确人选:Vermerris W,编辑。生物能源作物的遗传改良。纽约:施普林格;2008.309 - 45页。
- 5。
Lin CY, Donohoe BS, Ahuja N, Garrity DM, Qu R, Tucker MP等。影响柳枝稷组织培养的参数评价:向一个统一的程序农杆菌-介导的柳枝稷转化(黍virgatum).工厂方法。2017;13:113。
- 6。
EUDES A,LIANG Y,MITRA P,LOQUÉD。木质素生物工程。CurrOgin Biotech。2014; 26:189-98。
- 7。
Halpin C. Lignin工程改善草地上的糖化和消化率。CurrOgin Biotech。2019; 56:223-9。
- 8。
Eudes A,Sathitsuksanoh N,Baidoo Eek,George A,Liang Y,Yang F等人。细菌3-脱氢气相治脱水酶的表达降低了木质素含量并提高了生物质糖化效率。植物Biotechnol J. 2015; 13:1241-50。
- 9.
escamilla-treviñoll,shen h,hernandez t,yin y,xu y,dixon ra。早期木质素途径酶和转向林酸的途径(黍virgatuml .)。植物mol biol。2014; 84:565-76。
- 10.
Shen H,Mazarei M,Hisano H,Escamilla-Trevino L,Fu C,Pu Y等。切换植物中木质素生物合成的基因组学方法。植物细胞。2013; 25:4342-61。
- 11.
尼尔森RS,Stewart CN,Gou J,Holladay S,Gallego-Giraldo L,Flanagan A等人。开发和使用SheckGrass(黍virgatumL.)通过生物能源科学中心转型管道评估细胞壁重克群的植物。Biotechnol生物燃料。2017; 10:309。
- 12.
Damaj MB, Kumpatla SP, Emani C, Beremand PD, Reddy AS, Rathore KS等。甘蔗DIRIGENT和o -甲基转移酶启动子在不同的单子叶中提供茎调控的基因表达。足底。2010;231:1439-58。
- 13.
王浩,牛晓明,王海平,等。玉米纤维素合成:纤维素合成酶(CesA)基因家族的分离与表达分析。纤维素。2004;11:287 - 99。
- 14.
Ha cm,Fine D,Bhatia A,Rao X,Martin MZ,Engle Nl等。异位防御基因表达与生长缺陷有关Medicago Truncatula.木质素途径突变体。植物理性。2019; 181:63-84。
- 15.
Hoffmann L,Besseau S,Geoffroy P,Ritzenthaler C,Meyer D,Lapierre C,等。羟基氨基酰基焦酰基辅酶 - 辅羟基酰基氨基酰基氨基酰基氨基酰基酰基转移酶影响苯丙烷化生物合成。植物细胞。2004; 16:1446-65。
- 16。
Liang Y, Eudes A, Yogiswara S, Jing B, Benites VT, Yamanaka R,等。拟南芥中识别高效sgRNAs的筛选方法,与细胞特异性木质素还原结合使用。Biotechnol生物燃料。2019;12:130。
- 17。
彭XP,Sun SL,Wen JL,YIN WL,Sun RC。从羟基氨基酰基转移酶(HCT)下调转基因杨树的结构表征。燃料。2014; 134:485-92。
- 18。
Shadle G,Chen F,Srinivasa Reddy Ms,Jackson L,Nakashima J,Dixon Ra。羟基氨基酰基CoA的下调:转基因苜蓿中的Shikimate羟基氨基酰基转移酶影响褐化,发育和饲料质量。植物化学。2007; 68:1521-9。
- 19.
Van Acker等[1]研究了一种新的研究方法。用罕见缺陷等位基因(BRDA)繁殖:一种天然的杨树黑质以改性木质素的HCT突变体为例。新植醇。2013;198:765 - 76。
- 20.
周旭,杨松,陆敏,赵松,蔡玲,张勇,等。转C3H和HCT RNAi基因杨树苗的木质素结构及单体配比ChemistrySelect。2020; 5:7164-9。
- 21.
4-香豆酸3-羟化酶在木质素生物合成途径中是一种胞质抗坏血酸过氧化物酶。Nat Commun。2019;10:1994。
- 22.
吴伟,杜塔,范曼等。木质素定值:聚合木质素转化为增值化学品的两条混合生化途径。Sci众议员2017;7:8420。
- 23.
关键词:特谢拉;贝尼特;利用羟基肉桂酰辅酶a的底物混杂:莽草酸羟基肉桂酰转移酶降低木质素。植物生理学杂志。2016;57:568-79。
- 24.
康达NVSNM, Loqué D, Scown CD.经济可持续的木质纤维素生物炼制。正确答案:Kumar R, Singh S,编辑。生物炼制中木质纤维素生物质的稳定:从物流到环境和性能影响。Balan V: Nova Publishers;2016.321 - 38页。
- 25.
杨米,大石流,西蒙斯Ba,Mortimer JC,Shih PM,划分CD。高价值生物制作的积累在足底可以改善先进生物燃料的经济学。Proc Natl Acad SCI U S A. 2020; 117:8639-48。
- 26.
林海,别墅A.生物能源作物中生化的策略。Biotechnol生物燃料。2020; 13:71。
- 27.
关键词:大冢,日本,日本,河田,冈村通过原儿茶酸3,4代谢途径从木质素相关芳香族化合物中产生贝塔酮己二酸和麦内酯。生物工程学报。2016;121:652-8。
- 28。
Otsuka Y,Nakamura M,Shigehara K,Sugimura K,Masai E,Ohara S等人。高效地生产2-吡喃酮4,6-二羧酸作为来自微生物功能的新型聚合物基材料。苹果microbiol biotechnol。2006; 71:608-14。
- 29。
Rodriguez A, Ersig N, Geiselman GM, Seibel K, Simmons BA, Magnuson JK等。两种产油红酵母从工程原料中转化解聚糖和芳烃。Bioresour抛光工艺。2019;286:121365。
- 30.
董杰,陈勇,Benites VT, Baidoo EEK, Petzold CJ, Beller HR,等。甲基酮的生产假单胞菌putida由植物衍生的氨基酸增强。Biotechnol Bioeng。2019;116:1909-2。
- 31.
克里斯滕森啊,鹌鹑pH。泛素启动子基载体用于单胞内植物中可选和/或萃取标记基因的高水平表达。转基因Res。1996年; 5:213-9。
- 32.
杨F,Mitra P,Zhang L,Prak L,Verhertbruggen Y,Kim JS等。植物中的工程二次细胞壁沉积。植物Biotechnol J. 2013; 11:325-35。
- 33.
做PT, De Tar JR, Lee H, Folta MK, Zhang ZJ。ZmGA20ox cDNA的表达改变了柳枝稷的植物形态,增加了生物量(黍virgatuml .)。植物生物技术2016;14:1532-40。
- 34.
哈丁CF, Fu C, Hisano H, Xiao X, Shen H, Stewart CN,等。用于细胞壁和生物量性状分析的柳枝稷样品采集的标准化。生物能源研究》2013;6:755 - 62。
- 35.
李G,琼斯KC, Eudes Pidatala VR,太阳J,徐F, et al。水稻BAHD酰基转移酶基因在柳枝稷中的过表达(黍virgatumL.)增强糖化。BMC Biotechnol。2018; 18:54。
- 36.
Hao,Monhen。木质和木质素生物合成的综述:研究拟南芥的基础,血液缺血表型。Crit Rev Biochem mol Biol。2014; 49:212-41。
- 37.
Hao Z, Avci U, Tan L, Zhu X, Glushka J, Pattathil S, et al. .拟南芥GAUT12/IRX8缺失导致花药不裂,导致G木质素减少,与基质多糖沉积改变相关。植物科学与技术,2014;
- 38.
杨晓东,李建平,李建平,等。生物质中结构碳水化合物和木质素含量的测定。中国化学工业出版社,2005。见于:实验室分析程序。技术报告,NREL /TP-510-42618。Golden:国家可再生能源实验室;2008.
- 39.
二硝基水杨酸试剂测定还原糖的使用。肛门化学1959;31:426-8。
- 40.
EUDES A,Juminaga D,Baidoo Eek,Collins FW,Keasling JD,LoquéD。从葡萄糖中产生羟基氨基酰·蒽酸盐大肠杆菌.《微生物细胞工厂》,2013;12:62。
- 41.
Jefferson RA, Kavanagh TA, Bevan MW。GUS融合:β -葡萄糖醛酸酶作为高等植物敏感和通用的基因融合标记。EMBO j . 1987; 6:3901-7。
确认
作者感谢Zhanyuan J. Zhang博士和密苏里大学植物转型核心设施的工作人员,以进行交换草转型工作,以及用于提供窃款CTEC2的诺酶。
资金
这项工作是美国能源部联合生物能源研究所(http://www.jbei.org.),由美国能源部、科学办公室、生物与环境研究办公室支持,劳伦斯伯克利国家实验室与美国能源部签订了DE-AC02-05CH11231合同。美国政府保留和出版商,通过接受文章的出版,承认美国政府保留非排他性的,付费的,不可撤销的,世界范围的许可证,以出版或复制本手稿的出版形式,或允许其他人这样做,为美国政府的目的。资助机构没有参与研究的设计、数据收集、数据解释或手稿的撰写。
作者信息
从属关系
贡献
ZH和SY种植了这些植物;ZH、SY、TW进行PCR分型和RT-qPCR;ZH和SY分别进行GUS和间苯三酚- hcl染色;AS和SY进行了Klason木质素测量;AS进行代谢物提取;GW和EEKB进行了HPLC-ESI-TOF-MS分析;VTB设计了植物二进制向量;SY进行糖化试验;AE撰写稿件;ZH、PCR、HVS、DL编辑稿件; PCR, HVS, DL, and AE supervised the research. All authors have read and approved the manuscript.
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
AE和DL是该研究相关专利(US10415052B2)的作者。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
在窝藏的各种耕作线的各种分蘖部分中显示GUS活动的代表图片pShOMT:格斯构造。GUS在茎节中特异性表达。刻度:白条= 2毫米,黑条= 400μm。n:节点;在:internode,是:横截面。
附加文件2:图S2。
一个柳枝稷线的特性pZmCesa10: QsuB构造。(一)在窝藏的各种耕作线的各种分蘖部分中显示GUS活动的代表图片pZmCesa10:格斯构造。GUS的表达主要集中在节间,尤其是维管束发育过程中(红色箭头)。刻度:白条= 2毫米,黑条= 400μm。n:节点;在:internode,是:横截面。(B)检测到QSUB.PCR基因在线PZMESA10 :: QSUB-5.(C)检测QSUB.由RT-qPCR成绩单。QSUB.相对于的表达水平PvUBQ6所示。值是两个生物重复的±SD(N= 2)。(D)在SwitchGrass线的生物质中测量的Protocatechuate(PCA)含量PZMESA10 :: QSUB-5.包含pZmCesa10:格斯Construct作为对照。数值为三个生物重复的平均值±SE (N= 3)。星号表示使用未配对的学生t检验(*P.< 0.001)。(e)从柳枝稷的生物量中获得的细胞壁残留物(CWR)中木质素含量的测定PZMESA10 :: QSUB-5.包含pZmCesa10:格斯Construct作为对照。值是四种生物复制的±SE(N= 4)。星号表示使用未配对的学生t检验(*P.<0.05)。(F)茎和叶片横截面的代表图片用甘油酸-HCl染色线PZMESA10 :: QSUB-5一行包含pZmCesa10:格斯构造。值得注意的是,叶染色减少,特别是位于线的正轴和背面的粗纤维PZMESA10 :: QSUB-5(红色箭头)。
附加文件3:表S1。
在研究中使用的寡核苷酸。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Hao, Z., Yogiswara, S., Wei, T.。等等。细菌3-脱氢气候脱水酶(QSUB)的表达减少了木质素,并提高了SwitchGrass中的生物质糖化效率(黍virgatuml .)。BMC植物杂志21日,56(2021)。https://doi.org/10.1186/s12870-021-02842-021-02842-9.
收到了:
公认:
发表:
关键词
- switchgrass.
- 木质素
- Shikimate
- Protocatechuate
- 糖化
- 生物能源