摘要
背景
AP2/ERF (APETALA2/ethylene responsive factor, AP2/ERF)转录因子是植物特异的转录因子家族,是最大的转录因子家族之一。乙烯反应因子(ERF)调节植物生长,发育和对生物和非生物胁迫的反应。在以前的一项研究中,ERF2.基因在抗性和易感番茄品种中显着上调,响应于苯磺酸苯磺酸镁.本研究的主要目的是系统地分析ERF.家庭并探索机制ERF2.利用病毒诱导的基因沉默技术对番茄植株进行抗病原侵染。
结果
在这个实验中,134ERF.探索基因并进行生物信息分析并分成12个组。时空表达特征ERF.番茄中的转录因子基因家族多样化。结合RNA-SEQ,我们发现18的表达ERF.接种后转录因子增加S番茄.在ERF2.- 接种后观察到植物,易感表型被观察到S番茄.过敏反应和ROS生产在下降ERF2.- 植物。生理分析表明超氧化物歧化酶,过氧化物酶和过氧化氢酶活性较低ERF2.- 比在对照植物中的植物,而SA和JA含量较低ERF2.-沉默植株比对照植株接种后S番茄.此外,结果表明ERF2.可直接或间接调节PTO.,PR1B1和PR-P2提高番茄抗性。
结论
在这项研究中,我们确定并分析了番茄的成员ERF.利用生物信息学方法对这些基因进行分类、描述和分析。随后,我们使用VIGS技术显著降低了基因的表达ERF2.在西红柿里。结果表明ERF2.对番茄抗病性有积极影响S番茄.有趣的是,ERF2.在多种SA、JA和ROS信号通路中发挥关键作用,授予抗入侵黄瓜。此外,ERF2.可直接或间接调节PTO.,PR1B1和PR-P2表达和增强番茄抗性黄瓜。本研究为番茄抗病育种提供了基因资源。
背景
番茄易受各种疾病的影响,严重影响产量和质量。灰斑病S番茄是番茄全世界最具破坏性的真菌疾病之一。然而,植物已经开发出一种精心的信号网络来抵抗通过激活一系列抗性基因的表达来抵抗病原体的侵袭。此外,转录因子(TFS)起在各种防御响应途径中调节特异性抗性相关基因表达的基本作用。乙烯敏感因子(ERF)属于植物中AP2 / ERF超家族的亚家族。的ERF.族的定义是一个守恒的存在ERF.结构域由58或59个氨基酸组成,其中包含一个n端、一个三链β-片和一个c端α-螺旋。该家族广泛参与调节植物的发展,以及响应非生物和生物的胁迫。到目前为止,一些成员ERF.家庭被研究。先前的研究已经确认ERF.基因(PTI4./5/6基因),可能与发病相关PTO.蛋白激酶[1.].例如,过表达拟南芥pti4.可增强抗药性假单胞菌通过调节含GCC盒基因的表达来侵袭[2.,3.]. 同时,PTI5.在以前的研究中分离到它与PTO.基因[1.].此外,先前的研究表明番茄的过度表达ERF2.能增强对小麦的基础抗性两PV。番茄 [4.].
AP2/ERF (APETALA2/ethylene responsive factor, AP2/ERF)转录因子是植物特异的转录因子家族,是最大的转录因子家族之一。这些转录因子对植物生长和生理活动有重要影响,甚至影响进化[5.].AP2超家族由AP2、ERF、RAV三个亚家族组成,包含更多的AP2超家族ERF.家族成员比其他亚家族。AP2基因首次分离于拟南芥并发现调节花朵发展[6.,然后在细菌和病毒HNH内切酶中检测到AP2结构域[7.].随后,ERF.在烟草中发现,并发现存在于从烟草中分离的四种乙烯反应结合蛋白中,即,ERF1.,2,3和4 [8.].ERF.家族蛋白只包含一个保守结构域AP2,有60到70个氨基酸残基,以及ERF.可以分为两个亚属,ERF.和CBF公司/Dreb.根据保守氨基酸残基和结合序列的差异。基因的DNA结合域ERF.亚家族特异性与CIS作用元件GCC盒具有保守的AGCCGCC序列[9,10.].的能力ERF.向下游基因的功能表达发出正或负面影响,基于GCC盒环境中的核苷酸[11.].Dreba亚家族可以识别干旱诱导的元素DRE(TACCGACAT)和低温诱导的元素CRT(AGCCGAC)[12.]参与乙烯信号传导途径,帮助植物抵抗逆境的影响[13.,14.].
SALICYLIC酸(SA),乙烯(ET)和茉莉酸(JA)已被鉴定为在各种防御响应途径中起关键作用的信号传导分子。SA途径对ET / JA途径拮抗;然而,PTI4.和ATERF1由SA和JA / ET途径诱导[15.,16.]. 此外,研究表明PTI4.,PTI5.和PTI6.可能通过与其他TFs相互作用间接调节SA反应拟南芥[3.].ERF.显示TFS通过与其启动子区域中的含GCC(AGCCGCC)的基因结合来调节PR基因的表达[17.].在此之前,PTI4./ 5/6显示与之相互作用PTO.基因并结合GCC盒以激活植物防御响应对病原体的PR基因的表达[1.].
在本研究中,PlantTFDB用于识别和分析134ERF.番茄中的转录因子家族,包括它们的物理和化学性质,进化分组,保守的主题,基因结构,染色体位置,蛋白质三级结构和组织特异性表达。进一步审查的作用ERF2.基因在抵抗力S番茄在番茄中,我们使用病毒诱导的基因沉默(Vigs)来下调ERF2.抗性番茄植物中的基因表达。此外,我们确定了潜在的信令调节网络ERF2.参与抵抗S番茄.在这项研究中,我们旨在确定的作用ERF2.在回应S番茄为培养造型番茄品种提供理论依据。
结果
土壤理化性质的鉴定与分析ERF.转录因素
一共137个西红柿ERF.基因被智能确认(http://smart.emblheidelberg.de/smart/batch.pl.)和CDD(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)在线工具。没有完整AP2 / ERF结构域的基因被丢弃。最后,筛查了134个转录因子。如补充表所示1.,序列最长,分子量最大Solyc04g071770.2.1,分别为452 aa和49582.81;观察到最短的序列和最轻的分子量solyc10g080310.1.1,分别为73 AA和8382.60。等电点的范围从4.09(solyc10g076380.1.1)至10.08 (solyc10g080310.1.1).不稳定系数范围为21.51(solyc12g038450.1.1)至86.25(solyc01g090340.2.1).在转录因子中,成员solyc03g093530.1.1,solyc06g050520.1.1,solyc06g063070.2.1,solyc10g080310.1.1,SOLYC0080650.1.1电缆,solyc12g038440.1.1, 和solyc12g038450.1.1所有的不稳定系数都低于40,表明它们比其他的更稳定。总平均亲水性范围为− 1.122 (Solyc06g068830.1.1)至−0.303 (solyc03g006320.1.1),表示亲水性蛋白质。
系统发育树ERF.转录因素
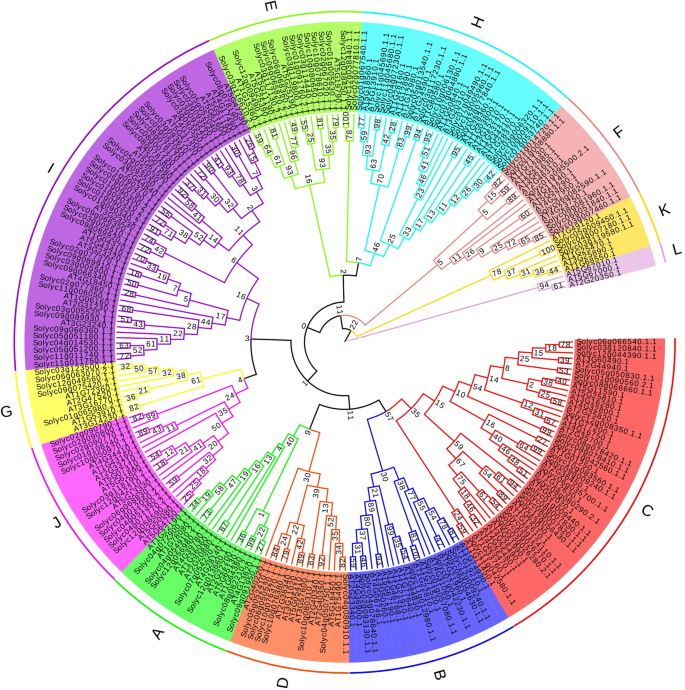
共有134个番茄ERF.转录因子和122ArabidopsisERF.基因组合构建了一个完整的系统发育树。根据保守域分组和ERF.家庭基因拟南芥,番茄和ArabidopsisERF.将该实验中的转录因子基因分成12组(图。1.). 在这些组中,A、B、C和D组包含CBF公司/ERF博士亚科,与A6、A5、A1/A4和A2相对应拟南芥分别分别。没有A3-亚家族基因ERF.番茄科,证明没有结构和功能类似的基因AT2G40220.1.在番茄。在之前的研究中,12ERF.基因分为B6组拟南芥蒂利亚纳[18.,19.]. 根据基序分析,将B6基因分为3组。因此,在本试验中,B6被分为三组(E,K,L),并没有番茄ERF.L组基因。组F、G、H、I和J对应于图中的B5、B2、B1、B3和B4组拟南芥, 分别。共有43个基因属于CBF / Drbe亚家族,92个基因属于ERF.亚家族。小组我包含了最多的番茄ERF.基因,35。
基因的保守基序分析和基因结构分析ERF.转录因素
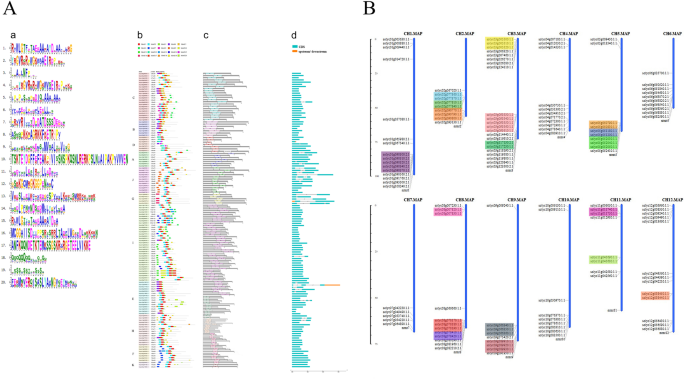
了解番茄保守基序的具体分布ERF.通过在线MEME分析工具识别出20个保守的图案(http://meme-suite.org/).图中显示了发现的20个保守motif的logo,图中显示了它们在各子组中的位置信息。2.A-a。平均而言,每个成员包含4个图案,Solyc11g006050.1.1软件拥有最多的母题,为7个(图。2.A-B)。结果表明,由锡序1,2和3构成的保守的AP2结构域在番茄序列中最受保守ERF.转录因子与其他保守因子共同促进了基因的多样性和一致性。在这些转录因子中,有18个C、B、D、E和H亚群缺少基序2。同样,亚群B、D、J和I的大多数基因包含motif 15。Motif 5在C和b组中检测到,Motif 6出现在C、D、I亚组成员中,并保守在蛋白序列的C端。在F和K两组中,序列的n端均发现motif 7是保守的。Motifs 8/9/12/16/20是C/J/D/G/E组所特有的。第一组的成员最多,对应的是最具特色的母题,母题10/11/13/14/17。结果表明,同一亚群的成员在级别和位置上相似,不同亚群中独特的保守基序也增强了系统发育树的支持度。番茄保守结构域的分布ERF.族如图所示。2.得了。大部分的ERF.AP2是一个长度约为60-70个氨基酸的保守结构域。例如,solyc05g052410.1.1和Solyc08g081960.1.1,除含有AP2外,还含有H+- 分别 - 酶亚亚基H(NTPH)超家族和黄酮氧素结构域。的名称Solyc02g077810.1.1保守结构域与AP2超家族相同。进化分支成员的亲缘关系越密切,其保守域的亲缘关系越密切,其生物学功能也越相似。同一亚群成员之间保守结构域排列的不同可能是由子代的进化或重组突变引起的。
进一步研究基因结构ERF.转录因子家族,通过基因结构显示服务器(GSD)分析平台获得134个成员的内含子和外显子的结构分布图(http://gsds.cbi.pku.edu.cn/)(图。2.A-d)。如图所示,番茄的大多数成员ERF.家庭仅包含外显子(107/134,79.8%)。这种结构特征类似于ArabidopsisERF.家庭。在B、F、K亚群中未发现内含子,在C、D、I亚群中仅发现一个内含子。在番茄中含内含子的成员比非含内含子的成员数量少ERF.家庭可能是由于进化期间增加或内含子的损失。
番茄的分布ERF.染色体上的转录因子
134年ERF.番茄中的转录因子显示12条染色体上的不均匀分布(图。2.b)。染色体3载有大多数成员,22名成员。染色体7含有最少的,只有五名成员。总共16,9,22,11,10,10,5,12,9,9,8和13ERF.基因顺序分布于番茄1-12号染色体上。串联重复序列定义为同一染色体上100kb内的相邻基因。在番茄中有20对基因ERF.展示串联复制的家族以及染色体3上的串联复制基因的数量是最高的,4对,包括总共13个基因。串联复制导致生产多种基因集群。成员ERF.番茄家系中有39.5%的染色体为串联重复,75%的染色体为串联重复。
番茄的表达ERF.不同器官的转录因子家庭
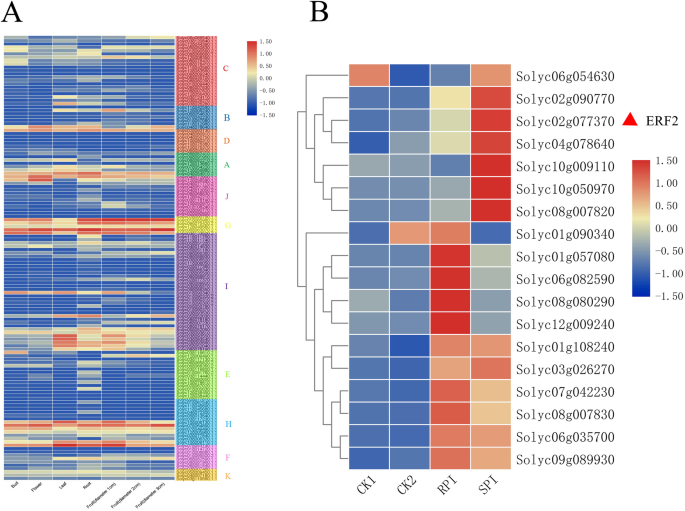
更好地了解的角色ERF.我们利用之前发表的番茄RNA-seq数据绘制了一个热点图ERF.组织特异性表达(图。3.一种)。结果表明,番茄中大部分基因的表达ERF.家庭在芽,花,叶,根和番茄果实中很低。表达水平solyc06g063070.2.1,Solyc03g123500.2.1型, 和solyc07g064890.1.1.1在番茄幼苗中与其他基因相似且含量较高。solyc06g063070.2.1鲜花中的表达水平最高。的solyc12g056590.1.1,solyc07g064890.1.1.1,Solyc04g072900.1.1, 和Solyc03g123500.2.1型基因在花中高度表达。solyc07g053740.1.1叶子中的表达最高。的solyc10g006130.1.1,solyc03g093540.1.1,solyc03g093550.1.1,solyc06g063070.2.1,Solyc03g093560.1.1电缆, 和solyc05g052040.1.1基因在叶片中也有较高的表达水平。solyc06g063070.2.1也是根中表达量最高的基因。的Solyc01g065980.2.1,solyc07g053740.1.1,solyc07g064890.1.1.1,solyc04g054910.2.1, 和Solyc09g075420.2.1基因在根中有较高的表达。在果实膨大期,随着果实直径的增加,一些基因的表达量下降,而另一些基因的表达量则相反。这个Solyc01g065980.2.1该基因在直径为1的果实中表达量最高 厘米。随着果实的逐渐成熟,该基因的表达水平下降。表达solyc06g063070.2.1基因显示出果实的上升趋势,其成熟的果实,具有3厘米的水果中的最高表达。
表达模式ERF.番茄接种中的转录因子S番茄
在这项研究中,我们筛选了18岁ERF.基因基于转录组数据。将这些基因分为两组。结果表明除了solyc06g054630.和solyc01g090340.,表达16ERF.在接种后RNA-SEQ数据中检索的基因增加(图。3.b)。值得注意的是,在第一组中,差异主要显示在CK2和SPI中,而在另一组中,它以CK1和RPI显示。这表明了这些ERF.基因在番茄抗病原菌侵染中发挥积极作用。
系统发育分析和序列比对ERF2.
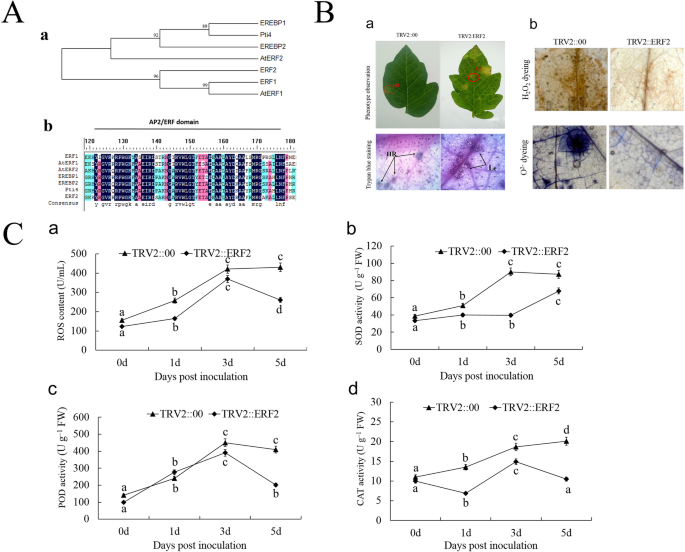
编码序列ERF2.有一个AP2 / ERF结构域,该蛋白质属于ERF.TF B-3系列(图。4.A-A)。此外,ERF2.和番茄有密切关系吗ERF1.和A.拟南芥.结果表明ERF2.可能与植物中的其他B-3家族成员有类似的功能。对保守蛋白质序列数据库的分析表明ERF2.与他人有很高的相似性ERF.蛋白质的整个假定蛋白质序列(图。4.A-B)。
序列比对、表型分析和酶活性分析ERF2.在番茄。A.系统发育树及序列比对ERF2..(a)…的系统发育树ERF2.以及其他ERF.蛋白质;通过AP2/ERF结构域的氨基酸序列构建系统发育树。(b)的一致性ERF2.和其他人ERF.蛋白质。ERF2.由ERF域组成。黑色和浅灰色颜色分别代表相同和保守的氨基酸,较暗的蓝色表示相同氨基酸的更大百分比。B沉默后的表型和生理变化ERF2.基因。(a)沉默ERF2.番茄植物中的抗病性降低。的ERF2-沉默的植物表现出疾病症状,在3dpi的叶片上具有病变,并且在TRV2空载体植物中仅观察到没有疾病症状的过敏反应。(b)H组的组织病理学观察H.2.O2.和o.2.−. HR,超敏反应;Le,病变。C、 番茄接种番茄后ROS含量(a)、SOD(b)、POD(C)和CAT(d)活性的变化S番茄在不同的时间点。数据显示在(C)来自三个独立实验的平均值±SD,列上方的不同字母表明了显着的差异P < 0.05 level
ERF2.- 沉默的植物表现出抗病的抗病患者S番茄
调查是否ERF2.影响番茄植物防御S番茄,我们进行了VIGS下调ERF2.基因表达。为了防止干扰其他表达ERF.基因,我们选择的靶片段如补充图所示1.. 结果表明,该病症状明显ERF2.- 与接种后的TRV2空载体植物相比,植物S番茄.在里面ERF2.-沉默的植物,病变加重,并观察到穿孔。相反,在TRV2空载体植物中仅观察到无疾病症状的超敏反应(HR)(图。4.B-A)。这些结果表明沉默ERF2.抗病番茄植株中的基因可能会削弱番茄的抗病性黄瓜。
如图。4.B-A,低水平的菌丝体菌丝和具有坏死病变的弱HRERF2.- 植物。然而,在TRV2 :: 00空向量植物中观察到没有悬垂生长的强劲的HR症状。因此,这些结果表明人力资源受损ERF2.-沉默植株与TRV2::00空载体植株相比,在3 dpiS番茄.
累积H.2.O2.和o.2.−在ERF2.- 植物
H的积累2.O2.和o.2.−可用于评估番茄植物中抗病抗性的影响。在3 dpi,h2.O2.TRV中的积累太弱,无法观察到:ERF2.植物与TRV :: 00空传染媒介植物相比。H2.O2.在TRV :: 00比TRV ::植物中观察到,比TRV ::更丰富ERF2.植物(图。4.B-B)。基于这些结果,我们认为ERF2.基因表达可降低抗药性S番茄在番茄植株中。
ROS含量和SOD,POD和CAT活动测定
在时间过程中检测到ROS生产和酶活性;因此,收集0,1,3和5dPI的叶片以确定ROS含量和SOD,POD和猫活动。接种S番茄使ROS含量和SOD、POD、CAT活性在3dpi时急剧升高(图。4.C)。特别是,在ERF2.在1、3和5 dpi时,沉默植株的ROS含量和SOD、POD、CAT活性均低于对照植株。
ERF2.可以增强抗病能力吗S番茄通过SA和JA信号通路
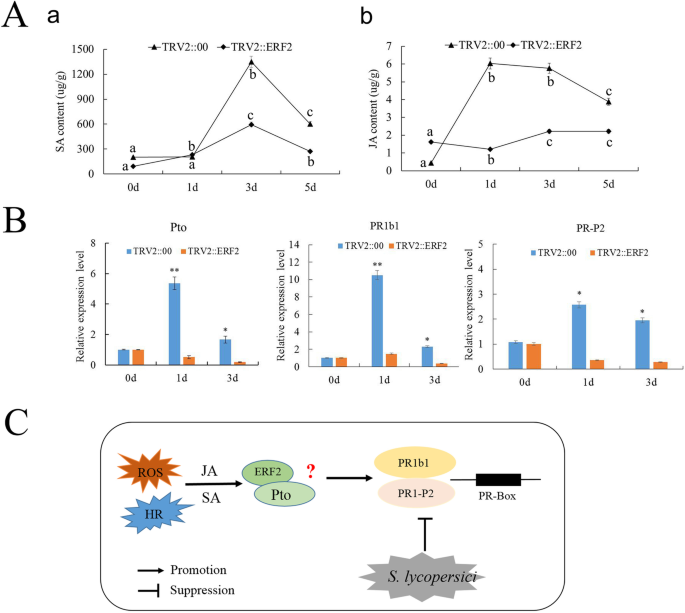
分析荷尔蒙反应S番茄采用液相色谱-质谱联用(LC-MS)法测定小鼠血清中JA和SA的含量ERF2.-silenced和trv :: 00植物。对于SA,TRV2 ::的内容ERF2.和TRV :: 00植物在3天达到顶峰,后者的内容比前者的内容大4.7倍。JA水平ERF2.-沉默植株显著低于接种TRV::00的植株S番茄(图。5.一种)。这些结果表明ERF2.可能同时参与SA和JA信号通路,以提高抗病性S番茄在番茄植株中。
ERF2.-Silencing减少了PTO.和PR.基因表达水平
先前的研究表明Pti4/5/6与PTO.调节抗病能力。此外,许多研究表明ERF.基因调节PR基因的表达,增强植物对疾病的抗性[20.,21.].这里,QRT-PCR用于识别之间的调节关系ERF2.以及防御基因PTO.和PRS.. 如图。5.B、 基因的表达水平Pto,PR1b1和PR1-P2基因在实验组显著减少ERF2.-与TRV::00株接种后沉默植株的比较黄瓜。因此,我们提出ERF2.增强疾病抵抗力S番茄通过直接或间接调节PTO.番茄植株中的PR基因。
特别地,研究表明,人力资源和ROS的积累比在易感品种中更强,导致疾病抵抗力改善[22.].与以前的研究一致,我们的研究表明,下调基因表达ERF2.降低HR诱导的细胞死亡,减少H2.O2.,和2.−在ERF2.-静音植物与TRV::00植物相比。这些结果表明,在抗病过程中,ROS的积累与HR呈正相关黄瓜。
许多研究表明,PR基因表达的调控ERF.TFs需要gc -box或DRE/CRT顺式作用元件的组合[23.,24.]. 此外,研究表明,GCC盒侧不同的序列会影响蛋白质的结合效率ERF.,表明各种各样的ERF.可以调节不同的基因套[25.].PR-P2和PR1b是JA/ET-和SA介导的防御信号通路的代表性标记基因。尤其是西红柿PTO.该基因可增强接种后的防御反应P丁香PV。烟[26.]. 番茄的过度表达PTO.可激活PR抗性基因的表达假单胞菌物种之间的相互作用PTO.调节抗病能力的蛋白质[20.]. 在这里,我们的研究表明ERF2.基因表达可降低细胞凋亡率PTO.介导的抗性黄瓜。此外,PTI4./5/6 TFs与PR box结合调节基因表达。同样,我们的研究也表明,让ERF2.基因降低了基因表达PR1B1和PR-P2. 总之,这些结果表明ERF2.可直接或间接调节PTO.,PR1B1和PR-P2表达和增强番茄抗性S番茄.但是,它仍有待确定是否ERF2.与PTO.调控PR基因表达,增强番茄的抗性S番茄(图。5.C)。
此外,之前的研究还表明,SA和JA是参与PTI和ETI的重要信号传导分子,调节植物疾病和对非生物胁迫的反应[27.,28.]. 此外,SA和JA/ET信号通路可以诱导防御反应,包括大多数基因的表达PR.蛋白质[29.,30.,31.].我们的数据与前一个结果一致,即SA和JA内容下降ERF2.-与TRV::00植物相比,沉默植物表明ERF2.番茄抗逆性的研究进展S番茄可能依赖于SA和JA信号通路。
讨论
乙烯是植物中最重要的激素之一,其生理功能通过一系列生理活动影响植物的生长发育。乙烯受体调节下游ERF.并通过信号介导刺激相关基因的表达[32.].的ERF.家庭是一大家族的转录因子,是植物独有的。迄今为止,ERF.在各种植物水果中已鉴定转录因子。其家庭成员在每株植物中都有守恒的特征。系统发育分组还揭示了相似之处,但基因数量变化:拟南芥有122个基因[19.],米有131[18.,玉米有133个[33.]小麦有104,苹果有51 [34.],和芸苔栗鸟有286个(35.]. 在某些物种中,个体亚群不存在,没有低等植物含有单体,一些高等植物含有单体。所有研究的类群都属于双子叶植物或单子叶植物系统,因此推测ERF.转录因子家庭在分离二坐子和单子圈子之前完成分化。物种演化过程中的基因突变,染色体交换和基因损失是表达差异和功能多样性的所有原因ERF.家庭在不同的物种。
在这个实验中,有137个番茄ERF.使用植物转录因子数据库获得基因。在检测到保守结构域中,134个基因符合要求,因此它们被挖掘并进行生物信息分析。这个实验分开了134ERF.成员基于基因的保守领域进入12个组。Sakuma分裂了ArabidopsisERF.将成员分为A1-A6(属于DREB亚家族)和B1-B6(属于ERF.亚科)。中野分裂ArabidopsisERF.根据Sakuma的那些,家庭成员分为两组,即十组I-X和VI类(VI-L)和XB类(XB-L)组。该实验采用了类似于Nakamo的分组方法。第VI-L组对应于K组,XB-L组不含同源番茄ERF.基因。同一思工中的基因具有最近的血缘关系,并且可能进行类似或互补的生理功能。初步了解番茄功能ERF.同一分支或同一类群中的基因可以通过了解相应基因的功能而获得ArabidopsisERF.基因。转录因子中参与植物生长发育调控的保守结构域往往由不同的保守基序组成。在本研究中,motif 1、2、3、4和15对应于AP2结构域的保守部分,其中最保守的是WLG和YRG。除AP2的保守结构域外,同一亚组的转录因子还包含一个或多个特定的基序,可能与AP2的不同调控功能有关ERF.成员,反映了功能的功能多样性ERF.家庭,有潜力促进核定位与蛋白质之间的相互作用[36.].的ERF.Family大部分没有内含子,正如在一些物种中已经证明的那样[18.,35.]. 拿拟南芥以20多个基因为例,只有少数基因含有内含子,与本研究结论相似,且内含子位于保守位置,验证了分组的可靠性。缺少内含子可能是由于在进化过程中缺少内含子转座子或内含子丢失。当植物完成进化时,往往会发生基因复制,从而扩大和丰富了基因组中基因的数量和功能。结果表明,9条染色体上有53个基因存在串联复制。这说明ERF.家族主要依赖串联重复。三级结构的同源性模拟结果ERF.蛋白质显示,同一亚家族中蛋白质的三级结构是相似的,而不同亚家族中基因的三级结构因空间角度不同而不同。但总体而言,AP2结构域的空间结构是由3个平行于β-片α-螺旋的反平行β-片组成,这与之前的结论相同[37.].
已有研究表明,AP2/ERF蛋白在各种生物应激反应的转录调控中发挥重要作用。此外,b亚家族基因已被证明参与了对各种疾病的抵抗[18.据报道,B-3亚家族成员调节植物疾病抵抗[38.]. 在本研究中,系统发育分析表明ERF2.属于B-3亚家族ERF.蛋白家族,ERF2.表现出密切的关系ERF1.和ATERF1. 以前的研究表明ERF1.和ATERF1在抗病抵抗中发挥作用。在本研究中,我们的结果表明,下调基因表达ERF2.受损疾病抵抗力黄瓜,并观察到明显的病变ERF2.-静音植物与TRV::00植物比较。
结论
在这项研究中,我们确定并分析了番茄的成员ERF.通过生物信息学方法进行家庭,然后进行分类,描述和分析这些基因。共134岁ERF.基因分为12个分支,同一分支中的基因具有相似的基因结构。这些基因在番茄植物的不同器官中的表达是特异性的。我们发现了ERF2.是AP2 / ERF TF,积极地调节番茄植物抵抗力S番茄中收取。有趣的是,ERF2.在多种SA、JA和ROS信号通路中发挥关键作用,授予抗入侵黄瓜。此外,ERF2.可直接或间接调节PTO.,PR1B1和PR-P2表达和增强番茄抗性黄瓜。总之,本研究为番茄植物中抗性育种提供了基因资源。
方法
植物材料
番茄抗性品种。汽车旅馆)由中国农业科学院提供。所有番茄植株均在人工气候室中生长,光暗循环(LD)为16 H 长:8 光照条件为:光照强度40000lx,温度24℃ °C,相对湿度60%;黑暗条件如下:温度16 °C和相对湿度50%。S番茄于28℃左右接种于马铃薯葡萄糖琼脂(PDA)上 2°C 直到孢子产生。
番茄鉴定ERF.转录因子家庭成员
番茄的蛋白质序列ERF.转录因子家族基因从PlantTFDB下载(http://planttfdb.cbi.pku.edu.cn.).根据番茄的PFAM PF00847ERF.从PFAM数据库获得的转录因子AP2结构域,通过使用在线蛋白质结构预测工具智能识别所有序列(http://smart.embl-heidelberg.de/)不含AP2结构域的基因被删除。在ExPASy网站上,所有番茄蛋白质氨基酸序列的物理和化学性质,如蛋白质长度和分子量ERF.预测筛选的转录因子。
番茄的系统发育分析ERF.转录因子家庭
我们引入了ArabidopsisERF.转录因子家族作为番茄的参考ERF.在构建番茄的系统发育树时分组ERF.转录因子家族。139个氨基酸序列的ArabidopsisERF.从PlantTFDB数据库获得转录因子家庭。排除了没有保守结构域的重复基因和基因。保守AP2域的多音阶对齐ERF.番茄家族和拟南芥蒂利亚纳,并将结果导入MEGA 7.0软件,构建ERF.家庭。所采用的算法是邻居连接(NJ)模型,验证的bootstrap值设置为1000,模型选择参数为p距离。进化树是用EvolView v3在线编辑的(https://www.evolgenius.info/evolview.)[39.].
番茄的结构分析ERF.转录因子家庭
番茄氨基酸序列的保守基序分析ERF.家庭是通过模因在网上表演的(http://meme-suite.org/). 最大搜索基序数设为20个,氨基酸宽度设为6-50个。番茄保守结构域的基本信息ERF.家族数据来源于NCBI的保守域数据库(CDD),利用DOG 2.0软件(http://dog.biocuckoo.org/index.php)[40].德牧(http://gsds.cbi.pku.edu.cn/)在线分析功能用于获得番茄ERF.转录因子家族外显子和内含子遗传结构模式。番茄的编码序列(CDS)和基因组序列信息ERF.转录因子家族由SGN (https://solgenomics.net/).
番茄的染色体定位ERF.转录因子家庭
获得位置信息后ERF.以SGN数据库中的12条番茄染色体为家系,用MapInspect软件完成番茄染色体的分析ERF.家庭染色体位置图(http://www.plantbreeding.wur.nl/uk/software_mapinspect.html.). 西红柿ERF.确定了具有连环复制的基因。
番茄的蛋白质三级结构分析ERF.转录因子家庭
通过在线分析软件SWISS-MODEL (https://swissmodel.expasy.org/)[41.],所有的番茄基因ERF.对转录因子家族进行同源建模,分析并预测其三级结构ERF.家族蛋白质。
分析番茄的表达模式ERF.转录因子家庭
我们从SGN和NCBI获得了番茄Illumina RNA-SEQ数据(SRP097450)。每百万次映射读取(FPKM)值的外显子模型的每千碱基碎片用于表示表达水平ERF.基因。我们选择的基因转录组数据属于ERF.转录因子家族。以亨氏品种为例,使用TBtools软件(https://github.com/cjchen/tbools.)[42.]计算了以log10为基的对数FPKM值,绘制了热图,并进行了计算ERF.分析了番茄组织中的基因。还分析了表达水平。具体组织包括芽,花,叶,根和水果。关于病原体的感染,表达剖面ERF.基因符合高概率值标准(P > 0.8).
Vigs Vector Construction和Agroinfiltration
由SGN Vigs工具设计的特定引物被扩增以防止干扰其他其他的表达ERF.基因(https://vigs.solgenomics.net/).PCR方案如下:94℃10分钟;在94℃,65℃下的40个循环为65℃,30s / kb在72°C;和72°C 10分钟。用限制酶EcoRI和BamHI消化扩增的300bp PCR产物和TRV2空载体。然后,将靶片段连接到TRV2空载体中。将构建体转化为能力大肠杆菌DH5α和单克隆在含有50μg/ ml卡那霉素的液体LB中培养。一旦通过测序确认重组质粒,将它们转化为农杆菌肿瘤术菌株GV3101,在28°C和200 rpm下摇至光密度= 0.25。此外,和富-PDS公司(植物去饱和酶)被用作评估Vigs的对照[43.].农将含有TRV1的细胞与含有TRV2衍生构建物或TRV2空载体的细胞按1:1的体积比混合。对14日龄的Motelle植株进行真空渗透TRV-PDS公司,trv-ERF2.和TRV-00注射器含有大约0.5-1毫升的农杆菌属细胞并在具有12-H光周期的生长室中保持22℃。
病原菌接种及表型观察
番茄植物被TRV-接种PDS公司,trv-ERF2.和TRV-00在4周时。处理组接种1 × 10孢子悬浮液250 mL4.孢子/mL),对照组植株喷洒等量灭菌水。每一组包含10种具有相同生长潜力的植物。这些植物被保存在光照培养箱中(光照:16) h、 28个 摄氏度;深色:8 h、 25个 °C),相对湿度为80%。接种后连续观察植株病情,于0、3日采集叶片 接种后天数(dpi)。此外,PDS基因的光漂白表型可作为VIGS评价的阳性对照。TRV2:00空载体作为对照。
显微镜观察
在0 dpi和3 dpi条件下,用0.1%台盼蓝(TB)染色确定番茄植株的病害状态S番茄[44.].类似地,使用0.1%3,3'-二氨基苯甲酸(DAB)和0.2%硝基氮唑鎓蓝氯化物(NBT)来检测H的积累2.O2.和o.2.−在植物叶中,分别[45.,46.].最后,使用光学显微镜来记录这些图像。
QRT-PCR分析和生理指标测定
在QTower3G实时系统(Analytik Jena Ag,Germany)上,使用Aceq®QPCRSybr®GreenMaster混合物(Vazyme,南京,南京)进行三个独立的生物重复进行QRT-PCR进行QRT-PCR。QRT-PCR引物列于补充表中2..EF1α.被用作数据标准化的内部控制。使用2计算相对表达–△△CT法。
使用ROS测定试剂盒E004-1-1,SOD测定试剂盒A001-3-2,POD测定试剂盒A084-3和猫确定主要抗病酶,包括ROS,SOD,POD和CAT,包括ROS,SOD,POD和CAT的活动Assay套件A007-1-1(南京江城生物工程研究所,南京,中国)与制造商提供的协议。我们收集的叶子是随机的,它们混合在一起以提取总RNA。在接种后10:00在0,1,3和5天收集叶子,并立即使用收集的样品进行分析。所有治疗组在同一时间进行,整个实验重复三次。
SA、JA含量测定
高效液相色谱(HPLC)用于确定内源激素SA和JA的水平[47.].在接种后10:00,植物的叶子在0,1,3和5天收集,并将收集的样品立即用于分析。每组的数据是从3个个体植物获得的。三个独立实验的数据用于分析SA和JA含量。
数据和材料的可用性
番茄的蛋白质序列ERF.转录因子家族基因从PlantTFDB下载(http://planttfdb.cbi.pku.edu.cn.).通过使用在线蛋白质结构预测工具智能识别所有序列(http://smart.embl-heidelberg.de/). 支持本文结论的数据集包含在本文及其补充文件中。
参考文献
- 1。
周J,Tang X,Martin GB。PTO激酶赋予番茄细菌斑疾病的抗性与蛋白质相互作用,所述蛋白质与结合的发病生成相关基因的CIS-元素。Embo J. 1997; 16:3207-18。
- 2。
吴K,田L,霍林沃思J,布朗DCW,米基B。番茄Pti4的功能分析拟南芥.植物理性。2002; 128:30-7。
- 3.
顾yq,wildermuth mc,chakravarthy s,loh yt,yang c,他x,han y,martin gb。番茄转录因子PTI4,PTI5和PTI6在表达时激活防御响应拟南芥. 植物细胞。2002;14:817–31.
- 4.
何平,华伦RF,赵涛,单磊,朱磊,唐欣,周建民。Pti5在番茄中的过表达增强了病原菌诱导的防御基因的表达,增强了番茄对丁香假单胞菌的抗病能力。植物微生物学2001;14:1453-7。
- 5。
Riechmann JL,听到J,Martin G,Reuber L,Jiang C,Keddie J,Adam L,Pineda O,Ratcliffe Oj,Samaha Rr。拟南芥转录因子:真核生物全基因组比较分析。科学。2000;290:2105-10。
- 6。
Jofuku KD、den Boer BG、Van Montagu M、Okamuro JK。控制拟南芥欧洲疗法基因Apetala2的花卉和种子开发。植物细胞。1994年; 6:1211-25。
- 7。
Magnani E,Sirodander K,Hake S.从内切核酸酶到转录因子:植物中AP2 DNA结合结构域的进化。植物细胞。2004; 16:2265-77。
- 8。
Ohme Takagi M,Shinshi H。与乙烯反应元件相互作用的乙烯诱导DNA结合蛋白。植物细胞。1995;7:173–82.
- 9。
Hao D,Ohme Takagi M,Sarai A。植物乙烯反应元件结合因子(ERF结构域)DNA结合域识别GCC盒的独特模式。生物化学杂志。1998;273:26857–61.
- 10。
关键词:盐胁迫,ERF,转录因子,番茄abstract:植物生长调节剂。2018;84:573-82。
- 11.
Pirrello J、Prasad BCN、Zhang W、Chen K、Mila I、Zouine M、LatchéA、Pech JC、Ohme Takagi M、Regad F、Bouzayen M。番茄乙烯反应因子的功能分析和结合亲和力为植物乙烯反应差异的分子基础提供了依据。BMC植物生物学。2012;12:190.
- 12.
Kizis D,Lumbreras V,页面M. AR2 / EREBP转录因子在非生物杆菌基因调节中的作用。费用。2001; 498:187-9。
- 13。
徐志刚,夏立群,陈明,程兴国,张锐,李丽玲,等。小麦乙烯响应因子1 (TaERF1)的分离和分子特性研究。中国生物医学工程学报,2007;
- 14。
郑MC,廖PM,郭WW,林TP。这个拟南芥乙烯反应因子1通过与不同顺式作用元件结合来调节非生物胁迫响应基因的表达,以响应不同的胁迫信号。植物生理学。2013;162:1566–82.
- 15.
顾永强,杨超,周杰,周国平。Pti4由乙烯和水杨酸诱导,其产物被Pto激酶磷酸化。植物细胞。2000;12:771 - 86。
- 16。
Onate Sanchez L,Singh KB。识别拟南芥乙烯反应元件结合因子在病原体感染后具有不同的诱导动力学。植物杂志。2002;128:1313-22。
- 17。
carls L, Pieterse CMJ, Van wee SCM。水杨酸如何对茉莉酸信号传导进行转录控制。植物科学与技术,2015;
- 18。
关键词:ERF,基因家族,全基因组分析拟南芥还有米饭。植物生理学。2006;140:411–32.
- 19。
关键词:ERF/AP2, ERF/AP2, dna结合,特异性拟南芥dreb,参与脱水和冷诱导基因表达的转录因子。生物化学与生物物理,2002;
- 20.
李X,夏B,江Y,吴Q,王C,He L,Peng F,Wang R.来自Lycoris Radiata的新发病相关蛋白,LRPr4及其对Magnaporthe Grisea的抗真菌活性。MOL BIOL REP。2010; 37:995-1001。
- 21。
El-Kereamy A, El-Sharkawy I, Ramamoorthy R, Taheri A, Errampalli D, Kumar P, Jayasankar S. Prunus domestica pathogenisrelated protein-5激活防御反应通路,增强对真菌感染的抗性。《公共科学图书馆•综合》。2011;6:e17973。
- 22。
HückelhovenR,Foder J,Preis C,Kogel Kh。受粉状霉菌真菌攻击的大麦的过敏细胞死亡和乳头形成与H相关联2.O2.但不是水杨酸积累。植物杂志。1999;119:1251-60。
- 23。
VOS IA,Moritz L,Pieterse CMJ,Van Wees Scm。荷尔蒙串扰对多攻击条件下植物抵抗力和健身的影响。前植物SCI。2015; 6:639-52。
- 24。
朴智杰、金吉、申瑞、朴智杰、申YC、白赫。从辣椒中分离的致病相关蛋白10在抗病毒途径中起核糖核酸酶的作用。植物J。2004;37:186–98.
- 25。
关键词:葡萄,ERF,基因,表达谱,dna结合红衣主教被高浓度一氧化碳污染2.在低温下。前植物SCI。2016; 7:370-83。
- 26。
Thilmony RL, Chen Z, Bressan RA, Martin GB。番茄Pto基因在烟草中的表达增强了对丁香假单胞菌的抗性。烟表达avrPto。植物细胞。1995;7:1529-36。
- 27。
Divi UK,Rahman T,Krishna P. Brassinosteroid介导的应力耐受性拟南芥显示与脱落酸、乙烯和水杨酸途径的相互作用。BMC植物生物学。2010;10:151–65.
- 28。
Ton J,Flors V,Mauch Mani B。ABA在抗病性中的多方面作用。植物科学趋势。2009;14:310–7.
- 29。
Van Loon LC,Rep M,Pieterse CMJ。诱导型防御相关蛋白在感染植物中的意义。Annu Rev phytopathol。2006; 44:135-62。
- 30.
Beckers GJM,Spoel SH.微调植物防御信号:水杨酸盐与茉莉酸盐。植物生物学。2006;8:1–10.
- 31。
MUR LA,Kenton P,Atzorn R,Miersch O,Wasternack C.水杨酸盐和己酸酯信号传导之间的浓度特异性相互作用包括协同,拮抗和氧化应激导致细胞死亡。植物理性。2006; 140:249-62。
- 32。
安凤英,赵强,纪永一,李文英,蒋志强,于晓春,张超,韩勇,何伟荣,刘亚东,张树青,艾克尔JR,郭宏伟。乙烯诱导的乙烯INSENSITIVE3和EIN3- like1的稳定是通过蛋白酶体降解EIN3结合F-box 1和2,这需要EIN2在拟南芥.植物细胞。2010;22:2384 - 401。
- 33。
庄杰,邓德东,姚庆华,张杰,熊飞,陈建民,熊as。玉米ap2样基因的发现、系统发育和表达模式。Plant Growth Regul. 2010; 62:51-8。
- 34。
壮族,姚QH,熊,张J.苹果(Malus×Dibusta Borkh)中AP2样基因的分离,系统发育和表达模式。植物mol biol报告。2011; 29:209-16。
- 35。
Owji H,Hajiebrahimi A,Seradj H,Hemmati S。基因组分析通过基因组分析对芸苔类药物应激响应AP2 / ERF转录因子的鉴定和功能预测。计算Biol Chem。2017; 71:32-56。
- 36。
刘丽,白美赞臣,麦克雷。转录因子及其基因在高等植物功能域中的进化与调控。欧洲生物化学杂志。1999;262:247–57.
- 37。
Allen MD,Yamasaki K,Ohme-Takagi M,Tateno M,Suzuki M.通过与DNA的复合物中的GCC盒结合结构域的溶液结构揭示的β-纸张的DNA识别模式。Embo J. 1998; 17:5484-96。
- 38。
关键词:AP2, ERF,转录因子,抗病性植物生物学。2004;7:465-71。
- 39。
Subramanian B、Gao S、Lercher MJ、Hu S、Chen WH。Evolview v3:一个用于可视化、注释和管理系统发育树的web服务器。核酸研究,2019年;47:270–5.
- 40.
任杰,温立平,高晓军,金长军,薛勇,姚晓斌。DOG 1.0:蛋白质结构域的插画。细胞研究》2009;19:271-3。
- 41.
Waterhouse A、Bertoni M、Bienert S、Studer G、Tauriello G、Gumienny R、Heer FT、Beer TAP、remfer C、Bordoli L、Lepore R、Schwede T. SWISS-MODEL:蛋白质结构和配合物的同源建模。核酸研究:2018;46:296-303。
- 42.
Chen CJ,陈H,张Y,Thomas Hr,Frank Mh,He Yh,夏R.TBTools:为大生物数据的交互分析开发了一种综合工具包。莫尔植物。2020; 13:1194-202。
- 43.
刘y,schiff m,dinesh-kumar sp。番茄中病毒诱导的基因沉默。工厂J. 2002; 31:777-86。
- 44.
王X,哈德拉米AE,亚当LR,达伊夫F。代表US-1和US-8基因型的马铃薯晚疫病菌菌株对马铃薯防御反应的差异激活和抑制。植物病理学。2008;57:1026–37.
- 45。
Rao MV,Davis KR.臭氧诱导的细胞死亡是通过两种不同的机制发生的拟南芥:水杨酸的作用。工厂J. 1999; 17:603-14。
- 46。
Kumar D,Yusuf MA,Singh P,Sardar M,Sarin NB。超氧化物和H的组织化学检测2.O2.甘蓝叶幼苗积累。生物协议。2014; 4:E1108。
- 47。
Llugany M,Martin SR,BarcelóJ,Poschenrieder C.内源性茉莉和水杨酸水平在CD-HyperActumator Noccaea(Thlaspi)PRAECOX暴露于真菌感染和/或机械应力。植物细胞代表2013; 32:1243-9。
致谢
我们感谢我们实验室的所有同事提供有用的讨论和技术援助。
资金
农业部园艺作物生物学与遗传改良重点实验室(东北地区)开放项目资助;中国国家自然科学基金委员会(32002059);中国科学院黑龙江自然科学基金(LH2020C10);中国国家重点研究开发计划(2017YFD0101900)中国博士后科学基金会(2020) M681068型);东北农业大学“青年人才”工程(18QC08)。资助者在研究设计、收集、分析和解释数据以及撰写手稿方面没有任何作用,只是提供资金支持。
作者信息
从属关系
贡献
实验采用JFL和JBJ设计。HHY和YGS撰写原稿,并对其进行修改和编辑。采用HHY、YGS和HXW进行实验。YGS和HXW对家族基因进行了分析,并对其结构进行了可视化分析。TTZ和XYX负责监督。所有作者阅读并批准最终稿件。
作者的信息
番茄遗传育种实验室,园艺作物生物学与遗传改良重点实验室(东北地区),农业和农村事务部,东北农业大学园艺与园林学院,哈尔滨150030,中国。
华桓阳,耀光孙,湖洋王,婷婷赵,襄阳徐,京滨江和景福李
相应的作者
伦理宣言
道德认可和参与同意
不适用。
出版许可
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充信息
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用这篇文章
杨,H.,Sun,Y.,Wang,H.et al。基因组识别和功能分析ERF2.基因家族以应对疾病抵抗苯磺酸苯磺酸镁在番茄。BMC植物BIOL.21,72(2021)。https://doi.org/10.1186/s12870-021-02848-3
已收到:
认可的:
出版:
关键字
- 番茄
- 乙烯反应的因素,ERF2.
- 抗病性
- 美国黄瓜