抽象的
背景
果实流产是水果生产的主要限制因素。在扁平桃子中,在早期水果开发期间,在一些戒指中存在果实流产。然而,扁平果实流产的生理因素和遗传机制仍然很难以难以捉摸。
结果
在这项研究中,我们透露了施肥过程的完成,蔗糖和淀粉含量的减少可能导致扁平果实流产。通过组合关联和基因表达分析,关键候选基因,PPSNRK1βγ.,被识别出来。具有扁平果实形状的1.67 MB反转共同进行了改变的启动子活性PPSNRK1βγ.,导致败育扁桃的表达量低得多。在番茄中的异位转化和桃果实中的瞬时过表达已经证实PPSNRK1βγ.能提高糖和淀粉含量。比较转录组分析进一步证实了这一点PPSNRK1βγ.参与碳水化合物代谢亚细胞定位发现PpSnRK1βγ位于细胞核内。
结论
本研究提供了扁平果实流产的可能原因,并确定了关键候选基因,PPSNRK1βγ.,这可能负责桃子中的扁平果实流产。结果将在桃养殖中提供很大的帮助,并促进其他植物物种中果实流产的基因鉴定。
背景
为了养活越来越多的全球人口,粮食安全正在成为一个紧迫的任务,包括果实产量。桃 (Prunus PersicaL.)是世界上第第四个经济上重要的果实作物(粮农组织,http://faostat.fao.org.),由于其相对较小的基因组大小和短的少年阶段,被认为是罗西阿地区的模型植物[1].扁平桃子在中国培育[2]并被介绍给世界,其中最喜欢的味道和可食用的方便果实[3.那4.].然而,在早期水果开发期间,水果中的一些扁平桃子中产了[5.那6.那7.那8.],它极大地限制了平桃养殖和工业。
扁平果实形状由单个占优势基因控制S.(碟形)[9.].使用连杆分析进一步映射到染色体6的远端部分的基因[5.那6.]和关联映射[8.那10].dirlewanger等。(2006)[6.]发现,来自F2人口('Ferjalou jalousia')和圆形('Fantasia')品种的一些后代显示出异常的水果,水果套装后不久。这个隐性角色已被命名AF.并证明与扁平果实基因有关[6.].同样,这种扁平的果实败育现象也被其他研究人员发现和隐性的AF.基因座被隔离比率支持。还识别出中产阶级平面桃树类中的几个成熟水果,其表现出异常形状的果实和种子,显示在激发池侧和缺席的果实表型裂解果实表型[11].因此,等位基因S.与连接AF.和S.与连接AF..在这种情况下,S / S确定平果形状和AF / AF.负责扁平果实流产特质。最近,负责扁平果实的关键基因,PPOFP1.,已被识别和验证,而过表达PPOFP1.没有导致果实流产的番茄和拟南芥[8.那12].这些研究表明,扁平形状和果实流产被不同的基因受到遗传控制,邻近基因的扁平果实流产仍然保持不变。
水果和种子流产是实现作物产量的主要限制因素[13那14那15].果实和种子作为库器官,在发育过程中伴随着贮藏产物的积累,主要是蛋白质、淀粉和油脂等,这些贮藏产物是生长成熟阶段的典型特征[16].糖发挥着至关重要的作用,尽管许多因素参与了水果和种子组,例如源水槽相互作用,激素信号传导和其他代谢途径[17].在非生物的压力下,糖限制是导致水果和种子堕胎的众所周知的因素[13那18那19].在番茄,沉默基因林5.编码反转酶导致果实流产和降低果实尺寸[20.].同样,过表达蔗糖合酶基因在棉花减少的种子堕胎中[21].因此,与糖代谢相关的基因可能会调节水果和种子流产。
哺乳动物中蔗糖非发酵1相关激酶(SnRK),也称为蔗糖无发酵1(SNF1)在哺乳动物中,是植物生长和调节转录和代谢的关键组分流程[22那23那24].有三个SNRKS的Subfilies,包括SNRK1S,SNRK2S和SNRK3S [25那26].SNRK2和SNRK3亚家族主要涉及应力和脱钙(ABA)信号传导[27那28那29那30.那31],而SNRK1S调节碳水化合物代谢,对正常发育和对压力的反应至关重要[32那33那34].SNRK1作为异络空酶,其包含催化α亚基,调节性γ亚基和β亚基,作为支架连接α和γ亚基。绿色植物已经进化了杂交βγ蛋白,以用作SNRK1络合物中的γ亚基。杂交蛋白还含有N-末端碳水化合物结合结构域,其通常仅在β亚基中发现。这些蛋白质还具有更保守的γ结构域和来自其他王国的功能性SNRK1γ亚基的群体中的细胞发育分析。35那36]在调节糖和淀粉代谢中据报道α亚基基因[37],功能丧失在拟南芥中表现出胚胎致死率[38].γ亚基也称为酵母和AMPKγ中的SNF4,在β亚基的复合物中发现了β亚基[22那39].在豌豆(Pisum sativum.),SNRK1-反义种子具有成熟缺陷并导致种子堕胎[40那41].在桃子中,过度表达PpSnRK1α在番茄中增加了糖和淀粉内容[33那34然而,关于糖代谢中βγ亚基的功能很少,特别是在调节水果和种子流产中。
在这项研究中,我们调查了扁平果实流产的生理因素,并报告了重要候选基因,ppsnrk1βγ,在种子和水果中促进糖和淀粉的积累,这可能负责桃子的扁平果实流产。这些结果进一步富集了SNRK1sβγ亚基在碳水化合物代谢中的功能,并为未来的扁平桃养殖提供了有价值的遗传基础。
结果
平桃败育的表型分析
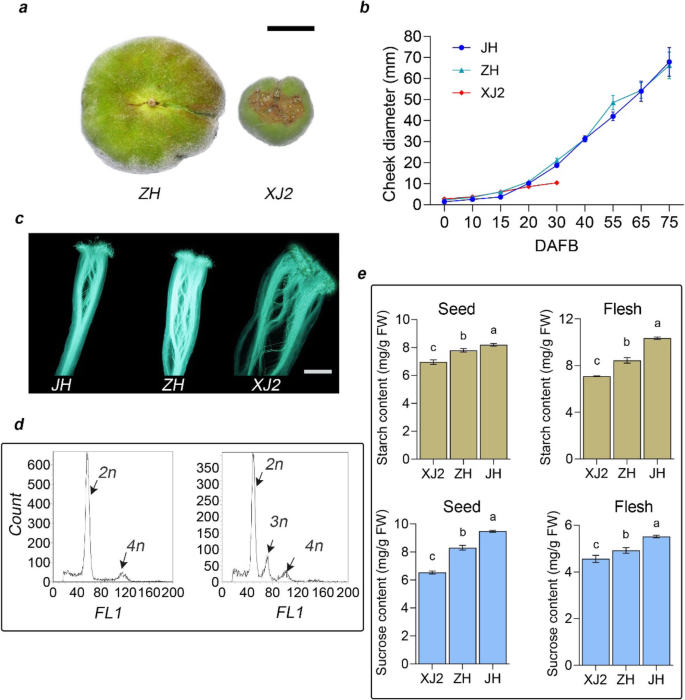
在我们的桃质种质中观察到中止的扁平桃品种,表现出类似的表型,具有通过Dirlewanger等人获得的个体。(2006)和picañol等人。(2012)。为了调查扁平桃子流产的原因,我们分析了圆形('jh')的表型特征,可行的扁平('zh')和中止扁平水果('xj2')。首先,我们发现中止的扁平桃停止生长,并且倾向于在30 dafb(盛开后的天数)下降(图。1a,b)。然后,我们调查了中止扁平果实中受精过程中是否存在缺陷,因为花器官的风格大小与圆形和可行的平面桃子不同[6.].研究了花粉萌发和花粉管的生长,表明花粉可以正常发芽并生长到花粉管中(图。1c).利用流式细胞仪检测受精胚胎的倍性,确定受精过程。结果表明,受精过程应该在‘XJ2’中完成,因为观察到三倍体细胞(图。1d)。总之,这些结果表明,施肥过程在中止平桃中完成,应该有其他因素有助于平坦的果实流产。
据报道,碳水化合物的缺乏可以诱导种子堕胎[38那40那41].在这项研究中,我们发现掉落的扁平桃的种子在30 dafb左右枯萎(图S1).据报道,糖在水果和种子集中发挥着至关重要的作用[17].To investigate whether altered carbohydrate metabolism was associated with flat fruit abortion, we detected the sugar and starch content in seed and flesh for round (‘JH’), viable flat (‘ZH’), and aborting flat (‘XJ2’) peach at 15 DAFB, when all these three peach types still under healthy growth status without fruit dropping phenomenon. In this section, much lower contents of starch and sucrose in ‘XJ2’ were observed than those in viable flat and round peach in seed and fruit flesh (Fig.1e)。这种观察结果也与扁平果实流产基因座的基因型一致,显示AF./AF.对于'XJ2',AF./AF.对于'zh'和AF./AF.对于'jh'。这些结果表明,种子中糖和淀粉的还原可能在扁平果实流产中发挥重要作用,表明碳水化合物代谢参与了果实流产过程。
鉴定和表达分析PPSNRK1βγ.
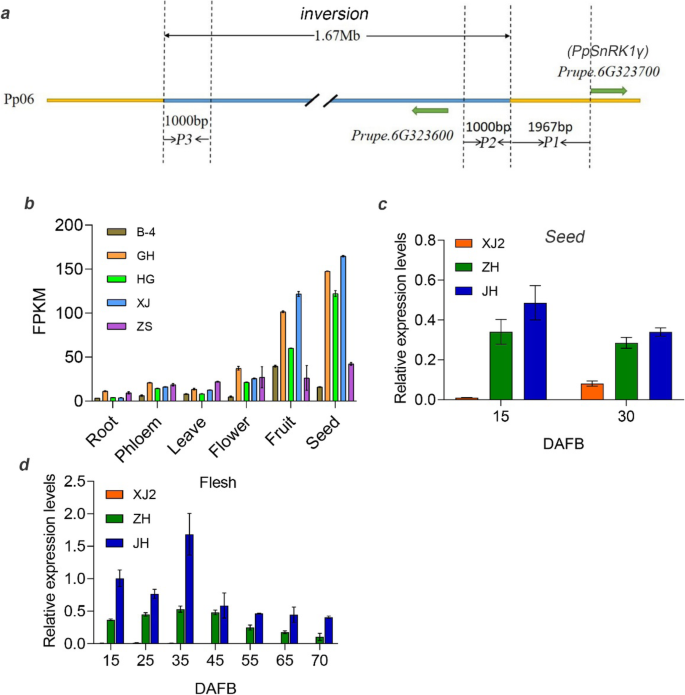
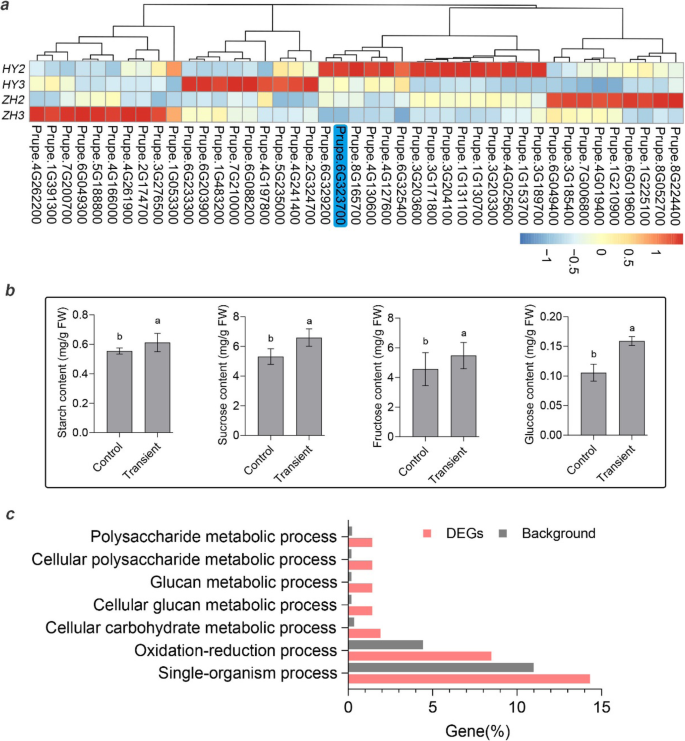
为了阐明扁果败育的遗传基础,对候选基因进行了鉴定。我们已经确定了一个1.67 mb的染色体倒位共分离与扁平的果实形状,并在336个桃子种质中验证了其准确性[8.] (图。2一种)。一个关键基因PPOFP1.已被验证控制扁平果实[8.那12].使用我们之前研究中生成的转录组数据[7.,在1.67 MB反转区域中仅鉴定出7个差异表达的基因(DEGS),包括prupe.6g303900.那prupe.6g311400.那prupe.6g313000.那Prupe.6G314000那prupe.6g314100.那prupe.6g317200., 和prupe.6g319200.根据它们的基因型,其中5个用FPKM(每百万百万读数的每千碱基碎片映射)= 0进一步消除了一些果实发育阶段。左两个基因中的一种作为未知的功能蛋白质,另一个是核糖核酸酶,其显示与糖和淀粉代谢没有相关性。
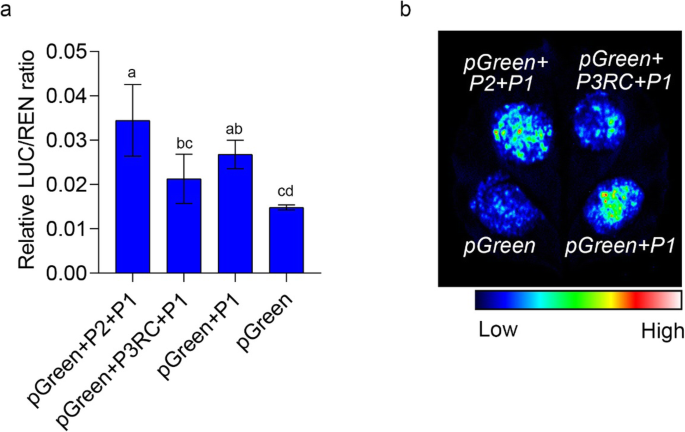
候选基因PPSNRK1βγ.鉴定和启动子活动分析。一种图说明了平果流产基因座的结构。浅蓝色水平杆表示1.67-MB反转[8.].B.组织具体分析PPSNRK1βγ.使用五个桃子。C基因表达分析PPSNRK1βγ.在圆形的种子中('jh'),可行的平面('zh')和中止('xj2')桃在15和30 dafb。D.基因表达分析PPSNRK1βγ.在水果开发期间的肉体。“XJ2”中的基因表达几乎等于0,如“Zh”旁边所示。酒吧是SD.
我们已经分析了围绕1.67 MB反转的四个基因,发现表达水平prupe.6g290900.(PPOFP1.,扁平果实形状基因)和prupe.6g323700.与平坦和圆形桃子的基因型相关[8.].鉴于平面形状和扁平果实流动基因座之间的密切位置,以及隐性性状,prupe.6g323700.推测为扁果败育的候选基因,该基因为snf1相关蛋白激酶βγ亚基。在本研究中,我们确定了扁平果败育的可能因素,即种子中蔗糖和淀粉的显著减少,而不是未完成的受精过程。组织特异性分析表明,该基因主要在种子和果实中表达。2b)。同样,基因表达在15只DAFB和30个DAFB的种子中进行。实时PCR结果表明prupe.6g323700.中止平桃的表达低于可行的平坦和圆形桃(图。2c),进一步表明该候选基因的可靠性。基因表达模式与它们的基因型一致,因为果实流动性状是隐性的[6.那8.].不仅在种子中,还在水果中进行基因表达。在水果开发期间,候选基因在'XJ2'中表达得比在'ZH'和'JH'中表达,这表明该基因可能在种子和水果中发挥作用(图。2d)。这些结果表明prupe.6g323700.可能是调节扁平果实流产的重要候选基因。根据其预测的蛋白质结构和功能注释,我们将其命名为它ppsnrk1βγ。
亚细胞本地化PPSNRK1βγ.
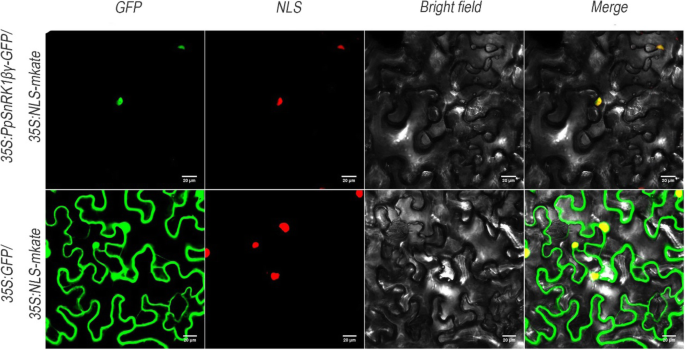
进一步了解潜在的基因功能PPSNRK1βγ.,进行亚细胞定位测定。三个载体,35S:PPSNRK1βγ-GFP那35 s:绿色荧光蛋白和35s:nls-makte,用于烟草中的瞬时表达(n benthamiana) 树叶。这35s:nls-mkate特异性定位于细胞核内。这35S:PPSNRK1βγ-GFP和35 s:绿色荧光蛋白与之共同改造35s:nls-mkate分别。在本研究中,PPSNRK1βγ-GFP融合蛋白在核中局部化(图。3.),与其他研究一致[42].结果表明PPSNRK1βγ.可以通过影响基因表达来发挥作用。
SNRK基因家族的系统发育分析
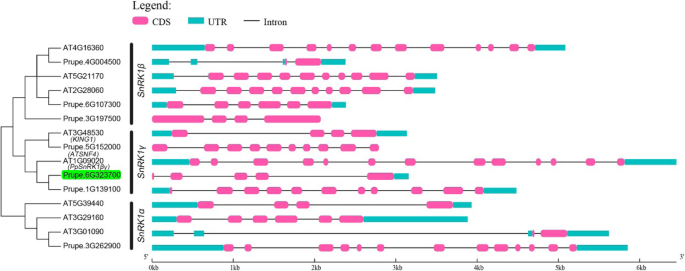
为了充分了解桃中的SNRK基因家族,进行了基因组宽的基因鉴定。首先,我们从国家生物技术信息中心(NCBI)中搜索和下载了拟南芥中的43个SNRK基因,其中包括三个SNRK1αs,三个SNRK1β,两个SNRK1γ,10个SNRK2和25个SNRK3S。我们使用当地爆炸在桃基因组中搜索了类似的基因[43]使用MERCATOR进行基因注释[44].如图所示,鉴定了一个SNRK1α,三个SNRK1βS,三个SNRK1γS(包括两个SNRK1βγs),七个SNRK2和17个SNRK3S(图S2).我们研究中发现的候选基因,PPSNRK1βγ.,被聚集在一起atsnf4,也被称为Kinβγ.(无花果。4.),已被证实是一个功能性的βγ亚基[42那45].
染色体反转改变启动子的活性
进一步证明这一点PPSNRK1βγ.通过1.67 MB染色体反转减少了表达水平,分析了其启动子的不同部分,如图3所示。2一种。这些启动子片段及其再组合分别与荧光素酶报告融合。通过烟叶通过瞬态表达农杆菌肿瘤术介导的方法。如所预期的,由P2 + P1片段驱动的荧光素酶报告基因,其是来自圆形桃的启动子序列,高于其他启动子片段,特别是高于P3RC + P1,其是扁平桃的启动子(图。5.a,b),表明该1.67mb反转减少了启动子活性ppsnrk1βγ。此外,通过“ZPT15”(扁平果实形状)和其芽突变体'ZPT15-Mut'(圆形果实形状)桃子果实验证了该结果,在'ZPT15-MUT'中表现出更高的表达(图S3.).所有这些结果表明1.67 MB反转减少了启动子活动PPSNRK1βγ.结果表明,其在平桃中的表达量明显低于圆桃。
启动子活动分析ppsnrk1βγ。一种促进剂活性分析的相对LUC / ren比。P1,P2和P3是图2中所示的片段。2c. P3RC表示P3的反向互补序列。P2+P1片段为圆桃启动子序列,P3RC+P1片段为平桃启动子序列。B.荧光素酶强度表明启动子活性。PGREEN是阴性对照。P1,P2和P3RC与所示的相同一种.酒吧是SD.
过度表达PPSNRK1βγ.在番茄中增加糖和淀粉含量
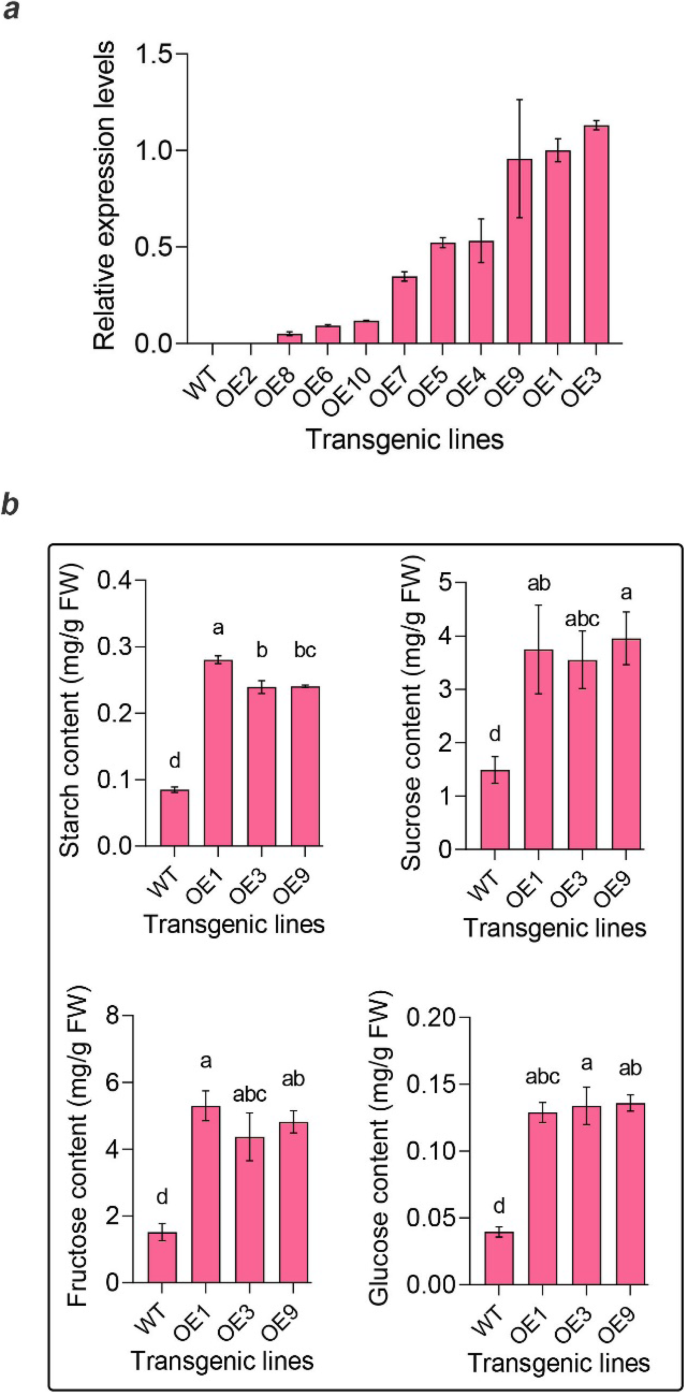
最新,功能验证PPSNRK1βγ.仍然不能通过产生稳定的转基因桃线来执行。作为一种替代方法,我们使用微米番茄基因型来验证基因功能。十种转基因番茄系具有不同的表达水平PPSNRK1βγ.(图生成。6.一种)。选择具有更高的表达水平,OE1,OE3和OE9中的三种用于糖和淀粉含量测定。结果表明,这三种OE线中的糖和淀粉含量明显高于野生型(WT)中的糖和淀粉含量(图。6.b)(P.<0.05),表明PPSNRK1βγ.有糖和淀粉代谢的功能。
富含碳水化合物新陈代谢相关基因
在果实发育过程中,使用先前研究中产生的转录组数据(SRP116734)鉴定差异表达基因(DEG)[7.].在本研究中,我们只考虑了15个DAFB到55 DAFB的最后两个发展阶段。完全,鉴定了1350次,其中43种与碳水化合物代谢有关。在“Zh”(扁平桃)和24中高度表达94岁,在'hy'(圆形桃)中高度表达(图。7.一种)。考虑到桃基因组中鉴定的所有31个SNRK基因PPSNRK1βγ.差异表达,进一步提出了在果实发育过程中在碳水化合物代谢中的作用。
桃子的瞬时表达和比较转录组分析
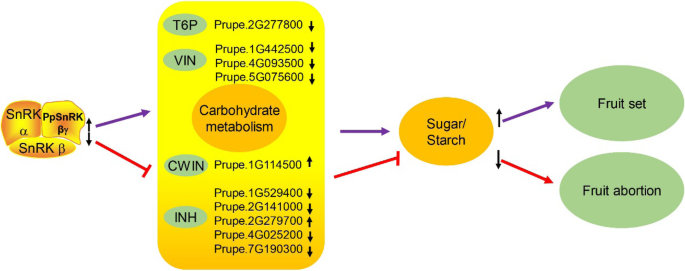
虽然桃子的稳定转化有限,但桃子果实中的瞬时过度表达是可执行的。为了验证基因功能,35s:PPSNRK1βγ.在50 dafb使用的'hakuho'桃桃中瞬时表达35 s:绿色荧光蛋白作为控制。转化后,收集样品进行糖和淀粉含量测定,并用于比较转录组分析。结果表明,瞬时过表达的桃果实中糖和淀粉含量显著增加。7.B),这进一步证实了基因在碳水化合物代谢中的功能。此外,对瞬态和对照样品进行转录组比较分析发现,有411个基因差异表达,其中一些基因在多糖、葡聚糖、碳水化合物代谢过程中富集(图1)。7.c),包括176个上调和235个下调基因(表S.1).比较转录组分析并促进富集,提出了果实流产模型(图。8.).上调PPSNRK1βγ.通过调节影响碳水化合物代谢T6P.(海藻糖-6-磷酸磷酸酶),vin.(真空转化酶),CWIN.(细胞壁结合转化酶)和伊(转化酶抑制剂)基因,进一步增加种子和果实中糖和淀粉含量,导致坐果。相反,扁平的果实会夭折(如图。8.).
讨论
水果流产对水果生产和粮食安全有很大影响。在桃子中,在一些扁平桃子的整个树上严重存在果实流产。从平面('ferjalou jalousia')和圆形('Fantasia')品种产生的F2种群中观察到中止的扁平桃子后代,其可以通过单一显性基因解释(S / S)或两个紧密连接的基因(S / S和AF / AF.)[6.].据报道,相当多的水果可能异常成熟,没有种子和裂缝的果实表型在这些中止的平桃后代[11].此外,过表达平整形状基因,PPOFP1.,没有导致番茄果实流产[8.] 和拟南芥[12].这些结果表明PPOFP1.是平坦的形状基因和扁平果实流动性状应由相邻的控制AF.基因座。
为了找出导致果实败育的休闲基因,对生理因素进行了表征。对大多数开花植物来说,授粉和受精是果实和种子结实的先决条件。在本研究中,我们发现平桃品种‘XJ2’败育过程中完成了授粉和受精过程,这表明桃果实败育过程中可能还涉及其他过程(图2)。1C,D)。种子和水果套装在受精后尽快建立,并从胚珠传递到种子和卵巢到果实。在此过程中,细胞分裂,种子和果实的扩张和协调发展立即发生,包括糖和淀粉的积累[16那18那46].据报道,水果和种子流产可以通过谷物中的光学摩擦限制诱导[47水果作物[48],如糖和淀粉[13那49].在最佳条件下,果实和种子套装以足够的营养成分,包括蔗糖,葡萄糖和淀粉[17].在这项研究中,我们确定了15 dafb在15 dafb中中止平坦,可行的平坦和圆形桃子的种子中的糖和淀粉的含量,以澄清扁平果实流产的可能原因。结果表明,蔗糖和淀粉含量下降扁平果实显着降低,这表明碳水化合物代谢可能涉及果实流产过程(图。1 e).虽然‘XJ2’的淀粉含量在25、35 DAFB时要高得多(图S4.),原因可能是水果开发已经在流产过程中,潜在的新陈代谢过程未知。这一发现与粮食和水果作物的水果和种子流产的研究一致,可以增强对其他水果作物的果实流产的理解。
SNRK1亚家族包含三个亚基,其作为异络全酶的功能,包括催化α亚基,调节γ或βγ亚基,以及作为支架连接α和γ亚基的β亚基[35那36].据报道,α亚基具有调节糖和淀粉代谢的功能[37].例如,SNRK1-反义种子具有成熟缺陷并通过豌豆中的碳水化合物和激素代谢的相互作用而导致种子流产(Pisum sativum.)[40那41].也是过度表达PpSnRK1α在番茄中有糖和淀粉内容物增加,并调节果实成熟度和桃子中的盐胁迫[33那34].对于β亚基,还据报道涉及糖信号[36].对于γ亚基,它可以与α亚基和SNRK2S相互作用[45那50].在拟南芥,Kinβγ是一种细胞质和核局部化蛋白[42],而PPSNRK1βγ仅在核中局部局部。并且存在两种βγ亚基基因(Prupe.1g139100.那PPSNRK1βγ.)在桃子中(图。4.),表明另一个βγ亚基(PRUPE.1G139100)可能局部地置于细胞质中以形成SNRK1复合物。虽然Kinβγ.据报道在控制花粉发展中[42[jh'(男性)和'xj2'(雌性)之间的杂交也在本研究中进行,这仍未改变果实流产命运(数据未显示)。结果表明PPSNRK1βγ.应该在其他方面发挥作用,但不是花粉发育。关于βγ亚基在糖代谢中的功能几乎熟知,特别是在调节水果和种子流产方面。在这项研究中,基因功能PPSNRK1βγ.,在番茄中稳定的异位转化进行验证,桃子中的瞬时过表达,糖和淀粉含量增加(图。6.b,无花果。7.b)。瞬态过度表达PPSNRK1βγ.在桃果中,411基因差异表达,其中一些在多糖,葡聚糖,碳水化合物代谢过程中富集(图。7.C)。
虽然表达水平PPSNRK1βγ.早期果实发育阶段比晚果制发育阶段更高得多(图。2d),晚果发育阶段的糖含量要高得多(图S4.).这些结果表明PPSNRK1βγ.对早期的水果和种子发育可能是至关重要的,并且可以与一些其他相关基因一起赋予成熟桃果汁中的糖生物合成。据报道,扁平桃有比圆形桃子更喜欢的味道[3.那4.]在果实形状基因座周围存在一种可溶的固体含量(SSC)QTL [51那52].通过评估12个平面和28轮桃子的SSC,我们证实了平面桃中的SSC远高于圆形桃子(图S5.一种)。因此,确保是否PPSNRK1βγ.在果实成熟阶段对其表达进行分析,发现扁桃品种的表达量远高于圆桃品种(图S5.b).此外,我们利用另外两个品种在果实发育阶段进行基因表达,结果显示平桃(' ZPT10 ')在果实成熟阶段的基因表达量远高于圆桃(' HY ')(图S)6.).更高的表达PPSNRK1βγ.在果实成熟阶段,可以解释为什么平桃有比圆形更好的味道。但是,相反的结果PPSNRK1βγ.在果实成熟阶段的平面桃子中的激活仍然需要在未来探索很好。
结论
在这项研究中,研究了扁平桃流产的生理因素和遗传基础。我们透露,取得了施肥过程,蔗糖和淀粉内容物的减少可能导致扁平果实流产。关键候选基因,PPSNRK1βγ.通过将基因表达分析,比较转录组分析和基因转化进行整合来鉴定。具有扁平果实形状的1.67 MB反转共同进行了改变的启动子活性PPSNRK1βγ.,导致败育扁桃的表达量低得多。在番茄中的异位转化和桃果实中的瞬时过表达已经证实PPSNRK1βγ.能提高糖和淀粉含量。比较转录组分析进一步证实了这一点PPSNRK1βγ.参与碳水化合物代谢本研究提供了扁平果实流产的可能原因,并确定了关键候选基因,PPSNRK1βγ.,这可能负责桃子中的扁平果实流产。结果将在桃养殖中提供很大的帮助,并促进其他植物物种中果实流产的基因鉴定。
方法
植物材料和样品收集
Three peach cultivars were used in this study, including one round peach ‘Zhong Nong Jin Hui’ (‘JH’), one viable flat peach ‘Zao Huang Pan Tao’ (‘ZH’) and one aborting flat peach ‘Xinjiang Pan Tao 2#’ (‘XJ2’) for which the fruit aborted at around 30 DAFB. ‘JH’ and ‘ZH’ have similar developmental period. We collected fruit samples at 0, 7, 15, 30, 40, 55, 65 DAFB for sugar and starch content measurements, check diameter measurement and gene expression analyses. Six fruits per stage were measured for the check diameter. Fruit flesh and seeds were separated at 15 DAFB, when developmental seeds were visible and could be stripped out. All cultivars used in this study were grown in the field of National Horticulture Germplasm Resources Center at Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences (34°42’N, 113°42’E), Henan Province, China.
花粉管伸长
'jh','zh'和'xj2'的花朵被从'中陶玉'('hy')收集的花粉阉割和授粉。在授粉后12小时,收集雌蕊并在乙酸的溶液中温育:乙醇在1:9的比例下[53一夜之间)。雌蕊经乙醇(90、70和50%)和水(3次),每隔3分钟浸泡1 M NaOH过夜,0.1 M K溶解0.1% (w/v)苯胺蓝染色3.宝4.在黑暗中超过1小时。使用装有相机(DP71; OLYMPUS)的外延荧光显微镜观察雌蕊中的染色花粉管。
利用流式细胞术检测倍增性检测
Nuclei were isolated from young leaves and 15-day-old seeds of ‘XJ2’, and run through a flow-cytometer (PARTEC, Germany) after they were stained with DAPI solution (PARTEC, HR-B) following a protocol reported by Guo et al. [54].在本部分进行三次重复。
RNA提取及基因表达分析
使用RNA提取套件(Waryong,China)在水果发育过程中从三种品种中提取总RNA。通过REVERTRA ACE QPCR RT MOSTER MIX与GDNA去除剂(日本TOYOBO,日本)中的10μl反应体积中的0.5μg总RNA合成第一链cDNA。使用Sybr混合物(Roche)在Ligcycler 480(Roche)上进行定量PCR(QPCR),下列步骤:95℃,5分钟,然后在95℃下进行45个循环10 s,58℃,10 s和10 s72°C为20秒。相对表达水平由2计算-ΔΔct方法 [55].本节中使用的引物列于表S中2.
亚细胞本地化
编码序列PPSNRK1βγ.使用表S中列出的PCR引物,从“jh”没有停止密码子2在植物二进制表达载体中融合到GFP的N-末端的框架pBWA HS-Glosgfp (V)生成35S:PPSNRK1βγ-GFP构造。使用一步克隆试剂盒(NovoProtein,中国)形成重组载体。这35 s:绿色荧光蛋白原始载体中的构建体用作控制和35s:nls-mkate用作核分化标记。农杆菌肿瘤术将这3种载体分别转化至GV3101,在含50 μg/mL卡那霉素的LB培养基中,在28℃下培养。培养后,用含有10 mM MgCl的渗透缓冲液重新悬浮农杆菌细胞2,10 mm MES和200μm乙酰苯胺酮至OD600,0.6-1.0,并在室温下置于2小时。含有的细胞35S:PPSNRK1βγ-GFP和35 s:绿色荧光蛋白与同样体积的细胞混合35 s: NLS-mkate,并注入烟草的叶组织(n benthamiana)使用没有针的1ml注射器。渗透后,首先在室温下在暗中沉积烟草植物12小时,然后移动到16小时光的条件和8小时黑暗48小时。使用共聚焦激光扫描显微镜(TCS SP5,Leica,德国)观察GFP和MKATE(Katushka的单体版)荧光。
启动子活动分析
基于1.67mb反转的染色体位置,使用PCR克隆具有不同长度的启动子区段。如图1所示。2C,P1,P2,P3的启动子及其重组用于荧光素酶活性分析。P2 + P1,P3RC + P1和P1的启动子区域可以用于平板和圆形桃中的两种不同等位基因的启动子区域的主要部分用于启动子活性分析0800 - luc pgreen - ii向量。相应的载体使用一步克隆试剂盒(NovoProtein,中国)构建并命名为PGREEN + P1那pGreen + p + P1和PGREEN + P3RC + P1.p2 + p1的片段是启动子区PPSNRK1βγ.在圆形桃中,而P3RC + P1是扁平桃子的启动子。p1是截短的启动子(图。2a).瞬态表达实验使用空载体,按照上述方案进行pgreen.作为负面控制。使用Tanon-5200Multi机器(Tanon,China)评估荧光素酶活性。在本实验中使用的引物列于表S中2.
糖和淀粉内容量化
对于糖萃取,将100mg浇筑的新鲜样品和10mL 80%乙醇加入15ml管中,并在80℃水浴中孵育30分钟,然后以12000×g离心15分钟。将上清液转移到用于糖分析的新管中,左侧物品用于淀粉量化。对于蔗糖,果糖,葡萄糖和淀粉量化,根据相应的协议使用测量试剂盒(生物工程,中国)。
RNA-SEQ和数据分析
在瞬时过表达测定中从桃果中提取RNA。进行了三种生物学重复,并将总RNA混合在一起以分别构建一个实验和对照样品的一个文库。为图书馆建设和测序送到Anboroco(中国北京)公司的总RNA。illumina Hiseq™X十个平台以配对端模式用于排序。生成原始读取,过滤低质量读取以使用FastX Toolkit获取清洁读取(http://hannonlab.cshl.edu/fastx_toolkit/).清洁读数被映射到参考桃基团(发布版本2.0_A2.1)[56使用TOPHAT和FPKM(每百万百万只读数的每千碱基片段映射)和差异表达基因(DEGS)使用袖扣计算[57].
系统发育和基因结构分析
SnRK家族基因拟南芥SnRK1αs 3个,SnRK1βs 3个,SnRK1γs 2个(含1个SnRK1βγ), SnRK2s 10个,SnRK3s 25个。下载这些SnRK基因的氨基酸序列。这40个基因被用于桃基因组SnRK家族基因的查询。使用blast (Version 2.2.26)执行本地爆炸[43]以下参数:BLASTALL -P BLASTP-M 8 -D -o。通过将等于0.0或同一性的e-vange,进一步管理爆炸结果,或者均超过70%。用Mega7构建系统发育树[58]使用具有1000的引导的邻接方法,并使用ITOL显示(https://itol.embl.de/).使用GSDS显示基因结构(http://gsds.cbi.pku.edu.cn/index.php.).
番茄中的基因转化
的全长编码序列PPSNRK1βγ.从'jh'扩增。然后,使用该过表达载体PBI121传染媒介由花椰菜马赛克病毒(CAMV)35S推动者使用一步建设套件(C112,Vazyme,中国)。Sun等人中描述的协议。[59[微米番茄转化使用农杆菌肿瘤术GV3101。转化后获得转基因品系,分析基因表达水平。利用3个高表达系(OE1、OE3、OE9)和野生型(WT)进一步测定成熟期果实中糖和淀粉的含量。在本实验中使用的引物列于表S中2.
桃子果实中的瞬态过度表达
进一步了解的功能PPSNRK1βγ.,瞬态表达在桃果实中进行。过表达载体与番茄转换中使用的载体相同。用于瞬态表达的桃品种是“Hakuho”(HK),由于其白色肉体和在空气中暴露时呈褐变犹豫不决。将桃子果实收集在50只DAFB中,切成1cm厚的立方体,然后通过浸没渗透农杆菌肿瘤术根据Liu等人的描述,在- 70kpa真空条件下悬浮30分钟[60].然后在MS培养基上培养果片2天。之后,将部分收集并储存在80℃下进行基因表达和糖/淀粉含量分析。在本节中进行了三次重复。
可用性数据和材料
本研究产生的原始数据保存在NCBI Short Read Archive (SRA)中prjna633964.还使用了在我们以前的研究中生成的RSCALITION PRJNA401307下的数据。本文中包含的所有其他相关数据可在纸质和补充文件中提供。
缩写
- SNRK1:
-
蔗糖非发酵1相关激酶
- DAFB:
-
盛开后的几天
- OE:
-
过度表达
- 可见:
-
差异表达基因
- SSC:
-
可溶性固体含量
- JH:
-
中润金辉
- Zh:
-
枣庄潘涛
- XJ2:
-
新疆潘涛2#
- ZPT15:
-
zhongpantao 15#
- ZPT15-MUT:
-
Zhongpantao 15 #突变
- T6P:
-
Trehalose-6-phosphate磷酸酶
- vin:
-
真空转化酶
- CWIN:
-
细胞壁结合转化酶
- Inh:
-
转化酶抑制剂
参考
- 1.
Shulaev V,Korban Ss,Sosinski B,Abbott Ag,Aldwinckle Hs,Folta Km,等。枸杞基因组学的多种模型。植物理性。2008; 147(3):985-1003。
- 2.
Faust M,Timon B.桃子的起源和传播。1995年的霍尔西纲领; 17:331。
- 3.
莫奈,私生子T, Gibault B. Etude génétique et amélioration des pêches plates;1985.
- 4.
王L,舒H,陈X.桃子果实类型与质量的相关分析。Acta Horticulturae Sinica。2008; 35(11):1567-72。
- 5.
Dirlewanger E,Pener V,Parrmery C,Rothan C,Guye A,Monet R.桃子[Prunus Persica(L.)击球率使用形态学和分子标记。Al Appl Genet。1998年; 97:888。
- 6.
Dirlewanger E,Cosson P,Boudehri K,Renaud C,Capdeville G,Tauzin Y等。开发桃子的第二代遗传联系地图[Prunus Persica(L.)BATSCH]及影响花卉果实形态特征的特征。树遗传学基因组织。2006; 3(1):1-13。
- 7.
郭j,cao k,li y,姚杰,邓c,王q等。比较转录组和显微镜分析在桃子中提供了扁平形状形成的见解(Prunus Persica).植物学报。2017;8:2215。
- 8。
郭j,cao k,deng c,li y,zhu g,fang w等。综合桃基团结构变异图揭示了与果实性状相关的基因。基因组Biol。2020; 21(1):258。
- 9。
桃碟形性状的遗传研究;1940.
- 10.
Cao K,周Z,Wang Q,Guo J,Zhao P,Zhu G等。桃子中12种农艺性状的基因组关联研究。NAT Communce。2016; 7:13246。
- 11.
picañolr,eduardo我,aranzana mj,howad w,batlle i,iglesias i等。结合连锁和关联映射,以搜索与桃子中的平坦水果特征相关的标记。Euphytica。2012; 190(2):279-88。
- 12.
周H,MA R,GAO L,张J.一个下游1.7MB染色体反演PPOFP1.基因负责桃子中的扁平果实形状。植物Biotechnol J. 2020; 19(1):192。
- 13.
Boyer Js,Mclaughlin JE。鉴定多群反应控制基因的功能恢复:花卉流产分析。J Exp Bot。2007; 58(2):267-77。
- 14.
Patrick JW,Stoddard FL。蚕豆灌装的生理学。现场裁剪。2010; 115(3):234-42。
- 15.
阮yl。蔗糖新陈代谢在发展中的信号传导作用。莫尔植物。2012; 5(4):763-5。
- 16.
Weber H,Borisjuk L,Wobus U.豆类种子发展的分子生理学。Annu Rev植物Biol。2005; 56:253-79。
- 17.
陈志强,陈志强,陈志强,等。水稻种子和坐果的分子调控。植物科学进展,2012;17(11):656-65。
- 18.
BARNABAS B,JAGER K,担心A.干旱和热应力对谷物生殖过程的影响。植物细胞环境。2008; 31(1):11-38。
- 19。
刘毅,小臣,阮友。调节水果和种子反应的热量和糖干旱作为营养素和信号。前植物SCI。2013; 4:282。
- 20。
Zanor Mi,Osorio S,Nunes-Nesi A,Carrari F,Lohse M,Usadel B等。RNA干扰林5.在番茄中证实了其在控制Brix含量方面的作用,揭示糖对果激素水平的影响,并证明了蔗糖切割对正常水果开发和生育的重要性。植物理性。2009; 150(3):1204-18。
- 21。
徐姆,布里尔e,llewellyn dj,furbank rt,阮yl。棉花加速叶片膨胀,降低种子流产,增强纤维生产的棉花蔗糖合成酶基因的过度表达。莫尔植物。2012; 5(2):430-41。
- 22。
POLGE C,Thomas M.Sunf1 / AMPK / SNRK1激酶,能量控制核心的全球调节器?趋势植物SCI。2007; 12(1):20-8。
- 23。
Hardie DG。AMP活化/ SNF1蛋白激酶:细胞能量的保守守护者。NAT Rev Mol Cell Biol。2007; 8(10):774-85。
- 24。
SNF1/AMPK通路在酵母中的作用。Biosci前面。2008;13:2408。
- 25。
Coello P,Hey SJ,Halford NG。蔗糖非发酵-1相关(SNRK)蛋白激酶系列:操纵潜力以改善应力耐受性和增加产率。J Exp Bot。2011; 62(3):883-93。
- 26。
陈春华,陈春华,陈春华,等。拟南芥CDPK-SnRK蛋白激酶超家族。植物杂志。2003;132(2):666 - 80。
- 27。
Fujii H.Zhu J-K:3脱离酸活化蛋白激酶缺乏拟南芥突变体缺乏患者生长,繁殖和应力的关键作用。PROC NATL ACAD SCI。2009; 106(20):8380-5。
- 28。
Umezawa T,Nakashima K,Miyakawa T,Kuromori T,Tanokura M,Shinozaki K,等。ABA响应中核心监管网络的分子基础:传感,信号和运输。植物细胞生理。2010; 51(11):1821-39。
- 29。
白建军,毛军,杨华,范安,刘胜,等。蔗糖非发酵相关蛋白激酶2 (SnRK2)基因介导了马铃薯的胁迫反应(Solanum Tuberosum.l .)。BMC麝猫。2017;18(1):41。
- 30.
Zhong R,Wang Y,Gai R,Xi D,Mao C,Ming F. DiC in Snrk蛋白激酶ossapk8用作非生物应激反应的阳性调节因子。植物SCI。2020; 292:110373。
- 31。
陆匡,张捷,赵力,周lh,赵qy,chen t等。拟南芥激酶相关蛋白磷酸酶Kapp,与蛋白激酶的相互作用SNRK2.2 / 2.3 / 2.6,负调节脱落酸信号传导。植物mol biol。2020; 102(1-2):199-212。
- 32.
Emanuelle S,Doblin MS,Stapleton di,Bacic A,Gooley Pr。分子见解进入神秘代谢调节剂,SNRK1。趋势植物SCI。2016; 21(4):341-53。
- 33.
王文,梁杰,王gf,太阳mx,彭富,萧ys。过度表达ppsnrk1alpha.通过调节ABA信号通路和反应性氧代谢来提高番茄增强的耐盐性。BMC植物BIOL。2020; 20(1):128。
- 34.
yu w,peng f,xiao y,王g,罗杰。过度表达ppsnrk1alpha.在番茄中,通过增强成熟抑制剂调节途径来促进果实成熟。前植物SCI。2018; 9:1856。
- 35.
Emanuelle S,Hossain Mi,Moller Ie,Pedersen HL,Van de Meene Am,Doblin Ms,等。SNRK1来自拟南芥蒂利亚纳为非典型AMPK。植物j . 2015; 82(2): 183 - 92。
- 36.
Bitrian M,Roodbarkelari F,Horvath M,Koncz C. Bac-Refombineerations用于研究植物基因调控:SNRK1激酶亚基的发育控制和细胞定位。工厂J1111; 65(5):829-42。
- 37.
Tsai Ay,Gazzarrini S.AKIN10和Fusca3.相互作用以控制南方器官发展和拟南芥中的相变。工厂J. 2012; 69(5):809-21。
- 38.
Baena-gonzáleze,Frolland F,Thevelein JM,Sheen J.在植物应力和能量信号中的转录网络中央集成商。自然。2007; 448:938。
- 39.
Ramon M,Ruelens P,Li Y,Sheen J,Geuten K,Rolland F.杂交四CBS-Domain Kinbetagamma亚单位作为植物能量传感器SNRK1的规范伽玛亚基。工厂J. 2013; 75(1):11-25。
- 40。
Radchuk R,Radchuk V,Weschke W,Borisjuk L,Weber H.抑制蔗糖纯净-1相关蛋白激酶基因在豌豆胚胎中的表达导致脂肪缺陷的成熟缺陷类似于脱钙酸不敏感的表型。植物理性。2006; 140(1):263-78。
- 41。
Radchuk R,Emery RJ,Weier D,Vigeolas H,Geigenberger P,Lunn Je,等。蔗糖非发酵激酶1(SNRK1)在豌豆子叶生长和分化期间坐标坐标。工厂J.2010; 61(2):324-38。
- 42。
高XQ,Liu CZ,Li Dd,Zhao Tt,Li F,贾XN等。SNRK1复合物的Arabidopsis Kinbetagamma亚基通过介导花粉中的活性氧量水平来调节耻骨上的花粉水合。Plos Genet。2016; 12(7):E1006228。
- 43。
Camacho C,Coulouris G,Avagyan V,Ma N,Papadopoulos J,Bealer K,等。BLAST +:架构和应用程序。BMC生物信息学。2009; 10:421。
- 44。
Lohse M,Nagel A,牧民T,May P,Schroda M,Zrenner R等。MERECTOR:一个快速简单的Web服务器,用于基因组刻度型植物序列数据的功能注释。植物细胞环境。2014; 37(5):1250-8。
- 45。
Kleinow T,Bhalaerao R.通过筛选酵母的SNF4缺乏的异源多拷贝抑制剂筛选拟南芥SNF4 Ortholog的功能鉴定。工厂J. 2000; 23(1):115-22。
- 46。
阮yl,金烨,杨yj,李gj,博伊尔js。转化酶介导的糖输入,新陈代谢和信号传导:发育中的作用,产量潜力和对干旱和热量的反应。莫尔植物。2010; 3(6):942-55。
- 47。
Reynolds M,Foulkes MJ,Slafer Ga,Berry P,Parry Ma,Snape Jw等人。在小麦中提高产量潜力。J Exp Bot。2009; 60(7):1899-918。
- 48。
利用时间-事件分析法定量分析生殖器官流产率及其影响因素。植物学报。2011;38(5):431-40。
- 49。
Mclaughlin Je,Boyer JS。玉米卵巢中的葡萄糖定位在低水位电位下的核数和蔗糖被送入茎时。Ann Bot。2004; 94(1):75-86。
- 50。
Punkkinen M,Denessiouk K,Fujii H. Arabidopsis Kin Gamma亚基1具有调节体外体外蔗糖纯度1-相关蛋白激酶2S(SNRK2S)的活性。BIOL植物。2019; 63(1):54-8。
- 51。
Salazar Ja,Ruiz D,Campoy Ja,Sánchez-pérezr,crisosto ch,martínez-garcíapj,等。定量特质基因座(QTL)和孟德尔特征在梅瑞斯分析:一种育种视角和超越。植物mol biol报告。2013; 32(1):1-18。
- 52。
Cirilli M,Bassi D,Ciacciulli A.桃果汁中的糖:繁殖视角。Hortic Res。2016; 3:15067。
- 53。
Sato R,Maeshima M. ER-Localized Aquaporin Sip2; 1参与了花粉萌发和花粉管伸长拟南芥蒂利亚纳.植物mol biol。2019; 100(3):335-49。
- 54。
郭WW,梁WJ,谢克,夏QM,傅杰,郭代等。从39个柑橘幼苗群中剥削多倍体。Acta Hortic。2016; 1135:11-6。
- 55。
Livak KJ,Schmittgen TD。使用实时定量PCR和2的相对基因表达数据分析(-Delta Delta C(T))方法。方法。2001; 25(4):402-8。
- 56.
Verde I,Jenkins J,Dondini L,Micali S,Pagliarani G,Vendramin E等人。桃v2.0释放:高分辨率连杆映射和深度重新排列改善染色体尺度组装和恒星。BMC基因组学。2017; 18(1):225。
- 57.
Trapnell C,Roberts A,Goff L,Pertea G,Kim D,Kelley Dr,等。TOPHAT和袖扣RNA-SEQ实验的差异基因和转录物表达分析。NAT PROTOC。2012; 7(3):562-78。
- 58.
Kumar S,SteCher G,Tamura K. Mega7:用于更大数据集的分子进化遗传学分析版本7.0。mol Biol Evol。2016; 33(7):1870-4。
- 59.
Sun HJ,Uchii S,Watanabe S,Ezura H.一种高效的微米转型方案,番茄功能基因组学的模型品种。植物细胞生理。2006; 47(3):426-31。
- 60。
刘H,Cao X,Liu X,Xin R,Wang J,Gao J等。UV-B照射差异地调节萜烯合成酶和桃的萜烯含量。植物细胞环境。2017; 40(10):2261-75。
致谢
不适用。
资金
该研究得到了中国国家自然科学基金(31972392),农业科技创新计划(CAAS-ASTIP-2020-ZFRI-01),国家园艺种质资源中心的支持。资助者在研究和收集,分析和解释的设计中没有作用,并以书面形式的书面形式。
作者信息
隶属关系
贡献
L.W.和W.G.设计并管理了这个项目。建国、国志、文峰、C.C.和x.w收集资料。j.g., y.l., J.W.和L.G.制备和纯化DNA和RNA样品。J.G.进行了数据分析。是J.G.写的论文。梁文伟,陈志强,陈志强。修改后的论文。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者宣布他们没有对这项工作的利益冲突。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
败育扁桃的表型。黑色箭头表示正在流产的种子。图S2。SNRK基因家族在桃子中的系统发育和基因结构分析拟南芥.引用的SNRK基因拟南芥从NCBI下载并作为查询,以搜索桃的同源基因。系统发育树采用邻居连接法,bootstrap值为1000。图S3。扁桃栽培品种及其芽突变。一种相对基因表达PPSNRK1βγ.在扁平桃子“中帕岛15”('ZPT15')及其芽突变'ZPT15-mut'(圆形桃)。B.在‘ZPT15’树上发现了芽突变。‘ZPT15’为扁桃,芽突变为圆桃。图S4。糖和淀粉含量在桃果实开发期间测定。Dafb表示完全绽放后的几天。果实成熟阶段为70张DAFB。'xj2',中止平桃;'Zh',可行的平桃;'jh',圆形桃子。图S5。高等SSC与更高表达的关系PPSNRK1βγ.在桃子里。一种SSC在28轮和12种扁平桃子中。B.相对基因表达PPSNRK1βγ.在28轮和12个扁平的桃子里。在果实成熟阶段测定SSC含量和基因表达。**表示P.<0.01。图S6。相对表达PPSNRK1βγ.在' HY '(圆桃)和' ZPT11 '(扁桃)中。表S1。在瞬时表达测定中鉴定的DEG。表S2。本研究中使用的引物。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
郭军,曹凯,姚建林。等等。减少蔗糖非发酵1相关激酶亚基基因的表达,PPSNRK1βγ.,通过调节糖和淀粉代谢来赋予桃子的扁平果实流产。BMC植物杂志21,88(2021)。https://doi.org/10.1186/s12870-021-02850-9.
收到了:
公认:
发表:
关键词
- 平桃子
- 水果堕胎
- 糖
- 淀粉
- 糖类