摘要
背景
镰刀菌冠腐病是小麦的主要病害。然而,小麦对抗这种疾病的防御机制仍然鲜为人知。
结果
利用串联质谱标记(TMT)定量蛋白质组学方法,对一个感病小麦品种(UC1110)和一个抗病小麦品种(PI610750)进行了免疫鉴定镰刀菌素pseudograminearumWZ-8A型。形态学和生理学结果表明,PI610750的平均根径和根中丙二醛含量下降了3 接种后3d(dpi),平均根尖数增加。两品种根系活力均显著提高,说明两品种根系对病害的形态、生理生化反应存在差异。TMT分析表明,在UC1110\ U 3dpi/UC1110\ U 0dpi(163)和PI610750\ U 3dpi/PI610750\ U 0dpi(203)两个对照组中,通过基因本体论和京都基因与基因组富集百科全书鉴定出366个差异表达蛋白(DEPs)。结果表明,苯丙酸生物合成(8)、次生代谢产物生物合成(12)、亚麻酸代谢产物(5)、谷胱甘肽代谢(8)、植物激素信号转导(3)、MAPK信号途径(4)和光合作用(12)参与了小麦的防御机制。蛋白质相互作用网络分析表明,DEPs在糖代谢和光合两个途径中都有相互作用。16个基因经实时定量聚合酶链反应验证,与蛋白质组学数据一致。
结论
研究结果为小麦与水稻相互作用的分子机制提供了理论依据F伪禾本科.
背景
小麦(小麦L.)是一个主要的全球粮食作物。令人毛骨冠腐败(FCR),由镰刀菌素pseudograminearum是小麦生产的主要威胁。作为土传病害中破坏力最大的植物病原之一,F伪禾本科可以在殖民化后吸收主要冬季谷物的营养素[1].的殖民化F伪禾本科通过表皮渗透,最常见的是通过气孔孔,并进入苦难性的下皮枝杆菌。菌丝通过组织垂直地从秆底部蔓延,最初通过秆组织中的皮下肌和粘性腔[2]. 该病菌主要侵染小麦、硬粒小麦(膨胀小麦L. spp. durum (Dest.)和大麦(大麦芽l .) [3.].虽然燕麦(Avena Sativa.可被感染,很少或没有疾病症状[4].在太平洋西北部和澳大利亚,在自然接种水平下,产量损失可达10-35% [5,6,7].据报道,F伪禾本科小麦冠腐病在我国也有发生,而在我国最大的小麦生产省河南,其环境条件特别适宜F伪禾本科。这种病原体可能对未来的小麦生产构成严重威胁[8]. 普通小麦尚未发现完全抗病或免疫的品种。因此,提高小麦对冠腐病的遗传抗性是一个重要目标。
之前的研究构建了一个基因图谱F伪禾本科并完成基因组序列[9,10].周等人。调查了与镰刀菌腐烂相关的病原体的分布和多样性在中国黄淮小麦生长地区腐败,发现F伪禾本科是优势种[11].一些研究已经证实ER Lumenal Hsp70蛋白FpLhs1、转录因子FpAda1和FpNPS9是重要的F伪禾本科感染[12,13,14].小麦中的FCR抗性反应是复杂的并且由多种定量性状基因座(QTL)控制[15].因此,一些研究专注于鉴定抗皇冠腐蚀的小麦和大麦的基因基因座[16,17]. 例如,Yang等人利用来自小麦品种UC1110和PI610750的双亲群体,在染色体6A上检测到三个QTL[18].此外,据报道F伪禾本科产生一种新的活性细胞分裂素,可以在感染期间激活植物细胞分裂素信号[19]. 这些分子可能通过与防御激素信号通路的串扰而广泛地重新编程宿主环境[20,21].
关于植物的防御反应触发F伪禾本科利用Affymetrix基因芯片对小麦进行了转录组分析[22].已经提出,差异表达的基因参与抗菌防御,氧化应激和信号转导,以及初级和次生新陈代谢[22]. 抗FCR品种Sunco比感病品种Kennedy对某些防御相关基因的诱导速度更快[23].此外,许多F伪禾本科- 反应基因被毒素脱氧苯酚和植物防御相关激素改变,防止F伪禾本科小麦植株感染[22]. 转录组学和代谢组学的结合也被用来研究防御反应,与病原体识别和信号转导、转录因子、细胞运输和解毒相关的基因也被发现[24].
目前,我们对侵染宿主植物的蛋白质组和代谢组的动态以及对其的抗性知之甚少F伪禾本科尚未从蛋白质组学的角度探索小麦。在这项研究中,我们选择了耐受性和易感性的小麦品种F伪禾本科作为研究材料。我们分析了小麦的蛋白质表达丰度F伪禾本科应用串联质谱标记(TMT)定量蛋白质组学技术研究感染。我们的目的是阐明这些蛋白是如何参与抗性的,并收集有关诱导防御机制的信息F伪禾本科感染。我们也期望本研究能为种质创新提供一个新的视角F伪禾本科为小麦的遗传改良和新品种的选育做出了贡献。
结果
的影响F伪禾本科小麦生长发育的胁迫
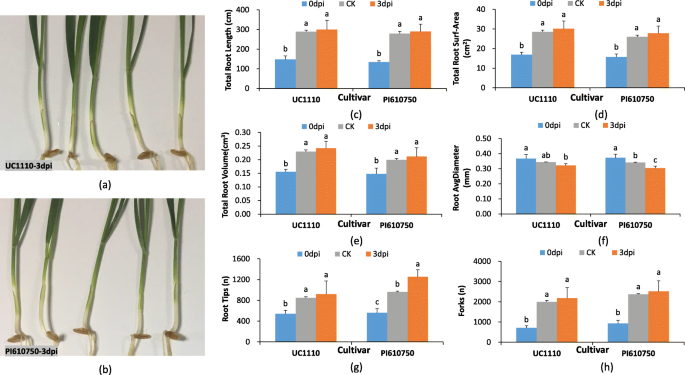
结果表明F伪禾本科胁迫影响了小麦幼苗的生长发育,尤其是根系的生长发育。1a–h)。在3点 感病品种UC1110在接种后3d,茎基部开始出现浅棕色的病害症状,表明其潜伏期已过(图1)。1a, b)。根据我们的观察,PI610750幼苗的平均根径在3 dpi时比3 dpi处理的幼苗显著降低了11.0% (CK)。1f) 而PI610750幼苗的平均根尖数显著增加了30.0%(图。1g) 是的。然而,UC1110和PI610750幼苗的总根长、总根表面积、总根体积和分叉没有显著差异(图。1c-e,h)。
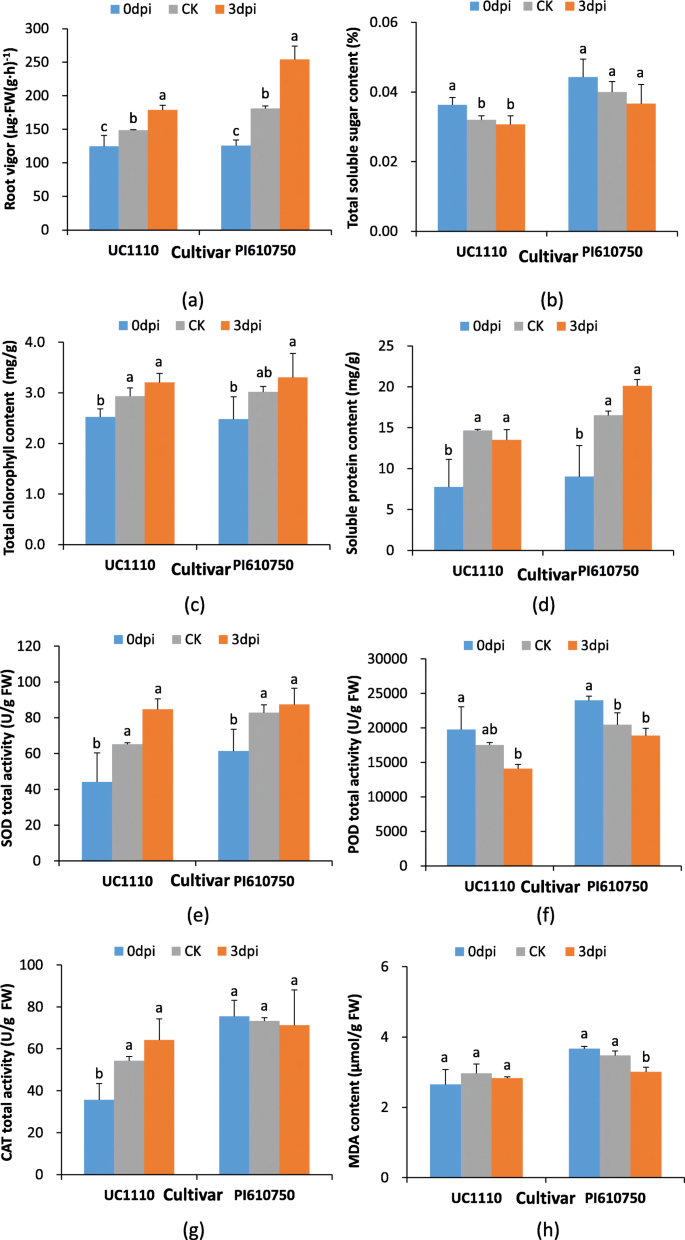
这些生理结果表明,与CK中的3dpi相比,UC1110和PI610750小麦幼苗的根部活力显着增加了20.4和40.5%(图。2a) 而PI610750幼苗根系丙二醛(MDA)含量显著降低13.3%(图。2H)。在UC1110和PI610750幼苗根系中,溶于糖和蛋白质中可溶性糖和蛋白质,叶片含量(SOD),过氧化物酶(POD)和过氧化氢酶(猫)的活性没有显着差异(如图。2这些结果表明,抗病品种PI610750和感病品种UC1110在形态、生理和生化方面的反应存在一定的差异F伪禾本科压力。
识别响应的depF伪禾本科感染
我们综合地检查并确定了两种小麦品种的茎基的防御相关蛋白,UC1110和PI610750F伪禾本科应用TMT定量蛋白质组学技术研究应激反应。本实验选择小麦茎基进行蛋白质组学分析,因为它们是冠腐病菌入侵的第一个障碍F伪禾本科.
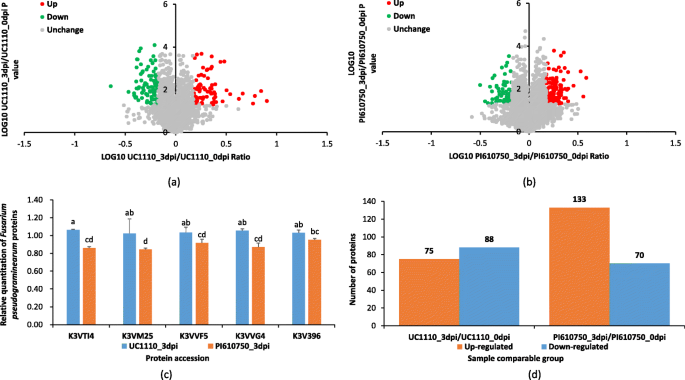
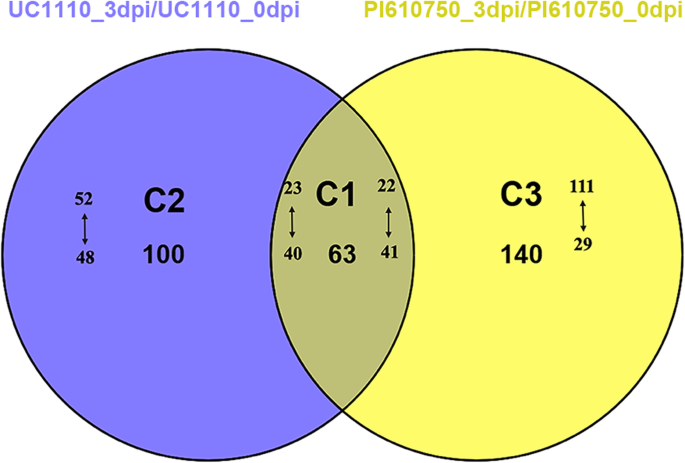
接下来在蛋白水平上探讨UC1110和PI610750耐药差异的机制F伪禾本科接种,我们比较了两组,即UC1110_3DPI / UC1110_0DPI和PI610750_3DPI / PI610750_0DPI,使用TMT定量蛋白质组学。与UC1110_0DPI处理相比,我们在UC1110_3DPI处理中鉴定了163个差异表达的蛋白质(DEP),包括75个上调和88个下调蛋白质物种,其中在该基团中特别表达100(图。3.和4).在PI610750_3dpi/PI610750_0dpi中,差异表达蛋白有203个,其中上调蛋白133个,下调蛋白70个,其中140个在本组特异性表达。UC1110_3dpi/UC1110_0dpi和PI610750_3dpi/PI610750_0dpi共有63个蛋白,其中UC1110_3dpi/UC1110_0dpi上调蛋白23个,下调蛋白40个,PI610750_3dpi/PI610750_0dpi上调蛋白22个,下调蛋白41个。4).
UC1110\ u3dpi/UC1110\ u0dpi与PI610750\ u3dpi/PI610750\ u0dpi的差异表达蛋白分析。UC1110\ U 3dpi/UC1110\ U 0dpi中所有DEP的火山图(一个)和pi610750_3dpi / pi610750_0dpi(b); 五种基因标记蛋白的相对定量分析F伪禾本科在UC1110_3DPI和PI610750_3DPI之间(c).数据显示为平均值±SD(n= 3)三个独立实验。不同小写字母(一个或b)在组之间表明组之间的显着差异(P < 0.05). K3VTI4:醛酮还原酶家族成员;K3VM25:NF-X1指状和螺旋酶;K3VVF5:BHLH家族转录因子;K3VVG4:BHLH家族转录因子;K3V396:核孔蛋白;UC1110\ u3dpi/UC1110\ u0dpi与PI610750\ u3dpi/PI610750\ u0dpi蛋白质组的定量分析(d).蓝色(下调):带t-试验P < 0.05和折叠变化< 0.667; 橙色(上调):DEPst-试验P < 0.05和折叠变化> 1.5
基于GO富集的DEPs聚类分析
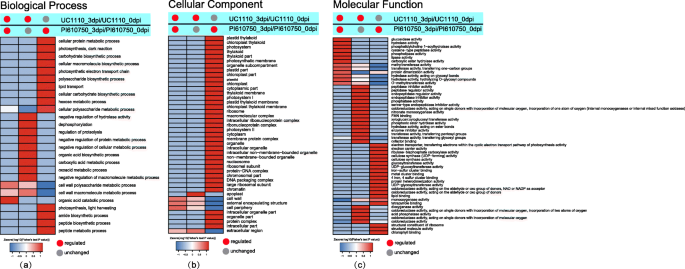
为了确定其潜在功能,我们通过基因本体(GO)注释了366张。GO功能性富集分析表明,分别在生物过程,细胞组分和分子功能中富集了186,126和161种蛋白质物种(附加文件1).
与生物过程相关的DEPs的富集
在生物方法下,在有机酸分解代谢,细胞壁多糖代谢和细胞壁大分子代谢的术语中显着富集了UC1110_3DPI / UC1110_0_0DPI和PI610750_3DPI / PI610750_3DPI / PI610750_0DPI中的常见羟基(C1)。(图。5一种)。UC1110_3DPI / UC1110_0DPI的特异性DEPS(C2)在水解酶活性的负调节,去磷酸化,蛋白质溶解的调节,蛋白质代谢的阴性调节,细胞代谢的阴性调节,有机酸生物合成,羧酸代谢,氧酸代谢和宏观分子代谢的阴性调节(图。5a). PI610750_3dpi/PI610750_0dpi的特异DEPs (C3)在细胞蛋白质代谢、光合作用(暗反应)、碳水化合物生物合成、细胞大分子生物合成、光合电子传递链、多糖生物合成、脂质转运、细胞碳水化合物生物合成,己糖代谢,细胞多糖代谢,光合作用(光收获),酰胺生物合成,肽生物合成,肽代谢(图。5a) 是的。分析表明,与有机酸分解代谢和细胞壁代谢有关的DEPs对有机酸有反应F伪禾本科感病品种和耐病品种幼苗茎基的胁迫。感病品种UC1110也通过与去磷酸化和羧酸代谢有关的DEPs对胁迫作出反应,而抗病品种PI610750主要通过与光合作用和糖代谢有关的DEPs对胁迫作出反应。
富集与细胞组分相关的Deps
在细胞组分类别中,在单元壁,外部封装结构,电池周边和细胞外区域中显着富集了UC1110_3DPI / UC1110_0_0_0_0DPI和PI610750_3DPI / PI610750_0DPI中的两个比较组中的公共DEPS(C1)(图。5b). UC1110_3dpi/UC1110_0dpi的特异DEPs (C2)在外质体中显著富集(图5)。5b). PI610750_3dpi/PI610750_0dpi特异的DEPs (C3)显著富集于质体类囊体、叶绿体类囊体、光系统、光合膜、细胞质部分、类囊体膜、核糖体、核糖核蛋白复合物、细胞质、膜蛋白复合物和细胞器中(图)。5b).该分析表明,与细胞壁相关的DEPs首先响应F伪禾本科敏感和耐受性品种幼苗茎基的胁迫。感病品种UC1110也通过叶绿体相关的DEPs响应胁迫,而耐病品种PI610750主要通过叶绿体相关的DEPs响应胁迫。
分子功能相关DEPs的富集
在分子功能方面,在葡萄糖苷酶活性,水解酶活性,磷脂酰胆碱1-酰酰氨基氢化酶活性,半胱氨酸型肽酶活性,磷脂脂酶活性,磷脂酶活性,磷脂酶活性,磷脂酶活性,磷脂酶活性,磷脂酶活性,磷脂酶活性,磷脂酶活性,磷脂酶活性,磷脂酶活性,脂肪酶活性和羧酸酯水解酶活性(图。5c) 是的。UC1110\ U 3dpi/UC1110\ U 0dpi的特异性DEPs(C2)在肽酶调节活性、内肽酶调节活性、磷酸酶活性、氧化还原酶活性、亚硝酸单加氧酶活性、黄素单核苷酸结合、水解酶活性、酶抑制剂活性、转移酶活性等方面显著富集,双加氧酶活性和酸性磷酸酶活性(图。5c) 是的。PI610750\ U 3dpi/PI610750\ U 0dpi的特异性DEPs(C3)在电子转运体活性、电子载体活性、核酮糖二磷酸羧化酶活性、纤维素合酶活性、葡萄糖基转移酶活性、金属簇结合活性、蛋白质异源二聚化活性、氧化还原酶活性等方面显著富集,脂质结合、四吡咯结合、核糖体结构成分、结构分子活性和叶绿素结合(图。5c)分析表明,在植物-病原体互作过程中,抗病品种PI610750主要通过与电子转运体活性、电子载体活性、纤维素合成酶活性和氧化还原酶活性相关的DEPs响应胁迫。
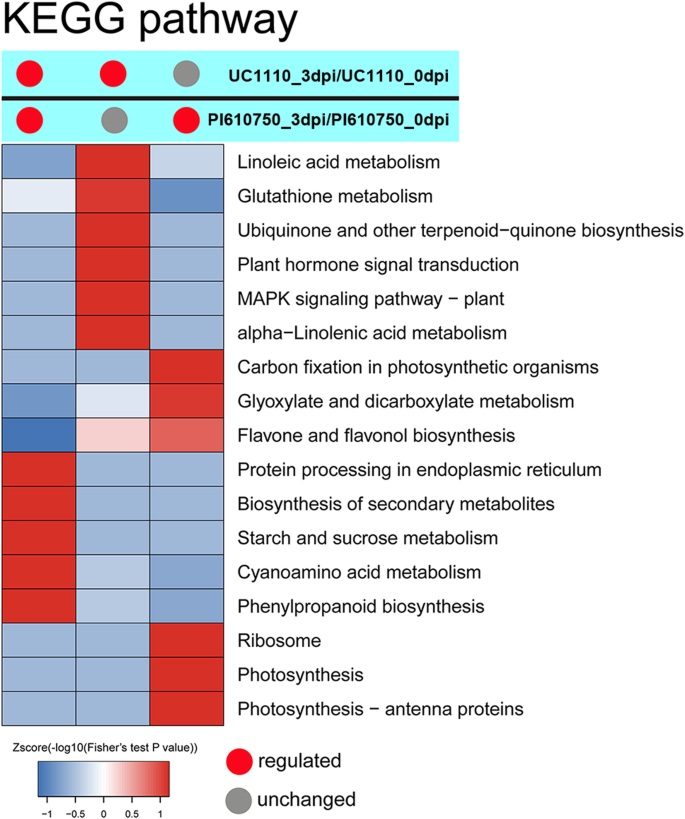
京都基因和基因组百科全书DEPs途径富集分析
使用基因和基因组(Kegg)途径富集的进一步分析表明,两种比较组的所有DEP在核糖体(20%),苯丙醇丙烷生物合成(14%),光合作用(11%),谷胱甘肽中显着富集新陈代谢(11%),光合生物中的碳固定(7%),α-亚麻酸代谢(7%),乙醛酸和二羧酸酯代谢(7%),亚油酸代谢(6%),氰基氨基酸代谢(6%),光合作用 - 天线蛋白(6%)和黄酮和黄酮化生物合成(5%)(附加文件2).UC1110_3dpi/UC1110_0dpi和PI610750_3dpi/PI610750_0dpi两组中常见的63个DEPs (C1)在次生代谢物生物合成(osa01110)、苯丙类生物合成(osa00940)、内质网蛋白加工(osa04141)、淀粉和蔗糖代谢(osa00500)方面显著富集,和氰氨基酸代谢(osa00460)(图。6,附加文件3.).
UC1110_3dpi/UC1110_0dpi特异性DEPs (C2)在亚油酸代谢(osa00591)、谷胱甘肽代谢(osa00480)、α -亚麻酸代谢(osa00592)、MAPK信号通路-植物(osa04016)、黄酮和黄酮醇生物合成(osa00944)、泛素和其他萜类醌类生物合成(osa00130)(图。6,附加文件4).PI610750_3dpi/PI610750_0dpi特异性DEPs (C3)显著富集于核糖体(osa03010)、光合作用(osa00195)、光合-天线蛋白(osa00196)、黄酮和黄酮醇生物合成(osa00944)、光合生物固碳(osa00710)、乙醛酸和二羧酸代谢(osa00630)(图。6,附加文件5). 分析表明,感病品种和耐病品种幼苗茎基中与次生代谢产物、蛋白质加工和能量代谢途径有关的DEPs对胁迫均有反应。感病品种UC1110主要通过与亚油酸代谢和谷胱甘肽代谢有关的DEPs来响应胁迫,抗病品种PI610750主要通过与光合作用、乙醛酸和二羧酸代谢有关的DEPs来响应胁迫。
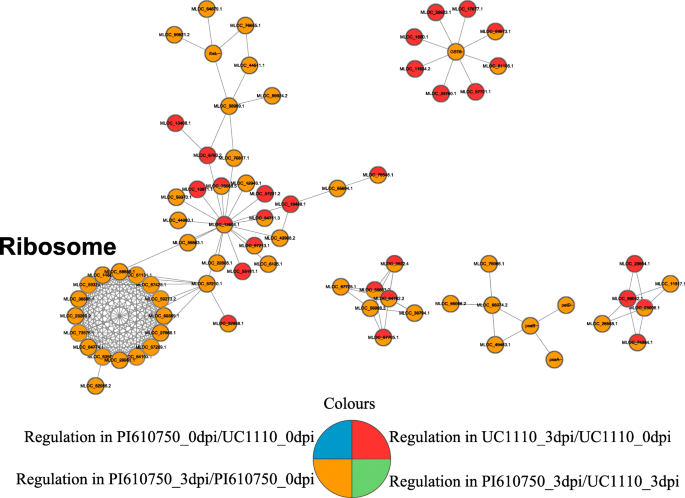
相互作用网络分析F伪禾本科小麦中的-反应蛋白
本研究利用在线STRING数据库和Cytoscape软件构建了两组反应中所有DEPs的蛋白-蛋白相互作用网络F伪禾本科.这个网络显示76个可能的dep相互作用。使用MCODE插件工具包,三个富集的相互作用聚类与核糖体、光合作用和糖代谢相关(图。7).十六个相互作用蛋白属于核糖体网络。这些蛋白质包括15个上调的蛋白质和比较组PI610750_3DPI / PI610750_0DPI中的一个下调蛋白质。七种相互作用蛋白属于碳水化合物代谢过程网络,包括UC1110_3DPI / UC1110_0DPI和PI610750_3DPI / PI610750_3DPI / PI610750_3DPI / PI610750_3DPI / PI610750_3DPI的四个下调蛋白,以及PI610750_3DPI / PI610750_0_0DPI的比较组中的一个下调和两个上调蛋白.三种相互作用蛋白属于光合作用网络,包括PI610750_3DPI / PI610750_0DPI中的三个上调蛋白。有关蛋白质的更多信息显示在附加文件中6.
mRNA与蛋白质丰度的关系
为了进一步验证蛋白质组学数据的可靠性,我们选择了16个基因进行定量实时聚合酶链反应(qRT-PCR)分析。NMT1、GLU1B、XIPI等三个常见基因在两组中均表现出与蛋白表达相似的趋势。在UC1110_3dpi/UC1110_0dpi的对照组中,NMT1和GLU1B分别上调和下调。而在PI610750_3dpi/PI610750_0dpi的对照组中,XIPI和GLU1B均下调(表1). 在UC1110\u3dpi/UC1110\u0dpi对照组中,5种特异性DEPs在转录和翻译水平均上调。同样地,在PI610750苻3dpi/PI610750苻0dpi对照组中,8个特异性DEPs在转录水平和翻译水平均上调。这16个基因的引物序列在附加文件中列出7.
讨论
不同抗病性小麦品种根系对冠腐病菌的形态、生理生化反应存在明显差异F伪禾本科.PI610750幼苗的平均根径和根中MDA含量降低,平均根尖数量增加。在3 dpi时,PI610750的根系活力增幅高于UC1110。这说明了小麦幼苗对冠腐病的防御机制F伪禾本科是复杂的。虽然已经发现了许多与冠腐病抗性相关的因素,但对冠腐病抗性的分子机制仍知之甚少。因此,了解小麦植株对冠腐病的防御机制对小麦产量和品质的可持续提高具有重要意义。本研究中两个品种的DEPs与代谢途径、植物-病原体互作和光合作用有关。
代谢途径的反应F伪禾本科感染
小麦响应的代谢途径F伪禾本科是必要的,占所有KEGG通路中DEPs的37%。已有研究表明,脯氨酸代谢与植物对非生物胁迫的响应有关,脯氨酸脱氢酶(ProDH)是第一个催化脯氨酸降解的酶[25]. 据报道,4-羟基-7-甲氧基-3-氧基− 3,4-二氢-2H-1,4-苯并恶嗪-2-基葡萄糖苷β-D-葡萄糖苷酶是多种代谢途径的典型成员,4-羟基-7-甲氧基-3-氧代-3,4-二氢-2H-1,4-苯并恶嗪-2-基葡萄糖苷β-D-葡萄糖苷酶参与高能化合物的代谢和植物生长[26].一些研究表明,β-葡糖苷酶参与催化糖苷的水解以将葡萄糖释放到糖溶解过程中[27]. 在植物中,谷胱甘肽S-转移酶(GSTs)在细胞解毒和胁迫耐受中起着重要作用[28,29,30].以前,据报道,脂氧合酶,联烯酸环酶和一根烯氧化物合酶(AOS)是茉莉酸(JA)生物合成中的三种重要酶,AOS的活化增强了鹰嘴豆的干旱耐受性[31,32,33].研究还表明,细胞中的AOS转录物和JA浓度对于植物中对病原体和/或病毒感染的反应至关重要[34,35].
一些研究表明,NADH依赖性谷氨酸合成酶(NADH-GOGAT)位于非绿色组织中,并且在根中高度表达,参与铵同化途径,并促进植物的吸收[36]. 已有研究表明,苯丙氨酸解氨酶和肉桂酰辅酶A还原酶主要参与木质素的生物合成。木质素的生物合成是苯丙烷生物合成途径中的一个重要分支,苯丙烷的生物合成与植物抗病性有关[37,38,39].在本研究中,我们发现了UC1110_3DPI / UC1110_0DPI和PI610750_3DPI / PI610750_0DPI的两种比较组中的五种常见DEP,以显着下调,包括PRODH,4-羟基-7-甲氧基-3-氧代-3,4-二氢 -2H-1,4-苯并恶唑嗪-2-基葡萄糖苷β-D-葡糖苷酶,β-葡糖苷酶26,AOS和GSTU1。PRODH,AOS和GSTU1分别富集于精氨酸和脯氨酸代谢(OSA00330),α-亚麻酸代谢(OSA00592)和谷胱甘肽代谢(OSA00480)的Kegg途径中。
此外,4-羟基-7-甲氧基-3-氧代-3,4-二氢-2H-1,4-苯并恶唑-2-基葡萄糖苷β-D-葡糖苷酶和β-葡糖苷酶26在三种途径中富集淀粉和蔗糖新陈代谢(OSA00500),氰基氨基酸代谢(OSA00460)和苯丙醇化生物合成(OSA00940)在两个比较组中UC1110_3DPI / UC1110_0DPI和PI610750_0_3DPI / PI610750_0DPI。GSTU6和Nadh-Gogat分别上调,分别富集谷胱甘肽代谢(OSA00480)和氮代谢(OSA00910)的途径。肉桂酰基还原酶1,过氧化物酶和苯丙氨酸氨酶也上调,并富含苯丙醇化生物合成的途径(OSA00940)。这表明以下:(1)产品和4-羟基-7-甲氧基-3-氧代-3,4-二氢-2H-1,4-苯并恶嗪-2-基葡萄糖苷βD-葡糖苷酶在其中发挥着重要作用小麦的防御机制F伪禾本科;(2)通过对这两个小麦品种gst的研究,可以揭示GSTU1和GSTU6在小麦抗病机制中的作用差异F伪禾本科; (3) JA通路中AOS的下调使UC1110更易被病原体感染(4) 肉桂酰辅酶A还原酶1、过氧化物酶和苯丙氨酸解氨酶在苯丙烷生物合成过程中上调,与植物防御能力密切相关;(5)植物对病原胁迫的代谢途径复杂多变(图。8).
小麦的植物-病原体相互作用
植物有各种防御机制。这些包括产生抗微生物肽,特别是发病性相关的蛋白质(PR蛋白)。PR蛋白首先在植物中注意到作为过敏反应的一部分,但由于已被分配了一系列生物角色[40].Pr蛋白是一种应激响应蛋白的一种应激响应蛋白,其表达可以通过病原体侵袭诱导[41]. 大量研究表明,PR蛋白参与植物的防御机制,许多PR蛋白具有抗植物病原菌的抗菌活性,具有不同的抗真菌、抗菌和抗病毒作用[42,43].关于UC1110_3DPI / UC1110_0_0_0_0_0DPI的比较组中的特异性DEP,鉴定了与植物 - 病原体相互作用相关的多种PR蛋白,包括PR蛋白-1.2,PR蛋白1-1和PR蛋白1-2。这些蛋白质的表达水平响应于F伪禾本科感染。这些蛋白在PI610750\u3dpi/PI610750\u0dpi中表达上调,但差异不显著。
PR蛋白1是宿主防御中的一种抗菌蛋白,在感染过程中被植物病原体作为目标[44,45,46]. PR蛋白的产生与植物系统获得抗性(SAR)相关[47]. PR-1-5是ToxA的潜在作用靶点,PR-1-5与ToxA的特异性相互作用可能介导了ToxA诱导的感病小麦坏死[48]. 在本研究中,UC1110\ U 3dpi/UC1110\ U 0dpi对照组发病相关蛋白(PR-1.2,PR-1-1,PR-1-2)上调,并参与植物激素信号转导(osa04075)和MAPK信号植物途径(OSA00416),说明PR1家族在小麦冠腐病防御机制中起重要作用。
小麦茎秆根部的防御光合活性F伪禾本科感染
在植物中,叶绿体光合作用是一种重要的生物化学反应,它将光能转化为化学能以维持植物的生命[49].对植物防御和光合作用的研究表明,病原菌入侵后,光合速率降低,如大麦感染白粉病,马铃薯感染白粉病晚疫霉和大豆感染疫霉突变[50,51,52].本研究中,对照组PI610750_3dpi/PI610750_0dpi的特异DEPs显著富集于光合作用(osa00195)、光合作用-天线蛋白(osa00196)和碳固定(osa00710)三个光合作用相关通路中(图)。6).光合作用相关蛋白丰度的增加可能反映了光合作用为植物防御提供了大量的能量。因此,抗病品种PI610750中的光合作用相关蛋白在病害防御中发挥着重要作用。
先前的研究表明,Sedoheptulose-1,7-双磷脂酶,磷脂酶,甘油氨基酶,甘氨醛-3-磷酸脱氢酶,以及核苷酸1,5-二磷酸羧酸酯/氧酶(Rubisco)参与了钙素循环,并且磷酸甘油激酶参与糖酵解,葡糖来的和光合途径[53,54].也有报道称,在转基因烟草植株中增加sedoheptuose -1,7-二磷酸酶的活性,可以从发育早期开始促进光合作用和生长[55].Rubisco是植物中的一种酶复合体,由8个大亚基和8个小亚基组成[56].据报道,盐处理后中产-1 8 H的Rubisco的小和大亚基的丰富大幅增加[57].在对干旱的反应中,非转基因小麦中也检测到了Rubisco大亚基丰度的增加和小亚基的减少[58,59].有报道称,Rubisco大亚基和核糖-1在接种24 h后下调,48和72 h后上调[60.].
在我们的研究中,我们在PI610750的光合生物(OSA00710)的碳固定途径(OSA00710)的碳固定途径中检测到富集的Sedoheptulose-1,7-双磷酸酶,磷脂蛋白酶,磷酸糖激酶,甘油醛酶,磷酸糖激酶,甘油醛-3-磷酸脱氢酶,Rubisco大亚基和Rubisco小亚基。这些DEP的丰度的增加表明光合作用在耐受耐药品种PI610750的防御机制中起主要作用。然而,在疾病易感品种UC1110中未观察到这些DEP。总之,耐药品种PI610750可以通过增加其光合速率来保护疾病,从而为自己提供能量。
结论
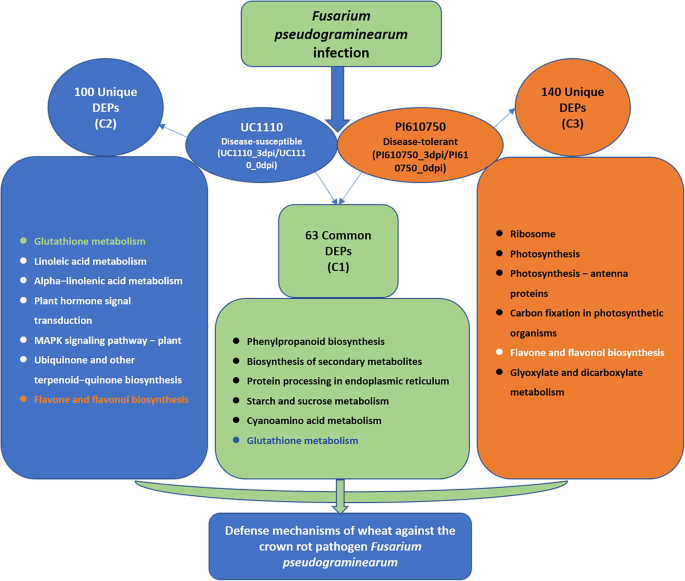
通过基于TMT的定量蛋白质组学分析,证实了小麦抗病品种PI610750和感病品种UC1110在不同胁迫下的生理生化反应存在显著差异F伪禾本科压力。基于GO富集和KEGG途径富集的聚类分析结果,小麦对代谢途径的响应F伪禾本科压力可能很复杂。抗病品种PI610750和感病品种UC1110在培养期间与病原菌互作。虽然这些品种共享许多相同的代谢途径,但它们也具有独特的代谢途径。感病品种UC1110的独特途径主要与亚油酸代谢、植物激素信号转导、MAPK信号通路-植物、泛素生物合成有关,而抗病品种PI610750的独特途径主要与光合作用、光合生物固碳、黄酮和黄酮醇的生物合成,乙醛酸酯和二羧酸酯的代谢。感病品种UC1110苗茎基中DEPs主要与谷胱甘肽代谢、氮代谢和苯丙烷生物合成有关,而耐病品种PI610750苗茎基中DEPs主要与光合作用有关。说明抗病品种PI610750与感病品种UC1110对小麦的防御机制存在差异F伪禾本科,为小麦的遗传改良和育种提供了新的思路。
方法
实验材料与接种
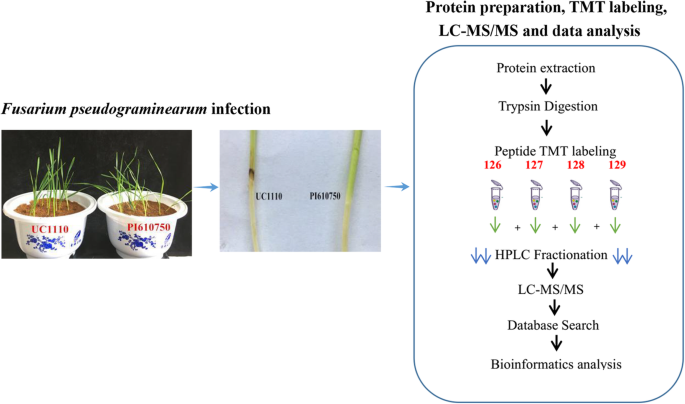
本研究采用加利福尼亚大学Jorge Dubcovsky教授戴维斯教授提供的小麦品种UC1110和PI610750。一个强壮而有侵略性的人F伪禾本科本研究采用河南农业大学植物保护学院洪连丽教授提供的WZ-8A菌株(JN86223 2.1)。品种UC1110对中国分离物WZ-8A敏感F伪禾本科,而品种PI610750是耐受的。通过浸入75%(w / v)醇30 s中灭菌UC1110和PI610750种子,然后用蒸馏水彻底洗涤。用2kg灭菌土壤(砂:土壤= 2.5:1)培养灭菌的种子。在16/8小时光/暗光周期和65/75%/夜间/夜间温度下,在25/20℃的夜间温度下保持幼苗和65/75%的相对湿度。
我们用F伪禾本科从大约20克的小米基质和使用植物以0 dpi为控制,用未处理的3 dpi幼苗用作阴性对照。我们在0,1,2和3 dpi下收集了两种小麦品种的茎碱,直到可见症状,然后在-80℃下储存样品直至蛋白质提取。我们每次治疗三次生物学重复(图。9).
植物形态和生理参数的测量
我们使用Epson Expression 12000XL照片扫描仪(Seiko Epson Corporation, Suwa, Nagano, Japan)检测形态,并使用Win-RHIZO系统(LA6400XL, Regent Instruments Inc., Quebec, Canada)分析形态参数,包括总根长、总根表面积、总根体积、平均根直径、根提示的数量和分叉的数量。我们在不同的时间(0、1、2、3 dpi)采集小麦的根和叶。根系活性采用三苯基四氮唑氯化物改性方法测定,如Wang等和Cao等[61.,62.].我们使用硫酸 - 蒽酮方法确定总可溶性糖的含量[63.,64.通过分光光度法测量叶片叶绿素含量[65.]. 我们根据先前描述的方法测量了与应激、POD、SOD和CAT相关的酶的活性[65.,66.],以牛血清白蛋白(BSA)为标准,采用Bradford法测定蛋白质含量[67.].根据先前描述的方法,我们确定了MDA内容[65.].
蛋白质提取
蛋白质提取、胰蛋白酶消化、LC-MS (MS/MS)分析,并参考文献检索数据库[68.,69.,70,71.,72.,73.,74.],有一些修改。将样品研磨成液氮中的细胞粉末。然后,将细胞粉末移动到5ml离心管。在下一步骤中,我们将四个体积的裂解缓冲液(即,8M尿素,1%Triton-100,10mM二硫代噻吩醇和1%蛋白酶抑制剂鸡尾酒)加入细胞粉末。高强度超声波处理器(Scienz,浙江,中国)用于在冰上进行超声处理。我们通过在4℃下以20,000g离心10分钟除去剩余的碎片。最后,我们用冷20%三氯乙酸沉淀出蛋白质,在-20℃下进行2小时。在4℃下以12,000g离心10分钟后,将上清液丢弃。我们用冷丙酮洗涤剩余的沉淀物三次。在8M尿素中重新溶解蛋白质,使用BCA试剂盒根据制造商的说明确定蛋白质浓度。
胰蛋白酶消化
对于消化,我们使用5毫米二硫代噻唑醇30分钟,以在56℃下减少蛋白质溶液。之后,在黑暗中在室温下,蛋白质用11mM碘乙酰胺烷基化15分钟。然后,我们通过加入100mM茶叶稀释蛋白质样品直至尿素浓度小于2米。最后,1:50和1:100胰蛋白酶 - 蛋白质质量比用于第一次消化过夜,第二个4小时分别消化。
质(MS / MS)分析
在0.1%甲酸(溶剂A)中溶解胰肽,然后将胰肽直接装入自制的反相分析柱(15 cm长,75 μm i.d.)上。以恒定流量400 nL /分钟EASY-nLC 1000超高效液相色谱(UPLC)系统的梯度溶剂B(0.1%的甲酸乙腈98%)在26分钟从6增加到23%,从23日增加到35%,8分钟3分钟攀升至80%,然后是80%,举行最后的3分钟。我们将肽置于NSI源中,然后将QExactiveTM Plus (ThermoFisher, Waltham, MA, USA)的串联质谱(MS/MS)在线耦合到UPLC上。施加2.0 kV电喷雾电压。在Orbitrap中,完整的肽被检测到分辨率为70000,而m/z公司全扫描范围为350 - 1800。然后,我们使用NCE设置为28,在MS/MS中选择多肽。这些碎片随后在轨道rap中以17,500的分辨率被探测到。我们执行了一个依赖于数据的程序,在一次MS扫描和随后的20次MS/MS扫描之间交替进行,动态排除15.0 s。我们把自动增益控制调到5E4。第一个质量固定在100m / z。
数据库搜索
我们使用Maxquant搜索引擎(v.1.5.2.8)来处理生成的MS/MS数据。之后,我们搜索了串联质谱与UniProt的对比小麦数据库,它与反向诱饵数据库连接。作为一种裂解酶,胰蛋白酶/P被允许有两个缺失的裂解。在First search和Main search中,前驱体离子的质量容限分别设置为20ppm和5ppm。我们将碎片离子的质量容限设置在0.02 Da。在Cys上,Met和carbamomethyl的氧化分别为可变修饰和固定修饰。我们将错误发现率(FDR)调整到< 1%,并将肽的最低分数设置为> 40。对于蛋白质定量,我们选择TMT 6-plex法。FDR设置为0.01,蛋白质组定量至少需要2个肽。在蛋白质定量方面,蛋白质比例是通过蛋白质唯一肽段的中位数计算的。我们用蛋白质的中位数将所有肽的比例标准化。 We used cutoff values of more than 1.50-fold and less than 0.667-fold to identify up-regulated and down-regulated proteins using at-试验地点P < 0.05.
生物信息学分析
我们从Uniprot-GoA数据库中派生了Go Annotation蛋蛋白序(http://www.ebi.ac.uk/GOA/). 我们使用KEGG数据库来注释蛋白质通路。我们使用stringv10.5数据库分析了所鉴定蛋白质的蛋白质相互作用(http://string-db.org)来确定它们的功能和途径。我们可视化了来自Cytoscape (https://cytoscape.org/).我们使用了一种图论聚类算法[即。,molecular complex detection (MCODE)] to analyze densely connected regions. MCODE is part of the plug-in toolkit of the network analysis and visualization software Cytoscape.
定量实时逆转录-聚合酶链反应
基因引物采用在线引物3.0设计,详见附加文件7. 我们使用TaKaRa MiniBEST植物RNA提取试剂盒(中国大连TaKaRa)从小麦茎基提取总RNA。按照试剂盒说明(美国威斯康星州麦迪逊市Promega公司)进行RNA逆转录。详细的方法可以在以前的出版物中找到[60.].通过3个生物重复,保证了结果的重现性。我们在CFX96实时PCR检测系统(Bio-Rad Laboratories, Inc., Hercules, CA, USA)中进行了反应。我们使用CFX管理软件(Bio-Rad Laboratories, Inc.)分析所有数据。相对表达量采用2-ΔΔct方法(75.]. β-肌动蛋白作为内控基因。
统计分析
我们对10个生物重复进行了形态学分析,对4个生物重复进行了生理生化分析,对3个生物重复进行了蛋白质组学分析。我们使用IBM SPSS Statistics 21.0 (IBM Corp., Armonk, NY, USA)进行方差分析。数据以均数±标准差(SD)表示。我们使用Student’s确定统计学意义t-测试在P < 0.05阈值。
数据和材料的可用性
本研究分析的所有数据均包含在本文及其附加文件中。质谱蛋白质组学数据已通过PRIDE合作伙伴储库(http://www.ebi.ac.uk/pride.)具有数据集标识符PXD023314。
缩写
- 高层管理团队:
-
串联质量标签
- 新闻部:
-
接种后的日子
- DEPs:
-
差异表达蛋白
- FCR公司:
-
镰刀菌皇冠腐烂
- QTLS:
-
数量性状位点
- CK:
-
3 dpi未经处理的幼苗
- 丙二醛:
-
丙二醛
- 草皮:
-
超氧化物歧化酶
- 豆荚:
-
过氧化物酶
- 猫:
-
过氧化氢酶
- 开始:
-
基因本体论
- 小桶:
-
京都基因和基因组百科全书
- qRT PCR:
-
实时定量聚合酶链反应
- ProDH:
-
脯氨酸脱氢酶
- 消费税:
-
肽硫转移酶
- AOS:
-
氧化丙二烯合酶
- 是:
-
茉莉酸
- NADH-GOGAT:
-
NADH-dependent谷氨酸合成酶
- Pr蛋白:
-
病因相关蛋白质
- SAR:
-
系统获取的阻力
- 上传:
-
超高效液相色谱
- 罗斯福:
-
错误发现率
工具书类
- 1.
喀山K, Gardiner DM.镰刀菌冠腐病引起镰刀菌素pseudograminearum谷类作物:最近的进展和未来的展望。摩尔植物病理学研究.2018;19(7):1547–1562.doi.org/https://doi.org/10.1111/mpp.12639
- 2.
骑士NL,Sutherland MW。组织病理学评估镰刀菌素pseudograminearum冠腐病侵染期间谷物秆的定殖。工厂说。2016;100(2):252 - 259。doi.org/https://doi.org/10.1094/PDIS-04-15-0476-RE
- 3.
Liu CJ,Ogbonnaya足球俱乐部。小麦和大麦对镰刀菌冠腐病的抗性研究进展。植物品种.2015;134(4):365–372.doi.org/https://doi.org/10.1111/pbr.12274
- 4.
珀西CD,威尔德穆特GB,萨瑟兰大师。在感病和部分抗病的谷物幼苗中,症状发育以不同的速率进行镰刀菌素pseudograminearum.南国植物病理学研究.2012; 41(6):621-631。doi.org/https://doi.org/10.1007/s13313-012-0146-2
- 5.
Smiley RW、goulie JA、Easley SA、Patterson LM、Whittaker RG。西北太平洋小麦和大麦冠腐病的作物损失估计。植物分布.2005;89(6):595–604.doi.org/https://doi.org/10.1094/PD-89-0595
- 6.
Murray Gm,Brennan JP。估算澳大利亚大麦行业的疾病亏损。南国植物病理学研究.2010; 39:85 - 96。doi.org/https://doi.org/10.1071/AP09064
- 7。
克莱恩TA,伯吉斯LW,埃里森FW,克莱恩TA,伯吉斯LW,埃里森FW。小麦侵染病毒的发生率及其空间格局禾谷镰刀菌第1组和冠腐病对产量的影响。澳大利亚农业保护区.1991;42:399–407.doi.org/https://doi.org/10.1071/AR9910399
- 8。
李HL,元HX,傅B,Xing XP,Tang WH:第一报告镰刀菌素pseudograminearum导致河南皇冠腐烂。植物DIS..2012年,96(7):1065。doi.org/https://doi.org/10.1094/pdis-01-12-0007-pdn.
- 9。
加德纳DM,Benfield啊,蒂尔斯·斯蒂芬·斯,艾特肯·k,刘建,等。谷冠腐病原体的高分辨率遗传图谱镰刀菌素pseudograminearum提供一个近乎完整的基因组组装。摩尔植物病理学研究.2018; 19(1): 217 - 226。doi.org/https://doi.org/10.1111/mpp.12519.
- 10.
张雪涛,高峰,张峰,谢勇,周玲,袁洪祥,等。一种新的巨型病毒的全基因组序列镰刀菌素pseudograminearum小麦冠腐病的病原。2018;163(11):3173–3175.doi.org/https://doi.org/10.1007/S00705-018-3970-Z.
- 11
周海峰,何晓林,王松,马庆忠,孙保军,丁双林,等。中国黄淮小麦产区与冠腐病相关的镰刀菌多样性。环境Microbiol。2019;21(8):2740 - 2754。doi.org/https://doi.org/10.1111/1462-2920.14602
- 12
陈丽丽,耿晓军,马玉明,赵建勇,陈文斌,邢小平,等。ER腔内Hsp70蛋白FpLhs1在分生孢子和植物感染中起重要作用镰刀菌素pseudograminearum.Microbiol前面。2019;10:1401。doi.org/https://doi.org/10.3389/fmicb.2019.01401
- 13
Chen Ll,Ma Ym,Zhao Jy,Geng XJ,Chen WB,Ding Sl,等。BZIP转录因子FPADA1对于真菌生长和共复合是必不可少的镰刀菌素pseudograminearum.Curr Genet。2020; 66(3):507-515。doi.org/https://doi.org/10.1007/s00294-019-01042-1
- 14
康瑞杰,李甘宁,张俊美,张培平,王利民,张永生,等。的表达镰刀菌素pseudograminearum小麦植物中的FPNPS9及其在致病性中的作用。Curr Genet。2020; 66(1):229-243。doi.org/https://doi.org/10.1007/s00294-019-01017-2
- 15
Pariyar SR, Erginbas-Orakci G, Dadshani S, Chijioke OB, Léon J, Dababat AA, et al.;小麦冠腐病抗性遗传复杂性分析。Sci众议员2020;10(1):3200。doi.org/https://doi.org/10.1038/s41598-020-601598-020-60190-4
- 16
Poole GJ,笑脸RW,Paulitz TC,Walker Ca,Carter Ah,参见Dr,Garland-Campbell K.定量特质基因座(QTL)的抵抗抗性冠腐(镰刀菌素pseudograminearum)在太平洋西北部的多种测定环境中。Al Appl Genet。2012; 125(1):91-107。doi.org/https://doi.org/10.1007/S00122-012-1818-6
- 17。
关键词:生物化学,生物化学,生物化学,生物化学小麦赤霉病和冠腐病抗性主要位点的细胞遗传定位长穗偃麦草7EL和它与来自钍。Ponticum.将同源臂放在面包小麦7DL上。理论应用基因。2017;130(10):2005–2024.doi.org/https://doi.org/10.1007/s00122-017-2939-8
- 18。
杨X,潘y,singh pk,他x,ren y,zhao l等。中国常见小麦镰刀菌腐蚀性研究的调查与基因组。BMC植物BIOL。2019; 19:153。doi.org/https://doi.org/10.1186/s12870-019-1758-2
- 19。
Blum A, Benfield AH, Sørensen JL, Nielsen MR, Bachleitner S, Studt L等。一种新型镰刀菌细胞分裂素的调控镰刀菌素pseudograminearum. 真菌生物学.2019, 123(3): 255 - 266。doi.org/https://doi.org/10.1016/j.funbio.2018.12.009
- 20.
Sørensen JL, Benfield AH, Wollenberg RD, Westphal K, Wimmer R, Nielsen MR等。谷物的病原体镰刀菌素pseudograminearum在感染过程中产生一类新的活性细胞分裂素。植物病理学。2018;19(5):1140–1154.doi.org/https://doi.org/10.1111/mpp.12593
- 21.
关键词:差异代谢重编程阿尔维拟杆菌- 预期高粱双色幼苗回应镰刀菌素pseudograminearum感染。代谢物。2019;9(7):150.doi.org/https://doi.org/10.3390/metabo9070150
- 22。
关键词:小麦,冠腐病,茉莉酸甲酯,基因表达镰刀菌素pseudograminearum.Physiol Mol Plant Pathol.2005、67(3 - 5):171 - 179。doi.org/https://doi.org/10.1016/j.pmpp.2005.12.007
- 23。
关键词:小麦,感染,基因表达,基因表达镰刀菌素pseudograminearum.Physiol Mol Plant Pathol.2008; 73(1 - 3): 40-47。doi.org/https://doi.org/10.1016/j.pmpp.2008.12.001
- 24。
Powell JJ, Carere J, Fitzgerald TL, Stiller J, Covarelli L, Xu Q,等。镰刀菌冠腐病原体镰刀菌素pseudograminearum引发了面包小麦的一系列转录和代谢变化(小麦l .)。安机器人。2017;119(5):853 - 867。doi.org/https://doi.org/10.1093/aob/mcw207
- 25。
Weltmeier F,Ehlert A,Mayer CS,Dietrich K,Wang X,Schutze K,等.通过bZIP转录因子特异性异二聚体对拟南芥脯氨酸脱氢酶转录的组合控制。EMBO J。2006;25(13):3133–3143.doi.org/https://doi.org/10.1038/sj.emboj.7601206
- 26。
关键词:菲,小麦,根,质膜蛋白,蛋白质组学环境科学与污染研究.2016; 23(11): 10863 - 10871。doi.org/https://doi.org/10.1007/S11356-016-6307-Z.
- 27
王颖,徐玲,唐美娟,蒋海燕,陈伟,张伟,等。铅暴露下萝卜根系蛋白质组的功能和整合分析。前植物科学.2016; 7:1871。doi.org/https://doi.org/10.3389/fpls.2016.01871
- 28
Piero ARL,Mercurio V,Puglisi I,Petrone G:两种不同甜橙的基因分离和表达分析[素类tau型谷胱甘肽转移酶。基因。2009;443(2):143 - 150。doi.org/https://doi.org/10.1016/j.gene.2009.04.025
- 29
Yasir M,He sp,sun gf,geng xl,pan z,gong wf等。基因组 - 范围的协会研究揭示了与旱地棉中盐度胁迫耐受相关的关键SNPS /基因。基因。2019; 10(10):829。doi.org/https://doi.org/10.3390/genes10100829
- 30.
马铃薯谷胱甘肽s -转移酶基因家族的全基因组分析茄属植物tuberosum及其在各种解剖组织和扰动条件下的表达谱。基因。2018;639:149–162.doi.org/https://doi.org/10.1016/j.gene.2017.10.007
- 31.
关键词:丛枝菌根,大麦,茉莉酸,生物合成植物杂志。2002;130(3):1213 - 1220。doi.org/https://doi.org/10.1104/pp.006007
- 32.
Schaller F,Schaller A,Stintz A.生物合成和茉莉酸盐的代谢。J工厂增长调节。2005; 23(3):179-199。doi.org/https://doi.org/10.1007/s00344-004-0047-x
- 33.
De Domenico S, Bonsegna S, Horres R, Pastor V, Taurino M, Poltronieri P,等。氧脂素生物合成基因的转录组学分析和化学分析揭示了干旱胁迫下鹰嘴豆根系中茉莉酸的早期诱导。植物生理学杂志。2012;61:115-122。doi.org/https://doi.org/10.1016/j.plaphy.2012.09.009
- 34.
Naqvi RZ、Zaidi SS、Mukhtar MS、Amin I、Mishra B、Strickler S等。栽培棉花的转录组学分析陆地棉在棉花叶卷曲疾病的棉花叶型疾病介导的冬季介导时提供洞察力的见解。Plos一个。2019; 14(2):E0210011。doi.org/https://doi.org/10.1371/journal.pone.0210011
- 35
Alazem M,Lin NS:植物激素在宿主病毒相互作用调节中的作用。植物别墅。2015; 16(5):529-540。doi.org/https://doi.org/10.1111/mpp.12204
- 36
Kojima S, Konishi N, Beier MP, Ishiyama K, Maru I, Hayakawa T等。依赖于nadh的谷氨酸合成酶参与了拟南芥根系的铵态氮同化。植物信号处理研究进展[j] .中国生物医学工程学报,2014;doi.org/https://doi.org/10.4161/psb.29402
- 37
Mauriat M,LepléJC,Claverol S,BartholoméJ,Negroni L,Richet N,et al.定量蛋白质组学和磷酸化蛋白质组学方法解读杨树张力木材形成的信号途径。蛋白质组研究杂志,2015;14(8):3188–3203.doi.org/https://doi.org/10.1021/acs.jproteome.5b00140
- 38
马清平,李红,邹志伟,Arkorful E,吕庆荣,周qq,等。转录组学分析鉴定了一种新型白化茶种质“花白1号”的白化相关基因。Hortic杂志2018;5:54。doi.org/https://doi.org/10.1038/s41438-018-0053-y
- 39
Reinprecht Y,Yadegari Z,Perry GE,Siddiqua M,Wright LC,McClean PE,et al.《含苯丙酸途径酶和转录因子编码基因的基因组区域的电子比较》菜豆土地甘氨酸最大L. Merr。前植物SCI。2013; 4:317。doi.org/https://doi.org/10.3389/fpls.2013.00317
- 40。
Morris JS, Caldo KMP, Liang S, Facchini PJ。PR10/Bet v1-like蛋白是植物生化多样性的新贡献者。Chembiochem》2020。doi.org/https://doi.org/10.1002/cbic.202000354
- 41.
曹勇,韩勇,李丹,金强,林勇,等。中国梨iii类过氧化物酶基因家族的结构、进化和功能分析梨).植物科学与技术,2016;doi.org/https://doi.org/10.3389/fpls.2016.01874
- 42.
Proietti S, Bertini L, Van der Ent S, Leon-Reyes A, Pieterse CM, Tucci M,等。小麦和拟南芥WRKY转录因子的交叉活性实验机器人。2011;62(6):1975-1990。doi.org/https://doi.org/10.1093/jxb/erq396
- 43.
Hollbacher B、Schmitt AO、Hofer H、Ferreira F、Lackner P。过敏性和非过敏性花粉中蛋白酶和蛋白酶抑制剂的鉴定。国际分子科学杂志。2017;18(6):1199.doi.org/https://doi.org/10.3390/ijms18061199
- 44.
病理相关蛋白1的研究进展植物科学进展。2017;22(10):871-879。doi.org/https://doi.org/10.1016/j.tplants.2017.06.013
- 45.
Gamir J,Darwiche R,Van't Hof P,Choudhary V,Stumpe M,Schneiter R R等。致病相关蛋白1的固醇结合活性揭示了抗菌蛋白的作用模式。植物J。2017;89(3):502–509.doi.org/https://doi.org/10.1111/tpj.13398
- 46。
吴文,王鹤,杨泽,孔立。镰刀菌,黄矮化病毒(YDV)蚜虫传播和Hessian飞行,对小麦感染染色的病因相关(Pr)基因的表达比较。j infrogric。2014; 13:926-936。doi.org/https://doi.org/10.1016/S2095-3119(13)60570-5.
- 47。
张建军,王峰,梁峰,张永军,马立林,王海燕,等。叶锈菌诱导小麦thumatin样蛋白基因TaLr35PR5的功能分析BMC植物杂志.2018;18(1):76.doi.org/https://doi.org/10.1186/s12870-018-1297-2
- 48。
吕西南,法里斯JD,舍伍德R,弗里森TL,爱德华兹MC。一种二聚体PR-1型致病相关蛋白与ToxA相互作用并可能介导ToxA诱导的敏感小麦坏死。植物病理学。2014;15(7):650–663.doi.org/https://doi.org/10.1111/mpp.12122
- 49。
王学斌,陈学忠,李建荣,周xx,刘永涛,钟丽玲,等。广藿香叶中赖氨酸琥珀酰化的全局分析。Hortic杂志2019;6:133。doi.org/https://doi.org/10.1038/s41438-019-0216-5
- 50.
Swarbrick PJ, Schulze-Lefert P, Scholes JD。大麦叶片对白粉病的敏感性和抗性(种特异性和广谱性)的代谢后果。植物细胞包围.2006; 29(6):1061-1076。doi.org/https://doi.org/10.1111/j.1365-3040.2005.01472.x
- 51.
Restrepo S,Myers KL,Del Po,Martin GB,Hart Al,Buell Cr等。基因分析与之间的相容相互作用晚疫霉和茄属植物tuberosum表明碳酸酐酶有作用。植物与微生物相互作用。2005;18:913–922.doi.org/https://doi.org/10.1094/MPMI-18-0913
- 52.
黄建平,张建平,李建平,等。大豆侵染后基因表达谱的变化疫霉突变.Mol植物微生物相互作用。2004; 17:1051-1062。doi.org/https://doi.org/10.1094/MPMI.2004.17.10.1051
- 53.
Missihoun TD、Kotchoni SO、Bartels D。乙醛脱氢酶在小鼠体内吡啶核苷酸稳态中的作用拟南芥. Sci代表,2018年;8(1):2936.doi.org/https://doi.org/10.1038/s41598-018-21202-6
- 54.
du df,gao x,geng j,li qy,li l,lv q等。鉴定小麦籽粒发育的关键蛋白和网络(小麦L.)通过等位基因变异的比较转录和蛋白质组学分析tagw2-6a.. 前植物科学。2016;7:922.doi.org/https://doi.org/10.3389/fpls.2016.00922
- 55.
Lefebvre S、Lawson T、Zakhleniuk OV、Lloyd JC、Raines CA、Fryer M。转基因烟草中sedoheptulose-1,7-双磷酸酶活性的增加从发育早期就刺激光合作用和生长。植物生理学。2005;138(1):451–460.doi.org/https://doi.org/10.1104/pp.104.055046
- 56.
萌FJ,罗QX,王Qy,张XL,齐Zh,徐佛罗里达州。二倍体和四倍体黑色蝗虫叶绿体中盐胁迫的生理和蛋白质组评判(刺槐l .)。SCI批准。2016; 6:23098。doi.org/https://doi.org/10.1038/srep23098
- 57.
Long Rc,Li Mn,张TJ,康JM,Sun Y,Cong Ll等。比较蛋白质组学分析显示差分根蛋白紫花苜蓿和Medicago truncatula以应对盐胁迫。植物科学与技术,2016;doi.org/https://doi.org/10.3389/fpls.2016.00424
- 58.
小麦中干旱响应蛋白的分析小麦属植物硬质), 2D-PAGE和MALDI-TOF质谱。植物科学。2009;177(6):570 - 576。doi.org/https://doi.org/10.1016/j.plantsci.2009.08.007
- 59
关键词:匍匐茎,匍匐茎,抗旱性,蛋白质积累ipt细胞分裂素合成的基因。机器人学报。2011;62(15):5311-5333。doi.org/https://doi.org/10.1093/jxb/err166
- 60。
李军,杨晓伟,刘兴华,于海斌,杜春英,李md,等。小麦与白粉病亲和互作的蛋白质组学分析(Blumeria Graminis F.sp。Tritici.).植物生理学报,2017;doi.org/https://doi.org/10.1016/j.plaphy.2016.12.006
- 61。
王X,张W,郝Z,李X,张Y,王S。植物生理生化实验原理与技术。北京:高等教育出版社;2015
- 62。
曹晓春,吴丽丽,吴美,朱长青,金启英,张建辉。缺氧胁迫下两种不同基因型水稻根系中脱落酸介导的脯氨酸合成及其抗氧化能力。中国生物医学工程学报(英文版)doi.org/https://doi.org/10.1186/s12870-020-02414-3
- 63。
[10]李慧,孙强,赵松,张伟。植物生理生化实验原理与技术。北京:科学出版社。3版。北京:高等教育出版社;2000.
- 64。
于建杰,陈世新,赵琦,王婷,杨CP,迪亚茨C,等。大豆耐盐性的生理和蛋白质组学分析Puccinellia tenuiflora.J蛋白质组。2011; 10(9):3852-3870。doi.org/https://doi.org/10.1021/pr101102p
- 65.
张丽玲,辛志勇,于鑫,马超,梁文伟,朱mc,等。牛磺酸脱氧胆酸可缓解渗透胁迫诱导的小麦细胞死亡,并与内质网应激相关基因的表达有关。植物科学与技术,2017;doi.org/https://doi.org/10.3389/fpls.2017.00667
- 66.
Su XY,Fan XC,Shao RX,Guo J,Wang YC,Yang JP,et al.生理学和基于iTRAQ的蛋白质组学分析表明,褪黑素减轻干旱胁迫下玉米叶片的氧化损伤。植物生理生化。2019;142:263–274.doi.org/https://doi.org/10.1016/j.plaphy.2019.07.012
- 67.
一种利用蛋白质染料结合原理的快速和灵敏的蛋白质定量方法。肛门。1976;72 (s1-2): 248 - 254。doi.org/https://doi.org/10.1016/0003 - 2697 (76) 90527 - 3.
- 68.
梁S,谢M,唐J,王M,张D,侯S。蛋白质组学研究Ⅰ型干扰素对北京鸭A型肝炎病毒3型致病性的影响。兽医微生物学。2020;248:108813.doi.org/https://doi.org/10.1016/j.vetmic.2020.108813
- 69.
张震,刘慧,毕欣,于慧,徐勇,陈勇,等。微分的反应疫霉突变游动孢子对大豆种子分泌物的影响为大豆种子分泌物参与宿主抵抗提供了证据。土壤植物。2020;452(1 - 2):601 - 614。doi.org/https://doi.org/10.1007/s11104-020-04607-z
- 70
苏浩,罗勇,孙杰,刘旭,凌S,许B,等。谷氨酰胺转胺酶3通过DC-SIGN激活单核细胞来源的树突状细胞,促进特应性皮炎皮肤炎症。皮肤科杂志。2020;140(2):370–9 e8。doi.org网站/https://doi.org/10.1016/j.jid.2019.07.703
- 71
张立光,胡子贞,张×,秦Z,颜志刚,魏QQ,等。线粒体蛋白乙酰化在脂肪肝发病机制中起重要作用。BMC基因组学。2020;21(1):435.doi.org/https://doi.org/10.1186/s12864-020-06837-y
- 72.
袁L,王家,谢S,赵M,Nie L,Zheng Y等。比较蛋白质组学表明,雷诺稳态涉及一种新的WUCAI(芸苔属植物定l .)基因型。国际分子物理学报,2019;doi.org/https://doi.org/10.3390/ijms20153760
- 73.
白F,Tu T,Qin F,Ma Y,Liu N,Liu Y等。心房颤动瓣膜心脏病患者左侧阑尾组织中琥珀酰化蛋白表达分析的定量蛋白质组学。Clin Chim Acta。2019; 495:345-354。doi.org/https://doi.org/10.1016/j.cca.2019.05.002
- 74.
袁建杰,张琦,龚倩倩,王福凤,黄建春,杨国庆,等。年轻血浆对脑出血后老年性急性脑损伤的改善作用。Biosci Rep.2019年;39(5). doi.org网站/https://doi.org/10.1042/bsr20190537
- 75.
Livak KJ, Schmittgen TD。采用实时荧光定量PCR对相关基因表达数据进行分析−ΔΔCT方法。方法。2001;25(4):402 - 408。doi.org/https://doi.org/10.1006/meth.2001.1262
致谢
我们感谢李建安李教授,胜利鼎,河南农业大学冯辰,以及来自加利福尼亚大学的Jorge Dubcovsky教授,戴维斯为实验提供了材料和指导。我们还感谢小宇苏,海峰苏,海滨张,剑钊段和亚法根赵博士写作援助,并为此稿件的语言编辑。
基金
该工作得到了国家重点研发计划“中国科技创新”(2018YFD0300701)的支持。支持者在研究和收集,分析和解释方面没有发挥作用以及写作稿件。
作者信息
从属关系
贡献
QF, YXW, ZSM, HDX设计了实验。QF、XFD、HY、ZJM和SM进行了实验。QF和YXW对数据进行分析。QF, YXW, ZM, HDX起草并修改了稿件。所有作者都阅读并批准了原稿。
通讯作者
道德宣言
道德认可和参与同意
不适用。
出版许可
不适用。
利益争夺
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1。
去功能丰富的366个部门。
附加文件2:图S1。
Kegg途径中所有差异表达蛋白的分布。
附加文件3:表S2。
C1的KEGG途径富集。
附加文件4:表S3。
C2的KEGG途径富集。
附加文件5:表S4。
Kegg富集C3的富集。
附加文件6:表S5。
蛋白质相互作用网络。
附加文件7:表S6。
引物序列。
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
乔,F.,杨,X.,徐,F。等等。基于tmt的定量蛋白质组学分析揭示了小麦对冠腐病的防御机制镰刀菌素pseudograminearum.BMC植物杂志21,82 (2021). https://doi.org/10.1186/s12870-021-02853-6
收到了:
接受:
出版:
关键词
- 小麦(小麦l .)
- 皇冠腐烂
- 镰刀菌素pseudograminearum
- 台湾海陆运输公司
- 差异表达蛋白(DEPs)
- 防御机制