- 研究文章
- 开放存取
- 发布:
马铃薯X病毒介导的基因表达小菜蛾PxSDF2L1基因尼古利亚娜·宾夕法尼亚州赋予抵抗力疫霉parasiticavar。nicotianae
BMC植物生物学体积21,商品编号:78(2021.)
摘要
背景
的小菜蛾PxSDF2L1先前据报道基因以高基础转录率提高对病原体的抗虫抗性。PXSDF2L1显示了具有基质细胞衍生因子2(SDF2)的类似模拟,这是在整个动物和植物中高度保守的ER应激诱导的伴侣蛋白。SDF2的精确生物功能尚不清楚,但其表达是植物中的先天免疫所必需的。在这里,我们调查是否具有连续表达PxSDF2L1型在尼古利亚娜·宾夕法尼亚州可以类似地赋予植物病原体的抗性,特别是黑柄疫霉parasiticavar。nicotianae.
结果
的N底栖动物植物接种农杆菌转化的PVX-based二元载体PxSDF2L1型基因;类似的农业分泌实验,具有携带的PVX载体绿色荧光蛋白基因用于对照。在锅里试验中,农生N底栖动物植物持续表达PxSDF2L1型表现出由接种引起的茎疾病症状的显着减少P. Parasitica.,与对照组进行比较。
结论
我们确认PxSDF2L1型在抵抗黑色柄,潜在应用于在商业中对这种oomycete的工程抵抗力N塔巴库姆并提出其在其他作物科和植物病原菌中的评价。
背景
基质细胞衍生因子2(SDF2)是一种在植物和动物体内高度保守的内质网蛋白[1,2].SDF2型蛋白质采用由三个MIR基序组成的典型β-三轴折叠,其也在蛋白质O-甘露糖基转移酶中发现,我诺西醇1,4,5-三磷酸受体和r烟碱受体[3.]. 在SDF2型蛋白序列中,三对疏水残基分别位于三角帽和桶的底部和中间层,维持β-三叶结构[2].
SDF2的确切分子功能尚不清楚。SDF2是内质网质量控制(ER- qc)机制的一部分,与ER驻留伴侣蛋白Hsp40蛋白ERdj3、Hsp70腔体结合蛋白(BiP)等折叠酶一起,控制分泌蛋白和跨膜蛋白的折叠状态,以确保功能分子到达最终目的地[4,5].BIP是MultiProtein复合BIP / ERDJ3 / SDF2的中央播放器,而ERDJ3共伴侣将BIP伴侣提供展开的多肽,并调节其活性[6].SDF2与ERDJ3形成稳定的络合物,以通过直接抑制非天然蛋白的聚集来辅助BIP [7].在人类胰腺细胞中,SDF2-like 1 (SDF2L1)蛋白通过er相关蛋白降解(ERAD)机制延缓了未折叠蛋白的降解[8].
植物通过在跨膜免疫受体中动员许多蛋白质来响应病原体,并分泌的防守蛋白质快速过载ER折叠能力并诱导触发复杂保护途径的ER应激,称为展开的蛋白质反应(UPR)[9].其中一个upr目标是sdf2,其表达被显着诱导拟南芥,小鼠和人类[1,2]. UPR试图通过减少内质网中蛋白质的数量和增强内质网QC能力(即增加内质网伴侣和相关蛋白的合成)以及ERAD活性来恢复内质网的稳态[10,11,12,13]. 当内质网应激过度和延长时,UPR也能激活程序性细胞死亡(PCD)[14].一些ER-QC组分,包括SDF2,已被证明对宿主免疫有显著影响。例如,糖基化免疫受体EFR(模式识别受体,PRR)的生物发生和成熟需要ER-QC复合物BiP/ERdj3/SDF2 [15].在拟南芥T-DNA插入突变体sdf2-2(Salk_141321)和sdf2-5(WiscDsLox293–296invI23)不表达SDF2蛋白,保留并降解内质网中的EFR。在水稻中,SDF2在与XA21相互作用的ER-QC蛋白中被恢复,XA21是一种使PTI对水稻产生抑制作用的寄主PRRXanthomonas oryzae.光伏。oryzae(Xoo)[16,17]. 击倒SDF2型基因表达影响XA21介导的Xoo抗性,表明SDF2的参与对XA21的功能至关重要[17].
黑柄疫霉parasiticavar。nicotianae是全球经济上重要作物和森林树的根臭核桃病原体,没有控制方法[18].在植物中尼古利亚人家庭,包括模型植物尼古利亚娜·宾夕法尼亚州和N塔巴库姆,P. Parasitica.主要影响根和基部的面积,但植株的所有部位都会被感染[19]. 这种病最常见的症状与茎的黑色基部或柄部有关。使用的机制P. Parasitica.为了实现宿主兼容性和促进感染尚未完全理解。已发现效应蛋白PPRXLR2抑制N底栖动物以未知的植物易感基因为靶点进行免疫[20]. 而Breeze等人[21]的研究表明,ER是rxlr型效应物的重要靶点,rxlr型效应物诱导细胞器快速重组,同时抑制宿主防御和病原体初始增殖。
之前,我们发现基础mRNA水平增加PxSDF2L1型,在Diamondback蛾中编码SDF2型蛋白质同源的基因,Plutella Xylostella.(Lepidoptera:plutellidae),耐受抵抗Bacillus thuringiensis.(BT)[22]. 鉴于SDF2型蛋白在整个植物和动物王国中高度保守的性质[1,2]其对血浆膜中免疫受体的积累和功能的重要性,我们假设“构成表达”PxSDF2L1型可能对宿主免疫有启动作用,防止病原体在感染早期生长。
本研究的目的是测试本构型表达PxSDF2L1型在N底栖动物能抵抗P. Parasitica..我们使用了马铃薯病毒X(PVX)介绍了表达系统,以便在Planta验证我们的假设中进行快速。一种pvx构造携带PxSDF2L1型基因被导入N底栖动物由agroinfiltration植物;携带绿色荧光蛋白(GFP)插入物的PVX载体用于农接种对照。的转录PxSDF2L1型通过RT-PCR研究了PVX.PXSDF2L1-农生植物的根中的基因。通过疾病抵抗疫霉盆栽试验。我们发现了系统性的结构性表达PxSDF2L1型在N底栖动物授予保护P. Parasitica.,潜在应用于在商业中对此Oomycete来设计积极的抵抗力N塔巴库姆并提出其在其他作物科和植物病原菌中的评价。
结果
PxSDF2L1和昆虫同源物是sdf2型蛋白
PXSDF2L1与植物和哺乳动物SDF2型蛋白质的多序列比对揭示了昆虫中SDF2家族的典型特征,例如三重药中MIR基序的布置以及维持β-三叶件必然的临界疏水性残留物结构(图。1). 与植物的SDF2型蛋白质不同,昆虫的SDF2样序列在羧基末端含有一个ER检索信号,类似哺乳动物的SDF2L1[1]表明内质网是它们唯一的亚细胞定位。
植物、哺乳动物和昆虫SDF2型蛋白的多重序列比对。使用默认设置(EMBL-EBI;https://www.ebi.ac.uk/Tools/msa/). 为了更好的比对,用“signalp4.1服务器”预测信号肽(http://www.cbs.dtu.dk/services/signalp//) [23]从序列中删除。顺序Plutella Xylostella.PXSDF2L1已发布(GenBank登录号。HQ199329)。其他SDF2序列由他们的GenBank加入编码编码。其次是有机体的缩写名称:A.T.,拟南芥蒂利亚纳;厦门市。烟草attenuata则临睡时,智人; M.M.:小肌;T.C.,赤拟谷盗;B.m。Bombyx Mori.. 在比对中,包含每个MIR基序的氨基酸残基的延伸以不同的颜色突出显示:MIR1呈品红,MIR2呈青色,MIR3呈绿色。在β-三叶草桶内部的保守残余物排列在底部和中间层,分别用黑色和蓝色表示。三角形帽的关键剩余部分用红色正方形表示。内质网保留四肽“HDEL”或“HTEL”[24]显示为红色
pvx介导的系统表达PxSDF2L1型在N底栖动物植物
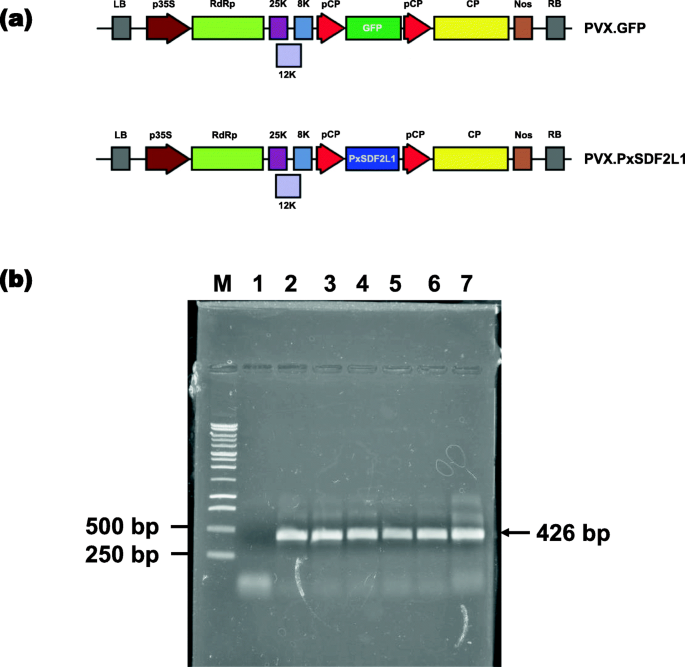
表达PxSDF2L1型在N底栖动物使用携带重组插入物的PVX衍生二元载体(PVX.PxSDF2L1)进行研究;类似的感染与携带病毒的对照PVX二元载体平行进行绿色荧光蛋白基因(PVX.GFP)(图。2a) 是的。首先,通过共聚焦激光扫描显微镜(CLSM)在PVX的系统未接种上部叶片中检测GFP来监测PVX病毒感染的进展。与允许的宿主物种一样N底栖动物[25,26]在所有测试的PVX.GFP植物中,检测到PVX.GFP的强大全身积累PVX.GFP(基于GFP衍生的绿色荧光信号)21天(D.P.ai.)在所有测试的PVX.GFP植物中(图S1).CLSM之后,进行了RT-PCR实验PxSDF2L1型PVX.PXSDF2L1-农生植物根组织中的全身表达。预期尺寸(〜426个碱基对)的cDNA片段从PVX.PXSDF2L1植物的根部一致地扩增,而不是在PVX.GFP植物中的那种(图。2b).扩增的cDNA被验证为PxSDF2L1型通过DNA序列分析(数据未显示)。40天后未检测到PVX载体DNA污染 来自PVX.PxSDF2L1植物的RNA样本的PCR循环(图2).
PVX介导的重组基因在大肠杆菌中的表达N底栖动物.一个携带重组基因的PVX.GFP(对照)和PVX.SDF2L1二元结构的示意图绿色荧光蛋白和PxSDF2L1型,分别。方案中:LB和RB,左右T-DNA边界序列;花椰菜花叶病毒p35S、35S启动子PVX依赖RNA的RNA聚合酶基因;25k、8k、12k PVX运动蛋白基因;pCP,亚基因组启动子序列(重复);CP、PVX外壳蛋白基因;不,诺帕林合成酶转录终止子。b逆转录聚合酶链反应PxSDF2L1型在来自植物根部的RNA样品中,用重组PVX载体,21d.p.ai农植物。泳道1:pvx.gfp植物(阴性控制);车道2-7:pvx.pxsdf2l1植物。M,1 KB DNA梯子
PVX.PxSDF2L1-1文件N底栖动物植物对磷有抗性。寄生虫感染
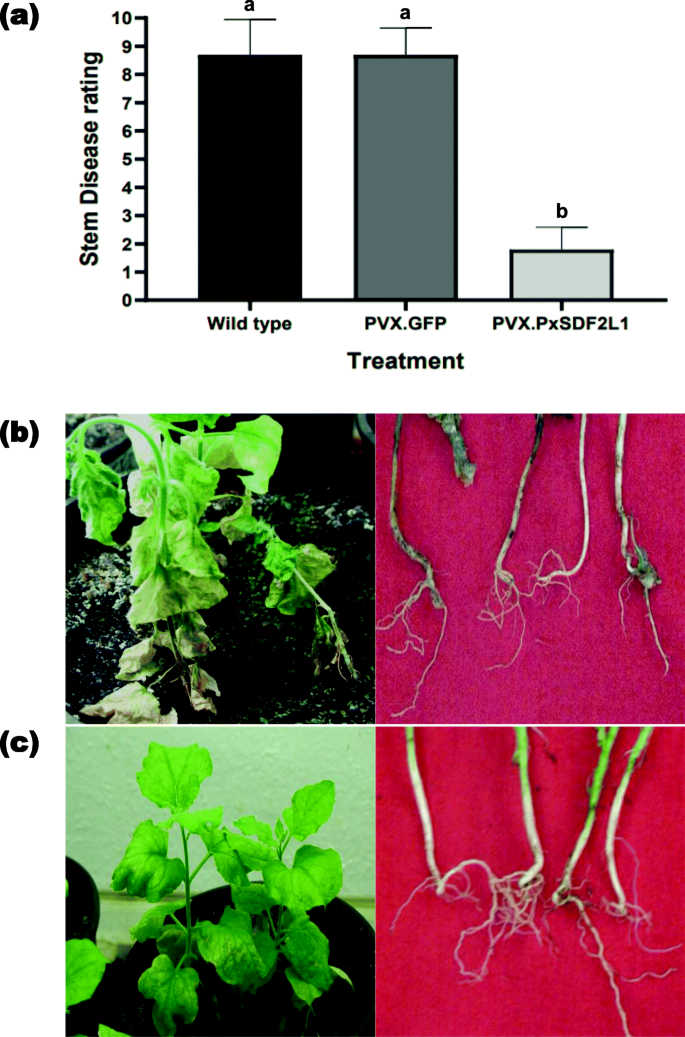
尼古利亚娜·宾夕法尼亚州是一群P. Parasitica..野生型,pvx.gfp-和pvx.pxsdf2l1-农业染色N底栖动物植物21d.p.ai。用分离物ppniit23接种P. Parasitica.种族0和疾病症状在接种后7天内评分(D.P.I.)。定量评估疫霉盆栽试验表明,与PVX、GFP和野生型相比,PxSDF2L1植株的茎病症状明显减轻(F2,27 = 154.1,P < 0.0001)(图。3.一种)。PVX.GFP和野生型植物中干病症状无显着差异(F.9,9 = 1.74,P = 0.42),表明与PVX载体的非特异性相互作用不影响对病毒的敏感性P. Parasitica..虽然控制(野生型和PVX.GFP)植物产生严重的干疾病症状并抑制与...相关联P. Parasitica.(图。3.b),在PVX.PXSDF2L1植物上仅检测到边际症状(图。3.C)。
PVX.PXSDF2L1-AgroInfect的Glasshouse评估N底栖动物植物接种P. Parasitica..一个定量评估N底栖动物用1-10线性标度表示茎部疾病等级的植物,其中1为无疾病,10为死亡植物[27]对于野生型,PVX.GFP-或PVX.PxSDF2L1-农业感染植物(21 d.p.ai.)接种P. Parasitica.在七个d.p.i.条上显示了三个独立实验的平均值±SE。在每个实验中,每个处理使用12株植物。采用单因素方差分析(ANOVA)和Tukey的后测方法对平均值进行比较P < 0.05. Treatments not sharing a common letter were significantly different (P< 0.0001)。植物和茎的表型(b)控制(野生型和PVX.GFP-)和(c)PVX.PXSDF2L1 - 七个D.Pi的挑战植物。和P. Parasitica.
讨论
疫霉parasitica被认为是最具破坏性的卵菌属植物病原之一,对多种寄主物种造成严重损害,其中一些是经济上重要的作物[18,19]. 在本研究中,我们组成性地表达了P木骨霉PxSDF2L1基因N底栖动物使用基于pvx的二进制向量,证明它赋予抗性P. Parasitica.在温室的盆栽试验中。在昆虫中,对sdf2型蛋白的研究较少;然而,正如引言中提到的,研究表明SDF2家族在动植物中具有功能保护。在我们的研究中,PxSDF2L1和其他昆虫在植物和哺乳动物中与SDF2蛋白同源物的多序列比对显示,昆虫序列遵循SDF2家族的非常结构模式。然而,内质网提取信号存在于哺乳动物和昆虫的SDF2序列中,而不存在于植物的SDF2序列中,表明后者的内质网保留依赖于特定的结合伙伴。
疫霉parasitica是一种半生物型病原体,这意味着当生物型病原体与活的宿主细胞建立密切接触以诱导其随后死亡时,它开始感染,并变成坏死型[18,19]. 这个A.拟南芥乙烯反应因子19基因(AtERF019公司)介导植物易感性P. Parasitica.通过取缔PTI [28].P. Parasitica.在生物营养关系中,已经发展出通过ER局部效应物抑制PTI的策略[21].转录组分析N塔巴库姆的分子反应P. Parasitica.在互动期间抑制了对Oomycetes和其他必需植物防御机制的防御[29]. 这个constitutive expression ofPxSDF2L1型在N底栖动物能在植物生长的早期提供防御优势P. Parasitica.的生物营养相互作用,允许一个未知的ER-QC客户PRR(s)的快速积累和功能,介导针对这种根感染物种的免疫反应。之前,我们发现基础表达增加PxSDF2L1型在BT抗性群体中P. Xylostella.是昆虫对这种病原体的预激活分子防御机制的一部分[22]. 需要更多的实验来确定PxSDF2L1在内质网中参与下游病原体抗性机制的相互作用伙伴。
在我们的研究中,有趣的问题是PXSDF2L1中的ER检索信号是否有贡献P. Parasitica.PVX.PxSDF2L1-1农杆菌感染的抗性研究N底栖动物植物。虽然SDF2已被识别为ER居民蛋白质拟南芥[2]它是如何在植物细胞器中被保留的,以及在什么条件下被保留的,我们仍然知之甚少。已识别的SDF2结合伙伴ERdj3B也缺乏内质网提取信号[15,30]在哺乳动物中,它可以在内质网应激条件下分泌,其中未折叠的构象有助于细胞外空间的蛋白质稳定[31]. ERdj3的结合增加了SDF2的稳定性,否则SDF2是一种短命蛋白质[7]. SDF2-ERdj3B复合物在与UPR的主调节因子BiP相互作用过程中阻止未折叠蛋白质聚集,后者可能参与将两种蛋白质保留到植物内质网中。BiP也是一些人的目标疫霉er-incalized eventiveors,如psavh262P. sojae.[32]. 这个在teraction BiP-effector has been suggested to decouple the SDF2/ERdj3B/BiP complex [32,33]这可能导致SDF2和ERdj3b的释放和分泌,对PRRs在质膜上的稳定积累和下游防御反应产生负面影响。PxSDF2L1分子伴侣具有内质网恢复信号,可以在BiP被效应器占据时拯救系统。这个解释需要进一步研究。
综上所述,我们给出了PxSDF2L1型基因N底栖动物授予保护P. Parasitica.并提出了其在工程上的应用前景N塔巴库姆. 未来的工作PxSDF2L1型包括获得稳定表达该基因的植物,以便更精确地确定该基因在抗黑胫病中的作用。
结论
的P. Xylostella.PxSDF2L1与内质网应激诱导的动植物SDF2型蛋白具有相似性,该基因在高基础转录率下可增强昆虫对病原菌的抗性。在本研究中,我们制作了一个系统的本构表达PxSDF2L1型在N底栖动物借助于基于PVX的载体系统的植物。更多,N底栖动物表达PxSDF2L1型基因显示出茎疾病症状的显着降低了接种引起的P. Parasitica.在盆栽试验中,与对照相比。我们的结果表明PxSDF2L1型在商业中对抗这种Oomycete的主动抵抗力N塔巴库姆物种。未来的研究应该评估PxSDF2L1型其他作物家族和植物病原体的基因。
方法
植物材料
植物的实验研究严格按照CIGB植物部门批准的指导方针进行。的N底栖动物种子来自古巴哈瓦那烟草研究所。尼古利亚娜·宾夕法尼亚州植物在25℃下在遏制玻璃室(CIGB)中生长,直至农药过滤实验。
PVX.PxSDF2L1施工
的大肠杆菌XL-1蓝色菌株[34]被用于所有标准的分子生物学技术。的源代码P木骨霉PxSDF2L1基因(GenBank登录号HQ199329)是一个携带全长基因的质粒PxSDF2L1型通过快速扩增cDNA末端获得的cDNA序列(1111bp)[22]. 从大肠杆菌中扩增出676个碱基对(bp)的PCR片段PxSDF2L1型使用突变寡核苷酸(正向)5′-ATCGATGTTACAGGAATACGATG-3′和(反向)5′-GTCGACTTAAACTCAGTAGAACTGC-3′的cDNA模板,其中下划线序列分别对应于ClaI和SalI核酸内切酶的附加限制位点。将包含该基因的开放阅读框的扩增产物经ClaI/SalI消化、纯化并连接到基于PVX的二元载体pGR106(GenBank登录号AY297843)的ClaI/SalI限制性位点[35,36]从爵士大卫·鲍尔科姆(英国剑桥大学植物部)获得。通过菌落PCR鉴定得到的重组pVX.pxSDF2L1克隆并通过DNA序列分析(宏强)证实。
携带GFP插入子的PVX.GFP质粒克隆到pGR106的AscI和NotI限制位点[26]是由Eleanor M Gilroy博士(James Hutton研究所,Dundee, UK)获得的,并被用作病毒感染进展和潜在的病毒诱导变化的指标N底栖动物植物。
Agroinfiltration的N底栖动物使用PVX衍生的二进制向量
根癌农杆菌菌株GV3101[37]通过直接转换,用PVX.pxsdf2L1或PJICSA_REP)进行辅助质粒psoup(pjicsa_rep)[38]在添加卡那霉素的luriabertani(LB)培养基中生长,培养温度为50℃ 微克/毫升。农杆菌感染N底栖动物对于PVX.PxSDF2L1或PVX.GFP如Voinnet等人所述进行[39].简而言之,在16℃下以2250×g离心每种构建体(20ml)10分钟以在16℃,将细胞粒料重悬于5ml新鲜制剂和过滤的Agromix溶液中[10mm 2-(N-morpholino)乙磺酸(MES),pH 5.6;10 mm mgcl2;0.150 mm acetosyringone]。农杆菌悬浮液在黑暗中在黑暗中静态静置2小时。然后通过在Agromix中稀释农杆菌悬浮液制备的接种物(OD600〜0.2)在六叶阶段的下叶表面上轻轻渗入到六叶阶段的下叶面上N底栖动物使用1-mL注射器的植物(没有皮下注射的)。在受控生长条件下置于16:8 H(光:暗)循环,50-60%湿度和16-21℃温度下置于受控生长条件下。
GFP的检测
分析了PVX.GFP感染植物的全身未征收的叶片进行绿色荧光21d.p.ai。使用Zeiss LSM 700共聚焦激光扫描显微镜。GFP的激励和检测窗口分别设置为488nm和500-600nm。使用PVX.pxsdf2L1感染植物的全身未征收的叶子作为阴性对照。
总RNA提取及RT-PCR实验
用PVX.PxSDF2L1或PVX.GFP(每株6株)处理植物,收集21株d.p.ai.根,然后用蒸馏水冲洗,去除其表面的土壤。收集的根被切成小块,立即在液氮中冷冻(− 196 °C),然后在预冷砂浆和研杵中研磨。用SV总RNA分离系统(Promega)分离总RNA;纯化的RNA样品用试剂盒中不含RNA酶的DNaseⅠ酶消化30分钟 37分钟 °C去除污染PVX载体DNA,然后在0.3%乙醇存在下进行乙醇沉淀 M NaOAc pH值 5.2. 用特异性引物(5′-gaaacctcctggattccat-3′)对RNA样品进行PCR;用5′-tctccaaaatgaatgaatcttcc-3′)检测菜花花叶病毒(p35S)35S启动子的一个312bp片段,并用PVX-based二元载体(PVX.PxSDF2L1或PVX.GFP)进行dna酶切。用凝胶红(Biotium)染色的1%琼脂糖凝胶电泳验证RNA的完整性,并用nanodrop2000分光光度计(Thermo-Scientific)测量RNA浓度。
引物(正向)5′-aaggcagaattcgtagtg-3′和(反向)5′-tgccaatatgctgcagtgt-3′,共同扩增426bpPxSDF2L1型cDNA片段在PVX无dna模板(1 μg)上进行RT-PCR。用AccessQuick RT-PCR系统(Promega)检测pxsdf2l1感染植株。PVX无dna RNA样本(1 μg)。绿色荧光蛋白-infected plants were used as the negative control.
疫霉锅试验
的分离物PpnIIT23P. Parasitica.我们研究中使用的0号小种由古巴哈瓦那烟草研究所提供。对于接种物的制备,将灭菌的V8果汁浸渍牙签放置在马铃薯葡萄糖琼脂平板上,并用5-mm的活性生长的塞子接种P. Parasitica.文化。将平板在黑暗(27℃)中孵育14天,以确保满落于oomycete的殖民化。
锅试验进行了21 D.P.ai.在25℃下的容纳玻璃室(CIGB)中。PVX-农药冻结植物高15厘米,茎直径为5毫米,塑料盆(直径20厘米)生长,填充有巴氏杀菌土壤。每种治疗(pvx.pxsdf2l1或pvx.gfp)由12植物(每壶两株植物)组成,并被复制三次。当需要保持恒定的湿土条件时,植物被浇水。
植物接种无菌推送疫霉- 在植物底部附近的牙签进入根系系统[40]. 未受感染的牙签作为对照。根据Csinos,选择1-10的线性标度测量干病变[27],其中1是指无疾病或抗病,而10包括疾病易感性和植物的总死亡率。评级在七个d.p.i上呈茎。
数据分析
数据分析使用GraphPad Prism软件8.0.2版本的Windows。方差分析(ANOVA)结合Tukey的后测P < 0.05 as the significance level were performed to determine differences among treatments during the疫霉盆栽试验。每个处理重复3次,结果相似。采用均数标准误差对重复进行比较。
可用性数据和材料
本研究中使用和/或分析的数据集可在合理要求下从通讯作者处获得。
缩写
- SDF2:
-
基质细胞来源因子2
- SDF2L1:
-
基质细胞衍生因子2样1
- 呃:
-
内质网
- PVX公司:
-
马铃薯病毒X.
- 毕普:
-
Hsp70腔结合蛋白
- ER-QC:
-
内质网质量控制
- ERAD公司:
-
内质网相关蛋白降解
- 普遍定期审议:
-
未折叠蛋白反应
- PCD:
-
程序性细胞死亡
- PRR编号:
-
模式识别受体
- PTI公司:
-
模式触发的免疫力
- Xoo公司:
-
Xanthomonas oryzae.光伏。oryzae
- 英国电信:
-
Bacillus thuringiensis.
- d.p.ai。
-
农业感染后天数
- d.p.i:
-
天post-inoculation
- 种族:
-
cDNA末端的快速扩增
- 磅:
-
仅有Bertani
- NaOAc公司:
-
醋酸钠
- 方差分析:
-
方差分析
参考文献
- 1.
(2)高桥(Takahashi)等。SDF2L1是一种内质网应激诱导基因,编码Pmt/rt蛋白家族的新成员。生物化学与生物物理。2001;280:407-14。
- 2.
Schott A,Ravaud S,Keller S,Radzimanowski J,Viotti C,Hillmer S等人。拟南芥基质衍生因子2(SDF2)是内质网未折叠蛋白反应的重要靶点。生物化学杂志。2010;285:18113–21.
- 3.
ponting cp。新型ryanodine和IP3受体和蛋白质O-甘露糖基转移酶重复。趋势Biochem SCI。2000; 25:48-50。
- 4.
Meunier L、Usherwood YK、Chung KT、Hendershot LM。分子伴侣和折叠酶的一个子集在内质网中形成多蛋白复合物来结合新生的蛋白质。分子生物学细胞。2002;13:4456–69.
- 5.
李杰,赵辉C,巴图M,内克拉索夫V,Roux M,栗鼠D,等。植物天然免疫受体EFR生物发生所需的特异性内质网质控成分。美国国家科学院学报。2009;106:15973–8.
- 6.
郭峰,Snapp EL。ERdj3调节活细胞中BiP的占用。细胞科学,2013;126:1429-39。
- 7.
Fujimori T,Suno R,Iemura Si,Natsume T,Wada I,Hosokawa N.内质网蛋白SDF2和SDF2L1作为BIP伴侣循环的组分,以防止蛋白质聚集。基因细胞。2017; 22:684-98。
- 8.
Tiwari A,Schuiki I,Zhangi,Zhang L,Allister Em,Wheeler MB,Volchuk A.SDF2L1与ER相关的降解机械相互作用,并延迟胰腺β细胞中突变体胰岛素的降解。J Cell SCI。2013; 126:1962-8。
- 9
刘JX,豪威尔谢。内质网蛋白质质量控制及其与植物环境应激反应的关系。植物细胞。2010; 22:2930-42。
- 10。
刘y,李杰。内质网介导的蛋白质质量控制拟南芥.前植物SCI。2014; 5:162。
- 11
刘JX,豪威尔谢。在植物的内质网中管理蛋白质折叠要求。新植物。2016; 211:418-28。
- 12
Angelos E、Ruberti C、Kim SJ、Brandizzi F。维持工厂:未折叠蛋白反应在植物细胞内稳态中的作用。植物J。2017;90:671–82.
- 13
Nawkar Gm,Lee Es,Shelake Rm,Park JH,Ryu Sw,Kang Ch,等。植物中展开蛋白反应的换能器的激活。前植物SCI。2018; 9:214。
- 14
Kim R,Emi M,Tanabe K,Murakami S.展开蛋白质反应在细胞死亡中的作用。细胞凋亡。2006; 11:5-13。
- 15
acta photonica sinica, 2011, 38(5): 639 - 644。植物免疫中ER蛋白复合物对模式识别受体EFR的控制。EMBO j . 2009; 28:3428-38。
- 16
宋文英,王国良,陈丽丽,金海生,皮丽丽,等。水稻抗病基因Xa21编码的受体激酶样蛋白。科学。1995;270:1804-6。
- 17
Park CJ, Sharma R, Lefebvre B, Canlas PE, Ronald PC。内质网质量控制成分SDF2对xa21介导的水稻免疫至关重要。植物科学。2013;210:53-60。
- 18
疾病管理。正确:Coop NC,编辑器。烤烟的信息。罗利:北卡州立大学,公牛分机;2005.p . 150 - 71。
- 19
卢卡斯·格勃。烟草疾病。罗利:生物咨询公司;1975
- 20。
Dalio RJD、Máximo HJ、Oliveira TS、Días RO、Breton MC、Felizatti H等。疫霉parasitica效应PpRxLR2抑制尼古利亚娜·宾夕法尼亚州免疫力。MPMI。2018; 31:481 - 93。
- 21。
Breeze E、Vale V、McLellan H、Godiard L、Grant M、Frigerio L。植物内质网对病原效应物既有感受性又有反应性。生物十四。2020https://doi.org/10.1101/2020.06.09.142141.
- 22。
Ayra-Pardo C,Raymond B,Gulzar A,Rodríguez-Cabrera L,Moran-Bertot I,Crickmore N等。涉及抵抗力的新型遗传因素Bacillus thuringiensis.在Plutella Xylostella..昆虫摩尔生物。2015; 24:589-600。
- 23
Nielsen H.用信号预测分泌蛋白。在:Kihara D,编辑。蛋白质功能预测。柏林:斯普林克;2017. p。59-73。
- 24
Robbi M,Beaufay H.几种肝脏羧基酶的CoOH末端靶向内质网的内腔中的这些酶。J Biol Chem。1991年; 266:20498-503。
- 25
Lacomme C,Chapman S.使用马铃薯病毒X(PVX)的基因表达和病毒诱导的基因沉默的载体(Vigs)。Curr protoc microbiol。2008;第16章:单位16i.1。https://doi.org/10.1002/9780471729259.mc16i01s8.
- 26
Faivre-Rampant O,Gilroy Em,Hrubikova K,Hein I,Millam S,Loake GJ等。马铃薯病毒X诱导基因在马铃薯叶片和块茎中沉默。植物理性。2004; 134:1308-16。
- 27
Csinos AS公司。茎和根对烟草黑胫病的抗性。植物分布。1999;83:777–80.
- 28
卢W,邓德,贾俊,陈X,李茹,温Q等。的拟南芥蒂利亚纳基因AtERF019公司负调控植物对疫霉parasitica通过抑制pamp触发的免疫Mol Plant Pathol. 2020;21(9): 1179-93。
- 29
杨杰,童Z,方D,陈X,张K,肖B。烟草的转录组学研究烟草疫霉感染。SCI REP。2017; 7:401。
- 30.
Ohta M,Takaiwa F。植物内质网驻留J蛋白的新特征。电厂信号行为。2014;9:e28194。
- 31。
花津县、和田县、细川县。SDF2样蛋白1(SDF2L1)调节ERdj3蛋白的内质网定位和伴侣活性。生物化学杂志。2019;294:19335–48.
- 32。
景M,郭B,李H,杨B,王H,孔G,等.APhytophthora sojae.效应通过稳定植物结合免疫球蛋白蛋白抑制内质网应激介导的免疫。Nat Commun。2016;7:11685。
- 33。
景M,王Y。植物病原菌利用效应器劫持宿主内质网作为其感染策略的一部分。工程学。2020https://doi.org/10.1016/j.eng.2020.03.003.
- 34。
布洛克沃,费尔南德斯JM,肖特JM。XL1-blue:转化recA的高效质粒大肠杆菌具有β-半乳糖苷酶选择的菌株。生物技术。1987;5:376–8.
- 35
吕R,Malcuit I,Moffett P,Ruiz MT,Peart J,Wu AJ,等.高通量病毒诱导的基因沉默与热休克蛋白90在植物抗病性中的作用。EMBO J。2003;22(21):5690–9.
- 36
Lu R,Martin-Hernandez Am,Peart Jr,Malcuit I,BaulCombe DC。病毒诱导的植物中的基因沉默。方法。2003; 30:296-303。
- 37
Hellens RP,Edwards Ae,Leyland Nr,豆子,Mullineaux PM。pgreen:一种多功能和灵活的二进制Ti矢量农杆菌-介导植物转化。植物分子生物学。2000;42:819–32.
- 38
关键词:基因转染,转化,细胞动力学根癌农杆菌.Mol Gen Genet。1978; 163(2):181-7。
- 39
Voinnet o,Rivas S,Mestre P,BaulCombe DC。基于番茄级特技毒性病毒P19蛋白抑制基因抑制的植物中增强的基因表达系统。工厂J. 2003; 33:949-56。
- 40。
Sullivan MJ、Melton TA、Shew HD。比赛0和1的适合度疫霉parasiticavar。nicotianae.植物DIS。2005; 89:1220-8。
致谢
作者感谢M Ponce女士的技术援助。作者感谢编辑和两位匿名评论员提出的有用建议。
基金
这项工作得到了古巴生物技术群体Biocubafarma(授予3031-243),英国皇家学会的部分支持。(到D.J.W.)和南洋师范大学(南部,Y.K.和C.a.-P)。资助者在研究设计中没有作用;在收集,分析或解释数据;在写作稿件,或在决定发布结果。
作者信息
隶属关系
贡献
概念化,DJW和CA-P;方法,OBH和CA-P;调查,IMB和LRC;写作原创草案准备,LRC和CA-P;写作审查和编辑,djw;监督,OBH和CA-P;项目管理,CA-P;资金收购,SH,YK和DJW。所有作者都已读取并同意发布的稿件版本。
通讯作者
道德宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图S1
. PVX介导的重组GFP在大肠杆菌中的表达N底栖动物. 用CLSM,21d.p.ai.(+30)检测PVX.GFP-agro侵染植物未接种叶片表皮细胞的绿色荧光。用PVX.PxSDF2L1激发植物的系统未接种叶片作为阴性对照。图S2. PCR检测PVX-DNA载体。用特异性引物(5’-gaaacctcctggattccat-3’)循环40次后的PCR产物;5'-tctccaaaatgaatcttcc-3')在从PVX.PxSDF2L1-agro感染植物(lane 1-6)的根中分离的DNase I消化的总RNA(1μg)上检测基于PVX的二元载体(PVX.PxSDF2L1或PVX.GFP)中花椰菜花叶病毒(p35S)的35S启动子中的312bp片段;(+)根癌农杆菌GV3101细胞携带PVX。PxSDF2L1向量。M, 1kb DNA阶梯。
权利和权限
开放存取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Moran-Bertot, I., Rodríguez-Cabrera, L., borra - hidalgo, O.。等等。马铃薯X病毒介导的基因表达小菜蛾PxSDF2L1基因尼古利亚娜·宾夕法尼亚州赋予抵抗力疫霉parasiticavar。nicotianae.BMC植物生物学21,78(2021)。https://doi.org/10.1186/s12870-021-02854-5
已收到:
接受:
发表:
关键词
- 作物保护
- 抗病性
- oomycetes.
- 农药过滤
- 内质网伴侣