抽象的
背景
肉桂醇脱氢酶(Cinnamyl alcohol dehydrogenase, CAD)是木质素单体合成过程中重要的最后一步酶。我们之前的工作发现干旱诱导了cmcad.基因并促进甜瓜茎中木质素生物合成。
结果
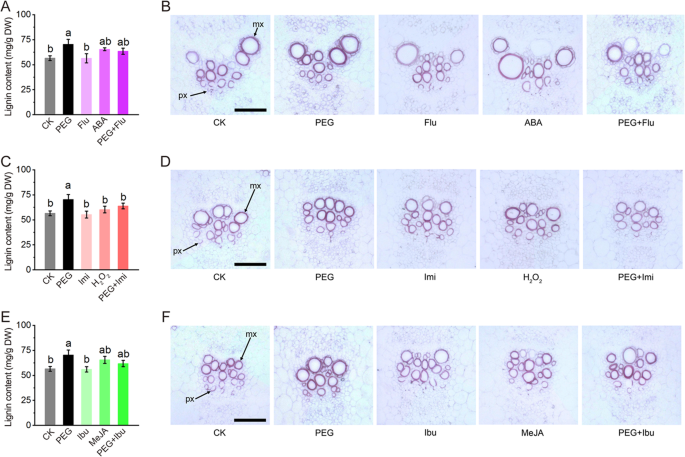
本文研究了脱落酸(ABA)、过氧化氢(H2O.2)和茉莉酸(JA)cmcads.在干旱压力下。结果发现干旱诱发的ABA,H2O.2和Meja有效地阻止了用氟酮(流感,ABA抑制剂),咪唑(IMI,H2O.2清道夫)和布洛芬(IBU,JA抑制剂)。阿巴和H.2O.2参与积极的规定CMCAD1.那2那3., 和5.而JA则参与了正向调控CMCAD2.那3., 和5..根据木质素生物合成基因的表达谱,ABA,H2O.2和Meja都表现出积极的规定CmPAL2-like那CmPOD1-like那cmpod2样和CmLAC4-like.此外,也与ABA观察过肯定规定cmpal1样那CMC4H.和CMCOMT.与H2O.2来cmpal1样那CMC4H.那CMCCR.和CMLAC17样,和ja到CMCCR.那CMCOMT.那CmLAC11-like和CMLAC17样.如预期的那样,信号分子正调控干旱胁迫下CAD活性和木质素生物合成。启动子:GUS检测不仅进一步证实了信号分子的调控作用CmCAD1 ~ 3,也揭示了其重要作用CMCAD3.由于最强的染色而在木质素合成中CmCAD3发起人::格斯.
结论
cmcads.但CMCAD4.正调控ABA, H2O.2和JA在干旱胁迫下参与木质素的合成。
背景
木质素是植物中的第二种富含物质[1除了支持的基础功能外,还在SAP运输和水障中起重要作用[2].在木质素单体合成途径中,肉桂醇脱氢酶(CAD)是一种重要的酶,其在最后一步中起到负责肉桂醛和褐胶醇之间的转化的重要酶。木质素合成不仅符合常规增长,而且可以通过生物和非生物胁迫来调节。随着一个经常发生的非生物应激,干旱对植物生长产生负面影响,但促进了褐化过程。有些研究表明,诱导胶合酶(肉桂酰CoA还原酶(CCR),CAD,种类的过氧化物酶),在干旱胁迫下在芽中促进了木质素合成[3.那4.那5.那6.].而在根系中,遭受干旱胁迫时,木质素的生物合成开始受到抑制,后期受到诱导[7.那8.那9.].对紫地化的阳性促进干旱可能会在水运输方面进行植物耐旱性[10水分损失[11].
干旱胁迫诱导的信号分子如脱落酸(ABA)、过氧化氢(H2O.2)、茉莉酸(JA)、水杨酸(SA)等。既往研究报道JA可诱导CAD.基因表达 [12],并与活性氧(ROS)一起促进木质素沉积[13那14].H2O.2光不仅可以控制笋的木质化[15],但也有根无光[16].虽然ABA的监管仍然存在争议,Mohr和Cahill(2007)[17[报道,ABA抑制木质素综合,征询拟南芥叶片,但研究还发现,ABA增加了木质素生物合成基因的表达(苯丙氨酸氨(朋友),肉桂酸4-羟化酶(C4H),4-香豆素-CoA连接酶(4CL5.),CAD.那CCR,阿魏酸5-羟化酶(F5H1))和番茄酶(PAL,过氧化物酶(POD))的活性,从而促进了木质素的积累[18那19那20.].此外,在ABA,JA,SA和成熟组织中的胃果和衰老组织之间也观察到阳性相关性[21那22].
作为木质素单体合成途径中的重要酶,CAD酶的活性和表达水平CAD.基因被干旱和信号分子促进,导致木质素沉积[5.那16那23].CAD.基因通常作为一个基因家族出现在不同的物种中,每个成员的功能可能不同或不同[24那25].我们的团队发现了五个cmcad.甜瓜基因组数据库中的基因(http://melonomics.cragenomica.es/)[26发现干旱胁迫可以显著上调甜瓜幼苗的产量[27].但是,仍然不清楚哪种信号分子负责调节cmcads.在干旱压力下。
本研究探讨了ABA、H2O.2和ja到五cmcad.基因以及一些木质素生物合成基因,通过使用它们相应的抑制剂或清除剂来沉积木质素沉积。然后进行启动子:: GUS测定以研究信号分子的规定CMCAD1.那2, 和3.,根据系统发育分析选择哪些成员[26]和干旱胁迫下的表达谱[27]以及甜瓜幼苗中的表达模式(未发布数据)。结果显示了ABA,H的重要作用2O.2和JA在调节CmCAD1 ~ 3那5.和木质素生物合成基因,从而调控干旱胁迫下木质素的生物合成。
结果
干旱诱发ABA,H2O.2MeJA可被相应的抑制剂或清除剂抑制
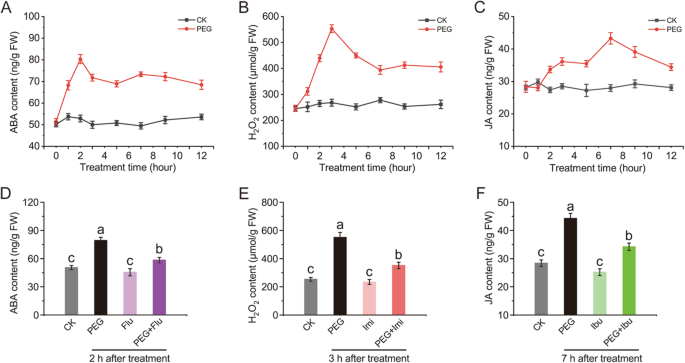
阿巴和H.2O.2经常被报告为在干旱胁迫下调节下游基因表达和代谢的重要信号分子[6.那28].然而,JA在干旱胁迫下的作用仍有争议[29].探讨ABA、H2O.2干旱胁迫下甜瓜茎中ABA、H2O.2确定并发现并发现信号分子全部通过PEG处理诱导(图。1A-C)。阿巴和H.2O.2在2小时(1.6倍)和3小时(2.26倍)时,达到干旱快速,达到峰值,而在PEG处理后JA达到7小时(1.54倍)的峰值。虽然在达到峰值后观察到降低,但信号分子的含量仍然比对照的含量保持更高。
氟立酮(Flu)、咪唑(Imi)和布洛芬(Ibu)被用作抑制剂或清除剂,用于研究ABA、H2O.2和植物中的Ja [30.那31].在这里,我们评估了流感,IMI和IBU到ABA的抑制效率2O.2分别在甜瓜茎下分别在干旱胁迫下。如图所示。1D.-F那T.he signal molecules slightly decreased when treated with Flu, Imi or Ibu alone, showing 9.5, 7.5 and 11% decreases compared to those in control, respectively, but were significantly restricted from increasing in PEG-treated melon stems pretreated with Flu, Imi and Ibu, showing 26.4, 36.1 and 22.7% decreases compared to those in PEG-treated samples, respectively. Thus, they can also be used as effective inhibitor or scavenger in melon seedlings for further study.
cmcads.ABA、H2O.2和Meja在干旱下
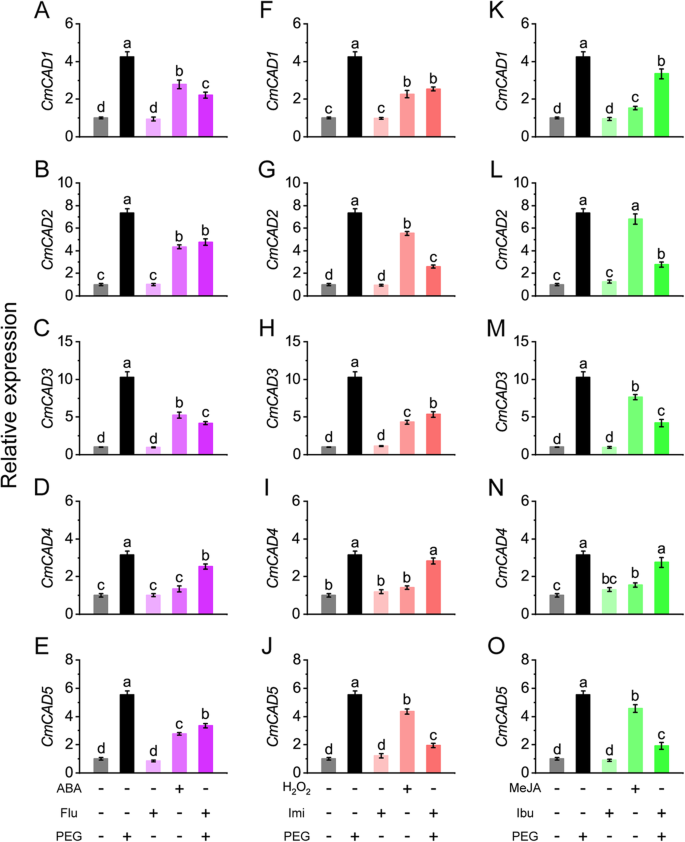
干旱诱导的关系cmcads.[27然后对信号分子进行研究。如图所示。2,表达概况CmCAD1 ~ 5在PEG处理下,分别增加了4.2、7.3、10.3、3.2、5.6倍。ABA处理显著上调CMCAD1.(2.8折),2(4.4折),3.(5.2折),和5.(2.8倍),而Flu预处理可显著抑制peg处理甜瓜幼苗中上述因子的上调(分别为2.2、4.8、4.2、3.4倍)。H2O.2治疗也显着上调了表达式CMCAD1.(2.3折),2(5.5倍),3.(4.3折),5.(4.4折),IMI预处理严重抑制了它们在PEG处理的甜瓜幼苗(2.5,2.6,5,2倍)中的上述规定。Meja治疗显着上调了表达式CMCAD2.(6.8折),3.(7.6倍),和5.(4.6倍),IBU预处理在PEG处理的甜瓜幼苗(2.8,4.2,1.9倍)中强烈抑制了它们的上述规定。值得注意的是,Meja表现出更强大的法规CMCAD2.和3.比aba和h2O.2做过。CMCAD4.用信号分子略微调节。单独用每种抑制剂或清除剂治疗没有或没什么影响cmcads.表达。
木质素生物合成基因由ABA,H多样化2O.2和Meja在干旱下
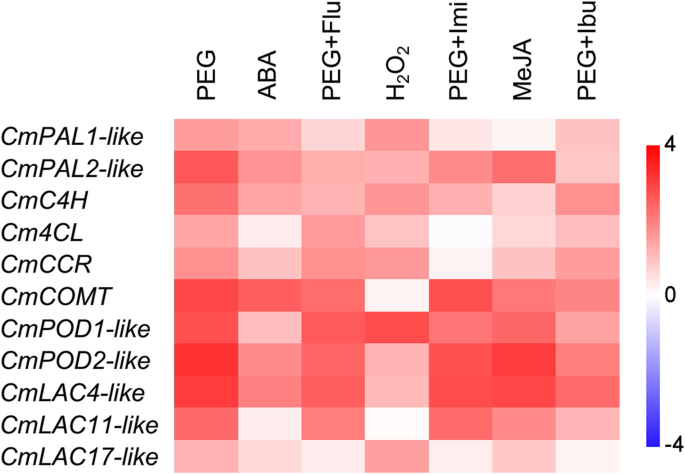
随后,我们还研究了木质素单体合成途径中一些木质素生物合成基因的表达谱,如图所示。3..CMC4H.那cm4cl.那CMCCR.和咖啡酸O.- 甲基转移酶(CMCOMT.),根据Jing et al. (2018) [32].cmpal1.-像那cmpal2.-像那CmPOD1-像那CmPOD2-像漆酶(CmLAC4-像那CMLAC11.-像和CMLAC17.-像)基因对拟南芥中木质素合成中鉴定的相应基因进行高度同源[33那34那35].
木质素生物合成基因在干旱胁迫下的表达中均高度调节。在基因中,cmpal1样那CmPAL2-like那CMC4H.那CMCOMT.那CmPOD1-like那cmpod2样和CmLAC4-like在PEG+Flu处理下,ABA信号被抑制,表明ABA信号参与了这些基因的调控。同样的,cmpal1样那CmPAL2-like那CMC4H.那CMCCR.那CmPOD1-like那cmpod2样那CmLAC4-like和CMLAC17样由h上调2O.2治疗和限制在PEG + IMI处理下的诱导,表明H的正规调节2O.2这些基因。木质素生物合成基因除了cmpal1样那CMC4H.和cm4cl.由Meja治疗诱导并被PEG + IBU治疗抑制,暗示JA信号传导涉及这些基因的调节。cm4cl.在这里学习仅被H略微调节2O.2.
CAD活动由ABA,H积极调控2O.2和Meja在干旱下
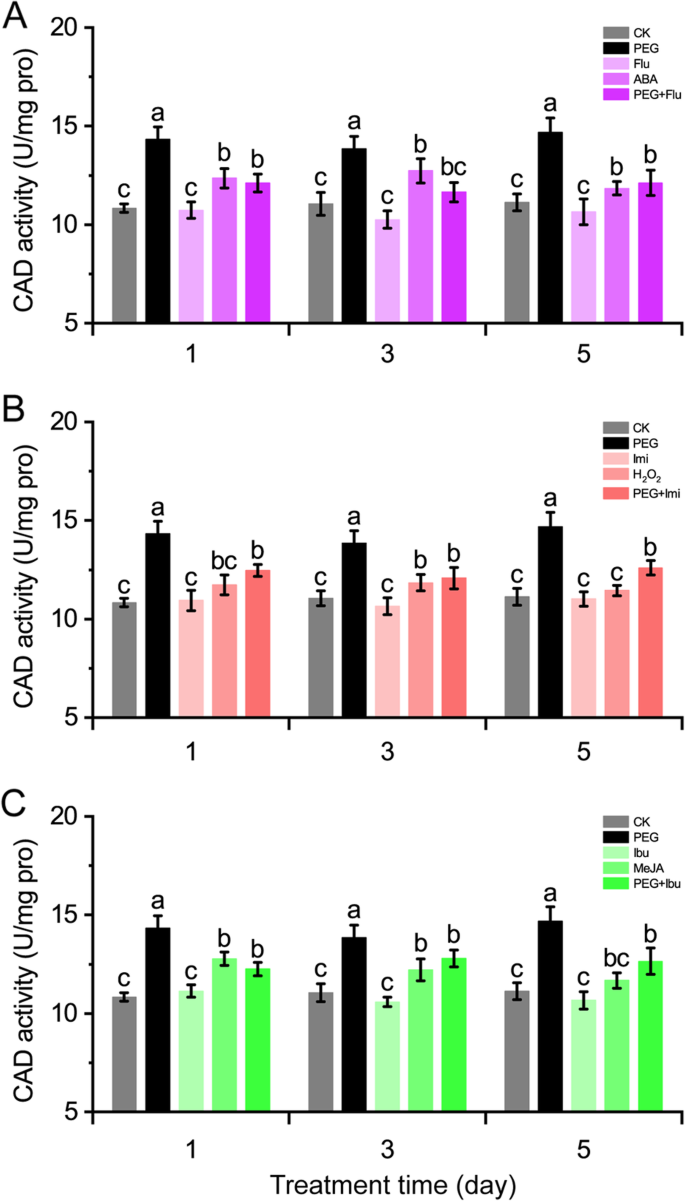
由于ABA, H2O.2和Meja在规范中发挥积极作用cmcads.在干旱胁迫下,有必要研究信号分子对CAD活性的影响。在各种治疗中,CAD活性在PEG处理下积极诱导,并且不受每个抑制剂或清除剂治疗的影响。信号分子处理促进CAD活性在甜瓜茎中增加,抑制剂或清除剂预处理抑制CAD活性在PEG处理的甜瓜茎中增加(图。4.).在信号分子中,ABA诱导CAD活性至显着水平(增加6.4-15.2%)(图。4.a),Meja促进CAD活动增加约4.9-17.9%(图。4.c),而h2O.2表现出轻微的CAD活性,在治疗后3天才达到显着水平(7%)(图。4.b).抑制剂或清除剂预处理均能强烈抑制peg处理甜瓜茎中CAD活性的上调。这些结果提示信号分子可能参与了PEG处理对CAD活性的上调。
木质素生物合成受ABA、H2O.2和Meja在干旱下
此外,进行木质素含量和组织化学染色的测定。结果如图1所示。5.PEG处理可显著促进木质素的合成,抑制剂或清除剂预处理可抑制木质素的合成。虽然没有达到显著水平,但信号分子处理对木质素的生物合成和沉积有轻微的促进作用。5.a,c,e)。用甘油蛋白-HCl的组织化学染色是常用于木质素观察的方法。与木质素含量检测一致,血管束中的木质组织在PEG处理下表现出最强的染色,在治疗中的抑制剂或清除剂的治疗中的适度染色,以及在治疗抑制剂或清除剂的对照染色(图。5.B,D,F)。这些结果表明,在干旱胁迫下,信号分子在木质素生物合成中发挥阳性作用。
启动子CMCAD1.那2, 和3.Aba,H是积极的诱导2O.2和惩罚
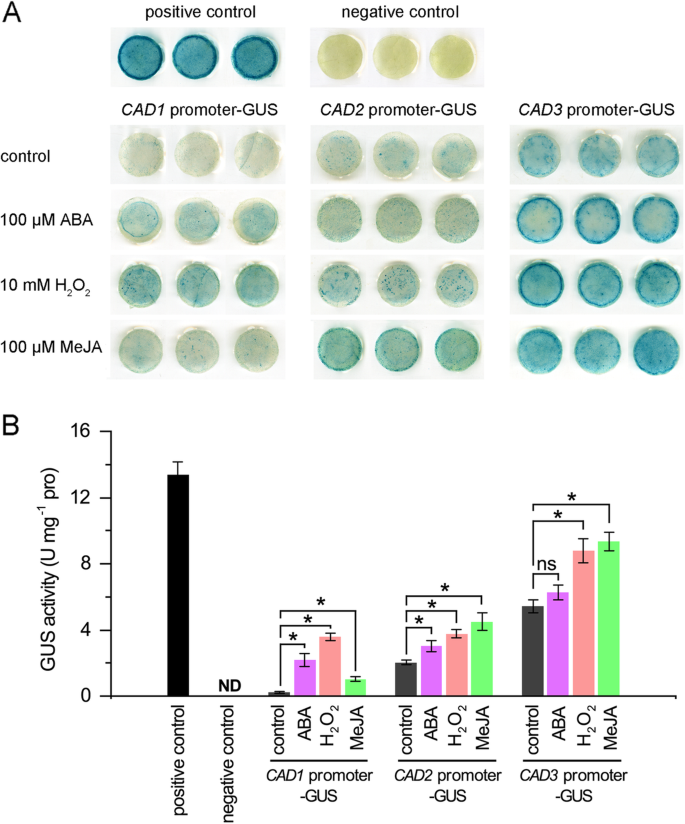
进一步研究响应cmcads.对三个信号分子,构建启动子::GUS载体cmcad1 pro :: gus那cmcad2 pro :: gus和cmcad3 pro :: gus在用ABA(100μm),H处理的烟草叶中进行GUS测定2O.2(10 mm)或Meja(100μm)。如图。6.揭示的阳性对照显示出由35s启动子驱动的最强的GUS染色,阴性对照表现出没有启动子的GUS染色。掌握之中,CAD1 PRO :: GUSGUS染色最轻微,cad 2职业::格斯谦虚,和CAD3 Pro :: GUS在甜瓜幼苗中表达最强,与表达模式一致。在信号分子处理下,cmcad1 pro :: gus由Meja略微引起,但是由ABA和H强烈诱导2O.2.尽管cmcad2 pro :: gus和cmcad3 pro :: gus表现出类似的染色模式,它们均略微由ABA诱导,并强烈地由H诱导2O.2和惩罚。Gus活性测定,图。6.B,与组织化学染色的结果相似。Gus活动驱动CMCAD1.启动子响应ABA,H增加9.7,15.9和4.6倍2O.2分别和惩罚。Gus活动驱动CMCAD2.启动子观察到1.5,1.9和2.2倍,响应ABA,H增加2O.2分别和惩罚。GUS活性分别增加1.2、1.6和1.7倍CMCAD3.启动子回应ABA,H2O.2分别和惩罚。这些结果表明,信号分子在调节方面发挥着重要作用CMCAD1.那2, 和3..
讨论
金等人。(2014)[26分析了这五个人的推动者cmcad.基因,并发现了负责ABA, H2O.2,Ja,强调等在植物中,aba,h2O.2JA是非常重要的信号分子,负责正常或胁迫条件下植物的生长调控[36那37那38].干旱是一种常见的非生物胁迫,通常诱导ABA、H2O.2和JA的高度增长[6.那39],然而,这些信号分子在不同物种中调节木质化的方式不同[14那17那20.那40].因此,有必要揭示这些信号分子的调节模式cmcad.干旱胁迫下甜瓜茎的木质素化及其基因的研究。
首先,我们确认了ABA,H2O.2和JA均能被干旱胁迫显著诱导,并在PEG处理后分别达到峰值,然后通过抑制剂或清除剂预处理有效地限制其达到每个峰值,表明其对下游的信号传导可以有效地减弱。而单独使用抑制剂或清清剂对信号分子及其后指标影响不大,这与Hu et al.(2013)、Kojo et al.(2006)、Shan and Liang(2010)等人观察到的结果相似[30.那41那42].当单独处理时,抑制剂或清除剂对信号分子的影响很小,但在PEG+抑制剂或清除剂处理下,信号分子的增加受到强烈抑制。这可以解释为它们对已存在的信号分子不做任何作用,而强烈抑制PEG处理诱导的信号分子的合成和积累。
抑制剂或清除剂的应用表明,ABA和H2O.2表现出类似的正向规则CMCAD1.那2那3., 和5..虽然,JA显示了更直接的法规CMCAD2.和3.,以及CMCAD5.,并表现出轻微的规定CMCAD1..CMCAD4.受到信号分子的轻微影响。这与以前一致cmcads.启动子分析[26].在1.5 kb启动子序列中cmcads.,启动子CMCAD1.那2, 和5.含有富含TC的重复(涉及防御和应力响应性的CIS作用元件),其可能会驱使基因对H响应2O.2.启动子CMCAD1.那2那3., 和5.包含ABRE元素(参与脱落酸反应的顺式作用元素),我们证明了这些cmcads.可以由ABA监管。CMCAD3.启动子包含TGACG-motif和CCAAT-boxCMCAD5.启动子含有CGTCA-MOTIF,所有这三个要素都作为CIS作用的调控元素参与MEJA反应性,在本研究中也证实。此外,还发现了一些其他压力和信号响应元件cmcad.启动子([26),表1)可能是在用抑制剂或清除剂预处理的沉默处理的甜瓜幼苗中观察到某些增加的原因。信号分子的正调节模式cmcads.与以前的报告一致CAD.基因可由几种信号分子调控[19那43和不同的CAD.家庭成员对信号分子和压力的反应可能不同,这是由于每个成员的功能不同[24那44].木质素生物合成基因的表达分析进一步证实了ABA,H的阳性规定2O.2干旱胁迫下的JA至Lignin生物合成。在一起,这些结果再次表明干旱介导基因表达,这取决于各种信号分子[8.那9.那45].
通过干旱应激和信号分子和PEG +抑制剂或+清除剂治疗略微诱导CAD活性和木质素含量。通过信号分子的外源性施加的CAD活性和木质素含量的轻微诱导可能是由于吸收效率以及外源施加信号分子的时间的效应。虽然PEG +抑制剂或+清除剂处理下的CAD活性和木质素含量的某些增加可能是由于抑制剂和清除剂的抑制效率,或者存在旁路信号通路。这些表明信号分子和CAD活性之间的正相关,导致木质素积累,这与先前的报告一致[6.].在信号分子中,ABA和H2O.2显示了类似的规定cmcad.基因,但ABA和JA表现出与CAD活性和木质素沉积类似的规定。但是,Mohr和Cahill(2007)[17[介绍了ABA和木质素之间的负相关,这可能是因为JA和SA更可能在生物应激下对木质素生物合成负责[46那47].在ABA和JA之间的生物应激之间观察到对抗和合作[48那49],ABA和JA相互作用之间的机制被认为是依赖和独立的方式[38].
JA也是一个重要的干旱响应信号[42那50]及调节木质素生物合成的功能[21那51].我们的结果证明了JA功能在促进干旱的甜瓜茎中促进木质素生物合成,在拟南芥中类似地观察到[40].关于H的研究2O.2也报道了对木质素化的正调控2O.2含量与较高的木质素沉积相对应[52]并减少h2O.2含量与较低的木质素沉积相关[16].始终如一地,我们的研究也观察到H的积极规定2O.2来cmcad.外源H基因的表达量、CAD活性和木质素化程度均较低,这可能与外源H基因的使用寿命较短有关2O.2.
早些时候,金等人。(2014)[26]分析并发现应激和信号反应元件的启动子cmcad.基因,后来,刘等人。(2018)[27]透露干旱可以诱导cmcads.表达和促进木质素沉积。作为本研究中揭示的信号分子和抑制剂或清除剂治疗,cmcads.正调控ABA, H2O.2和贾。为了进一步证明调节模式,通过用启动子取代35s启动子来构建启动子:: GUS构建体CMCAD1.那2, 和3.,分别在pCAMBIA1381Z载体中。这三个基因是根据它们对干旱胁迫的积极反应而选择的[27[系统发育分析[26]及其在木质素合成中的主要作用[53].信号分子处理后的烟草叶片GUS染色结果显示,信号分子的调控模式与三种信号分子相似cmcad.基因表达分析显示一致cmcad.基因可以由与Kim等人类似的应激诱导的信号分子调节。(2010)[43]报道。然而,cmcad1 pro :: gus显示不含信号分子处理的最轻的GUS染色和活性,而且cmcad3 pro :: gus在所有条件下表现出最强的染色和活动cmcad2 pro :: gus适度的。这些GUS分析进一步证实了ABA,H的规定2O.2和JA到CMCAD1.那2, 和3.一方面证明了CMCAD3.可能是东方甜瓜幼苗的主要吊血成员。
结论
3个信号分子对干旱胁迫反应强烈,ABA和H2O.2以快速的方式。在信号分子中,ABA和H2O.2显示出类似的正调节模式CMCAD1.那2那3., 和5., JA正调控CMCAD2.那3., 和5..此外,这些信号分子还表现出对大多数木质素生物合成基因的阳性规定。通过信号分子调节CAD活性和木质素含量,显示出褐化与干旱胁迫下的信号分子之间的正相关性。此后启动子:: GUS测定提供了进一步的示范,即信号分子在调节方面函数CMCAD1.那2, 和3..
方法
植物材料及处理
东方甜瓜(Cucumis Melo.var。makuwa以黑龙江省齐齐哈尔市蔬菜研究所购品种“彩红7号”为试验材料,进行木质化相关分析。烟草benthamiana)保留在我们的实验室(沉阳农业大学教育部和辽宁省保护部的重点实验室,沉阳,中国。)用于推动者分析。种子在播种前灭菌。使用Yamasaki甜瓜营养溶液(半强度)培养甜瓜幼苗[54],每2天更新一次,盆栽(土壤:泥炭:堆肥= 1:1:1),两株幼苗均在本实验室生长室(25±2℃,14 h/10 h光照/暗循环)中培养。
用四个完全消耗叶片的甜瓜幼苗用于治疗。对于干旱处理,将PEG-6000加入到营养溶液中,以终浓度为8%(w / v);用于氟酮(流感,ABA抑制剂,25μm),咪唑(IMI,H.2O.2清道夫,10毫米)[30.或布洛芬(IBU,JA抑制剂,1 mm)[31]处理后,在营养液中添加抑制剂或清除剂至预定浓度;ABA (100 μM)2O.2(10 mm)或Meja(100μm)处理,用每个配置的ABA,H喷洒幼苗2O.2或meja;对于抑制剂或清除剂与干旱处理相结合,用流感,IMI或IBU进行幼苗12小时,然后转移到含有8%PEG-6000的营养溶液中。未经处理的幼苗被视为对照。在2018年8月的第一次批量和2019年12月,在0小时,1小时,2小时,3小时,5小时,7小时,12小时,5,3d,5 d进行分析后,将样品收集。批次(凭证号码CM-20,180,806-001〜010和CM-20,191,212-001〜010)。
用6周龄烟草幼苗进行农业渗透。接种后的烟苗先在室温下暗培养24 h,再在室温下光照培养24 h。初步培养48 h后,用ABA (100 μM)、h2O.2(10 mm)和Meja(100μm)。在2018年10月在2018年10月的第一次批量和1月2020年,在24°C培养后24小时培养24°C培养后24小时培养和GUS活性分析样品的叶片和GUS活性分析。CM-20,181,013-001和CM-20,200,128-001)。
各指标测定包含3个生物重复,每个生物重复包含3个分析重复。采集经处理的冬瓜幼苗的第2和第3节间(从基部到生长点数),与新鲜或冷冻样品一起进行测定。以冷冻样品的形式采集烟草叶片进行GUS酶活性测定。冷冻样品采集后立即用液氮冷冻,保存在−80℃。
ABA、JA和H的测定2O.2内容
根据Li et al.(2011)使用0.5 g冷冻样品测定ABA和JA含量[55ELISA检测试剂盒(中国农业大学生产)。采用特异性单克隆抗体进行ABA和JA分析,并根据厂商说明书建立各激素的标准曲线。ABA和JA含量以ng表示−1鲜重。
H的内容2O.2使用0.1g冻结的样品确定H后的H.2O.2内容检测试剂盒(Cat#A064,南京建城生物工程研究所,中国南京)H2O.2含量以mmol g表示−1通过405nm处的吸光度计算的鲜重(fw)计算。
木质素含量测定
木质素含量的测定依据Zhang et al. (2010) [56]以及我们之前描述的[27那53].在280nm下测量提取的木质素溶液。根据标准曲线计算木质素含量,并表示为mg g−1DW。
组织化学木质素染色
甘油酸-HCl-HCl染色与我们之前的研究中所述相同[27].切片厚度为10 μm。
CAD活动的测定
CAD活动的执行与我们前面描述的相同[27].用作乙酸醇作为底物,CAD活性作为U mg呈现−1蛋白质。基于Bradford(1976)描述的方法,通过使用Biorad蛋白质测定试剂盒(Takara,Japan,Takara,Japan)来测量蛋白质浓度[57.].
RNA提取,cDNA合成和QRT-PCR
RNA提取、cDNA合成和qRT-PCR过程均按照我们前面的描述进行[27].基因序列cmpal1样那CmPAL2-like那CmCAD1 ~ 5那CmPOD1-like那cmpod2样那CmLAC4-like那CmLAC11-like和CMLAC17样在Melonomics (https://www.melonomics.net/),序列18岁rrna,CMC4H.那Cm4CL1和CMCOMT.在NCBI实现(https://www.ncbi.nlm.nih.gov/)和序列CMCCR.在广场实现(https://bioinformatics.psb.ugent.be/plaza/versions/plaza_v4_dictots/).表S中列出了基因加入号和PCR引物序列1.每个基因/18年代0小时的RRNA比为1. 2-ΔΔCT.方法用于计算基因的相对表达。
Gus报道基因载体的构建和烟草中的表达
使用Hi-DNAsecure植物试剂盒从未经处理的甜瓜叶中萃取用于启动子克隆的DNA(Cat#DP350-02,天根,北京,中国)。PrimeStar®HS(PREMIX)(代码编号R040A,TAKARA,日本)用于序列克隆。启动子序列CMCAD1.那CMCAD2.和CMCAD3.首先使用没有限制酶切割部位的引物克隆,然后添加多尾(猫#TT124,天根,北京,中国)并连接到T-Vector(PMDTM19(简单),代码编号3271,Takara,Japan)使用T4 DNA连接酶试剂盒(猫#TT406,天根,北京,中国)进行测序。正确的序列,与从骨骼学下载的序列相同(https://www.melonomics.net/)使用具有限制酶切割部位的引物克隆并通过使用与ACC I和后III限制酶的双消化方案连接到线性化的PCAMBIA1381Z中。Takara Minibest DNA片段净化套件Ver.4.0(代码No.9761,Takara,日本)用于必要时克隆序列纯化。构建的矢量被引入根癌土壤杆菌(菌株GV3101)分别使用冻融方案能力,并用含有25mg L的LB培养基筛选和接种病毒−1利福平和50毫克L−1卡那霉素。PCR和凝胶电泳检测后,将正确的菌斑接种于50 ml LB液体培养基中,利福平和卡那霉素存在于erlenmeyer烧瓶中,接种14-16 h。4°C 5000rpm离心10 min。的收获农杆菌属将粒料重悬于浸润缓冲液(10mM MgCl)的600nm处的1.0的密度。2,10 mm mes,0.1 mm acetosyringone)。在室温下在暗条件下温育3小时后,使用1mL无需注射器避免静脉注入浸润培养物压入完全消费的烟草植物叶子。这里使用的引物列于表s中2.
GUS染色
根据Jefferson等人描述的方法,测定烟草中的GUS染色。(1987)[58.].将接种烟叶的盘在GUS染色溶液中孵育[50mM磷酸盐缓冲液(pH7.0),0.5mm k3.Fe(CN)6., 0.5 mM K4.Fe(CN)6.,在37℃下,在37℃下,0.1%(v / v),Triton X-100,10mM EDTA和0.5mg / mL X-Gluc(5-溴-4-氯-3-吲哚基-3-吲哚基-3- Ingolyl-β-D-incolyl-β-D-incolyl-β-D-incolyl-β-D-incolyl-β-D-incolyl-β-D-incolyl-β-d-incolyl-β-d-indolyl-β-d-incolar-incolyl-β-d-incolyl-β-d-incoluld)。.然后将染色样品除去叶绿素,用80%(v / v)乙醇,并使用EPSON扫描仪(EPSON表达12000xL)扫描。
格斯活动
GUS活性参照Jefferson et al. (1987) [58.Wang et al. (2019) [59.].接种烟草叶(每种生物复制样品0.2g)用于GUS活性检测,其计算为μmol底物的μmol底物,如每分钟所述,并表达为U mg−1蛋白质。使用Biorad蛋白质测定试剂盒来确定基于Bradford(1976)描述的Coomassie亮蓝G-250的酶提取物的蛋白质浓度[57.].
统计分析
用Excel 2013进行数据整理,用SPSS 18.0进行分析P.= 0.05检验显著性。然后使用Origin 8.0和Photoshop CS4进行图形生成和美化。
可用性数据和材料
数据集包含在文章和其附加文件中。本文分析的基因的登录号可以在表S中实现1.
缩写
- 计算机辅助设计:
-
肉桂醇脱氢酶
- 阿坝:
-
脱盐酸
- H2O.2:
-
过氧化氢
- JA:
-
茉莉酸
- Meja:
-
茉莉酸甲酯
- SA:
-
水杨酸
- ROS:
-
活性氧
- 流感:
-
氟酮
- IMI:
-
咪咪罗
- IBU:
-
布洛芬
- 挂钩:
-
聚乙二醇
- GUS:
-
β葡萄糖醛酸酶
- 存在:
-
定量实时聚合酶链反应
- C4H:
-
肉桂醛4-羟化酶
- 4CL:
-
4-coumarate-CoA连接酶
- CCR:
-
肉桂 - CoA还原酶
- COMT:
-
咖啡酸O.- 甲基转移酶
- 朋友:
-
苯丙氨酸氨裂解酶
- 圆荚体:
-
过氧化物酶
- LAC:
-
漆酶
- F5H:
-
发射5-羟基化酶
参考
- 1.
BONAWITZ ND,CHAPPLE C.木质素生物合成的遗传学:将基因型连接到表型。Annu Rev Genet。2010; 44(1):337-63。
- 2.
Boudet am。木质素和讽刺:选定的问题。植物理性生物化学。2000; 38(1):81-96。
- 3.
Srivastava S, Vishwakarma RK, Arafat YA, Gupta SK, Khan BM。在非生物胁迫下,紫花楸幼苗的肉桂酰辅酶a还原酶(Cinnamoyl CoA Reductase, CCR)蛋白丰度和木质素沉积发生变化leucaena leucocephala.physiolmol biol植物。2015; 21(2):197-205。
- 4.
Lee BR, Muneer S, Jung WJ, Avice JC, Ourry A, Kim TH。菌根定殖缓解干旱胁迫下多年生黑麦草叶片中干旱诱导的氧化损伤和木质化(Lolium perenne.).杂志。2012;145(3):440 - 9。
- 5.
Li Z,Peng Y,Ma X.不同响应耐旱性耐受性和小叶和大叶白色三叶草之间的干旱后恢复(Trifolium Repens.L.)与抗氧化酶保护和木质素代谢相关。acta physiol植物。2013; 35(1):213-22。
- 6。
Jubany-Marí T, Munné-Bosch S, López-Carbonell M, Alegre L.过氧化氢参与了地中海灌木的驯化,Cistus alphidus.L,到夏天干旱。中国农业科学。2009;60(1):107-20。
- 7。
Dalal M,Sahu S,Tiwari S,Rao Ar,Gaikwad K.转录组分析显示激素,ROS代谢和细胞壁生物合成之间的相互作用在小麦中进行干旱诱导的根生长。植物理性生物化学。2018; 130:482-92。
- 8。
杨林,王传聪,郭卫东,李晓波,卢敏,于春林。水分亏缺条件下水稻根系伸长区细胞壁相关基因的差异表达植物生理学报。2006;53(3):390-5。
- 9。
3种干旱植物(野生西瓜)根系抗旱和抗旱能力的蛋白质组学研究。植物生理学报。2008;49(2):226-41。
- 10。
木质素降低的转基因杨树木质部电导率、生长效率和存活率均受到影响。植物学报。2011;34(4):655-68。
- 11.
软管E,Clarkson DT,Steudle E,Schreiber L,Hartung W. exodermis:一种可变的吻合障碍。J Exp Bot。2001; 52(365):2245-64。
- 12.
关键词:启动子,基因工程,序列分析,功能特性云杉肉桂醇脱氢酶转基因云杉植物的基因。植物学报2009;28(5):787-800。
- 13.
茉莉酸对大麻下胚轴次生生长的促进作用。足底。2018;248(4):1029 - 36。
- 14.
Denness L,McKenna JF,Segonzac C,Wormit A,Manyhe P,Bennett M等。细胞壁损伤诱导的木质素生物合成通过拟南芥中的反应性氧物质和茉莉酸依赖性方法调节。植物理性。2011; 156(3):1364。
- 15.
苏国光,安智,张伟,刘玉英。光通过H的生成促进木质素的合成2O.2大豆下胚轴二胺氧化酶介导。植物生理学杂志。2005;162(12):1297-303。
- 16。
KováčikJ,GrúzJ,Klejdus B,Štorkf,Marchiosi R,法拉雷雷斯 - Filho O.铜化和铜暴露的相关参数洋甘菊chamomilla根:H的作用2O.2在这个过程中没有。植物SCI。2010; 179(4):383-9。
- 17。
Mohr PG, Cahill DM. ABA抑制水杨酸和木质素的积累和多基因的表达,在感染拟南芥假单胞菌含油PV。番茄。Funct综合基因组。2007; 7(3):181-91。
- 18。
徐伟,唐伟,王超,葛丽,孙建军,齐旭,等。SiMYB56通过调控木质素生物合成和ABA信号通路提高转基因水稻的抗旱能力植物学报。2020;11:785。
- 19。
程华,李丽,徐飞,程胜,曹飞,王勇,等。木质素生物合成和环境胁迫中肉桂醇脱氢酶基因的表达模式银杏叶.MOL BIOL REP。2013; 40(1):707-21。
- 20.
Kuyyogsuy A,Deenamo N,Khompatara K,Ekchaweng K,Churngchow N.壳聚糖增强了橡胶树的抗性(Hevea Brasiliensis.),通过诱导脱落酸(ABA)。physiol mol植物疗法。2018; 102:67-78。
- 21.
Gamuyao R,Nagai K,Ayano M,Mori Y,Minami A,Kojima M,等。竹笋中的激素分布和转录组曲线在竹干出现和生长中提供了见解。植物细胞生理。2017; 58(4):702-16。
- 22.
Yamaguchi M,Valliyodan B,Zhang J,Lenoble Me,Yu O,Rogers EE,等。调节大豆原代根系中水胁迫的生长反应。I.蛋白质组学分析揭示了苯丙醇丙醇代谢和控制伸长区的游离铁的特异性调节。植物细胞环境。2010; 33(2):223-43。
- 23.
Moura JCMS,Bonine Cav,De Oliveira Fernandes Viana J,Dornelas MC,Mazzafera P.非生物和生物胁迫以及木质素含量的变化和植物中的组成。J Intent Plant Biol。2010; 52(4):360-76。
- 24.
Barakat A, Bagniewska-Zadworna A, Frost CJ, Carlson JE。系统发育和表达谱CAD.和像CAD样子杂交杨树的基因(P. deltoides.×p .黑质):来自食草动物损伤的证据对子功能化和功能性分歧的损害。BMC植物BIOL。2010; 10(1):100。
- 25.
托拜厄斯CM,周ek。水稻肉桂醇脱氢酶基因家族的结构及其与木质素化相关的启动子活性。足底。2005;220(5):678 - 88。
- 26.
Jin Y,张C,刘W,齐H,陈H,Cao S.甜瓜中肉桂醇脱氢酶基因家族(Cucumis Melo.生物信息学分析与表达模式。《公共科学图书馆•综合》。2014;9 (7):e101730。
- 27.
刘文,金烨,李米,东路,郭d,lu c等。分析cmcads.和东方甜瓜('Caihong7')幼苗的三个胶结酶,响应三种非生物胁迫。SCI Hortic Amsterdam。2018; 237:257-68。
- 28.
barun A, Jensen CR, Asch F, Mogensen VO。干旱诱导的木质部pH、离子组成和ABA浓度的变化是大田玉米(Zea Mays.L.)。J Exp Bot。2002; 53(367):251-63。
- 29.
Riemann M,Dhakarey R,Hazman M,Miro B,Kohli A,Nick P.在干旱和盐度反应的激素网络中探索Jasonates。前植物SCI。2015; 6:1077。
- 30.
胡w,huang c,deng x,zhou s,chen l,li y等。Taasr1.,小麦的转录因子基因,赋予转基因烟草中的干旱胁迫耐受性。植物细胞环境。2013; 36(8):1449-64。
- 31。
杨t,朱ls,meng y,lv r,zhou z,zhu l等。α-Momorcharin在烟草中增强烟草马赛克病毒抗性神经网络通过操纵茉莉酸 - 水杨酸串扰。J植物理性。2018; 223:116-26。
- 32。
静X,王H,龚B,刘S,魏米,AI X等。通过涉及甜瓜耐药的不同光质组合调节次级和蔗糖代谢。植物理性生物化学。2018; 124:77-87。
- 33。
陈志强,李志强,李志强,等。中断的LACCASE4和17结果在木质化的组织特异性改变拟南芥蒂利亚纳茎。植物细胞。2011;23(3):1124 - 37。
- 34。
黄杰,古米,赖泽,粉丝B,Shi K,Zhou Yh等。拟南芥的功能分析朋友基因家族在植物生长,发展和对环境压力的反应。植物理性。2010; 153(4):1526-38。
- 35。
Tokunaga N,Kaneta T,Sato S,Sato Y.三种过氧化物酶基因的表达谱分析拟南芥蒂利亚纳.physiol植物。2009; 136(2):237-49。
- 36.
黄志强,王志强,王志强。ABA转运对植物水分胁迫的响应。植物学报,2018;23(6):513-22。
- 37.
Mittler R. ROS很好。植物学报,2017;22(1):11-9。
- 38.
Per TS, Khan MIR, Anjum NA, Masood A, Hussain SJ, Khan NA。非生物胁迫下植物茉莉酸类:与其他植物激素的串扰。Environ Exp Bot. 2018; 145:104-20。
- 39.
干旱胁迫对番茄幼苗内源脱落酸、茉莉酸、多胺和多胺氧化酶活性的影响。Sci Hortic Amsterdam. 2013; 159:172-7。
- 40.
杰克,崔yd。通过调节细胞分裂素和茉莉酸之间的相互作用,促进抗旱胁迫促进木瓜分化。植物信号表现。2018; 13(3):E1451707。
- 41.
Kojo K,Yaeno T,Kusumi K,Matsumura H,Fujisawa S,Terauchi R等。ROI生成的调节机制受稻瘟病突变的影响。植物细胞生理。2006; 47(8):1035-44。
- 42.
单春,梁志忠。茉莉酸对抗坏血酸和谷胱甘肽代谢的调节作用Agropyron Cristatum.叶片在水分胁迫下。植物科学。2010;178(2):130 - 9。
- 43.
Kim YH, Bae JM, Huh GH。甘薯肉桂醇脱氢酶基因对植物发育阶段和环境胁迫的转录调控植物学报2010;29(7):779-91。
- 44.
邓万,张米,吴政,江泽民,唐湖,李伊,等。三肉桂醇脱氢酶的分子克隆,功能分析(CAD.)的基因,茶树.J植物理性。2013; 170(3):272-82。
- 45.
Seki M,Narusaka M,Ishida J,Nanjo T,Fujita M,Oono Y等。使用全长CDNA微阵列监测干旱,冷和高盐度应力下的7000拟拟拟合基因的表达曲线。工厂J. 2002; 31(3):279-92。
- 46.
McConn M,Creelman Ra,Bell E,Mullet Je,浏览J. Jasmonate对拟南芥中的昆虫防御至关重要。Proc Natl Acad Sci USA。1997年; 94(10):5473-7。
- 47.
PENG X,HU Y,TANG X,周P,DENG X,Wang H,等。稻米的组成型表达WRKY30基因增加了内源茉莉酸的积累,公关水稻对真菌病原的基因表达与抗性。足底。2012;236(5):1485 - 98。
- 48.
作者简介:赵小龙,男,河北人,博士,主要研究方向为生物医学工程。ABA是影响植物抗病性的一个重要信号,它影响植物JA的合成和防御系统的激活拟南芥.植物细胞。2007;19(5):1665 - 81。
- 49.
Lorenzo O,Solano R.调节斋月信号网络的分子参与者。CurrOp植物BIOL。2005; 8(5):532-40。
- 50。
Carlos dO, Bárbara H, Vicent A, Aurelio GC。干旱胁迫条件下,柑橘根系脱落酸的增加需要茉莉酸的瞬时积累。杂志。2013;147(3):296 - 306。
- 51。
胡q,min l,杨x,金s,zhang l,li y等。LACCASE GHLAC1通过操纵苯基丙醇途径和茉莉酸合成来调节广谱生物应激耐受性。植物理性。2018; 176(2):1808。
- 52。
Alamgir Hossain M, Zakir Hossain AKM, Kihara T, Koyama H, Hara T2O.2在小麦幼苗中的一代。土壤SCI植物NUTR。2005; 51(2):223-30。
- 53。
刘文,江y,王c,赵l,金y,xing q等。木质素被综合CMCAD2.和CMCAD3.在东方甜瓜(Cucumis Melo.L.)幼苗有助于耐旱性。植物mol biol。2020; 103(6):689-704。
- 54。
刘氏现代实用无土栽培技术。北京(中文):中国农业出版社;2001年。
- 55。
李义,赵立,段B,Korpelainen H,Li C.干旱和ABA对生长,光合作用和抗氧化系统的影响Cotinus Coggygria在两个CDHFJGFJCGDFIFFERENT光条件下的幼苗。Environ Exp Bot。2011; 71(1):107-13。
- 56。
张L,王G,Chang J,Liu J,Cai J,Rao X等人。1-MCP和乙烯对三种表达的影响CAD.收获Tsai Tai茎中的基因和瘫痪(芸苔属植物对).食品化学。2010;123(1):32-40。
- 57。
布拉德福德mm。利用蛋白质染料结合原理定量微克数量蛋白质的快速敏感方法。肛门生物化学。1976; 72(1):248-54。
- 58。
杰斐逊镭,kavanagh ta,bevan mw。GUS Fusions:β-葡萄糖醛酸酶作为高等植物中的敏感和通用基因融合标记物。Embo J. 1987; 6(13):3901-7。
- 59。
王超,高光,曹松,谢强,齐华cmlox08.与东方甜瓜中的信号分子和非生物应激反应相关的启动子,Cucumis Melo.var。Makuwa Makino。BMC植物BIOL。2019; 19(1):75。
确认
我们感谢Tao Xu和Feng Wang教授为撰写本文提供有价值的帮助。
资金
中国农业科学研究系统(CARS-25)资助。资助机构在实验的设计、数据的收集、分析和解释以及手稿的准备中没有作用。
作者信息
从属关系
贡献
WL,YJ和HYQ构思和设计了实验。YZJ鉴定了木质素生物合成基因。WL和YJ进行了实验。WL,CHW和JY分析了数据。WL和YJ写了稿件和HYQ改进了它。所有作者都读过并批准了稿件。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
刘,W.,江,Y.,金,Y。等等。干旱诱发ABA,H2O.2和贾巴积极调节cmcad.甜瓜茎中的基因和木质素合成。BMC植物杂志21,83(2021)。https://doi.org/10.1186/s12870-021-02869-0.
已收到:
公认:
发表:
关键字
- 东方西瓜
- 肉桂醇脱氢酶
- 干旱
- 木质素
- 脱盐酸
- 过氧化氢
- 茉莉酸