摘要
背景
广泛存在于植物中的Bzip基因家族参与不同的生物过程,包括生长和发育和应激反应。基因如何调节这种生物过程?系统生物学对于基因功能的机械理解是强大的。然而,杨树尚未报告这些研究。
结果
本研究鉴定了86个杨树bZIP转录因子,并对其保守结构域进行了描述。根据系统发育树的结果,我们将这些成员划分为12个具有特定基因结构和基序组成的群体。在杨树的17条染色体上,存在大量的片段复制事件的基因分布不均匀。此外,我们还进一步研究了这些基因与其他6个物种相关基因的共线性。转录组数据表明,bZIP基因在杨树的根、茎和叶中表现出不同的表达模式。此外,我们在三个组织中鉴定了45个响应盐胁迫的bZIP基因。我们对代表性基因进行共表达分析,然后进行基因集富集分析。结果表明,组织差异表达基因,特别是共表达基因,主要参与次生代谢和次生代谢产物的生物合成过程。而盐胁迫应答基因及其共表达基因主要参与金属离子转运调控和蛋氨酸生物合成调控。
结论
利用比较基因组学和系统生物学方法,首次系统地研究了杨树bZIP基因家族的结构和功能。bZIP基因家族通过不同的基因网络或生物学过程在杨树的生长发育和盐胁迫响应中发挥着重要的调控作用。这些发现为利用工程调控靶标和相应基因网络进行杨树品系的遗传育种奠定了基础。
背景
基本亮氨酸拉链(BZIP)代表编码转录因子的超基因族。该基因家族广泛分布在真核生物中。Bzip蛋白,由保守的Bzip结构域定义[1那2],在植物生长发育和盐胁迫反应等各种生物过程的调控中发挥重要作用。
bZIP基因家族编码的转录因子蛋白含有高度保守的bZIP结构域。该结构由60-80个氨基酸组成,包括一个基本的DNA结合区域和邻近的亮氨酸拉链[2].绑定区域包含核定位信号和N-x7.-R/K基序以恒定的精确间隔接触目标DNA [3.].亮氨酸拉链区由亮氨酸或其他大型疏水氨基酸的七核苷酸重复序列组成,不同基因的重复序列数量可能有很大差异[3.那4.].亮氨酸位于七肽序列的第7个氨基酸位置,可被异亮氨酸、缬氨酸、苯丙氨酸或蛋氨酸取代[3.].Bzip蛋白通常通过通过亮氨酸拉链形成二聚体来起作用[4.].植物bZIP转录因子对ACGT核心序列具有结合偏好,如a -box (TACGTA)、C-box (GACGTC)和G-box (CACGTG)。此外,它们还与其他DNA序列基序结合[3.那4.].核心元件的外侧翼调节蛋白质- dna相互作用的特异性[3.].以往的研究表明,片段基因组复制和全基因组复制事件可以解释bZIP基因家族的扩展[2那5.].在分类方面,研究人员最初将拟南芥中bZIP基因家族成员根据共同域划分为10个组[3.].然后更新拟南芥BZIP基因并进一步分为13组(A-M)[4.].
bZIP基因家族在植物生长发育、花的成熟和逆境反应等生物学过程中发挥着重要作用。拟南芥的bZIP11基因通过将低能量信号链接到生长素介导的原发性根生长的控制来影响根部发育[6.].HY5编码Bzip蛋白,其参与拟南芥根系和缺杆状发育的调节[7.].过度的ZmbZIP4玉米的侧根数量增加,主根变长,根系得到改善[8.].bZIP蛋白还调节植物对非生物胁迫的反应,如盐胁迫。表达的SlAREB番茄基因可提高植物对水分亏缺和盐胁迫的耐受性[9.].类似的结果也被观察到GhABF2拟南芥和棉花的基因[10],以及Gmbzip2.在转基因大豆[11].
对杨树bZIP基因家族的研究主要集中在其在根系发育和抗旱性方面的作用。例如,杨树ptabzip1l.主要在根中表达,通过调节多种代谢途径调控侧根的发育和抗旱性[12].白杨bZIP53是盐胁迫诱导的基因表达,并负调控不定根的发育[13].的杨树AREB1可以调节干旱的反应和宽容Populus Trichocarpa.通过影响组蛋白乙酰化[14].对杨树bZIP基因家族进行全面分析和表征,利用转录组测序技术筛选组织差异表达基因(DEGs)和盐胁迫响应基因,可为基因功能研究和基因工程育种提供重要参考。此外,利用生物信息学方法揭示基因可能参与的生物学过程将有助于分析基因的调控机制。本研究对杨树bZIP基因进行了系统的研究,包括基因家族成员的鉴定;蛋白质序列分析和系统发育关系;基因的染色体分布;基因组串联复制和节段复制;以及跨物种共线性分析。此外,基于转录组分析数据,我们还探索了bZIP基因在不同组织中的差异表达模式,以及它们对盐胁迫的响应。最后,我们对关键基因进行基因共表达和网络分析,然后进行基因集富集分析。 Our systems biology approach has shed light on differential gene networks or biological pathways associated with varied biological processes.
结果
杨树中Bzip转录因子家庭的鉴定与表征
在这项研究中,我们通过使用HMMER分析确定了来自Bzip家族的86个蛋白质(E值<1×10−5).然后我们使用PFAM和智能数据库来验证结果[15那16那17].Pfam和SMART验证的证据表明86个杨树蛋白共享bZIP结构域,这与我们的预测一致。因此我们从每个成员中提取bZIP保守域的氨基酸序列,并进行多序列比对[18].结果如图所示。1.bZIP结构域由一个基本的dna结合区域和一个相邻的亮氨酸拉链结构组成。基本区域包含一个不变的N-X7.-R/K基序,而ZIP结构域由Leucine (L)或相关疏水氨基酸的七肽重复序列组成。高度保守的亮氨酸残基偶尔会被异亮氨酸、蛋氨酸等所取代(图。1).与之前对拟南芥的研究相比[3.那4.,我们的结果是一致的。
系统发育树和序列结构分析
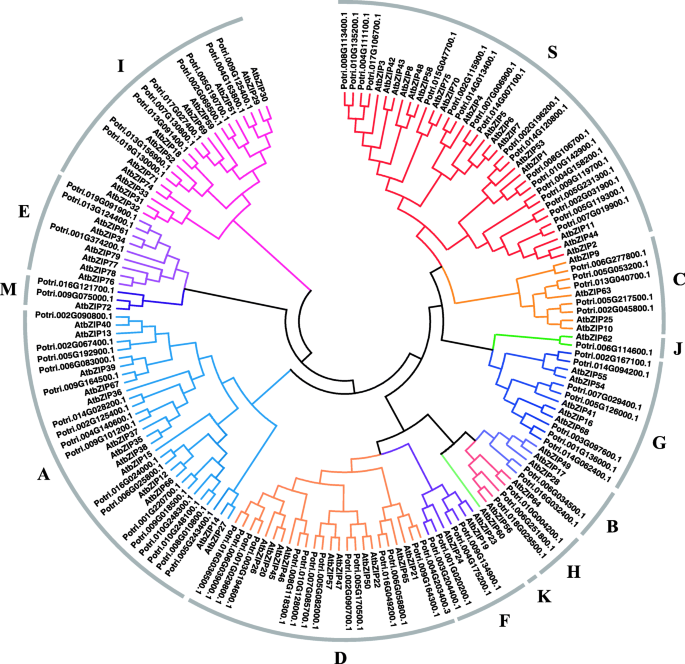
为了探索Bzip家族的进化关系和分类,我们构建了一种系统发育树,使用来自杨树和拟南芥的每个成员的整个氨基酸序列。拟南芥Bzip家族成员使用代表其一些重要成员的字母分为13组(用于ABF / arsb / Abi5,CPRF2样,G对于GBF,H为HY5),蛋白质大小(B为Big,S小),或按字母顺序[3.那4.].如图1所示。2,在前人研究的基础上,我们将杨树bZIP蛋白分为12组拟南芥.这12组的人数各不相同。最大的三个组有19个(S组)、17个(A组)和14个(D组)成员,而J组、B组、M组和K组分别只有1、2、2和0个成员。
此外,为了探索杨树bZIP家族的序列结构,我们分析了每个成员的内含子/外显子结构和基序组成(图)。3.).正如预期的那样,同一群体的成员,特别是一些亲密的成员,拥有相似的基因结构。例如,在S组的19个成员中,18个只包含一个外显子。C组的所有成员都含有6个外显子和5个内含子。G组7个成员中有6个有12个外显子和11个内含子。有趣的是,许多关系更密切的成员也有相似的外显子长度(图)。3.).
使用MEME [19,共发现20个保存完好的图案(图。3.).通过SMART和Pfam数据库的注释,我们发现motif 1为bZIP域,motif 2和4为DOG1,其他motif没有具体的注释信息(supplementary Table)1).不出所料,所有杨树bZIP成员都分享了这个主题。而Motif 2、3、4和6只存在于d组的大多数成员中。类似地,Motif 7和9只出现在a组中。Motif 8只出现在S组、C组、C组中。和j .主题10休息只在A组和b主题11只有在d组所有成员共享主题14只存在于d组图案的六名成员15只存在于f组所有成员主题16只发生在7 d组的成员主题17只存在于5 G组和b .主题18礼物只有三个成员许多基序存在于特定的群中,可能与特定的生物功能有关。
杨树bZIP基因家族的染色体定位及共线性分析
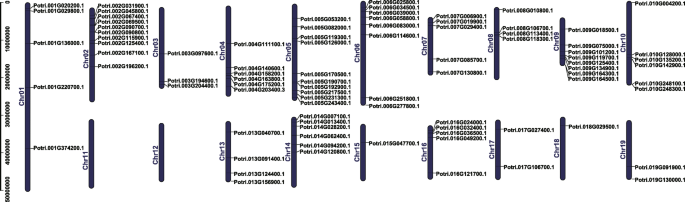
使用poplar基因组注释信息和tbtools [20.那21,我们可视化了bZIP基因家族的染色体分布。结果从无花果。4.表明86个bZIP基因在17条染色体上分布不均匀,每条染色体上的基因数量与染色体大小无关。例如,最大的染色体(Chr 1)仅包含5个基因,而最小的染色体(Chr 9)包含8个bZIP基因。11号和12号染色体上没有基因。
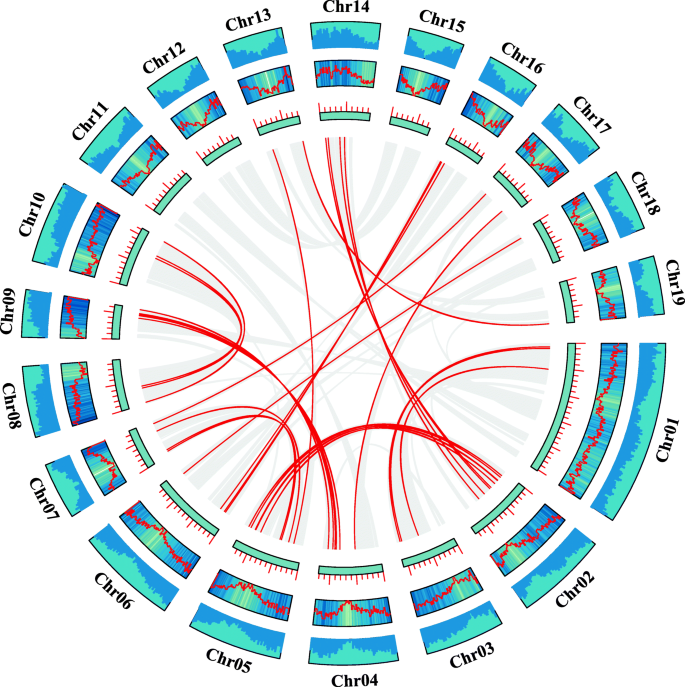
随后,使用具有多个共线性扫描工具包(MCSCanx)方法的TBTools [21那22,我们分析了基因之间的串联复制事件。有趣的是,没有发现串联重复事件。然后,我们使用TBtools结合BLASTP和MCScanX方法分析了片段重复事件[21那22].我们的结果如图所示。5.和补充表2.我们共鉴定出31对基因片段复制事件,发生在19条染色体中的16对。这些证据表明,节段复制事件是杨树bZIP基因多样性的主要驱动因素。
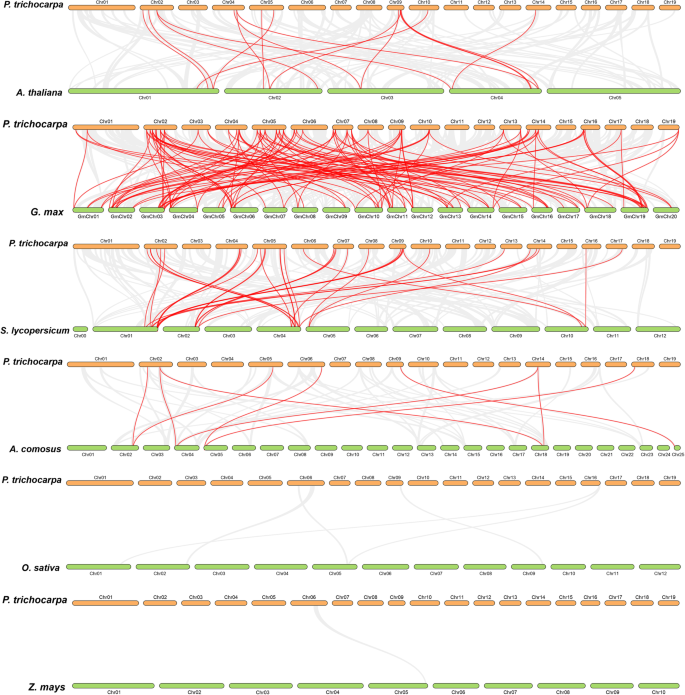
此外,我们还探讨了杨树bZIP基因与6个代表性树种相关基因的共线性关系,包括3个双子叶杨树(拟南芥那大豆,茄属植物lycopersicum)及三个单子叶植物(奥雅萨苜蓿那Zea Mays.,菠萝comosus),以探索直系关系(图。6.补充表3.).共有55个杨树基因与11个拟南芥基因、74个大豆基因、20个番茄基因和5个菠萝基因共线性。然而,杨树基因与水稻和玉米基因之间没有这种关系(补充表)3.).杨树与拟南芥的同源基因对为16对,杨树与大豆的同源基因对为127对,杨树与番茄的同源基因对为34对,杨树与菠萝的同源基因对为9对。然而,在杨树和水稻之间、杨树和玉米之间没有发现这样的基因对。这可能是由于双子叶相对于单子叶更接近的系统发育关系。
值得注意的是,杨树基因和大豆基因之间存在很大的共同性,而不是用其他五种物种发现的那些。这可能与杨树和大豆都属于Fabids的事实有关。此外,我们发现大量杨树Bzip基因具有与三到四个大豆基因的共同关系,这表明这些基因可能在基因家族的演变中起重要作用。此外,我们还发现两种杨树Bzip基因(Potri.006G251800.1和Potri.018G029500.1)与菠萝基因共线。然而,与其他5种植物的基因没有这种关系,这表明这些基因在菠萝和杨树中保留了,而在其他分析的植物中已经丢失。
我们还使用TBtools计算每个基因对的非同义(Ka) /同义(Ks)比值,以探索杨树bZIP基因的进化约束[21].片段重复和共线性基因对的Ka/Ks比值均小于1。这意味着杨树bZIP基因家族在进化过程中可能经历了强烈的净化选择压力。
杨树bZIP基因的组织差异表达
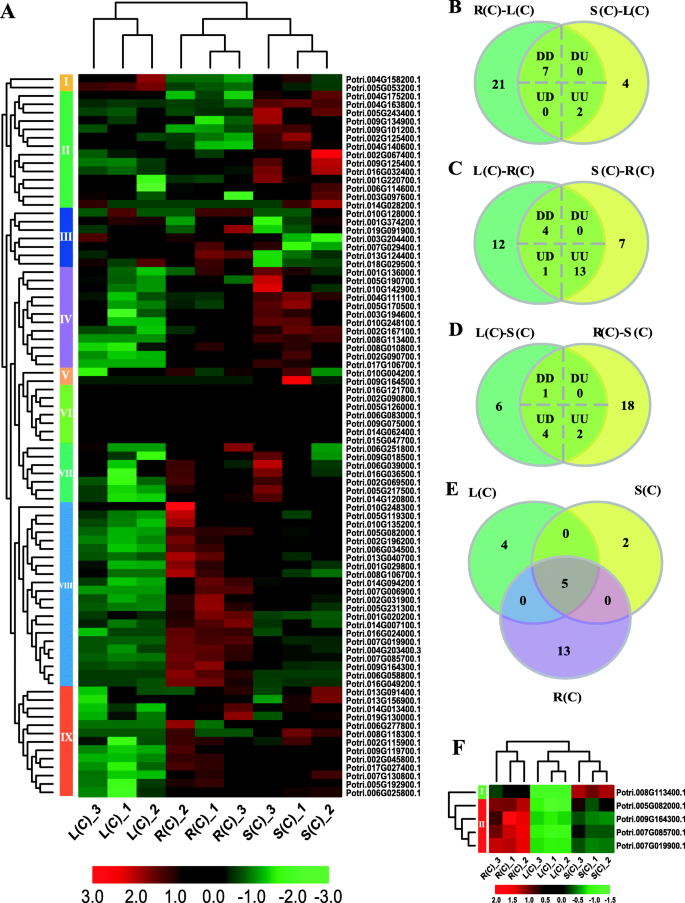
为了探讨不同组织中POPLAR BZIP基因家族的表达模式,我们使用来自RNA-SEQ的转录组分析数据来分析杨树根,茎和叶中的BZIP基因表达。如图1所示。7.A,我们将这些基因分成9组,具体模式。例如,组2和4中的基因在茎中高度表达。相反,第8组的那些在根上具有更高的表达水平。
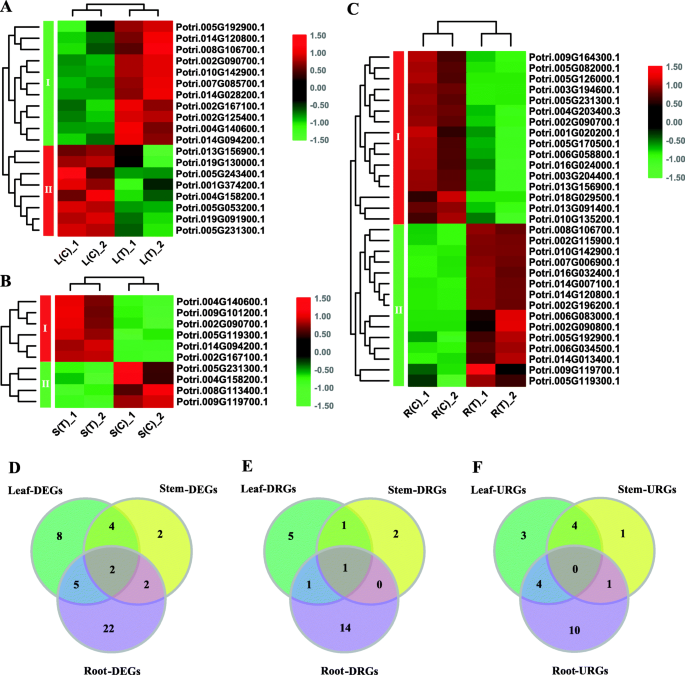
然后,我们使用DESEQ方法来识别整个组织的次数[23].我们的结果表明,叶子和根部之间有30°(分别在茎和茎之间的根部和上调),13分别在茎和茎中,分别在茎上下调,25在根和茎之间(分别在茎中的15和10下调)(源于补充数据)1).随后,我们鉴定了相对于其他两个组织在一种组织中差异表达的基因。如图1所示。7.b-d和补充数据1,大多数DEGs(18)在根中被鉴定。其中,根中有4个基因相对于其他两种组织表达下调,13个基因相对于其他组织表达上调。还有一种基因在根中相对于叶的表达量是上升的,而在根中相对于茎的表达量是下降的。同样,我们在叶子中发现了9个DEGs。其中,与茎和根相比,叶片中分别有7个和2个基因表达下调和上调。在茎中鉴定出7个DEGs。与叶和根相比,茎中有1个基因表达下调,2个基因表达上调。4个基因在茎中相对于叶片表达上调,而茎中相对于根表达下调。最后,我们将上述三组基因进行比较,得到5个共享的基因,这些基因在任何组织中相对于其他两个组织有差异表达(图)。7.e)。然后,基于这些5基因的表达数据,我们制作了热爱图(图。7.f).表现出清晰的组织特异性表达模式;即一个基因在茎、根和叶中分别表现出高、中、低表达。然而,其余的基因显示出不同的模式(图。7.F)。
杨树对盐胁迫响应的基因表达
为了探索bZIP基因家族在盐胁迫下的表达模式,我们基于RNA-Seq数据分析了盐胁迫前后响应基因的表达变化。如图1所示。8.a-c和补充数据2其中,根中有16个基因表达下调,15个基因表达上调;叶中有19个基因表达下调,8个基因表达上调,11个基因表达下调;茎中有10个基因表达上调,4个基因表达上调。8.D-F)。如图1所示。8.D,发现响应于盐胁迫的大部分基因(22)是特异性的根,然后将8个基因叶,并通过2个基因到茎。此外,5个基因对叶子和根(叶根),4个基因的盐胁迫,叶茎中的4个基因和根茎中的2个基因。其中,在三组DEG之间重叠2个基因(图。8.d).图中显示了下调和上调的deg的比较。8.e, f。
QRT-PCR验证DEGS
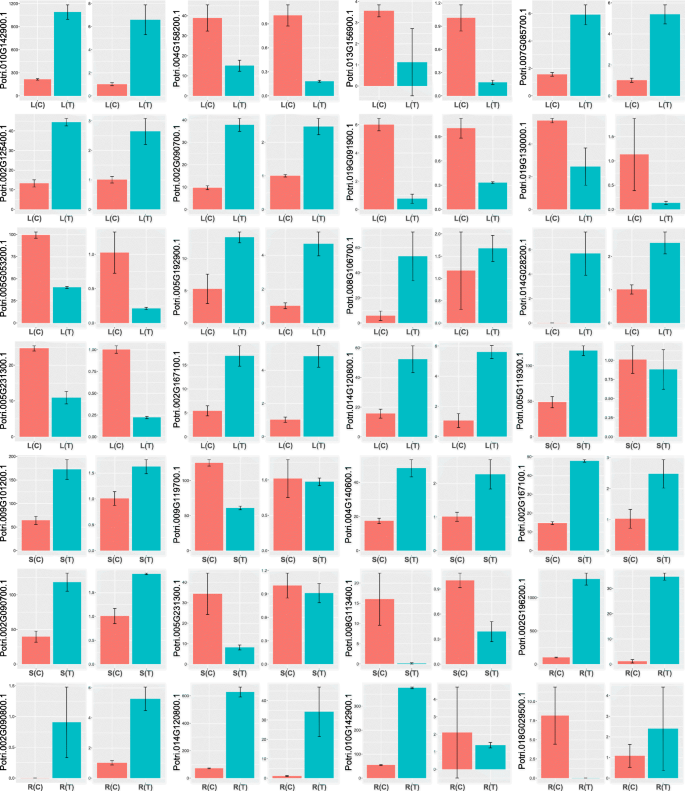
为了验证RNA-SEQ的结果,我们使用QRT-PCR在盐胁迫之前和之后量化根部,茎和叶片中的23°的表达水平。如图1所示。9.,RNA-SEQ和QRT-PCR的结果是一致的。
基因共表达分析
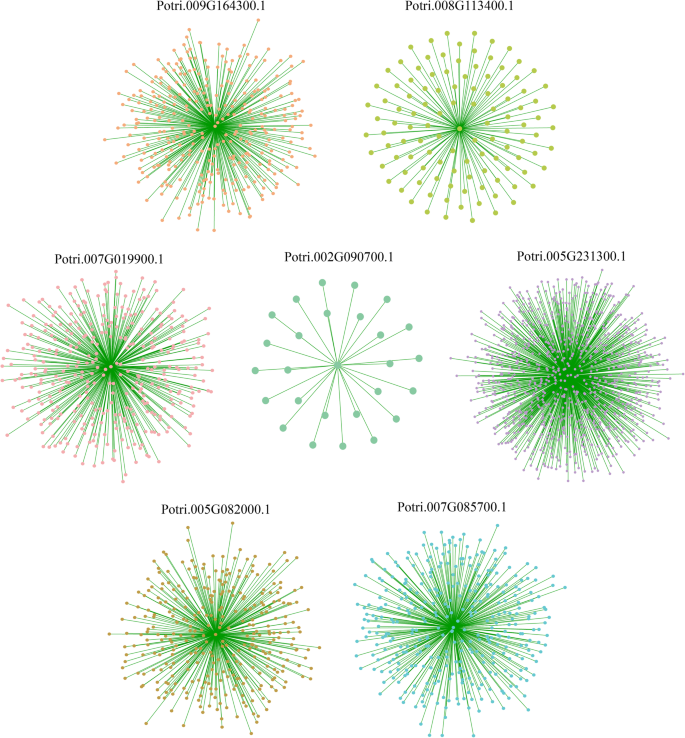
共表达分析可以帮助寻找具有类似表达模式的基因。这些基因可以紧密调节,在功能中紧密相关,或参与相同信号通路或生理过程的成员。在该研究中,我们使用了加权相关网络分析(WGCNA)方法和21个样品的RNA-SEQ数据,以构建以5个组织差异表达基因和上述2种盐响应基因为中心的共表达网络[24].如图1所示。10和补充数据3.,我们总共获得了7个共表达网络。其中,网络以网络为中心Potri.005G231300.1是最大(855个基因)。相反,网络的中心是Potri.002G090700.1是最小的(27个基因)。
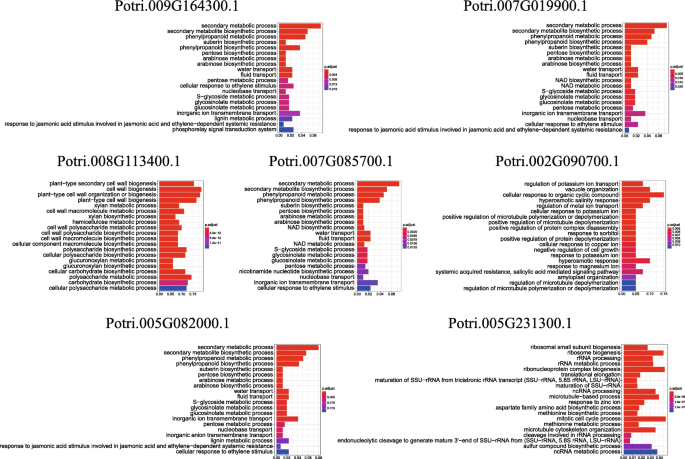
为了探究这些基因可能参与的生物学过程,我们对上述7组共表达基因进行了基因集富集分析(图)。11).五个组织差异表达基因中的四个(Potri.005G082000.1那Potri.007G085700.1.那Potri.007G019900.1那Potri.009G164300.1),分享17个明显丰富的GO条款。共享GO条款包括二次代谢过程,次级代谢产物生物合成过程,苯丙醇代谢过程和苯丙醇化生物合成过程。这表明四种基因可能在杨树生长和发育和应力反应的调节中起重要作用。有趣的是,四个基因在组织中具有相同的表达模式(图。7.F)。
其他参与组织差异表达和共表达基因网络的基因在细胞壁生物发生、细胞壁高分子生物合成过程、木聚糖代谢过程、木聚糖生物合成过程、半纤维素代谢过程等生物过程中显著富集,提示它们可能与细胞壁的形成有关。
关于根、茎和叶组织中响应盐胁迫的基因,Potri.002G090700.1其共表达的基因网络以GO术语显着富集,例如调节钾离子转运,高肉体盐度响应,金属离子转运调节和高骨肉反应。怀疑这些基因可以通过调节离子平衡来响应盐或渗透胁迫。Potri.005G231300.1其网络中的基因在氧化石墨烯方面显著富集,如蛋氨酸生物合成过程和蛋氨酸代谢过程。植物中的s -腺苷- l-蛋氨酸合成酶(s - adenosyl -methionine synthetase, SAMS)可以催化蛋氨酸与ATP反应生成s -腺苷- l- methionine,是调节蛋氨酸循环的关键酶。先前的研究表明萨姆是生物体抵御逆境和压力的关键基因[25].因此,我们推测这些基因可能参与蛋氨酸合成和代谢的过程,其与应力抗性有关。
讨论
Bzip转录因子在植物王国中发现,这在调节生长和发展以及对生物和非生物胁迫的反应中起重要作用[4.那26].以前对杨树的研究仅受到少数Bzip基因的限制,该基因调节根部发育和干旱胁迫。因此,尚未报道对杨树Bzip基因族的系统研究。在这项研究中,我们使用严格的标准来鉴定杨树的86个Bzip基因。然后我们提取了构件的Bzip蛋白域序列。来自多个序列对齐的证据表明杨树和rabidopsis都共享相同的bzip域。与拟南芥相比[3.那4.],杨树的bZIP结构域也由包含N-X的DNA结合区组成7.-R/K图案和亮色拉链结构。然后,根据蛋白质序列的相似性,我们将这86个成员分成12组。值得注意的是,许多主题存在于特定的群体中。由于bZIP转录因子具有不同的功能,这些基序可能具有特定的功能。这种现象值得进一步研究。
以往的研究表明,在进化过程中,基因家族通常经历串联复制或大规模节段复制,以维持每个家族的较大规模[27].与桦树不同,桦树最近没有经历整个基因组复制[28],杨树经历了至少三轮全基因组复制,随后是多段复制、串联复制和转座事件[20.那29].由于bZIP基因家族是一个相对较大的家族,因此我们对串联复制事件和节段复制事件进行了分析。有趣的是,我们发现在杨树bZIP基因中没有串联复制事件。然而,发生了大量的片段复制事件,这与以往在水稻上的研究一致[2].这些结果表明,节段性重复事件在扩增Bzip基因家族中发挥着重要作用。此外,我们分析了Poplar Bzip基因与三次拒仅索诊断和三种单子叶的对应物之间的共同性。结果表明,杨树和拒于在杨树和单子叶之间产生了显着更多的共同性基因对。具有相对较近的进化关系的物种,例如杨树和大豆,似乎具有更多的共线基因对。我们还鉴定了许多如此基因对存在的许多杨树BZIP基因,或者仅在与单焦点的共同性中存在。所有基因对的Ka / Ks比的计算值小于1,表明这些基因可能在进化中经历了强烈的净化选择压力。
我们以组织特异性方式探索了Bzip基因的表达模式。我们已经鉴定了组织之间的许多次数,其中五个基因在三种组织中的任何两个中差异表达。这些基因显示出叶片和根部或茎中高表达的低表达。然后我们将这些基因映射到拟南芥基因组以了解他们可能的功能(补充表4.)[30.那31].最好的比赛Potri.005G082000.1和Potri.007G085700.1.是AT5G65210.1.,是拟南芥中bop依赖的发育调控过程中必不可少的辅助因子[29].AT1G08320.1.是对应的Potri.009G164300.1,参与拟南芥花药发展[32].AT1G75390.1是最好的匹配Potri.007G019900.1,影响种子的萌发过程[33].在一起,这些组织特异性的可在杨树生长和发育中可能发挥重要作用。
由于bZIP基因在杨树盐胁迫调控中的作用尚不清楚,我们对其在盐胁迫下的表达模式进行了研究。通过比较盐胁迫前后样品的表达数据,我们在根、茎和叶中共鉴定了45个响应盐胁迫的基因。我们还将它们定位到拟南芥基因组中(补充表)4.)[30.那31].同源基因参与拟南芥的生长和发育,以及对非生物胁迫的反应。例如,AT2G40950.1.,一种同源基因Potri.006G034500.1和Potri.016G032400.1,是一种转录因子,通过渗透胁迫调节细胞对盐度的反应[34].最适合Potri.001G020200.1(AT4G35040.1)和Potri.003G204400.1(AT2G16770.1)调控拟南芥对缺锌的适应[35].AT1G45249.1.,对手Potri.009G101200.1那Potri.014G028200.1,Potri.002G125400.1,能够调控abre依赖的与抗旱胁迫相关的ABA信号通路[36].
为了了解它们的功能,我们进行了基于共表达的基因网络分析,重点分析了我们鉴定的7个关键基因,然后进行了基因集富集分析。基因本体论分析结果表明,在次生代谢过程和次生代谢产物生物合成过程中,跨组织的DEGs及其相应的网络基因富集。然而,盐诱导基因及其网络基因在调控金属离子转运和蛋氨酸生物合成过程中富集。这表明不同的调控因子和调控基因网络在特定的生物功能中发挥着重要的作用。
结论
在这项研究中,我们在杨树中鉴定了86个Bzip基因家族成员,并表征了他们的保守的Bzip结构域。然后我们对基因家族进行了系统分析。在系统发育分析的基础上,这些构件可分为12组,每组具有特异性基因结构和基序组合物。Bzip基因在杨树的17个染色体上不均匀地分布。值得注意的是,杨树Bzip基因之间没有鉴定串联复制事件,但是,我们检测到大量的节段重复事件,这表明节段性重复事件是杨树中Bzip基因家族演化的主要驱动力。此外,我们研究了杨树Bzip基因与六种代表性物种的同源基因之间的共同关系。这些将使未来的比较基因功能研究受益。此外,我们鉴定了特异性基因表达模式,以及盐诱导基因表达模式。根据七个关键调节剂及其相应的基因网络,已发现差分调节剂和相应的基因网络与不同的生物过程相关联。
方法
杨树Bzip转录因子及其保守域的鉴定
所有杨树蛋白的氨基酸序列从植物血红素血红素数据库下载[20.那30.],以及Pfam数据库bZIP_1 (PF00170) [17].首先,我们使用了hmmsearch (http://www.hmmer.org/用bzip_1搜索杨树氨基酸序列,e-values <1×10的阈值−5.在获得候选基因后,我们应用Pfam和SMART数据库进一步验证我们的结果[15那16那17].然后,我们提取了杨树bZIP蛋白的保守结构域序列。最后,我们分别使用ClustalX 1.83和WebLogo进行多序列比对和可视化[18那37].
BZIP成员的分类和序列分析
杨树和拟南芥家族成员的氨基酸序列从Phytozome数据库下载[20.那30.那31].从以前的研究中确定了拟南芥bZIP基因家族的成员[4.].
我们使用MEGA 7最大似然法和SMS选择的最佳模型构建系统发生树[38那39].杨树bZIP蛋白家族的分类参考了之前在拟南芥上的研究[4.].
为了分析Bzip基因家族的结构,我们下载了来自植物血红素数据库的基因组序列和基因的编码序列[20.那30.].然后我们使用基因结构显示服务器绘制基因结构图[40].基因结构图中基因的顺序和分组参照了系统发育树的结果。利用模因,我们鉴定了bZIP基因家族中的保守基序[19].最后,我们将生成的文件导入TBtools进行可视化[21].主题注释信息来自SMART和PFAM数据库[15那16那17].
染色体分布及共线性分析
利用TBtools和下载自Phytozome数据库的杨树基因组数据[20.那21那30.,观察bZIP基因在杨树染色体上的分布。此外,使用TBtools和MCScanX,我们分析了bZIP基因家族的串联复制事件[21那22].同样,使用TBtools结合MCScanX和BLASTP方法,我们研究了来自不同物种的基因对的片段复制事件和共线性关系[21那22].利用TBtools计算基因对之间的Ka和Ks替换[21].
植物材料及基因表达分析
本研究使用的植物材料为二单倍体Populus Simonii×Populus nigra来自东北林业大学实验林野生型无性系的幼苗。使用我们之前研究中描述的RNA-Seq数据[41[我们探索了Bzip基因的组织差异表达模式。为了响应于盐胁迫来研究基因的表达模式,我们使用从根,茎和叶组织中收集的RNA-SEQ数据以0或150mM NaCl 24小时[42].所有样品都具有10倍测序深度。使用R中的DESEQ包,我们识别DEG(折叠变化> = 2和PADJ <= 0.05)[23].
使用qRT-PCR验证差异表达基因
为了验证来自RNA-SEQ的基因表达数据,我们使用QRT-PCR来响应于盐胁迫量化DEG的表达水平。QRT-PCR根据公布的研究进行[43那44].我们用actin作为参考基因[45].根据未加盐处理的各基因的表达量计算相对表达量。引物清单见补充表5..
基因共表达网络和基因本体分析
使用R中的WGCNA包,我们鉴定了基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于基于的基因网络网络[24].然后使用Cytoscape来可视化结果[46].上述21个RNA-SEQ数据用于共表达分析。只有表达水平和跨越10的基因用于分析。关于所使用的参数,最佳β(软阈值电源)值设置为18(在20次迭代之后),将“DeepSplit”值为2,“MinModulesize”值为30,以及“MergeCheight”值为0.15。使用Pearson算法计算相关系数。具有最强重量的前20%基因用于绘制共同表达网络。
使用R[聚类分析器包进行基因集富集分析。47].我们专注于生物过程。这P.-采用Benjamin-Hochberg方法计算并调整各路径的值[48].
可用性数据和材料
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。本研究使用的原始测序数据已保存在NCBI SRA中,登录号为SRP267437。
缩写
- 度:
-
差异表达基因
- 山姆:
-
S-Adenosyl-L-methionine合成酶
- MCScanX:
-
多个共线扫描工具包
- 卡:
-
非同义
- ks:
-
同义词
- WGCNA:
-
加权相关网络分析
参考文献
- 1.
亮氨酸拉链:一种新一类DNA结合蛋白共同的假想结构。科学。1988;240(4860):1759 - 64。
- 2.
Nijhawan A, Jain M, Tyagi AK, Khurana JP。水稻碱性亮氨酸拉链转录因子家族的基因组调查及基因表达分析。植物杂志。2008;146(2):333 - 50。
- 3.
王志强,王志强,王志强,等。拟南芥bZIP转录因子的克隆与表达分析。植物科学进展,2002;7(3):106-11。
- 4.
中国拟南芥bZIP转录因子家族的研究进展。acta botanica yunnanica(云南植物研究). 2018;45(Pt A): 36-49。
- 5.
周勇,徐东,贾玲,黄旭,马刚,王胜,朱敏,张安,关敏,卢凯。甘蓝型油菜bZIP转录因子基因的全基因组鉴定和结构分析。基因。2017;8(10):288。
- 6.
Weiste C, Pedrotti L, Selvanayagam J, Muralidhara P, Fröschel C, Novák O, Ljung K, Hanson J, Dröge-Laser W.拟南芥bZIP11转录因子将低能信号连接到生长素介导的主根生长控制。公共科学图书馆麝猫。2017;13 (2):e1006607。
- 7.
Oyama T,Shimura Y,Okada K.拟南芥Hy5基因编码了调节刺激诱导的根和缺口的刺激蛋白的Bzip蛋白。基因开发。1997年; 11(22):2983-95。
- 8.
马辉,刘超,李志强,冉强,谢光,王波,方松,楚军,张建军。ZmbZIP4通过调控ABA合成和根系发育对玉米抗逆性的影响。植物杂志。2018;178(2):753 - 70。
- 9.
谢天华,李志伟,苏荣昌,郑志平,蔡永昌,陈明涛。番茄bZIP转录因子SlAREB参与了水分亏缺和盐胁迫反应。足底。2010;231(6):1459 - 73。
- 10.
梁C,孟Z,孟Z,Malik W,Yan R,Lwin Km,Lin F,Wang Y,Sun G,周T.Ghabf2,Bzip转录因子,棉花(Gossypium Hirsutum L.)的促进和盐度耐受性.SCI批准。2016; 6(1):1-14。
- 11.
杨Y,于t f,马J,陈J,周得到,陈M, Ma - z,魏何华麟,徐Z-S。大豆bZIP转录因子基因GmbZIP2在转基因植株中具有抗旱性和耐盐性。中国生物医学工程学报。2020;21(2):670。
- 12.
杨树Ptab ZIP 1-like增强了干旱胁迫下侧根的形成和生物量的增长。植物j . 2017; 89(4): 692 - 705。
- 13.
张y,杨x,cao p,za x,zhan c,liu m,nvsvrot t,王n。Bzip53-iaa4模块抑制了杨树的不定根开发。J Exp Bot。2020; 71(12):3485-98。
- 14.
李姝,林云杰,王鹏,张斌,李敏,陈胜,史瑞,刘旭,王志强。AREB1转录因子对白杨抗旱性和抗旱性的影响。植物细胞,2019,31(3):663 - 86。
- 15.
Leatunic I,Deerks T,Bork P. Smart:2015年最近的更新,新的发展和地位。核酸Res。2015; 43(D1):D257-60。
- 16.
Leatunic I,Bork P. 20年的智能蛋白质域注释资源。核酸RES。2018; 46(D1):D493-6。
- 17.
El-Gebali S,Mistry J,Bateman A,Eddy SR,Luciani A,Potter SC,Qureshi M,Richardson LJ,Salazar Ga,Smart A等人。PFAM蛋白质家族数据库2019年。核酸RES。2019; 47(D1):D427-D432。
- 18.
Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG。CLUSTAL_X窗口接口:由质量分析工具辅助的多序列比对的灵活策略。核酸学报1997;25(24):4876-82。
- 19.
Bailey TL,Boden M,Buske Fa,Frith M,Grant Ce,Clementi L,Ren J,Li WW,Noble WS。MEME SUITE:主题发现和搜索的工具。核酸RES。2009; 37(SUPPLE_2):W202-8。
- 20.
图斯坎GA, Difazio S, Jansson S, Bohlmann J, Grigoriev I, Hellsten U, Putnam N, Ralph S, Rombauts S, Salamov aPopulus Trichocarpa.(托。&灰色)。科学。2006;313(5793):1596 - 604。
- 21.
TBtools:一种用于生物大数据交互分析的集成工具。摩尔。2020;13(8):1194 - 202。
- 22.
王Y,唐,黛巴里JD,Tan X,Li J,Wang X,Lee Th,Jin H,Marler B,Guo H. McScanx:一种用于基因同志和共同性的检测和进化分析的工具包。核酸RES。2012; 40(7):E49。
- 23.
序列计数数据的差异表达分析。基因组医学杂志。2010;11 (10):R106。
- 24.
Langfelder P,Horvath S.WGCNA:用于加权关联网络分析的R包。BMC生物信息学。2008; 9:559。
- 25.
龚波,李昕,王雪梅,孙胜,魏敏,李勇,杨峰,石强,王雪梅。S-腺苷-l-蛋氨酸合成酶过表达对番茄碱胁迫耐受性的影响。植物生态学报;2014;12(6):694-708。
- 26.
RITONGA FN,陈S.植物冷应激耐受性的生理和分子机制。植物(巴塞尔)。2020; 9(5):560。
- 27.
Cannon Sb,Mitra A,Baumgarten A,Young Nd,May G.分段和串联基因复制在拟南芥中大型基因家族演变中的作用。BMC植物BIOL。2004; 4(1):10。
- 28.
刘帮H,李R,赵Y, G,陈年代,江j .失去GLK1转录因子功能显示叶绿素生物合成的新见解和叶绿体发育。acta botanica sinica(云南植物研究),2019;70(12):3125-38。
- 29.
王Y,Salasini Bc,Khan M,Devi B,Bush M,Subramaniam R,Hepworth SR。CLADE I TGACG-MOTIF结合碱性亮氨酸拉链转录因子介导叶片依赖于叶片依赖性的发育调控。植物理性。2019; 180(2):937-51。
- 30.
Goodstein DM,Shu S,Howson R,Neupane R,Hayes Rd,Fazo J,Mitros T,Dirks W,Hellsten U,Putnozome:绿色植物基因组学的比较平台。核酸RES。2012; 40(D1):D1178-86。
- 31.
Lamesch P,Berardini TZ,Li D,Swarbreck D,Wilk C,Sasidharan R,Muller R,Drieher K,Alexander DL,Garcia-Hernandez M.拟南芥信息资源(Tair):改进基因注释和新工具。核酸RES。2012; 40(D1):D1202-10。
- 32.
Murmu J, Bush MJ, DeLong C, Li S, Xu M, Khan M, Malcolmson C, Fobert PR, Zachgo S, Hepworth S .拟南芥碱性亮氨酸-拉链转录因子TGA9和TGA10与花中glutaredoxins ROXY1和ROXY2互作,并且在花药发育中是必需的。植物杂志。2010;154(3):1492 - 504。
- 33.
iglesias-fernándezr,巴勒罗-sicilia c,卡拉洛氏菌,oñate-sánchezl,Carbonero-sánchezl,Carbonero p. arabidopsis thalanaa bzip 44:一种影响种子萌发和甘露酶编码基因Atman7的表达的转录因子。工厂J. 2013; 74(5):767-80。
- 34.
Cifuentes-Esquivel N, Celiz-Balboa J, Henriquez-Valencia C, Mitina I, Arraño-Salinas P, Moreno AA, Meneses C, Blanco-Herrera F. bZIP17调控种子贮藏和萌发相关基因的表达,降低种子对渗透胁迫的敏感性。中国生物医学工程学报,2018;
- 35.
AssunçãoAG,Herrero E,Lin YF,Huettel B,Talukdar S,Smaczniak C,Immink Rg,Van Eldik M,Fiers M,Schat H等人。Arabidopsis Thaliana转录因子Bzip19和Bzip23调节对缺锌的适应性。Proc Natl Acad Sci U S A. 2010; 107(22):10296-301。
- 36.
Yoshida T,Fujita Y,Sayama H,Kidokoro S,Maruyama K,Mizoi J,Shinozaki K,yamaguchi-Shinozaki K. areb1,areb2和Abf3是母版转录因子,可协同调节依赖于干旱胁迫耐受性的ABRE依赖的ABA信令。要求ABA进行全激活。工厂J.2010; 61(4):672-85。
- 37.
GE, Hon G, Chandonia JM, Brenner SE。WebLogo:一个序列logo生成器。基因组研究》2004;14(6):1188 - 90。
- 38.
MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。生物化学学报。2016;33(7):1870-4。
- 39.
Lefort V, Longueville J-E, Gascuel O. SMS:基于PhyML的智能模型选择。生物医学进展。2017;34(9):2422-4。
- 40.
胡斌,金军,郭爱华,张华,罗军,高国刚。gss2.0:一种改进的基因特征可视化服务器。生物信息学,2015,31(8):1296 - 7。
- 41.
姚W,李C,林S,王J,周B,姜T.杨树浓度和木质相关NAC的转录体分析。BMC植物BIOL。2020; 20(1):1-12。
- 42.
赵凯,李树华,姚伟,周斌,李锐,姜涛。杨树碱性螺旋-环-螺旋基因家族的特性及其对盐胁迫响应的组织差异表达。PeerJ。2018; 6: e4502。
- 43.
王胜,黄辉,韩瑞,陈静,姜军,李辉,刘刚,陈胜。BpAP1直接调控bppdef促进白桦雄性花序形成。树杂志。2019;(6):1046 - 60。
- 44.
王S,Huang H,Han R,Liu C,秋Z,刘G,陈S,江J.BPP1和BPPI / BPDEF异二聚体之间的负反馈环桦木属platyphylla×B. Pendula..植物科学。2019;289:110280。
- 45.
杨树基因表达研究的相关RT-qPCR方法的实验比较。BMC Mol Biol. 2010;11:57。
- 46.
Shannon P,Markiel A,Ozier O,Baliga NS,Wang JT,Ramage D,Amin N,Schwikowski B,Ideker T.Cytoscape:用于生物分子交互网络的集成模型的软件环境。Genome Res。2003; 13(11):2498-504。
- 47.
于刚,王立刚,韩艳,何秋艳。clusterProfiler:用于比较基因簇间生物学主题的R包。组学。2012; 16(5): 284 - 7。
- 48.
Benjamini Y,Hochberg Y.控制虚假的发现率:多种测试的实用和强大的方法。j r stat soc ser b方法。1995年; 57(1):289-300。
确认
我们感谢李仁华博士为修改本文所做的努力。
资金
中央高校基本科研业务费专项资金资助项目(no . 2572018CL03);黑龙江省应用技术研发计划项目(no . GA20B401);资助机构没有参与研究设计、数据收集、分析或手稿的准备。
作者信息
从属关系
贡献
TJ和BZ设计的研究。KZ进行了实验,数据分析并写了稿件。SC,WY和ZC进行了数据分析。所有作者均阅读并批准了手稿。
相应的作者
道德声明
伦理批准和同意参与
本研究使用的植物材料为二单倍体Populus Simonii×Populus nigra中国哈尔滨,东北林业大学实验林的野生型无性系幼苗。采集植物样本不需要许可证。这项研究不需要伦理上的批准或同意,因为它没有涉及任何濒危或受保护的物种。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:补充表1。
Bzip蛋白序列图的注释。
附加文件2:补充表2。
杨树bZIP基因对的节段复制。
附加文件3:补充表3。
Syntenic基因对列表。
附加文件4:补充表4。
度的注释。
附加文件5:补充表5
.引物序列。
附加文件6:补充数据
成对基因表达。c表示没有盐处理。通过使用DESEQ软件识别DEGS,并且在折叠变化> = 2和PADJ <= 0.05时设定阈值。
附加文件7:补充数据2。
DEGs对盐胁迫的反应。L、S、R分别表示叶、茎、根。T和C分别表示加盐处理和不加盐处理。使用DESeq软件识别DEGs,在> = 2和padj <= 0.05时设置阈值。
附加文件8:补充数据
Co-expression基因集。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
赵,克。,陈,s。,姚明,w。等等。杨树bZIP基因家族的全基因组分析及表达谱。BMC植物杂志21,122(2021)。https://doi.org/10.1186/s12870-021-02879-w
收到了:
公认:
发表:
关键词
- 杨树bZIP基因家族
- 组织差异表达
- 盐胁迫
- Co-expression分析